Индазолы, обладающие анальгетической активностью
Номер патента: 8499
Опубликовано: 29.06.2007
Авторы: Фурлотти Гвидо, Поленцани Лоренцо, Ализи Мария Алессандра, Каццолла Никола, Гильельмотти Анджело
Формула / Реферат
1. Соединение формулы
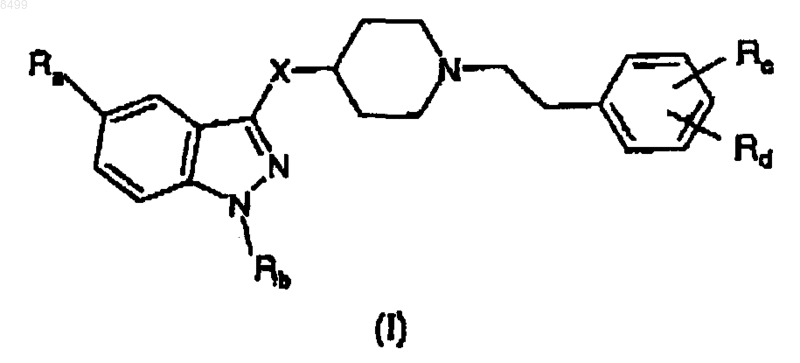
где X означает C(O)NHCH2, NHC(O) или NHC(O)CH2;
Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1-C3алкил, линейный или разветвленный C1-C3алкокси или галоген;
Rb означает Н, линейный или разветвленный C1-C6алкил, арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3алкильной группой или C1-C3алкоксигруппой;
и в которой
a) когда X означает C(O)NHCH2,
Rc означает гидрокси, аминогруппу, ди (C1-C3)алкиламиногруппу, три (C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н или линейный или разветвленный C1-C6алкил,
Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,
при условии, однако, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси;
b) когда X означает NHC(O) или NHC(O)CH2,
Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3алкокси, галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,
и его аддитивные соли фармацевтически приемлемых органических и неорганических кислот.
2. Соединение по п.1, отличающееся тем, что Ra означает Н или C1-C3алкил.
3. Соединение по п.1 или 2, отличающееся тем, что Rb означает Н или C1-C3алкил.
4. Соединение по любому из пп.1-3, отличающееся тем, что Rc означает Н, NO2, NH2, ОН или C1-C3алкокси.
5. Соединение по любому из пп.1-4, отличающееся тем, что Rd означает Н.
6. Аддитивная соль кислоты соединения по любому из пп.1-5, отличающаяся тем, что кислоту выбирают из группы, включающей щавелевую кислоту, малеиновую кислоту, метансульфокислоту, паратолуолсульфокислоту, янтарную кислоту, лимонную кислоту, винную кислоту, молочную кислоту, соляную кислоту, фосфорную кислоту и серную кислоту.
7. Способ получения соединения формулы (I)
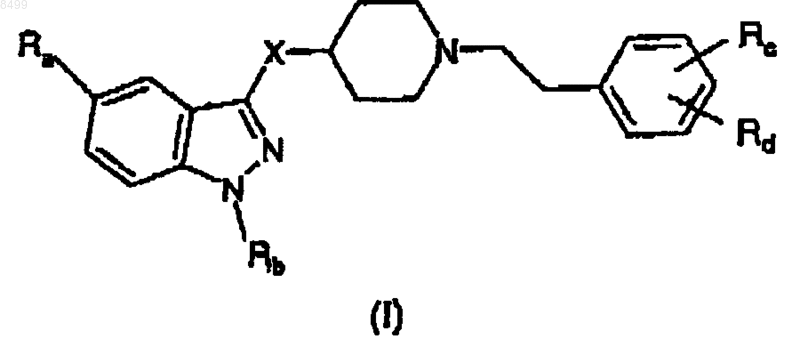
и его аддитивных солей фармацевтически приемлемых органических или неорганических кислот,
где X означает C(O)NHCH2;
Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1-C3алкил, линейный или разветвленный C1-C3алкокси или галоген;
Rb означает Н, линейный или разветвленный C1-C6алкил, арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3алкильной группой или C1-C3алкоксигруппой;
Rc означает гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6алкил,
Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,
при условии, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси;
отличающийся тем, что он включает следующие стадии:
а) реакцию амина формулы (II)
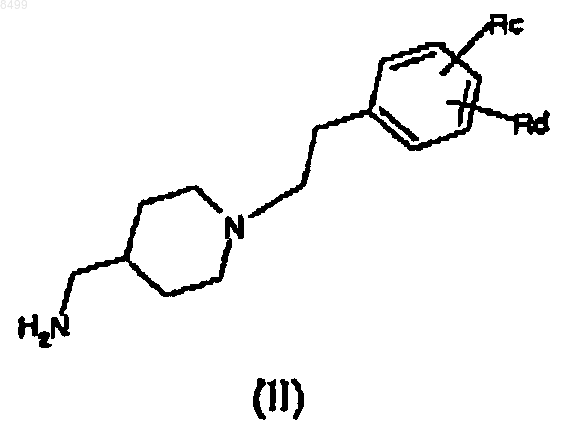
где Rc и Rd имеют те же значения, как указанные выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа,
с производным индазолкарбоновой кислоты формулы (IIIа)
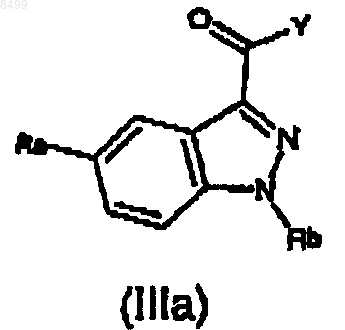
где Ra и Rb имеют значения, указанные выше, и
Y означает атом Cl или Br или группу OR или OC(O)R, где R означает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,
или с производным индазолкарбоновой кислоты формулы (IIIb)
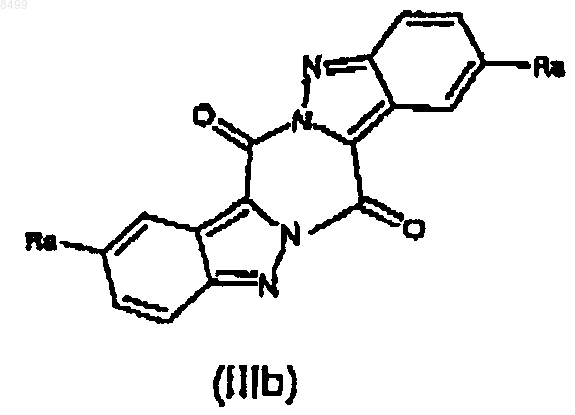
где Ra имеет значения, указанные выше,
b) отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы и
c) необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты.
8. Способ получения соединения формулы (I)
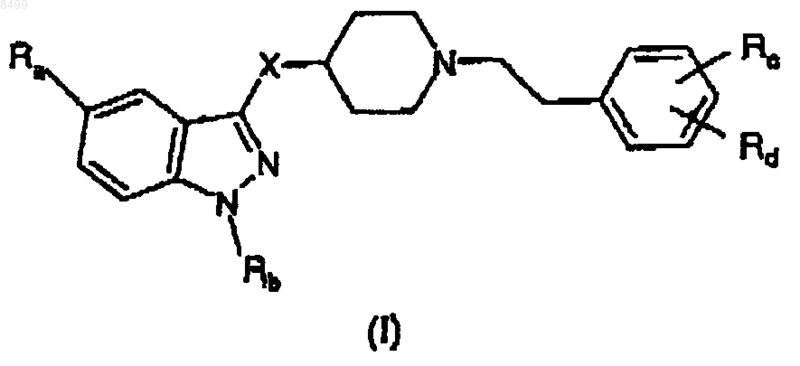
и его фармацевтически приемлемых аддитивных солей органических и неорганических кислот,
где X означает NHC(O) или NHC(O)CH2;
Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1-C3алкил, линейный или разветвленный C1-C3алкокси или галоген;
Rb означает Н, линейный или разветвленный C1-C6алкил; арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3алкильной группой или C1-C3алкоксигруппой;
Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3 алкокси, галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6алкил, отличающийся тем, что он включает следующие стадии:
а') амин формулы (IV)
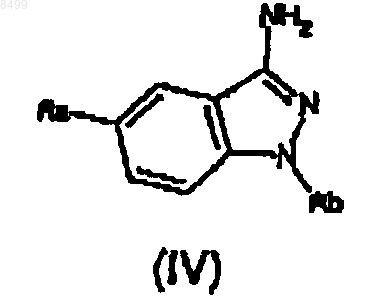
где Ra и Rb имеют значения, указанные выше,
конденсируют с производным карбоновой кислоты формулы (V)
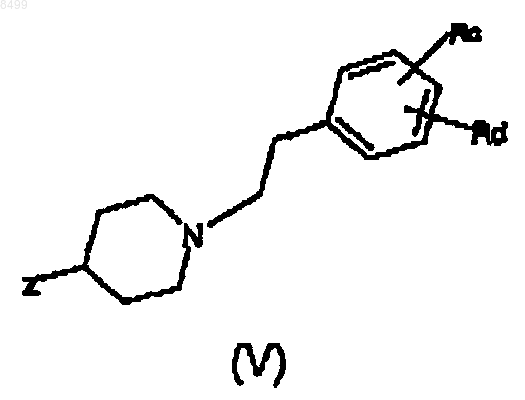
где Rc и Rd имеют те же значения, как указаны выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа, и
Z означает группу C(O)Y или CH2C(O)Y, в которой Y означает атом Cl или Br или группу OR или OC(O)R, где R означрхт линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,
b') отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы и
с') необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты.
9. Способ по п.7, отличающийся тем, что стадию (а) осуществляют путем реакции соединения формулы (II) с соединением формулы (IIIа), в которой Y означает хлор, или с соединением формулы (IIIb) в присутствии подходящего растворителя и при температуре от 0 до 140шС в течение времени от 0,5 до
20 ч.
10. Способ по п.8, отличающийся тем, что стадию (а') осуществляют путем реакции соединения формулы (IV) с соединением формулы (V), в которой Y означает хлор, в присутствии подходящего растворителя и при температуре от 0 до 140шС в течение времени от 0,5 до 20 ч.
11. Способ по п.9 или 10, отличающийся тем, что температура реакции составляет от 15 до 40шС.
12. Способ по п.9 или 10, отличающийся тем, что время реакции составляет от 1 до 18 ч.
13. Способ по любому из пп.9-12, отличающийся тем, что растворитель является апротонным растворителем, выбранным из группы, состоящей из толуола, диметилформамида и диметилсульфоксида.
14. Промежуточное соединение формулы (II)
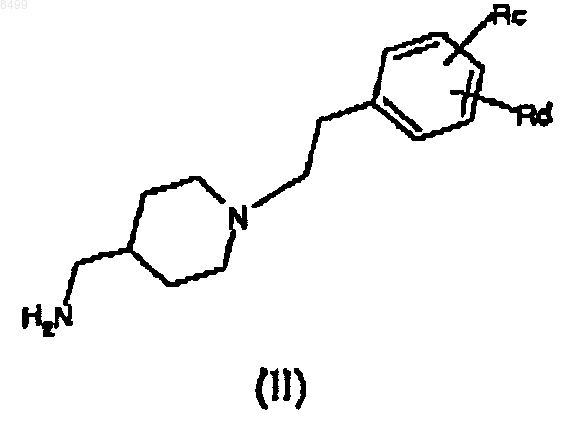
где Rc означает гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6алкил,
Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше.
15. Фармацевтическая композиция, содержащая эффективное количество соединения формулы (I)

где X означает C(O)NHCH2, NHC(O) или NHC(O)CH2;
Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1-C3алкил, линейный или разветвленный C1-C3алкокси или галоген;
Rb означает Н, линейный или разветвленный C1-C6алкил; арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3алкильной группой или C1-C3алкоксигруппой;
и в которой
a) когда X означает C(O)NHCH2,
Rc означает гидрокси, аминогруппу,
ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н или линейный или разветвленный C1-C6алкил,
Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,
при условии, однако, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси;
b) когда X означает NHC(O) или NHC(O)CH2, Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3алкокси, галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три (C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,
или его фармацевтически приемлемой аддитивной соли органической или неорганической кислоты, и по меньшей мере один фармацевтически приемлемый инертный ингредиент.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что она содержит соединение по любому из предыдущих пп.2-6.
Текст
008499 Настоящее изобретение относится к индазолу, обладающему анальгетической активностью, способу его получения и содержащей его фармацевтической композиции. Хроническая боль является очень широко распространенной. В среднем почти 20% взрослого населения страдает от нее, и обычно она связана с клиническими состояниями, характеризующимися хроническими и/или дегенеративными повреждениями. Типичными примерами патологий, характеризующихся хронической болью, являются ревматоидный артрит, остеоартрит, фибромиалгия, невропатии и т.д. [Ashbum M.A., Staats P.S. Management ofchronic pain. Lancet 1999; 353: 1865-69]. Хроническая боль часто изнуряет и является причиной потери работоспособности и низкого качества жизни. Поэтому она также вызывает неблагоприятные экономические и социальные последствия. Анальгетические лекарственные средства, используемые в настоящее время при лечении хронической боли, относятся, в основном, к двум классам: нестероидные противовоспалительные лекарственные средства (NSAID), которые сочетают анальгетическую активность и противовоспалительную активность,и опиоидные анальгетики. Эти классы составляют основу трехбалльной "анальгетической шкалы", предложенной Всемирной Организацией Здравоохранения (World Health Organization) для лечения боли лекарственным средством [Textbook of Pain. 4-е изд. Редакторы P.D. Wall и R. Melzack, Churchill Livingstone, 1999]. Хроническая боль, как известно, трудноизлечима при использовании доступных в настоящее время терапий. Поэтому получение новых анальгетиков является одной из главных целей фармацевтической промышленности. Однако несмотря на обширные исследовательские усилия, направленные на идентификацию подходящего аналгезирующего соединения, имеется значительное число пациентов, чье болевое состояние все еще в достаточной мере не поддается лечению [Scholz J., Woolf C.J., Can we conquerpain Nat Neusci. 2002; 5: 1062-76]. Неожиданно в настоящее время найдено, что такими свойствами обладает новое семейство индазолов. Согласно своему первому аспекту настоящее изобретение, таким образом, относится к индазолу общей формулыRa означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1C3 алкил, линейный или разветвленный C1-C3 алкокси или галоген;Rb означает Н, линейный или разветвленный C1-C6 алкил; арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3 алкильной группой или C1-C3 алкоксигруппой; и в которойa) когда X означает C(O)NHCH2,Rc означает гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6 алкил,Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,при условии, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси;b) когда X означает NHC(O) или NHC(O)CH2,Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3 алкокси,галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,и его аддитивным солям фармацевтически приемлемых органических и неорганических кислот. Типичными примерами фармацевтически приемлемых кислот являются щавелевая, малеиновая, метансульфокислота, паратолуолсульфокислота, янтарная, лимонная, винная кислота, молочная, соляная,фосфорная, серная. Предпочтительными значениями Ra являются Н и C1-C3 алкил. Предпочтительными значениями Rb являются Н и C1-C3 алкил.-1 008499 Предпочтительными значениями Rc являются Н, NO2, NH2, ОН и C1-C3 алкокси. Предпочтительным значением Rd является Н. Аналгезирующая активность соединений формулы (I) найдена при использовании двух экспериментальных моделей в случае крыс: механическая гипералгезия, вызываемая CFA, и механическая гипералгезия при диабетической невропатии, вызываемая стрептозотоцином. Как известно квалифицированному специалисту в данной области, вышеупомянутые экспериментальные модели могут быть рассмотрены как прогноз активности у человека.CFA-индуцируемая гипералгезия представляет собой синдром, характеризующийся активацией участков с задачей регуляции воспалительного ответа и ассоциирующийся с появлением состояний, интерферирующих с ощущением боли. Инъекция CFA на самом деле способна периферически вызывать высвобождение специфических веществ (медиаторов воспалительного ответа и алгогенных агентов),ответственных за локальное повреждение и центрально на уровне спинного мозга, определяющих биохимические изменения, которые способствуют увеличению восприятия боли. Как хорошо известно, эта модель представляет собой надежный инструмент для изучения лекарственных средств в целях использования при лечении воспалительной боли у человека и, в частности, при контроле состояний, таких как гипералгезия и аллодиния. Типичными примерами патологий человека, характеризующихся этим типом боли, связанной с дегенеративными воспалительными процессами, являются ревматоидный артрит и остеоартриты. В свою очередь, диабетическая невропатия, вызываемая стрептозотоцином у крыс, представляет собой инсулинзависимый синдром, характеризующийся сопутствующим снижением скорости проводимости моторных и чувствительных нервов и появлением числа аномалий в болевых ощущениях. Как хорошо известно, эта экспериментальная модель представляет собой полезный инструмент для исследования лекарственных средств в целях использования при лечении невропатической боли у человека. В частности, модель представляет собой достоверный пример невропатических болей всего организмахозяина, характеризующихся явлениями, такими как гипералгезия и аллодиния, с последующими первичными повреждениями или дисфункциями нервной системы. Типичными примерами патологий человека, характеризующихся дисфункциями этого типа и наличием невропатической боли, являются диабет,рак, иммунодефицитные состояния, травма, ишемия, рассеянный склероз, седалищная невралгия, невралгия тройничного нерва и постгерпетические синдромы. Согласно второму аспекту настоящее изобретение относится к способу получения соединения формулы (I), в которой X=C(O)NHCH2, и его аддитивных солей фармацевтически приемлемых органических или неорганических кислот, отличающемуся тем, что он включает следующие стадии: а) реакция амина формулы (II) где Rc и Rd имеют те же значения, как указанные выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа,с производным индазолкарбоновой кислоты формулы (IIIа)Y означает атом Cl или Br или группу OR или OC(O)R, где R означает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,или с производным индазолкарбоновой кислоты формулы (IIIb) где Ra имеет значения, указанные выше,b) отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы, иc) необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты. Согласно третьему аспекту настоящее изобретение относится к способу получения соединения формулы (I), в которой X=NH(CO) или NH(CO)CH2, и его аддитивных солей фармацевтически приемлемых органических или неорганических кислот, отличающемуся тем, что он включает следующие стадии: а') амин формулы (IV) где Ra и Rb имеют значения, указанные выше,конденсируют с производным карбоновой кислоты формулы (V) где Rc и Rd имеют те же значения, как указанные выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа, иOC(O)R, где R означает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,b') отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы, и с') необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты. Специалисту в данной области понятно, что некоторые соединения формулы (I) также могут быть получены из другого соединения формулы (I) обычными способами. Например, когда Rc и/или Rd означают NO2-группу, последняя может быть восстановлена с получением соответствующего соединения формулы (I), в которой Rc и/или Rd означают NH2. Амин формулы (II) может быть получен в соответствии с обычными способами. Например, путем алкилирования изонипекотамида с подходящим галогенидом и затем восстановления амида до первичного амина (WO 9807728) или путем защиты аминометилпиперидина с помощью бензальдегида (SyntheticCommunications 22(16), 2357-2360, 1992), путем алкилирования с помощью подходящего галогенида и удаления защитных групп. Промежуточное соединение формулы (II), в которой Rc и Rd имеют значения, указанные выше, является новым. Это промежуточное соединение, следовательно, составляет другой аспект настоящего изобретения. Соединения формул (IIIа) и (IIIb) также могут быть получены согласно обычным способам. Например, соединения формулы (IIIа), в которой Y означает хлор, могут быть получены из соответствующей кислоты с помощью тионилхлорида (J. Med. Chem., 1976, т. 19(6), с. 778-783), тогда как соединения формулы (IIIа), в которой Y означает OR или OC(O)R, могут быть получены посредством известных реакций этерификации или образования смешанных ангидридов (R.C. Larok, Comprehensive Organic Transformations, VCH, с. 965-966). В свою очередь, соединения формулы (IIIb) могут быть получены согласно J.O.C.-3 008499 1958, т. 23, с. 621. В свою очередь, соединения формулы (IV) могут быть получены согласно обычным способам, описанным в литературе, например, в J. of Heterocyclic Chemistry, 1979 (16), 783-784, или в J.A.C.S., 1943(65), 1804-1806. Соединения формулы (V) также могут быть получены согласно обычным способам. Например, соединения формулы (V), в которой Y означает хлор, могут быть получены омылением соответствующих сложных эфиров с последующей обработкой тионилхлоридом. Предпочтительно, стадии (а) и (а') осуществляют путем реакции соединения формулы (II) с соединением формулы (IIIа), в которой Y означает хлор, или соединения формулы (II) с соединением формулы (IIIb), или соединения формулы (IV) с соединением формулы (V), в которой Y означает хлор,в присутствии подходящего растворителя и при температуре от 0 до 140 С, в течение времени от 0,5 до 20 ч. Предпочтительно, температура реакции составляет от 15 до 40 С. Преимущественно, время реакции составляет от 1 до 18 ч. Предпочтительно растворитель является апротонным, полярным или неполярным. Наиболее предпочтительно он является апротонным неполярным. Примерами подходящих апротонных неполярных растворителей являются ароматические углеводороды, например толуол. Примерами подходящих апротонных полярных растворителей являются диметилформамид и диметилсульфоксид. Согласно вариантам осуществления, в которых соединение формулы (II) вводят во взаимодействие с соединением формулы (IIIа), в которой Y означает хлор, или в которых соединение формулы (IV) вводят во взаимодействие с соединением формулы (V), в которой Y означает хлор, вышеупомянутые стадии(а) и, соответственно, (а') предпочтительно осуществляют в присутствии органического или неорганического акцептора кислот. Примерами подходящих органических акцепторов кислот являются пиридин, триэтиламин и т.п. Примерами подходящих неорганических акцепторов кислот являются карбонаты и бикарбонаты щелочных металлов. На стадиях (b) и (b') отщепление защитной группы от аминогруппы или спиртовой группы предпочтительно осуществляют способами, известными в химии защитных групп. В свою очередь, стадиям (с) и (с') предпочтительно предшествует стадия выделения индазоламида формулы (I). Согласно дальнейшему аспекту настоящее изобретение относится к фармацевтической композиции,содержащей эффективное количество соединения формулы (I) или его аддитивной соли с фармацевтически приемлемой кислотой и по меньшей мере один фармацевтически приемлемый инертный ингредиент. Типичным примером патологического состояния, которому может помогать обработка фармацевтической композицией, согласно настоящему изобретению, является хроническая боль. Типично, эта хроническая боль обусловлена хроническими повреждениями или дегенеративными процессами, такими как ревматоидный артрит, остеоартрит, фибромиалгия, онкологическая боль, невропатическая боль и т.п. Предпочтительно, фармацевтические композиции по настоящему изобретению получают в подходящей лекарственной форме. Примерами подходящих лекарственных форм являются таблетки, капсулы, таблетки с покрытием,гранулы, растворы и сиропы для перорального введения; кремы, мази и содержащие лекарственное средство пластыри для локального введения; суппозитории для ректального введения и стерильные растворы для введения в виде инъекции, аэрозоля или глазного введения. Преимущественно, эти лекарственные формы могут быть получены таким путем, чтобы обеспечить контролируемое высвобождение во времени соединения формулы (I) или его соли с фармацевтически приемлемой кислотой. Действительно, в зависимости от типа обработки, необходимое время высвобождения может быть очень коротким, средним или продолжительным. Лекарственные формы могут также содержать другие обычные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества (ПАВ), буферы, соли для регулирования осмотического давления, эмульгаторы, подсластители, красители, ароматизаторы и т.п. Кроме того, когда необходимо особое лечение, фармацевтическая композиция согласно настоящему изобретению может содержать другие фармакологически активные ингредиенты, сопутствующие введения которых терапевтически полезны. Количество соединения формулы (I) или его фармацевтически приемлемой соли кислоты в фармацевтической композиции согласно настоящему изобретению можно изменять в широких пределах в зависимости от известных факторов, таких как, например, тип заболевания, которое нужно лечить, тяжесть заболевания, масса тела пациента, лекарственная форма, выбранный путь введения, число введений в сутки и эффективность выбранного соединения формулы (I). Однако оптимальное количество может быть легко и обычным образом определено специалистом в данной области. Типично, количество соединения формулы (I) или его соли с фармацевтически приемлемой кислотой в фармацевтической композиции согласно настоящему изобретению может быть таким, что оно-4 008499 обеспечивает уровень введения от 0,001 до 100 мг/кг/сутки. Наиболее предпочтительно от 0,1 до 10 мг/кг/сутки. Лекарственные формы фармацевтической композиции согласно настоящему изобретению могут быть получены способами, которые хорошо известны фармацевту и включают смешивание, грануляцию,прессование, растворение, стерилизацию и т.п. Следующие примеры иллюстрируют изобретение, никоим образом не ограничивая его объема охраны. В следующих примерах заместители в ароматическом цикле (Rc и Rd) указаны с нумерацией положения жирным шрифтом. Пример 1.a) N-Гексагидро-4-пиридинилметил-N-фенилметилиденамин. Бензальдегид (4,6 г, 0,044 моль) добавляют по каплям к раствору 4-аминометилпиперидина (5,0 г,0,044 моль) в толуоле (20 мл). Полученный таким образом раствор перемешивают в течение 3 ч при комнатной температуре. Затем растворитель удаляют выпариванием при пониженном давлении и остаток обрабатывают дважды толуолом с получением желательного продукта, который используют как таковой без дальнейшей очистки.b) 1-(2-(4-Нитрофенил)этил)-4-пиперидинилметанамин. Продукт примера 1 а) (8,8 г, 0,044 моль) растворяют в абсолютном этаноле (50 мл) и добавляют суспензию, содержащую 2-(4-нитрофенил)этилбромид (10,0 г, 0,044 моль) и безводный карбонат калия (12,1 г, 0,088 моль) в абсолютном этаноле (100 мл). Полученную таким образом суспензию кипятят с обратным холодильником в течение 16 ч. Реакционную смесь затем охлаждают до комнатной температуры и отфильтровывают. Фильтрат выпаривают при пониженном давлении. Полученный остаток затем суспендируют в 3 н. HCl (50 мл) и перемешивают в течение 3 ч при комнатной температуре. Раствор затем переносят в делительную воронку и кислую водную фазу промывают этилацетатом (450 мл), затем водную фазу подщелачивают добавлением 6 н. раствора NaOH и экстрагируют дихлорметаном. Органическую фазу сушат над Na2SO4 и растворитель удаляют выпариванием при пониженном давлении, получая желательный продукт (9 г). 1 Н-ЯМР (, CDCl3 + D2O): 1,43-1,50 (м, 3 Н); 1,76 (д, J=12 Гц, 2H); 2,03 (т, J=12 Гц, 2 Н); 2,67-2,52 (м,4 Н); 2,82-3,06 (м, 4 Н); 7,39 (д, J=9 Гц, 2 Н); 8,12 (д, J=9 Гц, 2 Н); 7,95 (квинтет, J=1 Гц, 1 Н). с) N-1-(2-(4-Нитрофенил)этил)-4-пиперидинил)метил)-1 Н-индазол-3-карбоксамид гидрохлорид. Раствор продукта примера 1b) (8,4 г, 0,032 моль) в толуоле (85 мл) добавляют, используя капельную воронку, к суспензии, содержащей 7 Н,14 Н-индазол(2',3':4,5)пиразин(1,2-b)индазол-7,14-дион (4,6 г, 0,016 моль), полученный, как описано в J.O.C., 1958, том 23, с. 621, в толуоле (60 мл). Реакционную смесь перемешивают при комнатной температуре в течение 38 ч и затем отфильтровывают. Твердое вещество отделяют и добавляют к перемешиваемому насыщенному раствору NaHCO3 (200 мл) в течение 2 ч. Реакционную смесь отфильтровывают и полученный таким образом твердый продукт превращают в соответствующий гидрохлорид путем растворения в абсолютном этаноле, добавления хлороводорода в этаноле и перекристаллизации из этанола, получая желательный продукт (4,2 г). Т.пл.: 251-252,5 С. Элементный анализ для C22H25N5O3HCl(I, Ra=Rb=Rd=H; Rc=4-NH2; X=C(O)NHCH2) Раствор продукта примера 1 с) в форме основания (3 г, 0,007 моль) в 95 этаноле (200 мл) гидрируют при использовании 10% Pd-C (0,3 г) при давлении 40 фунтов/кв. дюйм в течение 3 ч. Смесь затем отфильтровывают и фильтрат концентрируют при пониженном давлении. Таким образом полученный продукт кристаллизуют из этилацетата и превращают в соответствующий гидрохлорид путем растворения в смеси этилацетат:этанол = 9:1 и добавления хлороводорода в этаноле, получая желательный продукт-5 008499 Элементный анализ для C22H27N5O2HCl1/2 Н 2O(I, Ra=Rd=H; Rb=изо-C3 Н 7, Rc=4-NO2; X=C(O)NHCH2) Хлорангидрид 1-(1-метилэтил)-1 Н-индазол-3-карбоновой кислоты (2,45 г, 0,011 моль), полученный как описано в ЕР-В 1-0975623, добавляют порциями к раствору продукта 1b) (3,0 г, 0,011 моль) и триэтиламина (4,6 мл, 0,033 моль) в толуоле (50 мл). Смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют выпариванием при пониженном давлении. Остаток обрабатывают 1 н. раствором NaOH и дихлорметаном. Смесь переносят в делительную воронку. Органическую фазу отделяют и сушат над Na2SO4. Растворитель удаляют выпариванием при пониженном давлении и таким образом полученный остаток затем очищают флэш-хроматографией, элюируя этилацетатом, с получением желательного продукта (5,5 г), который затем превращают в соответствующий оксалат путем растворения в этилацетате, добавления стехиометрического количества щавелевой кислоты и перекристаллизации из смеси этилацетат:этанол = 9:1 два раза, с получением желательной соли (3,5 г). Т.пл.: 98 С (разложение). Элементный анализ для C25H31N5O3C2H2O41/2 Н 2O(I, Ra=Rd=H; Rb=изо-C3H7, Rc=4-NH2; X=C(O)NHCH2) Раствор продукта примера 3 в форме основания (2,7 г, 0,006 моль) в 95 этаноле (30 мл) гидрируют при использовании 10% Pd-C (0,27 г) при давлении 40 фунтов/кв. дюйм в течение 5 ч. Смесь затем отфильтровывают и фильтрат концентрируют при пониженном давлении. Полученный таким образом продукт превращают в соответствующий гидрохлорид путем растворения в этилацетате, добавления хлороводорода в этаноле и перекристаллизации из смеси этилацетат:этанол = 8:2, с получением желательного продукта (1,4 г). Т.пл.: 278 С (разложение). Элементный анализ для C25H33N5O2HClН 2Oa) Гидрохлорид 1-(2-фенилэтил)-4-пиперидинкарбоновой кислоты. Суспензию 1-(2-фенилэтил)-4-карбэтоксипиперидина (12,2 г, 0,047 моль), полученную как описано в J. Med. Chem. 1996 (39), 749-756, в 1 н. растворе NaOH (100 мл) кипятят с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры раствор подкисляют 6 н. HCl до рН 2, концентрируют выпариванием при пониженном давлении и таким образом полученное твердое вещество затем отфильтровывают и высушивают в вакуумном сушильном шкафу, получая желательный продукт (12,1 г). 1 Н-ЯМР (, ДМСО + D2O): 1,79-2,19 (м, 4 Н); 2,43-3,74 (м, 9 Н); 7,18-7,41 (м, 5 Н).b) Гидрохлорид 1-(2-фенилэтил)-4-пиперидинкарбонилхлорида. Суспензию продукта примера 5 а) (2,0 г, 0,007 моль) и тионилхлорида (0,81 мл, 0,011 моль) в толуоле (20 мл) кипятят с обратным холодильником в течение 3 ч. Растворитель затем удаляют выпариванием-6 008499 при пониженном давлении и остаток обрабатывают толуолом (220 мл), с получением желательного продукта (2,2 г), который используют как таковой без дальнейшей очистки.c) N-(1-Метил-1 Н-индазол-3-ил)-1-(2-фенилэтил)пиперидин-4-карбоксамид гидрохлорид. Продукт примера 5b) (1,68 г, 0,006 моль) добавляют к раствору 1-метил-1 Н-3-индазоламина (0,86 г,0,006 моль), полученного как описано в Journal of Heterocyclic Chemistry, 1979 (16), 783-784, и триэтиламина (2,4 мл, 0,018 моль) в толуоле (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем растворитель удаляют выпариванием при пониженном давлении. Таким образом полученный остаток обрабатывают 1 н. раствором NaOH и дихлорметаном и переносят в делительную воронку. Органическую фазу отделяют, сушат над Na2SO4 и растворитель удаляют выпариванием при пониженном давлении. Таким образом полученный продукт превращают в соответствующий гидрохлорид путем растворения в этаноле, добавления хлороводорода в этаноле и перекристаллизации из этанола, получая желательную соль (1,6 г). Т.пл.: 235-237 С. Элементный анализ для C22H26N4OHCl1/4 Н 2Oa) Гидрохлорид 1-(2-(4-метоксифенил)этил)-4-пиперидинкарбоновой кислоты. Указанный в заголовке продукт получают (15,8 г) обработкой подобным способом, описанным в примере 5 а), но исходя из 1-(2-(4-метоксифенил)этил)-4-карбэтоксипиперидина (16,5 г, 0,057 моль), полученного как описано в патенте США 6017931, вместо 1-(2-фенилэтил)-4-карбэтоксипиперидина. 1b) Гидрохлорид 1-(2-(4-метоксифенил)этил)-4-пиперидинкарбонилхлорида. Указанный в заголовке продукт получают (14,2 г) из продукта примера 6 а) (13,8 г, 0,048) и следуя методике, описанной в примере 5b). Таким образом полученный продукт используют как таковой без дальнейшей очистки. с) N-(1-Метил-1 Н-индазол-3-ил)-1-(2-(4-метоксифенил)этил)пиперидин-4-карбоксамид гидрохлорид. Указанный в заголовке продукт получают (9,2 г), исходя из продукта примера 6b) (14,2 г, 0,045 моль) и 1-метил-1 Н-3-индазоламина (6,6 г, 0,045 моль) и следуя методике, описанной в примере 5 с). Смесь этилацетат:этанол = 9:1 используют в качестве растворителя для кристаллизации. Т.пл.: 137-139 С (разложение). Элементный анализ для C23H28N4O2HCl2(I, Ra=Rd=H; Rb=CH3, Rc=4-OH, X=NHC(O Раствор продукта примера 6 с) (6,7 г, 0,017 моль) в дихлорметане (300 мл) добавляют по каплям к раствору BBr3 (8,5 г, 0,034 моль) в дихлорметане (50 мл). Реакционную смесь перемешивают при комнатной температуре в течение 6 ч. Затем осторожно добавляют воду и смесь подщелачивают 1 н. раствором NaOH до рН 9, и переносят в делительную воронку. Органическую фазу отделяют, сушат над Na2SO4 и растворитель удаляют выпариванием при пониженном давлении. Таким образом полученный остаток(4,4 г) очищают флэш-хроматографией, используя смесь CHCl3:МеОН=9:1 в качестве элюирующего средства. Таким образом получают 3 г продукта и превращают его в соответствующий гидрохлорид путем растворения в этаноле, добавления хлороводорода в этаноле, выпаривания растворителя и кристаллизации из смеси этилацетат:этанол = 9:1, с получением желательного продукта (2,8 г). Т.пл: 249-252 С.-7 008499 Элементный анализ для C22H26N4O2HCl2/3H2Oa) 1-(2-(4-Гидроксифенил)этил)-4-пиперидинилметанамин. Указанный в заголовке продукт получают (9,3 г) обработкой подобным таковому способом, описанному в примере 1b), но исходя из продукта примера 1 а) (7,5 г, 0,037 моль) и 2-(4-гидроксифенил)этилбромида (7,5 г, 0,037 моль), полученного как описано в Acta Chemica Scandinava (1947-1973) 1967, 21 (1), 52-62, вместо 2-(4-нитрофенил)этилбромида. 1 Н-ЯМР (, CDCl3 + D2O): 1,15-1,41 (м, 3H); 1,74 (д, J=9 Гц, 2 Н); 1,90-2,07 (м, 2 Н); 2,45-2,61 (м, 4 Н); 2,65-2,75 (м, 2 Н); 3,01 (д, J=12 Гц, 2 Н); 6,75 (д, J=9 Гц, 2 Н); 7,00 (д, J=9 Гц, 2 Н).b) Сложный изопропиловый эфир 1-(1-метилэтил)-5-метил-1 Н-индазол-3-карбоновой кислоты. 60%-ную суспензию иодида натрия в минеральном масле (17,1 г, 0,43 моль) добавляют к суспензии 5-метил-1 Н-индазол-3-карбоновой кислоты (30 г, 0,17 моль), полученной как описано в J. HeterocyclicChem. 1964, том 1 (5), 239-241, в диметилформамиде (450 мл), и реакционную смесь нагревают до 70 С. Через 30 мин добавляют изопропилбромид (48 мл, 0,51 моль). Реакционную смесь перемешивают в течение 6 ч при 70 С. После охлаждения добавляют воду. Реакционную смесь переносят в делительную воронку и экстрагируют диэтиловым эфиром. Органическую фазу промывают насыщенным водным раствором бикарбоната натрия и, наконец, растворитель удаляют выпариванием при пониженном давлении. Таким путем получают 20 г масла, которые очищают флэш-хроматографией, элюируя смесью гексан:этилацетат = 7:3, с получением 12 г желательного продукта. 1 Н-ЯМР (, CDCl3): 1,47 (д, J=6 Гц, 6 Н); 1,64 (д, J=7 Гц, 6 Н); 2,50 (д, J=1 Гц, 3H); 4,92 (гептет, J=7 Гц, 1 Н); 5,39 (гептет, J=6 Гц, 1 Н); 7,23 (дд, J=9,1 Гц, 1 Н); 7,40 (д, J=9 Гц, 1 Н); 7,95 (квинтет, J=1 Гц, 1 Н).c) 1-(1-Метилэтил)-5-метил-1 Н-индазол-3-карбоновая кислота. Суспензию продукта, полученного согласно примеру 8b) (8 г, 0,03 моль) в 1 М растворе NaOH (42 мл), кипятят с обратным холодильником в течение 3 ч. Затем ее выливают в воду, подкисляют 2 М HCl и экстрагируют дихлорметаном. После выпаривания растворителя при пониженном давлении получают 7 г желательного продукта. 1d) Хлорангидрид 1-(1-метилэтил)-5-метил-1 Н-индазол-3-карбоновой кислоты. Тионилхлорид (6,78 г, 0,057 моль) добавляют к суспензии продукта, полученного согласно примеру 8 с) (4,01 г, 0,019 моль), в толуоле (70 мл), и реакционную смесь кипятят с обратным холодильником в течение 2 ч. Растворитель удаляют выпариванием при пониженном давлении и дважды обрабатывают толуолом (50 мл 2), с получением желательного продукта (4,3 г), который используют как таковой без дальнейшей очистки.e) N-1-(2-(4-Гидроксифенил)этил)-4-пиперидинил)метил)-5-метил-1-(1-метилэтил)-1 Н-индазол-3 карбоксамид гидрохлорид. Следуя методике, описанной в примере 3, но используя продукт примера 8 а) (4,0 г, 0,017 моль) и хлорангидрид 1-(1-метилэтил)-5-метил-1 Н-индазол-3-карбоновой кислоты (4,0 г, 0,017 моль), полученный как описано в предыдущем примере 8d), получают 4,5 г желательного продукта и его превращают в соответствующий гидрохлорид путем растворения в абсолютном этаноле, добавления хлороводорода в этаноле и перекристаллизации из этанола с получением желательной соли (3,2 г). Т.пл.: 257,5-259,5 С. Элементный анализ для C26H34N4O2HCl-8 008499 Тесты. Механическая гипералгезия, индуцируемая CFA у крысы. Использовали самцов крыс CD, массой по 150-200 г. Применяя аналгезиометр, отбирали крыс,имеющих пороговый ответ на механический болевой раздражитель, от 150 до 180 г. Осуществляя постепенное увеличение давления на дорсальную зону левой задней лапы крысы, прибор позволяет регистрировать защитный ответ организма, выраженный в граммах, соответствующий моменту, когда животное втягивает свою лапу [Randall L.O. and Semite J.J. A method for the measurement of analgesic activity on inflamed tissue. Arch. Int. Pharmacodyn. Ther. 1957; 111: 409-419]. Гипералгезию вызывали односторонней инъекцией 150 мкл полного адъюванта Фрейнда (CFA) в подошвенную поверхность левой задней лапы животного [Andrew D., Greenspan J.D., Mechanical and heatthermal nociception in cutaneous hyperalgesia. Pain 1988; 32: 77-88]. Исследуемые соединения тестировали (доза 10-5 моль/кг) путем проведения теста спустя 23 ч после инъекции CFA. Спустя 1 ч после обработки измеренную пороговую боль у контрольных животных сравнивали с измеренной у животных, обработанных исследуемым продуктом. Контрольных животных обрабатывали тем же самым эксципиентом (водой), используемым для введения исследуемых продуктов. Результаты показаны в табл. 1. Таблица 1 Эффект CFA Пороговая боль нормальных животных равной массы/возраста = 1552,1 г. Механическая гипералгезия у крыс с диабетом, вызываемым стрептозотоцином. Использовали самцов крыс CD, массой по 240-300 г. Диабетический синдром индуцировали одной внутрибрюшинной (i.p.) инъекцией 80 мг/кг стрептозотоцина, растворенного в стерильном физиологическом растворе [Courteix С., Eschalier A., Lavarenne J.Bannon A.W., Decker M.W., Kim Dj., Campbell J.E., Arneric S.P. ABT-594, a novel cholinergic channel modulator, is efficacious in nerve ligation and diabetic neuropathy models of neuropathic pain. Brain Res. 1998; 801: 158-63]. Спустя по меньшей мере три недели после инъекции стрептозотоцина, отбирали крыс, обладающих уровнем гликемии 300 мг/дл и имеющих пороговый ответ на механический болевой раздражитель 120 г. Уровни гликемии измеряли посредством рефлектометра, используя реакционноспособные полоски,пропитанные глюкозооксидазой. Пороговую боль измеряли при использовании аналгезиометра. Осуществляя постепенное увеличение давления на дорсальную зону левой задней лапы крысы, прибор позволяет регистрировать защитный ответ организма, выраженный в граммах, соответствующий моменту, когда животное втягивает свою лапу. Спустя 2 ч после обработки, измеренную пороговую боль у контрольных животных сравнивали с таковой измеренной у животных, обработанных исследуемым продуктом (доза 10-5 моль/кг). Контрольных животных обрабатывали тем же самым эксципиентом (водой), используемым для введения исследуемого продукта. Результаты показаны в табл. 2. Пороговая боль нормальных животных равной массы/возраста = 2408,7 г. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыRa означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1C3 алкил, линейный или разветвленный C1-C3 алкокси или галоген;Rb означает Н, линейный или разветвленный C1-C6 алкил, арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3 алкильной группой или C1-C3 алкоксигруппой; и в которойa) когда X означает C(O)NHCH2,Rc означает гидрокси, аминогруппу, ди (C1-C3)алкиламиногруппу, три (C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н или линейный или разветвленный C1-C6 алкил,Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,при условии, однако, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси;b) когда X означает NHC(O) или NHC(O)CH2,Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3 алкокси,галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,и его аддитивные соли фармацевтически приемлемых органических и неорганических кислот. 2. Соединение по п.1, отличающееся тем, что Ra означает Н или C1-C3 алкил. 3. Соединение по п.1 или 2, отличающееся тем, что Rb означает Н или C1-C3 алкил. 4. Соединение по любому из пп.1-3, отличающееся тем, что Rc означает Н, NO2, NH2, ОН или C1C3 алкокси. 5. Соединение по любому из пп.1-4, отличающееся тем, что Rd означает Н. 6. Аддитивная соль кислоты соединения по любому из пп.1-5, отличающаяся тем, что кислоту выбирают из группы, включающей щавелевую кислоту, малеиновую кислоту, метансульфокислоту, паратолуолсульфокислоту, янтарную кислоту, лимонную кислоту, винную кислоту, молочную кислоту, соляную кислоту, фосфорную кислоту и серную кислоту. 7. Способ получения соединения формулы (I) и его аддитивных солей фармацевтически приемлемых органических или неорганических кислот,где X означает C(O)NHCH2;Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1C3 алкил, линейный или разветвленный C1-C3 алкокси или галоген;Rb означает Н, линейный или разветвленный C1-C6 алкил, арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3 алкильной группой или C1-C3 алкоксигруппой;Rc означает гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6 алкил,Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше,при условии, что, когда Ra и Rd, оба, означают Н и Rb означает изопропил, тогда Rc не означает гидрокси; отличающийся тем, что он включает следующие стадии: а) реакцию амина формулы (II) где Rc и Rd имеют те же значения, как указанные выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа,с производным индазолкарбоновой кислоты формулы (IIIа)Y означает атом Cl или Br или группу OR или OC(O)R, где R означает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,или с производным индазолкарбоновой кислоты формулы (IIIb) где Ra имеет значения, указанные выше,b) отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы иc) необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты. 8. Способ получения соединения формулы (I) и его фармацевтически приемлемых аддитивных солей органических и неорганических кислот,где X означает NHC(O) или NHC(O)CH2;Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1C3 алкил, линейный или разветвленный C1-C3 алкокси или галоген;Rb означает Н, линейный или разветвленный C1-C6 алкил; арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3 алкильной группой или C1-C3 алкоксигруппой;Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3 алкокси,галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6 алкил, отличающийся тем, что он включает следующие стадии: а') амин формулы (IV) где Ra и Rb имеют значения, указанные выше,конденсируют с производным карбоновой кислоты формулы (V) где Rc и Rd имеют те же значения, как указаны выше, или, когда Rc или Rd означает аминогруппу или спиртовую группу, Rc и Rd могут быть аминогруппой или спиртовой группой, защищенной защитной группой обычного типа, иOC(O)R, где R означает линейный или разветвленный алкил, имеющий от 1 до 6 атомов углерода,b') отщепление любой возможной защитной группы от вышеупомянутой аминогруппы или спиртовой группы и с') необязательное образование аддитивной соли индазоламида формулы (I) фармацевтически приемлемой органической или неорганической кислоты. 9. Способ по п.7, отличающийся тем, что стадию (а) осуществляют путем реакции соединения формулы (II) с соединением формулы (IIIа), в которой Y означает хлор, или с соединением формулы (IIIb) в присутствии подходящего растворителя и при температуре от 0 до 140 С в течение времени от 0,5 до 20 ч. 10. Способ по п.8, отличающийся тем, что стадию (а') осуществляют путем реакции соединения формулы (IV) с соединением формулы (V), в которой Y означает хлор, в присутствии подходящего растворителя и при температуре от 0 до 140 С в течение времени от 0,5 до 20 ч. 11. Способ по п.9 или 10, отличающийся тем, что температура реакции составляет от 15 до 40 С. 12. Способ по п.9 или 10, отличающийся тем, что время реакции составляет от 1 до 18 ч. 13. Способ по любому из пп.9-12, отличающийся тем, что растворитель является апротонным растворителем, выбранным из группы, состоящей из толуола, диметилформамида и диметилсульфоксида. 14. Промежуточное соединение формулы (II)C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2,R'R"NSO2, где R' и R" означают Н, или линейный или разветвленный C1-C6 алкил,- 12008499Rd означает Н, гидрокси, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил,нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" имеют значения, указанные выше. 15. Фармацевтическая композиция, содержащая эффективное количество соединения формулы (I)Ra означает Н, NH2C(O), CH3C(O)NH, CH3SO2, CH3SO2NH, линейный или разветвленный C1C3 алкил, линейный или разветвленный C1-C3 алкокси или галоген;Rb означает Н, линейный или разветвленный C1-C6 алкил; арил(C1-C3)алкил, необязательно замещенный 1 или 2 атомами галогена, C1-C3 алкильной группой или C1-C3 алкоксигруппой; и в которойa) когда X означает C(O)NHCH2,Rc означает гидрокси, аминогруппу,ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил,CH3C(O)NH, CH3SO2NH, CH3SO2, R'R"NSO2, где R' и R" означают Н или линейный или разветвленныйb) когда X означает NHC(O) или NHC(O)CH2, Rc и Rd, которые могут быть одинаковыми или различными, означают Н, гидрокси, C1-C3 алкокси, галоген, аминогруппу, ди(C1-C3)алкиламиногруппу, три(C1-C3)алкиламмониометил, нитрогруппу, трифторметил, нитрил, CH3C(O)NH, CH3SO2NH, CH3SO2,R'R"NSO2, где R' и R" имеют значения, указанные выше,или его фармацевтически приемлемой аддитивной соли органической или неорганической кислоты,и по меньшей мере один фармацевтически приемлемый инертный ингредиент. 16. Фармацевтическая композиция по п.15, отличающаяся тем, что она содержит соединение по любому из предыдущих пп.2-6.
МПК / Метки
МПК: C07D 401/12, A61K 31/454, A61P 29/00
Метки: индазолы, обладающие, анальгетической, активностью
Код ссылки
<a href="https://eas.patents.su/14-8499-indazoly-obladayushhie-analgeticheskojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Индазолы, обладающие анальгетической активностью</a>
Предыдущий патент: Замещённые соединения [1,4]бенздиоксино[2,3-e]изоиндола, способ их получения и фармацевтические композиции, которые их содержат
Следующий патент: Фармацевтическая композиция
Случайный патент: Способ лечения акне


















