Антивирусный и антибактериальный фармацевтический препарат “арменикум” и его применение для лечения инфекционных заболеваний
Номер патента: 4203
Опубликовано: 26.02.2004
Авторы: Ильин Александр Иванович, Габриелян Эмиль Самсонович, Мхитарян Левон Мкртычевич
Формула / Реферат
1. Фармацевтический препарат антивирусного и антибактериального действия, содержащий иод, иодид калия или натрия, хлорид натрия, хлорид лития, синтетический водорастворимый полимер, моно-, олиго- и полисахариды и воду, отличающийся тем, что дополнительно содержит галогенпроизводные моно-, олиго- и полисахаридов при следующем содержании компонентов, г/л:
| Иод | 0,8-25 |
| Иодид калия или натрия | 1,2-38 |
| Хлорид натрия | 9 |
| Хлорид лития | 0,1-20 |
| Синтетический водорастворимый полимер | 0,01-6 |
| Моно-, олиго- и полисахариды | 8-400 |
| Ггалогенпроизводные моно-, олиго- и полисахаридов | 0,001-0,01 |
| Вода | Остальное |
2. Фармацевтический препарат по п.1, отличающийся тем, что в качестве галогенпроизводных моно-, олиго- и полисахаридов используют их иодпроизводные.
3. Применение фармацевтического препарата по пп.1, 2 для лечения зараженных вирусными и бактериальными инфекциями млекопитающих, включая человека.
4. Применение фармацевтического препарата по п.3, отличающееся тем, что фармацевтически эффективное количество препарата вводят внутривенно.
5. Применение фармацевтического препарата по п.4, отличающееся тем, что препарат предварительно разбавляют физиологическим раствором в соотношении более от 1:4 до 1:30 по объему.
6. Применение фармацевтического препарата по любому из пп.4, 5, отличающееся тем, что препарат вводят внутривенно со скоростью 4-9 мл в минуту.
7. Применение фармацевтического препарата по п.3, отличающееся тем, что фармацевтически эффективное количество препарата вводят внутримышечно, подкожно или перорально.
8. Применение фармацевтического препарата по любому из пп.3-7, отличающееся тем, что препарат используется для лечения ВИЧ инфекции.
9. Применение фармацевтического препарата по любому из пп.3-8, отличающееся тем, что препарат используется для лечения СПИДа и сопутствующих оппортунистических болезней.
Текст
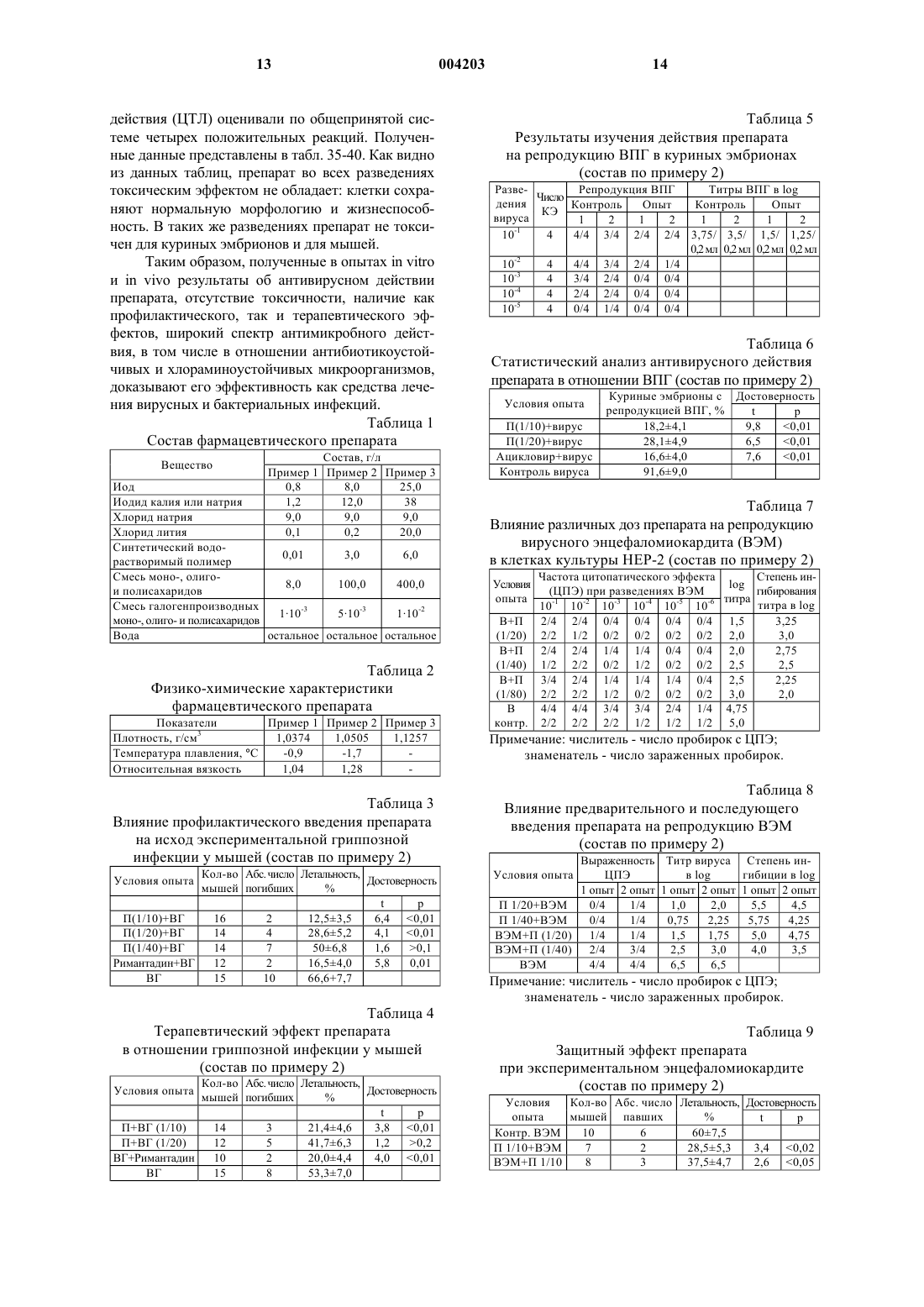
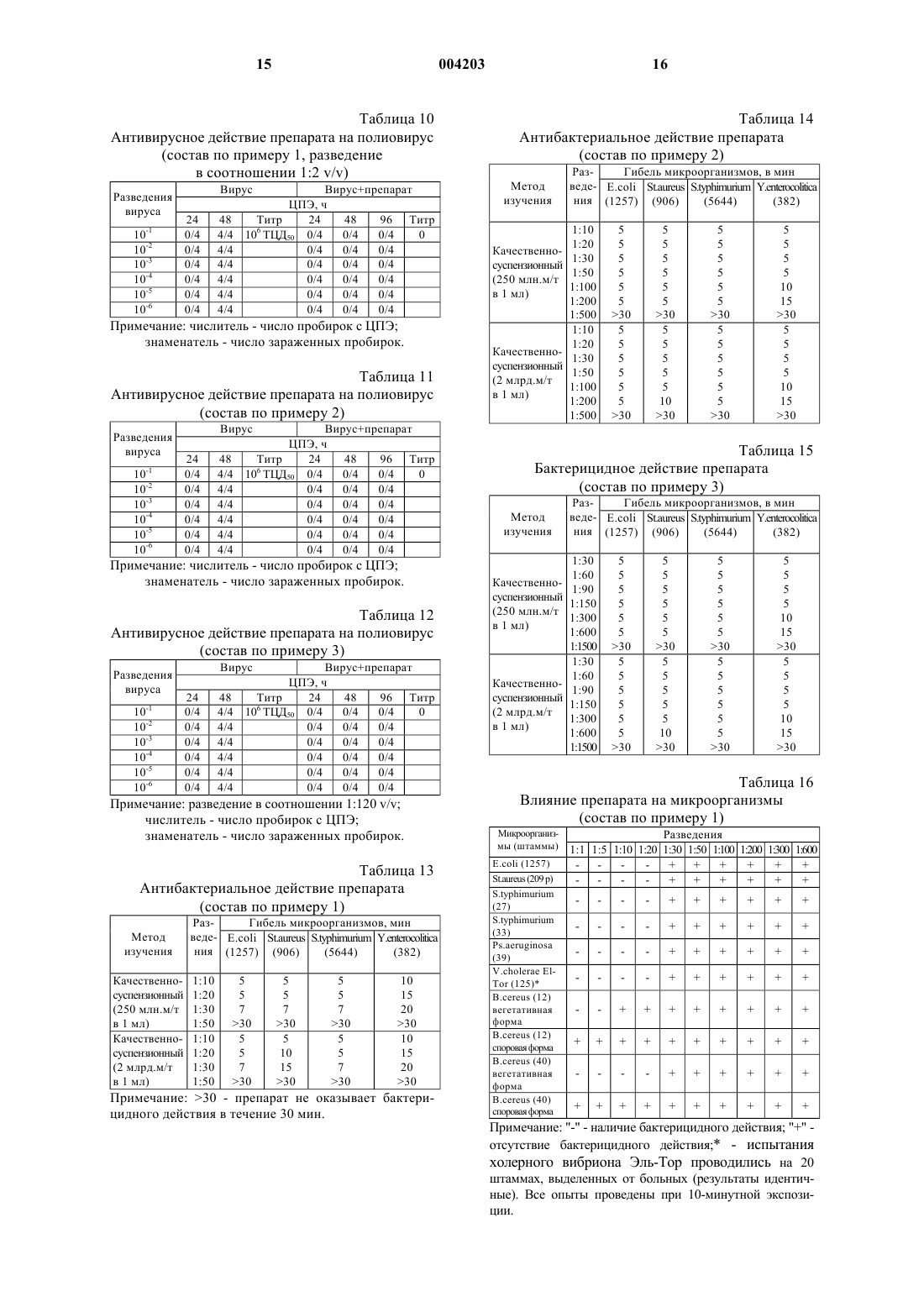
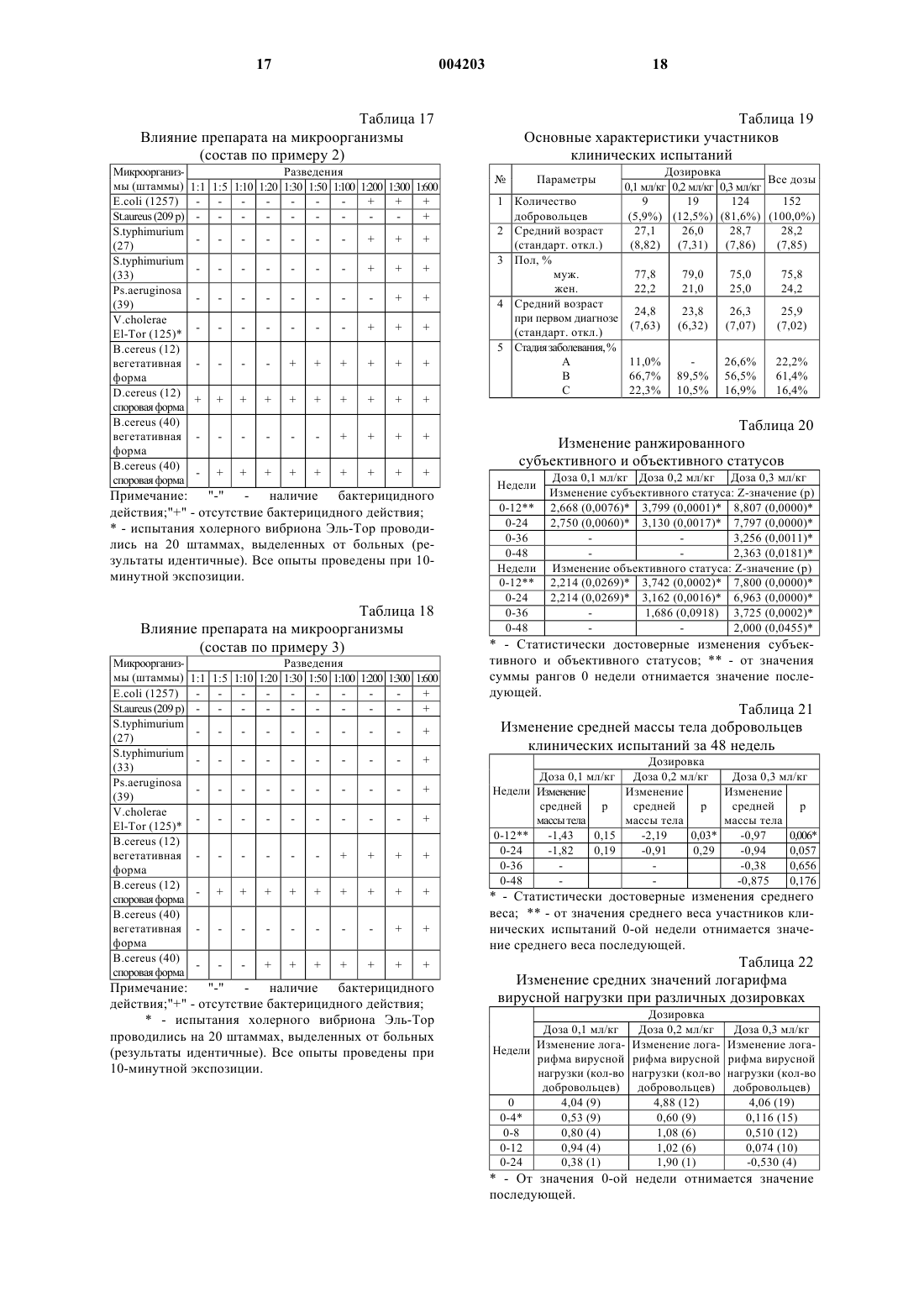
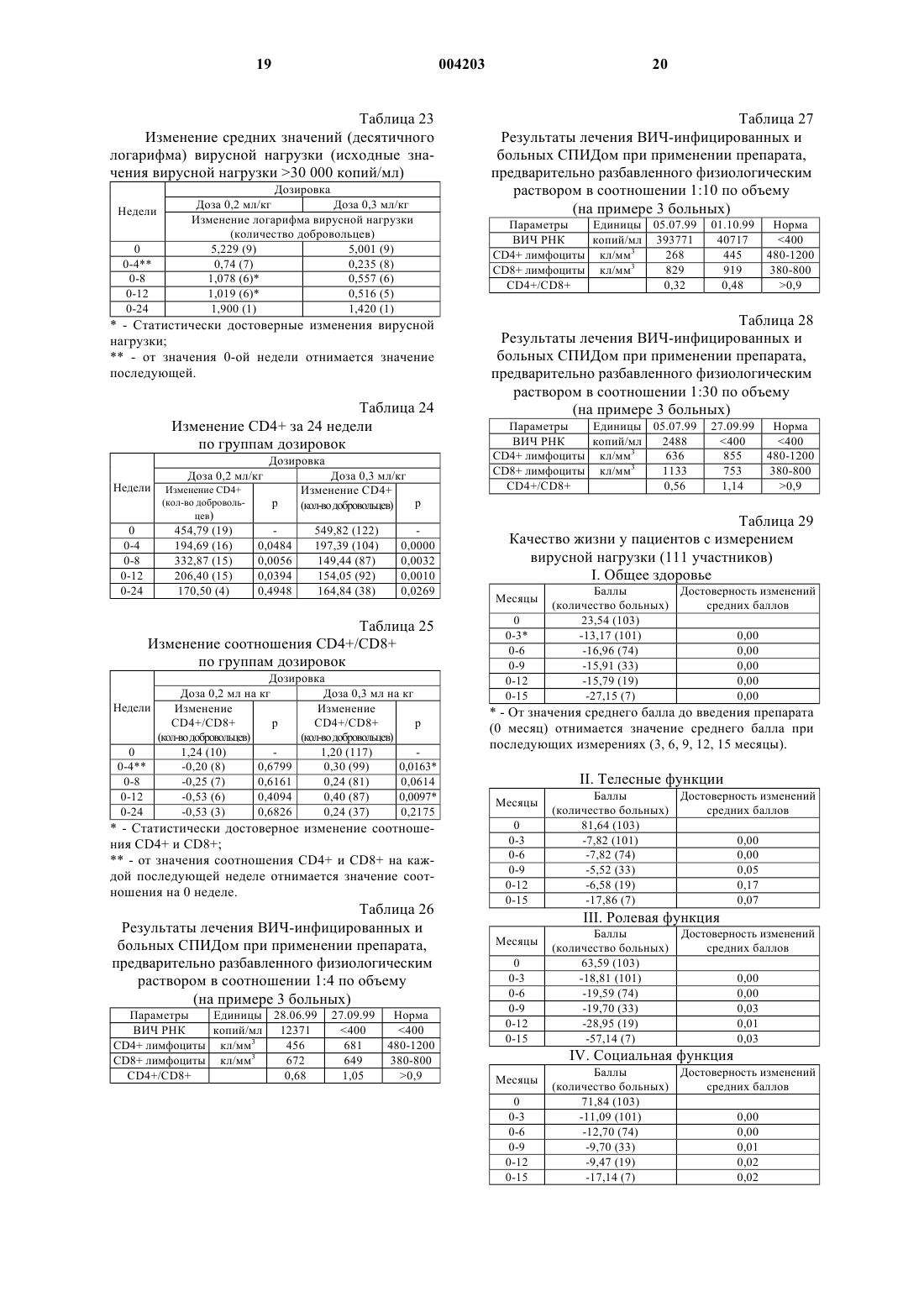
1 Изобретение относится к области медицины, конкретнее к антивирусным и антибактериальным лекарственным препаратам, а также к их применению при лечении инфекционных заболеваний. За последние три десятилетия было предложено множество препаратов для лечения вирусных болезней. Однако, из-за отсутствия правильной оценки естественного развития большинства вирусных инфекций, незнания механизма поражения вирусом живых клеток организма клинические испытания препаратов приводили к ошибочным заключениям. В последнее время в результате более детального изучения и разработки методов специфической вирусной диагностики, расширения биохимических знаний о процессах репликации вирусов, а также лучшего понимания поведения вирусов в специфических популяциях клеток хозяев, наметилась тенденция в разработке более действенных препаратов, используемых против вирусных инфекций. Важной вехой явилось открытие эндогенного интерферона и установление его противовирусной активности. В настоящее время установлено, что действие ряда иммуностимулирующих и антивирусных лекарств связано с их интерфероногенной активностью, то есть способностью стимулировать образование эндогенного интерферона [Машковский М.Д. Лекарственные средства: Пособие для врачей. - Харьков, Торсинг, 1998 г., т. 2, стр. 349]. Природный (лейкоцитарный человеческий) интерферон, относящийся к классу белков(протеинов), продолжают применять для профилактики и лечения гриппа и других вирусных инфекций. Известны также препараты, содержащие аминокислоты [DE 3811177; А 61K 31/95; заяв. 31.03.88. опубл. 19.10.89], пептиды [ЕР 0545991;WO 92/03147; А 61K 37/02; заяв. 20.08.91,опубл. 05.03.92], модифицированные плазменные белки [WO 90/0734; А 61K 37/04; заяв. 30.01.89. опубл. 12.07.90], проявляющие антиВИЧ-активность. Однако по активности все они значительно уступают интерферону. Из последних наиболее эффективных антивирусных синтетических препаратов следует выделить римантадин, используемый для лечения заболеваний, вызванных вирусом гриппа,аденовирусами, пикорнавирусами и др. [Кукайн Р.А. и др. Антивирусная активность и механизм действия различных химических соединений. Рига, Знание, 1979 г.]. Опасным свойством вирусов является их способность к мутации. Вирусы таких эпидемических заболеваний, как испанка, гонконгский грипп, а также вирус иммунодефицита человека (ВИЧ), относящийся к ретровирусам,считаются вирусами животных, тем не менее они поражают и человека. Известна липосомная фармацевтическая композиция, содержащая липид и полиен (на 004203 2 пример нистатин и амфотерицин В), используемая для лечения СПИДа. Однако липосомные композиции избирательно токсичны для ВИЧ-1 инфицированных клеток [WO 92/118415, А 61K 9/127, 31/71, 1992 г.]. В качестве соединений, проявляющих анти-ВИЧ-активность, известны различные производные глицирризиновой кислоты: гликопептид-глицирризиновой кислоты с метиловым эфиром глицил-L-валина [патент РФ 2024542; C 07J 53/00, 63/00, А 61K 31/705, заяв. 04.03.91; опубл. 15.12.94], амид -глицирризиновой кислоты с метиловым эфиром L-гистидина [патент РФ 2024543; C 07J 53/00, 63/00, А 61K 31/705. заяв. 04.03.91; опубл. 15.12.94], амид -глицирризиновой кислоты с 6-аминоурацилом [патент РФ 2024545; C 07J 53/00, 63/00, А 61K 31/705, заяв. 04.03.91; опубл. 15.12.94]. Для лечения СПИДа применяют также рапамицин или его аналог, вызывающий задержку развития или замедление распространения ВИЧинфекций у млекопитающих [WO 94/05300,А 61K 31/71, 1994 г.]. Известно, что повидон-иод обладает большим спектром антибактериального и антивирусного действия, чем другие известные антисептики. Он проявляет активность против многих видов вирусов, включая ВИЧ, в суспензионных опытах in vitro [Kawana R. et al., Inactivationwith other antiseptics. - Dermatology, 1997 г., 195,Прилож. 2, стр.29-35]. Противоинфекционные средства, содержащие повидон-иод, могут использоваться для борьбы с болезнями, вызванными ВИЧ, хламидиями, гонококками, трепонемой и вирусом простого герпеса [Tsutomu S.,Junko S. Anti-infective against STD relating, forfoam containing low molecular weight povidoneiodine. US 5545401, A 61K 31/79, А 61K 33/18,заяв. 02.06.94, опубл.13.08.96]. Известно, что композиция, состоящая из олигомера ноноксинол-9, поливинилпирролидона и иода или поливинилпирролидон-иодида,имеет выраженный синергический анти-ВИЧ эффект по сравнению с воздействием отдельных компонентов [Digenis G.A., Digenis A.G. Coatedproperties. WO 95/28165, A 61K 33/18, 9/10, заяв. 18.04.94. опубл. 26.10.95]. Известно также, что введение иода в полиуретановые полимеры вызывает эффективную инактивацию ВИЧ при контакте с полимерамиvirus.- J. Am. Coll. Surg., 1996 г. 183(3), стр. 195200]. Известен препарат Иодомидол, обладающий антивирусным и антибактериальным действием [патент Казахстана 6730, заяв. 26.01.96,опубл. 16.11.98], содержащий иод, иодид калия или натрия, синтетический водорастворимый полимер, выполняющий роль полимерной матрицы, смесь природных полимеров, например поли-, моно- и олигосахаридов, а также воду при следующем соотношении компонентов, г/л: Иод 6-10 Иодид калия или натрия 9-15 Синтетический водорастворимый полимер 2-4 Моно-, олиго- и полисахариды 8-120 Вода Остальное Этот препарат обладает относительно высокой токсичностью и предназначен исключительно для лечения вирусных и других бактериальных заболеваний животных. Известен также фармацевтический препарат, содержащий в качестве активного вещества бенаномицин А или В, для ингибирования заражения вирусом СПИДа [ЕР 0356330 А, А 61K 31/71, опубл. 15.09.90]. Общим недостатком вышеуказанных средств, используемых для ингибирования СПИДа и ВИЧ является то, что они вызывают ряд побочных реакций организма. В патогенезе ВИЧ-инфекции присутствуют два противоборствующих процесса - агрессивное воздействие ВИЧ и ответные защитные реакции организма [Покровский В.В. Патогенез и этиотропная терапия ВИЧ-инфекции. Эпидемиология и инфекционные болезни, 1998 г., N5,с. 53-58.]. Известно, что цикл репликации ВИЧвируса состоит из следующих стадий: связывание с клеткой хозяина; разложение оболочки вируса; контролирование образования ДНК, РНК и/или белка; ассемблирование вирионов; почкование вирионов. Антивирусные препараты могут влиять на различные звенья репродуктивного цикла вируса. По механизму действия антиретровирусные препараты классифицируются: 1. Нуклеозидные аналоги ингибиторов обратной транскриптазы (NARTI) (зидовудин, диданозин, зальцитабин, ламивудин, ставудин); 2. Ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) (делавирдин, невирапин, ловирид); 3. Ингибиторы протеазы (PI) (ритонавир,индинавир, саквинавир, нелфинавир). Обычно, для того чтобы уменьшить вероятность развития отрицательной реакции на 4 препарат, назначения делают в комбинации по два, три или четыре препарата. Недостатком вышеперечисленных препаратов - производных нуклеиновых кислот, является то, что проникая в клетку для проявления активности, они также оказывают значительное неблагоприятное воздействие на неинфицированые клетки. Результатом этого являются агранулоцитоз, тромбоцитопения и эритропения. Часто препараты из-за своей токсичности могут использоваться только местно. Наиболее близким по химическому составу и достигаемому результату является фармацевтический препарат, обладающий антивирусным действием [ЕР 0823996 А 1, А 01N 59/12,А 61K 9/00, заяв. 15.08.96. опубл. 12.02.98 и патент AM 659, А 61K 33/14, 33/18, 31/70, 31/74,опубл. 1999], содержащий иод, иодид калия или натрия, хлорид лития, синтетический водорастворимый полимер, смесь природных моно-,олиго- и полисахаридов при следующем соотношении компонентов, г/л: Иод 0,8-25 Иодид калия или натрия 1,2-38 Хлорид лития 0,1-20 Синтетический водорастворимый полимер 0,01-6 Смесь моно-, олигои полисахаридов 8-400 Вода Остальное Этот препарат (с дополнительным содержанием 9 г/л хлорида натрия) может быть использован для лечения людей, но, как и вышеописанные, имеет относительно высокую токсичность. Задачей данного изобретения является создание препарата антивирусного и антибактериального действия, который был бы лишен указанных недостатков. Другой задачей изобретения является применение препарата для лечения ВИЧ-инфекции,оппортунистических болезней. Предложен фармацевтический препарат антивирусного и антибактериального действия,содержащий иод, иодид калия или натрия, хлорид натрия, хлорид лития, синтетический водорастворимый полимер, моно-, олиго- и полисахариды и воду, а также, дополнительно, галогенпроизводные моно-, олиго- и полисахаридов при следующем соотношении компонентов, г/л: Иод 0,8-25 Иодид калия или натрия 1,2-38 Хлорид натрия 9 Хлорид лития 0,1-20 Синтетический водорастворимый полимер 0,01-6 Смесь моно-, олигои полисахаридов 8-400 Смесь галогенпроизводных моно-, олиго- и полисахаридов 0,001-0,01 Вода Остальное 5 Помимо них известны также галогенопроизводные других природных соединений - витаминов, нуклеозидов, аминокислот, которые могут быть включены в состав данного препарата, если они способны образовывать водорастворимые комплексные соединения с иодом. В качестве синтетических водорастворимых полимеров, обладающих гелеобразующими свойствами, используются полимеры, разрешенные к применению Международной Фармакопеей и Фармакопеей СССР XIизд., образующие водорастворимые комплексы с иодом в заявленных концентрациях иода и других компонентов. В качестве полисахаридов могут быть использованы все природные полисахариды,включая антибиотики и их производные, относящиеся к этому классу веществ и образующие с иодом водорастворимые комплексные соединения в заявленных концентрациях иода и других компонентов. Концентрации компонентов строго обоснованы. Все компоненты, входящие в состав предлагаемого препарата антивирусного и антибактериального действия, являются необходимыми и достаточно эффективными для достижения поставленной цели. Ни один из них не может быть исключен или заменен другим, в противном случае желаемый результат не будет достигнут. Биологически активным компонентом препарата является иод. При его концентрации ниже 0,8 г/л происходит реакция гидролиза иода: а это значит, что фармацевтический препарат не подлежит длительному хранению. При концентрации иода выше 25 г/л за счет структурообразования комплексных ассоциатов иода с другими компонентами лекарственного препарата образуется гель, неприемлемый для медицинского применения. Кроме того,со временем возникает вероятность протекания реакции галогенирования природных моно-,олиго- и полисахаридов, и при этом за счет выделения HI повышается токсичность препарата. Концентрации остальных компонентов выбраны так, чтобы обеспечивалось протекание реакций комплексообразования, ассоциации и агрегации при приготовлении препарата с целью достижения его антивирусных и антибактериальных свойств. Обычно синтетические водорастворимые полимеры (поливиниловый спирт, поли-Nвинилпирролидон) выполняют при введении в кровь функцию плазмозаменителей, сорбентов(например, токсинов) или пролонгаторов. В предложенном препарате синтетический водорастворимый полимер выполняет важную гелеобразующую функцию. 6 Известно, что углеводы, к которым относятся, в частности, моно-, олиго- и полисахариды, наряду с белками и липидами входят в состав биологических мембран, разделяющих клетки друг от друга и от окружающей среды. Моно-, олиго- и полисахариды, входящие в состав препарата, не являются чужеродными для организма млекопитающих, включая человека. Следует также отметить, что одним из важных моментов в подборе компонентов, входящих в состав препарата, является то, что роль матрицы выполняют комплексные соединения иода с низко- и высокомолекулярными лигандами, которые, в свою очередь, образуют ассоциаты. Их водный раствор имеет некоторые свойства геля. Иод, входящий в состав препарата, как в молекулярном виде, так и в виде солей (иодида калия или иодида натрия), находится в нескольких активных формах за счет реакций комплексообразования:n=1 или 2. Ассоциация комплексных соединений, образующихся согласно реакциям 1-4, приводит к гелеобразованию в препарате. Иод и его различные формы, входящие в состав препарата, способны взаимодействовать практически со всеми веществами, входящими в состав организма млекопитающего, включая человека, равно как и в состав мембраны и самой клетки: белками, углеводами, липидами,аминокислотами, глико- и фосфолипидами,гормонами, ферментами, витаминами и т.д.[Moroz J.D., Nelson P. Entropic elasticity of twist storing polymers. - Macromolecules, 1998r, cтp.137]. При этом протекают реакции комплексообразования и галогенирования. Однако, последовательность биохимических процессов в живом организме приводит к тому, что после взаимодействия одной из активных форм иода образуется новая активная форма иода, входящая в состав других комплексов, таких как иодфермент, иод-гормон, иод-биологическая мембрана, иод-белок и т.д. Каждый вновь образующийся комплекс является биологически активным и своим для живого организма млекопитающих, включая человека. За счет механизма "узнавания" и специфического химического взаимодействия иод, входящий в состав лечебного препарата, а также комплексы иода, образующиеся в организме,галогенируют (иодируют) ДНК- и РНКсодержащие вирусы, находящиеся как внутри,так и вне клетки [Fujihashi Т., Наrа Н., Sakata Т., 7Mori K., Higuchi H., Tanaka A., Kaji H., Kaji A.,Anti-human immunodeficiency virus (HIV) activities of halogenated gomisin J derivatives, new nonnucleoside inhibitors of HIV type 1 reverse transcriptase. - Antimicrob Agents Chemother, 1995 г.,т. 39, No. 9, стр. 2000-2007]. Галогенирование протекает в первую очередь посредством замещения атома водорода в группах N-H и -NH2 пуриновых и пиримидиновых оснований, входящих в состав молекул ДНК- и РНК-содержащих вирусов: В результате галогенирования образуются новые вещества, не обладающие свойствами вируса. На этом основано антивирусное действие фармацевтического препарата. Введение в состав препарата галогенпроизводных моно-, олиго- и полисахаридов очень существенно. Хотя на сегодняшний день из природных источников выделено лишь одно галогенпроизводное полисахаридов (антибиотик нуклеоцидин), такие соединения перспективны,так как внедрение в молекулу галогена часто приводит к появлению новых биологических свойств [Barnett J.E.G.- Adv. CarbohydrateChem., Ser., 1968 г., т.74, стр. 159; Szarek W.A Adv. Carbohydrate Chem., 1973 г., т.28, cтp.225]. Известно, что декстраны, относящиеся к полисахаридам, например декстрансульфат,характеризуются широким спектром антивирусного действия [Witvrouw M., DeClercq Е. - Gen.Pharmacol. 1997 г., т.29, стр. 497-511]. Механизм антивирусного действия декстрансульфата заключается в подавлении взаимодействия ретровирусов (ВИЧ) с соответствующими клеточными рецепторами [Watson K., Gooderham N.J.,Davies D.S., Edwards R.J. - Biochem. Pharmacol.,1999 г., т. 57, стр. 775-783]. В то же время известно, что некоторые полисахариды на поверхности клеток играют важную роль в межклеточном "узнавании". Полисахариды обладают потенциальной возможностью к созданию большого структурного многообразия. Так группа углеводов на поверхности клеток может иметь ряд вариантов, так как а) моносахариды могут соединяться друг с другом через любую из своих гидроксильных групп; б) связь по С-1 может быть как -, так и конфигурации и возможно интенсивное ветвление цепи [Streier L. Biochemistry - Перевод с английского, М., "Мир", 1984 г., т.1. стр.215]. Введенные в организм галогенпроизводные в количествах, меньших, чем в случае дек 004203 8 странсульфата, в силу большей реакционной способности будут аналогично взаимодействовать с рецепторами на поверхности ВИЧинфицированных клеток - Т-лимфоцитов[Jagodzinski P.P., Wierzbicki A., Wustner J.,Kanelo Y., Kozbor D. - Viral Immunol., 1999 г., т. 12, cтp.23-33]. Таким образом, создается дополнительная возможность воздействия на зараженную клетку комплексными соединениями препарата, образующимися при его синтезе (реакции 1-4). Галогениды щелочных металлов, введенные в состав препарата, выполняют необычную для них роль. Они улучшают проводимость в клеточных мембранах, способствуют улучшению латеральной диффузии в бислое клеточных мембран за счет малого размера катиона металла и его более прочной координации по донорным атомам моно-, олиго- и полисахаридов. Предлагаемый препарат - это темнофиолетовый водный раствор молекулярных и ионных комплексов иода с ассоциатами синтетических водорастворимых гелеобразующих полимеров и природных моно-, олиго- и полисахаридов. Температура плавления лечебного препарата равна от -0,9 до -1,7 С, плотность 1,0374-1,1257 г/см 3, значение рН от 5 до 7. Ниже приведена методика получения испрашиваемого фармацевтического препарата. В 100 мл воды растворяют 1,2 г иодида калия или натрия, добавляют 0,8 г иода кристаллического и раствор перемешивают до полного растворения иода. Отдельно растворяют в 100 мл воды 0,01 г поливинилового спирта. Отдельно растворяют в 200 мл воды 8,0 г смеси природных моно-, олиго- и полисахаридов. Полученные растворы смешивают в следующей последовательности: к раствору поливинилового спирта добавляют раствор смеси моно-, олиго- и полисахаридов, а после этого - раствор иода и иодида калия. Затем добавляют дистиллированную воду, доводя объем раствора до 1 л, предварительно добавив 9,0 г хлорида натрия и 0,1 г хлорида лития. В конце добавляются галогенпроизводные природных моно-, олиго- и полисахаридов. Реакции галогенирования с целью получения галогенпроизводных природных моно-,олиго- и полисахаридов проводят в соответствии с классическими реакциями галогенирования этих соединений [Edwards R.G., Hough L.,Richardson A.C., Tarelli E. - Carbohydrate Res.,1974 г., т.35, стр. 111;. Bhatt R.S., Hough L.,Richardson A.C. - Carbohydrate Res., 1976 г., т.49,cтp.103; Foster A.B., J.H. Westwood - Pure Appl.and Elmer F. Schroeder. Synthesis of Some lodosugar Derivatives. J. Am. Soc., v. 70, p. 2785-2789. 1948]. Идентификацию полученных соединений осуществляют методами элементарного анализа и ИК-спектроскопии (ИК-спектрометр "1600Series FTIR", Perkin-Elmer). В ИК-спектрах га 9 логенпроизводных моно-, олиго- и полисахаридов появляется интенсивная полоса валентных колебаний С-Х (Х=I или Вr) в области 510 см-1. При иных содержаниях концентраций компонента растворы готовятся по вышеописанной методике, в той же последовательности операций. Составы лекарственного препарата и их некоторые физико-химические показатели представлены в табл. 1 и 2. Антивирусное действие препарата изучено на клеточных культурах, у мышей и на куриных эмбрионах. В опытах использованы вирус гриппа А,штамм A/Aichi 2/68 Н 3N2 вирус простого герпеса второго серотипа, вирус энцефаломиокардита мышей и полиовакцина. Для поддержания жизнеспособности вирусов и изучения антивирусной активности препарата использованы передаточные линии клеток аденокарциномы гортани человека (Нер-2), рабдомиосаркомы человека (RD), а также первичные культуры фибробластов куриных эмбрионов. Известные антивирусные препараты римантадин, ацикловир и -интерферон использованы в качестве положительного контроля в опытах с вирусами гриппа и герпеса. Препарат испытан в различных условиях эксперимента: при введении до и после инфицирования, а также при введении одновременно с вирусом. Титрование вирусов на мышах осуществляли по методу Рида и Менча, на куриных эмбрионах - по реакции гемаглютинации, на клеточных культурах - по степени ингибиции цитопатического эффекта. Антибактериальная активность препарата была изучена по общепринятой методике, качественно-суспензионным методом, с использованием 2 млрд. микробной суспензии и суспензии,содержащей 250 млн. микробных тел в 1 мл. Эталонные культуры: E.соli (штамм 1257),энтеропатогенная Е.coli Crimea "0 151",St.aureus (штамм 906), St. aureus 209 p, B.cereus(штамм 96), B.cereus var.mycoides (штамм 12),Mycobacterium B5, и выделенные от больных хлораминоустойчивые культуры S.typhimuriumEl-Tor "Ogava"- 21 культура (штаммы 124-144). Статистическая обработка результатов проводилась согласно Европейской Фармакопее и биометрическим методам [Urbach В. Biometrical methods, Москва, 1964 г. GF XI СССР,стр.199-251]. Результаты лабораторных испытаний препарата по данному изобретению представлены в табл. 3-18. 10 В табл. 3-6 представлены результаты исследования действия препарата на вирусы гриппа и простого герпеса (ВПГ). Как следует из представленных данных, антивирусное действие препарата сравнимо с эффектом известных препаратов - римантадина и ацикловира. Изучение действия препарата на вирус энцефаломиокардита (ВЭМ) проводились in vitro и in vivo. Как следует из данных табл. 7-9, введение препарата как до, так и после заражения,в значительной степени подавляет развитие вируса при заражении в дозе 100 ТЦД 50 (титp цитопатического действия) in vitro и приводит к защитному действию in vivo. В табл. 10-12 представлены результаты действия препарата на полиовирус. Согласно этим данным, препарат полностью нейтрализует полиовирус, снижая титр 106 ТЦД 50/мл до нуля,что свидетельствует об антивирусном действии препарата. В табл. 13-18 представлены данные по изучению антибактериального действия препарата. Как следует из представленных данных,препарат обладает широким спектром антибактериального действия, в том числе и в отношении антибиотикоустойчивых и хлораминоустойчивых микроорганизмов, и может быть использован в качестве эффективного средства против многих внутрибольничных и раневых инфекций. Препарат антивирусного и антибактериального действия можно применять для лечения инфекционных заболеваний млекопитающих,включая человека, в частности ВИЧ-инфекции и сопутствующих оппортунистических болезней. Клинические испытания проводились на добровольцах в соответствии с требованиямиGCP [Good Clinical Practice - John WileySons,1998 г.]. В табл. 19-31 собраны результаты клинических исследований заявляемого препарата. Фармацевтически эффективное количество препарата вводится внутривенно. До введения его разводят физиологическим раствором натрия хлорида в объемном соотношении от 1:4 до 1:30, что делает его применение удобным в зависимости от индивидуальных особенностей больных. Предпочтительная скорость введения составляет 4-9 мл/мин. При более медленном введении процесс затягивается. При более высокой скорости, введение препарата может сопровождаться жжением по ходу вены. Возможны также внутримышечное, внутрибрюшинное,подкожное и другие применения препарата. Различные пути введения аналогичных иодсодержащих препаратов описаны в "Новое о полимерах и их использовании", Е.Е. Ергожин и др. "Мектеп", 1988 г., Алма-Ата, стр. 168. В табл. 19 представлены данные о 152 участниках клинических испытаний, распределенных в соответствии с получаемыми дозами. 11 В табл. 20 приведено изменение ранжированного субъективного и объективного статусов. Данные представлены в виде Z-значения (р) и парного теста Вилкоксона [Wilcoxon matchedpaired test, Armitage P., Berry G.: Statistical Methods in Medical Research (2-ое издание). BlackwellSons, 1980 г.]. Данные табл. 20 свидетельствуют о статистически достоверном улучшении субъективного и объективного статуса в сравнении со статусами до приема препарата. При этом очевидный положительный эффект обнаруживается уже при первом измерении статуса на 12-й неделе и не изменяется до последних измерений в течение года. Данные табл. 21 свидетельствуют о статистически достоверном увеличении массы тела на 12-й неделе в группах дозировок 0,2 и 0,3 мл/кг. Последующие изменения массы тела на 24-й, 36-й и 48-й неделях незначительны. Данные табл. 22 показывают, что максимальное уменьшение РНК вирусной нагрузки в плазме крови у больных в группе дозировки 0,2 мл/кг происходит на 8-й и 12-й неделях (на 1,08 и 1,02 log соответственно). Данные табл. 23 показывают изменение РНК вирусной нагрузки в плазме испытуемых с наибольшими исходными значениями вирусной нагрузки (30,000 копий/мл). При этом статистически достоверное уменьшение вирусной нагрузки наблюдается в дозе 0,2 мл/кг на 8-й и 12-й неделях(на 1,078 и 1,019 log соответственно). Данные табл. 24 показывают, что у больных при дозе 0,2 мл/кг наблюдается статистически достоверное повышение CD4+ на 4-й, 8-й и 12-й неделях, а также у больных при дозе 0,3 мл/кг в течение всего периода наблюдения. Данные табл. 25 показывают, что у больных при дозе 0,3 мл/кг наблюдается статистически достоверное повышение соотношения CD4+ иCD8+ на 4-й и 12-й неделях (на 0,3 и 0,4 соответственно). Как следует из данных табл. 26-28, изменения параметров одинаково во всех случаях разбавления препарата физиологическим раствором в объемном соотношении от 1:4 до 1:30. Клинические исследования показывают, что в процессе лечения препаратом биохимические и клинические показатели плазмы постепенно приближаются к норме. Измерения качества жизни проводились валидизированным тестом Medical Outcome StudyHIV Health Survey (MOS HIV Health Survey), специально созданным для оценки результатов клинических испытаний на больных ВИЧ. [ScottLennox J.A., Wu A.W., Воуеr J.G., Ware J.E.J. Realibility and validity of French, German, Italian, DutchStudy HIV Health Survey. - Med.Care, 37, 908-25]. Тест состоит из 11 компонентов, разносторонне 12 характеризующих качество жизни. Анализ результатов тестирования, приведенных в табл. 29, позволяет заключить, что при лечении препаратом у больных происходит резкое улучшение качества жизни по всем параметрам. Как следует из табл. 30 и 31, применение заявляемого фармацевтического препарата приводит не только к снижению вирусной нагрузки РНК ВИЧ и уменьшению образования РНК и ДНК ВИЧ, но и уменьшению количества оппортунистических вирусов (например, вирус простого герпеса I и II типов и цитомегаловирус). При этом для лечения оппортунистических инфекций не использовались дополнительные, специфические для оппортунистических вирусов, препараты. Клинические испытания препарата и различных способов лечения на ВИЧинфицированных и больных СПИДом добровольцах дают основание отнести заявляемый препарат к эффективным антиретровирусным препаратам. Дополнительным положительным его свойством является способность подавлять оппортунистические инфекции и существенно улучшать качество жизни больных. Вся совокупность полученных данных убедительно свидетельствуют о том, что введение в состав заявляемого препарата галогенпроизводных моно-, олиго- и полисахаридов повышает эффективность его антивирусного и антибактериального действия. Токсикологические исследования осуществлялись согласно нормативным документам [Требования к доклиническому исследованию общего токсического воздействия новых веществ. Методические рекомендации, Фармакологический Комитет Министерства Здравоохранения СССР, Москва, 1985 г. Правила доклинической оценки безопасности медицинских продуктов. Инструкции. Москва, 1992 г.]. Токсикологические исследования противовирусного препарата, проведенные на лабораторных животных при различных путях введения,свидетельствуют о его относительно малой токсичности и слабой кумулятивной способности. Препарат в терапевтических дозах, а также несколько раз превышающих среднесуточные дозы,нормированные для человека, многократно испытывался на животных. Результаты показали, что препарат не оказывает существенного влияния на общее состояние, поведение и температуру животных. В табл. 32-34 представлены параметры острой токсичности препарата. Как видно из этих данных, препарат малотоксичен при всех путях его введения. Возможную токсическую активность препарата относительно клеточных культур определяли в разведениях от 1:10 до 1:80 (составы по примерам 1 и 2) и от 1:30 до 1:240 (состав по примеру 3). Контакт препарата с монослоем клеточной культуры осуществляли в течение 10, 30 и 60 мин. Степень неспецифического цитотоксического 13 действия (ЦТЛ) оценивали по общепринятой системе четырех положительных реакций. Полученные данные представлены в табл. 35-40. Как видно из данных таблиц, препарат во всех разведениях токсическим эффектом не обладает: клетки сохраняют нормальную морфологию и жизнеспособность. В таких же разведениях препарат не токсичен для куриных эмбрионов и для мышей. Таким образом, полученные в опытах in vitro и in vivo результаты об антивирусном действии препарата, отсутствие токсичности, наличие как профилактического, так и терапевтического эффектов, широкий спектр антимикробного действия, в том числе в отношении антибиотикоустойчивых и хлораминоустойчивых микроорганизмов,доказывают его эффективность как средства лечения вирусных и бактериальных инфекций. Таблица 1 Состав фармацевтического препарата Вещество Иод Иодид калия или натрия Хлорид натрия Хлорид лития Синтетический водо 0,01 3,0 6,0 растворимый полимер Смесь моно-, олиго 8,0 100,0 400,0 и полисахаридов Смесь галогенпроизводных 510-3 110-2 110-3 моно-, олиго- и полисахаридов Вода остальное остальное остальное Таблица 2 Физико-химические характеристики фармацевтического препарата Показатели Пример 1 Пример 2 Пример 3 Плотность, г/см 3 1,0374 1,0505 1,1257 Таблица 3 Влияние профилактического введения препарата на исход экспериментальной гриппозной инфекции у мышей (состав по примеру 2) Кол-во Абс. число Летальность,Достоверность мышей погибших Таблица 4 Терапевтический эффект препарата в отношении гриппозной инфекции у мышей 14 Таблица 5 Результаты изучения действия препарата на репродукцию ВПГ в куриных эмбрионах(состав по примеру 2) РазвеPeпродукция ВПГ Титры ВПГ в log Число дения Контроль Опыт Контроль Опыт КЭ вируса 1 2 1 2 1 2 1 2 10-1 4 4/4 3/4 2/4 2/4 3,75/ 3,5/ 1,5/ 1,25/ 0,2 мл 0,2 мл 0,2 мл 0,2 мл 10-2 4 4/4 3/4 2/4 1/4 10-3 4 3/4 2/4 0/4 0/4 10-4 4 2/4 2/4 0/4 0/4 10-5 4 0/4 1/4 0/4 0/4 Таблица 6 Статистический анализ антивирусного действия препарата в отношении ВПГ (состав по примеру 2) Условия опыта П(1/10)+вирус П(1/20)+вирус Ацикловир+вирус Контроль вируса Таблица 7 Влияние различных доз препарата на репродукцию вирусного энцефаломиокардита (ВЭМ) в клетках культуры НЕР-2 (состав по примеру 2) Условия опыта В+П Частота цитопатического эффекта Степень инlоg(ЦПЭ) при разведениях ВЭМ гибирования титра титра в log 10-1 10-2 10-3 10-4 10-5 10-6 2/4 2/4 0/4 0/4 0/4 0/4 1,5 3,25 2/2 1/2 0/2 0/2 0/2 0/2 2,0 3,0 2/4 2/4 1/4 1/4 0/4 0/4 2,0 2,75 1/2 2/2 0/2 1/2 0/2 0/2 2,5 2,5 3/4 2/4 1/4 1/4 1/4 0/4 2,5 2,25 2/2 2/2 1/2 0/2 0/2 0/2 3,0 2,0 4/4 4/4 3/4 3/4 2/4 1/4 4,75 2/2 2/2 2/2 1/2 1/2 1/2 5,0 Таблица 8 Влияние предварительного и последующего введения препарата на репродукцию ВЭМ(состав по примеру 2) Выраженность Титр вируса ЦПЭ в log 1 опыт 2 опыт 1 опыт 2 опыт П 1/20+ВЭМ 0/4 1/4 1,0 2,0 П 1/40+ВЭМ 0/4 1/4 0,75 2,25 ВЭМ+П (1/20) 1/4 1/4 1,5 1,75 ВЭМ+П (1/40) 2/4 3/4 2,5 3,0 ВЭМ 4/4 4/4 6,5 6,5 Таблица 9 Защитный эффект препарата при экспериментальном энцефаломиокардите(состав по примеру 2) Условия Кол-во Абс. число Летальность, Достоверность опыта мышей павших Таблица 10 Антивирусное действие препарата на полиовирус Таблица 11 Антивирусное действие препарата на полиовирус Таблица 12 Антивирусное действие препарата на полиовирус Примечание: 30 - препарат не оказывает бактерицидного действия в течение 30 мин. Таблица 16 Влияние препарата на микроорганизмы Примечание: "-" - наличие бактерицидного действия; "+" отсутствие бактерицидного действия; - испытания холерного вибриона Эль-Тор проводились на 20 штаммах, выделенных от больных (результаты идентичные). Все опыты проведены при 10-минутной экспозиции. Таблица 17 Влияние препарата на микроорганизмы Примечание: "-" - наличие бактерицидного действия;"+" - отсутствие бактерицидного действия;- испытания холерного вибриона Эль-Тор проводились на 20 штаммах, выделенных от больных (результаты идентичные). Все опыты проведены при 10 минутной экспозиции. Таблица 18 Влияние препарата на микроорганизмы Примечание: "-" - наличие бактерицидного действия;"+" - отсутствие бактерицидного действия;- испытания холерного вибриона Эль-Тор проводились на 20 штаммах, выделенных от больных(результаты идентичные). Все опыты проведены при 10-минутной экспозиции. Таблица 19 Основные характеристики участников клинических испытаний(стандарт. откл.) 3 Пол, % муж. жен. 4 Средний возраст при первом диагнозе Дозировка Все дозы 0,1 мл/кг 0,2 мл/кг 0,3 мл/кг 9 19 124 152 Таблица 20 Изменение ранжированного субъективного и объективного статусов Недели 0-12 0-24 0-36 0-48 Недели 0-12 0-24 0-36 0-48- Статистически достоверные изменения субъективного и объективного статусов;- от значения суммы рангов 0 недели отнимается значение последующей. Таблица 21 Изменение средней массы тела добровольцев клинических испытаний за 48 недель Дозировка Доза 0,1 мл/кг Доза 0,2 мл/кг Доза 0,3 мл/кг Недели Изменение Изменение Изменение средней р средней р среднейp массы тела массы тела массы тела 0-12- Статистически достоверные изменения среднего веса;- от значения среднего веса участников клинических испытаний 0-ой недели отнимается значение среднего веса последующей. Таблица 22 Изменение средних значений логарифма вирусной нагрузки при различных дозировках Дозировка Доза 0,1 мл/кг Доза 0,2 мл/кг Изменение лога- Изменение логаНедели рифма вирусной рифма вирусной нагрузки (кол-во нагрузки (кол-во добровольцев) добровольцев) 0 4,04 (9) 4,88 (12) 0-4 0,53 (9) 0,60 (9) 0-8 0,80 (4) 1,08 (6) 0-12 0,94 (4) 1,02 (6) 0-24 0,38 (1) 1,90 (1) Доза 0,3 мл/кг Изменение логарифма вирусной нагрузки (кол-во добровольцев) 4,06 (19) 0,116 (15) 0,510 (12) 0,074 (10)- Oт значения 0-ой недели отнимается значение последующей. Таблица 23 Изменение средних значений (десятичного логарифма) вирусной нагрузки (исходные значения вирусной нагрузки 30 000 копий/мл) Недели 0 0-4 0-8 0-12 0-24 Дозировка Доза 0,2 мл/кг Доза 0,3 мл/кг Изменение логарифма вирусной нагрузки- Статистически достоверные изменения вирусной нагрузки;- от значения 0-ой недели отнимается значение последующей. Таблица 24 Изменение CD4+ за 24 недели по группам дозировок Дозировка Недели 0 0-4 0-8 0-12 0-24 Таблица 25 Изменение соотношения CD4+/CD8+ по группам дозировок Дозировка Доза 0,2 мл на кг Доза 0,3 мл на кг Недели Изменение Изменение- Cтатистически достоверное изменение соотношения CD4+ и CD8+;- от значения соотношения CD4+ и CD8+ на каждой последующей неделе отнимается значение соотношения на 0 неделе. Таблица 26 Результаты лечения ВИЧ-инфицированных и больных СПИДом при применении препарата,предварительно разбавленного физиологическим раствором в соотношении 1:4 по объему 20 Таблица 27 Результаты лечения ВИЧ-инфицированных и больных СПИДом при применении препарата,предварительно разбавленного физиологическим раствором в соотношении 1:10 по объему Таблица 28 Результаты лечения ВИЧ-инфицированных и больных СПИДом при применении препарата,предварительно разбавленного физиологическим раствором в соотношении 1:30 по объему Таблица 29 Качество жизни у пациентов с измерением вирусной нагрузки (111 участников)I. Общее здоровье Месяцы 0 0-3 0-6 0-9 0-12 0-15- От значения среднего балла до введения препарата(0 месяц) отнимается значение среднего балла при последующих измерениях (3, 6, 9, 12, 15 месяцы).II. Телесные функции Месяцы 0 0-3 0-6 0-9 0-12 0-15III. Ролевая функция Месяцы 0 0-3 0-6 0-9 0-12 0-15IV. Социальная функция Месяцы 0 0-3 0-6 0-9 0-12 0-15V. Познавательная функция Месяцы 0 0-3 0-6 0-9 0-12 0-15 Достоверность изменений средних баллов 0,00 0,00 0,08 0,67 0,36VII. Психическое здоровье Месяцы 0 0-3 0-6 0-9 0-12 0-15IX. Беспокойство по поводу здоровья Месяцы 0 0-3 0-6 0-9 0-12 0-15X. QOL - Качество жизни Месяцы 0 0-3 0-6 0-9 0-12 0-15XI. Улучшение здоровья Месяцы 0 0-3 0-6 0-9 0-12 0-15 22 Таблица 30 Динамика ДНК- и РНК-ВИЧ при применении препарата Доза 0,3 мл/кг ДНК ВИЧ РНК ВИЧ 0,57 0,63 0,72 (0,54, 0,97) 0,67 (0,51, 0,87) 0,83 (0,62, 1,11) 0,81 (0,64, 1,02) 0,71 (0,50, 0,99) 0,59 (0,44, 0,78) 0,51 (0,27, 0,97) 0,55 (0,38, 0,80)- данные представлены в виде соотношения рисков обнаружения ДНК по сравнению с 0-ой неделей (95% доверительный интервал);- статистически достоверное соотношение рисков. Таблица 31 Динамика выявляемости возбудителей ВПГ I и II типов и цитомегаловируса по неделям Таблица 32 Параметры острой токсичности препарата Летальная Летальная Максимально доза 100, доза 50, переносимая мл/кг мл/кг доза, мл/кг внутривенно 65,0 38,0 20,0 внутри 90,0 56,0 31,0 брюшинно перорально Таблица 33 Параметры острой токсичности препарата Летальная Летальная Максимально доза 100, доза 50, переносимая мл/кг мл/кг доза, мл/кг внутривенно 6,7 3.8 2,1 внутрибрю 9,5 5,6 3,2 шинно перорально 98,6 31,5 18,4 внутривенно 10,5 5.3 2,6 внутрибрю 8,4 4,6 2,2 шинно перорально 30,0 Путь введения Таблица 34 Параметры острой токсичности препарата Летальная Летальная Максимально доза 100, доза 50, переносимая мл/кг мл/кг доза, мл/кг внутривенно 0,5 0,3 0,2 внутрибрю 0,9 0,5 0,3 шинно перорально 2,0 1,2 0,9 внутривенно 0,9 0,5 0,2 внутрибрю 0,8 0,4 0,2 шинно перорально 6,0 4,0 3,0 Путь введения Таблица 35 Определение токсичности препарата на клеточной культуре RD при различных сроках инкубации Таблица 36 Определение токсичности препарата на клеточной культуре RD при различных сроках инкубации Примечание: числитель - отсутствие ЦТД; знаменатель - число тест-объектов. Таблица 37 Определение токсичности препарата на клеточной культуре RD при различных сроках инкубации Таблица 38 Определение токсичности препарата на клеточной культуре Нер-2 (состав по примеру 1) Таблица 39 Определение токсичности препарата на клеточной культуре Нер-2 (состав по примеру 2) 1:10 Примечание: числитель - отсутствие цитотоксического действия (ЦТД); знаменатель - число тестобъектов. Таблица 40 Определение токсичности препарата на клеточной культуре Нер-2 (состав по примеру 3) 1:30 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический препарат антивирусного и антибактериального действия, содержащий иод, иодид калия или натрия, хлорид натрия, хлорид лития, синтетический водорастворимый полимер, моно-, олиго- и полисахариды и воду, отличающийся тем, что дополнительно содержит галогенпроизводные моно-, олиго- и полисахаридов при следующем содержании компонентов, г/л: Иод 0,8-25 Иодид калия или натрия 1,2-38 Хлорид натрия 9 Хлорид лития 0,1-20 Синтетический водорастворимый полимер 0,01-6 Моно-, олиго- и полисахариды 8-400 Ггалогенпроизводные моно-,олиго- и полисахаридов 0,001-0,01 Вода Остальное 2. Фармацевтический препарат по п.1, отличающийся тем, что в качестве галогенпроиз 25 водных моно-, олиго- и полисахаридов используют их иодпроизводные. 3. Применение фармацевтического препарата по пп.1, 2 для лечения зараженных вирусными и бактериальными инфекциями млекопитающих, включая человека. 4. Применение фармацевтического препарата по п.3, отличающееся тем, что фармацевтически эффективное количество препарата вводят внутривенно. 5. Применение фармацевтического препарата по п.4, отличающееся тем, что препарат предварительно разбавляют физиологическим раствором в соотношении более от 1:4 до 1:30 по объему. 6. Применение фармацевтического препарата по любому из пп.4, 5, отличающееся тем, 26 что препарат вводят внутривенно со скоростью 4-9 мл в минуту. 7. Применение фармацевтического препарата по п.3, отличающееся тем, что фармацевтически эффективное количество препарата вводят внутримышечно, подкожно или перорально. 8. Применение фармацевтического препарата по любому из пп.3-7, отличающееся тем,что препарат используется для лечения ВИЧ инфекции. 9. Применение фармацевтического препарата по любому из пп.3-8, отличающееся тем,что препарат используется для лечения СПИДа и сопутствующих оппортунистических болезней.
МПК / Метки
МПК: A61P 31/04, A61K 31/70, A61K 33/14, A61K 33/18, A61P 31/12
Метки: арменикум, препарат, антибактериальный, лечения, фармацевтический, заболеваний, инфекционных, применение, антивирусный
Код ссылки
<a href="https://eas.patents.su/14-4203-antivirusnyjj-i-antibakterialnyjj-farmacevticheskijj-preparat-armenikum-i-ego-primenenie-dlya-lecheniya-infekcionnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Антивирусный и антибактериальный фармацевтический препарат “арменикум” и его применение для лечения инфекционных заболеваний</a>