Трициклические производные n,n’-замещенных 3,7-диазабицикло[3.3.1]нонанов и лекарственные средства на их основе
Номер патента: 24758
Опубликовано: 31.10.2016
Авторы: Лавров Мстислав Игоревич, Зефиров Николай Серафимович, Палюлин Владимир Александрович, Запольский Максим Эдуардович
Формула / Реферат
1. Соединение, представляющее собой трициклическое производное N,N'-замещенного 3,7-диазабицикло[3.3.1]нонана общей формулы (1) или его соль с фармакологически приемлемой кислотой
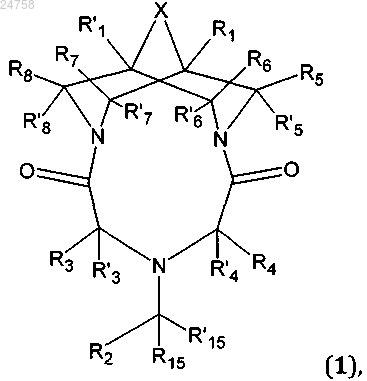
в которой
X представляет собой карбонильную группу или метиленовую группу;
R1 и R'1 могут быть одинаковыми или различными, и каждый независимо представляет собой H, C1-С6алкил или С1-С10алкокси;
R2 представляет собой фрагмент (1.1а), (1.2а), (1.3а) или (1.4а)
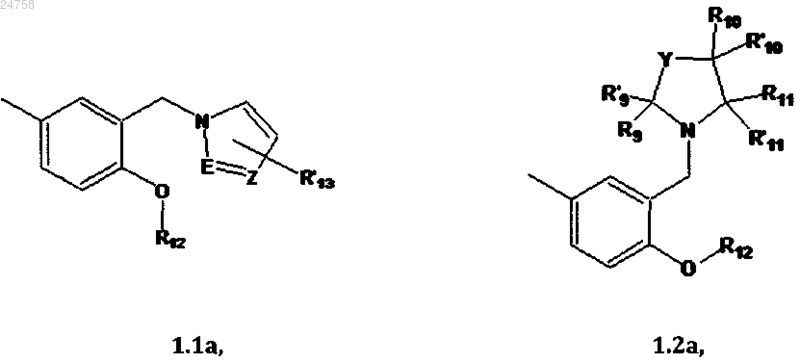
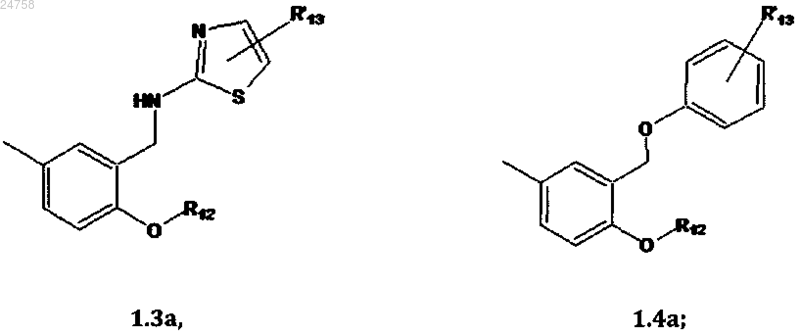
R3, R'3, R4, R'4, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R9, R'9, R10, R'10, R11, R'11, R15 и R'15 могут быть одинаковыми или различными и каждый независимо представляет собой H или С1-С6алкил;
R12 представляет собой C1-C6 алкил;
R'13 представляет собой H или С1-С6алкил, если R2 представляет собой 1.1а;
R'13 представляет собой H, если R2 представляет собой 1.2а или 1.3а;
R'13 представляет собой галоген, если R2 представляет собой 1.4а;
Z представляет собой N или CH;
E представляет собой N либо группу -C(R14)=;
R14 представляет собой H или C1-C6 алкил;
Y представляет собой -(CH2)2-;
или соединение 6-[4-метокси-3-(3,5-диметил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион или его соль с фармакологически приемлемой кислотой.
2. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7-диазабицикло[3.3.1]нонана общей формулы (1.1)
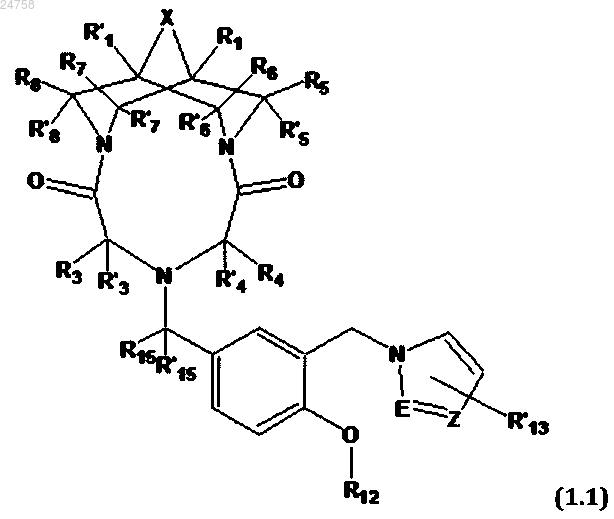
или его соль с фармакологически приемлемой кислотой, в которой
E, Z, R1, R'1, R3, R'3, R4, R'4, X, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R12, R'13, R15 и R'15 имеют значения, определенные в п.1.
3. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7-диазабицикло[3.3.1]нонана общей формулы (1.2)
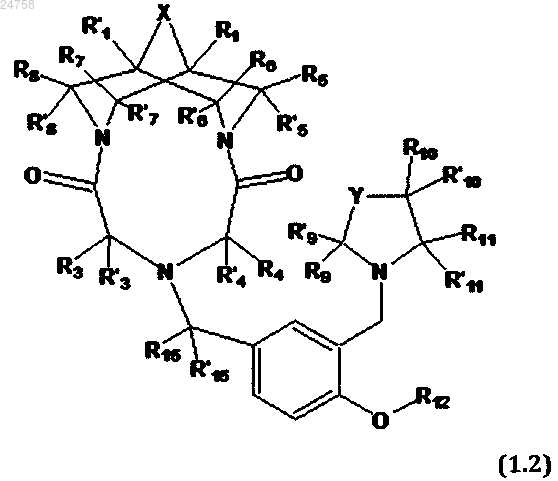
или его соль с фармакологически приемлемой кислотой, в которой
E, Z, R1, R'1 R3, R'3, R4, R'4, X, Y, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R9, R'9, R10, R'10, R11, R'11, R12, R15 и R'15 имеют значения, определенные в п.1.
4. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7-диазабицикло[3.3.1]нонана общей формулы [1.3]
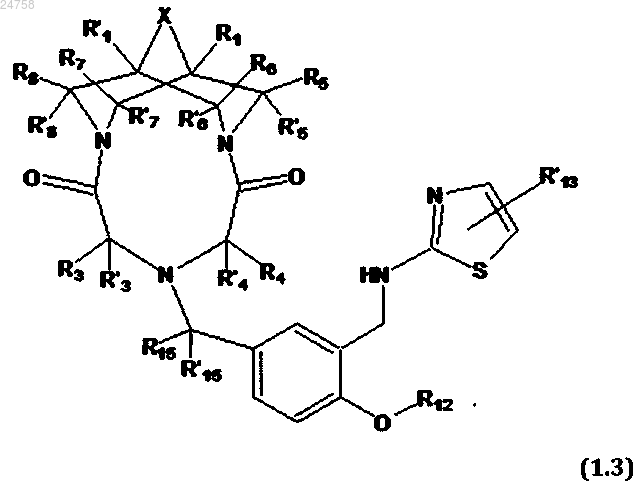
или его соль с фармакологически приемлемой кислотой, в которой
R1, R'1 R3, R'3, R4, R'4, X, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R12, R'13, R15 и R'15 имеют значения, определенные в п.1.
5. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7-диазабицикло[3.3.1]нонана общей формулы (1.4)
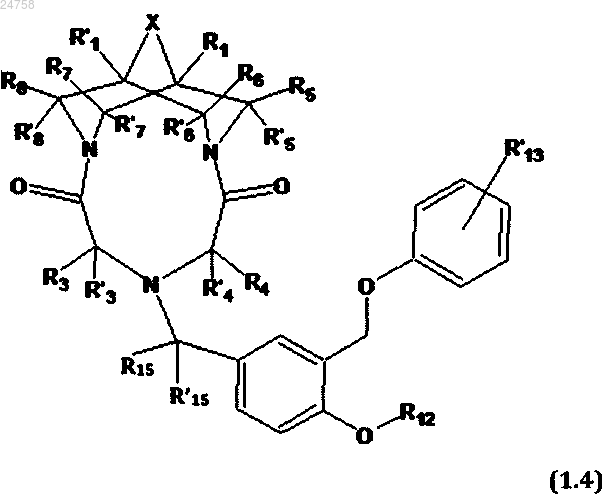
или его соль с фармакологически приемлемой кислотой, в которой
R1, R'1 R3, R'3, R4, R'4, X, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R12, R'13, R15 и R'15 имеют значения, определенные выше для формулы 1.
6. Соединение по п.1, представляющее собой
6-[4-метокси-3-(1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион,
6-[4-метокси-3-(3,5-диметил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион или
6-[4-метокси-3-(2-метил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион.
7. Соединение по п.3, представляющее собой 6-[4-метокси-3-(пиперидин-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион.
8. Соединение по п.4, представляющее собой 6-{4-метокси-3-[(1,3-тиазол-2-иламино)метил]бензил}-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион.
9. Соединение по п.5, представляющее собой 6-{3-[(2-фторфенокси]метил]-4-метоксибензил}-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион.
10. Применение соединения по любому из пп.1-9 в качестве аллостерического модулятора AMPA рецепторов для лечения заболеваний или расстройств, связанных с активностью AMPA рецепторов.
11. Применение по п.10, характеризующееся тем, что заболевание представляет собой нейродегенеративную патологию.
12. Применение по п.10, характеризующееся тем, что заболевание или расстройство представляет собой
когнитивные нарушения;
дефицитарные психические нарушения при функциональных психических расстройствах;
синдром дефицита внимания и гиперактивности (СДВГ);
проявления гиперсомнии и нарколепсии;
расстройства настроения.
13. Применение соединения по любому из пп.1-9 в качестве ноотропного средства.
Текст
ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ N,N'-ЗАМЕЩЕННЫХ 3,7 ДИАЗАБИЦИКЛО[3.3.1]НОНАНОВ И ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ИХ ОСНОВЕ Изобретение относится к новым трициклическим производным N,N'-замещенных 3,7 диазабицикло[3.3.1]нонанов формулы (1) где X - карбонильная или метиленовая группа; R2 представляет собой фрагмент (1.1 а), (1.2 а),(1.3 а) или (1.4 а), которые имеют значения, указанные в описании. R1, R'1 представляют собойH, C1-C6 алкил или C1-C10 алкокси; R3, R'3, R4, R'4, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R15 и R'15 представляют собой H или C1-C6 алкил. Соединения способны к аллостерической модуляции AMPA рецепторов, в частности, обладают ноотропным действием и могут быть использованы для лечения нейродегенеративных патологий.(71)(73) Заявитель и патентовладелец: ЗАПОЛЬСКИЙ МАКСИМ ЭДУАРДОВИЧ (RU) Область техники Данное изобретение относится в целом к новым производным N,N'-замещенных диазабициклононанов, потенциально способных к аллостерической модуляции AMPA (2-амино-3-(3-гидрокси-5 метилизоксазол-4-ил)пропионовая кислота) рецепторов. Более конкретно, настоящее изобретение относится к новым производным N,N'-замещенных 3,7-диазабицикло[3.3.1]нонанов, обладающим фармакологической активностью, и может быть использовано для лечения нейродегенеративных патологий. Также настоящее изобретение относится к лекарственным средствам, содержащим указанные соединения. Предшествующий уровень техники Глутаматергическая система, к которой относятся и AMPA рецепторы, является основной возбуждающей нейромедиаторной системой в мозге млекопитающих, в том числе и человека, и участвует в реализации целой серии физиологических и патологических процессов. Известно, что широкий круг психоневрологических заболеваний, таких как болезнь Паркинсона (БП), болезнь Альцгеймера (БА) и подобные им нейродегенеративные расстройства, связан с нарушением регуляции этих процессов [Doble A.AMPA рецепторы неравномерно распределены в головном мозге. Высокая концентрация этих рецепторов была обнаружена в поверхностных слоях новой коры (неокортексе) и в гиппокампе [Monaghan,Brain Res., 1984, V.324, pp.160-164]. Исследования на животных и человеке показали, что эти структуры в основном отвечают за сенсомоторные процессы и представляют собой матрицу для высокоповеденческих реакций. Таким образом за счет AMPA рецепторов осуществляется передача сигналов в нейросетях мозга, ответственных за совокупность когнитивных процессов. По причинам, изложенным выше, лекарства, усиливающие функционирование AMPA рецепторов,участвуют в регуляции процессов, формирующих память, а также процессов, отвечающих за восстановление нервных клеток. В экспериментах было показано [Arai, Brain Res., 1992, V.598, pp.173-14], что усиление функции AMPA-опосредованного синаптического ответа увеличивает индукцию долговременного потенцирования (LTP). Существует много доказательств того, что LTP, отражающее увеличение прочности синаптических контактов, которое обеспечивает постоянную физиологическую активность в мозге, является физиологической основой памяти и процессов обучения. Например, вещества, которые блокируют LTP, препятствуют механизмам запоминания у животных и людей [Cerro, Neuroscience, 1992,V.46, рр.1-6]. Вещества, которые усиливают функционирование AMPA рецепторов, содействуя индукцииLTP, могут положительно влиять на когнитивное функционирование [Granger, Synapse, 1993,V.15,pp.326-329; Arai, Brain Res., V.638, pp.343-346]. На данный момент известно много соединений, активирующих AMPA рецепторы. Примером может являться анирацетам [Ito, J. Physiol., 1990, V.424, рр.533-543]. Было показано, что анирацетам усиливает синаптический сигнал на нескольких сайтах гиппокампа, никак не действуя на NMDA-опосредованные сигналы [Staubli, 1990, Psychobiology, V.18, рр.377-381; Xiao, Hippocampus, 1991, V.1, pp.373-380]. К особенностям этого препарата относится то, что действие его кратковременно. При периферическом применении он превращается в анизоил-GABA (около 80% лекарства), который уже не имеет анирацетамподобных эффектов [Guenzi, J.Chromatogr., 1990, V.530, рр.397-406]. Клинический эффект анирацетама реализуется только при использовании его в больших концентрациях (0.1 мМ). Сравнительно недавно был открыт класс веществ, которые по своему физиологическому действию являются аллостерическими модуляторами AMPA рецепторов. Эти соединения более стабильны и более эффективны, чем известные ранее, как было показано в экспериментах [Staubli, PNAS, 1994,V.91: рр.11158-11162]. В связи с бурным развитием исследований, связанных с изучением фармакологического действия подобных соединений, недавно был установлен экспериментальный факт, что интенсивный ионный ток,который вызван действием таких аллостерических модуляторов на AMPA-рецепторы с последующей деполяризацией постсинаптической мембраны, запускает механизм экспрессии генов, отвечающих за синтез нейротропинов NGF (nerve growth factor) и BDNF (brain-derived neurotrophic factor) - факторов роста нервной ткани [Legutko В., Neuropharmacology, 2001, V.40, pp.1019-1027; Ebadi, NeurochemistryInternational, 2000, V.30, pp.347-374]. Процесс экспрессии генов, отвечающих за синтез нейротропина,имеет огромное значение при лечении нейродегенеративных расстройств и других психоневрологических заболеваниях. Так, в поведенческих моделях было показано [Siuciak, Brain Research,1994, V. 633, pp. 326-330], что BDNF имеет антидепрессивный эффект и уменьшает концентрацию глюкозы в крови у мышей, страдающих сахарным диабетом [Ono, J. Biochem. and Bioph. Res. Commun., 1997,Vol. 238, pp.633-637]. В отличие от известных стимуляторов (кофеин, метилфенидат (Ritalin) и амфетамин), ампакины не вызывают таких долгосрочных побочных эффектов, как бессонница, и активно исследуются как потенциальное лекарство от таких болезней мозга, как болезнь Альцгеймера, болезнь Паркинсона, шизофрения и другие неврологические и нейродегенеративные нарушения. Например, Broberg B.V. etc. (Psychopharmacology, 2004 Apr.24) установлено улучшение когнитивного статуса при шизофрении при использовании АМРАкина CX516, a Simmons D.D. etc. (Proc Natl Acad Sci USA, 2009 Mar 24; 106 (12): 4906-11) на животных моделях установил позитивное изменение когнитивного статуса при болезни Ган-1 024758Shimazaki Т. и другие (Eur J Pharmacol. 2007 Dec 1; 575 (1-3): 94-7) в эксперименте на взрослых крысах установили, что соединение CX546 в концентрации 0,3-3 мг/кг улучшает социальную память именно благодаря положительной стимуляции AMPA рецепторов. Соединение CX516 стало одним из немногих, которое было исследовано на больных людях в качестве дополнительной терапии к антипсихотикам при шизофрении [Goff D.C. etc., Neuropsychopharmacology 2008 Feb; 33 (3):456-72]. И хотя авторами не было отмечено значимого улучшения в общем состоянии больных или их когнитивном статусе по сравнению с плацебо, они уверены в необходимости продолжения поиска новых более селективных продуктов в этой категории. Раскрытие изобретения Задачей, на решение которой направлено предлагаемое изобретение, является расширение арсенала средств, которые могут быть использованы в качестве новых эффективных аллостерических модуляторов AMPA рецепторов. В результате проведенных исследований, направленных на поиск таких соединений, в том числе,запускающих механизм экспрессии генов, отвечающих за синтез нейротропинов - факторов роста нервной ткани, в частности, среди соединений, обладающих подобной активностью, изобретатели обнаружили широкую группу новых производных N,N'-замещенных 3,7-диазабицикло[3.3.1]нонанов в форме свободных оснований и солей с фармакологически приемлемыми кислотами, что в совокупности подробно охарактеризовано ниже и составляет один из аспектов настоящего изобретения. Техническим результатом настоящего изобретения является создание новых трициклических производных N,N'-замещенных 3,7-диазабицикло[3.3.1]нонанов, в том числе оснований и их солей с фармакологически приемлемыми кислотами, что в совокупности представлено общей формулой (1):X представляет карбонильную группу или метиленовую группу;R1 и R'1 могут быть одинаковыми или различными и каждый независимо представляет собой H,С 1-С 6 алкил или С 1-С 10 алкокси;R2 представляет собой фрагмент (1.1 а), (1.2 а), (1.3 а), (1.4 а):R3, R'3, R4, R'4, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R9, R'9, R10, R'10, R11, R'11, R15 и R'15 могут быть одинаковыми или различными и каждый независимо представляет собой H или C1-C6 алкил; триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион или его соль с фармакологически приемлемой кислотой. Под используемым здесь термином "галоген" имеется в виду фтор, хлор, бром или иод. Термин "алкокси" означает группу AlkO-. Примеры алкоксигрупп включают метокси, бутокси, изопропилокси и аналогичные группы. Термин "ацил" означает группу C(O)R (в которой R имеет значения H, алкил, арил, определенные выше). Примеры ацильных групп включают формильную, ацетильную, бензоильную, фенилацетильную и аналогичные группы. Термин "арил" означает незамещенную или замещенную фенильную или нафтильную группы. Заместителями фенильной группы могут быть галогены (например, фтор, хлор и аналогичные), низшие алкильные группы (например, метил, этил, изопропил и аналогичные), низшие алкоксигруппы (например, метокси, этокси, изопропокси и аналогичные). Заместителями нафтильной группы могут быть фтор,хлор, бром, метил и метоксигруппы. Термин "амино" означает группу NR'R" (в которой R' и R" могут быть одинаковыми или различными, и каждый независимо представляет H, алкил, циклоалкил, арил, определенные выше). Примеры амино-групп включают диизопропиламин, дифениламин, метилэтиламин и т.д. Термин "фармакологически приемлемые кислоты" охватывает все фармакологически приемлемые кислоты, как неорганические (например, соляную, серную, фосфорную и т.д.); так и органические (например, муравьиную, уксусную, щавелевую, лимонную, винную, малеиновую, янтарную, п-толуолсульфокислоту, метилсерную и т.д.). Предпочтительные варианты воплощения изобретения Среди соединений формулы (1), составляющих объект настоящего изобретения, предпочтительными являются следующие три группы соединений, который могут быть представлены формулами (1.1),(1.2), (1.3) и (1.4), приведенными ниже. В частности предпочтительными соединениями являются: 1.1. Производные N,N'-замещенные 3,7-диазабицикло[3.3.1]нонаны общей формулы (1.1):R12, R'13, R15 и R'15 имеют значения, определенные выше для формулы 1. Наиболее предпочтительным соединением формулы 1.1 (в виде фармакологически приемлемых солей и/или свободных оснований) является: 6-[4-метокси-3-(1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион,6-[4-метокси-3-(2-метил-1H-имидазол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Еще одним наиболее предпочтительным соединением является 6-[4-метокси-3-(3,5-диметил-1Hпиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Наиболее предпочтительным соединением формулы 1.2 (в виде фармакологически приемлемых солей и/или свободных оснований) является: 6-[4-метокси-3-(пиперидин-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Наиболее предпочтительным соединением формулы 1.3 (в виде фармакологически приемлемых солей и/или свободных оснований) является: 6-4-метокси-3-[(1,3-тиазол-2-иламино)метил]бензил-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1] тетрадекан-4,8,12-трион. Наиболее предпочтительным соединением формулы 1.4 (в виде фармакологически приемлемых солей и/или свободных оснований) является: 6-3-[(2-фторфенокси)метил]-4-метоксибензил-1,11-диметил-3,6,9-триазатри-цикло[7.3.1.1]тетрадекан-4,8,12-трион. Настоящее изобретение относится также к применению вышеуказанных соединений в качестве аллостерического модулятора AMPA рецепторов для лечения заболеваний или расстройств, связанных с активностью AMPA рецепторов. В частных вариантах воплощения изобретения заболевание представляет собой нейродегенеративную патологию. В других вариантах изобретения заболевание или расстройство представляет собой когнитивные нарушения, дефицитарные психические нарушения при функциональных психических расстройствах,синдром дефицита внимания и гиперактивности (СДВГ), проявления гиперсомнии и нарколепсии, расстройства настроения. Настоящее изобретение относится также к применению вышеуказанных соединений в качестве ноотропного средства. В том числе, соединения по изобретению могут быть использованы для усиления памяти и внимания, а также облегчения обучения у здоровых лиц в период повышенной нагрузки, или для профилактики вредного влияния на ЦНС в ходе хирургических вмешательств при наркозе или при нейрохирургических вмешательствах. Ниже изобретение описывается более подробно с помощью примеров получения конкретных соединений. Исходные реагенты, как и конечные продукты, получаются известными в литературе способами или являются промышленно доступными. Схема синтеза конечных соединений представлена ниже. Схема 1 Где R' представляет собой галоген, a R15 и R'15 имеют значения, определенные выше для формулы 1. Структуры полученных соединений подтверждались данными химического, спектрального анализов и других физико-химических характеристик. Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение. Пример 1. 6-[4-Метокси-3-(1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Белые кристаллы, выход: 88%. ПМР-спектр (CDCl3 , м.д.): 1.0 (с, 3H), 1.1 (с, 3H), 2.7 (д, J=13.3, 2H), 3.0 (д, J=13.3, 2H), 3.2 (д,J=14.1, 2H), 3.5 (с, 2H), 3.7 (д, J=14.1, 2H), 3.9 (с, 3H), 4.9 (м, 4H) 5.3 (с, 2H) 6.9-7.18 (м, 5H), 7.3 (д, J=8.4,1H), 7.45 (с, 1H), 7.53 (с, 1H). Пример 5. 6-[4-Метокси-3-(2-метил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Белые кристаллы, выход: 74%. ПМР-спектр (CDCl3 , м.д.): 1.0 (с, 3H), 1.1 (с, 3H), 2.45 (с, 3H), 2.7 (д, J=13.3, 2H), 3.0 (д, J=13.3,2H), 3.2 (д, J=14.1, 2H), 3.5 (с, 2H), 3.7 (д, J=14.1, 2H), 3.9 (с, 3H), 4.9 (м, 4H) 5.1 (с, 2H), 6.7 (с, 1H), 6.8 (с,1H), 6.95 (д, J=8.4, 1H), 7.0 (с, 1H), 7.2 (д, J=8.4, 1H). Пример 6. 6-4-Метокси-3-[(1,3-тиазол-2-иламино)метил]бензил-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. Белые кристаллы, выход: 75%. ПМР-спектр (CDCl3 , м.д.): 1.0 (с, 3H), 1.1 (с, 3H), 2.7 (д, J=13.3, 2H), 3.0 (д, J=13.3, 2H), 3.2 (д,J=14.1, 2H), 3.5 (с, 2H), 3.7 (д, J=14.1, 2H), 3.9 (с, 3H), 4.9 (м, 4H) 5.3 (с, 2H) 6.46 (д, J=3.2,1H), 6.8 (д,J=3.2,1H), 6.9 (д, J=8.4, 1H), 7.0 (с, 1H) 7.3 (д, J=8.4, 1H), 7.45 (с, 1H), 7.49 (с, 1H). Исследование влияния соединения общей формулы I на обучение в "слабой" модели пассивного избегания у цыплят. Методы. Для исследования действия соединения на память животных была использована методика однократного обучения пассивному избеганию цыплят (Gallus gallus domesticus) в возрасте 1-3 суток. Преимуществом модели является быстрое обучение, позволяющее точную фиксацию времени обучения и приводящее к формированию долговременной памяти. Неокостеневший череп цыплят позволяет вводить фармакологические препараты микрошприцем непосредственно в заданные структуры мозга, без операции и анестезии; используется также системное введение препаратов, которое облегчается незрелым гематоэнцефалическим барьером. Животные. В экспериментах были использованы цыплята (самцы) кросса "Птичное". Животные доставлялись с птицефабрики в день вылупления и содержались парами в пеналах размером 202520, с постоянным доступом к воде и корму, температуре 28C и световом цикле 12:12 ч. Минимальное время адаптации к обстановке перед началом эксперимента составляло два часа. Инъекции. Исследуемые соединения растворяли в физиологическом растворе и вводили животным в разное время до или после обучения. Внутричерепные инъекции выполнялись билатерально, микрошприцами ("Hamilton") объемом 10 мкл с помощью пластикового головодержателя и направлялись в область боковых желудочков мозга. Объем инъекций составлял 5 мкл на полушарие. После окончания эксперимента и декапитации животных проводился мониторинг поверхности черепа и мозга для контроля локализации инъекций. Для системного введения растворов использовались внутрибрюшинные инъекции в объеме 0.1 мл. Контрольные животные во всех экспериментах получали инъекции физиологического раствора в тех же объемах. Модель "слабого" обучения. Обучение цыплят в "слабой" модели пассивного избегания приводит к формированию избирательного избегания аверсивного объекта (бусинки), которое сохраняется на протяжении 6-12 ч после обучения; при тестировании через 24 ч у большинства обученных животных избегания не наблюдается. Эксперименты проводились по следующей схеме: за 20 мин до обучения проводили предобучение, состоящее из поочередного предъявления каждому животному двух нейтральных (смоченных водой) бусинок,закрепленных на стержне. Для последующего обучения использовали только тех цыплят, которые клевали каждую бусинку по крайней мере один раз в течение первых 10 с. Для обучения цыплятам предъявляли "аверсивную" бусинку, смоченную жгучим веществом (10%-ный раствор метилантранилата в этаноле). Цыплята, клюнувшие бусинку, демонстрировали типичную видоспецифическую аверсивную реакцию. Тестирование проводилось через 24 ч после обучения и состояло из 10-секундного предъявления такой же "аверсивной" бусинки как при обучении, но сухой, и затем - нейтральной бусинки. Избиратель-5 024758 ная реакция избегания "аверсивной" бусинки оценивалась как наличие долговременной памяти. Для оценки уровня памяти сравнивали процент животных, демонстрировавших реакцию избегания, в разных экспериментальных группах; статистическую достоверность различий оценивали с помощью непараметрического критерия 2. Результаты. 1. Внутримозговое введение экспериментального вещества за 5 мин до обучения (в боковые желудочки, 5 мкл на полушарие). Тест 24 ч. р .05; р .01; р .001 по сравнению с контролем (Saline). Результаты теста приведены на фиг. 1. 2. Внутримозговое введение экспериментального вещества за 30 мин до обучения (в боковые желудочки, 5 мкл на полушарие). Тест 24 ч. Достоверных различий между группами нет. Результаты - на фиг. 2. 3. Системное введение экспериментального вещества за 10 мин до обучения (внутрибрюшинно, 0.1 мл). Использованные дозы соответствуют диапазону 0,01-50 мкг на животное. Тест 24 ч. р .05; р .01 по сравнению с контролем (Saline). Результаты - на фиг. 3. 4. Системное введение 0,0025 мг/кг экспериментального вещества за 10 мин до обучения, через 5 мин или через 4 ч после обучения [внутрибрюшинно, 0,1 мл). Использованная доза соответствует 0,1 мкг на животное. Тест 24 ч. р .01; р .001 по сравнению с контролем. Результаты - на фиг. 4. 5. Пероральное введение экспериментального вещества за 10 мин до обучения (0,0025 мг/кг и 0,025 мг/кг, в объеме 0,1 мл; соответствует 0,1 и 1 мкг на животное). р .05 по сравнению с контролем. Результаты - на фиг. 5. Исследование влияния соединения общей формулы I на обучение в "слабой" модели условнорефлекторного замирания у мышей. Методы. Мышей линии С 57 В 1/6 помещали в камеру с электродным полом на 60 с, через 5 с после помещения на электродный пол подавали ток силой 0,16 мА, длительностью 2 с. Мышей тестировали через 24 ч,помещая в ту же камеру на три минуты. На графике показан процент времени тестирования, в течение которого животные были неподвижны (замирали). Это время является показателем того, что животные помнят данный контекст как опасный. Эксперимент 1. Мышей до эксперимента содержали по 5 в стандартных лабораторных клетках. Вещество общей формулы I вводили внутрибрюшинно (0,1 мл на 10 г веса) в дозе 2,5 мг/кг за 15 мин до обучения. В данной дозе экспериментальное вещество уменьшало процент замираний у обученных животных. Результаты - на фиг. 6. Эксперимент 2. Были использованы 22 мыши линии С 57 В 16. Мышей до эксперимента содержали по 5 в стандартных лабораторных клетках. Экспериментальное вещество вводили внутрибрюшинно (0,1 мл на 10 г веса) в дозе 0,0025 мг/кг и в дозе 0,025 мг/кг за 15 мин до обучения. Обучение и тестирование проводились так же, как в предыдущем эксперименте. Результаты - на фиг. 7. Резюме. 1. Системное (внутрибрюшинное) введение экспериментального вещества за 10-15 мин до "слабого" обучения в дозе 0.0025 мг/кг приводило к формированию устойчивой памяти у мышей и цыплят. При тестировании через 24 ч после обучения животные экспериментальной группы (введение экспериментального вещества) демонстрировали достоверно более высокий уровень воспроизведения навыка, чем животные контрольной группы. 2. Эффект усиления "слабой" памяти наблюдался у цыплят также при введении экспериментального вещества через 5 мин после обучения, но не через 4 ч после обучения, что предполагает действие препарата на клеточные процессы, протекающие в первые минуты после обучения. 3. Внутримозговое введение экспериментального вещества за 5 мин до обучения в дозах 0,1 и 1 мкг приводило к достоверно более высокому уровню воспроизведения навыка при тестировании через 24 ч . Введение препарата за 30 мин до обучения было неэффективным, что, возможно, связано с его быстрой метаболизацией. 4. Пероральное введение экспериментального вещества цыплятам за 10 мин до обучения в дозе 0,025 мг/кг приводило к достоверно более высокому уровню воспроизведения навыка при тестировании через 24 ч. 5. Внутрибрюшинное введение мышам экспериментального вещества в высокой дозе (2,5 мг/кг) не только не усиливало память, но и приводило к достоверному снижению уровня замирания в тесте. У цыплят также наблюдалась тенденция к снижению когнитивно-стимулирующего эффекта при использовании более высоких доз препарата (10 мкг при внутримозговом введении и 0,25-1,25 мг/кг при внутрибрюшинном). Таким образом, проведенные эксперименты позволяют сделать следующее заключение: Экспериментальное вещество оказывает когнитивно-стимулирующее действие в моделях "слабого" обучения у цыплят и мышей при введении непосредственно перед или сразу после обучения; способен усваиваться из желудочно-кишечного тракта и проходить гематоэнцефалический барьер; эффективен в низких дозах; при повышении дозы эффект снижается или инвертируется. Отчет по исследованию ноотропной активности соединений общей формулы I на модели амнезии,вызванной электрошоком с использованием условного рефлекса пассивного избегания. Методы исследования. Исследования проведены с использованием метода оценки выработки условного рефлекса пассивного избегания (УРПИ) на модели электрошоковой амнезии. У животных с выработанным рефлексом избегания моделировалась амнезия с помощью ЭСШ. Тестирование проводилось через 2 и 24 ч после обучения. Принципы используемых методов. УРПИ Исследования проводились на предварительно отобранных животных с развитым норковым рефлексом в условиях депривации пищи в течение 24 ч накануне исследования. Отбор животных для испытания осуществлялся в специальной камере, состоящей из темного и светлого отсеков. Животное помещалось в светлый отсек камеры и, подчиняясь норковому рефлексу, оно переходило в темный отсек. Продолжительность времени от момента помещения животного в камеру до перехода его в темный отсек (секунды) составляет латентный период реакции. В течение 120 с регистрировалось время пребывания животного отдельно в светлой и темной камерах. Обучение отобранных животных проводили в фиксированные интервалы времени, прошедшие после введения тестового материала. Для этого животное помещали в светлый отсек камеры и после перехода его в темный отсек наносили электроболевое раздражение через решетчатый металлический пол. Оценку обучения проводили через 2 и 24 ч после действия обучающего агента (электроболевой раздражитель) для оценки состояния кратковременной и долговременной памяти, соответственно. Для этого животное помещали в светлый отсек камеры и в течение 120 с регистрировали время пребывания животных в темном и светлом отсеках камеры, а также продолжительность латентного периода реакции и количество животных, не зашедших в темный отсек (обученные). Оценку результатов производили путем сравнения длительности латентного периода перехода в темный отсек камеры, количества животных, не зашедших в темный отсек (обученные экземпляры), а также времени пребывания в темном и светлом отсеках камеры в опыте (введен исследуемый напиток) и контроле (введен соответствующий раствор эталонного спирта). Обученные животные не должны заходить в предпочитаемый темный отсек или находиться там короткое время, поэтому уменьшение продолжительности латентного периода перехода, увеличение длительности пребывания в темной камере, само нахождение в темном отсеке свидетельствует о нарушении памяти и, следовательно, нарушении функционирования ЦНС [39]. Обработка результатов проводилась по методу Стьюдента. Достоверными считались результаты при P0,05. ЭСШ Амнезия у животных мыши создается нанесением непосредственно после выработки УРПИ ( в течение 10 с) электросудорожный шок (ЭСШ). ЭСШ наносится через электроды, наложенные на роговицу глаз (15-20 мА, 200-500 мс). Группы животных. 1-я серия опытов: 1-я группа - контроль 1 (интактные животные, подвергнутые обучению),2-я группа - контроль метода 2 (животным вводится физиологический раствор и наносится ЭСШ сразу после обучения),3-я группа - животным за 15 мин до обучения вводится препарат ампакин в дозе 0,025 мг/кг, после чего наносится ЭСШ,4-я группа - животным за 15 мин до обучения вводится препарат ампакин в дозе 0,0025 мг/кг, после чего наносится ЭСШ. Начальное (до нанесения ЭСШ) количество животных в группах-20. После нанесения ЭСШ - от 11 до 16. 2-я серия опытов: 1-я группа - контроль 1 (интактные животные, подвергнутые обучению),2-я группа - контроль метода 2 (животным вводится физиологический раствор и наносится ЭСШ сразу после обучения),3-я группа - животным за 15 мин до обучения вводится препарат Z-108a в дозе 0,025 мг/кг, после чего наносится ЭСШ,4-я группа - животным за 15 мин до обучения вводится препарат экспериментальное соединение в дозе 0,025 мг/кг, после чего наносится ЭСШ. Начальное (до нанесения ЭСШ) количество животных в группах-20. После нанесения ЭСШ - от 11 до 16. 3-я серия опытов: 1-я группа - контроль 1 (интактные животные, подвергнутые обучению),2-я группа - контроль метода 2 (животным вводится физиологический раствор и наносится ЭСШ сразу после обучения),3-я группа - животным за 15 мин до обучения вводится препарат ампакин в дозе 0,025 мг/кг,4-я группа - животным вводится препарат Z-108a в дозе 0,025 мг/кг, после чего наносится ЭСШ,5-я группа - животным за 15 мин до обучения вводится экспериментальное соединение в дозе 0,025 мг/кг, после чего наносится ЭСШ,6-я группа - животным вводится экспериментальное соединение в дозе 0,25 мг/кг. после чего наносится ЭСШ. Начальное (до нанесения ЭСШ) количество животных в группах - 10. После нанесения ЭСШ - 9-7. Исследуемые препараты вводились внутрибрюшинно. Результаты исследования Результаты представлены в табл. 1-3. Влияние ампакина на выполнение УРПИ на модели ЭСШ амнезии. Таблица 1 Данные табл. 1 свидетельствуют, во-первых, об адекватности модели создания амнезии путем нанесения ЭСШ, во-вторых - о наличии ноотропной активности экспериментальных соединений в дозе 0,25 мг/кг при тестировании через 2 ч после обучения, т.е. о позитивном влиянии на краткосрочную память. Влияние исследованных препаратов на выполнение УРПИ на модели ЭСШ амнезии представлено в табл. 2.P0,05 по сравнению с контролем 1P 0,05 по сравнению с контролем 2 Из данных таблицы следует, что оба исследованных препарата достоверно улучшают кратковременную память (через 2 ч после обучения), при тестировании через 24 ч количество обученных животных при введении этих препаратов увеличивается, но временные показатели практически не отличаются от контроля. Сделать выбор в пользу какого-то соединения не представляется возможным т.к. отсутствует достоверная разница между опытными группами. Влияние исследованных препаратов на выполнение УРПИ на модели ЭСШ амнезии. Таблица 3P0,05 по сравнению с контролем 2 Результаты, представленные в табл. 3, свидетельствуют, что экспериментальные соединения обладают ноотропным действием, которые проявляются через 2 и 24 ч, как по показателю количества обученных животных, так и по временным показателям пребывания в темной и светлой камерах. Наиболее активным на данной модели амнезии представляется экспериментальное соединение III, эффект которого стабилен в обеих сериях эксперимента, антиамнестический эффект регистрируется как по показателю числа обученных животных так и по временным показателям и проявляется как в отношении краткосрочной так и долговременной памяти. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представляющее собой трициклическое производное N,N'-замещенного 3,7 диазабицикло[3.3.1]нонана общей формулы (1) или его соль с фармакологически приемлемой кислотойX представляет собой карбонильную группу или метиленовую группу;R1 и R'1 могут быть одинаковыми или различными, и каждый независимо представляет собой H,C1-С 6 алкил или С 1-С 10 алкокси;R2 представляет собой фрагмент (1.1 а), (1.2 а), (1.3 а) или (1.4 а)R3, R'3, R4, R'4, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R9, R'9, R10, R'10, R11, R'11, R15 и R'15 могут быть одинаковыми или различными и каждый независимо представляет собой H или С 1-С 6 алкил;Y представляет собой -(CH2)2-; или соединение 6-[4-метокси-3-(3,5-диметил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9 триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион или его соль с фармакологически приемлемой кислотой. 2. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7 диазабицикло[3.3.1]нонана общей формулы (1.1) или его соль с фармакологически приемлемой кислотой, в которойE, Z, R1, R'1, R3, R'3, R4, R'4, X, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R12, R'13, R15 и R'15 имеют значения, определенные в п.1. 3. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7 диазабицикло[3.3.1]нонана общей формулы (1.2) или его соль с фармакологически приемлемой кислотой, в которойE, Z, R1, R'1 R3, R'3, R4, R'4, X, Y, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R9, R'9, R10, R'10, R11, R'11, R12, R15 и R'15 имеют значения, определенные в п.1. 4. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7 диазабицикло[3.3.1]нонана общей формулы [1.3] или его соль с фармакологически приемлемой кислотой, в которойR1, R'1 R3, R'3, R4, R'4, X, R5, R'5, R6, R'6, R7, R'7, R8, R'8, R12, R'13, R15 и R'15 имеют значения, определенные в п.1. 5. Соединение по п.1, представляющее собой трициклическое производное N,N'-замещенного 3,7 диазабицикло[3.3.1]нонана общей формулы (1.4) или его соль с фармакологически приемлемой кислотой, в которой ленные выше для формулы 1. 6. Соединение по п.1, представляющее собой 6-[4-метокси-3-(1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион,6-[4-метокси-3-(3,5-диметил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион или 6-[4-метокси-3-(2-метил-1H-пиразол-1-илметил)бензил]-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1] тетрадекан-4,8,12-трион. 7. Соединение по п.3, представляющее собой 6-[4-метокси-3-(пиперидин-1-илметил)бензил]-1,11 диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. 8. Соединение по п.4, представляющее собой 6-4-метокси-3-[(1,3-тиазол-2-иламино)метил]бензил-1,11-диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. 9. Соединение по п.5, представляющее собой 6-3-[(2-фторфенокси]метил]-4-метоксибензил-1,11 диметил-3,6,9-триазатрицикло[7.3.1.1]тетрадекан-4,8,12-трион. 10. Применение соединения по любому из пп.1-9 в качестве аллостерического модулятора AMPA рецепторов для лечения заболеваний или расстройств, связанных с активностью AMPA рецепторов. 11. Применение по п.10, характеризующееся тем, что заболевание представляет собой нейродегенеративную патологию. 12. Применение по п.10, характеризующееся тем, что заболевание или расстройство представляет собой когнитивные нарушения; дефицитарные психические нарушения при функциональных психических расстройствах; синдром дефицита внимания и гиперактивности (СДВГ); проявления гиперсомнии и нарколепсии; расстройства настроения. 13. Применение соединения по любому из пп.1-9 в качестве ноотропного средства.
МПК / Метки
МПК: C07D 487/18
Метки: производные, основе, 3,7-диазабицикло[3.3.1]нонанов, n,n'-замещенных, средства, лекарственные, трициклические
Код ссылки
<a href="https://eas.patents.su/14-24758-triciklicheskie-proizvodnye-nn-zameshhennyh-37-diazabiciklo331nonanov-i-lekarstvennye-sredstva-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические производные n,n’-замещенных 3,7-диазабицикло[3.3.1]нонанов и лекарственные средства на их основе</a>
Предыдущий патент: Способ очистки воды и аппарат для его осуществления
Следующий патент: Изображающий гиперспектрометр на основе дифракционной решетки с переменной высотой штрихов
Случайный патент: Предохранительное укупорочное устройство для бутылок и тому подобного, снабженное оптическим индикатором вскрытия












