Слитый белок из числа регуляторных/вспомогательных белков вич
Формула / Реферат
1. Слитый белок, включающий аминокислотную последовательность по меньшей мере четырех ВИЧ-белков, выбранных из Vif, Vpr, Vpu, Vpx, Rev, Tat и Nef, или производные аминокислотной последовательности одного или нескольких указанных белков, где данный слитый белок не процессируется до индивидуальных ВИЧ-белков, обладающих естественными N- и С-концами, и где производное аминокислотной последовательности ВИЧ-белка представляет собой аминокислотную последовательность, демонстрирующую по меньшей мере 50% гомологии при сравнении соответствующей части аминокислотной последовательности в слитом белке с аминокислотной последовательностью соответствующего ВИЧ-белка из известных ВИЧ-изолятов.
2. Слитый белок по п.1, где гомология составляет по меньшей мере 80%.
3. Слитый белок по п.1, где для получения ВИЧ-белка со сниженной активностью или вовсе неактивного не более 10 аминокислот делетируют, встраивают или замещают в производном аминокислотной последовательности по сравнению с аминокислотной последовательностью соответствующего ВИЧ-белка из известных ВИЧ-изолятов.
4. Слитый белок по любому из пп.1-3, где ВИЧ-белки выбраны из Vif, Vpr, Vpx, Vpu, Rev и Tat.
5. Слитый белок по любому из пп.1-4, включающий аминокислотную последовательность из числа ВИЧ-белков Vif, Vpr, Vpu, Rev и Tat, или производные аминокислотной последовательности одного или нескольких указанных белков.
6. Слитый белок по любому из пп.1-5, где аминокислотные последовательности по меньшей мере двух ВИЧ-белков сливают друг с другом без дополнительных аминокислот.
7. Слитый белок по любому из пп.1-6, где аминокислотные последовательности по меньшей мере двух ВИЧ-белков разделяют по меньшей мере одной дополнительной аминокислотой.
8. Слитый белок по любому из пп.1-7, где аминокислотную последовательность по меньшей мере одного из данных ВИЧ-белков сливают с партнером слияния, который не является ВИЧ-белком, выбранным из Vif, Vpr, Vpx, Vpu, Rev, Tat и Nef.
9. Нуклеиновая кислота, кодирующая слитый белок по любому из пп.1-8.
10. Нуклеиновая кислота по п.9, где данная нуклеиновая кислота представляет собой ДНК.
11. Нуклеиновая кислота по п.10, где экспрессия слитого белка из данной ДНК контролируется регуляторными элементами, выбранными из эукариотического, прокариотического и вирусного промоторов.
12. Нуклеиновая кислота по п.11, где вирусный промотор представляет собой поксвирусный промотор.
13. Нуклеиновая кислота по любому из пп.9-12, где данная нуклеиновая кислота дополнительно включает последовательность, кодирующую по меньшей мере один дополнительный ВИЧ-белок, выбранный из Gag, Pol и Env.
14. Нуклеиновая кислота по п.13, где данная нуклеиновая кислота включает кодирующую последовательность ВИЧ-белков Gag, Pol и Env.
15. Вектор, включающий нуклеиновую кислоту по любому из пп.9-14.
16. Вектор по п.15, где данный вектор представляет собой вирусный вектор.
17. Вектор по п.16, где данный вирусный вектор представляет собой поксвирусный вектор, в частности вектор вируса осповакцины.
18. Вектор по п.17, где вектор вируса осповакцины представляет собой модифицированный вирус осповакцины Ankara (MVA).
19. Вектор по п.18, где MVA выбран из MVA-57 5, депонированного в Европейской Коллекции Клеточных Культур Животных (ЕСАСС) с каталожным номером V00120707, и MVA-BN, депонированного в ЕСАСС под каталожным номером V00083008.
20. Способ получения белка по любому из пп.1-8, включающий стадии
- трансфицирования клетки-хозяина нуклеиновой кислотой по любому из пп.9-14 или вектором по п.15 либо
- инфицирования клетки-хозяина вирусным вектором по любому из пп.16-19,
экспрессирования слитого белка в трансфицированной клетке-хозяине или в инфицированной клетке-хозяине, а также
- извлечения данного слитого белка.
21. Клетка-хозяин, трансфицированная нуклеиновой кислотой по любому из пп.9-14 либо вектором по п.15 или инфицированная вирусным вектором по любому из пп.16-19.
22. Применение слитого белка по любому из пп.1-8 в качестве лекарственного средства.
23. Применение нуклеиновой кислоты по любому из пп.9-14 в качестве лекарственного средства.
24. Применение вектора по любому из пп.15-19 в качестве лекарственного средства.
25. Применение слитого белка по любому из пп.1-8 в качестве вакцины.
26. Применение нуклеиновой кислоты по любому из пп.9-14 в качестве вакцины.
27. Применение вектора по любому из пп.15-19 в качестве вакцины.
28. Вакцина, включающая слитый белок по любому из пп.1-8, нуклеиновую кислоту по любому из пп.9-14 либо вектор по любому из пп.15-19.
29. Применение слитого белка по любому из пп.1-8 для получения вакцины.
30. Применение нуклеиновой кислоты по любому из пп.9-14 для получения вакцины.
31. Применение вектора по любому из пп.15-19 для получения вакцины.
32. Способ защиты животного, в том числе и человека, против ВИЧ-инфекции путем введения животному, в том числе и человеку, нуждающихся в нем, слитого белка по любому из пп.1-8, нуклеиновой кислоты по любому из пп.9-14 либо вектора по любому из пп.15-19.
Текст
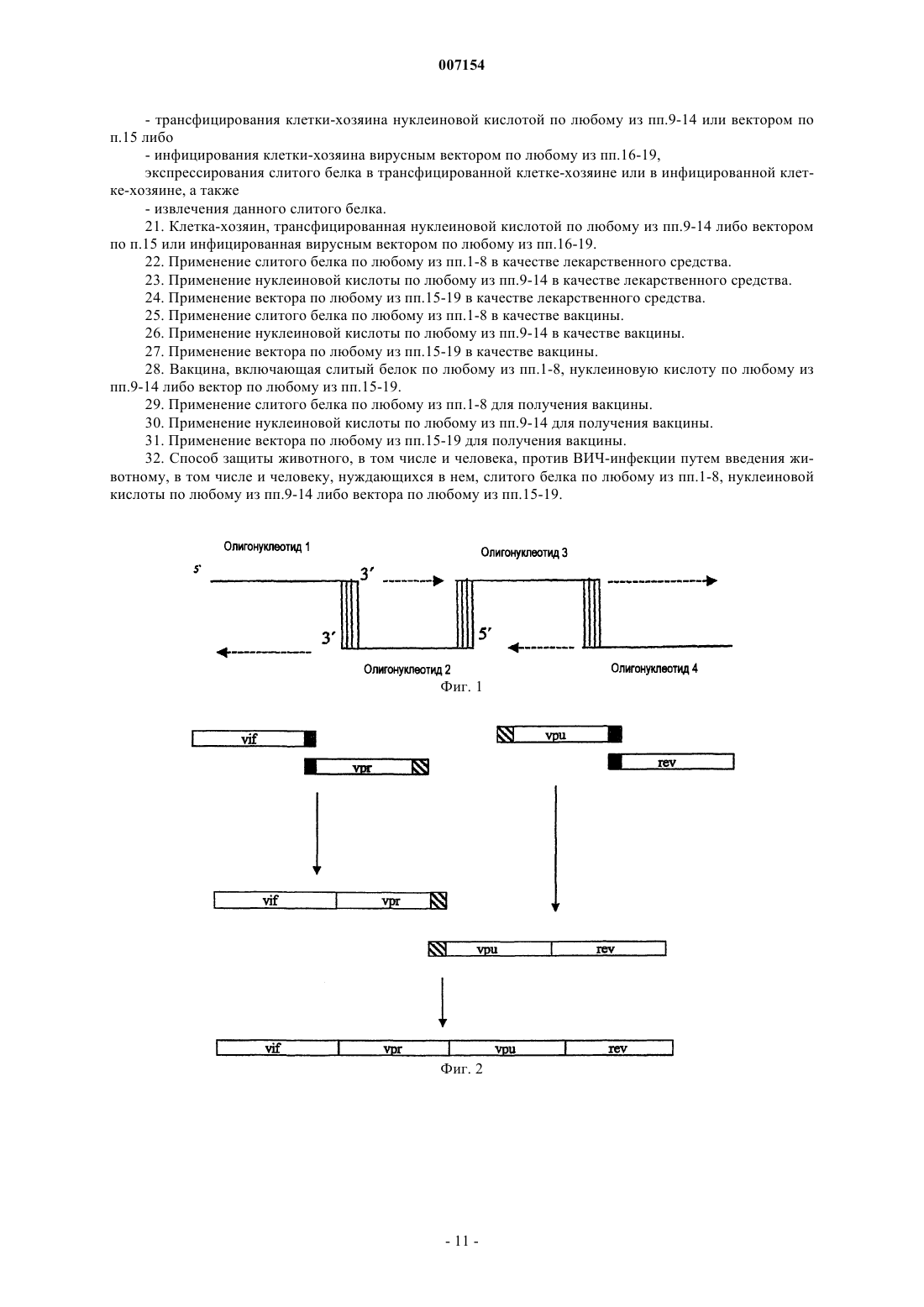
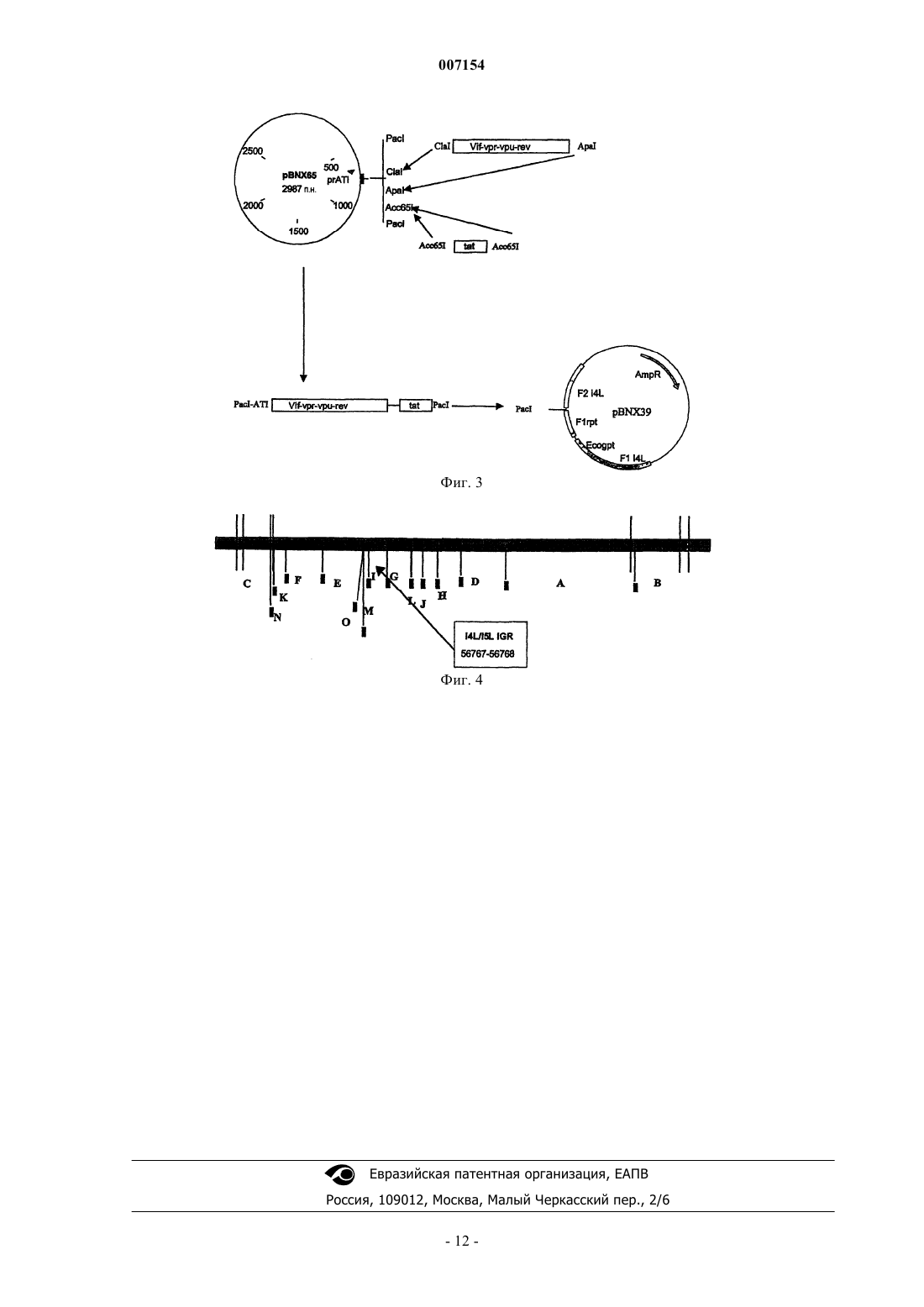
007154 Настоящее изобретение относится к слитым белкам, включающим аминокислотную последовательность по меньшей мере четырех белков ВИЧ, выбранных из Vif, Vpr, Vpu, Vpx, Rev, Tat и Nef, или производные данной аминокислотной последовательности одного или нескольких указанных белков, где данный слитый белок не процессируется до индивидуальных белков ВИЧ, обладающих природными Nи С-концами. Кроме того, настоящее изобретение относится к нуклеиновым кислотам, кодирующим указанные белки, векторам, включающим указанные нуклеиновые кислоты, и к способам получения указанных белков. Рассматриваемые слитый белок, нуклеиновые кислоты и векторы используют в качестве вакцин, по меньшей мере, для частичной профилактики ВИЧ-инфекций. Известный уровень техники Вирус иммунодефицита человека (ВИЧ) является причинным фактором синдрома приобретенного иммунодефицита (СПИД). Подобно всем ретравирусам геном данного вируса кодирует белки Gag, Pol иEnv. Кроме того, геном данного вируса кодирует дополнительные регуляторные белки, а именно Tat иRev, а также вспомогательные белки, а именно Vpr, Vpx, Vpu, Vif и Nef. Несмотря на усилия здравоохранения контролировать распространение эпидемии СПИДа, численность вновь зараженных людей, тем не менее, растет. К концу 2000 г. по оценке Всемирной Организации Здравоохранения эпидемия СПИДа во всем мире составила 36,1 млн инфицированных индивидов, что на 50% больше, чем предсказывалось на основе данных десять лет тому назад (WHOUNAIDS. UNAIDS,2000). В 2000 г. число новых зараженных ВИЧ-1 оценили в 5,3 млн человек. Из-за устойчивого распространения данной эпидемии сохраняется необходимость поставлять в клиники эффективную вакцину. В настоящее время создан ряд различных методик доставки вакцин против ВИЧ-1, таких как новые векторы или системы адъювантов, которые опробованы в разных доклинических условиях, а также в клинических испытаниях. Первая кандидатная вакцина, которая вошла в фазуIII клинического испытания, основана на оболочечном белке gр 120 в квасцах (Francis и соавт., AIDS Res.Hum. Retrovirus 1998; 14 (Suppl. 3)(5): S325-31). Фазу III испытаний начали, хотя более ранняя фаза II испытания оказалась не совсем удачной. После многих лет работы по получению профилактической вакцины, основанной на оболочечных антигенах, в последнее время усилия сосредоточили на использовании регуляторных белков, таких какTat, Nef и Rev, в качестве предполагаемых вакцинных антигенов. В течение нескольких лет данные регуляторные антигены используют в терапевтических учреждениях (Miller и соавт., Nature Medicine 1997, 3,389-94, Calarota и соавт., Lancet 1998, 351, 1320-5, Ayyavoo и соавт., AIDS, 2000, 14, 1-9). Совсем недавно использование данных антигенов в исследованиях по получению профилактической вакцины в немногочисленных доклинических испытаниях оказалось перспективным. Использование Tat и Rev, или одногоTat, в качестве предполагаемой профилактической вакцины, как показано, контролирует SIVmac(Osterhaus и соавт., Vaccine 1999, 17, 2713-4). Более того, имеются указания на то, что CTL, нацеленные на ранние вирусные регуляторные белки, существенны для устранения инфицированных клеток перед тем, как они образуют в большом количестве зрелые вирионы (van Baalen и соавт., J. Gen. Virol. 1997, 78,1913-8; Addo и соавт., PNAS, 2001, 98, 1781-6). Несмотря на то, что регуляторные/вспомогательные белки ВИЧ индуцируют эффективный иммунный ответ, большинство из них, если не все, обладают существенными побочными эффектами, которые в настоящее время ограничивают их использование в качестве вакцины: показано, что Nef, Tat и Vpu играют роль в снижении регуляции экспрессии CD4+ и/или МНС класс I (Howcroft и соавт., Science, 1993,260, 1320-2; Schwartz и соавт., Nature Med. 1996, 2, 338-342; Swann и соавт., Virology, 2001, 282, 267-77;Janvier и соавт., J. Virol., 2001, 78, 3971-6, Weissmann и соавт., PNAS 1998, 95, 11601-6). Известно, что Tat опосредует острую иммунную супрессию in vivo (Cohen и соавт., PNAS, 1999, 96, 10842-10847). Иммуносупрессивные эффекты описаны также для Vpr (Ayyavoo и соавт., Nature Med., 1997, 3: 1117-1123). Описано, что Vpr и Vpx обладают разными цитостатическим и цитотоксическим эффектами в дрожжевых клетках (Zhang и соавт., Virology, 1997, 230, 103-12). Таким образом, большинство, если не все,вспомогательные/регуляторные белки ВИЧ обладают, по-видимому, функциональными свойствами, нежелательными при создании вакцины. Попытки уменьшить вредное действие ВИЧ-белков описаны в WO 02/06303. В частности, в WO 02/06303 раскрыт слитый белок, включающий аминокислотные последовательности Vif, Vpu и Nef ВИЧ,где компонентные белки соединены с другим компонентным белком, или разделены некомпонентными белками, а именно аминокислотными последовательностями, которые составляют сайты протеолитического расщепления. Показано предпочтительное использование таких слитых белков, которые включают сайты протеолитического расщепления между данными компонентными белками. Поскольку компонентные белки разделены сайтами протеолитического расщепления, продуцируются нативные ВИЧбелки, которые, как известно, являются вредными. Для того чтобы уменьшить какое-либо повреждающее действие этих ВИЧ-белков, которые возникают из расщепляемого слитого белка из WO 02/06303, предполагается использование аттенуированных белков. Так, в WO 02/06303 указано использование слитого белка, включающего Vif, Vpr и Nef-белок ВИЧ, в котором сайты расщепления встроены между данными ВИЧ-белками и в котором данные ВИЧ-белки представляют собой аттенуированные белки. Однако недостаток аттенуированных белков заключается в том, что аминокислотная последовательность аттенуи-1 007154 рованного белка отличается от аминокислотной последовательности нативного белка, и поэтому иммунизация данным аттенуированным белком может привести к появлению иммунного ответа, который весьма слабо распознает нативный белок, либо вовсе не распознает нативный белок. Цель изобретения Цель настоящего изобретения заключается в создании вакцины, позволяющей генерировать эффективный иммунный ответ, в частности, эффективный цитотоксический ответ Т-клеток, против нескольких либо всех регуляторных/вспомогательных белков ВИЧ, где регуляторные/вспомогательные ВИЧ-белки в данной вакцине или продуцируемые данной вакциной являются менее функциональными, чем нативные индивидуальные регуляторные/вспомогательные белки, так что риск того, что вспомогательные/регуляторные белки в данной вакцине проявляют нежелательные побочные эффекты, уменьшается,и где менее активные ВИЧ-белки индуцируют сходный иммунный ответ по сравнению с нативными ВИЧ-белками. Подробное описание настоящего изобретения Данная цель достигается в результате получения слитого белка, включающего аминокислотную последовательность, по меньшей мере, четырех разных ВИЧ-белков, выбранных из Vif, Vpr, Vpu, Vpx, Rev,Tat и Nef, или производные данной аминокислотной последовательности одного или нескольких указанных белков, где данный слитый белок не процессируется до индивидуальных ВИЧ-белков, обладающих природными N- и С-концами. В частности, цель настоящего изобретения достигается с помощью нуклеиновых кислот и векторов, кодирующих указанные слитые белки. Если данный слитый белок продуцируется в животных клетках, в том числе и в клетках человека,то этот слитый белок не расщепляется клеточными протеазами так, что получаются вспомогательные/регуляторные белки с нативными N- и С-концами. Вследствие того факта, что ВИЧ-белок, который является частью слитого белка, обладает измененной вторичной/третичной структурой, сопоставимой с индивидуальным ВИЧ-белком, ВИЧ-белок в слитом белке является менее функциональным, если не полностью дисфункциональным, чем индивидуальный белок. Регуляторный/вспомогательный белок, который менее функционален или даже не функционален,вовсе не обладает нежелательными побочными эффектами ВИЧ-белка в его нативной конформации. Что касается иммуногенности, то нет существенной разницы при сравнении иммуногенности слитого белка с иммуногенностью индивидуальных регуляторных/вспомогательных ВИЧ-белков, которые образуют слитый белок. В частности, нет существенной разницы в отношении ответа цитотоксических Т-клеток(CTL), поскольку эпитопы, которые присутствуют в иммунной системе, идентичны. Такие же соображения применимы также к ситуации, когда слитый белок вводят пациенту. Применительно к настоящему изобретению термин "ВИЧ" относится к любой ВИЧ-группе, подтипу (кладе), штамму или изоляту, которые известны специалистам в данной области техники. В частности, ВИЧ может представлять собой ВИЧ-1 или ВИЧ-2. ВИЧ-1 классифицируют на девять подтипов(клады от А до I), а ВИЧ-2 классифицируют на пять подтипов (от А до Е), которые все находятся в рамках настоящего изобретения. В соответствии с настоящим изобретением наиболее предпочтительными кладами являются клады А, В и С ВИЧ-1. Однако настоящее изобретение не ограничивается этими наиболее предпочтительными кладами. Специалистам в данной области техники известны последовательности регуляторных белков ВИЧVif, Vpr, Vpu, Rev, Tat, Vpx и Nef. В качестве примера и без ограничения указанными вариантами осуществления настоящего изобретения даны ссылки на разные последовательности, которые раскрыты в базе данных банка генов, в частности, на последовательность изолята HXB2R ВИЧ-1, обладающего в банке генов каталожным номером К 03455. В данном банке генов указаны приведенные последовательности разных генов ВИЧ-1 и белков,кодируемых указанными генами. Предпочтительно ВИЧ-белки, которые образуют слитый белок, получают из одной и той же клады. В соответствии с альтернативным вариантом осуществления настоящего изобретения ВИЧ-белки, которые образуют слитый белок, получают из двух или нескольких клад. Возможно также, что один или несколько ВИЧ-белков, которые образуют слитый белок, представляют собой белки ВИЧ-1, и что один или несколько ВИЧ-белков, которые образуют слитый белок, представляют собой белки ВИЧ-2. Аминокислотные последовательности ВИЧ-белков, которые образуют слитый белок, предпочтительно представляют собой последовательности, которые кодируются известными ВИЧ-изолятами, то есть аминокислотная последовательность ВИЧ-белков в слитом белке идентична аминокислотным последовательностям соответствующих белков, которые кодируются естественно встречаемыми ВИЧизолятами. Альтернативно, аминокислотная последовательность одного или нескольких ВИЧ-белков в слитом белке может представлять собой консенсусную последовательность, то есть последовательность,которая как таковая не обнаружена в известном ВИЧ-изоляте, но которая в нескольких или во всех известных ВИЧ-изолятах проявляет оптимальную гомологию - в частности, относительно CTL-эпитопов. Компьютерные алгоритмы для вычисления консенсусной последовательности известны специалистам в данной области техники.-2 007154 В альтернативном варианте осуществления настоящего изобретения слитый белок может включать производные аминокислотной последовательности одного или нескольких ВИЧ-белков, которые являются частью слитого белка. Термин "производное аминокислотной последовательности ВИЧ-белка", используемый в настоящем изобретении, относится к ВИЧ-белкам, которые обладают измененной аминокислотной последовательностью по сравнению с соответствующим естественно встречаемым ВИЧбелком. Измененная аминокислотная последовательность может представлять собой последовательность, в которой одна или несколько аминокислот последовательности ВИЧ-белка замещены, встроены или делетированы. В частности, "производное аминокислотной последовательности ВИЧ-белка" представляет собой аминокислотную последовательность, демонстрирующую по меньшей мере 50% гомологии, более предпочтительно по меньшей мере 70%, еще более предпочтительно по меньшей мере 80%,наиболее предпочтительно по меньшей мере 90% гомологии при сравнении соответствующей части аминокислотной последовательности в слитом белке с аминокислотной последовательностью соответствующего ВИЧ-белка из известных ВИЧ-изолятов. Аминокислотную последовательность рассматривают как имеющую гомологию с вышеуказанной последовательностью даже в том случае, если гомология обнаруживается по соответствующему белку из одного лишь ВИЧ-изолята, независимо от того факта,что могут существовать соответствующие белки в других изолятах, которые имеют более низкую гомологию. В качестве примера, если Vpr-производное в слитом белке демонстрирует 95%-ю гомологию сVpr-последовательностью одного ВИЧ-изолята и только 50-70%-ю гомологию с (со всеми) другими ВИЧ-изолятами, то гомологию указанного Vpr-производного рассматривают как составляющую по меньшей мере 90%. Выше подчеркивалось, что данные ВИЧ-белки в слитом белке обладают сниженной активностью или даже вовсе не обладают активностью по сравнению с отдельными белками, поскольку конформация белков в слитом белке отличается от природной конформации биологически активных белков. Однако желательно еще больше снизить риск того, что ВИЧ-белки в слитом белке будут биологически активными. Для этой цели особенно предпочтительными "производными" индивидуального ВИЧ-белка, который является частью слитого белка, являются производные аминокислотной последовательности, в которых для получения ВИЧ-белка со сниженной активностью или вовсе неактивного несколько аминокислот делетируют, встраивают или замещают, более предпочтительно - не более 10 аминокислот, наиболее предпочтительно - не более 5 аминокислот. Специалистам в данной области техники известны тесты,чтобы определить, действительно ли ВИЧ-белок обладает сниженной биологической активностью. Молекулярный механизм действия Vif-белка, который существен для вирусной репликации in vivo,остается неизвестным, но Vif обладает большой способностью самосборки. Показано, что данная мультимеризация существенна для Vif-функции в жизненном цикле вируса (Yang S. и соавт., J. Biol. Chem. 2001; 276:4889-4893). Показано также, что vif специфически ассоциируется с вирусным нуклеопротеиновым комплексом, и данная ассоциация может быть функционально значимой (Khan М.А. и соавт., J.Virol. 2001; 75(16):7252-65). Поэтому vif-белок со сниженной активностью демонстрирует меньшую мультимеризацию и/или ассоциацию с нуклеопротеиновым комплексом. Указанный Vpr-белок играет существенную роль в жизненном цикле вируса. Vpr регулирует приток в ядро прединтеграционного вирусного комплекса и обеспечивает заражение неделящихся клеток, таких как макрофаги (Agostini и соавт., AIDS Res. Hum. Retrovirus 2002; 18 (4):283-8) . Кроме того, он обладает трансактивирующим действием, опосредованным взаимодействием с LTR (Vanitharani R. и соавт.,Virology 2001; 289(2):334-42). Таким образом, vpr со сниженной активностью демонстрирует сниженную,или даже не демонстрирует вообще трансактивацию и/или взаимодействие с прединтеграционным вирусным комплексом.Vpx, который имеет высокую гомологию с Vpr, также крайне необходим для эффективной вирусной репликации в неделящихся клетках. Vpx упакован в вирусные частицы в результате взаимодействия с доменом р 6 предшественника полипротеина gag. Подобно Vpr, Vpx участвует в переносе прединтеграционного вирусного комплекса в ядро (Mahalingam и соавт., J. Virol. 2001; 75 (1):362-74). Таким образом,Vpx со сниженной активностью обладает меньшей способностью связываться с прединтеграционным комплексом через gag-предшественник.Vpu известен в качестве белка, который взаимодействует с цитоплазматическим хвостом CD4 и вызывает деградацию CD4 (Bour и соавт., Virology 1995; 69(3):1510-20). По этой причине Vpu со сниженной активностью обладает уменьшенной способностью инициировать деградацию CD4. Релевантная биологическая активность хорошо охарактеризованного Tat-белка представляет собой трансактивацию транскрипции в результате взаимодействия с элементом ответа трансактивации (TAR). Было показано, что Tat обладает способностью повышенной трансактивации гетерологичных промоторов, не имеющих ВИЧ-последовательностей, кроме TAR (Han Р. и соавт., Nucleic Acid Res. 1991; 19(25):7225-9). Таким образом, tat-белок со сниженной активностью демонстрирует пониженную трансактивацию промоторов с помощью TAR-элемента.Nef-белок существен для вирусной репликации, ответственной за развитие заболевания, путем снижения CD4 на поверхности клетки (Lou Т. и соавт., J. Biomed Sci. 1997; 4 (4): 132). Это изменение инициируется прямым взаимодействием CD4 и Nef (Preusser А. и соавт., Biochem. Biophys. Res. Commun.-3 007154 2002; 292(3):734-40). Таким образом, Nef-белок со сниженной функцией демонстрирует уменьшенное взаимодействие с CD4. Релевантная функция Rev заключается в посттранскрипционной трансактивации, инициируемой взаимодействием с элементом Rev-ответа (RRE) вирусной РНК (Iwai и соавт., 1992; Nucleic Acids Res. 1992; 20(24):6465-72). Таким образом, Rev со сниженной активностью демонстрирует пониженное взаимодействие с RRE. В соответствии с настоящим изобретением слитые белки включают аминокислотную последовательность по меньшей мере четырех ВИЧ-белков, выбранных из Vif, Vpr, Vpu, Rev, Vpx, Tat и Nef. Слитый белок может предпочтительно включать 5, 6 или все указанные ВИЧ-белки. Порядок ВИЧ-белков в указанном слитом белке не существен. По меньшей мере один или несколько из четырех разных ВИЧ-белков можно включить в слитый белок в виде двух или нескольких копий. Таким образом, в качестве примера слитый белок в соответствии с настоящим изобретением может включать Vif, Vpr, Vpu и две копии Rev. Аминокислотные последовательности двух или нескольких копий ВИЧ-белка могут быть идентичными. Альтернативно, аминокислотная последовательность данных копий может быть разной, в частности, если используемые белковые последовательности являются производными разных ВИЧ-штаммов или клад (например, одна копия Rev из ВИЧ-1 и одна копия Rev из ВИЧ-2). Близлежащие ВИЧ-белки в слитом белке могут быть слиты без дополнительных аминокислот или слиты таким образом, что два соседних ВИЧ-белка в слитом белке разделены по меньшей мере одной дополнительной аминокислотой. Оба вида этих сочетаний также находятся в рамках настоящего изобретения. В качестве примера, в слитом белке в соответствии с настоящим изобретением, включающем аминокислотную последовательность из четырех ВИЧ-белков, два соседних ВИЧ-белка могут непосредственно соединяться друг с другом, а третий и четвертый ВИЧ-белки соединяются с помощью дополнительных аминокислот. Термин "дополнительная аминокислота" применительно к данному варианту осуществления настоящего изобретения относится к аминокислотам, которые не обнаруживаются в данном местоположении в естественно встречаемых ВИЧ-белках. Таким образом, слитый белок в соответствии с настоящим изобретением предпочтительно обладает нижеследующей общей формулой:+ Р 1 Р 2 Р 3 Р 4 Р 5 Р 6 Р 7 + где Р 1-Р 7 представляют собой разные белки, выбранные из Vif, Vpr, Vpx, Vpu, Tat, Rev и Nef, где слитый белок включает по меньшей мере четыре разных указанных ВИЧ-белка, а именно Р 1-Р 4, и необязательно один (Р 5), два (Р 5 Р 6) или три (Р 5 Р 6 Р 7) дополнительных из указанных ВИЧ-белков. Сокращение независимо означает 0-n дополнительных аминокислот. Когда символизирует 0 аминокислот, это означает, что соседние ВИЧ-белки непосредственно сливаются друг с другом без дополнительных аминокислот. Когда сокращение символизирует 1-n аминокислот, то это означает, что соседние ВИЧ-белки отделены одной или n аминокислотами. Верхний предел дополнительных аминокислот, то есть целое число n, зависит от максимального размера слитого белка, который могут произвести или экспрессировать в клетках. В соответствии с одним из вариантов осуществления настоящего изобретения все символизируют независимо 0-20, более предпочтительно 0-10, еще более предпочтительно 0-5 дополнительных аминокислот. В соответствии с альтернативным вариантом осуществления настоящего изобретения по меньшей мере одно из символизирует аминокислотную последовательность дополнительного белка или его части, который не представляет собой ВИЧ-белок, выбранный из Vif, Vpr, Vpx, Vpu, Rev, Tat иNef. Таким образом, в соответствии с альтернативным вариантом осуществления настоящего изобретения дополнительный белок фланкирован регуляторными/вспомогательными ВИЧ-белками. Дополнительный белок может представлять собой любой белок. Более предпочтительно дополнительный белок включает дополнительные эпитопы, которые могут помочь индуцировать лучший иммунный ответ против ВИЧ. Так, дополнительный белок может представлять собой Env-, Gag- и/или Pol-белок ВИЧ или их части. В этой связи термин "часть" Env, Gag и Pol относится к аминокислотному отрезку, полученному от одного из указанных белков, который включает по меньшей мере один эпитоп. Более предпочтительно термин "часть" относится по меньшей мере к 10, еще более предпочтительно по меньшей мере к 20,наиболее предпочтительно по меньшей мере к 50 аминокислотам одного из указанных белков. В соответствии с близким вариантом осуществления настоящего изобретения по меньшей мере одно из значений символизирует аминокислотную последовательность одного или нескольких белков Р 1-Р 7, которые являются частью слитого белка. Таким образом, в данном случае слитый белок может включать одну или несколько копий одного или нескольких белков, которые представляют собой часть слитого белка. Как указывается, копии белков могут обладать или могут не обладать идентичной аминокислотной последовательностью. В вышеприведенной формуле сокращение "+" независимо символизирует 0-n дополнительной концевой аминокислоты. Таким образом, слитый белок, в соответствии с настоящим изобретением, может включать или может не включать дополнительные аминокислоты на С- и/или N-конце данного белка. В соответствии с одним из вариантов осуществления настоящего изобретения по меньшей мере одно "+"-4 007154 символизирует аминокислотную последовательность дополнительного белка или его части, который не является ВИЧ-белком, выбранным из Vif, Vpr, Vpx, Vpu, Rev, Tat и Nef. Таким образом, в соответствии с этим вариантом осуществления настоящего изобретения слитый белок включает на своем С- и/или Nконце дополнительный белок, который не представляет собой Vif, Vpr, Vpx, Vpu, Rev, Tat или Nef. Дополнительный белок может представлять собой любой белок. Более предпочтительно дополнительный белок включает дополнительные эпитопы, которые могут помочь индуцировать лучший иммунный ответ против ВИЧ. Например, дополнительный белок может представлять собой Env-, Gag- и/или Pol-белок ВИЧ либо его частей. В этой связи, термин "часть" Env, Gag и Pol относится к аминокислотному отрезку,полученному от одного из указанных белков, который включает по меньшей мере один эпитоп. Более предпочтительно термин "часть" частично относится по меньшей мере к 10, еще более предпочтительно по меньшей мере к 20, наиболее предпочтительно по меньшей мере к 50 аминокислотам одного из указанных белков. В соответствии с альтернативным вариантом осуществления настоящего изобретения по меньшей мере одно "+" символизирует аминокислотную последовательность, которая позволяет легко детектировать или выделять очисткой слитый белок. Таким образом, по меньшей мере одно "+" может, например,представлять собой метку, такую как His-метка. В соответствии с настоящим изобретением слитый белок не процессируется до индивидуальных ВИЧ-белков, обладающих природными N- и С-концами. В частности, слитый белок, в соответствии с настоящим изобретением, не процессируется до индивидуальных ВИЧ-белков, обладающих природнымиN- и С-концами, при экспрессии в клетках человека. Специалистам в данной области известны способы,каким образом проконтролировать, действительно ли слитый белок при экспрессии в клетках человека процессируется до индивидуальных ВИЧ-белков, обладающих природными N- и С-концами. В этой связи отсылаем к Ayyavoo и соавт., AIDS 2000, 14, 1-9, в частности, к эксперименту, раскрытому на фиг. 2 указанной публикации. Вкратце, специалисты в данной области могут легко экспрессировать соответствующий слитый белок в клетках человека, таких как клетки HeLa; затем эти клетки лизируют и полученные клеточные лизаты подвергают Вестерн-блотированию или иммунопреципитации антителами, специфичными к отдельным ВИЧ-белкам, которые совместно образуют соответствующий слитый белок ВИЧ. Что касается слитого белка настоящего изобретения, детектируется незначительное количество ВИЧ-белков, размер которых соответствует размеру индивидуального регуляторного/вспомогательного ВИЧ-белка. Для того чтобы гарантировать, что слитый белок настоящего изобретения не преобразуется в индивидуальные ВИЧ-белки, обладающие естественными N- и С-концами, данный слитый белок не должен содержать специфических последовательностей, расщепляющихся клеточными протеазами, которые могут запустить образование ВИЧ-белков, обладающих естественными N- и С-концами, между аминокислотными последовательностями ВИЧ-белков, которые образуют данный слитый белок. Таким образом,аминокислотная последовательность , в виде сокращения в вышеуказанной общей формуле, не содержит специфических расщепляющихся последовательностей для клеточных протеаз, которые могут запустить образование ВИЧ-белков, обладающих естественными N- и С-концами. В частности, данный слитый белок не содержит расщепляющейся последовательности REKRAVVG (однобуквенный аминокислотный код) между аминокислотными последовательностями разных ВИЧ-белков, которые образуют данный слитый белок. Кроме того, последовательности, расщепляющиеся клеточными протеазами, известны специалистам в данной области техники. Поэтому специалисты в данной области техники могут легко исключить включение последовательностей, расщепляющихся (клеточными) протеазами, что могло бы дать индивидуальные ВИЧ-белки, обладающие естественными N- и С-концами. Примером такой расщепляющейся последовательности является Ile/leu-X-Thr-X-Gly. Белки настоящего изобретения не включают специфичных расщепляющихся последовательностей, дающих ВИЧ-белки, обладающие обоими нативными N- и С-концами. Однако это, как правило, не исключает присутствия сайтов расщепления для клеточных протеаз между белками в слитом белке, при условии, что эти расщепляющиеся сайты не опосредуют образование ВИЧ-белков, обладающих обоими нативными N- и С-концами. В частности,аминокислотная последовательность , в виде сокращения в вышеуказанной общей формуле, может включать сайты расщепления для определенных протеаз, которые участвуют в образовании коротких пептидов, представленных в MHCI или MHCII. В соответствии с данным вариантом осуществления настоящего изобретения результат такой реакции расщепления представляет собой короткий пептид длиной предпочтительно менее 20 аминокислот, N- или С-конец которого могут соответствовать N- или Сконцу одного из вспомогательных/регуляторных ВИЧ-белков. Однако эти короткие пептиды, образуемые в процессе презентации антигенов, не обладают какой-либо активностью ВИЧ-белка, от которого они произошли. Кроме того, настоящее изобретение относится к нуклеиновым кислотам, кодирующим вышеуказанные слитые белки настоящего изобретения. Нуклеиновая кислота может представлять собой ДНК или РНК. Предпочтительно нуклеиновая кислота представляет собой ДНК, если предполагается встроить данную нуклеиновую кислоту в клетки человека путем использования ДНК-вектора, такого как плазмида, или вектора, основанного на вирусной ДНК.-5 007154 Специалистам в данной области техники известны способы конструирования нуклеиновой кислоты,кодирующей слитый белок настоящего изобретения. Не ограничиваясь нижеследующими способами,специалисты в данной области техники могут начинать с геномного ВИЧ-клона, с субгеномного ВИЧклона или с любого исходного материала, такого как плазмиды, включающего кодирующую последовательность одного или нескольких регуляторных/вспомогательных ВИЧ-белков. Когда такая кодирующая последовательность регуляторного/вспомогательного белка представлена в виде сплошной рамки считывания, указанную кодирующую последовательность можно извлечь путем расщепления нуклеиновой кислоты, включающей указанную кодирующую последовательность, с помощью соответствующих ферментов рестрикции. Полученные таким образом ДНК-фрагменты можно использовать для последующего клонирования. Альтернативно кодирующие последовательности вспомогательного/регуляторного белка можно получить методами полимеразной цепной реакции с соответствующими праймерами. Если регуляторные/вспомогательные белки кодируются более чем одним экзоном, как в случае, например, Tat иRev, может понадобиться независимое клонирование разных экзонов и сливание их для получения непрерывной рамки считывания для определенного регуляторного/вспомогательного белка или для использования метода обратной транскрипции, такого как RT-ПЦР. Кодирующую последовательность можно также создать с помощью генного синтеза, то есть путем создания гена с использованием набора комплементарных и/или перекрывающихся олигонуклеотидов. Для того чтобы получить слитый белок, нуклеиновая кислота, кодирующая указанный слитый белок, предпочтительно содержит непрерывную рамку считывания. Следовательно, стоп-кодоны, все, кроме последней последовательности, кодирующие ВИЧ-белки или дополнительные белки, видоизменяются в кодон, кодирующий аминокислоту, или полностью делетируются. Предпочтительно, это можно легко осуществить при использовании специфичных праймеров для ПЦР, которые амплифицируют данную кодирующую последовательность без стоп-кодона. Иными словами, в соответствии с данной альтернативой обратный праймер не должен быть комплементарен стоп-кодону. Поэтому данный амплифицируемый ДНК-фрагмент не содержит стоп-кодона и может быть клонирован в клонирующий вектор. Альтернативно представляется возможным также клонировать кодирующую последовательность с ее стопкодоном в клонирующий вектор. Позднее можно удалить этот стоп-кодон, например, путем использования специфичной эндонуклеазы, либо путем мутагенеза. Результатом осуществления стадий клонирования должна явиться непрерывная рамка считывания,кодирующая слитый белок настоящего изобретения. Регуляторные элементы, которые необходимы для получения экспрессии слитого белка, могут представлять собой любые регуляторные элементы, которые управляют экспрессией в требуемой экспрессионной системе. Если предполагается получить слитый белок в прокариотических клетках, таких как Escherichia coli, предпочтительно использовать бактериальный или фаговый промотор. Если предполагается экспрессировать слитый белок в эукариотических клетках, предпочтительно использовать эукариотический или вирусный промотор/энхансер. Если предполагается экспрессировать слитый белок путем использования поксвирусного промотора (см. ниже), предпочтительно использовать поксвирусный промотор, такой как 7,5-промотор или ATI-промотор. Как указано выше, слитый белок может включать партнеров слияния, которые не представляют собой ВИЧ-белки, выбранные из Vif, Vpr, Vpx, Vpu, Tat, Rev и Nef. Поэтому слитый белок может включать аминокислотную последовательность иных белков или их частей. Примерами иных белков являются такие ВИЧ-белки как Gag, Pol и Env. Следовательно, нуклеиновая кислота настоящего изобретения может включать также кодирующие последовательности одного или нескольких дополнительных белков или их частей в открытой рамке считывания, кодирующей по меньшей мере четыре регуляторные/вспомогательные ВИЧ-белки или их производные. В дополнительном варианте осуществления настоящего изобретения нуклеиновая кислота может также включать независимые экспрессионные кассеты, кодирующие дополнительные белки, которые,кроме того, могут помочь улучшить иммунный ответ против ВИЧ. В предпочтительном варианте осуществления настоящего изобретения нуклеиновая кислота может также включать экспрессионные кассеты,включающие кодирующую последовательность по меньшей мере одного дополнительного ВИЧ-белка,выбранного из Gag, Pol и Env или их частей. Еще более предпочтительно, если данная нуклеиновая кислота может включать, помимо кодирующей последовательности слитого белка, кодирующие последовательности всех ВИЧ-белков Gag, Pol и Env. Нуклеиновая кислота является предпочтительно частью вектора. Нуклеиновая кислота может представлять также вирусный геном или его часть в вирусном векторе,предпочтительно поксвирусном векторе, таком как MVA. Поэтому представляется возможным экспрессировать из указанного поксвирусного вектора слитый белок, а также дополнительные ВИЧ-белки, к примеру, по меньшей мере один дополнительный ВИЧ-белок, выбранный из Gag, Pol и Env. Кроме того, настоящее изобретение относится к векторам, включающим нуклеиновую кислоту настоящего изобретения. Термин "вектор" относится к любым векторам, известным специалистам в данной области техники. Вектор может представлять собой плазмидный вектор, такой как pBR322 или вектор из группы pUC. Более предпочтительно данный вектор представляет собой вирусный вектор. В связи с настоящим изобретением термин "вектор на основе вируса" или "вирусный вектор" относится к инфекци-6 007154 онному и/или аттенуированному вирусу, включающему вирусный геном. В этом случае нуклеиновая кислота настоящего изобретения является частью вирусного генома соответствующего вирусного вектора и/или составляющих вирусного генома. Рекомбинантные векторы можно использовать для инфицирования клеток и клеточных линий, в частности, для инфицирования живых животных, в том числе, и людей. Типичными вирусными векторами для настоящего изобретения являются аденовирусные векторы,ретровирусные векторы или векторы на основе аденоассоциированного вируса 2 (AAV2). Наиболее предпочтительными являются поксвирусные векторы. Этот поксвирус может представлять собой предпочтительно поксвирус канареек, поксвирус дичи или вирус осповакцины. Более предпочтительным является модифицированный вирус осповакцины Ankara (MVA) (Sutter G. и соавт. [1994], Vaccine 12: 103240). Типичный MVA-штамм представляет собой MVA 575, который депонирован в Европейской Коллекции Клеточных Культур Животных с каталожным номером ЕСАСС V00120707. Наиболее предпочтительным является MVA-BN или его производное, который был описан в РСТ-заявке РСТ/ЕР 01/13628,поданной в Европейское Патентное Ведомство 22 ноября 2001 г. с названием "Модифицированный вариант вируса осповакцины Ankara". MVA-BN депонирован в Европейской Коллекции Клеточных Культур Животных с каталожным номером ЕСАСС V00083008. С использованием MVA-BN или его производного можно решать дополнительную техническую проблему по созданию исключительно безопасной вирусной вакцины против ВИЧ, так как вирусный вектор MVA-BN является чрезвычайно аттенуированным вирусом, который получают из модифицированного вируса осповакцины Ankara, и который характеризуется утраченной способностью репродуктивно реплицироваться в клетках человека. Вследствие отсутствия репликации у людей MVA-BN является самым безопасным по сравнению с другими известными штаммами вируса коровьей осповакцины. В предпочтительном варианте осуществления настоящее изобретение относится к вирусному вектору, содержащему ДНК MVA-BN настоящего изобретения и производных MVA-BN. Признаки MVA-BN, описание биологических испытаний, позволяющих оценить,действительно ли MVA представляет собой MVA-BN или его производное и способы получения MVABN или его производного, раскрыты в вышеуказанной РСТ-заявке РСТ/ЕР 01/13628, которая включена здесь путем ссылки. Таким образом, в соответствии с этими вариантами осуществления, настоящее изобретение относится предпочтительно к рекомбинантному MVA, такому как MVA-BN, включающему в своем геноме экспрессионную кассету, кодирующую слитый белок настоящего изобретения. Способы встраивания нуклеиновой кислоты настоящего изобретения в вирусный геном и способы получения рекомбинантных вирусов известны специалистам в данной области техники. В рекомбинантном вирусе осповакцины экспрессия ДНК в соответствии с настоящим изобретением предпочтительна, но не исключительна, под транскрипционным контролем поксвирусного промотора,более предпочтительно под промотором вируса осповакцины. Встраивание ДНК настоящего изобретения в несущественную область генома данного вируса является предпочтительным. В другом предпочтительном варианте осуществления настоящего изобретения гетерологичную последовательность нуклеиновой кислоты встраивают в естественно встречаемый делеционный сайт генома поксвируса (описанного в РСТ/ЕР 96/02926). Однако природа сайта встраивания не является для настоящего изобретения решающей до тех пор, пока получают рекомбинантный вирус осповакцины. Поэтому специалисты в данной области техники могут легко предусмотреть дополнительные подходящие сайты встраивания. Предпочтительно, вирусный вектор, в частности поксвирусный вектор, может включать, помимо кодирующей последовательности слитого белка настоящего изобретения, дополнительные ретровирусные гены, выбранные из ВИЧ-генов Gag, Pol и Env генома данного вируса. Более предпочтительно, вирусный вектор, в частности поксвирусный вектор, может включать, помимо кодирующей последовательности слитого белка настоящего изобретения, все ВИЧ-гены, кодирующие Gag, Pol и Env. Эти дополнительные гены можно встраивать вместе с той же самой нуклеиновой кислотой настоящего изобретения. В соответствии с данным вариантом осуществления настоящего изобретения, все ВИЧ-гены должны быть расположены в одном и том же сайте встраивания генома вируса. В альтернативном варианте осуществления настоящего изобретения все дополнительные гены встраивают в разные места генома вируса. В предпочтительном варианте осуществления настоящего изобретения настоящее изобретение относится к нуклеиновой кислоте, вектору или слитому белку настоящего изобретения, в качестве вакцины, по меньшей мере, для частичной профилактики против ВИЧ-инфекций и СПИДа. "Вакцина" представляет собой соединение, то есть нуклеиновую кислоту, слитый белок, вектор или вирус, которое стимулирует специфичный иммунный ответ. В соответствии с одной из альтернатив данного варианта осуществления настоящего изобретения"вакцина", в соответствии с настоящим изобретением, основывается на слитом белке настоящего изобретения. В предпочтительном варианте осуществления настоящего изобретения нуклеиновую кислоту настоящего изобретения, в частности ДНК, используют в качестве вакцины. Специалистам в данной области известно, что введение "голой" ДНК, содержащейся в эукариотической экспрессионной кассете, как в настоящем изобретении, в частности, внутримышечная инъекция ДНК, приводит к экспрессии белка,-7 007154 кодируемого данной экспрессионной кассетой. Экспрессируемый белок экспонируется в иммунной системе и индуцируется специфический иммунный ответ. В альтернативном варианте осуществления настоящего изобретения вакцинацию осуществляют путем введения вектора, в соответствии с настоящим изобретением, в частности вирусного вектора, более предпочтительно поксвирусного вектора, наиболее предпочтительно вектора вируса осповакцины, например MVA-вектора. Для получения вакцины на основе вируса осповакцины, вирус в соответствии с настоящим изобретением преобразуют в физиологически приемлемую форму. Это можно осуществить, исходя из опыта получения поксвирусных вакцин, используемых для вакцинации против натуральной оспы (как описано у Stickl H. и соавт. [1974] Dtsch. med. Wschr. 99, 2386-2392). Например, выделенный очисткой вирус хранят при -80 С с титром 5x108 TCID50/мл помещенного в около 10 мМ Tris, 140 мМ NaCl pH 7,4. Для получения вакцинных доз, например, 102-108 частиц вируса лиофилизируют в 100 мл фосфатно-солевого буфера (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно в стеклянной ампуле. Или же, вакцинные дозы можно получить путем ступенчатой лиофилизации вируса в композиции. Данная композиция может содержать дополнительные добавки, такие как манит, декстран, сахарозу, глицин, лактозу или поливинилпирролидон, или другие добавки, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, альбумин сыворотки человека),пригодные для введения in vivo. Стеклянную ампулу с лиофилизованным содержимым затем запаивают,и ее можно хранить в течение нескольких месяцев при температуре между 4 С и комнатной температурой. Однако при отсутствии необходимости использовать такую ампулу в настоящее время, ее хранят при температурах ниже -20 С. Для вакцинации полученный лиофилизат можно растворить в 0,1-0,5 мл водного раствора, предпочтительно физиологического раствора или Tris-буфера, и вводить либо системно, либо местно, то есть парентерально, внутримышечно или любым иным путем введения, известным специалистам-практикам. Режим введения, дозу и число введений могут оптимизировать специалисты в данной области техники известным способом. Наиболее предпочтительным для векторов на основе поксвирусов является подкожное или внутримышечное введение. Если данная вакцина представляет собой MVA-BN-вектор или его производное, включающий ДНК в соответствии с настоящим изобретением, конкретный вариант осуществления настоящего изобретения относится к введению вакцины в терапевтически эффективных количествах для первой иммунизации("первичная иммунизация") и для второй иммунизации ("повторная иммунизация"). Если вакцина представляет собой MVA-BN-вектор или его производное, включающий ДНК в соответствии с настоящим изобретением, конкретный вариант осуществления настоящего изобретения относится к набору для вакцинации, включающему MVA-BN-вирусный вектор в соответствии с настоящим изобретением для первой вакцинации ("примирующей"), первый флакон/контейнер, и для второй вакцинации ("повторной")- второй флакон/контейнер. Следовательно, настоящее изобретение относится к вакцинным вариантам вакцины, включающей нуклеиновую кислоту, вектор или слитый белок, в соответствии с настоящим изобретением, и к использованию указанной нуклеиновой кислоты, вектора или белка для получения вакцины. В соответствии с дополнительным вариантом осуществления настоящего изобретения настоящее изобретение относится к способу защиты животного, в том числе и человека, от ВИЧ-инфекции путем введения животным, в том числе и человеку, нуждающимся в нем, слитого белка в соответствии с настоящим изобретением, нуклеиновой кислоты в соответствии с настоящим изобретением или вектора в соответствии с настоящим изобретением. Кроме того, настоящее изобретение относится к способу получения белка в соответствии с настоящим изобретением, включающему стадии (i) трансфекции клетки-хозяина нуклеиновой кислотой или вектором в соответствии с настоящим изобретением, или (ii) инфицирования клетки-хозяина вирусным вектором в соответствии с настоящим изобретением (iii) экспрессии слитого белка в трансфицированной клетке-хозяине стадии (i), или инфицированной клетке-хозяине стадии (ii), а также (iv) извлечения слитого белка. Кроме того, настоящее изобретение относится к клеткам-хозяевам, трансфицированным нуклеиновой кислотой или вектором в соответствии с настоящим изобретением или инфицированным вирусным вектором в соответствии с настоящим изобретением. В соответствии с альтернативным вариантом осуществления настоящего изобретения, слитый белок может включать по меньшей мере три разных ВИЧ-белка, выбранных из Vif, Vpr, Vpu, Rev, Vpx иTat. Слитый белок может предпочтительно включать 4, 5 или все указанные ВИЧ-белки. Типичный слитый белок в соответствии с данным вариантом настоящего изобретения включает аминокислотную последовательность указанных ВИЧ-белков Vpr, Vif, Vpu, Rev и Tat или производные аминокислотной последовательности одного или нескольких указанных белков. Как указано выше, порядок этих ВИЧбелков в слитом белке не является первостепенно значимым. Все предпочтительные варианты осуществления настоящего изобретения, как указано выше, также применимы к данному альтернативному варианту осуществления настоящего изобретения.-8 007154 Краткое описание чертежей Фиг. 1 - схематическое представление отжига олигонуклеотидов. Данный чертеж демонстрирует отжиг четырех олигонуклеотидов. Они являются одноцепочечными и могут отжигаться по комплементарным концам. Пробелы заполняют с помощью полимеразы, которая обнаруживает корректирующую активность (например, Pfx-полимераза). Фиг. 2 - схематическое представление отжига четырех генов blob.Vif-ген демонстрирует перекрывающуюся последовательность с vpr-фрагментом, vpu-кодирующий фрагмент демонстрирует перекрывающуюся последовательность с rev-геном (серый цвет). ПЦРфрагменты денатурируют, а перекрывающиеся комплементарные концы гибридизуют. Получающиеся пробелы заполняют с использованием Pfx-полимеразы. Vif-vpr-фрагмент сливают с перекрывающейся последовательностью vpu-rev-фрагмента, который снова используют для слияния. Фиг. 3 - метод клонирования последовательности, кодирующей слитый белок в соответствии с настоящим изобретением, в рекомбинантном векторе для встраивания чужеродных генов в геном MVA. Кодирующую область слитых полипротеинов vif, vpr, vpu и rev амплифицировали с помощью праймеров, включающих сайт рестрикции Clal и Apal. Данный ПЦР-продукт клонировали в Clal/Apalразрезанный вектор pBNX65, который содержит поксвирусный ATI-промотор. Tat-кодирующую область амплифицировали в ПЦР с помощью праймеров, содержащих сайт рестрикции Асс 651, и лигировали с Асс 651-линеаризованной плазмидой pBNX65+vif-rev. Полученную экспрессионную кассету (ATIпромотор + последовательность, кодирующая слитый белок в соответствии с настоящим изобретением) извлекали с помощью Pacl-рестрикции и встраивали в рекомбинантный вектор для встраивания чужеродных генов в межгенную 14L-область MVA (pBNX39). pBNX39 содержит последовательности, гомологичные фланкирующим последовательностям сайта встраивания генома данного MVA (F1 I4L и F2I4L). Для селекции рекомбинантных вирусов после гомологичной рекомбинации MVA-генома и pBNX39 данный вектор дополнительно содержит gpt-ген Е. coli (ген фосфорибозилтрансферазы). После выделения очисткой рекомбинантных вирусов, данную селекционную кассету удаляют путем гомологичной рекомбинации между Flank 1 и повторяющейся последовательностью flank 1 (F1rpt). Фиг. 4 - схематическое представление генома MVA.MVA содержит линеаризованный геном, который демонстрирует характерные фрагменты после рестрикции с помощью HindIII (А-O). Нефункционирующая область между генами 14L и I5L располагается в данном I-фрагменте. Встраивание чужеродных генов с использованием pBNX39 происходит в положении 56767-56768. Примеры Получение ДНК, кодирующей слитый ВИЧ-белок Vif-Vpr-Vpu-Rev-Tat Отдельные гены ВИЧ-генома получали из геномной ДНК с помощью ПЦР с использованием стандартных ПЦР-протоколов или синтетическим методом, который основан на отжиге олигонуклеотидов с помощью перекрывающихся последовательностей и заполнения полученных одноцепочечных пробелов. Для образования на олигонуклеотидной основе кодирующих областей генов, которые встраивают в нуклеиновую кислоту, кодирующую слитый белок в соответствии с настоящим изобретением, конструировали 40-членные олигонуклеотиды с 15 п.н. перекрыванием. Данная последовательность олигонуклеотидов основывается на геномной карте НХВ 2R-изолята ВИЧ 1, который получают из штамма IIIB. Олигонуклеотиды для реакции отжига или ПЦР для выделения требуемой последовательности конструировали таким образом, чтобы в получающейся кодирующей последовательности удалялись стоп-кодоны для терминации трансляции. Tat-ген синтезировали с использованием олигонуклеотидов, содержащих стоп-кодон, поскольку данный ген встраивали в последнее положение нуклеиновой кислоты, кодирующей слитый белок в соответствии с настоящим изобретением, и поэтому он должен содержать стоптриплет для корректной терминации трансляции данного полипротеина. В реакции отжига олигонуклеотидов осуществляли 10 циклов двухстадийной Pfx-полимеразной(Gibco-BRL) реакции (денатурация при 95 С, а отжиг/удлинение при 68 С). В течение этой реакции перекрывающиеся последовательности олигонуклеотидов становятся отожженными, а бреши заполняются с помощью корректирующей Pfx-полимеразы (фиг. 1). Для синтеза vif-кодирующей области первый кодируемый ген в нуклеотидной последовательности,кодирующей слитый белок, осуществляли ПЦР с использованием геномной кДНК ВИЧ. Данную ПЦР осуществляли таким образом, чтобы слить vif-кодирующую область с первыми 15 п.н. последующегоvpr-гена для более позднего отжига vif и vpr. Эту Vpr-кодирующую область, которая охватывает 55595847 п.н. HXB2R ВИЧ-генома, получали путем отжига 10 олигонуклеотидов. Получающиеся бреши заполняли с последующей ПЦР для амплификации продукта, содержащего vpr-кодирующую область, слитую с фланкирующими областями для vif и vpu, который встраивают после vpr-кодирующей области.Vpu-кодирующую область амплифицировали с помощью ПЦР из той же самой кДНК, используемой для синтеза vif, и получали продукт, содержащий фланкирующие области для слияния с vpr и rev.Rev-кодирующую область синтезировали путем отжига 14 олигонуклеотидов, которые охватывают область 5970-6045 п.н. и 8379-8650 п.н. HXB2R ВИЧ-генома, и 15 п.н. перекрывания для отжига с vpu иVif- и vpr-кодирующую область, также как и vpu- и rev-кодирующую область сливали путем отжига двух фрагментов посредством их перекрываний с помощью двухстадийной реакции Pfx-полимеразы(фиг. 2). После дополнительной ПЦР-амплификации слитых продуктов полученные фрагменты выделяли очисткой и лигировали друг с другом посредством перекрывания vpr и vpu (фиг. 2). После ПЦРамплификации получающийся продукт (кодирующие последовательности для vif-vpr-vpu-rev) tatкодирующей области сливали путем клонирования фрагмента vif-vpr-vpu-rev и tat в смежных сайтах клонирования в pBluescriptKS+ векторе, содержащем ATI-промотор поксвируса (фиг. 3, pBNX65). Затем с помощью PacI-рестрикции выделяли полноразмерную экспрессионную кассету и встраивали ее вMVA, что делает возможным их встраивание в некодирующую область (14L) генома с помощью гомологичной рекомбинации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Слитый белок, включающий аминокислотную последовательность по меньшей мере четырех ВИЧ-белков, выбранных из Vif, Vpr, Vpu, Vpx, Rev, Tat и Nef, или производные аминокислотной последовательности одного или нескольких указанных белков, где данный слитый белок не процессируется до индивидуальных ВИЧ-белков, обладающих естественными N- и С-концами, и где производное аминокислотной последовательности ВИЧ-белка представляет собой аминокислотную последовательность,демонстрирующую по меньшей мере 50% гомологии при сравнении соответствующей части аминокислотной последовательности в слитом белке с аминокислотной последовательностью соответствующего ВИЧ-белка из известных ВИЧ-изолятов. 2. Слитый белок по п.1, где гомология составляет по меньшей мере 80%. 3. Слитый белок по п.1, где для получения ВИЧ-белка со сниженной активностью или вовсе неактивного не более 10 аминокислот делетируют, встраивают или замещают в производном аминокислотной последовательности по сравнению с аминокислотной последовательностью соответствующего ВИЧбелка из известных ВИЧ-изолятов. 4. Слитый белок по любому из пп.1-3, где ВИЧ-белки выбраны из Vif, Vpr, Vpx, Vpu, Rev и Tat. 5. Слитый белок по любому из пп.1-4, включающий аминокислотную последовательность из числа ВИЧ-белков Vif, Vpr, Vpu, Rev и Tat, или производные аминокислотной последовательности одного или нескольких указанных белков. 6. Слитый белок по любому из пп.1-5, где аминокислотные последовательности по меньшей мере двух ВИЧ-белков сливают друг с другом без дополнительных аминокислот. 7. Слитый белок по любому из пп.1-6, где аминокислотные последовательности по меньшей мере двух ВИЧ-белков разделяют по меньшей мере одной дополнительной аминокислотой. 8. Слитый белок по любому из пп.1-7, где аминокислотную последовательность по меньшей мере одного из данных ВИЧ-белков сливают с партнером слияния, который не является ВИЧ-белком, выбранным из Vif, Vpr, Vpx, Vpu, Rev, Tat и Nef. 9. Нуклеиновая кислота, кодирующая слитый белок по любому из пп.1-8. 10. Нуклеиновая кислота по п.9, где данная нуклеиновая кислота представляет собой ДНК. 11. Нуклеиновая кислота по п.10, где экспрессия слитого белка из данной ДНК контролируется регуляторными элементами, выбранными из эукариотического, прокариотического и вирусного промоторов. 12. Нуклеиновая кислота по п.11, где вирусный промотор представляет собой поксвирусный промотор. 13. Нуклеиновая кислота по любому из пп.9-12, где данная нуклеиновая кислота дополнительно включает последовательность, кодирующую по меньшей мере один дополнительный ВИЧ-белок, выбранный из Gag, Pol и Env. 14. Нуклеиновая кислота по п.13, где данная нуклеиновая кислота включает кодирующую последовательность ВИЧ-белков Gag, Pol и Env. 15. Вектор, включающий нуклеиновую кислоту по любому из пп.9-14. 16. Вектор по п.15, где данный вектор представляет собой вирусный вектор. 17. Вектор по п.16, где данный вирусный вектор представляет собой поксвирусный вектор, в частности вектор вируса осповакцины. 18. Вектор по п.17, где вектор вируса осповакцины представляет собой модифицированный вирус осповакцины Ankara (MVA). 19. Вектор по п.18, где MVA выбран из MVA-57 5, депонированного в Европейской Коллекции Клеточных Культур Животных (ЕСАСС) с каталожным номером V00120707, и MVA-BN, депонированного в ЕСАСС под каталожным номером V00083008. 20. Способ получения белка по любому из пп.1-8, включающий стадии- трансфицирования клетки-хозяина нуклеиновой кислотой по любому из пп.9-14 или вектором по п.15 либо- инфицирования клетки-хозяина вирусным вектором по любому из пп.16-19,экспрессирования слитого белка в трансфицированной клетке-хозяине или в инфицированной клетке-хозяине, а также- извлечения данного слитого белка. 21. Клетка-хозяин, трансфицированная нуклеиновой кислотой по любому из пп.9-14 либо вектором по п.15 или инфицированная вирусным вектором по любому из пп.16-19. 22. Применение слитого белка по любому из пп.1-8 в качестве лекарственного средства. 23. Применение нуклеиновой кислоты по любому из пп.9-14 в качестве лекарственного средства. 24. Применение вектора по любому из пп.15-19 в качестве лекарственного средства. 25. Применение слитого белка по любому из пп.1-8 в качестве вакцины. 26. Применение нуклеиновой кислоты по любому из пп.9-14 в качестве вакцины. 27. Применение вектора по любому из пп.15-19 в качестве вакцины. 28. Вакцина, включающая слитый белок по любому из пп.1-8, нуклеиновую кислоту по любому из пп.9-14 либо вектор по любому из пп.15-19. 29. Применение слитого белка по любому из пп.1-8 для получения вакцины. 30. Применение нуклеиновой кислоты по любому из пп.9-14 для получения вакцины. 31. Применение вектора по любому из пп.15-19 для получения вакцины. 32. Способ защиты животного, в том числе и человека, против ВИЧ-инфекции путем введения животному, в том числе и человеку, нуждающихся в нем, слитого белка по любому из пп.1-8, нуклеиновой кислоты по любому из пп.9-14 либо вектора по любому из пп.15-19.
МПК / Метки
МПК: C07K 14/16, C12N 15/62
Метки: белок, слитый, белков, числа, вич
Код ссылки
<a href="https://eas.patents.su/13-7154-slityjj-belok-iz-chisla-regulyatornyh-vspomogatelnyh-belkov-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Слитый белок из числа регуляторных/вспомогательных белков вич</a>
Предыдущий патент: Твердая дисперсная композиция
Следующий патент: Способ получения енамидопроизводных фенилаланина
Случайный патент: Местный анестетик для наружного применения