Слитый белок, вектор экспрессии слитого белка, рекомбинантный штамм бактерий escherichia coli и вакцинный препарат
Номер патента: 307
Опубликовано: 29.04.1999
Авторы: Гильен Ньето Херардо Энрике, Мартин Дунн Алехандро Мигель, Сильва Родригес Рикардо Де Ла Каридад, Гомес Родригес Кармен Элена, Леал Ангуло Мария Де Хесус, Дуарте Кано Карлос Антонио, Карпио Муньос Эмилио Луис, Насабаль Гальвес Консуэло, Кинтана Васкес Диогенес, Альварес Акоста Анабель
Формула / Реферат
1. Слитый белок, содержащий пептид-стабилизатор, представляющий собой модифицированный N-концевой участок из 47 аминокислот антигена Р64К Neisseria meningitidis B:4:P1.15 структуры
![]()
и гетерологичный белок или полипептид.
2. Слитый белок по п.1, отличающийся тем, что гетерологичный белок представляет собой белок внешней мембраны Neisseria meningitidis.
3. Слитый белок по п.2, отличающийся тем, что белок внешней мембраны N. meningitidis представляет собой белок РогА или Opc(5c) Neisseria meningitidis.
4. Слитый белок по п.1, отличающийся тем, что гетерологичный полипептид представляет собой мультиэпитопный полипептид, включающий несколько повторов центральной области вариабельного участка 3 (V3) gp 120 ВИЧ-1.
5. Слитый белок по п. 4, отличающийся тем, что мультиэпитопный полипептид представляет собой полипептид TAB 4 или TAB 9.
6. Вектор экспрессии слитого белка по п.1 формулы в бактериях E.coli с сохранением рамки считывания, содержащий следующие конструктивные элементы:
- последовательность нуклеотидов, кодирующую пептид-стабилизатор, представляющий собой модифицированный N-конце-
вой участок из 47 аминокислот антигена 64К Neisseria meningitidis B:4;P1.15, имеющую структуру:
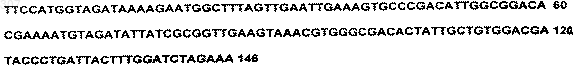
и находящуюся под контролем триптофанового промотора E.coli;
сайты рестрикции Хba I, Eco R V и Bam HI, локализованные за последовательностью нуклеотидов, кодирующей пептид-стабилизатор;
- ДНК-фрагмент, кодирующий гетерологичный белок или полипептид, встроенный по указанным выше сайтам;
- сигнал терминации бактериофага Т4, расположенный за ДНК-фрагментом, кодирующим гетерологичный белок или полипептид;
- ген устойчивости к ампициллину в качестве селективного маркерного гена.
7. Вектор экспрессии по п.6, отличающийся тем, что ДНК-фрагмент кодирует белок внешней мембраны N. meningitidis.
8. Вектор экспрессии по п.6, отличающийся тем, что ДНК-фрагмент кодирует гетерологичный полипептид, представляющий собой мультиэпитопный полипептид, включающий несколько повторов центральной области вариабельного участка 3 (V3) gp 120 ВИЧ-1.
9. Вектор экспрессии по п.7, отличающийся тем, что он представляет собой вектор рМ-80.
10. Вектор экспрессии по п.7, отличающийся тем, что он представляет собой вектор рМ-82.
11. Вектор экспрессии по п.6, отличающийся тем, что он представляет собой вектор рТАВ9.
12. Рекомбинантный штамм бактерии Escherichia coli, трансформированный вектором экспрессии по любому из пп.6-11 формулы и используемый для получения слитого белка по любому из пп.1-5 формулы.
13. Вакцинный препарат, отличающийся тем, что содержит слитый белок по любому из пп.1-5 формулы и подходящий адьювант.
Текст
Настоящее изобретение относится к области биотехнологии и генной инженерии, в частности к экспрессии гетерологичных белков в бактериальных хозяевах посредством слияния этих белков с пептидами бактерий с использованием технологии рекомбинантных ДНК.Эффективность технологии рекомбинантных ДНК для получения белков любого происхождения в Е.со 11 широко известна. В указанных целях разработано большое количество векторов, однако необходимость в разработке новых вариантов векторов все еще остается актуальной, так как каждый клонируемый и экспрессируемый ген уникален (всыпают, 1).Т. Со 1 азаш 1, 1., Уестогз, Випегшогшз, Згопепаш,МА, рр. 179-204, 179, 1987 1111 асо/1 с 11, Т. е: а 1., ]опша 1 01 В 1 о 1 ес 11 по 1 о 3 у, 13, 243-250, 1990).Наиболее распространенной стратегией,используемои для продуцирования гетерологичных полипептидов в Е.со 11, является внутриклеточный синтез, поскольку в этом случае могут быть достигнуты высокие уровни экспресстш (С 0 еббе 1, 1)./., Мешоаз Еп 2 уп 1 о 1., 185, 3-7,1990). Однако такие факторы, как чувствительность к протеазам хозяина или токсичность экспрессированного белка могут приводить к значительному снижению уровней экспрессии независимо от использования высокоэффективных регуляторных последовательностей (кеааз, С.А. 5 а 1 ег, М.Н., 1. Вас[ег 1 о 1., 153, 685-692; Сшуп,ОЗУ. МешЬгапе Рготепт Ехргеззюп Зузтептз: То П 5 ег' Сшае, Рогг 1 апс 1 Ргезз, Ьопаоп, ИК, 29-82).Клонирование нуклеотидных последовательностей, кодирующих нужные белки в соответствующих векторах, с сохранением рамки считывания последовательностей нуклеиновой кислоты, кодирующих стабильные полипептиды в клетке-хозяине, приводит к экспрессии гибридных продуктов в цитоплазме, известных как слитые белки (Магзгоп, Р.А.О., В 1 ос 11 еш. 1. 240,1-12, 1986). Обычно такие полипептиды являются менее чувствительными к протеолитической деградации протеазами хозяина, либо менее токсичными вследствие образования телец включения, что позволяет достичь более вЬ 1 соких уровней экспрессии, чем уровни, получаемые без использования пептида-стабилизатораКроме того, такой способ экспрессии облегчает первоначальные стадии очистки и снижает затраты на их осуществление при условии,что используются различные методы для последующей ренатурации рекомбинантного продукта (Етзспег, В., Зцшптег 1. Сооаепоип, Р. В 1 огес 1 шо 1. Втоепд, 41, 3-13).Тельца включения представляют собой нерастворимые белковые агрегаты, которые образуются в виде электрически плотных телец в цитозоле в процессе экспрессии многих рекомбинантных белков в Е.с 011 (Кшаз, От. Ва 11 еу,1., Арр 1. М 1 сгоЬ 1 о 1. В 1 о[ес 11 по 1., 37, 609-614). Эти тельца формируются в результате взаимодейст 000307ВИЯ МСЯСДУ ПОЛИПСПГИДЗМИ, ШИСЮЩИМИ ЧЗСТИЧНО складчатую структуру, агрегация которых является термодинамически благоприятной вследствие воздействия растворителя на гидрофобные остатки, находящиеся внутри указанных полипептидов (К 1 е 111 а 13 ег, Т., 12114011, К, ег. а 1., В 1 огес 1 шо 1 оу, 9, 825-829). Медленная укладка многих эукариотических белков в бактериальном цитозоле, обусловленная избыточным количеством аминокислот, образующих дисульфидные мостики (цистеин), или аминокислот, образующих бета-изгиб (пролин), благоприятствует их широкому применению в качестве белковстабилизаторов. Использование полршептидов в этих целях было описано ранее, например, были ОПИСЗНЫ ПОЛИПСПТИДЫ С ЗНТИТСЛОСВЯЗЫВЗЮЩСЙ активностью, происходящие из жировых глобул человеческого молока (НМРС) (международная заявка Мг 9207939 А 2 920514); полипептиды,происходящие из константных областей иммуноглобулинов (заявка на Европейский патент Мг ЕР 0464533 А 1 920108); полипептиды, происходящие из ангиогенина человека (заявка на Европейский патент Мг ЕР 0423641 А 2 910424); полипептиды, происходящие из гормона роста (ЕР 0429586 А 1 910605); полипептиды, происходящие из глутатион-Б-трансферазы (ЕР 08809372 А 1 881201); и полипептиды, происходящие из аденилаткиназы свиньи (ЕР 0423641 А 2 910424 и ЕР 0412526 А 2 910213).Однако использование стабилизирующих полипептидов, которые составляют значительную часть слитого белка, шиеет определенные недостатки в том случае, если этот белок является "кандидатом" на использование в качестве вакцины, поскольку присутствие чужеродных последовательностей может изменить естественный порядок локализации В- и Т-клеточных эпитопов (Вептоп, С. Нпбеси, Е, Карат, 1. ет. а 1.,Рергше Кезеагсп, 7, 258-264) или повлиять на их процессинг под воздействием антигенпрезентирующих клеток (1)е 1 Ма 1, М., 5011110111,Н., Кцррегг, Т., ет а 1., Се 11, 66, 1145-1153), что может оказать весьма существенное воздействие на иммуногенность "кандидата" вследствие явления специфической эпитопной супрессииИсходя из вышеуказанного, в некоторых случаях были предприняты попытки определения тех небольших фрагментов, которые еще способны стабилизировать экспрессию. Так,например, в заявке на патент Германии Не 3541856 А 1 (Ноеспзг АС) сообщается о возможности использования пептида-стабилизатора,соответствующего, по крайней мере, первым 95 аминокислотам М-концевого участка интерлейкина (113-2) человека, для получения гибридных белков в нерастворимой форме, синтезируемых в Е.со 11. Аналогично, в заявках на Европейский патент Мг 0 416 673 А 2 и Мг 229 998 той же самой фирмы описано использование пептидастабилизатора, соответствующего первым 58или 38 аминокислотам указанного белка (113-2). Использование первых 58 аминокислот 113-2 было также описано в Европейском патенте Мг 416673 В 1 и, кроме того, аналогичная стратегия для достижения вышеуказанных целей была описана в случае использования Ы-концевых фрагментов альбумина сыворотки человека (заявка на Европейский патент Мг ЕР 0 423 641 А 1 920212), пептида-активатора 111 соединительной ткани (ШО 90136647 А 1 901115) и фрагментов калликреина человека (ЕР 0381433 А 1 900808). Изобретения, описанные в этих заявках, решают вышеуказанную проблему, однако полученные гибридные полипептиды не могут быть включены в вакцинные препараты, предназначенные для введения человеку, вследствие риска индуцирования аутоиммунных болезней из-за наличия в этих препаратах последовательностей,ГОМОЛОГИЧНЫХ ИЛИ ИДСНТИЧНЫХ ПОСЛСДОВЗТСЛЬностям белков человека.Кроме того, разработана успешная альтернативная стратегия использования полипептидов-стабилизаторов бактериального происхождения, не обладающих перекрестной реактивностью с антигенами человеческого происхождения, для внутриклеточной экспрессии. Одним из наиболее часто используемых в этих целях белков является Б-галактозидаза Е.с 011 (11 а 111 га К., е 1 211., 5 с 1 е 115 е, 198, 1056, 1977) или ее фрагменты(заявка на патент Германии Мг ЕР 0235754 А 2 870909 компаьши Н 0 ес 1151 АС). Существенным недостатком данной системы является слишком большой размер указанного белка, что весьма нежелательно, поскольку нужный пептид должен составлять лишь небольшую часть от полного гибридного белка (Р 1 ошег, М. е 1. а 1., Арр 1. М 1 сгоЬ 1 о 1. В 1 о 1 ес 1111 о 1. 25, 267, 1986; Соеаае] ВУ. е 1 211., Р.11.А.5. П 5 А, 76, 106-110). Аналогичные проблемы возникают при использовании С-фрагмента токсоида столбняка (1 е 1 аг 1115 1 охо 1 а) и эшотоксина Рзецаошопаз эр. (международная заявка Й/О 9403615 А 1 940217 и заявка на Европейский патент 0369316 А 2 900523). Весьма перспективной стратегией экспрессии является использование гибридов с тиорредоксином Е.со 11 (Международная заявка Ю 9402502 А 1 940203), который обладает способностью вЬ 1 свобождаться из клетки при осмотическом шоке(Е 1 уаа 3 о 11131, А., Ко 111 уап 1 а, М., 121 с 11 агп 1 е, 6., 1. Вас 1 ег 1 о 1., 176, 7074-7078), что облегчает очистКу. Однако этот принцип не может быть использован для получения телец включения, поскольку они не высвобождаются таким способом.Многие из указанных проблем были решены за счет получения модульных гибридных белков. В этих белках пептид-стабилизатор отделен от нужного белка спейсером, благодаря которому осуществляется их независимая укладка, причем аминокислотная последовательность спейсера делает его восприимчивым к воздействию специфических эндопептидаз. Если имеется лиганд, который распознает вЬ 1 бран 000307ный стабилизатор, то в этом случае гибридный полипептид может быть очищен методами аффинной хроматографии и, в конечном счете,отделен от стабилизатора путем обработки различными протеазами (Сгезз, 1)., 51111112, 1. и ВгеШош, 5. Ргошеда, ссылка 42, 2-7).Еще одним преимуществом описанной методики является возможность использования указанного молекулярного взаимодействия для последующего контролирования промежуточных стадий очистки без необходимости получения антител к каждому белку. В качестве хорошо известного примера может служить использование сродства гистидина (Нуз) к некоторым металлам, таким как никель (М) и цинк (211), в системах, состоящих из стабилизатора с последовательно расположенными 6 Нуз и аффинной матрицы С НИКСЛСВЫМ ХСЛЗТНЬПИ КОМПЛСКСОМ,как описано в международной заявке Ю 9115589 А 1 911017 (Пр]о 11 г 1 Т 11 е С 0.). Тем не менее, экспрессирующая система такого типа не будет по разным причинам функционировать во всех случаях, поскольку нужный белок может иметь рестрикционные сайты для выбранной протеазы или быть уложен таким образом, что спейсер окажется доступным для растворителя(Н 111 е 11, М., Мо 1(5, Т., Ме 111. Ег 12 уп 1 о 1. 185, 129140; Сгезз, 1., 51111112, 1. Вге 111 ош, 5., Ргошева,ссылка 42, 2-7), что будет препятствовать связыванию стабилизатора и аффинной матрицы(Меж Еп 31 аг 1 с 1 В 1 о 1 аЬ 5, Т 11 е МЕВ Тгаг 15 сг 1 р 1, 3, 14). Кроме того, для очистки белка могут просто потребоваться условия, неблагоприятно влияющие на его биологическую активность. Исходя из этих соображений, желательно, чтобы существовали различные варианты экспрессии, поскольку каждый белок индивидуален. В этих целях были сконструированы пептидыстабилизаторы на основе связывающего мальтозу белка Е.со 11 (Ма 1 Е), которые обладают сродством к амилозным смолам (заявка на Европейский патент ЕР 0426787 А 1 910515) и входят в состав хлорамфениколацетилтрансферазы (заявка на Европейский патент Мг ЕР 0131363 А] 850116) или глутатион-5-трансферазЬ 1 (заявка на Европейский патент Мг ЕР 0293249 А 1 88130,Ашгаа Согр., 13111), полученных с использованием иммобилизованных субстратных матриц; белка А 51 ар 11 у 1 ососс 11 аигепз (международная заявка ИО 9109946 А 1 910711), и 12,5- кДа субьедиицу транскарбоксилазного комплекса Ргор 1 ог 1113 ас 1 ег 111 п 1 511 егша 1111, который биотинилируется 111 то и позволяет осуществлять очистку по сродству биотина к авидину (Сгезз, 1).,51111112, 1. Вге 111 ош, 5., Ргошева Мо 1 е 5, 42, 2-7,заявка на Европейский патент 0472658 А 1 920304 или ШО 9014431 А 1 901129).Особый интерес представляет метод, описанный в заявке на Европейский патент ЕР 0472658 А 1 920304 или ШО 9014431 А 1 901129 и разработанный Корпорацией по исследованиям и разработкам в области биотехнологии(В 1 о:ес 11 по 1 о 3 у Кезеагсп апс 1 Веуе 1 орп 1 еп: Согрогапоп) совместно с Уъшверситетом штата Иллинойс, США. В этих заявках раскрыта экспрессирующая система, в которой используется домен дигидролипоамидацетилтрансферазы (ЕС 2.3112), связывающий липоевую кислоту (известный также как субьединица Е 2 пируватдегидрогеназного комплекса Е.со 11). Этот домен подвергали посттрансляционной модификации 111 что путем присоединения молекулы липоевой кислоты к атому азота лизиновых остатков указанного домена (Оцез: 1.12, Ап 31 ег, 1.5. КЦ 55 е 11, С.С., Апп. ИХ. Асаб. 501., 573, 76-99) И использовали для очистки И идентификации гибридных белков, содержащих этот домен, с помощью антител, распознающих только лиПОИЛЗТНЪ 1 С ДОМСНЫ.Однако этот метод имеет ряд недостатков. Во-первых, известно, что сверхсинтез белков,содержащих ДОМСНЫ СВЯЗЫВЗНИЯ С ЛИПОСВОЙ кислотой, повышает способность клеток к липоилированию, что в результате приводит к продуцированито не липоилатных доменов(М 11 е 5 1.5. 61.1651, 112., В 1 ос 11 еш. 1., 245, 869874; А 11 5.Т. Сцен, 112., В 1 ос 11 еш. 1., 271, 139145) или октаноилатов (А 11, .Т., Мо 1 г, А.].,А 511:оп, Р.К. е: а 1., Мо 1. М 1 стоЬ 1 о 1., 4, 943-950; Вал 1 е 1, Е, Рас 1 шап, Ь.С. Рег 11 аш, КМ, ЕЕВЗ Ье. 295, 13-16), которые могут уменьшать вЬ 1 ход в процессе очистки иммунноаффиниыми методами. Во-вторых, существует группа заболеваний, имеющая, как предполагается, аутоиммунную природу, где общим этиологическим фактором является присутствие антител, которые специфически распознают липоевую кислоту в аминокислотном окружении указанных доменов. Такими заболеваниями являются первичный билиарный цирроз печени, хроническое заболевание, характеризующееся воспалением и прогрессирующей обструкцией внутрипеченочНЬ 1 Х желчных протоков (Тиа 111 оп, М. Апбте, С.,Вг 1 апс 1, ].Р. е: а 1., 1. 1 шш 1 шо 1, 148, 445-450), и гепатит, провоцируемый галотаном, Широко используемым анастетиком, который дериватизирует некоторые белки посредством образования трифторацетил-лизина (Ош, 1., С 11 г 15:еп, Ог.,Ртеу, М. е: а 1., Тох 1 со 1 о 3 у, 97, 199-224). Сыворотка пациентов, страдающих таким заболеванием, распознает указанные комплексы, молекулярная структура которых имитируется липоевой кислотой в окружении дигидролипоамидацетилтрансфераз (Ош, 1., сплетен, Ог., Ргеу,11., е: а 1., Тох 1 со 1 о 3 у, 97, 199-224). По этой причине желательно, чтобы липоевая кислота не присутствовала в таких пептидах в том случае,если гибридные белки, содержащие указанные пептиды, предназначены для введения человеку В КЗЧССТВС ВЗКЦИНЫ.Целью настоящего изобретения является способ получения в Е.со 11 высоких уровней геТСрОЛОГИЧНЫХ бСЛКОВ В КЗЧССТВС СЛИТЫХ ПОЛИПСПТИДОВ, ОСНОВЗННЫЙ на ИСПОПЬЗОВЗНИИпервые 47 аминокислот антигена Р 64 К 11.п 1 еп 1 п 31:1 с 11 В: 4 : Р 1.15 (заявка на Европейский патент Мг ЕР 0474 313 А 2) иобеспечивающего способность к экспрессии указанных белков в виде телец включения. Последовательность стабилизатора, хотя и обладающая гомологией с участком связывающего липоевую кислоту домена дигидролипоамидацетилтрансферазы, была генетически модифицирована в целях исключения возможности ее самомодификации. Преимущество указанной модифрщированной последовательности заключается в е низкой иммуногенности. Заявленный способ также предусматривает использование моноклонального антитела, которое специфически распознает указанный стабилизатор, что позволяет осуществлять иммунодетекцию любого белка, слитого с этой последовательностью.В частности, в настоящем изобретении в качестве экспрессирующего вектора используется рекомбинантная плазмида, содержащая вышеуказанный стабилизатор под контролем триптофанового промотора (ршр) Е.со 11, за которым расположены рестрикционные сайты ферментов ХЪа 1 ЕсоКУ и ВашН 1. Эти сайты позволяют клонировать с сохранением рамки считывания ДНК-фрагменты, кодирующие нужные полипептиды. Указанный вектор также содержит терминатор транскрипции от гена 32 бактериофага Т 4 и ген устойчивости к ампициллину в качестве селективного маркера.Заявленный способ также позволяет использовать полученный слитый полипептид в ВЗКЦИЪШЫХ препаратах, предназначенных ДЛЯ введения человеку, а природа используемого пептидного стабилизатора позволяет генерировать протективный иммунный ответ против чужеродного белка или связанного с ним мультиЗПИТОПНОГО ПСПТИДЗ.Новизна настоящего изобретения заключается в генетической модификации и использовании пептида-стабилизатора, гомологичного участку связывающего липоевую кислоту домена дигидролипоамидацетилтрансферазы, в целях получения слитых белков в Е.со 11 с применением технологии рекомбинантных ДНК. В частности, новизна настоящего изобретения ЗЗКТПОЧЗСТСЯ В ИСПОЛЬЗОВЗНИИ ПСПТИДЗстабилизатора, представляющего собой первые 47 аминокислот антигена Р 64 К М. шепйпдппйз В:4:Р 1.15 (заявка на Европейский патент Не 0 474 313 А 2), и моноклонального антитела,специфически распознающего указанный стабилизатор.(Р 64 К, ЬраА) является белком, содержащим 594 ЗМИНОКИСЛОТЫ И принадлежащим К ССМСЙСТВУ дигидролипоамидодегидрогеназ (ЕС 1.8. 1.4), в частности к их новой подгруппе, который отлиЧЗСТСЯ ТСМ, ЧТО ШИССТ ДОМСН СВЯЗЫВЗНИЯ С ЛИ поевой кислотой, аналогичный домену в Ыконцевом участке дигидролипоамидоацетилтрансфераз (Кшег, М, Оррегшапп, Р.В.,Ьогепи], Н. апс 1 5 ге 1 пЬис 1 те 1, А., 1., Вас[ег 1 о 1., 176,3614-3630, 1994, Неш, 5. апа 51 е 1 пЬ 11 с 11 е 1, А., 1.,Вастегйо], 176, 4394-4408, 1994). Белок ЬраА клонировали и сверхэкспрессировали в Е.со 11 с добавлением 5 аминокислот (МЬВКК) в концевой участок (заявка на Европейский патент Мг 0 474 313 А 2, фиг. 1). Хотя обозначения ЬраА и Р 64 К являются эквивалентными, Р 64 К относится к рекомбинантному белку, который используется при осуществлении заявленного способа. Для определения иммуногенности различных фрагментов указанного антигена и анализа на возможность использования менее иммуногеннЬ 1 х пептидов-стабилизаторов выявляли локализацию эпитопов Р 64 К для В-клеток посредством оценки реактивности поликлональной антиР 64 К сыворотки, направленной против синтетических пептидов.С этой целью белок Р 64 К очищали (заявка на Европейский патент Мг 0 474 313 А 2) посредством гидрофобной хроматографии в БутилТЗК и гель-фильтрации, а затем его денатурировали путем осаждения трифторуксусной кислотой (ТСА), нейтрализовали МаОН и уравновешивали в фосфатном слое путем тельхроматографии. Этот препарат использовали для иммунизации 30 мышей Ва 1 Ь/с путм подкожного введения 20 мкг доз с добавлением 2 мкг гидроокиси алюминия (день 0), а затем проводили повторную иммунизацию теми же антигенами на 7 и 21 день. Сыворотки собирали на 28 день после первого экстрагирования. Полученные сыворотки объединяли и образовавшуюся смесь распределяли на аликвоты и хранили при температуре -20 С.Помимо этого, 59 пептидов из 20 аминокислот, которые охватывают полную последовательность рекомбинантного белка и перекрЬ 1 ваются 10 аминокислотами, синтезировали с использованием коммерчески доступного набора для твердофазного синтеза (Мишрш Рерпае 5 утп 11 е 515 Зузгеш, СЬапоп Мшюторе, Р[у., ыа. ПЗА) в 96-луночных планшетах в соответствии с инструкциями, рекомендованными изготовителем.Затем аминокислоты были пронумерованы, начиная от Ы-концевой части белка. Реактивность анти-Р 64 К сыворотки, направленной против указанных пептидов, определяли с использованием разведения 1:2000, а иммуноанализ проводили по схеме, рекомендованной изготовителем вышеуказанного коммерческого набора.Результаты исследований приведены на фиг.2, где представлены величины оптических плотностей для каждого пептида. Очевидно, что первые 110 аминокислот (соответствующие пептидам 1-11) образуют слабоиммунногенный сегмент несмотря на денатурацию иммуногена, 000307который может даже включать крт/Штические(скрытые) эпитопы. Этот сегмент содержит, в основном, домен, связывающий липоевую кислоту, и спейсерную область, богатую пролином и аланином, которые связывают его с остатком белка.Полученные результаты указывают на то,что пептид-стабилизатор или фрагменты, происходящие из этого пептида, могут быть использованы прешиущественно в качестве пептидов-стабилизаторов, благодаря небольшому ВЛИЯШПО на ИММУНОГСННОСТЬ ТСХ ПОЛИПСПТИДОВ,с которыми они слиты. Это преимущество особенно важно, если этот гибридный полршептид является кандидатом на изготовление вакцины.Пример 2. В целях экспрессии различных гетерологичных белков в Е.со 11 посредством их слияния со связывающим липоевую кислоту доменом антигена Р 64 К М.п 1 еп 1 п 3111 с 11 В :4:Р 1. 15, конструировали экспрессирующий вектор рМ-83, в который встраивают последовательность, кодирующую пептид-стабилизатор,представляющий собой первые 47 аминокислот указанного белка (ЗЕО П) Мг 1). Данную последовательность клонировали под контролем триптофанового промотора Е.со 11, при этом использовали сигнал терминации транскрипции бактериофага Т 4 и ген резистентности к ампициллину в качестве селективного маркера.Для получения вектора экспрессии рМ-83 пептид-стабилизатор сначала амлифицировали с помощью полимеразной цепной реакции (РСК)(КапааП, К. е: а 1., 5 с 1 епсе, 42394, 487-491, 1988) из плазмиды рМ-6, которая содержит нуклеотидную последовательность, кодирующую Р 64 К(заявка на Европейский патент Не 0 474 313 А 2 фиг.1). Для этого использовали олигонуклеотидные праймеры 1573 и 1575, которые вводят рестрикционные Ысо 1- и ХЬа 1 сайты в амплифицированный ДНК-фрагмент,соответствующий амино- и карбоксильным концам стабилизатора, кодированного этим фрагментом:Аминокислотная последовательность полученного стабилизатора показана на фиг.3(ЗЕО П) Мг 6). Введение рестрикционного Мсо 1 сайта приводит к замене лейцина в положении 2 на валин; а праймер 1575 удаляет последовательность ЕТВ (положение 45-47), вводя в это положение последовательность ВЬЕ. В этом случае лизин липоевой кислоты (положение 48) не образует части стабилизатора, а его близлежащие участки, которые являются высоко консервативными в этих доменах (Киззы, С.С.,Сиезг, ].Р., В 1 ос 111 п 1. В 1 ор 11 уз. Кесогб, 1076, 225232, 1991), изменяются. Все это позволяет ис ТТССАТССТАСАТААААС 3'
МПК / Метки
МПК: A61K 39/095, C07K 14/16, C12N 15/62
Метки: препарат, вакцинный, белок, белка, слитый, слитого, бактерий, вектор, escherichia, рекомбинантный, экспрессии, штамм
Код ссылки
<a href="https://eas.patents.su/17-307-slityjj-belok-vektor-ekspressii-slitogo-belka-rekombinantnyjj-shtamm-bakterijj-escherichia-coli-i-vakcinnyjj-preparat.html" rel="bookmark" title="База патентов Евразийского Союза">Слитый белок, вектор экспрессии слитого белка, рекомбинантный штамм бактерий escherichia coli и вакцинный препарат</a>
Предыдущий патент: Способ производства продуктов, содержащих дисоли муравьиной кислоты
Следующий патент: Производные индола в качестве антагонистов возбуждающих аминокислот
Случайный патент: Применение производного антрациклина для лечения опухоли печени











