Комбинации ингибиторов вируса гепатита с
Номер патента: 22303
Опубликовано: 30.12.2015
Авторы: Макфи Фиона, Гардинер Дэвид Ф., Лемм Джюли А., Гао Мин, Восс Стейси А.
Формула / Реферат
1. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I)
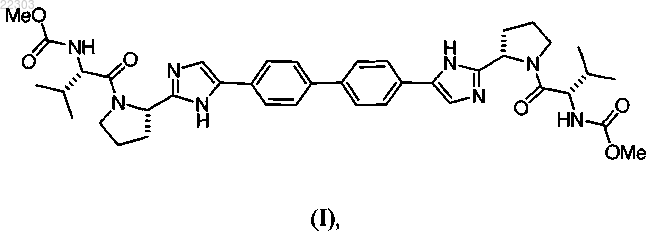
или его фармацевтически приемлемой соли; терапевтически эффективное количество соединения формулы (II)
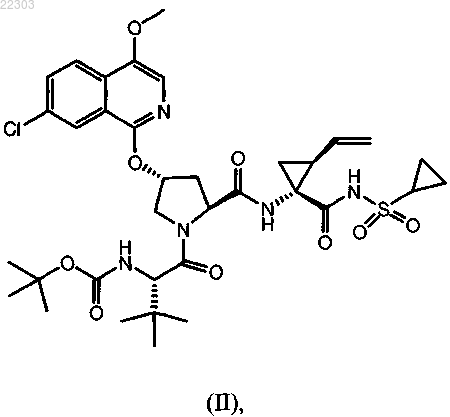
или его фармацевтически приемлемой соли; терапевтически эффективное количество соединения формулы (III)
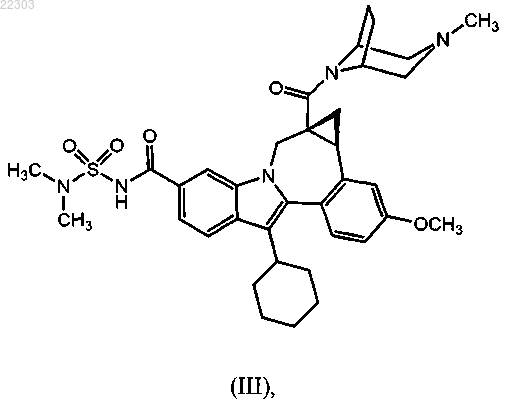
или его фармацевтически приемлемой соли; и фармацевтически приемлемый носитель.
2. Композиция по п.1, в которой молярное соотношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:20:5.
3. Композиция по п.1, в которой молярное соотношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:250:1000.
4. Способ лечения инфекции HCV у пациента, включающий введение пациенту терапевтически эффективного количества композиции по п.1.
Текст
КОМБИНАЦИИ ИНГИБИТОРОВ ВИРУСА ГЕПАТИТА С Изобретение в основном относится к противовирусным соединениям и более конкретно к композициям соединений,которые могут ингибировать вирус гепатита С (HCV), и способам лечения гепатита С с использованием таких комбинаций. Композиция содержит терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (III) или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.(71)(73) Заявитель и патентовладелец: БРИСТОЛ-МАЙЕРС СКВИББ ХОЛДИНГС АЙЕЛЕНД (US) Перекрестная ссылка на родственные заявки По заявке на данный патент испрашивается приоритет в соответствии с предварительной заявкой на патент США 61/371399, поданной 6 августа 2010 г. Уровень и область техники Настоящее изобретение в основном относится к противовирусным соединениям и, более конкретно,относится к комбинациям соединений, которые могут ингибировать вирус гепатита С (HCV), композициям, содержащим такие соединения, и способам лечения гепатита С с использованием таких комбинаций.HCV является главным человеческим патогеном, инфицируя приблизительно 170 млн человек во всем мире - примерно в пять раз больше инфицированных вирусом иммунодефицита человека 1 типа. У существенной части этих HCV-инфицированных людей развивается серьезное прогрессирующее заболевания печени, включая цирроз печени и гепатоцеллюлярную карциному.HCV является вирусом с одноцепочечной РНК с положительной полярностью. На основе сравнения расшифрованной аминокислотной последовательности и обширного подобия в 5' нетранслируемой области HCV был классифицирован как отдельный род в семействе Flaviviridae. Все члены семейства Flaviviridae представляют собой вирионы, заключнные в оболочку, которые содержат геном в виде одноцепочечной РНК с положительной полярностью, кодирующий все известные вирус-специфичные белки посредством трансляции единственной, непрерывной открытой рамки считывания. Значительная гетерогенность найдена в нуклеотидной и кодирующей аминокислотные последовательности по всему геному HCV вследствие высокой частоты появления ошибок закодированной РНКзависимой РНК-полимеразы, в которой отсутствует корректирующая активность. Были охарактеризованы по меньшей мере шесть главных генотипов, и больше чем 50 подтипов были описаны с распределением во всем мире. Клиническое значение генетической гетерогенности HCV продемонстрировало склонность к мутациям, которые возникают во время монотерапии; таким образом желательно использовать варианты дополнительного лечения. Одноцепочечный РНК-геном HCV состоит приблизительно из 9500 нуклеотидов в длину и имеет единственную открытую рамку считывания (ORF), кодирующую единственный большой полипептид из приблизительно 3000 аминокислот. В инфицированных клетках этот полипептид расщепляется в многочисленных сайтах клеточными и вирусными протеазами, что приводит к образованию структурных и неструктурных (NS) белков. В случае HCV образование зрелых неструктурных белков (NS2, NS3, NS4A,NS4B, NS5A и NS5B) осуществляется двумя вирусными протеазами. Первая, как полагают, является металлопротеиназой и расщепляет в сочленении NS2-NS3; вторая является сериновой протеиназой, содержащейся в N-концевом районе белка NS3 (также упомянутого в настоящем изобретении как протеиназаNS3), и опосредует все последующие расщепления вниз по течению NS3, как в цис в сайте расщепленияNS3-NS4A, так и в транс для оставшихся NS4A-NS4B, NS4B-NS5A, NS5A-NS5B сайтов. Белок NS4A, по всей видимости, выполняет множество функций, действуя как в качестве кофактора для протеазы NS3,так и способствуя в мембранной локализации NS3 и других вирусных репликазных компонентов. Формирование комплекса NS3/NS4A необходимо для надлежащей активности протеиназы, приводящей к увеличенной протеолитической эффективности расщепления. Белок NS3 также демонстрирует активности как нуклеозид-трифосфатаза и РНК-геликаза. NS4B является интегральным мембранным белком,вовлеченным в формирование мембранной сети, где, как предполагается, собираются репликационные комплексы HCV. NS5B (также упоминаемый в настоящем изобретении как полимераза HCV) является РНК-зависимой РНК-полимеразой, которая вовлечена в репликацию HCV с другими белками HCV,включая NS5A, в репликазном комплексе. Современным стандартом лечения большинства пациентов с хронической инфекцией HCV является терапия пегилированным интерфероном-альфа и рибавирином. Однако высокий процент пациентов не отвечают на эту терапию, и лечение связано с существенными побочными эффектами. Таким образом,существует большая потребность в развитии более безопасных и более эффективных способов лечения. Хотя много низкомолекулярных ингибиторов HCV в настоящее время проходят клинические испытания,на основании клинических данных от нескольких исследований стало очевидно, что могут потребоваться комбинации ингибиторов для эффекта устойчивого вирусологического ответа у пациентов, инфицированных HCV. Возникновение устойчивости у пациентов во время лечения и в постлечебный период вирусной отдачи наблюдается при лечении протеазными ингибиторами, так же как нуклеозидными и ненуклеозидными ингибиторами HCV. Чтобы достигнуть максимальной эффективности и потенциально полностью уничтожить вирус, необходимо использовать комбинированные терапии, особенно такие,которые имеют различные вирусные мишени HCV. Основанные на репликоне in vitro исследования комбинаций показали, что увеличение синергистических эффектов может быть достигнуто с различными комбинациями ингибиторов HCV. Заявка на патент того же заявителя WO 2008/021927 раскрывает соединения, которые ингибируют функцию белка NS5A, закодированного HCV. Патент США Ser.6995174 раскрывает соединения, которые ингибируют функцию протеазы NS3, закодированной HCV. Патент США Ser.7456166 раскрывает соединения, которые ингибируют функцию полимеразы NS5B. Настоящее изобретение представля-1 022303 ет комбинации специфичного ингибитора NS5A HCV, специфичного протеазного ингибитора NS3 HCV и ингибиторов полимеразы NS5B, которые являются полезными для лечения HCV. В первом аспекте настоящее изобретение обеспечивает композицию, содержащую терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (III) или его фармацевтически приемлемую соль; и фармацевтически приемлемый носитель. В варианте осуществления данного аспекта молярное отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:20:5. Во втором варианте осуществления первого аспекта молярное отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:250:1000. При этом соединение формулы (III) является эффективным для ингибирования функции полимеразы HCV. Во втором аспекте настоящее изобретение обеспечивает способ лечения инфекции HCV у пациента,включающий введение пациенту терапевтически эффективного количества композиции, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемую соль; терапевтически эффективное количество соединения формулы (III) или его фармацевтически приемлемую соль; и фармацевтически приемлемый носитель. В первом варианте осуществления второго аспекта молярное отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:20:5. Во втором варианте осуществления второго аспекта молярное отношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:250:1000. Другие аспекты настоящего изобретения могут включать подходящие комбинации вариантов осуществления, раскрытых в настоящем изобретении. Тем не менее другие аспекты и варианты осуществления могут быть найдены в описании, приведенном в настоящем изобретении. Все патенты, заявки на патент и литературные ссылки, процитированные в описании, включены в настоящее изобретение посредством ссылок во всей их полноте. В случае несоответствия настоящее изобретение, включая определения, будет иметь преимущественную силу. При использовании по тексту настоящего описания следующие термины имеют значения, указанные далее. Некоторые соединения настоящего изобретения могут существовать в различных устойчивых конформационных формах, которые можно разделить. Торсионная асимметрия вследствие ограниченного вращения вокруг асимметричной простой связи, например вследствие пространственного затруднения или напряжения кольца, может дать возможность к разделению различных конформеров, обычно известных как атропизомеры. Настоящее изобретение включает каждый конформационный изомер этих соединений и их смесей. Соединения настоящего изобретения могут существовать как фармацевтически приемлемые соли. Термин "фармацевтически приемлемая соль" при использовании по тексту настоящего изобретения представляет соли или цвиттерионные формы соединений настоящего изобретения, которые являются водорастворимыми или маслорастворимыми или диспергируемыми, которые являются по результатам тщательной медицинской оценки подходящими для применения в контакте с тканями пациентов без особой токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, соразмерного с разумным соотношением польза/риск, и являются эффективными для их предполагаемого применения. Соли могут быть получены в процессе окончательного выделения и очистки соединений или посредством специальной реакцией подходящего атома азота с подходящей кислотой. Типичные представители солей присоединения кислоты включают ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бен-3 022303 золсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептоноат, гексоноат, формиат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2 гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтилсульфонат, никотинат, 2-нафталинсульфонат, оксалат, палмоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, паратолуолсульфонат и ундеканоат. Примеры кислот, которые могут использоваться для образования фармацевтически приемлемых солей присоединения, включают минеральные кислоты, такие как хлористоводородную, бромисто-водородную, серную и фосфорную, и органические кислоты, такие как щавелевую, малеиновую, янтарную и лимонную. Соли присоединения основания могут быть получены в процессе заключительного выделения и очистки соединений посредством реакции кислотного протона с подходящим основанием, таким как гидроокись, карбонат или бикарбонат катиона металла или с аммиаком или органическим первичным,вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают литий, натрий, калий, кальций, магний и алюминий, так же как нетоксичные катионы четвертичных аммониевых оснований, такие как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, Nметилпиперидин,N-метилморфолин,дициклогексиламин,прокаин,дибензиламин,N,Nдибензилфенэтиламин и N,N'-дибензилэтилендиамин. Другие типичные представители органических аминов, полезные для образования солей присоединения основания, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. Изобретение обеспечивает фармацевтические композиции, которые содержат терапевтически эффективные количества соединений формул (I), (II) и (III), или их фармацевтически приемлемые соли, и один или больше фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Термин "терапевтически эффективное количество" в данном контексте относится к общему количеству каждой активной компоненты, которая является достаточной, чтобы продемонстрировать значимую пользу для пациента, например длительное сокращение вирусной нагрузки. Когда применяют индивидуально активный ингредиент, который вводят в единственном числе, термин относится только к одному этому компоненту. Когда это относится к комбинации, термин относится к объединенному количеству активных ингредиентов, которые приводят к терапевтическому эффекту, будут ли они введены в комбинации, последовательно или одновременно. Носитель(и), разбавитель(и) или вспомогательное(ые) вещество(а) должны быть приемлемыми в смысле того, чтобы быть совместимым с другими компонентами композиции и не оказывать вредного воздействия на потребителя композиции. В соответствии с другим аспектом настоящего изобретения также обеспечивается процесс для получения фармацевтической композиции, включая смешение соединений формул (I) и (II) или их фармацевтически приемлемых солей с ингибитором полимеразы NS5B, и одним или больше фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами. Термин "фармацевтически приемлемый" в данном контексте относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые являются по результатам тщательной медицинской оценки подходящими для применения в контакте с тканями пациентов без особой токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, соразмерного с разумным соотношением польза/риск, и являются эффективными для их предполагаемого применения. Фармацевтические составы могут быть представлены в формах единичной дозы, содержащих заранее определенное количество активных ингредиентов на единичную дозу. Как правило, фармацевтические композиции настоящего изобретения будут вводиться от приблизительно 1 до приблизительно 5 раз в день или альтернативно посредством непрерывной инфузии. Такое введение может использоваться в качестве продолжительной или острой терапии. Количество активного ингредиента, который может быть скомбинирован с материалами-носителями, чтобы получить форму единичной дозы, изменяется в зависимости от условий лечения, серьезности состояния, длительности введения, способа введения, скорости экскреции используемого соединения, продолжительности лечения и возраста, пола, массы и состояния пациента. Предпочтительные единичные дозированные лекарственные формы содержат суточную дозу или субдозу, как изложено в настоящем изобретении выше, или ее соответствующую часть, активного ингредиента. Как правило, лечение начинается с небольших дозировок существенно меньших, чем оптимальная доза соединения. Затем дозировку увеличивают небольшими порциями, пока не будет достигнут эффект, оптимальный при этих обстоятельствах. Как правило, наиболее желательно соединение вводить в концентрации, которая обычно приводит к антивирусному эффекту, не вызывая неблагоприятных или вредных побочных эффектов. Поскольку композиции настоящего изобретения включают комбинацию трех или больше соединений, имеющих анти-HCV активность, все соединения могут присутствовать в дозе, которая меньше чем или равна дозировке, которую обычно вводят в режиме монотерапии. Уровни дозировки между приблизительно 0,01 и приблизительно 250 мг/кг массы тела в день, предпочтительно между приблизительно 0,05 и приблизительно 100 мг/кг массы тела в день каждого из соединений настоящего изобретения являются типичными в монотерапии для профилактики и лечения HCV-опосредованных заболеваний. Композиции настоящего изобретения могут быть комбинированы с одним или более дополнительными терапевтическими или профилактическими агентами, например, в форме монолитной и/или би/мультислойной таблетки или могут вводиться отдельно от терапевтического или профилактического агента(ов). Фармацевтические составы могут быть адаптированы к введению любым подходящим способом,например пероральным (включая буккальный или сублингвальный), ректальный, интраназальный, для местного применения (включая буккальный, или сублингвальный, или трансдермальный), вагинальный или парентеральный (включая подкожный, внутрикожное введение, внутримышечное, внутрисуставное,внутрисиновиальное, внутригрудинное, интратекальное, внутриочаговое, внутривенные или внутрикожные инъекции или инфузии) способ. Такие формулировки могут быть получены любым способом, известным специалисту в области фармакологии, например объединяя активный ингредиент с носителем(ями) или вспомогательным(и) веществом(ами). Фармацевтические составы, предназначенные для перорального приема, могут быть представлены как дискретные единицы, такие как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевые пены или взбитые массы; или жидкие эмульсии маслов-воде или эмульсии вода-в-масле. Например, для перорального введения в форме таблетки или капсулы, активный компонент препарата может быть объединен с фармацевтически приемлемым для перорального приема инертным носителем, таким как этанол, глицерин, вода и т.п. Порошки получают дроблением соединений до подходящего небольшого размера и смешением с так же раздробленным фармацевтическим носителем, таким как пищевой углевод, как, например, крахмал или маннит. Могут также присутствовать ароматизатор,консервант, диспергирующий агент и краситель. Капсулы изготавливаются путем получения порошковой смеси, как описано выше, и заполнением сформированных желатиновых капсул. Скользящие вещества и лубриканты, такие как коллоидная окись кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, могут быть добавлены к порошковой смеси перед процессом заполнения. Дезинтегрирующие или солюбилизирующие агенты,такие как агар-агар, карбонат кальция или карбонат натрия, могут также быть добавлены, чтобы улучшить биодоступность медикамента, когда капсула проглатывается. Кроме того, если желательно или необходимо, подходящие связующие вещества, лубриканты, дезинтегрирующие агенты и красители могут также быть включены в смесь. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические камеди, такие как гуммиарабик, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль и т.п. Лубриканты, используемые в этих лекарственных формах, включают олеат натрий, хлорид натрия и т.п. Дезинтегрирующие агенты включают, помимо прочего, крахмал, метилцеллюлозу, агар, бетонит, ксантановую камедь и т.п. Таблетки готовят, например, приготовлением порошковой смеси, гранулированием или брикетированием, добавлением лубриканта и дезинтегрирующего агента и прессованием в таблетки. Порошковая смесь получается посредством смешения соединения, раздробленного удобным образом, с разбавителем или основой, как описано выше, и при необходимости, со связующим веществом, таким как карбоксиметилцеллюлоза, альгинат, желирующим веществом или поливинлпирролидоном, замедляющий раствор, такой как парафин, промотор всасывания, такой как соль четвертичного основания и/или агент абсорбции, такой как бетонит, каолин или вторичный дикальций фосфат. Порошковая смесь может гранулироваться влажным способом со связующим веществом, таким как сироп, крахмальный клейстер, раствор камеди гуммиарабика или растворы целлюлозных или полимерных материалов и прошедшие через сито. Как альтернатива гранулированию, порошковую смесь можно пропускать через таблеточную машину, и результат представляет собой неполностью сформированные куски, измельченные в гранулы. Гранулы могут быть смазаны для предотвращения прилипания формующей головки к таблеткам посредством добавления стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. Смазанная смесь затем прессуется в таблетки. Соединения настоящего изобретения могут также быть комбинироваться с легкосыпучим инертным носителем и прессоваться в таблетки непосредственно, минуя стадии гранулирования или брикетирования. Может быть обеспечено прозрачное или непрозрачное защитное покрытие, состоящее из защитного слоя шеллака, покрывающего углеводный или полимерный материал,и покрытия для блеска воском. Красители могут быть добавлены к этим покрытиям, чтобы отличить препараты с различными дозировками. Жидкости для перорального введения, такие как раствор, сиропы и эликсиры, могут быть приготовлены в форме единицы дозировки так, чтобы данное количество содержало заранее определенное количество соединения. Сиропы могут быть приготовлены растворением соединения в соответствующим образом ароматизированном водном растворе, в то время как эликсиры получают с использованием нетоксичной основы. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбитола, консерванты, вкусовые добавки, такие как масло перечной мяты или природные подслащивающие вещества или сахарин или другие искусственные подслащивающие вещества и т.п., могут также быть добавлены. При необходимости, единицы дозировки рецептур для перорального введения могут быть микро-5 022303 капсулированы. Рецептура может также быть приготовлена, чтобы пролонгировать или задержать высвобождение, как, например, с помощью покрытия или с помощью внедрения материала в виде частиц в полимеры, воск и т.п. Соединения формул (I), (II) и (III) и их фармацевтически приемлемые соли могут также вводиться в форме липосомальной системы доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть сформированы из различных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединения формулы (I), (II) и (III) и их фармацевтически приемлемые соли могут также быть доставлены при помощи моноклональных антител как индивидуальных переносчиков, к которым молекулы соединения присоединяются. Соединения могут также быть присоединены к растворимым полимерам как нацеливаемым переносчикам препарата. Такие полимеры могут включать поливинилпирролидон,пирановый сополимер, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол,или полиэтиленоксидполилизин, замещенный палитоильными остатками. Кроме того, соединения могут быть соединены с классом биоразлагаемых полимеров, полезных для достижении контролируемого высвобождения лекарства, например полимолочная кислота, поли(эпсилон-капролактон), полигидроксимасляная кислота, полиортоэфиры, полиацетали, полидигидропираны, полицианакрилаты и поперечно сшитые или амфифильные блок-сополимеры гидрогелей. Фармацевтические составы, приспособленные для трансдермального введения, могут быть представлены в виде отдельных пластырей, предназначенных для обеспечения близкого контакта с эпидермой реципиента в течение длительного периода времени. Например, активный ингредиент может высвобождаться из пластыря ионтофорезом, как в общих чертах описано в Pharmaceutical Research, 3(6), 318(1986). Фармацевтические составы, приемлемые для местного введения, могут быть сформулированы как мази, кремы, суспензии, лосьоны, порошки, растворы, пасты, гели, спреи, аэрозоли или масла. Для лечения глаза или других внешних тканей, например рта и кожи, рецептуры предпочтительно применяются в виде мази или крема для местного применения. При приготовлении в виде мази активный ингредиент может использоваться либо с парафиновой, либо со смешивающейся с водой мазевой основой. Альтернативно, активный ингредиент может быть сформулирован в виде крема с кремовой основой масло-в-воде или основой вода-в-масле. Фармацевтические составы, приемлемые для местного применения для глаз, включают глазные капли, в которых активный ингредиент растворяется или суспендируется в подходящем носителе, главным образом в водном растворителе. Фармацевтические составы, приемлемые для местного применения во рту, включают леденцы для рассасывания, пастилки и жидкости для полоскания рта. Фармацевтические составы, приемлемые для ректального введения, могут быть представлены как свечи или как клизмы. Фармацевтические составы, приемлемые для интраназального введения, в которых носитель является твердым веществом, включают крупный порошок, который вводится наподобие понюшки табака,т.е. быстрой ингаляцией через носовой проход из контейнера с порошком, поднесенного близко к носу. Подходящие составы, в которых носителем является жидкость, для введения как назальный спрей или капли в нос, включают водные или масляные растворы активного ингредиента. Фармацевтические составы, приемлемые для их введения путем ингаляции, включают порошки тонкодисперсных частиц или аэрозоли, которые могут быть генерированы посредством различных типов дозированных аэрозолей в герметичных небулайзерах или инсуффляторах. Фармацевтические составы, приемлемые для вагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пены или рецептур в аэрозольной упаковке. Фармацевтические составы, приемлемые для парентерального введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферные растворы, бактериостатики и растворенные вещества, которые создают композицию, изотоническую с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции могут быть представлены в виде однодозного или многодозного контейнеров, например запаянные ампулы и пузырьки, и могут храниться в сублимированном(лиофилизированном) состоянии, которое требует только добавления стерильного жидкого носителя,например воды для инъекций, непосредственно перед использованием. Приготовленные для немедленного прима растворы для инъекции и суспензии могут быть получены из стерильных порошков, гранул и таблеток. Следует понимать, что в дополнение к компонентам, в частности, упомянутым выше, рецептуры могут включать другие агенты, обычные в данной области техники, учитывающие тип рассматриваемой рецептуры, например подходящие для перорального введения могут включать ароматизаторы. Термин "пациент" включает как человека, так и других млекопитающих. Термин "лечение" относится к (i) предотвращению болезни, расстройства или состояния, случив-6 022303 шихся у пациента, который может быть предрасположен к болезни, расстройству и/или состоянию, но еще не был диагностирован, как имеющих их; (ii) ингибирование заболевания, расстройства или состояния, т.е. купируя их развитие; и (iii) облегчение течения болезни, расстройства или состояния, т.е. вызывая регресс болезни, расстройства и/или состояния. Табл. 1, представленная ниже, приводит некоторые иллюстративные примеры соединений, которые могут вводиться с композициями настоящего изобретения. Композиции настоящего изобретения могут вводиться с другими соединениями, имеющими анти-HCV активность, в комбинированной терапии либо совместно, или по отдельности, или комбинируя соединения в композиции. Таблица 1 Композиции настоящего изобретения могут также использоваться в качестве лабораторных реактивов. Соединения могут служить инструментарием для обеспечения исследовательских инструментов для конструирования систем исследования вирусной репликации, валидации систем испытания на животных и исследований в структурной биологии для дальнейшего продвижения в познании механизмов болезниHCV. Кроме того, соединения настоящего изобретения полезны в установлении или определении участка связывания других противовирусных соединений, например посредством конкурентного ингибирования. Соединения настоящего изобретения могут также использоваться для устранения или предотвращения вирусной контаминации материалов и поэтому снижать риск вирусной инфекции лабораторного или медицинского персонала или пациентов, которые контактируют с такими материалами, например,кровь, ткани, хирургические инструменты и одежда субъекта, лабораторные инструменты и одежда и аппараты и материалы для взятия или переливания крови. Настоящее изобретение далее описывается на конкретных вариантах осуществления, которые не следует рассматривать в качестве ограничений объема изобретения. Напротив, изобретение настоящего изобретения охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Поэтому следующие примеры, которые включают в себя конкретные варианты осуществления, являются только иллюстрацией осуществления на практике настоящего изобретения, при этом следует иметь в виду, что примеры служат для иллюстрации конкретных вариантов осуществления, и предполагается, что они приводятся для наиболее содержательного и легко понятного описания методов и концептуальных аспектов изобретения. Исходные вещества могут быть получены из коммерческих источников или приготовлены известными литературными методами, известными специалистам в данной области техники. Примеры Соединения. Ингибитор HCV NS5A (соединение формулы (I может быть получен в соответствии с процедурой,описанной в заявках на патент того же заявителя WO 2008/021927 или WO 2009/020825. Ингибитор протеазы HCV NS3 (соединение формулы (II может быть получен в соответствии с процедурой, описанной в патенте США серийный 6995174 того же заявителя, и в заявке на патент США 12/547158 того же заявителя. Ингибитор HCV NS5B ингибитор формулы (III) может быть получен в соответствии с процедурой, описанной в патенте США серийный 7456166 того же заявителя. Противовирусная активность ингибитора NS5A (формула (I); 60 мг каждый день) и ингибитора протеазы NS3 (формула (II); 600 мг два раза в день) одного (группа А) или с пегилированным интерфероном-альфа и рибавирином (группа В) в течение 24 недель у больных с генотипом HCV 1 не давали клинического ответа. Основная цель состояла в том, чтобы определить долю субъектов, у которых не обнаруживается PHK HCV (10 МЕ/мл) на вторую и четвертую неделю от начала терапии и через 24 недели после лечения. Осуществляли промежуточный анализ на 12 неделе. Двадцать один пациент (11 группа А, 10 группа В) рандомизировал в сигнальной когорте. Средний возраст составлял 55 лет; мужчин было 13, белых было 16. Таблица 2RVR (быстрый вирусологический ответ) = РНК HCV не обнаруживается на 4 неделю лечения.eRVR (продленный быстрый вирусологический ответ) = РНК HCV не обнаруживается как на 4 неделю, так и на 12 неделю лечения.cRVR (полный быстрый вирусологический ответ) = РНК HCV не обнаруживается на 12 неделю лечения.Статистический анализ всех рандомизированных пациентов; прорыв = неудача.Один субъект с РНК HCV 25 МЕ/мл на 12 неделю, не обнаруживается (UD, 10 МЕ/мл) при повторном тестировании. Как показано в табл. 2, шесть субъектов (54,5%) испытали увеличение вирусной нагрузки, в то время как все субъекты в группе В демонстрировали вирусную супрессию. Увеличение вирусной нагрузки произошло исключительно в индивидуумах, инфицированных генотипом 1 а, и случилось в начале 3 недели, и в конце 12 недели. У двух субъектов с генотипом 1b в группе А РНК HCV оставалась необнаруженной. Шесть субъектов с увеличением вирусной нагрузки дополнительно получили пегилированный интерферон-альфа и рибавирин. РНК HCV снизилась ниже предела обнаружения у двух субъектов и до 25 МЕ/мл еще у двух субъектов, в то время как другие два имели 1,5 log10 уменьшения РНК HCV. Не было зарегистрировано никаких смертельных случаев, значительных побочных явлений или досрочного завершения терапии вследствие побочных явлений во время периода наблюдений. Наиболее распространенным побочным явлением была диарея, но главным образом от легкой до умеренной степени тяжести. Результаты показывают, что в то время как лечение ингибитором NS5A формулы (I) и ингибитором протеазы NS3 формулы (II) с или без пегилированным интерфероном-альфа и рибавирином продемонстрировали подобные уровни RVR у больных, не дающих клинического ответа, инфицированных генотипом HCV 1, шесть из одиннадцати субъектов, получавших одни лишь два низкомолекулярных соединения, испытали увеличение вирусной нагрузки к 12 недели, в то время как комбинация из четырех препаратов поддержали вирусную супрессию во всех субъектах. Поэтому лечение непосредственным действием антивирусных агентов без пегилированного интерферона-альфа и рибавирина потребовало один или более дополнительных терапевтических агентов для предотвращения увеличения вирусной нагрузки. Клеточные линии. Клеточная линия Huh-7, используемая для настоящих исследований, была получена от доктора RalfBartenschlager (University of Heidelberg, Heidelberg, Germany) и выращивалась в DMEM, содержащем 10%-ный FBS, 10 Е/мл пенициллина и 10 мкг/мл стрептомицина. HCV репликоны, используемые в настоящих исследованиях, были произведены в Bristol-Myers Squibb с использованием методики, описанной в WO 2004014852. Кодирующая последовательность опубликованного генотипа репликона 1b HCV(Lohmann, V., F. Korner, J.-O. Koch, U. Herian, L. Theilmann, and R. Bartenschlager 1999, Science 285:110113) была синтезирована Operon Tehnologies, Inc. (Alameda, СА) с использованием последовательности,выложенной в EMBL AccessionAJ242652, нуклеотиды 1801-7758. Функциональный репликон затем собрали в плазмиде pGem9zf(+) (Promega, Madison, WI) с использованием стандартных методик молекулярной биологии. Чтобы создать репликон, кодирующий люциферазный репортер, ген, кодирующий гуманизированный белок люциферазы Renilla, вставляли выше по течению гена фосфотрансферазы неомицина. Полученный репликон состоит из (i) 5' UTR HCV, соединенный с первыми 12 аминокислотам капсидного белка, (ii) гена люциферазы Renilla, (iii) гена фосфотрансферазы неомицина (neo), (iv) IRES от вируса энцефаломиокардита (EMCV) и (v) генов HCV от NS3 до NS5B и 3' UTR HCV. Клеточные линии с репликоном HCV выделяли из колоний, как описано Lohman, et al. (Lohmann,V., F. Korner, J.-O. Koch, U. Herian, L. Theilmann, and R. Bartenschlager 1999, Science 285:110-113), и использовали для всех экспериментов. Коротко, клоны с репликоном линеаризовали с помощью ScaI, и синтезировали in vitro РНК-транскрипты с использованием комплекта Т 7 MegaScript transcription kit(Ambion, Austin, TX) согласно указаниям изготовителя. От 10 до 20 мкг in vitro транскрибированной репликонной РНК вводили в 4-5106 клеток Huh-7 трансфекцией с реактивом DMRIE-C (Invitrogen Corporation, Carlsbad, CA) в соответствии с протоколами изготовителя. Через 24 ч добавляли селективную среду,содержащую 0,5 мг/мл Geneticin (G418, Gibco-BRL, Rockville, MD), и среду меняли каждые 3-5 дней. Приблизительно через 4 недели клетки вырастали для дальнейшего анализа. Клетки поддерживали при 37C в DMEM (Gibco-BRL, Rockville, MD) с 10%-ной телячьей сывороткой, инактивированной высокой температурой (Sigma), пенициллин/стрептомицин и 0,5 мг/мл G418. Цитотоксичность клеточной культуры и люциферазный анализ. Чтобы определить эффективность соединения, клетки с HCV репликоном засевали при плотности 104 на лунку в 96-луночные планшеты на среду DMEM, содержащую 10% FBS. После инкубации в течение ночи соединения, последовательно разбавленные в ДМСО или одном только ДМСО, добавляли в отдельные лунки до конечной концентрации ДМСО 0,5%. Планшеты с клетками затем инкубировали при 37C в течение 3 дней до исследований на цитотоксичность и ингибирования HCV. Жизнеспособность клеток измеряли, используя Alamar Blue assay, и значения CC50 вычисляли, используя уравнения медианного эффекта. Планшеты затем промывали два раза PBS, и активность люциферазы renilla оценивали с использованием Dual-Glo Luciferase Assay System (Promega Corporation, Madison, WI) согласно указаниям изготовителя. Показания с планшета снимали с помощью TopCount NXT Microplate Scintillation and Luminescence Counter (Packard Instrument Company). Концентрации 50%-ной эффективности (EC50) вычисляли при помощи Excel Fit (Version 2.0, Build 30). Значения известного x (концентрация соединения) и y (% относительно контрольных лунок только с ДМСО) использовали, чтобы вычислить EC50 с помощью Excel Fit equation 205, представленного как y=A+B-A)/(1+C/x)D, где A и B равны нижнему и верхнему плато кривой соответственно, C равняется значению х в середине кривой, a D равняется угловому коэффициенту. Исследования комбинации. Для исследований комбинации ингибиторов ингибиторы NS5A HCV, протеазу NS3 и полимеразуNS5B каждую проверяли при одиннадцати концентрациях. Сток-растворы с 200-кратной концентрацией от желаемой конечной концентрация исследования получали 3-кратным разбавлением в ДМСО перед прибавлением к клеткам/среде. Соединения исследовали в виде монотерапии и в комбинациях при различных концентрационных отношениях. Клетки экспонировали с соединениями в течение 3 дней, и значения ингибирования HCV затем определяли с использованием люциферазного анализа, как описано выше. Потенциальные цитотоксичности этих комбинированных агентов также анализировали парал- 10022303 лельно с помощью окрашивания аламаровым синим. Степень антагонизма, аддитивности или синергии определяли в диапазоне концентраций препарата, и характеристические кривые комбинации оказались пригодны для оценки противовирусных эффектов лечения комбинациями препаратов. Совместное воздействие препаратов в комбинации анализировали, используя метод Chou Chou T. Theoretical Basis, Experimental Design, and Computerized Simulation of Synergism and Antagonism in Drag Combination Studies.Pharmacological Reviews. 2006; 58(3):621-81. Все оценки вычисляли, используя биостатистическое программное обеспечение SAS Proc NLIN и четырехпараметровую логистику. Все индексы комбинации проверяли на отклонение от аддитивности,используя изоболограммные методы. Асимптотические доверительные интервалы также вычисляли для каждого из индексов комбинации. Эти интервалы использовали для проверки на отклонение от аддитивности путем сравнения границ с единицей - нижняя граница интервала, большая чем 1, указывает на антагонизм, верхняя граница, меньшая чем 1, указывает на синергизм, и значение 1, содержавшееся в интервале, указывает на аддитивность. Результаты. Таблица 3 Исследования тройных комбинаций с использованием протеазы NS3, ингибиторов NS5A и NS5BPI = Протеазный ингибитор. Исследуемые соединения в мольном отношении 250:1:1000, PI NS3 к ингибитору NS5A, к ингибитору NS5B. Устойчивость к противовирусной терапии становится главной проблемой при введении пациентов с хроническими вирусными инфекциями. Чтобы достигнуть устойчивых вирусных ответов, важно использовать комбинированные терапии, особенно такие, которые направлены на различные вирусные мишениHCV. Настоящие результаты демонстрируют, что комбинированное лечение клеток с репликоном ингибитором NS5A формулы (I), протеазным ингибитором HCV NS3 формулы (II) и ингибитором NS5B формулы (III) приводит к аддитивным противовирусным эффектам. Важно отметить, что никакие антагонистические эффекты или увеличенная цитотоксичность не наблюдались ни с одной из этих комбинаций. Поэтому эти комбинации являются превосходными кандидатами на комбинационные схемы лечения у пациентов, инфицированных HCV. Для специалиста в данной области техники будет очевидно, что настоящее изобретение не ограничивается предшествующими иллюстративными примерами и что оно может быть воплощено в других конкретных формах без отступления от его существенных признаков. Поэтому желательно, чтобы примеры рассматривались во всех отношениях как иллюстративные, но не ограничительные, при этом ссылка делается предпочтительнее на приложенную формулу изобретения, а не на предшествующие примеры, и все изменения, которые подпадают под значение и диапазон эквивалентности формулы изобретения, следовательно, предполагаются охваченными ею. а ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли; терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли; терапевтически эффективное количество соединения формулы (III) или его фармацевтически приемлемой соли; и фармацевтически приемлемый носитель. 2. Композиция по п.1, в которой молярное соотношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:20:5. 3. Композиция по п.1, в которой молярное соотношение соединения формулы (I) или его фармацевтически приемлемой соли к соединению формулы (II) или его фармацевтически приемлемой соли, к соединению формулы (III) или его фармацевтически приемлемой соли составляет около 1:250:1000. 4. Способ лечения инфекции HCV у пациента, включающий введение пациенту терапевтически эффективного количества композиции по п.1.
МПК / Метки
МПК: A61K 9/00
Метки: гепатита, вируса, ингибиторов, комбинации
Код ссылки
<a href="https://eas.patents.su/13-22303-kombinacii-ingibitorov-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинации ингибиторов вируса гепатита с</a>
Предыдущий патент: Водосодержащая пестицидная суспензия
Следующий патент: Оправа для очков, масок для профессионального или спортивного применения
Случайный патент: Способ и система для обнаружения аналита












