Соль карбоновой кислоты фосфонамидного производного 2,6-диаминопурина, способы и средства для лечения новообразований и лечения злокачественных новообразований крови, набор, стерильный водный раствор и композиция
Номер патента: 16995
Опубликовано: 28.09.2012
Авторы: Чонг Ли С., Уоткинс Уильям Дж., Ли Уильям Э., Тамэс Дэниел Б., Рейзер Ханс К., Рэй Эйдриен С.
Формула / Реферат
1. Соль карбоновой кислоты соединения, охватываемого структурной формулой
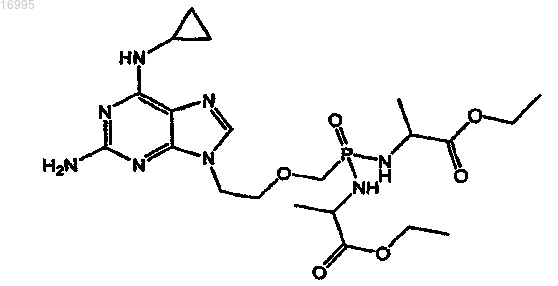
2. Соль по п.1, в которой карбоновая кислота является янтарной кислотой.
3. Стерильный водный раствор, включающий в себя соль по п.1 и углевод.
4. Способ лечения новообразований, включающий в себя введение пациенту терапевтически эффективной дозы соли по п.1.
5. Набор, содержащий контейнер, приспособленный для парентерального фармацевтического продукта, и размещенную в нем терапевтически эффективную дозу соли по меньшей мере одной карбоновой кислоты соединения, охватываемого структурной формулой
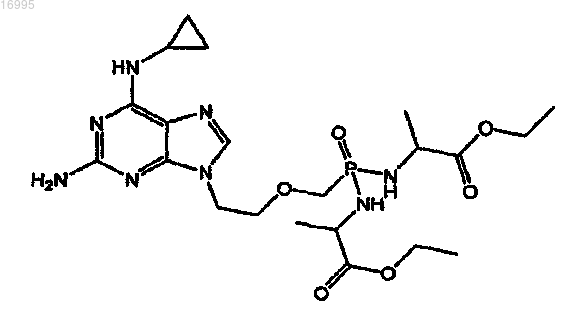
6. Набор по п.5, в котором соль карбоновой кислоты упомянутого соединения размещена, по существу, в изотоническом водном растворе.
7. Набор по п.5, в котором карбоновая кислота представляет собой янтарную кислоту.
8. Набор по п.5, в котором контейнер снабжен стерильным отверстием.
9. Набор по п.5, в котором контейнер выполнен в виде ампулы или гибкого мешка.
10. Способ лечения злокачественного новообразования крови, включающий в себя введение пациенту терапевтически эффективного количества соли карбоновой кислоты соединения, охватываемого структурной формулой
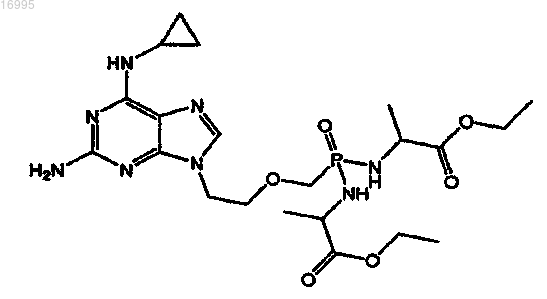
11. Способ по п.10, в котором лечат злокачественное новообразование крови, представляющее собой множественную миелому или миелодиспластический синдром.
12. Способ по п.10, в котором лечат злокачественное новообразование крови, представляющее собой лейкоз или лимфому.
13. Способ по п.10, в котором вводят соль янтарной кислоты упомянутого соединения.
14. Способ по п.10, в котором соединение вводят парентерально.
15. Фармацевтическая композиция, включающая в себя соль карбоновой кислоты соединения, охватываемого структурной формулой
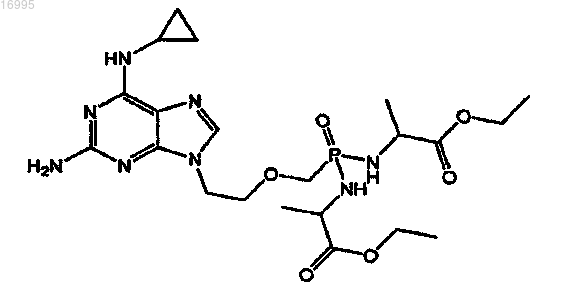
и по меньшей мере один другой агент, эффективный при лечении злокачественного новообразования крови.
16. Применение соли карбоновой кислоты соединения, охватываемого структурной формулой
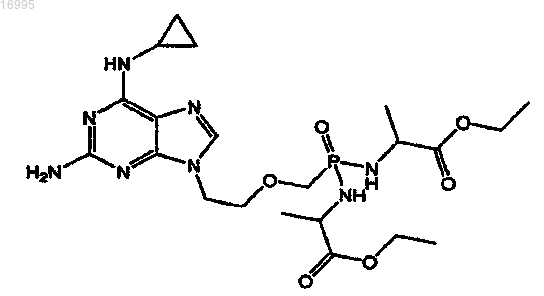
для изготовления лекарственного средства для лечения злокачественного новообразования крови.
17. Применение соли карбоновой кислоты соединения по п.1 для лечения новообразований.
18. Применение соли карбоновой кислоты соединения по п.1 для лечения злокачественного новообразования крови.
Текст
СОЛЬ КАРБОНОВОЙ КИСЛОТЫ ФОСФОНАМИДНОГО ПРОИЗВОДНОГО 2,6 ДИАМИНОПУРИНА, СПОСОБЫ И СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ И ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ КРОВИ, НАБОР,СТЕРИЛЬНЫЙ ВОДНЫЙ РАСТВОР И КОМПОЗИЦИЯ Соединение формулы (1) и/или его соли, таутомеры или сольваты применяют для лечения злокачественых заболеваний крови. В соответствии с вариантом осуществления изобретения предложена соль органической кислоты соединения (1) для общего использования при лечении новообразований. В соответствии еще с одним вариантом осуществления изобретения соль стабилизируют с помощью углевода. 016995 Область техники, к которой относится изобретение Изобретение относится к фармацевтической химии и медицине. Предложены соединения и/или его соли, таутомеры или сольваты для лечения злокачественных новообразований крови. Предложены соли органической кислоты этих соединений для общего использования при лечении новообразований. Предложены соли органической кислоты этих соединений, стабилизированные углеводом. Сведения о предшествующем уровне техники Было показано, что N6-циклопропил ФМЭДАП (9-(2-фосфонилметоксиэтил)-N6-циклопропил-2,6 диаминопурин, сокращенно - "cpr-PMEDAP", или "ЦПФМЭДАП") является эффективным, вызывая антипролиферативный эффект и индукцию дифференцировки в культуре клеток in vitro у разнообразных линий клеток опухолей (Naessens et al., Biochem. Pharmacol. 1999. Jul 15; 58(2):311-23). Тем не менее,когда ЦПФМЭДАП и другие N6-замещенные ФМЭДАП (9-(2-фосфонилметоксиэтил)-2,6-диаминопурин) соединения применяли на модели новообразования крови in vivo у инбредных крыс линииSprague-Dawley (Valerianova et al., Anticancer Res. 2001 May-Jun; 21(3B):2057-64), авторы пришли к выводу, что "ациклические нуклеозидфосфонаты, замещенные по шестому положению 2,6-диаминпуринового кольца, по-видимому, не являются многообещающими препаратами для лечения злокачественных новообразований крови" вследствие "высокой токсичности". Здесь раскрываются различные сложные эфиры бис- и моноаминокислотных сложных эфиров ЦПФМЭДАП (и их использование в качестве антипролиферативных агентов); см. WO 2005/066189. ВWO 2002/008241 раскрыт способ тестирования аналогов пролекарств метоксифосфонатнуклеотидов с пониженной токсичностью, которые эффективны при лечении злокачественных новообразований крови. Злокачественные новообразования крови общеизвестны как нарушения пролиферации клеток крови и/или их предшественников, при которых эти клетки неконтролируемо пролиферируют. Анатомически онкологию крови подразделяют на две основные группы: лимфомы - злокачественные скопления лимфоидных клеток, преимущественно, но не исключительно в лимфоузлах, и лейкозы - новообразования,которые происходят обычно из лимфоидных или миелоидных клеток и преимущественно поражающие костный мозг и периферическую кровь. Лимфомы подразделяются на болезнь Ходжкина и неходжкинские лимфомы (ЛНХ). Последняя группа включает в себя несколько различных представителей, которые различаются клинически (например, агрессивная лимфома, неактивная лимфома), гистологически (например, фолликулярная лимфома, лимфома мантийных клеток) или по происхождению злокачественных клеток (например, B-лимфоциты, T-лимфоциты). Лейкозы и родственные злокачественные новообразования включают в себя острый миелогенный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ),острый лимфобластный лейкоз (ОЛЛ) и хронический лимфобластный лейкоз (ХЛЛ). Другие злокачественные новообразования крови включают в себя дискразии плазматических клеток, в том числе множественную миелому и миелодиспластические синдромы. Хотя появление новых агентов, таких как иматиниб (Gleevec), бортезомиб (Velcade) и ритуксимаб (Rituxin), повысили частоту благоприятного исхода при нескольких злокачественных новообразованиях крови, в медицине все еще сохраняется неудовлетворенная потребность в новых эффективных способах лечения. Например, поскольку заболеваемость ЛНХ существенно возросла в США в течение последних 50 лет, в медицине существует неудовлетворенная потребность в отношении пациентов, страдающих от не поддающихся лечению рецидивов ЛНХ. Число пациентов с лейкозом ниже. Тем не менее все еще сохраняется значительная неудовлетворенная потребность, например, для лечения острого миелогенного лейкоза (ОМЛ) и хронического лимфобластного лейкоза (ХЛЛ), что иллюстрирует низкий уровень выживаемости в течение 5 лет. Существует потребность в универсальном антиметаболическом агенте с широким спектром активности и улучшенным терапевтическим диапазоном по сравнению с существующими способами лечения,который может применяться как отдельно при монотерапии, так и в комбинации с другой терапией. Большинство антиметаболических агентов взаимодействуют с ферментами, участвующими в синтезе дезоксирибонуклеиновой кислоты (ДНК), такими как ферменты, связанные с биосинтезом тимидиновых или пуриновых нуклеотидов, и/или встраиваются в состав новосинтезированной ДНК. Аналоги азотистых оснований, нуклеозидов и нуклеотидов являются важным классом эффективных цитотоксических препаратов и широко применяются для лечения лейкозов и лимфом. Некоторые из этих агентов,5-фторурацил, капецитабин и особенно гемицитабин, также применяются для лечения солидных опухолей. Три аналога аденозина, флударабин, кладрибин и клофарабин, показаны при ХЛЛ, лейкемии волосковых клеток и ОЛЛ у детей соответственно. Аналог пурина, пентостатин (2'-деоксикоформицин), ингибитор аденозин деаминазы, клинически активен против лимфоидных злокачественных новообразований. Неларабин является пролекарством аналога деоксигуанозина ara-G, который устойчив к опосредованному фосфорилазой катаболизму пуриновых нуклеозидов и активен против Т-клеточных злокачественных новообразований. Из аналогов пиримидина оценивали цитарабин (ara-C); он активен против ряда злокачественных новообразований крови и является одним из агентов, используемых при лечении острого миелогенного лейкоза.-1 016995 Тем не менее существующие способы лечения имеют ограничения, касающиеся, в частности, безопасности, эффективности и удобства применения. Способы лечения редко эффективны вначале лечения,зачастую через некоторое время происходит рецидив злокачественного новообразования крови. Следовательно, все еще сохраняется потребность в новых нуклеозидах/нуклеотидах с улучшенным терапевтическим диапазоном и/или более дешевых по сравнению с существующими соединениями этого класса. Авторы проводили поиск соединения, подходящего для лечения злокачественных новообразований крови с улучшенной фармакокинетикой (ФК) и нагрузкой, улучшенным терапевтическим диапазоном и/или со сниженной лекарственной резистентностью. В частности, было желательно идентифицировать соединение, которое накапливается в клетках крови, особенно в мононуклеарных клетках периферической крови (МКПК). Ожидается, что накопление соединения в этих целевых клетках может расширять терапевтический диапазон за счет снижения влияния соединения на другие ткани пациента. В WO 2005/066189 раскрыто соединение, имеющее структуру (1) Настоящее изобретение относится к соединению 1. Оно также относится к его диастереомеру, в котором атом фосфора замещен двумя остатками L-аланина, а также к диастереомеру, свободному отD-аминокислоты. Ранее соединения формулы 1 применяли в виде свободных оснований. Тем не менее авторы установили, что свободное основание не является коммерчески оптимальным для изготовления дозированой формы лекарственного средства, поскольку свободное основание является гигроскопичным. При этом изобретатели провели поиск формы соединения 1, упрощающей способ производства лекарственных форм. Сущность изобретения Авторы обнаружили, что природа алкильного сложного эфира на карбоксильной группе в классе сложных эфиров аминокислоты и ЦПФМЭДАП бисамидатов представляет собой инструмент для направленного распределения соединения в МКПК. Неожиданно было обнаружено, что прием бис-(этилового) сложного эфира (например, соединения 1) приводит к высокоспецифичному поглощению ЦПФМЭДАП мононуклеарными клетками периферической крови из плазмы. Такое распределение намного превосходило распределение, наблюдаемое для другого близкородственного бис-(изопропилового) сложного эфира. Кроме того, было установлено, что соли органической кислоты соединения 1 были менее гигроскопичны по сравнению со свободным основанием, таким образом облегчалось производство продуктов, содержащих соединение 1. Наконец, было установлено, что стабильность этих солей (особенно в составе парентеральных лекарственных композиций) была увеличена благодаря включению углеводов в эти лекарственные композиции. Соответственно, один вариант осуществления изобретения касается соли органической кислоты соединения 1 и/или его таутомеров и сольватов. В другом варианте осуществления изобретение относится к композиции, содержащей (а) соль органической кислоты соединения 1 и/или его таутомер и сольват и (б) углевод, тем самым стабильность при хранении соли увеличивается. В другом варианте осуществления изобретение относится к способу лечения пациента со злокачественным новообразованием крови, который включает в себя введение пациенту терапевтически эффективного количества соединения-2 016995 Следующий вариант осуществления изобретения касается набора, содержащего соединение и/или его соли, таутомеры и сольваты в контейнере, подходящем для парентерального введения соединения. В еще одном варианте осуществления изобретение относится к способу, включающему в себя изготовление стерильного водного раствора соли органической кислоты соединения и углевода и хранение указанного раствора в течение периода, превышающего 1 ч. Следующий вариант осуществления изобретения представляет собой упакованную композицию,включающую в себя стерильный водный раствор углевода и соли органической кислоты соединения: вместе с сообщением (например, вкладышем для пациента) на то, что раствор необязательно хранится дольше 1 ч. Подходящие органические кислоты для получения солей, описанных в настоящем изобретении,обычно представляют собой соединения, содержащие по крайней мере одну карбоксильную группу, в том числе аминокислоты (природные или синтетические), такие как глутаминовая или аспарагиновая кислота, и C1-16 алкил-, C1-16 арил- или C4-16 гетероарилкарбоксильные кислоты, такие как уксусная, гликолевая, молочная, пировиноградная, малоновая, глутаровая, винная, лимонная, фумаровая, янтарная, яблочная, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная, салициловая и 2-феноксибензойная кислоты, вместе с любыми их производными (включая сложные эфиры, в составе которых не остается свободного гидроксила), имеющими тот же самый корень (например, "ацетоуксусная кислота"), которые раскрыты в таблице "Физические константы органических соединений", с. 3-12 3-523, Merck Index, 74th Ed. 1993. Органические кислоты, содержащие две карбоксильные группы, представляют собой особый интерес. Применение более чем одной органической кислоты в комбинации также находится в пределах объема изобретения. Соли получали аналогично процедуре, показанной в примере 1 ниже. Обычно молярное соотношение органической кислоты и соединения 1 составляет примерно 1:1. Тем не менее, соотношение может быть больше 1 моль соединения 1 к числу кислотных групп в случае поликислот, например соотношение соединения 1 к соли составляет 2:1 для соли дикарбоксильной кислоты. Тем не менее, соотношение может изменяться в меньшую сторону до 1:1 и менее, в зависимости от наличия кислотных функциональных групп и степени его замещения кислотными функциональными группами. Лекарственные композиции с соединением 1, подходящие для использования в ветеринарии и для человека, необязательно содержат один или несколько подходящих носителей. Носитель (носители) должны быть "допустимыми" в том смысле, что они должны быть совместимы с другими ингредиентами лекарственной композиции и физиологически безвредными для пациента.-3 016995 Лекарственные композиции по выбору содержат наполнители, такие, как описаны в "Handbook ofPharmaceutical Excipients" (1986). Эксципиенты необязательно включают в себя аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА, углеводы, такие как декстрин, маннитол или декстрозу, буферы (например, цитратный буфер), соли щелочных металлов, агенты, облегчающие скольжение, наполнители и другие вещества, типично содержащиеся в таблетках, капсулах, растворах или других композициях, подходящих или предназначенных для терапевтического использования. Как правило, лекарственные композиции не содержат типичных наполнителей для таблеток, поскольку они обычно составляются для парентерального введения. Лекарственные композиции в идеале должны быть стерильны. Кроме того, композиции для парентерального введения должны быть изотоническими. pH лекарственных композиций необязательно варьирует от 5 до 10, обычно от 6 до 9, типично от 5 до 6. Парентеральные (стерильные водные) растворы солей органических кислот соединения 1 необязательно содержат стабилизирующее количество углевода, обычно сахарида (моно-, ди- или полисахарида), гликозида или углеводного спирта (альдитола). Полисахариды подвергаются биодеградации при парентеральной инъекции или инфузии и включают в себя декстрины и крахмалы, обычно содержащие 3-10 единиц. Типичные представители углеводов включают в себя гексозы, альдозы, альдогексозы, альдотриозы (например, глицеральдегид), альдотетрозы (например, эритрозу), альдопентозы (например,арабинозу), кетозы, кетогексозы (например, фруктозу), кетопентозы (например, рибулозу), мальтозу,сахарозу, лактозу, рибозу, ксилозу, луксозу, аллозу, альтрозу, глюкозу, маннозу, гулозу, идозу, галактозу и таллозу. Особый интерес представляют углеводы, условно использующиеся в парентеральных лекарственных композициях, например маннитол или декстроза. Оптические свойства углевода не являются критическими, но желательно, чтобы конфигурация была такова, чтобы углевод подвергался биодеградации при парентеральном введении. Например, 5% декстроза (по массе; pH примерно 4,2, незабуференная) обеспечивает хранение сукцината соединения 1 при 40C в течение 60 ч без значительной деградации. С другой стороны, хранение в забуференных растворах при pH 2,7 и 9 в тех же условиях приводит к значительному распаду соединения 1: около 100, 18 и 76 мас.% соответственно. Стабилизирующее количество углевода может изменяться и зависит от ожидаемых условий хранения и желаемого срока хранения, выбранного буфера, pH, количества соединения 1 и других факторов,которые оценивает производитель. Обычно используется концентрация от 0,5 до 5 мас.%. Типично оптимальное количество углевода определяется рутинным экспериментированием, но, как правило, количество не превышает (вместе с буферами, хлоридом натрия и т.п.) того количества, которое придает изотоничность раствору. Однако гиперизотонические концентрации допускаются, если ожидается, что парентеральную композицию будут разводить до или во время инфузии. Парентеральная композиция необязательно забуферена (обычно цитратным буфером) до pH от 4 до 6. Присутствие углевода стабилизирует соли соединения 1 в водном растворе для хранения (включая время введения пациенту) по крайней мере приблизительно на 60 ч, вплоть до 1 недели, 1 месяца или 1 года или в течение любого промежуточного периода, который зависит от упомянутых выше факторов для концентрации углевода, например температуры хранения и т.п. Терапевтические композиции необязательно вводят парентерально (в том числе подкожно, внутримышечно, внутривенно, внутрикожно, интратекально и эпидурально), поскольку это наиболее подходящий способ при лечении новообразований. Обычно выбирают внутривенные инфузии в качестве способа введения. Лекарственные композиции представлены в контейнерах, содержащих одну или несколько доз, например запаянные ампулы, пузырьки или гибкие мешки для инфузий. Контейнеры необязательно изготовляют из стекла или жесткого пластика, но обычно используют полужесткие или гибкие контейнеры,выполненные из полиолефинов (полиэтилена) или пластифицированного поливинилхлорида. Контейнер обычно является однокамерным. Эти контейнеры имеют по крайней мере один выполненный за одно целое стерильный порт, облегчающий стерильный ввод в контейнер устройства доступа к содержимому(обычно иглы или иглы из набора для внутривенных инъекций). Порт обеспечивает стерильный доступ для разбавления раствора (при необходимости) и выведение парентерального раствора. Контейнер необязательно выполнен имеющим внешнюю оболочку (обычно из полиолефина). Лекарственная композиция находится в контейнере в виде раствора или в сухой форме. При хранении, по существу, в безводной форме, например лиофилизированной, непосредственно перед использованием требуется только добавление стерильного жидкого носителя к лекарственной композиции, например воды для инъекции. Растворы включают в себя агенты, создающие осмотическое давление, такие как хлорид натрия, или сахар, такой как маннитол или декстроза. Неожиданным преимуществом углевода или сахара оказалось увеличение стабильности соли соединения 1 в водном растворе при хранении. Контейнеры заполняют стерильным раствором или заполняют и затем стерилизуют, например, нагреванием или химическими агентами в соответствии с известными способами. В общем, стерильным раствором лекарственной композиции стерильно заполняют гибкий контейнер и затем необязательно лиофилизируют. Подходящая технология производства контейнеров, описанных в данном изобретении, может быть найдена в Avis et al., Pharmaceutical Dosage Forms: Parenteral Medications, vols.1 and 3 (1984).-4 016995 Парентеральные контейнеры содержат дневную дозу или единицу дневной дозы соединения 1, как описано ниже, или соответствующую его фракцию. Соединение 1, соли органической кислоты соединения 1 или их водные растворы, стабилизированные углеводом, по выбору, применяют для лечения новообразования, в том числе не только злокачественных новообразований крови, но также и солидных опухолей любого типа, например головы и шеи,легких, почек, печени, костей, мозга и других, особенно рак матки и шейки матки, и дисплазии, меланомы, и рак молочной железы, прямой кишки, простаты, легких (мелкоклеточный и немелкоклеточный) и поджелудочной железы. Лекарственные композиции, описанные в данном изобретении, вводятся как отдельно в виде монотерапии, так и в комбинации с другими агентами для лечения злокачественных новообразований крови. Лекарственная композиция, описанная в данном изобретении, необязательно вводится пациенту, по существу, одновременно с другими противоопухолевыми агентами либо агенты комбинируют с лекарственной композицией, описанной в данном изобретении, которую затем единовременно вводят пациенту. Типично, противоопухолевые агенты, эффективные с соединением 1 (как в комбинации с ним в терапевтически эффективных количествах или вводимые параллельно), включают в себя любые лекарственные препараты, в настоящее время применяемые для лечения злокачественных новообразований, в том числе лекарственные препараты, используемые для лечения злокачественных новообразований крови, которые были упомянуты выше в разделе "Уровень техники". Эти сопутствующие агенты вводят (а) одновременно, но другим способом введения, (б) в комбинации с лекарственной композицией, описанной в данном изобретении, параллельно, или (в) в течение чередующихся периодов (например, в течение периода, когда соединение 1 не вводится). В общем, при использовании в комбинации лекарственную композицию,описанную в данном изобретении, терапевтически комбинируют с другим противоопухолевым агентом,который отбирают из определенного класса, например из класса моноклональных антител. Лечение НХЛ обычно включает в себя циклофосфамид, доксорубицин, винкристин, преднизон и ритуксимаб. При использовании в комбинации соединение 1 вводят в составе терапевтического курса вместе или в качестве заменяющего лекарства для одного или нескольких агентов, указанных выше. Соединение 1 также может вводиться в комбинации с ритуксимабом. Для лечения ХЛЛ соединение 1 вводится отдельно или в комбинации с другими агентами, такими как циклофосфамид и/или ритуксимаб. Другие терапевтические агенты, подходящие для использования с соединением 1, включают в себя этопозид, мелфалан, нитрозомочевину, бусульфан, комплексы платины, неклассические алкилирующие агенты, такие как прокарбазин, антиметаболиты, такие как фолаты, пурины, аналоги аденозина, аналоги пиримидина, алкалоиды барвинка и др. На основании изучения токсичности однократной дозы на собаках справедливо полагать, что доза соединения 1 от 1 до 3 мг/кг/день или выше, до примерно 10 мг/кг/день будет эффективной для собак(при использовании соли органической кислоты соединения 1 доза должна быть скорректирована с учетом дополнительного веса соли). Допуская, что фармакокинетический профиль соединения у человека похож на профиль, полученный для собак, в настоящее время данные позволяют предложить эффективную для человека дозу соединения 1 (скорректированная для площади поверхности посредством фактора, равного 0,54) от 0,54 до 1,62 мг/кг внутривенно или больше, которая вводится за один раз; введение дозы повторяют с интервалами примерно от 1 до 14 дней, как правило, один раз в неделю или каждые 2 недели, типично - еженедельно по 2 дозы в зависимости от состояния пациента и переносимости инфузий среди прочих факторов. Поскольку следует ожидать значительных изменений подходящих доз из-за уникальной природы рака каждого пациента, состояния пациента, переносимости пациента и других причин, известных любому онкологу, то интервал эффективных доз будет шире, чем в экспериментальной модели. Таким образом, ожидается, что интервал доз от 0,5 до 5,4 мг/кг в день будет подходить для лечения. Для лечения подходит единичная доза, но ожидается, что типичными будут многократные циклы введения дозы, которые также зависят от состояния пациента и переносимости лечения, что будет очевидно профессионалу. Все цитаты выше и далее из литературы и патентов включены посредством ссылок. Изобретение описано в достаточных деталях, чтобы специалист мог получить и использовать объект нижеприведенной формулы изобретения.-5 016995 Сведения, подтверждающие возможность осуществления изобретения Следующие примеры иллюстрируют настоящее изобретение, но не ограничивают объем притязаний. Пример 1. Смесь ЦПФМЭДАП (1,64 г, 5 ммоль), гидрохлорида аланилэтилового сложного эфира (4,62 г,30 ммоль) и триэтаноламина (8,36 мл, 60 ммоль) обрабатывали 10 мл безводного пиридина и нагревали до 60C, чтобы получить гомогенный раствор. Добавляли раствор алдритиола-2 (7,78 г, 35 ммоль) и трифенилфосфина (9,18 г, 35 ммоль) в 10 мл безводного пиридина. Образовавшуюся смесь инкубировали при 60C в течение ночи. После остывания ярко-желтый раствор вливали в насыщенный водный раствор бикарбоната натрия и экстрагировали этилацетатом. Органическую фазу отмывали рассолом, затем высушивали над сульфатом натрия. После удаления растворителя сырой осадок очищали хроматографией 100%-ным этилацетатом, целевой продукт элюировали 10-15% MeOH/DCM (1,12 г, выход 43%). Образование сукцината. Нейтральное пролекарство (2,60 г) растворяли в растворе янтарной кислоты (583 мг) в этаноле(15 мл). Затем добавляли 50% об./об. н-гептана в этаноле (20 мл), целевую соль выделяли фильтрованием(9-(2-фосфонилметоксиэтил)гуанина) и ФМЭДАП (9-(2-фосфонилметоксиэтил)-2,6-диаминопурина). Также был проанализирован спектр соединений, которые используют для лечения злокачественных новообразований крови, в частности ингибитор ДНК-полимеразы (ara-C), ингибиторы ДНКполимераз/редуктаз рибонуклеотидов (кладрибин, слофарабин, флударабин, гемцитабин), ингибитор деаминазы аденозина (деоксикоформицин), ингибитор ДНК-метилазы (децитабин), алкилирующий ДНК агент (доксорубицин) и ингибитор митоза (винкристин). Все соединения, за исключением доксорубицина и винкристина, являются аналогами нуклеозидов; ara-C, гемцитабин и децитабин являются аналогами цитозина, а остальные соединения являются аналогами аденозина. ЦПФМЭДАП и ФМЭГ могут считаться аналогами аденозина и гуанозина соответственно. Соединения были испытаны на лимфобластах человека и собаки (стимулированных T-клеточным митогеном фитогемагглютинина (ФГА) или B-клеточным митогеном фитолакки американской), на двух линиях T-лимфоидных клеток, полученных от пациентов с острым лимфоцитарным лейкозом (CEM и Molt-4), на двух линиях миелоидных клеток, полученных от пациентов с острым миелогенным лейкозом (KG-1 и HL-60), на двух линиях B-лимфоидных клеток, полученных из лимфомы Беркитта (Daudi и Raji), на линии B-лимфоидных клеток из неходжкинской лимфомы (RL), на линии T-лимфоидных клеток из T-лимфомы кожи (РМ-1) и на линии клеток моноцитов из гистиоцитарной лимфомы (U937).-6 016995 Соединение 1 проявляет антипролиферативную активность на различных клеточных линиях лимфобластов и клеток при лейкозе/лимфоме. Его EC50 колеблется от 27 до 1043 нМ, подобно клофарабину(25-418 нМ) и ara-C (23-1820 нМ), два аналога нуклеозидов обычно применяются для лечения злокачественных новообразований крови. Среди других нуклеозидов гемцитарабин был наиболее сильнодействующим (3,4-18 нМ), а деоксикоформицин был наименее сильнодействующим (200000 нМ). Среди всех соединений винкристин (0,6-5,3 нМ) был наиболее сильнодействующим. Не наблюдалось значительных различий активности соединения 1 в клетках человека и собаки. Кроме того, не наблюдалось различий между РНА-бластами (преимущественно T-клетки) и PWM-бластами (преимущественно В-клетки) или между T-лимфоидными и B-лимфоидными линиями клеток. Таким образом, в отличие от других аналогов гуанозина неларабин, который является единственным эффективным препаратом против Т-клеточных лимфом, соединение 1 может быть эффективным против и T-, и В-клеточных лимфом. С большинством проанализированных типов клеток ЦПФМЭДАП, являющийся продуктом гидролиза соединения 1, был значительно менее сильнодействующим, чем соединение 1, что позволяет предположить, что фосфорамидатное пролекарство усиливает накопление препарата клетками и что пролекарство расщепляется внутри клеток. ФМЭГ, продукт дезаминирования ЦПФМЭДАП, был значительно более сильнодействующим, чем деалкилированный продукт - ФМЭДАП, что согласуется с гипотезой,что активная молекула, обладающая антипролиферативной активностью в соединении 1, представляет собой ФМЭГ-дифосфат. Таблица 1 Антипролиферативные EC50 (нМ) в лимфобластах человека, в лимфобластах собаки и в линиях клеток человека, полученных от пациентов с лейкемией/лимфомой РНА-лимфобласты получали трехдневной инкубацией мононуклеарных клеток периферической крови (МКПК) с РНА-митогеном Т-клеток (1 мкг/мл), затем инкубировали с 10 ед/мл интерлейкина-2 дольше 4 дней. PWM-лимфобласты получали инкубацией В-клеток (очищенных от МКПК с помощью магнитных бусин, конъюгированных с CD19) с PWM (20 мкг/мл) в течение 7 дней. Лимфобласты (150000 клеток на ячейку микротитровального планшета) инкубировали с сериями пятикратных разведений соединений в течение 3 дней. Бромодеоксиуридиновый анализ (BrdU) проводили следующим образом: лимфобласты инкубировали с сериями пятикратных разведений соединений в микротитровальных планшетах (150000 клеток на ячейку) в течение 3 дней. На 3 день клетки метили при помощи 10 мкл BrdU в течение 3 ч, количество BrdU, присоединившегося к ДНК клеток, определяли твердофазным иммуноферментным анализом (ИФА). С другой стороны, клетки инкубировали с 1 мг/мл реагента ХТТ (натрий 3,3'-[1-[(фениламино)карбонил]-3,4-тетразолиум]-бис-(4-метокси-6-нитро)бензолсульфоновой кислоты гидрата) и 1% ФМС (феназин метосульфат) в течение 2 ч и учитывали изменение цвета (дегидрогеназа из митохондрий восстанавливает желтый XTT до оранжевой соли формазана). Экспериментальные данные были использованы для построения S-образных кривых доза-эффект в зависимости от дозы и значения 50% эффективной концентрации (EC50) были вычислены с помощью программного обеспечения GraphPad Prism версии 4.00 для Windows (GraphPad Software, San DiegoCalifornia USA). Тесты повторяли 2-20 раз до тех пор, пока стандартная ошибка значения не становилась менее 50% среднего значения. В большинстве случаев тесты повторяли 2-20 раз до тех пор, пока стандартная ошибка измерения(SEM) не становилась менее 50% среднего значения.Вариабельные данные (SEM0,5 среднего EC50). ND - не выполнено.-9 016995 Пример 3. Распределение пролекарства между МКПК и плазмой у собак. Собакам вводили различные варианты пролекарства ЦПФМЭДАП в виде внутривенных инфузий в течение 30 мин 0,2 мг/кг. Пролекарства 1-4 представляли собой моноамидаты (фосфор также замещался феноксирадикалом), тогда как последние два соединения представляли собой бис-(амидаты). СоединенияA и B представляли собой главным образом выделенные энантиомеры, у которых хиральным центром является атом фосфора, тогда как моно(трет-бутиловый эфир аланина) представлял собой рацемат. Использовали L-изомер аланина. Кровь собирали в калий-ЭДТА и разделяли при помощи центрифугирования. Мононуклеарные клетки периферической крови (МКПК) отбирали при помощи CPT-пробирок (цитрат натрия). Для анализа образцы плазмы осаждали, добавляя 100 мкл ацетонитрила, содержащего внутренний стандарт (D4AP и TDF) к 100 мкл плазмы для анализа пролекарства. После осаждения белка при помощи центрифугирования 100 мкл переносили в другую пробирку и высушивали, затем растворяли в 100 мкл воды с 0,2% муравьиной кислоты. Аликвоту объемом 20 мкл наносили на колонку для ЖХ/МС/МС анализа (жидкостная хроматография/тандемная масс-спектрометрия). Анализ проводили при помощи 150 2,0 мм, 4 мкл колонки Synergi Fusion-RP 80A (Phenomenex) и многоступенчатого линейного градиента от 0,5 до 99% ацетонитрила в присутствии 0,2% муравьиной кислоты со скоростью 0,25 мл/мин. Анализируемые вещества детектировали при помощи масс-спектрометра Sciex API-4000, электроионизацию осуществляли MRM-положительным способом. Образцы анализировали на содержаниеGS-327260, -8369, -0573 и -0438. Образцы МКПК лизировали 70%-ным метанолом. Для доводки количества клеток в каждом образце использовали отдельные аликвоты клеток, ресуспендированные в 100%-ной сыворотке из каждой точки времени. Образцы клеток нормализировали так, чтобы образец содержал 1,5106 клеток в образце. Наблюдали различные уровни гемолиза. 70%-ный метанол, содержащий экстрагированный клеточный материал, разделяли для прямых анализов и дефосфорилирования и высушивали отдельно. После высушивания образцы для прямого анализа ресуспендировали в 20% ацетонитриле, содержащем внутренние стандарты (TDF и D4AP), и анализировали на содержание GS-327260, -8369. 20 мкл наносили на колонку 502,0 мм, 4 мкл Synergi Fusion-RP 80A (Phenomenex) для анализа ЖХ/МС/МС в многоступенчатом линейном градиенте от 0 до 95% ацетонитрила в присутствии 0,2% муравьиной кислоты со скоростью 1,0 мл/мин. Анализируемые вещества детектировали с помощью масс-спектрометраSciex API-4000 при помощи электроионизации MRM-положительным способом. После высушивания образцы для дефосфорилирования обрабатывали 1 ед кишечной фосфатазы теленка (щелочной фосфатазой, Sigma) 2 ч в буфере от производителя. Образцы затем доводили до 60% сухого ацетонитрила, ресуспендировали в 60%-ном ацетонитриле, содержащем внутренние стандарты(TDF и D4AP), и анализировали содержание ЦПФМЭДАП, как описано для прямого анализа МКПК.- 10016995 Таблица 2 Сравнение воздействия ЦПФМЭДАП (cpr-PMEDAP) на плазму и МКПК после введения пролекарства собаке породы бигль посредством 30-минутной внутривенной инфузииBLOQ - ниже минимального порога чувствительности. Для ЦПФМЭДАП в плазме это значение составляло 20 нМ.ND - не определяли. Образцы МКПК не отбирали при введении соединения 4. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль карбоновой кислоты соединения, охватываемого структурной формулой 2. Соль по п.1, в которой карбоновая кислота является янтарной кислотой. 3. Стерильный водный раствор, включающий в себя соль по п.1 и углевод. 4. Способ лечения новообразований, включающий в себя введение пациенту терапевтически эффективной дозы соли по п.1. 5. Набор, содержащий контейнер, приспособленный для парентерального фармацевтического продукта, и размещенную в нем терапевтически эффективную дозу соли по меньшей мере одной карбоновой кислоты соединения, охватываемого структурной формулой 6. Набор по п.5, в котором соль карбоновой кислоты упомянутого соединения размещена, по существу, в изотоническом водном растворе. 7. Набор по п.5, в котором карбоновая кислота представляет собой янтарную кислоту. 8. Набор по п.5, в котором контейнер снабжен стерильным отверстием. 9. Набор по п.5, в котором контейнер выполнен в виде ампулы или гибкого мешка.- 11016995 10. Способ лечения злокачественного новообразования крови, включающий в себя введение пациенту терапевтически эффективного количества соли карбоновой кислоты соединения, охватываемого структурной формулой 11. Способ по п.10, в котором лечат злокачественное новообразование крови, представляющее собой множественную миелому или миелодиспластический синдром. 12. Способ по п.10, в котором лечат злокачественное новообразование крови, представляющее собой лейкоз или лимфому. 13. Способ по п.10, в котором вводят соль янтарной кислоты упомянутого соединения. 14. Способ по п.10, в котором соединение вводят парентерально. 15. Фармацевтическая композиция, включающая в себя соль карбоновой кислоты соединения, охватываемого структурной формулой и по меньшей мере один другой агент, эффективный при лечении злокачественного новообразования крови. 16. Применение соли карбоновой кислоты соединения, охватываемого структурной формулой для изготовления лекарственного средства для лечения злокачественного новообразования крови. 17. Применение соли карбоновой кислоты соединения по п.1 для лечения новообразований. 18. Применение соли карбоновой кислоты соединения по п.1 для лечения злокачественного новообразования крови.
МПК / Метки
МПК: A61K 31/00, C07F 9/6561, A61P 35/00
Метки: соль, способы, 2,6-диаминопурина, средства, стерильный, производного, крови, лечения, раствор, карбоновой, водный, кислоты, композиция, фосфонамидного, злокачественных, новообразований, набор
Код ссылки
<a href="https://eas.patents.su/13-16995-sol-karbonovojj-kisloty-fosfonamidnogo-proizvodnogo-26-diaminopurina-sposoby-i-sredstva-dlya-lecheniya-novoobrazovanijj-i-lecheniya-zlokachestvennyh-novoobrazovanijj-krovi-nabor-st.html" rel="bookmark" title="База патентов Евразийского Союза">Соль карбоновой кислоты фосфонамидного производного 2,6-диаминопурина, способы и средства для лечения новообразований и лечения злокачественных новообразований крови, набор, стерильный водный раствор и композиция</a>
Предыдущий патент: Буровое лопастное долото
Следующий патент: Устройство для выполнения инъекций с демпфирующим средством на спусковой кнопке
Случайный патент: Способ получения p4o6 с высоким выходом












