Новое применение пептидных соединений для лечения боли при болезненной диабетической нейропатии
Формула / Реферат
1. Применение соединения, имеющего формулу (IIb)
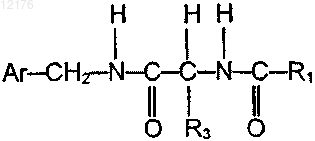
где Ar представляет собой фенил, который является незамещенным или замещенным по меньшей мере одним галогеном;
R3 представляет собой -СН2-Q, где Q представляет собой алкокси, содержащий 1-6 атомов углерода, и
R1 представляет собой алкил, содержащий 1-6 атомов углерода,
или его фармацевтически приемлемой соли для приготовления фармацевтической композиции для профилактики, облегчения и/или лечения боли, ассоциированной с болезненной диабетической нейропатией.
2. Применение по п.1, где Ar представляет собой незамещенный фенил.
3. Применение по п.1, где галоген представляет собой фтор.
4. Применение по п.1, где соединение формулы (IIb) представляет собой (R)-2-ацетамидо-N-бензил-3-метоксипропионамид или его фармацевтически приемлемую соль.
5. Применение О-метил-N-ацетил-D-серин-м-фторобензиламида; О-метил-N-ацетил-D-серин-п-фторобензиламида; N-ацетил-D-фенилглицинбензиламида; D-1,2-(N,О-диметилгидроксиламино)-2-ацетамидоуксусной кислоты бензиламида или D-1,2-(О-метилгидроксиламино)-2-ацетамидоуксусной кислоты бензиламида для приготовления фармацевтической композиции для профилактики, облегчения и/или лечения боли, ассоциированной с болезненной диабетической нейропатией.
6. Применение по любому из предшествующих пунктов, где соединение является, по существу, энантиомерно чистым.
7. Применение по любому из предшествующих пунктов, где боль, ассоциированная с болезненной диабетической нейропатией, представляет собой боль, ассоциированную с диабетической периферической сенсорной полинейропатией.
8. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения дозами соединения по меньшей мере 100 мг/день, предпочтительно по меньшей мере 200 мг/день, более предпочтительно по меньшей мере 300 мг/день и наиболее предпочтительно по меньшей мере 400 мг/день.
9. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения дозами соединения максимально 6 г/день, предпочтительно максимально 3 г/день, более предпочтительно максимально 1 г/день и наиболее предпочтительно максимально 400 мг/день.
10. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения увеличивающимися ежедневными дозами до тех пор, пока не достигается предварительно определенная ежедневная доза, которая поддерживается во время дальнейшего лечения.
11. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения тремя дозами в день, предпочтительно двумя дозами в день, более предпочтительно одной дозой в день.
12. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для введения, приводящего к достижению концентрации соединения в плазме крови 0,1-15 мкг/мл и максимально 5-18,5 мкг/мл (пик), рассчитанной в качестве среднего для множества леченых субъектов.
13. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения по меньшей мере в течение одной недели, предпочтительно по меньшей мере в течение двух недель, более предпочтительно по меньшей мере в течение четырех недель и наиболее предпочтительно в течение по меньшей мере восьми недель.
14. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для орального введения.
15. Применение по любому из предшествующих пунктов, где фармацевтическая композиция полезна для профилактики, облегчения и/или лечения состояния, ассоциированного с болезненной диабетической нейропатией, что представляет собой среднюю ежедневную боль, общую боль, интенсивность присутствующей боли, боль, препятствующую сну, восприятие субъектом боли, влияющей на общую активность, общее впечатление субъекта об изменении боли, общее клиническое впечатление об изменении боли, восприятие субъектом различных качеств нейропатической боли, качество жизни и доля дней без боли.
16. Применение по любому из предшествующих пунктов, где болезненная диабетическая нейропатия ассоциирована с сахарным диабетом типа I или типа II, предпочтительно с сахарным диабетом типа II.
17. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для ведения млекопитающему.
18. Применение по п.17, где фармацевтическая композиция приготавливается для введения людям.
Текст
012176 Область техники, к которой относится изобретение Настоящее изобретение направлено на применение класса пептидных соединений для лечения боли при болезненной диабетической нейропатии, предпочтительно при диабетической периферийной сенсорной нейропатии. Уровень техники Известно, что определенные пептиды проявляют активность в центральной нервной системе (ЦНС) и полезны при лечении эпилепсии и других заболеваний ЦНС. Эти пептиды, описанные в патенте США 5378729, имеют формулу (Ia) где R - это водород, низший алкил, низший алкенил, низший алкинил, арил, арил низший алкил, гетероциклил, гетероциклил низший алкила, низший алкил гетероциклил, низший циклоалкил, низший циклоалкил низшего алкила, и R является незамещенным или замещенным по меньшей мере одной электроноакцепторной или электронодонорной группой;R1 - это водород или низший алкил, низший алкенил, низший алкинил, арил низший алкил, арил,гетероциклил низший алкил, гетероциклил, низший циклоалкил, низший циклоалкил низший алкил, каждый из которых не замещен или замещен электронодонорной или электроноакцепторной группой; иR2 и R3 - это независимо водород, низший алкил, низший алкенил, низший алкинил, арил низший алкил, арил, гетероциклил, гетероциклил низший алкил, низший алкил гетероциклил, низший циклоалкил, низший циклоалкил низший алкил или Z-Y, где R2 и R3 могут быть незамещенными или замещенными, по меньшей мере, одной электронодонорной или электроноакцепторной группой;Y - это водород, низший алкил, арил, арил низший алкил, низший алкенил, низший алкинил, галоген, гетероциклил, гетероциклил низший алкил, и Y может быть незамещенным или замещенным электронодонорной или электроноакцепторной группой, при условии, что когда Y является галогеном, Z является химической связью или,ZY, взятые вместе, - это NR4NR5R7, NR4OR5, ONR4R7, OPR4R5, PR4OR5, SNR4R7, NR4SR7, SPR4R5 или PR4NR5R7, Р 4, R5 и R6 - это независимо водород, низший алкил, арил, арил низший алкил, низший алкенил или низший алкинил, где R4, R5 и R6 могут быть незамещенными или замещенными электроноакцепторной или электронодонорной группами; и и R7 - это R6 или COOR8 или COR8;R8 - это водород или низший алкил, или арил низший алкил, и арильная или алкильная группа может быть незамещенной или замещенной электроноакцепторной или электронодонорной группой; иn-это 1-4; и а-это 1-3. Патент США 5773475 раскрывает также дополнительные соединения, полезные для лечения расстройств ЦНС. Эти соединения являются N-бензил-2-амино-3-метоксипропионамидом, имеющим формулу (IIa): где Ar - это арил, который не замещен или замещен галогеном;R3 - это низший алкокси иR1 - это метил. Таким образом, патенты США 5378729 и 5773475 включены сюда путем отсылки. Однако ни один из этих патентов не описывает применение этих соединений как специфических анальгетиков для лечения боли при болезненной диабетической нейропатии, особенно при диабетической периферической сенсорной нейропатии. Клинически случаи нейропатической боли широко распространены и включают боли при травме и заболеваниях. Различные нейропатические синдромы (подобно диабетической нейропатии, постгерпетической невралгии, тригеминальной невралгии, постоперационной боли, посттравматической боли, боли при СПИДе, боли при раке и тому подобное) имеют различные механизмы и патофизиологию. Таким образом, знания о лечении, например, индуцированной травмой нейропатической боли не приводят к-1 012176 появлению способов лечения нейропатической боли, вызванной заболеванием.WO 02/074297 относится к применению соединения, соответствующего формуле (IIа), где Ar - это фенил, который может быть замещен по меньшей мере одним галогеном, R3 - это низший алкокси, включающий 1-3 атома углерода, и R1 - это метил, для приготовления фармацевтических композиций, полезных для лечения аллодинии, как основного заболевания и уникального болевого синдрома, не зависимого от природы и основного заболевания, но часто относящегося к периферической нейропатической боли.WO 02/074297 основан на результатах, полученных на моделях периферической нейропатической боли, являющейся следствием травмы, у животных (модель Чанга, модель Беннетта). WO 02/074297 не раскрывает специфических моделей индуцированной заболеванием (то есть, диабетической) нейропатической боли на животных. Модель периферической нейропатической боли Чанга основана на плотных лигатурах спинно-мозговых нервов у крыс, либо спинно-мозговых нервов L5, либо L5 и L6 (Kim andChang, 1992, Pain 50:355-363), либо у приматов (L7). В модели Беннетта (Bennett and Xie 1988, Pain 33:87107, Bennett 1993, Muscle Nerve 16:1040-1048) мононейропатия обеспечивается путем размещения четырех слабо сдавливающих лигатур вокруг общего седалищного нерва. После этой лигатуры в ответ на вредные тепловые стимулы, горчичное масло и механические стимулы развивается гиперальгезия. Процент диабетических пациентов, страдающих от аллодинии, является относительно небольшим по сравнению с пациентами, у которых аллодиния развивается в ответ на постгерпетическую или посттравматическую невралгию. Таким образом, модели на животных, примененные в патенте WO 02/074297, не подходят в качестве моделей индуцированной заболеванием (диабетической) невропатической боли, например, для идентификации соединений, обеспечивающих профилактику, облегчение или/и лечение диабетической нейропатической боли. В частности, эта модель не подходит для идентификации эффективной дозировки и концентраций этих соединений в плазме крови у человека для профилактики, облегчения или/и лечения диабетической нейропатической боли.WO 02/15922 описывает оценку (2R)-(2-ацетиламино)-N-[(4-фторофенил)метил]-3-метоксипропанамида в модели периферической нейропатической боли Чанга. Подобно WO 02/074297 этот документ не раскрывает специфических исследований моделей нейропатической боли, индуцированной заболеванием(диабетической), на животных. В патенте WO 02/15922 не раскрываются соединения, полезные для профилактики, облегчения или/и лечения диабетической нейропатической боли. Изобретатели настоящего изобретения опубликовали первоначальные результаты применения SPM 927 в лечении диабетической нейтропатии, показывающие, что SPM 927 является превосходным (по сравнению с плацебо) препаратом для снижения ежедневной оценки боли пациентом (Hovinda, IDrugs 2003, 6(5):479-485). Однако эффективная схема лечения и дозировки не были раскрыты. Кроме того, нет указаний, от какого типа или стадии диабета страдал пациент. Изобретатели настоящего изобретения опубликовали также открытое исследование 25 пациентов с(McCleane et al., Neuroscience Letters 352 (2003), 117-120). Результатом этого исследования было заключение, что SPM 927 может оказывать анальгезирующее действие на нейропатическую боль у человека. Поскольку это исследование не включало пациентов с диабетической нейропатией, не было собрано информации о популяции этих пациентов. Как было упомянуто выше, различные типы нейропатической боли имеют в основе различную патофизиологию.WO 02/074784 относится к применению соединения с формулой (Ia) или/и формулой (IIa), имеющего антиноцицептивные свойства, для лечения различных типов и симптомов острой и хронической боли,особенно ненейропатической воспалительной боли, например, боли при ревматоидных артритах или/и вторичной воспалительной остеоартритной боли. Боль является субъективным опытом, и восприятие боли осуществляется в определенных частях центральной нервной системы (ЦНС). Обычно вредные (периферические) стимулы передаются в ЦНС заблаговременно, но боль не всегда ассоциирована с ноцицепцией. Существует значительное разнообразие различных типов клинической боли, которая возникает благодаря различным патофизиологическим механизмам, лежащим в их основе, вследствие чего нужны различные подходы к лечению. Восприятие боли может характеризоваться тремя основными типами клинической боли: острая боль,хроническая боль - нейропатическая боль. Острая клиническая боль может возникать, например, в результате воспаления или повреждения мягких тканей. Этот тип боли является адаптивным и обладает важной биологической функцией предупреждения или излечения и заживления уже поврежденной части тела, для того чтобы она стала неповрежденной. Защитная функция достигается путем создания поврежденной/воспаленной области и окружающей ткани, обладающей гиперчувствительностью ко всем стимулам, так что устраняется контакт с любым наружным стимулом. Нейрональные механизмы, лежащие в основе этого типа клинической боли,достаточно хорошо понятны, и возможен эффективный фармакологический контроль острой клинической боли благодаря применению, например, как нестероидных противовоспалительных лекарственных средств (NSAID), так и опиоидов, в зависимости от типа и интенсивности ощущения.-2 012176 Хроническая клиническая боль проявляется в виде постоянных сенсорных аномалий, возникающих в результате существующей периферической патологии, такой как рак или хроническое воспаление (например, артрит), или она может быть независима от инициировавшего ее стимула. Последняя, будучи неспособной к адаптации к окружающей обстановке, не дает преимуществ для выживания и очень часто для нее не имеется доступного эффективного лечения. Существует несколько причин нейропатии человека со значительной вариабельностью в симптомах и нейрологических дефицитах. Болезненные нейропатиии определяются как нейрологические расстройства, характеризующиеся стойкостью боли и гиперчувствительностью в области тела, сенсорная иннервация которой была повреждена, но повреждение сенсорных нервов не всегда приводит к нейропатической боли, обычно наблюдается скорее потеря чувствительности, а не гиперчувствительность или боль. Нейропатическая боль может быть классифицирована как периферическая и центральная нейропатическая боль. Периферическая нейропатическая боль вызывается повреждением или инфекцией периферических сенсорных нервов, в то время как центральная нейропатическая боль вызывается повреждением ЦНС или/и спинного мозга. Как периферическая, так и центральная нейропатическая боль может иметь место без очевидного первоначального повреждения нервов. Обычные анальгетики, подобные опиоидам и нестероидным противовоспалительным средствам(NSAID), лишь несколько улучшают хронические аномальные болевые синдромы, такие как периферическая или центральная нейропатическая боль, что обусловлено недостаточной эффективностью или ограниченными побочными эффектами. В поисках альтернативных режимов лечения для получения удовлетворительного и продолжительного устранения боли были опробованы кортикостероиды, блокада проводимости, глицерин, антидепрессанты, локальные анестетики, ганглиозиды и электростимуляция, но полезными против различных типов периферической нейропатической боли оказались только антиконвульсанты. Подгруппа пациентов с нейропатической болью отвечает на опиоиды. Габапентин или прегабалин эффективны для снижения боли у пациентов с диабетической нейропатией. Однако прегабалин,например, приводит к увеличению веса пациентов с диабетом типа I или типа II за счет образования отека. Увеличение веса является установленным фактором риска для сердечно-сосудистых заболеваний, в частности, у пациентов с диабетом типа II. Механизмы нейропатической боли у пациентов с диабетом недостаточно исследованы. В настоящее время для лечения применяется множество фармакологических, хирургических, физических и психологических подходов. Однако доказательства для многих из этих типов лечения все еще ограничены. Боль, возникающая при диабетической сенсорной нейропатиии, является наиболее общей формой диабетической нейропатии. Обычно она имеет коварное начало. Преобладающая боль может сопровождаться потерей температурной и тактильной чувствительности. По качеству боль обычно ноющая, пощипывающая или обжигающая, с приступами и часто наиболее мучительная по ночам. Боль ощущается преимущественно в нижних конечностях, однако она появляется также в верхних конечностях и туловище. Если общую гиперактивность и неуправляемый низкий порог активации сенсорных нейронов рассматривать как один из основных симптомов нейропатии, а ощущение нейропатической боли со значительной механоаллодинией - как наиболее существенный клинический симптом, то избирательное ингибирование этого патофизиологического события вместо общего ингибирования высокого порога вредных стимулов (путем применения, например, локальных анестетиков) нормальной сенсорной ноцицепции обеспечивает значительные преимущества. До настоящего времени не было сообщений о применении соединений формулы (Ib) или/и формулы (IIb) для лечения боли при болезненной диабетической нейропатиии. Таким образом, настоящее изобретение относится к применению названных соединений формулы (IIb) для приготовления фармацевтической композиции изобретения, облегчения или/и лечения диабетической боли, такой как боль, ассоциированная со всеми типами болезненной диабетической нейропатиии, особенно, но не ограничиваясь этим, для профилактики, облегчения или/и лечения боли, ассоциированной с диабетической периферической сенсорной полинейропатией. Предпочтительно, болезненная диабетическая нейропатия ассоциирована с сахарным диабетом типа I или типа II, более предпочтительно с сахарным диабетом типа II. Неожиданно применение соединений (IIb), в частности, R-2-ацетамид-N-бензил-3-метоксипропионамида (SPM 927) в рандомизированном двойном слепом плацебо-контролируемом исследовании продемонстрировало статистически значимую и клинически существенную эффективность в снижении боли у субъектов с болезненной диабетической нейропатией. Ранее исследование диабетической нейропатии ни у человека, ни у животных не проводилось. В первый раз установлено эффективное воздействие SPM 927 на диабетическую нейропатическую боль у человека. Пациенты, включенные в исследование, испытывали клинически диагностируемую боль, относящуюся к периферической сенсорной полинейропатии, и имели диагноз сахарный диабет типа I или типа II. У пациентов был хороший или прекрасный контроль диабета, который был оптимизирован, по меньшей мере, в течение 3 месяцев до начала исследования. Неожиданно SPM 927 не вызывал увеличения веса у пациентов с сахарным диабетом типа I или типа II, что особенно важно для лекарственных средств, вводимых пациентам с сахарным диабетом типа II. Увеличение веса или/и тучность (которые могут быть вызваны лекарственными средства-3 012176 ми) являются установленными факторами риска для сердечно-сосудистых заболеваний (Schernthaner 1996, Diabetes Res. Clin. Pract. 1996, 31 :S3-S13), особенно у пациентов с сахарным диабетом типа II. В частности, при сравнении с диабетическими пациентами, получавшими плацебо, диабетические пациенты, получавшие соединения (IIb), в частности SPM 927, ощущали пониженную среднюю дневную боль, общую боль, интенсивность присутствующей боли и боли, препятствующую сну. Лечение SPM 927 было ассоциировано с улучшением восприятия субъектами боли, препятствующей общей активности,общего впечатления пациентов об изменении боли, клинического общего впечатления об изменении боли, восприятия пациентами различных качеств нейропатической боли, качества жизни и доли дней без боли. Анализ данных о безопасности не выявил серьезных проблем. В частности, не наблюдалось препятствий для лечения, связанного с контролем диабета. Изобретение применимо к животным, в частности млекопитающим, включая людей. Соединение в соответствии с изобретением является полезным для профилактики, облегчения или/и лечения боли, ассоциированной с болезненной диабетической нейропатией, особенно ассоциированной с диабетической периферической сенсорной нейропатией или/и для профилактики, облегчения или/и лечения болезненных состояний, ассоциированных с болезненной диабетической нейропатией, что проявляется, например, в виде средней дневной боли, общей боли, интенсивности представленной боли,боли, препятствующей сну, ощущения субъектами боли, препятствующей основной активности, общего впечатления пациентов об изменении боли, клинического общего впечатления об изменении боли, восприятия субъектами различных качеств нейропатической боли, качества жизни и доли дней без боли,имеет общую формулу где Ar - это фенил, который является незамещенным или замещенным, по меньшей мере одним галогеном; R3- это -СН 2-Q, где Q - это низший алкокси; и R1- это низший алкил, в особенности, метил. Настоящее изобретение направлено также на фармацевтическую композицию, включающую соединение в соответствии с формулой (IIb), полезную для профилактики, облегчения или/и лечения боли,ассоциированной с болезненной диабетической нейропатией, главным образом, ассоциированной с диабетической периферической сенсорной полинейропатией или/и для профилактики облегчения или/и лечения болезненных состояний, ассоциированных с болезненной диабетической нейропатией, что выражается, например, в средней дневной боли, общей боли, интенсивности представленной боли, боли, препятствующей сну, ощущения субъектами боли, препятствующей основной активности, общего впечатления пациентов об изменении боли, клинического общего впечатления об изменении боли, ощущения субъектами различных качеств нейропатической боли, качества жизни и доли дней без боли, и на приготовление названной фармацевтической композиции. Предпочтительно болезненная диабетическая нейропатия ассоциирована с сахарным диабетом типа I и II, более предпочтительно с сахарным диабетом типа II. Соединения формулы (Ia) описаны в патенте США 5378729, содержание которого включено сюда путем отсылки. Группы низший алкил, когда этот термин применяется отдельно или в комбинации с другими группами, представляют собой низший алкил, включающий от 1 до 6 атомов углерода, главным образом,от 1 до 3 атомов углерода, и могут быть с линейной или разветвленной цепью. Эти группы включают метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, амил, гексил и подобное. Группы низший алкокси представляют собой низший алкокси, включающий от 1 до 6 атомов углерода, главным образом, от 1 до 3 атомов углерода, и могут быть с линейной или разветвленной цепью. Эти группы включают метокси, этокси, пропокси, бутокси, изобутокси, третичный бутокси, пентокси,гексокси и подобное. Термин галоген включает фтор, хлор, бром, йод и подобное. Предпочтительно R1 является низшим алкилом. Наиболее предпочтительно группа R1 является метилом. Наиболее предпочтительными применяемыми соединениями являются соединения формулы (IIb): где Ar - это фенил, который не замещен или замещен по меньшей мере одной галогеновой группой,R1 - это низший алкил, особенно включающий 1-3 атома углерода; и наиболее предпочтительно, когда R3 - это СН 2-Q, где Q - это низший алкокси, особенно включающий 1-3 атома углерода. Наиболее предпочтительным R1 является СН 3. Наиболее предпочтительным R3 является CH2-Q, гдеQ - это метокси. Наиболее предпочтительным галогеновым заместителем является фтор. Наиболее предпочтительные соединения включаютD-1,2-(О-метилгидроксиламино)-2-ацетамидоуксусной кислоты бензиламид. Соединения, применяемые в настоящем изобретении, могут включать один или более асимметричных атомов углерода и могут существовать в рацемической и оптически активной формах. Конфигурации вокруг каждого асимметричного углерода могут быть либо D, либо L-формой. Специалистам хорошо известно, что конфигурации вокруг хиральных атомов могут быть описаны как R или S в номенклатурной системе Канна-Прелога-Ингольда. Все различные конфигурации относительно каждого асимметричного атома углерода, включая различные энантиомеры и диастереоизомеры, или то и другое, предусматриваются настоящим изобретением. В главной цепи существует асимметрия при атоме углерода, к которому присоединяются группы Н и R3. Термин конфигурация, как он применяется здесь, будет относиться к конфигурации относительно атома углерода, к которому присоединены Н и R3, даже несмотря на то, что в молекуле могут быть представлены другие хиральные центры. Таким образом, когда это относится к индивидуальной конфигурации, такой как D или L, это понимается как означающее D или L стереоизомер относительно атома углерода, к которому присоединены Н и R3. Однако он также включает все возможные энантиомеры и диастереоизомеры относительно других хиральных центров, если таковые имеются, присутствующие в соединении. Соединения настоящего изобретения направлены на все оптические изомеры, то есть соединения настоящего изобретения являются либо L-стереоизомером, либо D-стереоизомером (относительно атома углерода, к которому присоединены Н и R3). Эти стереоизомеры могут быть обнаружены в смесях L и D стереоизомеров, например, в рацематных смесях. D-стереоизомер является предпочтительным. Более предпочтительным является соединение формулы (IIb) в R-конфигурации, предпочтительно по существу энантиомерно чистое. Предпочтительно R - это незамещенный бензил или бензил, замещенный, по меньшей мере, одной галогеновой группой, которая является фтором. В зависимости от заместителей настоящие соединения могут также образовывать аддитивные соли. Все эти формы рассматриваются в рамках этого изобретения, включая смеси стереоизомерных форм. Получение применяемых соединений описано в патентах США 5378729 и 5773475, содержание которых включено сюда путем отсылки. Соединения, применяемые в настоящем изобретении, полезны как таковые, как описаны формулой(IIb), или они могут применяться в форме солей из-за их основной природы, обусловленной присутствием свободной аминогруппы. Следовательно, соединения формулы (IIb) образуют соли с широким набором кислот как органических, так и неорганических, включая фармацевтически приемлемые кислоты. Соли с терапевтически приемлемыми кислотами, конечно, полезны в приготовлении фармацевтических композиций, где повышенная растворимость в воде является выгодной. Эти фармацевтически приемлемые соли обладают также терапевтической эффективностью. Эти соли включают соли неорганических кислот, таких как соляная, иодоводородная, бромоводородная, фосфорная, метафосфорная, азотная и серная кислоты, а также соли органических кислот, таких как виннокаменная, уксусная, лимонная, яблочная, бензойная, перхлорная, гликолевая, глюконовая, янтарная,арилсульфоновая (например, п-толуолсульфоновая кислота, бензолсульфоновая), фосфорная, малоновая и подобные. Дополнительно настоящее изобретение направлено на способ профилактики, облегчения или/и лечения заболевания или состояния, как описано выше, у млекопитающего, включая человека, включающий введение по меньшей мере одного соединения формулы (IIb). Предпочтительно, соединения, применяемые в настоящем изобретении, применяются в терапевтически эффективных количествах. Врач определит дозировку настоящих терапевтических агентов, которая будет наиболее подходящей и которая будет варьировать в зависимости от формы введения и выбранного индивидуального соединения, и кроме того, она будет варьировать в зависимости от пациента, его возраста, типа расстройства, которое лечится. В основном он будет желать начать лечение малыми дозами, существенно меньшими, чем оптимальная доза соединения, и понемногу увеличивать дозу до тех пор, пока не достигнет оптимального эффекта при определенных обстоятельствах. Когда композиция вводится орально, для получения того же эффекта, что и с малым количеством, вводимым парентерально, будут требоваться большие количества активного агента. Соединения применимы тем же способом, как сравнимые тера-5 012176 певтические агенты, и уровень дозировки составляет величину того же порядка, что и обычно применяемые для этих других терапевтических агентов. В предпочтительном воплощении соединения настоящего изобретения вводятся в количествах в ряду примерно от 1 до 100 мг на килограмм веса тела в день, более предпочтительно, в количествах в ряду от примерно 1 до 10 мг на килограмм веса тела в день. Этот режим дозировок может быть приспособлен врачом для получения оптимального терапевтического ответа. Пациентов, нуждающихся в этом,можно будет лечить дозировками соединения настоящего изобретения по меньшей мере 50 мг/день,предпочтительно по меньшей мере 200 мг/день, более предпочтительно по меньшей мере 300 мг/день и наиболее предпочтительно по меньшей мере 400 мг/день. Максимально пациента, нуждающегося в этом,можно лечить дозировками с максимумом 3 г/день, более предпочтительно с максимумом 1 г/день и наиболее предпочтительно с максимумом 600 мг/день. В другом предпочтительном воплощении ежедневные дозировки увеличиваются до тех пор, пока не достигается предварительно определенная ежедневная доза, которая поддерживается во время дальнейшего лечения. В еще одном предпочтительном воплощении несколько раздельных доз может быть введено ежедневно, или дозировки могут быть пропорционально уменьшены, как требуется при острой необходимости в связи с терапевтической ситуацией. Например, могут быть введены три дозы в день, предпочтительно две дозы в день. Более предпочтительно вводить единственную дозу в день. Еще в одном воплощении может быть введено количество соединений настоящего изобретения, которое при введении обеспечивает получение концентрации в плазме от 0,1 до 15 мкг/мл (ряд) и от 5 до 18,5 мкг/мл (пик), рассчитанных как среднее для множества субъектов, подвергнутых лечению. Соединения формулы (IIb) могу быть введены подходящим способом, таким как оральный, внутривенный (когда оно водорастворимо), внутримышечный, интратекальный или подкожный. Оральное введение предпочтительно. Фармацевтическая композиция настоящего изобретения может быть приготовлена для таких схем лечения, которые описаны выше, в частности, для лечения дозами, описанными выше, для получения концентраций в плазме, которые описаны выше, для периодов введения или/и способов введения, как установлено в воплощениях настоящего изобретения, описанных выше. Соединения настоящего изобретения могут быть применены для приготовления фармацевтической композиции, как описано выше. Соединения формулы (IIb) могут быть введены орально, например, с инертным разбавителем или с ассимилируемым съедобным носителем, или они могут быть помещены в твердые или мягкие желатиновые капсулы, или они могут быть спрессованы в таблетки, или они могут быть включены непосредственно в диету. Для орального терапевтического введения активное соединение формулы (IIb) может быть включено с эксципиентом и применяться в форме проглатываемых таблеток, буккальных таблеток,капсул, эликсиров, суспензий, сиропов, облаток и подобного. Такие композиции и препараты должны включать по меньшей мере 1% активного соединения формулы (IIb). Процентное содержание соединения в композициях и препаратах может конечно варьировать и удобно, когда оно может быть в ряду между примерно 5-80% от веса единицы. Количество активного соединения формулы (IIb) в таких терапевтически полезных композициях таково, что будет получена подходящая дозировка. Предпочтительные композиции или препараты в соответствии с настоящим изобретением включают примерно между 10 мг и 6 г активного соединения формулы (IIb). Таблетки, пилюли, капсулы и подобное могут также включать следующее: связующее вещество,такое как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты такие как двузамещенный фосфат кальция; дезинтегрирующий агент, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и подобное; смазочный агент, такой как стеарат магния, и могут быть добавлены подсластители, такие как сахароза, лактоза или сахарин, или вкусовые агенты, такие как перечная мята, масло грушанки или агент, придающий вишневый вкус. Когда единичная лекарственная форма представлена капсулой, в добавление к материалам указанного выше типа она может включать жидкий носитель. Могут быть представлены другие разнообразные материалы, такие как покрытия или другая модификация физической формы единичной дозы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или обоими компонентами. Сироп или эликсир могут включать активное соединение, сахарозу как подсластитель, метил и пропилпарабензоаты в качестве консервантов, краситель и вкусовой агент, такой, что придают вкус вишни или апельсина. Конечно, любой материал, примененный для приготовления любой единичной лекарственной формы, должен быть фармацевтически чистым и в примененных количествах по существу нетоксичным. Кроме того, активное соединение может быть включено в препараты и композиции с замедленным высвобождением. Например, предусматриваются лекарственные формы с замедленным высвобождением, где активный ингредиент связан с ионообменной смолой, которая необязательно может быть покрыта диффузионным покрытием-барьером для модификации способности смолы обеспечивать освобождение. Активный компонент может быть также введен парентерально или интраперитонеально. Могут-6 012176 быть приготовлены дисперсии в глицерине, жидкости, полиэтиленгликолях, их смесях, и в масле. При обычных условиях хранения и применения, эти препараты включают консерванты, предотвращающие рост микроорганизмов. Фармацевтические формы, подходящие для применения в виде инъекций, включают стерильные водные растворы (в случае водорастворимых)или дисперсии и стерильные порошки для приготовления стерильных инъецируемых растворов или дисперсий для немедленного приема. Во всех случаях форма должна быть стерильной и должна быть жидкой в таких пределах, чтобы легко вводиться шприцом. Она должна быть стабильной в условиях изготовления и хранения и должна быть предохранена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, включая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и подобное), подходящие смеси этого и растительные масла. Надлежащая текучесть может поддерживаться, например, благодаря применению покрытия, такого как лецитин, благодаря поддержанию требуемого размера частицы в случае дисперсий и благодаря применению сурфактантов. Предохранение от действия микроорганизмов может быть обеспечено добавлением различных антибактериальных и антигрибковых агентов, например, парабензоатов, хлоробутанола, фенола, сорбиновой кислоты, тимеросала и подобного. Во многих случаях будет предпочтительно включить изотонические агенты, например, сахара или хлорид натрия. Замедленная абсорбция инъецируемых композиций может быть достигнута благодаря применению в композициях агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина. Стерильные растворы для инъекций приготавливаются путем включения активного соединения в требуемом количестве в подходящий растворитель с различными другими ингредиентами, перечисленными выше, по требованию с последующей стерилизацией фильтрованием. В основном дисперсии приготавливают путем включения различно стерилизованного активного ингредиента в стерильный носитель, который включает основную дисперсионную среду и другие требуемые ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительным способом приготовления является вакуумная сушка и лиофилизация плюс любой дополнительный желаемый ингредиент из предварительно стерилизованного фильтрацией раствора этого. Как это используется здесь, фармацевтически приемлемый носитель включает любой и все растворители, дисперсионную среду, покрытия, антимикробный и антигрибковый агент, изотонические и замедляющие абсорбцию агенты для фармацевтически активных веществ, которые хорошо известны специалистам. Кроме тех случаев, когда любая традиционная среда или агент являются несовместимыми с активным ингредиентом, рассматривается его применение в терапевтических композициях. Дополнительные активные ингредиенты также могут быть включены в композиции. Особенно выгодно составлять парентеральные композиции в единичной лекарственной форме дозировки для легкого введения и единообразия дозировки. Единичная лекарственная форма, как это применяется здесь, относится к физически дискретным единицам, подходящим как единичная дозировка для субъектов млекопитающих, которые подвергаются лечению; причем каждая единица включает предопределенное количество активного материала, рассчитанное для производства желаемого терапевтического эффекта в ассоциации с требуемым фармацевтическим носителем. Специфика новых единичных лекарственных форм изобретения диктуется и непосредственно зависит от (а) уникальных характеристик активного материала и индивидуального терапевтического эффекта, который должен быть достигнут, и(б) ограничений, присущих мастерству составления композиций, таких как активный материал для лечения заболевания у живых субъектов, находящихся в состоянии болезни, при которой здоровье организма нарушено, как это раскрыто здесь. Главный активный ингредиент составляется для удобного и эффективного введения в эффективных количествах с подходящим фармацевтически приемлемым носителем в единичной лекарственной форме,как раскрыто здесь выше. Единичная лекарственная форма может, например, включать основное активное соединение в количествах, находящихся в ряду примерно от 10 мг до 6 г. Выраженное в пропорциях,активное соединение в основном представлено в дозе примерно от 1 до 750 мг/мл носителя. В случае композиций, включающих дополнительные активные ингредиенты, дозировка определяется путем направления к обычной дозе и способу введения названного ингредиента. Как он применяется здесь, термин пациент или субъект относится теплокровному животному,предпочтительно млекопитающему, такому, как, например, кошки, собаки, лошади, коровы, свиньи,мыши, крысы и приматы, включая людей. Предпочтительным пациентом является человек. Термин лечить относится либо к облегчению боли, ассоциированной с заболеванием или состоянием, или к облечению заболевания или состояния пациента. Соединения настоящего изобретения вводятся пациенту, страдающему от упомянутого выше типа боли в эффективном для анальгезирования количестве. Эти количества эквивалентны терапевтически эффективным количествам, описанным здесь выше. Следующие примеры показывают свойства SPM 927 в уменьшении боли при клиническом исследовании у субъектов с болезненной диабетической нейропатией, в частности, с диабетической перифериче-7 012176 ской сенсорной нейропатией. Примененная субстанция была SPM 927, что является синонимом для Гаркосерида. В соответствии со стандартной химической номенклатурой это (R)-2-ацетамид-N-бензил-3-метоксипропионамид. Международное непатентованное название SPM 927 - лакозамид. Пример Для изучения безопасности и эффективности SPM 927 было организовано рандомизированное двойное, слепое, плацебо-контролируемое исследование. Цели: основная цель исследования заключалась в определении того, может ли SPM 927 быть эффективным в снижении боли у субъектов с диабетической периферической сенсорной полинейропатией. Вторичные цели были следующими: исследовать, как SPM 927 влияет на разные качества нейропатической боли; исследовать, может ли SPM 927 влиять на сон и активность у субъектов, страдающих от диабетической периферической сенсорной полинейропатии; исследовать, может ли SPM 927 влиять на Качество Жизни и Профиль Состояний Настроения; дополнительно исследовать переносимость и безопасность SPM 927; исследовать концентрации неизмененного SPM 927 в плазме крови до и после введения. Методология: это было мультицентровое, двойное слепое, плацебо-контролируемое исследование для оценки эффективности, безопасности, переносимости и определения концентраций неизмененногоSPM 927 в плазме крови до и после введения дозы лекарства субъектам с болезненной диабетической нейропатией. Базовые данные были собраны во время последней недели 4-недельной Фазы Входа для уверенности в пригодности субъекта для исследования. Затем пригодные для исследования субъекты были рандомизированы для получения максимум 400 мг в день SPM 927 (начиная со 100 мг в день в течение 3 недель, затем с титрованием со 100 мг интервалами в течение 3 недель) или плацебо. Наиболее высокие достигнутые дозы поддерживались в течение 4 недель во время Фазы Поддержания, после которой субъекты входили в Фазу Снижения, и дозы снижались для исследования медикамента в течение 1 недели. После Фазы Снижения следовала 2-недельная Фаза Последующего наблюдения за Безопасностью. Количество субъектов (запланированное и проанализированное): всего было запланировано включить 140 субъектов, для того чтобы достичь количества 100 пригодных для лечения субъектов. Всего для этого исследования было проверено 438 субъектов. Двести семьдесят семь из них были отбракованы, что обусловлено строгими входными критериями, и 42 из них были выведены из исследования на Фазе Входа. Таким образом, всего было рандомизировано 119 субъектов. Все 119 рандомизированных субъектов получали также, по меньшей мере, одну дозировку медикамента исследования, и были названы Набором Безопасности (SS). Все рандомизированные субъекты имели также, по меньшей мере,одну после-базовую оценку эффективности и рассматривались как Набор для Полного Анализа (FAS). Девяносто три субъекта в FAS закончили Фазу Поддержания, и у них отсутствовали нарушения основного протокола, таким образом, они рассматриваются как Набор для Протокола (PPS). В конечном итоге 94 субъекта прошли все фазы исследования. Диагноз и основные критерии для включения в исследование: Субъекты были мужчинами и женщинами в возрасте 18 лет и старше. У субъектов в течение 1-5 лет клинически диагностировалась боль,вызванная диабетической периферической сенсорной полиневропатией, они имели диагноз сахарный диабет (тип I и тип II). По меньшей мере, у субъектов была умеренная боль (средняя интенсивность боли во время Базовой недели 4 из 10 по 11-бальной шкале Ликерта), которая была стабильна в течение 4 недель до процедуры рандомизации. Кроме того, субъекты имели хороший или приемлемый контроль диабета (гликозилированный гемоглобин [HbA1c10%), который был оптимизирован (наилучшие усилия для достижения наилучшего контроля) в течение, по меньшей мере, трех месяцев до Визита 1. Продукт тестирования, доза и способ введения, номер партии: субъекты принимали 50 и 100 мг таблетки SPM 927 (Schwartz Pharma AG, Германия). Длительность лечения: после выполнения скрининговых исследований, субъекты входили в 4 недельную Фазу Входа. Пригодные для исследования пациенты были рандомизированы во время Визита 3 в соотношении 1:1 для приема активного SPM 927 или сбалансированного плацебо, начиная с дозы 100 мг в день (50 мг дважды в день [BID]) в течение трех недель. В соответствии со схемой титрования дозу увеличивали с прибавками по 100 мг еженедельно до максимальной дозы 400 мг/день (обеспечиваемая переносимость была удовлетворительной). Дозу наращивали только в случае, если переносимость дозы предыдущего уровня была удовлетворительной. В случае, когда субъекты испытывали такие неприятности, что, в соответствии с заключением исследователей, доза SPM 927 не должна быть повышена, субъектам разрешалось либо сохранять текущий уровень дозировки, либо возвращаться к предыдущему уровню дозировки. Во время исследования было разрешено только одно возвращение к предыдущему уровню. Если однажды дозировка исследуемого лекарства была снижена, она не могла быть увеличена вновь. Если субъекты заканчивали Фазу Титрования (то есть, после 5 недель), они входили в 4-недельную Фазу Поддержания.-8 012176 Если субъекты достигали полного или достаточного устранения боли с дозировкой менее чем 400 мг/день, после внимательного рассмотрения исследователем им позволялось оставаться на достигнутом уровне дозировки в Фазе Поддержания. Если неблагоприятные события во время Фазы Титрования или в первую неделю Фазы Поддержания были непереносимы (только для тех субъектов, которые достигли уровня 400 мг/день), субъектам могли понизить дозировку однажды до следующей находящейся ниже дозировки. В Фазе Поддержания субъектам давали 400 мг/день (или наивысшую достигнутую дозу) в течение 4 недель. После окончания Фазы Поддержания субъекты входили в Фазу Снижения, и доза активного компонента или плацебо была снижена слепым методом (в течение 1 недели). Субъектам, получавшим 400 мг в день, в Фазе Снижения доза исследуемого лекарства была снижена на 200 мг. Субъектам, получавшим 300 мг в день, доза исследуемого лекарства в Фазе Снижения была снижена на 100 мг. Субъекты, получавшие по 100 мг в день и 200 мг в день, в Фазе Снижения получали плацебо. Эталонная терапия, доза и способ введения: плацебо давали в таких же по виду таблетках. Критерии для оценки Эффективность: первичная переменная была изменением у субъекта средней ежедневной оценки боли от Базовой недели до Фазы Поддержания с использованием 11-бальной шкалы Ликерта (0-10). Вторичные переменные включали следующее: изменение у субъекта средней оценки ежедневной боли от Базовой недели до третьей недели увеличения дозы; изменение у субъекта средней ежедневной оценки боли от Базовой недели до каждой недели исследования; изменение у субъекта средней ежедневной Присутствующей Интенсивности Боли от Базовой недели до каждой недели исследования; изменения в ощущении субъектами различных качеств нейропатической боли (Шкала Нейропатической Боли) [NPS], оцененные во время Визитов 1, 3, 6, 10, 11 и 12; изменения в ощущении субъектами боли, нарушающей сон и активность от Базовой недели до каждой недели исследования. Сон оценивали каждое утро (Ликерт без Учета Короткой Боли [BPI]), и активность оценивали каждый вечер (Ликерт без BPI). изменение в восприятии субъектом боли, оцененное при каждом клиническом визите путем измерения с применением Короткой формы - Вопросника по Оценке Боли Мак-Гилла (SF-MPQ) в трех разделах: категориальная рейтинговая шкала боли от 0 (нет боли) до 3 (сильная боль); визуальная Аналоговая Шкала (VAS), ранжирующая боль по 100 мм шкале; интенсивность Присутствующей Боли (PPI), рейтинг боли по 6-бальной шкале; общее впечатление пациента об изменении боли (PGIC), зафиксированное при Визитах 6, 10 и 12; клиническое общее впечатление об изменении боли (PGIC), зафиксированное во время Визитов 6,10 и 12; изменение в Короткой Форме-36 (SF-36) вопросника по Качеству Жизни (QOL), заполненного во время Визитов 1, 3, 6, 10 и 12; изменение в вопроснике по Профилю Состояния Настроений (POMS), заполненном во время Визитов 1, 3, 6, 10 и 12; доля дней без боли во время Базовой Фазы, Фазы Титрования, Фазы Поддержания и Фазы Снижения; применение (число) лекарств, избавляющих от боли. Фармакокинетика: были определены концентрации неизмененного SPM 927 в плазме крови до введения дозы и максимальная концентрация (то есть, через 2-4 ч после введения дозы). Безопасность: переменные, характеризующие безопасность, включали неблагоприятные события,клинические лабораторные оценки, электрокардиограммы (ECG), оценку жизненных признаков и нейрофизиологическое исследование. Статистические методы: было выявлено, что 46 пригодных для исследования субъектов в каждой группе лечения дали бы 80% вероятность определения статистически значимых различий при двустороннем 5% уровне значимости, если истинный эффект лечения составлял 1,25 единиц по шкале Ликерта с общим стандартным отклонением 2,11. В целом, в каждой получавшей лечение группе должно было быть набрано 70 субъектов, на которые делается поправка - выпали во время 4-недельной Фазы Вхождения или которые не могли быть оценены в связи с отсутствием данных Базовой линии или последующего наблюдения. Было подсчитано, что 140 субъектов нужно было бы внести в список для достижения общего количества в 120 рандомизированных субъектов и 100 субъектов, поддающихся оценке для первичного анализа. Если уровень отбраковки был ниже, чем ожидалось, то внесение в список должно было быть остановлено до накопления общего количества 70 субъектов/группу лечения. Для переменных первичной эффективности был использован анализ ковариантности (ANCOVA) в терминах лечения и типа исследователя для сравнения разницы между активным лечением и лечением плацебо с применением оценки Базовой боли по шкале Ликерта в качестве коварианта и изменения от-9 012176 средней Базовой линии до средней оценки боли в Фазе Поддержания по шкале Ликерта в качестве ответа. Различия в лечении были определены на основе среднеквадратичного (LSNean). Для обработки различий был рассчитан двусторонний 95% доверительный интервал. Во вторичном анализе в модели ANCOVA были исследованы фактор взаимодействие лечение -исследователь или/и другие возможные факторы (возраст, раса, пол, и тяжесть в базовом состоянии). Основной эффект модели ANCOVA был применен к изменению средней оценки боли по шкале Ликерта от Базовой линии до первых трех недель Фазы Титрования, до всей Фазы Титрования, до стадии лечения и до каждого визита с использованием Базового уровня в качестве сопутствующей случайной величины. Результаты Результаты по эффективности: результаты по эффективности этого исследования последовательно демонстрируют статистически значимые различия между SPM 927 и плацебо у субъектов с болезненной диабетической нейропатией в отношении конечных значений первичной эффективности, тестированных в этом исследовании. Снижение средних оценок боли после введения SPM 927 может рассматриваться как клинически значимое. Анализ помеченных значений вторичной эффективности обеспечил дополнительные статистически значимые и клинически существенные результаты (например, клинически значимые улучшения в качестве сна и дневных уровней рутинной активности субъектов). Переменная первичной эффективности для этого исследования представляла собой изменение у субъекта средней дневной оценки боли от Базовой недели до Фазы Поддержания с применением 11 бальной шкалы Ликерта (0-10), где Базовая линия была 7-дневным периодом между Визитами 2 и 3. В Полном Наборе для Анализа (Last Observation Carried Forward, LOCF) было отмечено 3,11-бальное снижение боли от Базовой линии до Фазы Поддержания после лечения SPM 927 по сравнению с 2,21 бальным снижением боли после лечения плацебо, исходя из LSMean. Различие в LSMean оценке боли между двумя группами (0,9) было статистически значимым (р=0,0390) и клинически существенным. Анализ FAS (AS Observed) и PPS популяций на изменение от Базовой линии до Фазы Поддержания также продемонстрировал большее снижение боли после лечения SPM 927, чем после лечения плацебо; эти различия были статистически значимыми и клинически существенными. Для FAS (LOSF) и даже в большей степени для FAS (As Observed) SPM 927 был более эффективен в снижении боли по визитам, чем плацебо. По окончании первых трех недель Фазы Титрования, субъекты,получавшие SPM 927, имели более низкую среднюю ежедневную оценку боли, чем субъекты, получавшие плацебо. По мере того как доза повышалась в остающейся части Фазы титрования и в конечном итоге стабилизировалась во время Фазы Поддержания, средние ежедневные оценки боли в возрастающей степени меньше по сравнению с субъектами, получавшими плацебо. Снижение дозы SPM 927 сопровождалось последующим увеличением средней ежедневной оценки боли. Изменения в конечных значениях вторичной эффективности согласовывались с таковыми, наблюдавшимися в первичном конечном значении, и обеспечивают дополнительное подтверждение эффективности SPM 927 при диабетической болезненной нейропатии. Статистически значимые различия от Базовой линии до Фазы Поддержания после лечения SPM 927 по сравнению с плацебо наблюдались для VAS(рейтинг общей боли) и интенсивности присутствующей боли SF-MPQ, ощущения субъектом боли, нарушающей сон, и ощущения субъектом боли, мешающей общей активности. Статистически значимые различия наблюдались также после приема SPM 927 и плацебо для CGIC и PGIC оценок в конце Фазы Поддержания (Визит 10). Большая доля субъектов в группе SPM 927 по сравнению с группой плацебо испытывала снижение оценки на 2 и более балла по шкале боли Ликерта во время всех фаз исследования. Кроме того, лечение SPM 927 было ассоциировано с более значительными улучшениями по сравнению с плацебо других показателей боли (интенсивность присутствующей боли и ощущение субъектом различных качеств нейропатической боли), данных по качеству жизни (SF-36 и POMS) и доли дней без боли. Фармакокинетические результаты Текущие и пиковые концентрации лекарства в плазме крови во время Фазы Поддержания варьировали в широких пределах, что частично объяснялось различиями в весе субъектов и небольшом количестве собранных для анализа образцов. При дозе 400 мг/день средние концентрации лекарства в плазме увеличивались от 7,7 мкг/мл до 11,4 мкг/мл (от текущих концентраций до максимума, Визит 9) и от 7,9 мкг/мл до 9,1 мкг/мл (Визит 10). Результаты по безопасности: средняя длительность лечения исследуемым лекарством была 62,7 дня для субъектов группы, получавшей плацебо, и 59,6 дня для субъектов группы, получавшей SPM 927, показывая высокую переносимость по отношению к SPM 927. Процент субъектов, которые сообщили, по меньшей мере, об одном неблагоприятном событии, вызванном лечением (ТЕАЕ), был выше в группе, получавшей SPM 927, с общей частотой событий 87% для 60 субъектов в группе SPM 927 и 75% для 59 субъектов в группе плацебо. Среди всех субъектов ТЕАЕ были более характерны для центральной и периферической нервной системы, причем 46 субъектов (39% от 119 субъектов) сообщили, по меньшей мере, об одном неблаго- 10012176 приятном событии в его организме. Однако о неблагоприятных событиях, ассоциированных с центральной и периферической нервной системой, сообщил сравнимый процент субъектов в каждой группе, получавшей лечение (39% из 59 субъектов, получавших плацебо, и 38% из 60 субъектов, получавших SPM 927). Обзор профиля неблагоприятных событий не дал доказательств вредного воздействия на какуюлибо конкретную систему организма. В целом, головная боль (20% для 119 субъектов), головокружение (12%), не определенные иным способом события (NOS) (11%), инфекции верхних дыхательных путей (10%) и тошнота (9%) были среди ТЕАЕ, о которых сообщалось наиболее часто. В целом, доли субъектов, которые сообщили о специфических ТЕАЕ, или которые сообщили о ТЕАЕ, ассоциированных с определенными системами организма, были примерно одинаковыми для групп, получавших плацебо и SPM 927. В целом, значительно большее количество субъектов впервые сообщило о неблагоприятных событиях во время Фазы Титрования по сравнению с Фазой Поддержания и Фазой Снижения /Последующего наблюдения за безопасностью. Для большей части систем организма количество субъектов, сообщивших о неблагоприятных событиях в каждой из систем организма, было больше во время Фазы Титрования по сравнению с Фазой Поддержания и Фазой Снижения/Последующего наблюдения за безопасностью. Ни один из субъектов не умер во время исследования. В целом 2 субъекта сообщили о 2 серьезных неблагоприятных событиях во время этого исследования: один субъект с одним серьезным неблагоприятным событием в группе, получавшей плацебо (боль в правом боку, оцененная как не относящаяся к исследованию), и один субъект с одним SAE в группе, получавшей SPM 927 (аномальная электрокардиограмма [ECG], оцененная как вероятно не относящаяся к исследованию). В целом 8 субъектов (7% из 119 субъектов) выпали из исследования вследствие возникновения неблагоприятных событий: 3 в группе,получавшей плацебо (5% из 59 субъектов), и 5 в группе, получавшей SPM 927 (8% из 60 субъектов). Средние и медианные изменения от базовой линии в гематологии, клинической химии и свертываемости, мочевыводящей системе, жизненных признаках и параметрах ЭКГ были незначительными, в пределах нормальных значений, сравнимыми между группами, подвергавшимися лечению, и не имевшими клинического значения. Во время исследования не было идентифицировано значимых в отношении безопасности результатов по отношению к QT и PR интервалу. Уровни HbA1c во время исследования от Базовой линии до Визита 8 для двух получавших лечение групп изменялись незначительно (среднее изменение от -0,1% и 0,1% для групп, получавших плацебо и SPM 927, соответственно). Существенных различий в этих параметрах при переходах от Базовой линии к терапии не наблюдалось. Данные нейрологического исследования в конце исследования по сравнению с таковыми на Базовой линии не позволяет предполагать наличие каких-либо значительных эффектов, обусловленных SPM 927. Изменение веса тела во время лечения SPM 927 были небольшими (-0,5 кг для SPM 927 и 1,2 кг для плацебо). Заключение Суммируя, можно заключить, что SPM 927 показал статистически значимую и клинически существенную эффективность в снижении нейропатической боли, вызванной диабетической периферической сенсорной полинейропатией при постепенном увеличении дозировки (титровании) до поддерживающего дозы 400 мг/день. В целом SPM 927 в дозировке 100-400 мг/день лечили 60 субъектов с болезненной диабетической нейропатией, длительность лечения составила до 82 дней; 46 из этих субъектов завершили все фазы исследования. Анализы данных по безопасности (неблагоприятные события, клинические лабораторные исследования, ЭКГ, жизненные признаки и физические признаки) не выявили серьезных проблем с безопасностью и поддерживают дальнейшую клиническую разработку SPM 927 как агента для лечения диабетических пациентов с периферической нейропатической болью.SPM 927 не вызывал прибавку в весе, что является важным свойством для лекарственных средств,вводимых пациентам с диабетом типа II. Некоторые диабетические агенты, такие как инсулин и сульфонилмочевина ассоциированы с прибавкой в весе (UKPDS 1998), а тучность является установленным фактором риска для сердечно-сосудистых заболеваний (Schernthaner 1996). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения, имеющего формулу (IIb) где Ar представляет собой фенил, который является незамещенным или замещенным по меньшей мере одним галогеном;R1 представляет собой алкил, содержащий 1-6 атомов углерода,или его фармацевтически приемлемой соли для приготовления фармацевтической композиции для- 11012176 профилактики, облегчения и/или лечения боли, ассоциированной с болезненной диабетической нейропатией. 2. Применение по п.1, где Ar представляет собой незамещенный фенил. 3. Применение по п.1, где галоген представляет собой фтор. 4. Применение по п.1, где соединение формулы (IIb) представляет собой (R)-2-ацетамидо-N-бензил 3-метоксипропионамид или его фармацевтически приемлемую соль. 5. Применение О-метил-N-ацетил-D-серин-м-фторобензиламида; О-метил-N-ацетил-D-серин-пфторобензиламида;D-1,2-(N,О-диметилгидроксиламино)-2 ацетамидоуксусной кислоты бензиламида или D-1,2-(О-метилгидроксиламино)-2-ацетамидоуксусной кислоты бензиламида для приготовления фармацевтической композиции для профилактики, облегчения и/или лечения боли, ассоциированной с болезненной диабетической нейропатией. 6. Применение по любому из предшествующих пунктов, где соединение является, по существу,энантиомерно чистым. 7. Применение по любому из предшествующих пунктов, где боль, ассоциированная с болезненной диабетической нейропатией, представляет собой боль, ассоциированную с диабетической периферической сенсорной полинейропатией. 8. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения дозами соединения по меньшей мере 100 мг/день, предпочтительно по меньшей мере 200 мг/день, более предпочтительно по меньшей мере 300 мг/день и наиболее предпочтительно по меньшей мере 400 мг/день. 9. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения дозами соединения максимально 6 г/день, предпочтительно максимально 3 г/день, более предпочтительно максимально 1 г/день и наиболее предпочтительно максимально 400 мг/день. 10. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения увеличивающимися ежедневными дозами до тех пор, пока не достигается предварительно определенная ежедневная доза, которая поддерживается во время дальнейшего лечения. 11. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения тремя дозами в день, предпочтительно двумя дозами в день, более предпочтительно одной дозой в день. 12. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для введения, приводящего к достижению концентрации соединения в плазме крови 0,1-15 мкг/мл и максимально 5-18,5 мкг/мл (пик), рассчитанной в качестве среднего для множества леченых субъектов. 13. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для лечения по меньшей мере в течение одной недели, предпочтительно по меньшей мере в течение двух недель, более предпочтительно по меньшей мере в течение четырех недель и наиболее предпочтительно в течение по меньшей мере восьми недель. 14. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для орального введения. 15. Применение по любому из предшествующих пунктов, где фармацевтическая композиция полезна для профилактики, облегчения и/или лечения состояния, ассоциированного с болезненной диабетической нейропатией, что представляет собой среднюю ежедневную боль, общую боль, интенсивность присутствующей боли, боль, препятствующую сну, восприятие субъектом боли, влияющей на общую активность, общее впечатление субъекта об изменении боли, общее клиническое впечатление об изменении боли, восприятие субъектом различных качеств нейропатической боли, качество жизни и доля дней без боли. 16. Применение по любому из предшествующих пунктов, где болезненная диабетическая нейропатия ассоциирована с сахарным диабетом типа I или типа II, предпочтительно с сахарным диабетом типаII. 17. Применение по любому из предшествующих пунктов, где фармацевтическая композиция приготавливается для ведения млекопитающему. 18. Применение по п.17, где фармацевтическая композиция приготавливается для введения людям.
МПК / Метки
МПК: A61K 31/165, A61P 25/02
Метки: пептидных, болезненной, диабетической, нейропатии, лечения, новое, боли, применение, соединений
Код ссылки
<a href="https://eas.patents.su/13-12176-novoe-primenenie-peptidnyh-soedinenijj-dlya-lecheniya-boli-pri-boleznennojj-diabeticheskojj-nejjropatii.html" rel="bookmark" title="База патентов Евразийского Союза">Новое применение пептидных соединений для лечения боли при болезненной диабетической нейропатии</a>
Следующий патент: Новая композиция биотоплива
Случайный патент: Готовый к употреблению напиток зеленого чая и способ его получения












