Водные суспензии субмикронных 9-гидроксирисперидоновых сложных эфиров жирных кислот
Номер патента: 2926
Опубликовано: 31.10.2002
Авторы: Басстани Эстер Дина Гюидо, Дрис Вилли Мария Альберт Карло, Франсуа Марк Карел Йозеф
Формула / Реферат
1. Фармацевтическая композиция в виде препаративной формы депо для введения путем внутримышечной или подкожной инъекции, включающая дисперсию частиц, состоящую, по существу, из терапевтически эффективного количества пролекарственного средства кристаллического 9-гидроксирисперидонового сложного эфира жирной кислоты, имеющего формулу
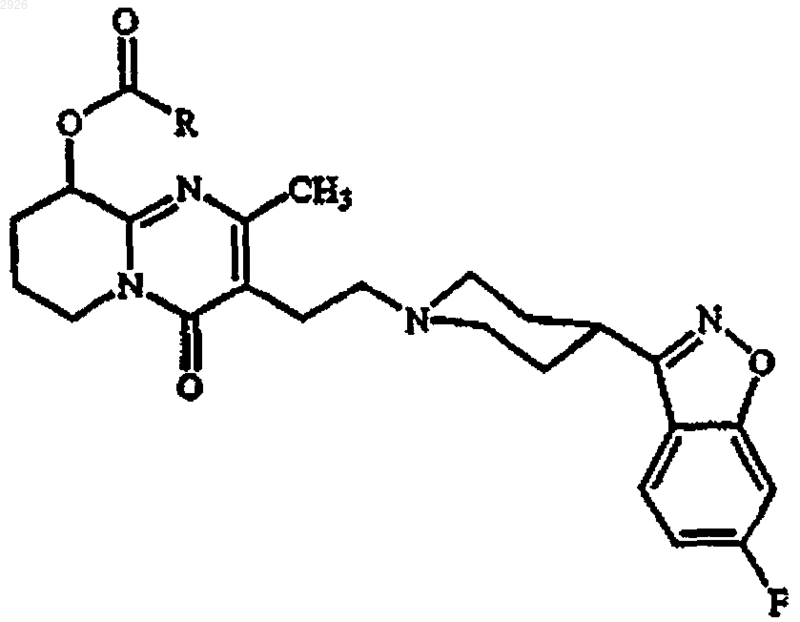
или его соли или его стереоизомера или стереоизомерной смеси, где R представляет собой линейный C9-C19 алкильный радикал; содержащих поверхностно-активное вещество, абсорбированное на их поверхности в количестве, эффективном для поддержания удельной площади поверхности >4 м2/г (соответствующей эффективному среднему размеру частиц менее 2000 нм) в фармацевтически приемлемом носителе, включающем воду.
2. Композиция по п.1, где R представляет линейную C15 (пентадецильную) цепь и активный ингредиент представляет сложный эфир - 9-гидроксирисперидонпальмитат.
3. Композиция по п.1, где композиция дополнительно включает суспендирующий агент и необязательно один или несколько консервантов, буферов и изотонических агентов.
4. Композиция по п.3, где суспендирующий агент представляет натрий карбоксиметилцеллюлозу, а поверхностно-активное вещество представляет полисорбат 20.
5. Композиция по п.4, где консервант представляет бензиловый спирт, а изотонический агент представляет маннит или фосфатный буфер.
6. Композиция по п.1, имеющая вязкость менее 75 мПа.с.
7. Композициия по п.3, включающая по весу из расчета на общий объем композиции
(a) от 3 до 20% (мас./об.) пролекарственного средства;
(b) от 0,5 до 2% (мас./об.) смачивающего агента;
(c) один или несколько буферных агентов, достаточных для придания композиции нейтральности или очень слабой основности (вплоть до рН 8,5);
(d) от 0,5 до 2% (мас./об.) суспендирующего агента;
(e) вплоть до 2% (мас./об.) консервантов; и
(f) воды до 100%.
8. Применение фармацевтической композиции по любому из пп.1-7 для лечения психоза, шизофрении, шизоидоаффективных нарушений, нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний.
9. Применение композиции по любому из пп.1-7 для получения лекарственного средства для лечения психоза, шизофрении, шизоидоаффективных нарушений, нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например, со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний.
Текст
1 Настоящее изобретение относится к фармацевтической композиции, подходящей в качестве препаративной формы в виде депо для введения путем внутримышечной или подкожной инъекции, включающей(1) в качестве активного ингредиента терапевтически эффективное количество 9-гидроксирисперидонового сложного эфира жирной кислоты или его соли или стереоизомера или его стереоизомерной смеси в субмикронной форме и(2) фармацевтически приемлемый носитель, где фармацевтически приемлемый носитель представляет собой воду и активный ингредиент суспендирован в ней; а также к способу получения таких соединений. Далее изобретение относится к фармацевтической композиции, полезной в качестве лекарственного средства для лечения психоза,шизофрении, шизоидоаффективных нарушений,нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний. Рисперидон представляет собой 3-[2-[4-(6 фтор-1,2-бензизоксазол-3-ил)-1-пиперидинил] этил]-6,7,8,9-тетрагидро-2-метил-4 Н-пиридо[1,2-а] пиримидин-4-он. Его получение и фармакологическая активность описаны в ЕР-0196132 (соответствующей патенту США 4804663). Там же представлены различные дозированные фармацевтические лекарственные формы, включая таблетки, капсулы, капли, суппозитории, пероральные растворы и растворы для инъекций. На практике рисперидон обычно вводят в виде основания в таблетке или в забуференном пероральном или внутримышечном растворе. Конкретные растворы для перорального или внутримышечного введения описаны в WO 96/01652. Рисперидон представляет собой сильнодействующее лекарственное средство, имеющее относительно узкий терапевтический индекс. При передозировке он может вызывать нежелательные побочные действия, наиболее значимым из которых является экстрапирамидольный синдром (ЭПС) и, в меньшей степени, гипотензия(вследствие периферической альфаадренергической активности). Для достижения антипсихотического действия у пациента общая дневная доза рисперидона изменяется от примерно 2 до примерно 8 мг; для облегчения поведенческих нарушений, связанных с нейродегенеративными заболеваниями, общая дневная доза обычно более низкая и составляет от примерно 0,5 до примерно 2 мг. Индивидуальные различия и сопутствующее лечение могут потребовать индивидуального выбора дозы для пациента. 2 Известно, что рисперидон метаболизирует до 9-гидроксирисперидона, который имеет фармакологический профиль и эффективность,сравнимую с таковыми для исходного лекарственного средства - рисперидона, но который имеет более длинное время периода полувыведения. Риспиридон распространяется в и выводится из тканей мозга более быстро, чем его метаболит - 9-гидроксирисперидон. 9-Гидроксирисперидон, его энантиомерные формы и его сложные эфиры С 2-20 алкановых кислот описаны в ЕР-0368388 (соответствующей патентам США 5158952 и 5254556). Указанные сложные эфиры рассматриваются как потенциально значимые пролекарственные средства активного метаболита рисперидона для применения в препаративных формах депо. По ряду причин желательно вводить рисперидон в виде препаративной формы (депо) с длительным или замедленным высвобождением,которая эффективна в течение продолжительного периода времени, предпочтительно в течение примерно 3 недель или более, в частности около 1 месяца.WO 94/25460 (соответствующий ЕР 0697019) относится к такой первой препаративной форме депо и касается рисперидонпамоатной соли, плохо растворимой в воде солевой формы рисперидона, которая может быть суспендирована в фармацевтически приемлемом носителе, таком как вода или масло, и может вводиться подкожно или внутримышечно. Однако данная соль имеет субоптимальные фармакокинетические свойства. Высвобождение активного ингредиента из препаративных форм оказалось слишком быстрым, что приводит к относительно высокому первоначальному уровню в плазме крови и неадекватной средней продолжительности действия, обе эти характеристики необходимо улучшить в действительно эффективных препаративных формах депо.WO 95/13814 касается препаративных форм с замедленным высвобожением для парентерального введения, в которых рисперидон микроинкапсулирован в биосовместимом, биоразрушаемом образующем оболочку материале(например, полимере, таком как dl-(полиактидсогликолид. Микроинкапсулированные препаративные формы имеют подходящие фармакокинетические свойства, но необходимы сложные технологические способы получения на специально построенных заводах. В РСТ/ЕР 97/02504 описаны водные суспензии 9-гидроксирисперидоновых сложных эфиров жирных кислот, в которых пролекарственное средство активного ингредиента находится в тонкоизмельченной форме. Неожиданно такие препаративные формы оказались слишком длительно сохраняющимися в человеческом организме, чтобы быть терапевтически полезными. Следовательно, до сих пор сохраняется необходимость в эффективных и легко доступных 3 препаративных формах депо рисперидона или рисперидонподобного соединения. Наночастицы хорошо известны из предшествующего уровня техники, они описаны, например, в ЕР-А-0499299. Такие частицы состоят, по существу, из кристаллического лекарственного вещества, имеющего модификатор поверхности, абсорбированный на поверхности этих частиц таким образом, что эффективный средний размер частиц составлял меньше, чем 400 нм. Также известно, что указанные частицы особенно полезны при получении препаративных форм слабо водорастворимых активных ингредиентов. Настоящее изобретение явилось следствием исследований по разработке эффективной,хорошо переносимой, с длительным или замедленным высвобождением препаративной формы(депо) 9-гидроксирисперидонового сложного эфира алкановой кислоты, которая является терапевтически эффективной в течение, по крайней мере, 3 недель или более, в частности около 1 месяца. Под выражением эффективный в течение, по крайней мере, 3 недель или более подразумевается, что уровень в плазме крови активного ингредиента, 9-гидроксирисперидона (свободного спирта, высвободившегося в результате гидролиза из сложного эфира алкановой кислоты), должен составлять выше приблизительно 10 нг/мл. С другой стороны, указанный уровень в плазме должен оставаться все время ниже порогового значения примерно 100 нг/мл, чтобы можно было бы называть препаративную форму эффективной. Пороговое значение представляет собой средний уровень в плазме крови в течение значительного промежутка времени,например в течение более 15 мин, при превышении которого пациенты могут испытывать нежелательные побочные эффекты или, наоборот, ниже которого системная толерантность рассматриваемой препаративной формы все еще остается приемлемой. Пороговое значение не соблюдается для кратковременных высоких уровней в плазме крови в течение короткого промежутка времени, например меньше 15 мин,что связано, например, с неожиданным взрывным высвобождением активного ингредиента. Оба вышеупомянутых характерных признака - уровень в плазме выше минимальной терапевтической концентрации, но ниже порогового значения, приводящего к побочному действию, рассматриваются как основные требования, которым должны удовлетворять современные препаративные формы депо для того, чтобы быть приемлемыми для предполагаемых пациентов. Ограничение количества введений лекарственного средства и возникновение нежелательных побочных действий после каждого введения будут, несомненно, усиливать привлекательность для пациентов такой терапии. Однако помимо этих основных требований может быть выявлен ряд дополнительных поже 002926 4 ланий, который будет дополнительно усиливать привлекательность для пациентов; двумя наиболее заметными из них являются хорошая местная переносимость и легкость введения. Хорошая местная переносимость означает минимальное раздражение и воспаление в месте инъекции; легкость введения относится к размеру иглы и длительности времени, необходимого для введения дозы конкретной препаративной формы лекарственного средства. Кроме того, препаративные формы депо должны оставаться стабильными и иметь время хранения, по крайней мере, в течение двух лет в обычных условиях. Исследования по разработке эффективной,хорошо переносимой, с длительным или замедленным высвобождением препаративной формы(депо) 9-гидроксирисперидонового сложного эфира алкановой кислоты, которая удовлетворяет вышеуказанным требованиям, привели к открытию, что фармацевтическая композиция, подходящая в качестве препаративной формы в виде депо для введения путем внутримышечной или подкожной инъекции, должна содержать дисперсию частиц, содержащую, по существу, терапевтически эффективное количество кристаллического 9-гидроксирисперидонового сложного эфира жирной кислоты, формулы или его соли или стереоизомера или его стереоизомерной смеси, где R представляет собой линейный С 9-19 алкильный радикал; содержащих поверхностно-активное вещество, абсорбированное на их поверхности в количестве, эффективном для поддержания удельной площади поверхности 4 м 2/г (соответствующей эффективному среднему размеру частиц менее 2000 нм) в фармацевтически приемлемом носителе, включающем воду. Неожиданно оказалось, что водные суспензии тонкоизмельченных 9-гидроксирисперидоновых сложных эфиров С 10-20 алкановых кислот (где R представляет собой линейный С 9-19 алкильный радикал) обладают исключительно длительным действием для человека, но не для испытуемых животных, в частности для собак. Это абсолютно неожиданный результат, так как фармакокинетика лекарственных средств для человека и для собак часто сопоставима. Фармакокинетические свойства для человека водных суспензий 9-гидроксирисперидоновых сложных эфиров алкановых кислот зависят от размера частиц в намного большей степени, чем ранее представлялось возможным. С 10-20 алкановые кислоты выбирают из группы, включающей декановую (капроновую), 5 ундекановую, додекановую (луриловую), тридекановую, тетрадекановую (миристиновую), пентадекановую, гексадекановую (пальмитиновую),гептадекановую, октадекановую (стеариновую),нонадекановую и эйкозановую кислоту. Было установлено, что лучшим сложным эфиром с точки зрения фармакокинетики, а также с точки зрения толерантности, является сложный эфир,содержащий C15 (пентадецил) цепь и соответствующий ему активный ингредиент, представляющий собой сложный эфир 9-гидроксирисперидонпальмитат. Наночастицы по настоящему изобретению включают поверхностно-активное вещество или модификатор поверхности, абсорбированные на их поверхности, в количестве, достаточном для поддержания удельной площади поверхности 4 м 2/г(т.е. соответствующей среднему размеру частиц менее 2000 нм), предпочтительно удельной площади поверхности 6 м 2/г и, в частности в диапазоне от 10 до 16 м 2/г. Полагают, что модификаторы поверхности, которые могут использоваться, включают те, которые обладают физической адгезией с поверхностью активного агента,но не связываются с ней химически. Подходящие модификаторы поверхности предпочтительно могут быть выбраны из известных органических и неорганических фармацевтических эксципиентов. Такие эксципиенты включают различные полимеры, низкомолекулярные олигомеры, природные продукты и поверхностно-активные вещества. Предпочтительные модификаторы поверхности включают неионные и анионные поверхностно-активные вещества. Примеры эксципиентов включают желатин, казеин, лецитин (фосфатиды), гуммиарабик, холестерин, трагакант, стеариновую кислоту, хлорид бензалькония, стеарат кальция,глицерилмоностеарат, цетостеариловый спирт,цетомакроголевый эмульгирующий воск, сложные эфиры сорбита, ациловые простые эфиры полиоксиэтилена, например макроголевые простые эфиры, такие как цетомакроголь 1000, полиоксиэтиленовые производные касторового масла, полиоксиэтиленсорбитовые сложные эфиры жирных кислот, например коммерчески доступный Tweens, полиэтиленгликоли, полиоксиэтиленстеараты, коллоидный диоксид кремния, фосфаты, додецилсульфат натрия, карбоксиметилцеллюлозу кальция, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, фталат гидроксипропилметилцеллюлозы, некристаллическую целлюлозу, алюминатсиликат магния,триэтаноламин, поливиниловый спирт (ПВС),полоксамеры, тилоксапол и поливинилпирролидон (ПВП). Большинство из этих эксципиентов подробно описаны в Handbook of Pharmaceutical 6 коммерчески доступными и/или могут быть получены способами, известными в технике. Два или более модификаторов поверхности могут использоваться в комбинации. Особенно предпочтительные модификаторы поверхности включают поливинилпирролидон; тилоксапол; полоксамеры, такие как Pluronic F68, F108 и F127, которые представляют собой блок-сополимеры этиленоксида и пропиленоксида, доступные от BASF; полоксамины,такие как Tetronic 908 (T908), который представляет собой тетрафункциональный блок-сополимер, полученный последовательным добавлением этиленоксида и пропиленоксида к этилендиамину, доступный от BASF; декстран; лецитин; Aerosol ОТ (АОТ), представляющий собой диоктиловый сложный эфир натрийсульфоянтарной кислоты, доступный от Cytec Industries;DuponolP, представляющий собой лаурилсульфат натрия, доступный от DuPont; Triton Х-200, представляющий собой алкилариловый полиэфирный сульфонат, доступный от Rohm иHaas; Tweens 20, 40, 60 и 80, представляющие собой полиоксиэтиленсорбитовые сложные эфиры жирных кислот, доступные от ICI SpecialityChemicals; Span 20, 40, 60 и 80, представляющие собой сорбитовые сложные эфиры жирных кислот; Аrlасеl 20, 40, 60 и 80, представляющие собой сорбитовые сложные эфиры жирных кислот, доступные от Hercules, Inc.; Carbowax3550 и 934, представляющие собой полиэтиленгликоли, доступные от Union Carbide; CrodestaF110, представляющий собой смесь стеарата сахарозы и дистеарата сахарозы, доступных от(СТАС); бычий сывороточный альбумин иSA90HCO, который представляет собой C18H17CH2Pluronic F108 соответствует полоксамеру 338 и представляет собой полиоксиэтиленовый,полиоксипропиленовый блок-сополимер, который отвечает обычно формуле НО[СН 2 СН 2 О]х[СН(СН 3)СН 2O]у[СН 2 СН 2O]zН, где средние значения х, у и z составляют 128, 54 и 128 соответственно. Другим коммерческим названием полоксамера 338 является Hodag Nonionic 1108-F, доступный от Hodag и SynperonicPE/F108, доступный от ICI Americas. Оптимальное относительное количество антипсихотического агента и модификатора поверхности зависит от различных параметров. Оптимальное количество модификатора поверхности может зависеть, например, от выбранных конкретных антипсихотического агента и модификатора поверхности, критической концентрации мицелл поверхности модификатора, в том случае, когда он образует мицеллы, 7 площади поверхности антипсихотического агента и т.д. Определенный модификатор поверхности предпочтительно присутствует в количестве от 0,1 до 1 мг на 1 м 2 площади поверхности антипсихотического агента. В том случае,когда в качестве антипсихотического агента используют 9-гидроксирисперидонпальмитат, а в качестве модификатора поверхности используют Pluronic F108, относительное количество(мас./мас.) обоих ингредиентов, составляющее приблизительно 6:1, является предпочтительным. Как используется в данном описании, выражение эффективный средний размер частиц меньше, чем 2000 нм означает, что, по крайней мере, 90% частиц имеет диаметр менее 2000 нм при измерении известными в данной области техники обычными способами, такими как седиментационное зонное фракционирование потока, протонная корреляционная спектроскопия или дисковое центрифугирование. Что касается эффективного среднего размера частиц, является предпочтительным, чтобы, по крайней мере,95% и более предпочтительно, по крайней мере,99% частиц имело размер частиц меньший, чем эффективный средний размер частиц, например 2000 нм. Наиболее предпочтительно, чтобы, по существу, все частицы имели размер меньший,чем 2000 нм. Частицы по данному изобретению могут быть получены способом, включающим стадии диспергирования антипсихотического агента в жидкой среде для дисперсии и применения механических устройств в присутствии измельчающей среды для уменьшения размера частиц антипсихотического агента до эффективного среднего размера частиц менее 2000 нм. Частицы могут быть уменьшены в размере в присутствии модификатора поверхности. Альтернативно, частицы могут быть приведены в контакт с модификатором поверхности после истирания. Общий способ получения частиц по данному изобретению включает(a) получение антипсихотического агента в тонкоизмельченной форме;(b) добавление тонкоизмельченного антипсихотического агента в жидкую среду для образования предварительной смеси; и(c) обработку предварительной смеси в механических устройствах в присутствии измельчающей среды для снижения эффективного среднего размера частиц. Выбранный антипсихотический агент в тонкоизмельченной форме получают коммерчески или готовят, используя способы, известные в данной области. Является предпочтительным,чтобы размер частиц тонкоизмельченного антипсихотического агента составлял менее, чем примерно 100 мкм, в соответствии с определением с использованием гранулометрического анализа. Если размер частиц тонкоизмельченного антипсихотического агента составляет более 8 примерно 100 мкм, то является предпочтительным, чтобы частицы антипсихотического агента были уменьшены в размере до менее чем 100 мкм. Тонкоизмельченный антипсихотический агент может быть добавлен к жидкой среде, в которой он, по существу, нерастворим, с образованием предварительной смеси. Концентрация антипсихотического агента в жидкой среде(мас.%/мас.) может широко меняться и зависит от выбранного антипсихотического агента, выбранного модификатора поверхности и других факторов. Подходящие концентрации антипсихотического агента в композициях изменяются от 0,1 до 60%, предпочтительно от 0,5 до 30% и более предпочтительно составляет приблизительно 7% (мас./об.). Более предпочтительный способ включает добавление модификатора поверхности к предварительной смеси перед тем, как ее обрабатывают механическими устройствами для уменьшения эффективного среднего размера частиц. Концентрация модификатора поверхности(мас.%/мас.) может изменяться от 0,1 до 90%,предпочтительно от 0,5 до 80% и более предпочтительно она составляет приблизительно 7%(мас./об.). Предварительная смесь может быть непосредственно использована для обработки механическими средствами для снижения эффективного среднего размера частиц в дисперсии до размера меньше, чем 2000 нм. Предпочтительно, чтобы непосредственно использовали предварительную смесь в том случае, когда для измельчения используется шаровая мельница. Альтернативно антипсихотический агент и, необязательно, модификатор поверхности, могут быть диспергированы в жидкой среде при использовании подходящего перемешивания, такого как, например, в вальцовой мельнице или миксере типа Коулеса (Cowles), до достижения гомогенной дисперсии. Механические устройства, применяемые для снижения эффективного среднего размера частиц антипсихотического агента, обычно имеют вид дисперсионной мельницы. Подходящие дисперсионные мельницы включают шаровую мельницу, мельницу тонкого помола(фрикционную мельницу), вибрационную мельницу, планетарную мельницу, мельницы с использованием измельчающих сред, такие как песчаная мельница и шариковая мельница. Мельница с использованием измельчающей среды является предпочтительной из-за относительно короткого времени измельчения, необходимого для достижения требуемого уменьшения размера частиц. Для измельчения с использованием измельчающей среды кажущаяся вязкость предварительной смеси составляет приблизительно между 0,1 и 1 Пас. Для шаровой мельницы кажущаяся вязкость предварительной 9 смеси предпочтительно составляет приблизительно между 1 и 100 мПас. Измельчающие среды для стадии уменьшения размера частиц могут быть выбраны из жестких сред, предпочтительно в форме сферических или макрочастиц, имеющих средний размер меньше чем 3 мм и более предпочтительно меньше чем 1 мм. Такие среды могут давать частицы по изобретению при коротком времени обработки и приводить к меньшему износу измельчающего оборудования. Предполагается, что выбор материала для измельчающей среды не является существенным. Однако 95% ZrO, стабилизированный окисью магния,силикат циркония и стеклянная измельчающая среда обеспечивают частицы, имеющие уровень загрязнения, который, как предполагается, является приемлемым для получения фармацевтических композиций. Кроме того, могут использоваться другие среды, такие как полимерные шарики, шарики из нержавеющей стали, окись титана, окись алюминия и 95% ZrO, стабилизированный иттрием. Предпочтительная измельчающая среда имеет плотность более 2,5 г/см 3 и включает 95% ZrO, стабилизированного окисью магния, и полимерные шарики. Время измельчения может широко изменяться и зависит, в первую очередь, от конкретного механического устройства и выбранных условий обработки. Для вальцовых мельниц может потребоваться время обработки до 2 дней или более. Частицы должны быть уменьшены в размере при температуре, которая не приводит в существенной степени к разложению антипсихотического агента. Обычно являются предпочтительными температуры обработки менее 3040 С. Если желательно, оборудование для обработки может охлаждаться с использованием обычного охлаждающего оборудования. Способ обычно осуществляют при температуре окружающей среды и давлениях обработки, которые являются безопасными и эффективными для спосoбов измельчения. Модификатор поверхности, в том случае если он не присутствует в предварительной смеси, должен быть добавлен к дисперсии после измельчения в количестве, как описано выше для предварительной смеси. После этого дисперсия может быть перемешана путем, например, интенсивного встряхивания. Дисперсия необязательно может быть подвергнута обработке ультразвуком с использованием, например, ультразвукового источника энергии. Водные композиции согласно настоящему изобретению обычно дополнительно включают суспендирующий агент и буфер и, необязательно, один или несколько консервантов и изотонический агент. Конкретные ингредиенты могут выступать к качестве двух или более таких агентов одновременно, например функциониро 002926 10 вать как консервант и как буфер или функционировать как буфер и изотонический агент. Подходящими суспендирующими агентами для использования в водных суспензиях согласно настоящему изобретению являются производные целлюлозы, например метилцеллюлоза, карбоксиметилцеллюлоза натрия и гидроксипропилметилцеллюлоза, поливинилпирролидон, альгинаты, хитозан, декстраны, желатин,полиэтиленгликоли, полиоксиэтиленовые и полиоксипропиленовые простые эфиры. Предпочтительно используют карбоксиметилцеллюлозу натрия в концентрациии от 0,5 до 2%, наиболее предпочтительно 1% (мас./об.). Подходящие смачивающие агенты для использования в водных суспензиях согласно настоящему изобретению представляют собой полиоксиэтиленовые производные сложных эфиров сорбита, например полисорбат 20 и полисорбат 80, лецитин, полиоксиэтиленовые и полиоксипропиленовые простые эфиры, деоксихолат натрия. Предпочтительно используют полисорбат 20 в концентрации от 0,5 до 3%, более предпочтительно от 0,5 до 2%, наиболее предпочтительно 1,1% (мас./об.). Подходящие буферные агенты представляют собой соли слабых кислот, и их следует использовать в количестве, достаточном для придания дисперсии нейтральности или очень слабой основности (вплоть до рН 8,5), предпочтительно в диапазоне рН от 7 до 7,5. Особенно предпочтительным является использование смеси динатрий гидрофосфата (безводного) (обычно примерно 0,9% (мас./об. и моногидрата дигидрофосфата натрия (обычно примерно 0,6%(мас./об Такой буфер также придает дисперсии изотонические свойства и, кроме того,меньшую склонность к флоккуляции (образованию хлопьев) суспендированного в ней сложного эфира. Консерванты представляют собой противомикробные агенты и антиоксиданты, которые могут быть выбраны из группы, состоящей из бензойной кислоты, бензилового спирта, бутилированного гидроксианизола, бутилированного гидрокситолуола, хлорбутола, галлата, гидроксибензоата, ЭДТК, фенола, хлоркрезола, метакрезола, хлорида бензетония, хлорида миристилпиколиния, ацетата фенилртути и тимерозаля. В частности, бензиловый спирт, который может использоваться в концентрации вплоть до 2% (мас./об.), предпочтительно вплоть до 1,5%(мас./об.). Изотонические агенты представляют собой, например, хлорид натрия, декстрозу, маннит, сорбит, лактозу, сульфат натрия. Суспензии обычно содержат от 0 до 10% (мас./об.) изотонического агента. Маннит может использоваться в концентрации от 0 до 7%. Однако более предпочтительно использовать от примерно 1 до примерно 3% (мас./об.), особенно от примерно 1,5 до примерно 2% (мас./об.) одного или нескольких электролитов для придания суспен 11 зии изотонических свойств, по-видимому, потому что ионы помогают предотвратить флоккуляцию суспендированного сложного эфира. В частности, электролиты буфера служат в качестве изотонического агента. Особенно желательной характеристикой препаративных форм депо для инъекций является легкость их введения. В частности, такая инъекция должна практически осуществляться с использованием максимально возможной тонкой иглы за максимально возможный короткий промежуток времени. Это может быть осуществлено для водных суспензий по настоящему изобретению путем поддержания вязкости ниже примерно 75 мПас, предпочтительно ниже 60 мПас. Водные суспензии такой или более низкой вязкости могут быть как легко набраны в шприц (например, из ампулы), так и инъецированы через тонкую иглу (например, иглу 21G 1 1/2, 22G 2 или 22G 1 1/4). Идеально, водные суспензии согласно настоящему изобретению будут содержать столько пролекарственного средства, сколько может переноситься для сохранения минимального объема инъекции и минимально возможного количества других ингредиентов. В частности,такая композиция будет содержать по весу из расчета на общий объем композиции(c) один или несколько буферных агентов,достаточных для придания композиции нейтральности или очень слабой основности (pН 8,5);(f) воды по необходимости до 100%. В плане полезности 9-гидроксирисперидона для лечения ряда болезненных состояний настоящее изобретение также касается фармацевтической композиции, описанной выше, для использования в качестве лекарственного средства для лечения психоза, шизофрении, шизоидоаффективных нарушений, нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний. Кроме того, настоящее изобретение относится к применению вышеописанной композиции для получения лекарственного средства для лечения психоза, шизофрении, шизоидоаффективных нарушений, нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома 12 Тоуретта, биполярной мании, депрессии, тревожных состояний. Далее, настоящее изобретение относится к способу лечения теплокровных животных, в частности людей, страдающих от психоза, шизофрении, шизоидоаффективных нарушений,нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний, причем указанный способ включает введение терапевтически эффективного количества вышеописанной водной суспензии. Обычно указанная препаративная форма вводится приблизительно через каждые 3 недели или даже с более длительными промежутками, насколько это возможно. Доза должна составлять от примерно 2 до 4 мг/кг веса тела. Следующие примеры предназначены для иллюстрации настоящего изобретения. Экспериментальная часть А. Получение сложного эфира 9-гидроксирисперидонпальмитата.N,N'-Дициклогексилкарбодиимид (1,39 г,6,8 ммоль) добавляли к раствору гексадекановой кислоты (1,54 г; 6 ммоль) в дихлорметане (140 мл) и перемешивали при комнатной температуре в течение 10 мин. К реакционной смеси добавляли 9-гидроксирисперидон (2,13 г; 5 ммоль), а затем 4-пирролидинопиридин (93 мг; 0,63 ммоль). Смесь перемешивали в течение 3 дней при комнатной температуре. К реакционной смеси добавляли воду (200 мл) и экстрагировали трижды хлороформом (100 мл). Объединенные органические слои сушили (MgSO4), фильтровали и упаривали. Смесь растирали в диизопропиловом эфире (100 мл), фильтровали и перекристаллизовывали из изопропанола (60 мл). Кристаллы отфильтровывали и сушили, получая сложный эфир 9-гидроксирисперидонпальмитат (2,67 г,80,4%). В. Примеры композиций. Приведенные далее в описании препаративные формы получали в соответствии со следующей общей методикой. Поверхностно-активное вещество, суспендирующий агент и буфер растворяли при перемешивании в воде при комнатной температуре и раствор стерилизовали нагреванием в течение 30 мин при 121 С. Активный ингредиент (тонкоизмельченный) стерилизовали гамма-облучением при 25 KGY и суспендировали в предварительно полученном растворе в стерильных условиях. Подходящие стеклянные ампулы наполняли примерно на 30% от их общего объема суспензией и измельчающей средой и затем подвергали вальцеванию при 50 об./мин в течение нескольких часов. Субмикронные препаративные формы затем просеивали для удаления измельчающей среды и хранили в стерильных(4,5% 9-гидроксирисперидона) Полисорбат 201,1% Карбоксиметилцеллюлоза натрия 30 мПас 1% Бензиловый спирт для парентерального введения 1,5% Гидрофосфат динатрия,безводный 0,9% Дигидрофосфат натрия,моногидрат 0,6% Вода до 100% Вязкость и значения рН для каждой из полученных таким образом субмикронных дисперсий A-D следующие. Препаративная форма рН Вязкость А 8,197 мПас В 7,98 мПас С 8,029 мПасD 7,98 10 мПас Распределение размера частиц измеряли с использованием Mastersizex X, а удельную площадь поверхности с использованием Mastersizex S. Для препаративных форм A-D были получены следующие значения: Удельная Размер частиц,Препаративная площадь помкм форма 2 10% 50% 90% верхности, м /г А 2,51 6,03 7,64 1,3 В 0,62 1,38 6,83 6,5 С 0,52 0,74 1,15 13,5D 0,43 0,52 0,65 15 Препаративные формы С и D оставляли на трехмесячный тест на стабильность и для хранившихся препаративных форм С и D были получены следующие значения: Размер частиц,Удельная Препаративная мкм площадь поформа 2 10% 50% 90% верхности, м /г С 0,27 0,40 0,62 13,5C.1. Фармакологическое испытание F1 и аналогичных масляных препаративных форм. Каждую из четырех препаративных формA-D вводили четырем собакам породы бигль внутримышечно в m.biceps femurus на левой задней лапе в дозе 2,5 мг/кг веса тела с использованием иглы 21G 1 1/2 BD Microlance; введение шприцом не вызывало проблем. Образцы 14 крови отбирали в течение 2 месяцев для определения уровня в плазме 9-гидроксирисперидона. Из экспериментальных данных рассчитывали следующие фармакокинетические параметрыD 132 (60) 6,3 (1,5) 34852 (14055) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция в виде препаративной формы депо для введения путем внутримышечной или подкожной инъекции,включающая дисперсию частиц, состоящую, по существу, из терапевтически эффективного количества пролекарственного средства кристаллического 9-гидроксирисперидонового сложного эфира жирной кислоты, имеющего формулу или его соли или его стереоизомера или стереоизомерной смеси, где R представляет собой линейный C9-C19 алкильный радикал; содержащих поверхностно-активное вещество, абсорбированное на их поверхности в количестве, эффективном для поддержания удельной площади поверхности 4 м 2/г (соответствующей эффективному среднему размеру частиц менее 2000 нм) в фармацевтически приемлемом носителе, включающем воду. 2. Композиция по п.1, где R представляет линейную C15 (пентадецильную) цепь и активный ингредиент представляет сложный эфир 9-гидроксирисперидонпальмитат. 3. Композиция по п.1, где композиция дополнительно включает суспендирующий агент и необязательно один или несколько консервантов, буферов и изотонических агентов. 4. Композиция по п.3, где суспендирующий агент представляет натрий карбоксиметилцеллюлозу, а поверхностно-активное вещество представляет полисорбат 20. 5. Композиция по п.4, где консервант представляет бензиловый спирт, а изотонический агент представляет маннит или фосфатный буфер. 6. Композиция по п.1, имеющая вязкость менее 75 мПас. 7. Композициия по п.3, включающая по весу из расчета на общий объем композиции(c) один или несколько буферных агентов,достаточных для придания композиции нейтральности или очень слабой основности(f) воды до 100%. 8. Применение фармацевтической композиции по любому из пп.1-7 для лечения психоза,шизофрении, шизоидоаффективных нарушений,нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными 16 заболеваниями, например со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии, тревожных состояний. 9. Применение композиции по любому из пп.1-7 для получения лекарственного средства для лечения психоза, шизофрении, шизоидоаффективных нарушений, нешизофренических психозов, поведенческих нарушений, связанных с нейродегенеративными заболеваниями, например, со слабоумием, поведенческих нарушений при умственной отсталости и аутизме, синдрома Тоуретта, биполярной мании, депрессии,тревожных состояний.
МПК / Метки
МПК: A61K 31/517, A61P 25/00
Метки: сложных, суспензии, субмикронных, водные, кислот, жирных, 9-гидроксирисперидоновых, эфиров
Код ссылки
<a href="https://eas.patents.su/9-2926-vodnye-suspenzii-submikronnyh-9-gidroksirisperidonovyh-slozhnyh-efirov-zhirnyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Водные суспензии субмикронных 9-гидроксирисперидоновых сложных эфиров жирных кислот</a>
Предыдущий патент: Восстановительное алкилирование гликопептидных антибиотиков
Следующий патент: Усовершенствования, касающиеся линз с переменным фокусным расстоянием
Случайный патент: Применение 4-[этил(диметил)аммонио]бутаноата для лечения сердечно-сосудистых заболеваний












