Аминоалкилзамещенные производные бензопирана
Номер патента: 4645
Опубликовано: 24.06.2004
Формула / Реферат
1. Соединение формулы (I)
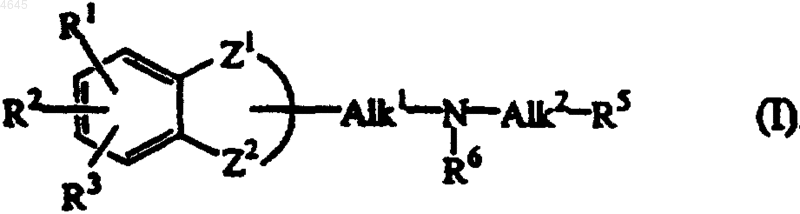
его стереохимически изомерные формы, его фармацевтически приемлемая кислотно-аддитивная соль,
где Alk1 представляет C1-6алкандиил, необязательно замещенный гидрокси;
Alk2 представляет C1-6алкандиил, замещенный гидрокси;
-Z1-Z2- представляет двухвалентный радикал формулы
-O-CH(R4)-CH2-CH2- (a-4)
R1, R2 и R3 каждый является водородом;
R4 представляет водород или ковалентную связь;
R6 представляет водород или фенилметил;
R5 представляет радикал формулы
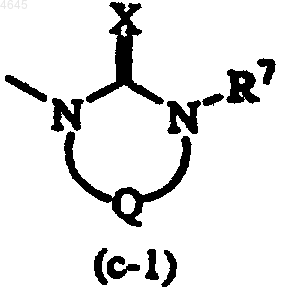
X представляет кислород;
R7 представляет водород или C1-6алкил и
Q представляет двухвалентный радикал формулы
| -CH2-CH2- | (d-1), |
| -CH2-CH2-CH2- | (d-2), |
| -CH2-CO- | (d-5), |
| -CO-CH2- | (d-6). |
2. Соединение по п.1, где R5 представляет радикал формулы (c-1), в которой X представляет кислород и Q представляет радикал формулы (d-2) или (d-5).
3. Соединение по п.1, где R4 представляет водород; Alk1 представляет -CH2-, Alk2 представляет -CH2-CHOH-CH2-, R6 представляет водород, R5 представляет радикал формулы (c-1), где X представляет кислород, R7 представляет водород и Q представляет (d-2).
4. Соединение по п.1, где R4 представляет водород; Alk1 представляет -CH2-, Alk2 представляет -CH2-CHOH-CH2-, R6 представляет водород, R5 представляет радикал формулы (c-1), где X представляет кислород, R7 представляет водород и Q представляет (d-5).
5. Соединение по п.1, где R4 представляет водород; Alk1 представляет -CHOH-CH2-, Alk2 представляет -CH2-CHOH-CH2-, R6 представляет водород, R5 представляет радикал формулы (c-1), где X представляет кислород, R7 представляет водород и Q представляет (d-2).
6. Соединение по п.1, где соединение представляет 1-[3-[[(3,4-дигидро-2H-1-бензопиран-2-ил)метил]амино]-2-гидроксипропил]-2,4-имидазолидиндион; его стереоизомерную форму или фармацевтически приемлемую кислотно-аддитивную соль.
7. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 тесно смешивают с фармацевтически приемлемым носителем.
9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
10. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (IV), где Alk1' представляет простую связь или C1-5алкандиил, подвергают восстановительному алкилированию промежуточным соединением формулы (III)
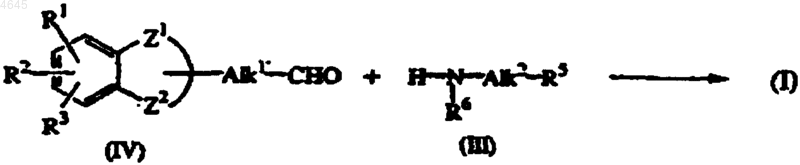
11. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (VI) подвергают взаимодействию с промежуточным соединением формулы (VII), получая таким путем соединения формулы (I-a), определенные как соединения формулы (I), в которой Alk2 представляет -CH2-CHOH-CH2-,
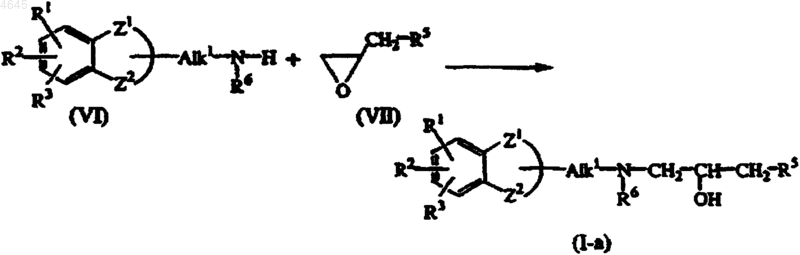
при этом в указанных выше схемах радикалы -Z1-Z2-, R1, R2, R3, R4, R5, R6 Alk1 и Alk2 имеют значения как в п.1 и W представляет собой подходящую уходящую группу.
Текст
1 Настоящее изобретение относится к новым соединениям аминоалкилхроманов, обладающим свойствами релаксации дна желудка. Изобретение также относится к способам получения таких соединений, фармацевтическим композициям, включающим указанные соединения,а также к применению указанных соединений в медицине. Структурно родственные производные аминометилхроманов раскрыты в US-5541199 в качестве селективных агонистов ауторецепторов, полезных в качестве антипсихотических агентов. Другие структурно родственные производные аминометилхроманов, обладающие сродством к церебральным 5-гидрокситриптаминовым рецепторам типа 5-HT1 и поэтому подходящие для лечения расстройств центральной нервной системы раскрыты в US-5137901. ЕР-0546388, опубликованная 16 июня 1993 года, раскрывает структурно родственные производные аминометилхроманов, обладающие сродством к церебральным 5-гидрокситриптаминовым рецепторам типа 5-HT1 и к допаминовым рецепторам типа D2. ЕР-0628310, опубликованная 14 декабря 1994 года, охватывает применение таких производных аминометилхроманов для ингибирования ВИЧ-протеазы.DE-2400094, опубликованная 18 июля 1974 года, раскрывает 1-[1-[2-(1,4-бензодиоксан-2-ил)2-гидроксиэтил]-4-пиперидил-2-бензимидазолиноны, обладающие действием по снижению кровяного давления.WO-93/17017, опубликованная 2 сентября 1993 года, раскрывает [(бензодиоксан, бензофуран или бензопиран)алкиламино]алкилзамещенные гуанидины в качестве селективных сосудосуживающих средств, полезных для лечения состояний, связанных с расширением кровеносных сосудов, таких как мигрень, "гистаминовая" головная боль и головная боль, связанная с сосудистыми расстройствами.WO-95/053837, опубликованная 23 февраля 1995 года, охватывает дигидробензопиранпиримидиновые производные, также обладающие сосудосуживающим действием. Другие структурно родственные производные аминометилхроманов раскрыты в WO97/28157, опубликованной 7 августа 1997 года,как антагонисты -адренергических рецепторов, 004645 2 применяемые для лечения дегенеративных неврологических состояний. Соединения по настоящему изобретению имеют структурные отличия от известных соединений предшествующего уровня техники,указанных выше, в том, что касается природы заместителя R5, а также фармакологические отличия, заключающиеся в том, что эти соединения неожиданно обладают свойствами релаксации дна желудка. Кроме того, соединения согласно настоящему изобретению обладают дополнительными полезными фармакологическими свойствами, заключающимися в том, что они обладают незначительным или совсем не обладают сосудосуживающим действием. В процессе поглощения пищи дно желудка, т.е. проксимальная часть желудка, расслабляется и обеспечивает функцию "резурвуара". Пациенты с нарушенной адаптивной релаксацией дна желудка при переваривании пищи, как оказалось, являются гипертензивными к растяжению желудка и обнаруживают симптомы диспепсии. Поэтому считают, что соединения,способные к нормализации нарушенной релаксации дна желудка, являются полезными для ослабления симптомов у пациентов, страдающих указанными симптомами диспепсии. Настоящее изобретение относится к соединениям формулы (I) их стереохимически изомерным формам, их фармацевтически приемлемым кислотноаддитивным солям, где-Z1-Z2- представляет двухвалентный радикал формулыR6 представляет водород или фенилметил;R7 представляет водород или C1-6 алкил, иQ представляет двухвалентный радикал формулы-СО-СН 2 Как использовано выше, родовое определение "галоген" относится к фтору, хлору, бро 3 му и иоду; С 1-4 алкил означает насыщенный углеводородный радикал с прямой или разветвленной цепью, имеющий от 1 до 4 атомов углерода, такой как метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и т.п.; C1-6 алкил включает С 1-4 алкил и его высшие гомологи,имеющие 5 или 6 атомов углерода, например, 2 метилбутил, пентил, гексил и т.п.; C1-2 алкандиил означает метилен или 1,2-этандиил; C1-3 алкандиил означает двухвалентный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 3 атомов углерода,например, метилен, 1,2-этандиил, 1,3-пропандиил и их разветвленные изомеры; С 1-5 алкандиил означает двухвалентный углеводородный радикал с прямой или разветвленной цепью,содержащий от 1 до 5 атомов углерода, например, метилен, 1,2-этандиил, 1,3-пропандиил,1,4-бутандиил, 1,5-пентандиил и их разветвленные изомеры; C1-6 алкандиил включает С 1-5 алкандиил и его высшие гомологи, имеющие 6 атомов углерода, например, 1,6-гександиил и т.п. Термин "СО" означает карбонильную группу. Некоторые примеры группы R5 представляют собой Термин "стереохимически изомерные формы", как он использован в данном описании выше, означает все возможные изомерные формы, которые могут иметь соединения формулы(I). Если не оговорено или не указано иное, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, при этом такая смесь содержит все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных (частично)насыщенных радикалах могут иметь либо цис- либо транс-конфигурацию. Соединения, включающие двойные связи,могут иметь Е или Z-стереохимию по указанной двойной связи. Стереохимически изомерные формы соединений формулы (I), как это очевидно, предназначены для охвата настоящим изобретением. Фармацевтически приемлемые кислотноаддитивные соли, как указано выше, включают терапевтически активные нетоксичные формы кислотно-аддитивных солей, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли могут быть удобно получены путем обработки формы основания подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты,например хлористо 004645 4 водородная или бромисто-водородная кислота,серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пирувиновая, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, паминосалициловая, памовая и подобные кислоты. И наоборот, указанные солевые формы могут быть преобразованы путем обработки подходящим основанием в форму свободного основания. Термин "аддитивная соль" как он использован в данном описании выше, включает сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такие сольваты представляют собой, например, гидраты, алкоголяты и т.п. Представляющими интерес соединениями являются такие соединения формулы (I), к которым применимы одно или несколько из нижеследующих ограничений:a) двухвалентный радикал -Z1-Z2- представляет собой формулу (а-4);d) Alk2 представляет C1-3 алкандиил, замещенный гидрокси, в частности Alk2 представляет собой СН 2-СНОН-СН 2-; и/илиe) R6 представляет водород или фенилметил. Конкретные соединения формулы (I) представляют такие соединения формулы (I) , в которых двухвалентный радикал -Z1-Z2- представляет собой формулу -СН 2-СН 2- (а-4). Предпочтительными соединениями являются такие соединения формулы (I), в которыхR5 представляет радикал формулы (с-1), в которой Х представляет кислород, и Q представляет радикал формулы (d-2) или (d-5). Более предпочтительными являются соединения формулы (I), в которой R4 представляет водород; Alk1 представляет -СН 2-; Alk2 представляет СН 2-СНОН-СН 2-; R6 представляет водород; R5 представляет радикал формулы (с-1),где Х представляет кислород, R7 представляет водород и Q представляет (d-2). Другими более предпочтительными соединениями являются соединения формулы (I),в которой R4 представляет водород; Alk1 представляет -СН 2-; Alk2 представляет СН 2-СНОНСН 2-; R6 представляет водород; R5 представляет радикал формулы (с-1), где Х представляет кислород, R7 представляет водород и Q представляет (d-5). 5 Еще более предпочтительными являются соединения формулы (I), в которой R4 представляет водород; Alk1 представляет -СНОН-СН 2-;Alk2 представляет CH2-CHOH-CH2-; R6 представляет водород; R5 представляет радикал формулы (с-1), где Х представляет кислород, R7 представляет водород и Q представляет (d-2). Наиболее предпочтительным соединением является 1-[3-3,4-дигидро-2 Н-1-бензопиран-2 ил)метил]амино]-2-гидроксипропил]-2,4 имидазолидиндион; его стереоизомерная форма или фармацевтически приемлемая кислотноаддитивная соль. Соединения по настоящему изобретению могут в основном быть получены путем алкилирования промежуточного соединения формулы (III) промежуточным соединением формулы(II), где W представляет собой подходящую удаляемую группу, такую как, например, галоген, например, фтор, хлор, бром, иод, или в некоторых случаях W может также представлять сульфонилоксигруппу, например, метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и т.п. реакционноспособные удаляемые группы. Реакцию можно осуществлять в инертном по отношению к реакции растворителе, таком как, например, ацетонитрил или тетрагидрофуран, и необязательно в присутствии подходящего основания, такого как,например, карбонат натрия, карбонат калия,оксид кальция и триэтиламин. Перемешивание может способствовать ускорению реакции. Реакцию удобно осуществляют при температуре между комнатной температурой и температурой кипения реакционной смеси с обратным холодильником и, если желательно, реакцию можно осуществлять в автоклаве при повышенной температуре. Соединения формулы (I) также могут быть получены путем восстановительного алкилирования промежуточного соединения формулы(IV), в которой Alk1' представляет простую связь или C1-5 алкандиил, следуя процедурам восстановительного алкилирования, известными из области техники, с промежуточным соединением формулы (III) Указанное восстановительное алкилирование осуществляют в инертном по отношению к реакции растворителе, таком как, например,дихлорметан, этанол, толуол или их смесь, и в присутствии восстановителя, такого как, например, боргидрид, например, боргидрид натрия,цианоборгидрид натрия или триацетоксиборгидрид. Также может быть удобным использо 004645 6 вание в качестве восстановителя водорода в сочетании с подходящим катализатором, таким как, например, палладий на угле, родий на углероде или платина на угле. В случае использования водорода в качестве восстановителя, может быть выгодным добавление к реакционной смеси дегидрирующего агента, такого как, например, трет-бутоксид алюминия. С целью предотвращения нежелательного дальнейшего гидрирования некоторых функциональных групп в реагентах и продуктах реакции, также может быть выгодным добавление к реакционной смеси каталитического яда, например, тиофена или хинолин-серы. Для ускорения реакции температура может быть повышена в пределах от комнатной температуры до температуры кипения реакционной смеси с обратным холодильником и, необязательно, в присутствии газообразного водорода. Альтернативно, соединения формулы (I) могут также быть получены взаимодействием хлорангидрида кислоты формулы (V), в которойAlk1' представляет С 1-5 алкандиил или простую связь, с промежуточным соединением формулы Указанное взаимодействие можно осуществлять в условиях гидрирования при помощи газообразного водорода в присутствии подходящего катализатора, такого как, например,палладий на активированном угле, родий на активированном угле или платина на активированном угле, в подходящем растворителе, таком как, например, этилацетат, и в присутствии оксида магния.С целью предотвращения дальнейшего нежелательного гидрирования некоторых функциональных групп в реагентах и продуктах реакции, также может быть выгодным добавление к реакционной смеси подходящего каталитического яда, например, тиофена или хинолинсеры. Для ускорения реакции температура может быть повышена в пределах от комнатной температуры до температуры кипения реакционной смеси с обратным холодильником и, необязательно, в присутствии газообразного водорода. Соединения формулы (I-а), определенные как соединения формулы (I), в которой Alk2 представляет -СН 2-СНОН-СН 2-, можно получить взаимодействием промежуточных соединений формулы (VI) с промежуточными соединениями формулы (VII) в инертном по отношению к реакции растворителе, таком как метанол,и, необязательно, в присутствии органического основания, такого как триэтиламин. Соединения формулы (I) также могут быть получены путем преобразования соединений формулы (I) друг в друга с помощью известных в технике реакций превращения функциональных групп. Например, соединения формулы (I),где R6 представляет собой фенилметил, могут быть преобразованы в соответствующие соединения формулы (I), где R6 представляет водород, путем известных в технике процедур дебензилирования. Указанное дебензилирование можно осуществлять, следуя известным процедурам, таким как каталитическое гидрирование,с использованием подходящих катализаторов,например, платина на активированном угле,палладий на активированном угле, в подходящих растворителях, таких как метанол, этанол,2-пропанол, диэтиловый эфир, тетрагидрофуран и т.д. Кроме того, соединения формулы (I), гдеR6 представляет водород, могут быть алкилированы с использованием известных в технике процедур, таких как, например, восстановительное N-алкилирование подходящим альдегидом или кетоном. Соединения формулы (I) могут также быть преобразованы в соответствующие N-оксидные формы, следуя известным в технике процедурам для преобразования трехвалентного азота в егоN-оксидную форму. Указанную реакцию Nокисления обычно осуществляют путем взаимодействия исходного материала формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, перекись водорода, перекиси щелочных или щелочноземельных металлов, например, перекись натрия, перекись калия; подходящие органические пероксиды включают пероксикислоты, такие как, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота,например, 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты, например, пероксоуксусная кислота, алкилгидропероксиды,например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.д., углеводороды, например, толуол, кетоны и т.д., 2 бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей. Исходные материалы и некоторые промежуточные продукты являются известными соединениями и являются коммерчески доступными или могут быть получены в соответствии с обычными реакционными процедурами, в основном известными из уровня техники. Например, некоторые промежуточные соединения 8 формулы (II) или (V) могут быть получены методами, известными из уровня техники, описанными в WO 93/17017 и WO 95/053837. Соединения формулы (I) и некоторые промежуточные соединения могут иметь в своей структуре один или несколько стереогенных центров, находящихся в R или S конфигурации,например, атом углерода, несущий заместительR4, и атом углерода, связанный с группой Alk1NR6-Alk2-R5. Соединения формулы (I), при их получении указанными выше способами, могут быть синтезированы в форме рацемических смесей энантиомеров, которые можно отделить один от другого при помощи известных в технике процедур разделения. Рацемические соединения формулы (I) могут быть преобразованы в соответствующие формы диастереомерных солей путем взаимодействия с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, при помощи селективной или фракционной кристаллизации,и энантиомеры высвобождают из них при помощи щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы(I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые изомерные формы также могут быть получены из соответствующих стереохимически чистых изомерных форм соответствующих исходных материалов,при условии, что реакция проходит стереоспецифически. Предпочтительно, когда хотят получить конкретный стереоизомер, указанное соединение синтезируют стереоспецифическим методом. Такие методы преимущественно включают использование энантиомерно чистых исходных материалов. Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые соли и стереизомерные формы обладают способствующими релаксации дна желудка свойствами,как можно видеть из фармакологического примера С.1, испытания "Желудочный тонус, измеренный при помощи электронного баростата у находящихся в сознании собак". Кроме того, соединения по настоящему изобретению обладают дополнительными полезными фармакологическими свойствами, заключающимися в том, что они обладают незначительным или совсем не обладают сосудосуживающим действием, как может быть продемонстрировано в фармакологическом примере С.2 "Сосудосуживающее действие на базилярную артерию". Сосудосуживающее действие может вызвать нежелательные побочные эффекты, такие как коронарные эффекты, вызывающие боль в грудной области. В свете способности соединений по настоящему изобретению вызывать релаксацию дна желудка, соединения, являющиеся предметом изобретения, являются полезными для ле 9 чения состояний, связанных с задержкой или нарушением релаксации дна желудка, таких как диспепсия, преждевременное насыщение, вздутие и анорексия. Диспепсию описывают как нарушение моторики. Симптомы могут быть вызваны замедленным высвобождением содержимого желудка или нарушенной релаксацией дна желудка при переваривании пищи. Теплокровные животные,включая человека (называемые в данном описании обобщенно "пациентами"), страдающие от симптомов диспепсии в результате замедленного опорожнения желудка, обычно имеют нормальную релаксацию дна желудка, и имеющиеся у них симптомы диспепсии можно облегчить путем введения прокинетического агента, такого как цисаприд. Пациенты могут иметь симптомы диспепсии и без нарушения опорожнения желудка. Такие симптомы диспепсии могут быть результатом гиперсокращенного дна желудка или гиперчувствительности в результате уменьшенной пластичности и отклонений адаптивной релаксации дна желудка. Гиперсокращенное дно желудка приводит к уменьшению пластичности желудка. "Пластичность желудка" может быть выражена как отношение объема желудка к давлению стенки желудка. Пластичность желудка относится к желудочному тонусу, который является результатом тонических сокращений мышечных волокон проксимальной части желудка. Эта проксимальная часть желудка, производя регулированные тонические сокращения (желудочный тонус), выполняет функцию резервуара желудка. Пациенты, страдающие преждевременным насыщением, не могут завершить процесс принятия пищи, поскольку они чувствуют насыщение до того, как они могут завершить указанный процесс принятия нормальной пищи. Обычно,когда субъект начинает есть, желудок демонстрирует адаптивную релаксацию, т.е. желудок расслабляется для принятия пищи, которая была проглочена. Такая адаптивная релаксация невозможна при замедленной пластичности желудка, что приводит к нарушенной релаксации дна желудка. В свете применимости соединений формулы (I), следует то, что настоящее изобретение обеспечивает также и способ лечения теплокровных животных, включая человека (в данном описании обобщенно "пациенты"), страдающих от нарушенной релаксации дня желудка при принятии пищи. Следовательно, обеспечивается способ лечения для облегчения состояния пациентов, страдающих от состояний, таких как диспепсия, преждевременное насыщение, вздутие и анорексия. Следовательно, обеспечивается применение соединения формулы (I) в качестве лекарственного средства и, в частности, применение соединений формулы (I) для производства лекарственного средства для лечения состояний, 004645 10 включающих нарушенную релаксацию дна желудка при принятии пищи. Предусматривается как профилактическое, так и терапевтическое лечение. Симптомы нарушенной релаксации дна желудка могут возникать из-за принятия химических веществ, например, селективных ингибиторов обратного захвата серотонина (SSRI),таких как флуоксепин, пароксетин, флувоксамин, циталопрам и сертралин. Для получения фармацевтических композиций по изобретению эффективное количество конкретного соединения, в форме основно- или кислотно-аддитивной соли, в качестве активного ингредиента объединяют в тесной смеси с фармацевтически приемлемым носителем, при этом носитель может иметь широкое разноообразие форм в зависимости от формы препарата,предназначенного для введения. Такие фармацевтические композиции желательно находятся в стандартной лекарственной форме, предпочтительно, для введения пероральным, ректальным путем или путем парентеральной инъекции. Например, для получения композиций лекарственной формы для перорального введения можно использовать любую обычную фармацевтическую среду, например, воду, гликоли,масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара,каолин, смазывающие вещества, связующие,дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения, таблетки и капсулы представляют наиболее преимущественную стандартную лекарственную форму для перорального введения, в этом случае, как это является очевидным,используют твердые фармацевтические носители. Для парентеральных композиций носитель включает стерильную воду, по меньшей мере, в большинстве случаев, хотя могут быть включены другие ингредиенты, например, вещества,способствующие растворению. Могут быть получены, например, растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут также быть получены суспензии для инъекций,в этом случае можно использовать подходящие жидкие носители, суспендирующие вещества и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно включает вещество, способствующее проникновению и/или подходящее смачивающее вещество, необязательно в сочетании с подходящими добавками любой природы в малых количествах, которые не оказывают какого-либо заметного неблагоприятного действия на кожу. Указанные добавки могут облегчать нанесение препарата на кожу и/или могут быть полезными для получения желаемой композиции. Такие композиции 11 можно вводить различными путями, например в виде чрескожного пластыря, в виде нанесенного пятна или в виде мази. Кислотно-аддитивные соли (I) из-за их улучшенной растворимости в воде по сравнению с соответствующей основной формой, видимо, являются более подходящими в приготовлении водных композиций. Особенно выгодно составлять вышеуказанные композиции в стандартную лекарственную форму для легкости введения и однородного дозирования. Стандартная лекарственная форма, как это используется в данном описании и формуле изобретения, относится к физически дискретным единицам, подходящим в качестве единичных дозировок, при этом каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для продуцирования желаемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки со(скором) меткой на поверхности или таблетки с покрытием),капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, препараты, отмеряемые мерной чайной ложкой,препараты, отмеряемые мерной столовой ложкой, и т.д. и их сегрегированные составляющие. Для перорального введения фармацевтические композиции могут принимать форму твердых лекарственных форм, например, таблеток(как только для проглатывания, так и жевательных форм), капсул или желатиновых капсул,полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие вещества (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например,лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества, (например, стеарат магния, тальк или двуокись кремния); разрыхлители (например, картофельный крахмал или натрий крахмал гликолят); или смачивающие вещества (например, лаурилсульфат натрия). На таблетки можно наносить покрытие при помощи способа, хорошо известного в технике. Жидкие препараты для перорального введения могут иметь форму, например, растворов,сиропов или суспензий, или они могут быть представлены в виде сухого продукта для получения состава с водой или другим подходящим носителем перед применением. Такие жидкие препараты можно получать традиционными способами, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита,метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или смола акации); неводные носители (например, мин 004645 12 дальное масло, маслянистые сложные эфиры или этиловый спирт); и консерванты (например,метил или пропил п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащивающие вещества предпочтительно включают,по меньшей мере, один интенсивный подсластитель, такой как сахарин, сахаринат натрия или кальция, аспартам, ацесульфам калия, цикламат натрия, алитам, дигидрокальконовый подсластитель, монеллин, стевиозид или сукралоза(4,1',6'-трихлор-4,1',6'-тридеоксигалактосахароза), предпочтительно сахарин, сахаринат натрия или кальция, и необязательно, объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза,гидрированный сироп глюкозы, ксилит, карамель или мед. Интенсивные подсластители обычно используют в низких концентрациях. Например, в случае сахарината натрия, концентрация находится в пределах от 0,04 до 0,1% (маc./об.) в расчете на общий объем конечной композиции,и предпочтительно от около 0,06% в композициях низкодозируемых препаратов и около 0,08% в композициях высокодозируемых препаратов. Объемный подсластитель можно эффективно использовать в больших количествах,составляющих от около 10 до около 35%, предпочтительно от около 10 до 15% (маc./об.). Фармацевтически приемлемые вкусовые добавки, которые маскируют имеющие горький вкус ингредиенты, в низкодозируемых препаратах предпочтительно представляют собой фруктовые добавки, такие как вишневая, малиновая,черносмородиновая или земляничная вкусовые добавки. Сочетание двух вкусовых добавок может дать очень хорошие результаты. В высокодозируемых препаратах могут потребоваться более сильные вкусовые добавки, такие как карамельно-шоколадная вкусовая добавка, мятноохлаждающая вкусовая добавка, фантазийная вкусовая добавка и т.п. фармацевтически приемлемые сильные вкусовые добавки. Каждая вкусовая добавка может присутствовать в конечной композиции в концентрации от 0,05 до 1% (маc./об.). Выгодно использовать сочетания таких сильных вкусовых добавок. Предпочтительно используют вкусовую добавку, которая не теряет и не изменяет своего вкуса и цвета в кислых условиях фармацевтического препарата. Соединения по настоящему изобретению также могут быть сформулированы в депо препараты. Такие композиции длительного действия можно вводить в качестве имплантатов (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения можно формулировать с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами,или в виде умеренно растворимых производ 13 ных, например, в виде умеренно растворимых солей. Можно получать композиции соединений по настоящему изобретению для парентерального введения путем инъекции, например, внутривенной, внутримышечной или подкожной инъекции путем болюсной инъекции или непрерывного внутривенного вливания. Препараты для инъекций могут быть представлены в виде стандартной лекарственной формы, например в ампулах или в многодозовых контейнерах, с добавленными консервантами. Композиции могут быть в форме суспензий, растворов или эмульсий в масляном или водном носителе, и могут содержать такие вещества, как изотонирующие, суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в форме порошка для составления препарата с подходящим носителем, например апирогенной водой,перед применением. Соединения по настоящему изобретению могут также быть сформулированы в композиции для ректального введения, такие как суппозитории или удерживающие клизмы, например,содержащие удобные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения соединения по изобретению можно использовать, например,в виде жидкого спрея, в виде порошка или в форме капель. Композиции по настоящему изобретению необязательно содержат ветрогонное средство,такое как симетикон, альфа -D-галактозидазу и т.п. В основном, считают, что терапевтически эффективное количество составляет от около 0,001 до около 2 мг/кг веса тела, предпочтительно от около 0,02 до около 0,5 мг/кг веса тела. Способ лечения может также включать введение активного ингредиента по схеме приема лекарственного средства от 2 до 4 раз в день. Экспериментальная часть В описанных ниже процедурах использованы следующие сокращения: "ACN" означает ацетонитрил и "DCM" означает дихлорметан. Для некоторых химических веществ использованы химические формулы, например CH2Cl2 для дихлорметана, СН 3 ОН - для метанола, NH3 для аммиака, НСl - для хлористо-водородной кислоты и NAOH - для гидроксида натрия. В случаях стереохимически изомерных форм, первая выделенная форма обозначена как"А", вторая - как "В", третья - как "С" и четвертая как "D", без дополнительной ссылки на действительную стереохимическую конфигурацию. А. Получение промежуточных соединений. Пример А.1. Реакционный раствор 1-(2-пропенил)-2,4 имидазолидиндиона (0,036 моль) и 3-хлорбен 004645 14 золкарбопероксовую кислоту (0,043 моль,70,75%) в DCM (25 мл) перемешивали в течение 2 ч при комнатной температуре. Добавляли водный раствор бисульфита (для удаления избытка 3-хлорбензолкарбопероксовой кислоты) и смесь перемешивали в течение 10 мин. ДобавлялиDCM. Отделенный органический слой сушили,фильтровали и выпаривали растворитель, получая 5 г (89%) -1-(оксиранилметил)-2,4-имидазолидиндиона (промежуточное соединение 1). Пример А.2.a) Раствор 2-гидроксипиримидина гидрохлорида (1:1) (0,075 моль) в метаноле (150 мл) перемешивали в течение 30 мин и затем добавляли к раствору карбоната натрия (0,075 моль) в метаноле (20 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 15 мин и охлаждали до 55 С. Добавляли по каплям раствор N,N-бис(фенилметокси)оксиранилметанамина (0,075 моль) в толуоле (160 мл) и реакционную смесь перемешивали в течение ночи при 50 С. Добавляли воду (75 мл) и смесь перемешивали при 55 С в течение 15 мин. Органический слой отделяли, промывали водой, сушили, фильтровали и выпаривали растворитель. Остаток очищали колоночной хроматографией над силикагелем (элюент: СН 3 ОН/СН 2 Сl2 97/3). Чистые фракции собирали и выпаривали растворитель, получая 11,8 г (45%) -1-[3[бис(фенилметил)амино]-2-гидроксипропил]-2(1 Н)пиримидинона (промежуточное соединение 2).b) Раствор промежуточного соединения (2)(0,034 моль) в метаноле (500 мл) гидрировали с использованием палладия на активированном угле в качестве катализатора в присутствии тиофена. После поглощения водорода (1 эквивалент), катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:СН 2 Сl2)/(СН 3 ОН/NН 3) 95/5). Чистые фракции собирали и растворитель выпаривали, получая 6,15 г (70%) тетрагидро-1-[2-гидрокси-3-[(фенилметил)амино]пропил]-2(1H)пиримидинон (промежуточное соединение 3). В. Получение конечных соединений. Пример B.1. 3,4-Дигидро-N-(фенилметил)-2 Н-1 бензопиран-2-метанамин (0,032 моль) в метаноле(100 мл) перемешивали при комнатной температуре. Добавляли по каплям раствор промежуточного соединения (1) (0,032 моль) в метаноле (50 мл) и полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3) 99/1). Желаемые фракции собирали и растворитель выпаривали, получая 1-[3-3,4-дигидро-2 Н-1-бензопиран-2-ил)метил] 15 Пример В.2. Смесь 3,4-дигидро-2 Н-1-бензопиран-2-карбоксальдегида (0,023 моль) и промежуточного соединения (3) (0,023 моль) в метаноле (250 мл) гидрировали с использованием палладия на активированном угле (10%) в качестве катализатора в присутствии тиофена. После поглощения водорода (1 эквивалент) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН 99/1). Чистые фракции собирали и растворитель выпаривали, получая 5,9 г (62%)-1-[3-3,4-дигидро-2 Н-1 бензопиран-2-ил)метил](фенилметил)амино]-2 гидроксипропил]тетрагидро-2(1 Н)-пиримидинона (соед. 1). Пример В.3. Смесь соединения (3) (0,0086 моль) в метаноле (100 мл) гидрировали при 25 С с использованием палладия на активированном угле (1 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывали и фильтрат упаривали. Остаток растворяли в ACN и преобразовывали в соль хлористо-водородной кислоты (1:1) при помощиa) Раствор 2-гидроксипиримидина (0,16 моль) в метаноле (300 мл) перемешивали при комнатной температуре в течение 30 мин. Добавляли раствор Nа 2 СО 3 (0,16 моль) в метаноле(40 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 15 мин и охлаждали до 55 С. Добавляли по каплям раствор(0,16 моль) в толуоле (320 мл). Смесь перемешивали в течение ночи при 50C. Добавляли воду (150 мл). Смесь перемешивали при 55 С в течение 15 мин. Органический слой отделяли,промывали водой, сушили, фильтровали и выпаривали растворитель. Остаток очищали колоночной хроматографией над силикагелем (элюент: СН 2 Сl2/СН 3 ОН 97/3). Чистые фракции собирали и выпаривали растворитель, получая 26,55 г -1-[3-[бис(фенилметил)амино]-2-гидроксипропил]-2(1 Н)пиримидинона (промежуточное соединение 4).b) Смесь промежуточного соединения (4)Pd/C 10% (2 г) в качестве катализатора. После поглощения водорода (3 эквивалента) катализатор отфильтровывали и фильтрат упаривали. Остаток разделяли на его энантиомеры при помощи ВЭЖХ (элюент: гексан:ЕtOН 50/50; Chiralpak AD 100020 мкм). Чистые фракции собирали и растворитель выпаривали, получая 4 гc) Смесь [S-(R,R)]-3,4-дигидро-2-оксиранил-2 Н-1-бензопирана (0,006 моль) и промежуточного соединения (5) (0,006 моль) в этаноле (25 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Растворитель выпаривали и остаток очищали ВЭЖХ (элюент: гексан/этанол 70/30; Chiralcel OJ 20 мкм). Чистые фракции собирали и растворитель выпаривали, получая 1,7 г [S(А)]-1-[3-2-(3,4-дигидро 2 Н-1-бензопиран-2-ил)-2-гидроксиэтил](фенилметил)амино]-2-гидроксипропил]тетрагидро 2(1 Н)-пиримидинона (промежуточное соединение 6).d) Смесь промежуточного соединения (6)(0,004 моль) в СН 3 ОН (100 мл) гидрировали с использованием Pd/C 10% (0,5 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывали. Реакционную смесь преобразовывали в соль хлористо-водородной кислоты (1:1) при помощи НСl/2-пропанола. Добавляли DIPE. Осадок отфильтровывали и сушили с получением 0,69 г Соединение 15 В табл. F-1 и F-2 перечислены соединения,которые были получены в соответствии с одним из вышеприведенных примеров, и в таблице F.3 представлены как экспериментальные (графа озаглавлена "эксп."), так и теоретические (графа озаглавлена "теор.") данные элементного анализа для углерода, водорода и азота некоторых соединений, полученных как описано в экспериментальной части выше. Таблица F-1.С 2 Н 2O4 означает этандиоатную соль Таблица F-2 С. Фармацевтические примеры. С.1. Желудочный тонус, измеренный электронным баростатом у находящихся в сознании собак. Желудочный тонус нельзя измерить манометрическими способами. Поэтому использовали электронный баростат. Это позволяет изучать физиологические особенности и регуляцию 18 желудочного тонуса у находящихся в сознании собак, а также влияние испытываемых соединений на этот тонус. Баростат состоит из системы нагнетания воздуха, которая соединена через двухпросветную интубационную поливиниловую трубку 14French со сверхтонким полиэтиленовым мешком (максимальный объем 700 мл). Изменения желудочного тонуса измеряют, записывая изменения объема воздуха в находящемся внутри желудка мешке, поддерживая при этом постоянное давление. Баростат поддерживает постоянное давление (предварительно выбранное) внутри тонкого заполненного воздухом мешка в желудке, при изменении объема воздуха внутри мешка при помощи электронной системы с обратной связью. Таким образом, баростат измеряет активность двигательной функции желудка (сжатие или релаксацию) по мере изменения внутрижелудочного объема (уменьшение или увеличение соотв.) при постоянном давлении внутри желудка. Баростат состоит из тензиометрического датчика, соединенного при помощи электронной системы с системой нагнетания воздухааспирации. Как тензиометрический датчик, так и система dghscrf подсоединены при помощи двухпросветной интубационной поливиниловой трубки к сверхтонкому полиэтиленовому мешку. Деления в баростате позволяют выбрать уровень давления, который поддерживается внутри находящегося в желудке мешка. Самок коротконогих гончих собак весом 717 кг обучали спокойно стоять в рамочной конструкции Павлова. Им имплантировали желудочную канюлю под общим наркозом в асептических условиях. После медианной лапаротомии делали разрез через стенку желудка в продольном направлении между большей и меньшей кривой на 2 см выше нервов впрыска. Канюлю удерживали в стенке желудка при помощи двойных кисетных швов и выводили наружу через рану в левой подреберной области. Собак оставляли на период выздоровления в течение 2 недель. В начале эксперимента канюлю оставляли открытой для удаления желудочного сока или остатков пищи. Если было необходимо, желудок промывали 40-50 мл теплой воды. Сверхтонкий мешок баростата размещали в донной части желудка через желудочную канюлю. Для обеспечения легкости раскрытия внутрижелудочного мешка в процессе эксперимента в мешок дважды инжектировали объем 300-400 мл. В процессе стабилизационного периода максимально 90 мин объем желудка оставался стабильным в течение 15 мин при постоянном давлении 6 мм рт.ст. (около 0,81 кПа), испытываемое соединение вводили подкожно (п.к.) или интрадуоденально (и.д.). Испытываемые соединения подвергали скринингу, т.е. измеряли изменения объема желудка, обычно при 0,63 19 мг/кг. Другие дозы и пути введения испытывали, если испытываемое соединение показывало активность в процессе осуществления скрининговых процедур. В табл. С-1 представлены средние значения максимального изменения объема при релаксации дна желудка в течение периода наблюдения 1 ч после п.к. и и.д. введения испытываемого соединения (0,63 мг/кг). Таблица С-1 Соед. Путь Макс. изм. Соед. Путь Макс. изм.введения объема, млвведения объема, мл 5 П.к. 41 14 И.д. 144 6 П.к. 146 14 П.к. 90 7 П.к. 34 15 И.д. 5 С.2. Сосудосуживающее действие на базилярную артерию. Сегменты базилярных артерий, полученные от свиней (анестезированных пентобарбиталом) подвешивали для записи изометрического напряжения в ванне для органов. Препараты выдерживали в растворе Krebs-Henseleit. Раствор поддерживали при 37 С и газировали смесью 95% O2 - 5% СО 2. Препараты растягивали до тех пор, пока не получали стабильное базальное напряжение 2 г. Препараты заставляли сжиматься при помощи серотонина (3 х 10-7 М). Измеряли ответную реакцию на добавление серотонина и после этого серотонин вымывали из препарата. Эту процедуру повторяли до тех пор, пока не получали стабильный ответ. После этого испытываемое соединение вводили в ванну для органов и измеряли сжимание препарата. Такую сжимающую ответную реакцию выражали как процент ответа на серотонин, который был измерен ранее. Значение ED50 (молярная концентрация) определяли как концентрацию, при которой испытываемое соединение вызывает 50% конструктивной ответной реакции, полученной с серотонином. Указанные значения ED50 определяли из экспериментов с использованием трех разных препаратов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его стереохимически изомерные формы, его фармацевтически приемлемая кислотноаддитивная соль, где-Z1-Z2- представляет двухвалентный радикал формулыR4 представляет водород или ковалентную связь;R6 представляет водород или фенилметил;R7 представляет водород или C1-6 алкил и Q представляет двухвалентный радикал формулы-СО-СН 22. Соединение по п.1, где R5 представляет радикал формулы (с-1), в которой Х представляет кислород и Q представляет радикал формулы (d-2) или (d-5). 3. Соединение по п.1, где R4 представляет водород; Alk1 представляет -СH2-, Alk2 представляет -СН 2-СНОН-СН 2-, R6 представляет водород, R5 представляет радикал формулы (с-1),где Х представляет кислород, R7 представляет водород и Q представляет (d-2). 4. Соединение по п.1, где R4 представляет водород; Alk1 представляет -СН 2-, Alk2 представляет -CH2-CHOH-CH2-, R6 представляет водород, R5 представляет радикал формулы (с-1),где Х представляет кислород, R7 представляет водород и Q представляет (d-5). 5. Соединение по п.1, где R4 представляет водород; Alk1 представляет -СНОН-СН 2-, Alk2 представляет -СН 2-СНОН-СН 2-, R6 представляет водород, R5 представляет радикал формулы (с 1), где Х представляет кислород, R7 представляет водород и Q представляет (d-2). 6. Соединение по п.1, где соединение представляет 1-[3-(3,4-дигидро-2 Н-1-бензопиран-2-ил)метил]амино]-2-гидроксипропил]-2,4 имидазолидиндион; его стереоизомерную форму или фармацевтически приемлемую кислотно-аддитивную соль. 7. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6. 8. Способ получения фармацевтической композиции по п.7, в котором терапевтически активное количество соединения по любому из пп.1-6 тесно смешивают с фармацевтически приемлемым носителем. 9. Применение соединения по любому из пп.1-6 в качестве лекарственного средства. 10. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (IV), где Alk1' представляет простую связь или С 1-5 алкандиил, подвергают восстановительному алкилированию промежуточным соединением формулы (III) 11. Способ получения соединения формулы (I), в котором промежуточное соединение формулы (VI) подвергают взаимодействию с промежуточным соединением формулы (VII),получая таким путем соединения формулы (I-а),определенные как соединения формулы (I), в которой Alk2 представляет -СН 2-СНОН-СН 2-, 22 при этом в указанных выше схемах радикалы-Z1-Z2-, R1, R2, R3, R4, R5, R6 Alk1 и Alk2 имеют значения как в п.1 и W представляет собой подходящую уходящую группу.
МПК / Метки
МПК: A61P 9/08, C07D 405/12, A61K 31/4164
Метки: аминоалкилзамещенные, бензопирана, производные
Код ссылки
<a href="https://eas.patents.su/12-4645-aminoalkilzameshhennye-proizvodnye-benzopirana.html" rel="bookmark" title="База патентов Евразийского Союза">Аминоалкилзамещенные производные бензопирана</a>
Предыдущий патент: Способ получения яичного желтка, обогащенного натуральными антисекреторными белками, яичный желток, полученный данным способом, и продукты, содержащие указанный желток
Случайный патент: Фармацевтические композиции, содержащие высшие первичные алифатические спирты и ингибитор гмг-коа-редуктазы, и способ их получения












