Производные циклобутендиона, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4268
Опубликовано: 26.02.2004
Авторы: Толлон Катрин, Вийенёв Николь, Пуатевин Кристоф, Бурньён Мари-Пьер, Вилайне Жан-Поль, Пеглиён Жан-Луи
Формула / Реферат
1. Соединения формулы (I)
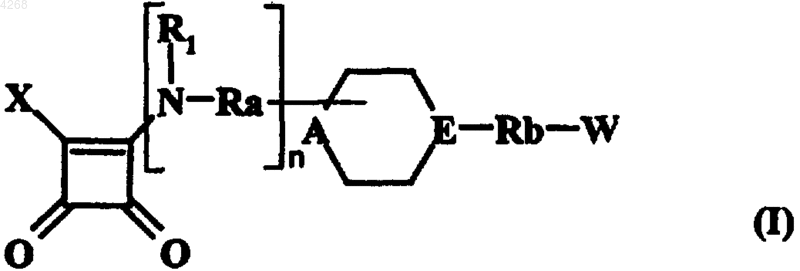
в которой X обозначает моноциклический или бициклический, насыщенный, частично ненасыщенный либо ароматический гетероцикл с 5-12 членами кольца, содержащий от 1 до 3 гетероатомов, которые выбирают из кислорода, азота и серы, однако по меньшей мере один атом азота, причем указанный гетероцикл связан с остальной молекулой посредством упомянутого атома азота и необязательно замещен,
или группу формулы -NR2R3, в которой R2 представляет собой атом водорода либо линейную или разветвленную (C1-C6)алкильную группу, а R3 обозначает необязательно замещенную арильную группу, 1,3-дигидро-2H-бензимидазолил-2-оновую группу или линейный либо разветвленный (C1-C6)алкил, замещенный моноциклическим или бициклическим, насыщенным, частично ненасыщенным либо ароматическим гетероциклом с 5-12 членами кольца, содержащим от 1 до 3 гетероатомов, которые выбирают из кислорода, азота и серы, однако по меньшей мере один атом азота, причем упомянутый гетероцикл необязательно замещен,
n равно нулю или 1,
R1 обозначает атом водорода или линейную либо разветвленную (C1-C6)алкильную группу,
Ra представляет собой простую связь или линейную либо разветвленную (C1-C6)алкиленовую цепь,
A обозначает атом азота или CH-группу, причем CH-группа возможна только в том случае, если Ra обозначает простую связь, а атом азота, если n равно нулю,
E представляет собой атом азота или CRe-группу, в которой Re обозначает либо атом водорода, либо связь с атомом углерода группы W, причем по меньшей мере одна из групп A и E обозначает атом азота,
Rb представляет собой простую связь или линейную либо разветвленную (C1-C6)алкиленовую цепь, один из атомов углерода которой необязательно замещен атомом кислорода или серы,
W обозначает арильную или гетероарильную группу, каждая из которых необязательно замещена,
их оптические изомеры, гидраты, сольваты и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты,
причем "арильная группа" обозначает группу, которую выбирают из фенила, бифенила, бицикло[4,2,0]окта-1,3,5-триенила, нафтила, дигидронафтила, тетрагидронафтила, инданила и инденила,
под "гетероарильной группой" подразумевается указанная выше арильная группа, содержащая 1-3 идентичных или отличающихся друг от друга гетероатома, которые выбирают из кислорода, азота и серы,
определение "необязательно замещенный", если оно употребляется применительно к "гетероциклу", "арильной группе" или "гетероарильной группе", обозначает, что они необязательно замещены одной или несколькими идентичными либо отличающимися друг от друга группами, которые выбирают из галогеновой, линейной или разветвленной (C1-C6)алкильной, гидрокси-, линейной либо разветвленной (C1-C6)алкокси-, меркапто-, линейной или разветвленной (C1-C6)алкилтио-, линейной либо разветвленной (C1-C6)тригалоалкильной, циано-, нитро-, амино-, линейной или разветвленной (C1-C6)алкиламино-, диалкиламиногруппы, в которой каждая алкильная часть имеет 1-6 атомов углерода и является линейной или разветвленной, и метилендиоксигруппы,
под "оптическими изомерами" подразумеваются энантиомеры и диастереомеры.
2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
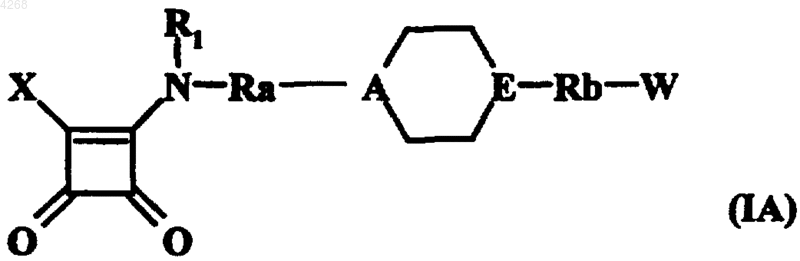
в которой X, R1, Ra, A, E, Rb и W принимают значения, приведенные для формулы (I), их оптические изомеры, гидраты, сольваты и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
3. Соединения формулы (I) по п.1, отличающиеся тем, что X обозначает гетероцикл, приведенный для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
4. Соединения формулы (I) по п.1, отличающиеся тем, что X представляет собой группу формулы -NR2R3, приведенную для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
5. Соединения формулы (I) по п.1 или 3, отличающиеся тем, что X обозначает 1-индолинильную группу, необязательно замещенную одной или несколькими группами, приведенными для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
6. Соединения формулы (I) по п.1 или 3, отличающиеся тем, что X представляет собой 2,3-дигидро-1H-пирроло[2,3-c]пиридин-1-ильную группу, необязательно замещенную одной или несколькими группами, приведенными для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
7. Соединения формулы (I) по п.1 или 4, отличающиеся тем, что X обозначает группу формулы -NR2R3, в которой R2 представляет собой атом водорода, а R3 обозначает необязательно замещенную фенильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
8. Соединения формулы (I) по п.1, отличающиеся тем, что W обозначает гетероарильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
9. Соединения формулы (I) по п.1 или 8, отличающиеся тем, что W представляет собой бензофурильную или индолильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
10. Соединения формулы (I) по п.1, отличающиеся тем, что -Rb-W совместно обозначают арилоксиалкильную группу, в которой алкильная часть имеет 1-5 атомов углерода и является линейной или разветвленной, а арильная часть необязательно замещена, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
11. Соединения формулы (I) по п.1, представляющие собой
3-анилино-4-({2-[4-(феноксиметил)-1-пиперидинил]этил}амино)-3-циклобутен-1,2-дион и его метансульфонат,
3-(4-хлороанилино)-4-({2-[4-(феноксиметил)-1-пиперидинил]этил}амино)-3-циклобутен-1,2-дион и его метансульфонат,
3-(2,3-дигидро-1H-индол-1-ил)-4-({2-[4-(феноксиметил)-1-пиперидинил]этил}амино)-3-циклобутен-1,2-дион и его метансульфонат,
3-({1-[2-(1-бензофуран-3-ил)этил]-4-пиперидинил}амино)-4-(4-фтороанилино)-3-циклобутен-1,2-дион и его метансульфонат,
4-{[2-({1-[2-(1-бензофуран-3-ил)этил]-4-пиперидинил}амино)-3,4-диоксо-1-циклобутен-1-ил]амино}бензонитрил и его метансульфонат,
3-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-4-[(2-оксо-2,3-дигидро-1H-бензимидазол-5-ил)амино]-3-циклобутен-1,2-дион и его метансульфонат,
3-(5-метокси-2,3-дигидро-1H-пирроло[2,3-c]пиридин-1-ил)-4-({2-[4-(феноксиметил)-1-пиперидинил]этил}амино)-3-циклобутен-1,2-дион и его дихлоргидрат,
3-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-4-(5-метокси-2,3-дигидро-1H-пирроло[2,3-c]пиридин-1-ил)-3-циклобутен-1,2-дион и его дихлоргидрат,
3-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-4-(4,5,6-триметокси-2,3-дигидро-1H-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат,
3-(6-хлоро-2,3-дигидро-1H-индол-1-ил)-4-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-3-циклобутен-1,2-дион и его метансульфонат,
3-(2,3-дигидро-1H-индол-1-ил)-4-[({1-[2-(1H-индол-3-ил)этил]-3-пиперидинил}метил)амино]-3-циклобутен-1,2-дион и его хлоргидрат,
3-(5,6-диметокси-2,3-дигидро-1H-индол-1-ил)-4-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-3-циклобутен-1,2-дион и его метансульфонат,
3-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-4-(6-метоксш-2,3-дигидро-1H-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат и
3-(4,5-диметокси-2,3-дигидро-1H-индол-1-ил)-4-[(2-{4-[2-(4-фторофенокси)этил]-1-пиперидинил}этил)амино]-3-циклобутен-1,2-дион и его метансульфонат.
12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II)
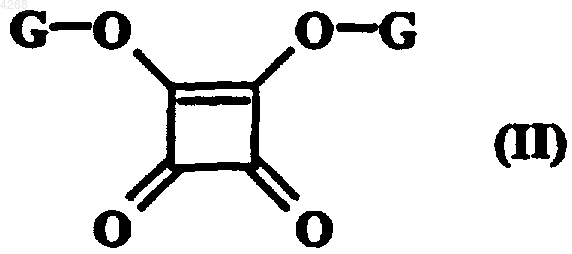
в которой G обозначает линейную или разветвленную (C1-C4)алкильную группу, вводя соединение формулы (II) в реакцию с амином формулы (III)
X-H (III),
в которой X принимает значения, приведенные для формулы (I), и получая соединение формулы (IV)
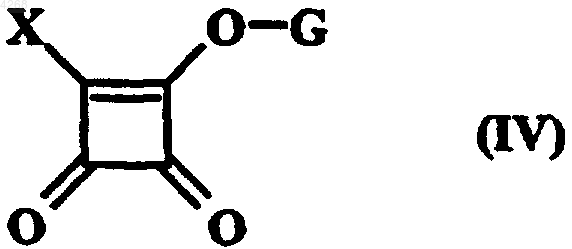
в которой X и G принимают приведенные выше значения,
после чего соединение формулы (IV) обрабатывают соединением формулы (V)

в которой n, R1, Ra, Rb, A, E и W принимают значения, указанные для формулы (I), получая соединения формулы (I)
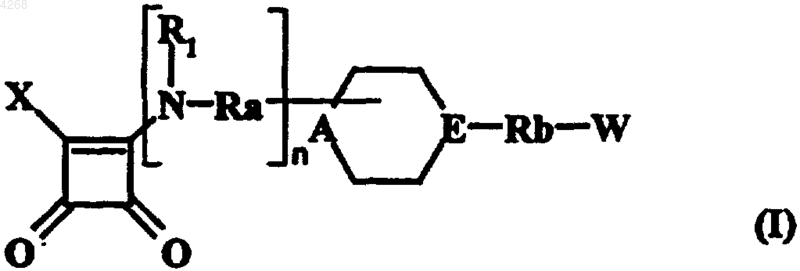
после чего соединения формулы (I), если это необходимо, очищают с помощью традиционной методики очистки, при желании, обычным методом разделения разделяют на различные оптические изомеры и, при желании, переводят в их соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты.
13. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп.1-11 в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми экспипиентами или носителями.
14. Фармацевтические композиции по п.13, включающие по меньшей мере один активный ингредиент по любому из пп.1-11, предназначенные для применения при лечении заболеваний и патологических состояний, при которых наблюдается эндотелиальная дисфункция.
15. Фармацевтические композиции по п.13, включающие по меньшей мере один активный ингредиент по любому из пп.1-11, предназначенные для применения с целью предупреждения развития и увеличения площади атеросклеротических повреждений, а также связанных с ними осложнений, предупреждения сосудистых осложнений после операций по сосудистому шунтированию, расширению сосудов, операций, направленных на возобновление проходимости сосудов, или таковых по трансплантации сердца, либо лечения ишемии миокарда или периферической ишемии, сердечной недостаточности и гипертензии легочной артерии.
Текст
1 Настоящее изобретение относится к новым соединениям циклобутендиона, способу их получения и содержащим их фармацевтическим композициям. Соединения по настоящему изобретению можно применять при лечении заболеваний или патологических состояний, при которых в качестве патогенного механизма и/или такового аггравации выступает эндотелиальная дисфункция. Подобными патологиями являются атеросклероз, наличие факторов риска возникновения сосудистых заболеваний (дислипидемия, диабет, системная артериальная гипертензия), различные клинические формы ишемии миокарда или периферической ишемии, сердечная недостаточность и ряд форм гипертензии легочной артерии. Упомянутые соединения также могут применяться при лечении пациентов, с которыми проводят операции по трансплантации сердца или возобновлению проходимости сосудов,такие как шунтирование, тромболиз или расширение артерий с использованием стента или без него. Понижение уровня закиси азота (NO) в сосудах представляет собой основной механизм развития эндотелиальной дисфункции, наблюдаемой при вышеупомянутых заболеваниях и патологических состояниях, и отражает патогенную роль этого процесса (Cardiovasc. Res.,1999, 43, 572; Coronary. Art. Dis. 1999, 10, 277;Dis., 1999, 10, 287; Coronary. Art. Dis., 1999, 10,295). При указанных патологических состояниях причинами эндотелиальной дисфункции могут быть, фактически, две: 1) недостаточная продукция NO, связанная с ингибированием эндотелиальной NO-синтазы эндогенными ингибиторами, такими как АДМА (асимметричный диметиларгинин), присутствующими в повышенных концентрациях в плазме пациентов, у которых наблюдаются факторы риска возникновения сердечно-сосудистых заболеваний (Cardiovasc. Res., 1999, 43, 542; Hypertension, 1997,29, 242; Circulation, 1997, 95, 2068), 2) инактивация NO анионом супероксида (O2-), продукция которого повышается при патологических состояниях (Cardiovasc. Res., 1999, 43, 562; Eur. JBiochem. 1997, 245. 541; J. Clin. Invest., 1993, 91,2546). В нормальных условиях основными функциями NO являются такие, как: 1) регуляция артериальной вазомоторики, когда она действует в качестве вазодилататора (N Engl. J. Med.,1993, 329, 2002; Nature, 1980, 288, 373), 2) ограничение адгезии и агрегации тромбоцитов(Trends Pharmacol. Sci., 1991, 12, 87), 3) устранение адгезии лейкоцитов и моноцитов с эндотелиальными клетками (Рrос. Natl Acad. Sci.USA, 1991, 88, 4651), 4) ингибирование пролиферации клеток гладкой мышечной ткани сосудов (Cardiovasc. Res., 1999, 43, 580, Circulation, 004268 2 1993, 87, V51), что является объяснением того,почему дефицит NO в стенке артерии способствует возникновению патологических явлений,таких как вазоконстрикция, тромбоз, аккумуляция липидов и пролиферация клеток гладкой мышечной ткани сосудов. Эксперименты in vitro позволили продемонстрировать, что соединения по настоящему изобретению способны ограничивать эндотелиальную дисфункцию и понижение уровня NO в сосудах, индуцированные в ходе исследований с использованием двух уже упомянутых физиопатологических механизмов: ингибирования эндотелиальной NO-синтазы и окислительного стресса, возникающего в результате продукции O2-. Помимо новизны, соединения по настоящему изобретению, благодаря их специфической фармакологической активности, позволяющей им ограничивать развитие эндотелиальной дисфункции, могут применяться для предупреждения развития и увеличения площади атеросклеротических повреждений, а также связанных с ними осложнений, в особенности, у пациентов, у которых наблюдается фактор риска возникновения сосудистого заболевания(дислипидемия, диабет, артериальная гипертензия), а также при лечении различных клинических форм ишемии миокарда или периферической ишемии, сердечной недостаточности и ряда форм гипертензии легочной артерии. Соединения также применяют для предупреждения сосудистых осложнений (спазм, тромбоз, рестеноз, ускоренный атеросклероз) у пациентов, с которыми проводят операции по шунтированию, расширению сосудов с использованием стента или без него либо другие операции, направленные на возобновление проходимости сосудов, или таковые по трансплантации сердца. В частности, настоящее изобретение относится к соединениям формулы (I) в которой Х обозначает моноциклический или бициклический, насыщенный, частично ненасыщенный либо ароматический гетероцикл с 5-12 членами кольца, содержащий от 1 до 3 гетероатомов, которые выбирают из кислорода, азота и серы, однако по меньшей мере один атом азота,причем указанный гетероцикл связан с остальной молекулой посредством упомянутого атома азота и необязательно замещен,или группу формулы -NR2R3, в которой R2 представляет собой атом водорода либо линейную или разветвленную (С 1-С 6)алкильную группу, а R3 обозначает необязательно замещенную арильную группу, 1,3-дигидро-2 Нбензимидазолил-2-оновую группу или линейную либо разветвленную (C1-С 6)алкильную 3 группу, замещенную моноциклическим или бициклическим, насыщенным, частично ненасыщенным либо ароматическим гетероциклом с 512 членами кольца, содержащим от 1 до 3 гетероатомов, которые выбирают из кислорода, азота и серы, однако по меньшей мере один атом азота, причем упомянутый гетероцикл необязательно замещен,n равна нулю или 1,R1 обозначает атом водорода или линейную либо разветвленную (C1-С 6)алкильную группу,Ra представляет собой простую связь или линейную либо разветвленную (С 1-С 6)алкиленовую цепь,А обозначает атом азота или СН-группу,причем СН-группа возможна только в том случае, если Ra обозначает простую связь, а атом азота - если n равна нулю,Е представляет собой атом азота или CReгруппу, в которой Re обозначает либо атом водорода, либо связь с атомом углерода W, причем по меньшей мере одна из групп А и Е обозначает атом азота,Rb представляет собой простую связь или линейную либо разветвленную (C1-С 6)алкиленовую цепь, один из атомов углерода которой необязательно замещен атомом кислорода или серы,W обозначает арильную или гетероарильную группу, каждая из которых необязательно замещена,их оптическим изомерам, гидратам, сольватам и солям, получаемым путем присоединения к этим соединениям фармацевтически приемлемой кислоты,причем"арильная группа" обозначает группу, которую выбирают из фенила, бифенила, бицикло[4,2,0]окта-1,3,5-триенила, нафтила, дигидронафтила, тетрагидронафтила, инданила и инденила,под "гетероарильной группой" подразумевается указанная выше арильная группа, содержащая 1-3 идентичных или отличающихся друг от друга гетероатомов, которые выбирают из кислорода, азота и серы,определение "необязательно замещенный",если оно употребляется применительно к "гетероциклу", "арильной группе" или "гетероарильной группе", обозначает, что они необязательно замещены одной или несколькими идентичными либо отличающимися друг от друга группами, которые выбирают из галогеновой, линейной или разветвленной (С 1-С 6)алкильной, гидрокси-, линейной либо разветвленной (С 1-С 6)алкокси-, меркапто-, линейной или разветвленной(С 1-С 6)тригалоалкильной, циано-, нитро-, амино-, линейной или разветвленной (С 1-С 6)алкиламино-, диалкиламиногруппы, в которой каждая алкильная часть имеет 1-6 атомов угле 004268 4 рода и является линейной или разветвленной, и метилендиоксигруппы,под "оптическими изомерами" подразумеваются энантиомеры и диастереомеры. В качестве примеров фармацевтически приемлемых кислот, среди прочего, можно упомянуть о соляной кислоте, бромисто-водородной кислоте,серной кислоте, фосфорной кислоте, уксусной кислоте, трифтороуксусной кислоте, молочной кислоте, пировиноградной кислоте, малоновой кислоте,янтарной кислоте, глутаровой кислоте, фумаровой кислоте, винной кислоте, малеиновой кислоте, лимонной кислоте, аскорбиновой кислоте, щавелевой кислоте, метансульфокислоте, камфорной кислоте. Соединения по настоящему изобретению предпочтительно представляют собой соединения формулы (IA) в которой X, R1, Ra, A, E, Rb и W принимают значения, приведенные для формулы (I). Согласно выгодному варианту осуществления данного изобретения предпочтительными соединениями являются таковые формулы (I), в которой Х обозначает гетероцикл, приведенный для формулы (I). Согласно другому выгодному варианту осуществления настоящего изобретения предпочтительными соединениями по данному изобретению являются таковые формулы (I), в которой Х представляет собой группу формулы NR2R3, приведенной для формулы (I). В особо выгодном варианте предпочтительные соединения по настоящему изобретению представляют собой таковые формулы (I), в которой Х обозначает 1-индолинильную или 2,3-дигидро-1H-пирроло[2,3-с]пиридин-1-ильную группу, каждая из которых необязательно замещена одной или несколькими группами,приведенными для формулы (I). Также в особо выгодном варианте предпочтительные соединения по настоящему изобретению являются таковыми формулы (I), в которой Х обозначает группу формулы -NR2R3,в которой R2 представляет собой атом водорода,а R3 обозначает необязательно замещенную фенильную группу. Согласно представляющему интерес варианту осуществления данного изобретения, предпочтительные соединения по настоящему изобретению представляют собой таковые формулы (I), в которой W обозначает гетероарильную группу, в выгодном варианте бензофурильную или индолильную группу. Согласно другому представляющему интерес варианту осуществления данного изобретения предпочтительные соединения по настоящему изобретению являются таковыми формулы (I), в которой -Rb-W совместно образуют арилоксиалкильную группу, в которой алкильная часть имеет 1-5 атомов углерода и является 5 линейной или разветвленной, а арильная часть необязательно замещена. Предпочтительными соединениями по настоящему изобретению являются 3-анилино-4-(2-[4-(феноксиметил)-1 пиперидинил]этиламино)-3-циклобутен-1,2 дион и его метансульфонат,3-(4-хлороанилино)-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен-1,2-дион и его метансульфонат,3-(2,3-дигидро-1H-индол-1-ил)-4-(2-[4(феноксиметил)-1-пиперидинил]этиламино)-3 циклобутен-1,2-дион и его метансульфонат,3-(1-[2-(1-бензофуран-3-ил)этил]-4 пиперидиниламино)-4-(4-фтороанилино)-3 циклобутен-1,2-дион и его метансульфонат,4-[2-(1-[2-(1-бензофуран-3-ил)этил]-4 пиперидиниламино)-3,4-диоксо-1-циклобутен 1-ил]аминобензонитрил и его метансульфонат,3-[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-4-[(2-оксо-2,3-дигидро 1H-бензимидазол-5-ил)амино]-3-циклобутен 1,2-дион и его метансульфонат,3-(5-метокси-2,3-дигидро-1H-пирроло[2,3 с]пиридин-1-ил)-4-(2-[4-(феноксиметил)-1 пиперидинил]этиламино)-3-циклобутен-1,2 дион и его дихлоргидрат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(5-метокси-2,3 дигидро-1H-пирроло[2,3-с]пиридин-1-ил)-3 циклобутен-1,2-дион и его дихлоргидрат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(4,5,6-триметокси 2,3-дигидро-1H-индол-1-ил)-3-циклобутен-1,2 дион и его метансульфонат,3-(6-хлоро-2,3-дигидро-1H-индол-1-ил)-4[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат,3-(2,3-дигидро-1H-индол-1-ил)-4-[(1-[2(1H-индол-3-ил)этил]-3-пиперидинилметил)амино]-3-циклобутен-1,2-дион и его хлоргидрат,3-(5,6-диметокси-2,3-дигидро-1H-индол-1 ил)-4-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(6-метокси-2,3 дигидро-1H-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат и 3-(4,5-диметокси-2,3-дигидро-1H-индол-1 ил)-4-[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Изомеры, гидраты, сольваты и соли предпочтительных соединений по настоящему изобретению, получаемые путем присоединения к последним фармацевтически приемлемой кислоты, являются неотъемлемой частью данного изобретения. 6 Настоящее изобретение также относится к способу получения соединений формулы (I),отличающемуся тем, что в качестве исходного материала используют соединение формулы (II) в которой G обозначает линейную или разветвленную (С 1-С 4)алкильную группу, вводя соединение формулы (II) в реакцию с амином формулы (III) Х-Н(III) в которой Х принимает значения, приведенные для формулы (I), и получая соединение формулы (IV) в которой Х и G принимают приведенные выше значения, после чего соединение формулы (IV) обрабатывают соединением формулы (V) в которой n, R1, Ra, Rb, А, Е и W принимают значения, указанные для формулы (I), получая соединения формулы (I) после чего соединения формулы (I), если это необходимо, очищают с помощью традиционной методики очистки, при желании, обычным методом разделения разделяют на различные изомеры и, при желании, переводят в их соли,получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. Соединения формул (II), (III) и (V) можно либо приобрести в торговой сети, либо получить традиционными методами органического синтеза. Соединения по настоящему изобретению можно применять при лечении заболеваний или патологических состояний, при которых наблюдается эндотелиальная дисфункция. Таким образом, соединения по настоящему изобретению,благодаря их специфической фармакологической активности, можно применять для предупреждения развития и увеличения площади атеросклеротических повреждений, а также связанных с ними осложнений, при лечении ишемии миокарда или периферической ишемии,сердечной недостаточности, гипертензии легочной артерии, а также для предупреждения сосудистых осложнений после операций по сосудистому шунтированию, расширению сосудов,операций, направленных на возобновление проходимости сосудов, или таковых по трансплантации сердца. Также настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного ингредиента по меньшей мере одно соединение формулы (I), его оптиче 7 ский изомер, гидрат или сольват либо соль, полученную путем присоединения к этому соединению фармацевтически приемлемой кислоты, в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми эксципиентами или носителями. В качестве примеров фармацевтических композиций по настоящему изобретению более подробно можно остановиться на таковых, пригодных для орального, парентерального (внутривенного, внутримышечного или подкожного),чрескожного, назального, ректального, чрезъязычного, глазного введения или такового через дыхательные пути, в частности, таблетках или драже, подъязычных таблетках, мягких желатиновых капсулах, твердых желатиновых капсулах, суппозиториях, кремах, мазях, накожных гелях, препаратах для инъекций или питья, аэрозолях, глазных каплях или каплях в нос. Дозировка зависит от возраста и веса пациента, формы применения, характера и тяжести заболевания, а также того, проходит ли пациент курс какого-либо ассоциированного лечения, и колеблется от 1 до 200 мг в сутки за один или несколько приемов. Следующие примеры приведены с иллюстративными целями и никоим образом не ограничивают объем настоящего изобретения. Используемые исходные материалы либо представляют собой широко известные продукты,либо могут быть получены с помощью известных методик. Посредством целого ряда последних получают промежуточные продукты синтеза, которые затем можно использовать для получения соединений по настоящему изобретению. Структуры описанных в примерах соединений были определены с помощью традиционных спектрофотометрических методик (инфракрасная спектрометрия, ядерный магнитный резонанс, масс-спектрометрия и т.д.). Точки плавления определяли с использованием горячей пластинки Кофлера (Kofler) (К.) или горячей пластинки под микроскопом (М.К.). Пример 1. 3-Анилино-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен 1,2-дион и его метансульфонат. Стадия 1. 4-Анилино-3-этокси-3-циклобутен-1,2-дион. 0,01 моля анилина добавляют к раствору из 0,01 моля 3,4-диэтокси-3-циклобутен-1,2 диона в 30 мл безводного этанола. Смесь нагревают с обратным холодильником в течение 12 ч и образовавшийся осадок, пока он не остыл,отфильтровывают. Полученный осадок отверждают в присутствии простого эфира, позволяющего выделить ожидаемый продукт. Точка плавления (К): 110 С Стадия 2. 3-Анилино-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен 1,2-дион и его метансульфонат. 8 0,01 моля продукта, полученного на стадии 1, и 0,01 моля 2-[4-(феноксиметил)-1-пиперидинил]этиламина в 66 мл безводного этанола нагревают с обратным холодильником в течение 18 ч. Образовавшийся осадок, пока он не остыл,отфильтровывают и сушат, получая ожидаемый продукт, который переводят в его метансульфонат, подвергая воздействию раствора 1,5 эквивалента метансульфокислоты в метаноле в процессе нагрева с обратным холодильником в течение 2 ч. Точка плавления (М.К.): 258-262 С Пример 2. 3-(4-Фтороанилино)-4-(2-[4(феноксиметил)-1-пиперидинил]-этиламино)-3 циклобутен-1,2-дион и его метансульфонат. Стадия 1. 3-Этокси-4-(4-фтороанилино)-3 циклобутен-1,2-дион. Продукт получают способом, описанным для стадии 1 примера 1, с использованием вместо анилина р-фтороанилина. Точка плавления (К): 180 С Стадия 2. 3-(4-Фтороанилино)-4-(2-[4(феноксиметил)-1-пиперидинил]этиламино)-3 циклобутен-1,2-дион и его метансульфонат. Продукт получают способом, описанным для стадии 2 примера 1, с использованием соединения, описанного для предыдущей стадии. Точка плавления (М.К.): 218-221 С Пример 3. 3-(4-Хлороанилино)-4-(2-[4(феноксиметил)-1-пиперидинил]этиламино)-3 циклобутен-1,2-дион и его метансульфонат. Стадия 1. 4-(4-Хлороанилино)-3-этокси-3 циклобутен-1,2-дион. Продукт получают способом, описанным для стадии 1 примера 1, с использованием вместо анилина р-хлороанилина. Точка плавления (К): 149 С Стадия 2. 3-(4-Хлороанилино)-4-(2-[4(феноксиметил)-1-пиперидинил]этиламино)-3 циклобутен-1,2-дион и его метансульфонат. Продукт получают способом, описанным для стадии 2 примера 1, с использованием соединения, описанного для предыдущей стадии. Точка плавления (М.К.): 243-246 С Пример 4. 4-[3,4-Диоксо-2-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-1-циклобутен-1-ил]аминобензонитрил и его метансульфонат. Стадия 1. 4-(4-Цианоанилино)-3-этокси-3 циклобутен-1,2-дион. Продукт получают способом, описанным для стадии 1 примера 1, с использованием вместо анилина р-цианоанилина. Точка плавления (К): 230 С Стадия 2. 4-[3,4-Диоксо-2-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-1-циклобутен-1-ил]аминобензонитрил и его метансульфонат. Продукт получают способом, описанным для cтадии 2 примера 1, с использованием соединения, описанного для предыдущей стадии. Точка плавления (М.К.): 295-299 С 9 Пример 5. 3-2,3-Дигидро-1 Н-индол-1-ил)-4(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен-1,2-дион и его метансульфонат. Стадия 1. 3-Этокси-4-(индолин-1-ил)-3 циклобутен-1,2-дион. Продукт получают способом, описанным для стадии 1 примера 1, с использованием вместо анилина индолина. Точка плавления (К): 204 С Стадия 2. 3-(2,3-Дигидро-1 Н-индол-1-ил)-4(2-[4-(феноксиметил)-1-пиперидинил]этиламино)3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом, описанным для стадии 2 примера 1, с использованием соединения, описанного для предыдущей стадии. Точка плавления (М.К.): 209-213 С Пример 6. 3-Анилино-4-(1-[2-(1-бензофуран-3-ил)этил]-4-пиперидиниламино)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом, описанным для стадии 2 примера 1, однако, с использованием в качестве субстрата продукта со стадии 1 примера 1 и 1-[2-(1-бензофуран-3-ил)этил]-4 пиперидиниламина. Точка плавления (М.К.): 276-280 С Пример 7. 3-(1-[2-(1-Бензофуран-3-ил)этил]-4 пиперидиниламино)-4-(4-фтороанилино)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 6 с использованием вместо продукта со стадии 1 примера 1 такового со стадии 1 примера 2. Точка плавления (М.К.): 266-271 С Пример 8. 3-(1-[2-(1-Бензофуран-3-ил)этил]4-пиперидиниламино)-4-(4-хлороанилино)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 6 с использованием вместо продукта со стадии 1 примера 1 такового со стадии 1 примера 3. Точка плавления (М.К.): 283-287 С Пример 9. 4-[2-(1-[2-(1-Бензофуран-3-ил) этил]-4-пиперидиниламино)-3,4-диоксо-1-циклобутен-1-ил]аминобензонитрил и его метансульфонат. Продукт получают способом из примера 6 с использованием вместо продукта со стадии 1 примера 1 такового со стадии 1 примера 4. Точка плавления (М.К.): 295-299 С Пример 10. 3-(1-[2-(1-Бензофуран-3-ил)этил]4-пиперидиниламино)-4-(2,3-дигидро-1 Н-индол-1 ил)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 6 с использованием вместо продукта со стадии 1 примера 1 такового со стадии 1 примера 5. Точка плавления (М.К.): 265-270 С Пример 11. 3-(4-Xлopoaнилинo)-4-[(2-4-[2-(4 фтopoфeнокси)этил]-1-пиперидинилэтил)амино]-3 циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 р-хлороанилина, а на стадии 2 - 2-4-[2-(4 фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 215-219 С-1-пиперидинилэтил)амино]-4-(4-нитроанилино)-3 циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 р-нитроанилина, а на стадии 2 - 2-4-[2-(4 фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 223-227 С Пример 13. 3-[(2-4-[2-(4-Фторофенокси)этил]-1-пиперидинилэтил)амино]-4-(5-нитро-2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5 нитроиндолина, а на стадии 2 - 2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 232-235 С Пример 14. 3-[(2-Оксо-2,3-дигидро-1 Нбензимидазол-5-ил)амино]-4-(2-[4-(феноксиметил)-1-пиперидиниламино)-3-циклобутен-1,2 дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-амино-1,3-дигидро-2 Н-бензимидазол-2 она. Точка плавления: 176-180 С Пример 15. 3-[(2-4-[2-(4-(фторофенокси)этил]-1-пиперидинилэтил)амино]-4-[(2-оксо-2,3 дигидро-1 Н-бензимидазол-5-ил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-амино-1,3-дигидро-2 Н-бензимидазол-2 она, а на стадии 2 -2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 184-188 С Пример 16. 3-(6,7-Дигидро-5 Н-[1,3]диоксоло[4,5-f]индол-5-ил)-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен 1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 6,7 дигидро-5 Н-[1,3]диоксоло[4,5-f]индола. Точка плавления: 193-196 С Пример 17. 3-(5-Метокси-2,3-дигидро-1 Нпирроло[2,3-с]пиридин-1-ил)-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен-1,2-дион и его дихлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5 метокси-2,3-дигидро-1 Н-пирроло[2,3-с]пиридина. Точка плавления: 190-195 С Пример 18. 3-[(2-4-[2-(4-фтopoфeнокси)этил]-1-пиперидинилэтил)амино]-4-(5-метокси-2,3-дигидро-1 Н-пирроло[2,3-с]пиридин-1-ил)-3-циклобутен-1,2-дион и его дихлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метокси-2,3-дигидро-1 Н-пирроло[2,3 с]пиридина, а на стадии 2 - 2-4-[2-(4 фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления; 224-228 С 11 Пример 19. 3-(5-Фторо-2,3-дигидро-1 Ниндол-1-ил)-4-[(2-4-[2-(4-фторофенокси)этил]1-пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на cтадии 1 5-фтороиндолина, а на стадии 2 - 2-4-[2(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 166-170 С Пример 20. 3-[(2-4-[2-(4-Фторoфенокси)этил]1-пиперидинилэтил)амино]-4-(4,5,6-триметокси 2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4,5,6-триметоксииндолина, а на стадии 2 2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 176-180 С Пример 21. 3-(2,3-Дигидро-1 Н-индол-1-ил)-4[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 индолина, а на стадии 2 - 2-4-[2-(4 фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 182-186 С Пример 22. 3-(6-Хлоро-2,3-дигидро-1 Ниндол-1-ил)-4-[(2-4-[2-(4-фторофенокси)этил]1-пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 6-хлороиндолина, а на стадии 2 - 2-4-[2(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 182-186 С Пример 23. 3-[(2-4-[2-(4-Фторофеноксиэтил]-1-пиперидинилэтил)амино]-4-(5-метокси-2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метоксииндолина, а на стадии 2 - 2-4[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 182-185 С Пример 24. 3-[(1-3-[2-(3,4-Дифторофенил)этокси]пропил-4-пиперидинил)амино]-4(2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2 дион и его хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 индолина, а на стадии 2 - 1-3-[2-(3,4 дифторофенил)этокси]пропил-4-пиперидинамина. Точка плавления: 250-254 С Пример 25. 3-(5-Хлоро-2,3-дигидро-1 Ниндол-1-ил)-4-[(2-4-[2-(4-фторофенокси)этил] 004268 12 1-пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-хлороиндолина, а на стадии 2 - 2-4-[2(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 167-171 С Пример 26. 3-(2,3-Дигидро-1 Н-индол-1 ил)-4-[2-(4-[(4-фторобензил)окси]метил-1 пиперидинил)этил]амино-3-циклобутен-1,2 дион и его хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 индолина, а на стадии 2 - 2-(4-[(4 фторобензил)окси]метил-1-пиперидинил)этанамина. Точка плавления: 230-235 С Пример 27. 3-(2,3-Дигидро-1 Н-индол-1 ил)-4-[(1-[2-(1 Н-индол-3-ил)этил]-3-пиперидинилметил)амино]-3-циклобутен-1,2-дион и его хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 индолина, а на стадии 2 - 1-[2-(1 Н-индол 3-ил)этил]-3-пиперидинилметанамина. Точка плавления: 237-242 С Пример 28. 3-(2,3-Дигидро-1 Н-индол-1 ил)-4-[(1-[2-(3,4-диметоксифенил)этил]-3-пиперидинилметил)амино]-3-циклобутен-1,2 дион и его хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 индолина, а на стадии 2 - 1-[2-(3,4 диметоксифенил)этил]-3-пиперидинилметанамина. Точка плавления: 228-232 С Пример 29. 3-(5,6-Диметокси-2,3-дигидро 1 Н-индол-1-ил)-4-[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5,6-диметоксииндолина, а на стадии 2 - 24-[2-(4-фторофенокси)этил]-1-пиперидинил этиламина. Точка плавления: 102-106 С Пример 30. 3-(1-[2-(1-Бензофуран-3-ил) этил]-4-пиперидиниламино)-4-(5-метокси-2,3 дигидро-1 Н-пирроло[2,3-с]пиридин-1-ил)-3-циклобутен-1,2-дион и его хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метокси-2,3-дигидро-1 Н-пирроло[2,3 с]пиридина, а на стадии 2 - 1-[2-(1-бензофуран 3-ил)этил]-4-пиперидинамина. Точка плавления: 278-288 С Пример 31. 3-[(2-4-[2-(4-Фторофенокси) этил]-1-пиперидинилэтил)амино]-4-(4-метокси-2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен 1,2-дион и его метансульфонат. 13 Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4-метоксииндолина, а на стадии 2 - 2-4[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 240-244 С Пример 32. 3-[(2-4-[2-(4-Фторофенокси) этил]-1-пиперидинилэтил)амино]-4-(6-метокси-2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен 1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 6-метоксииндолина, а на стадии 2 - 2-4[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Точка плавления: 178-182 С Пример 33. 3-(5-Метокси-2,3-дигидро-1 Нпирроло[2,3-с]пиридин-1-ил)-4-(2-[4-(2,3,4 триметоксибензил)-1-пиперазинил]этиламино)-3-циклобутен-1,2-дион и его трихлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метокси-2,3-дигидро-1H-пирроло[2,3-с] пиридина, а на стадии 2 - 2-[4-(2,3,4-триметоксибензил)-1-пиперазинил]этиламина. Точка плавления 181-183 С Пример 34. 3-(5-Метокси-2,3-дигидро-1 Нпирроло[2,3-с]пиридин-1-ил)-4-[4-(2,3,4-триметоксибензил)-1-пиперазинил]-3-циклобутен-1,2 дион и его фумарат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метокси-2,3-дигидро-1 Н-пирроло[2,3 с]пиридина, а на стадии 2 - 4-(2,3,4-триметоксибензил)-1-пиперазина. Продукт переводят в его фумарат, подвергая воздействию раствора фумаровой кислоты. Точка плавления: 190-195 С Пример 35. 3-[(2-4-[2-(4-Фторофенокси)этил]-1-пиперидинилэтил)амино]-4-[(1-метоксициклобута[с]пиридин-6-ил)метил]амино 3-циклобутен-1,2-дион и его гемифумарат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 6-аминометил-1-метоксициклобута[с]пиридина, а на стадии 2 -2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтиламина. Продукт переводят в его гемифумарат,подвергая воздействию раствора фумаровой кислоты. Точка плавления: 190-197 С Пример 36. 3-(5-Метокси-2,3-дигидро-1 Нпирроло[2,3-с]пиридин-1-ил)-4-[2-(спиро[2,3 дигидро-1-бензофуран-3:4'-пиперидин-1-ил]) этил]амино-3-циклобутен-1,2-дион и его полуторный хлоргидрат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 5-метокси-2,3-дигидро-1 Н-пирроло[2,3 с]пиридина, а на стадии 2 - 1-(2-аминоэтил)спиро[2,3-дигидро-1-бензофуран-3:4'-пиперидина]. 14 Продукт переводят в его полуторный хлоргидрат, подвергая воздействию раствора соляной кислоты. Точка плавления: 275-280 С Пример 37. 3-(4,5-Диметокси-2,3-дигидро 1 Н-индол-1-ил)-4-[(2-4-[2-(4-фторофенокси) этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4,5-диметоксииндолина, а на стадии 2 - 24-[2-(4-фторофенокси)этил]-1-пиперидинил этиламина. Точка плавления: 202-207 С Пример 38. 3-(4,5-Диметокси-2,3-дигидро 1 Н-индол-1-ил)-4-[(2-4-(феноксиметил)-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4,5-диметоксииндолина. Точка плавления: 209-213 С Пример 39. 3-(4,6-Диметокси-2,3-дигидро 1 Н-индол-1-ил)-4-[(2-4-[2-(4-(фторофенокси) этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4,6-диметоксииндолина, а на стадии 2 - 24-[2-(4-фторофенокси)этил]-1-пиперидинил этиламина. Точка плавления; 175-180 С Пример 40. 3-(4,6-Диметокси-2,3-дигидро 1 Н-индол-1-ил)-4-[(2-4-(феноксиметил)-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат. Продукт получают способом из примера 1 с использованием в качестве субстрата на стадии 1 4,6-диметоксииндолина. Точка плавления: 236-240 С Фармакологическое исследование соединений по настоящему изобретению В стандартных условиях in vitro релаксация аортальных колец, вызываемая действием ацетилхолина (ACh) и возможная только в присутствии эндотелия, свидетельствует о продукции NO (стимулируемой ACh), которая, диффундируя в клетки гладкой мышечной ткани,способствует релаксации артерий (Nature, 1980,288, 373). Соединения по настоящему изобретению испытывали на двух моделях с использованием двух различных механизмов эндотелиальной дисфункции, наблюдаемой при патологии: первая модель состоит в индуцировании ингибирования релаксации, имеющей место благодаря действию ACh, путем блокирования активности фермента (эндотелиальная NOS),отвечающего за продукцию NO; вторая модель состоит в индуцировании окислительного стресса in vitro с использовани 15 ем ферментной системы, генерирующей O2(ксантиноксидаза -ХО и гипоксантин - Hypo). Пример 41. Защитное действие в отношении сосудов при эндотелиальной дисфункции,вызванной ингибитором NOS. Грудную аорту крысы Wistar (325-375 г),анестезированной путем интраперитонеального введения пентобарбитала натрия (30 мг/кг), удаляют и разделяют на кольца длиной 3 мм. Каждое кольцо подвешивают к детектору изометрического растяжения, подключенному к записывающему устройству. Начальное растягивающее усилие составляет 2,5 г. Используемый насыщенный кислородом (95% O2+5% СО 2) физиологический раствор, температура которого с помощью термостата поддерживается на отметке 37 С,включает (в мМ): NaCl 112,0; KCl 5,0; СаСl2 2,5; КН 2 РO4 1,0; MgSO4 1,2; NаНСО 3 25,0; глюкозу 11,5; Са-этилендиаминтетрауксусную кислоту 0,016. По завершении 90-минутного периода стабилизации препараты сокращают с использованием фенилэфрина (РНЕ 10-6 М) и, добавляя 10-5 М ацетилхолина, вновь вводят в состояние релаксации,чтобы таким образом убедиться в целостности эндотелиального слоя. Если результат положителен,препараты промывают и в среду сперва в некоторой концентрации добавляют испытуемый продукт, а затем -3 х 10-7 М NG-нитро-L-аргинин(LNA). Препараты повторно сокращают с помощью фенилэфрина и через 30 мин, в присутствии индометацина (10-5 М) оценивают степень релаксации, индуцированной с использованием ацетилхолина (ACh от 10-8 М до 10-5 М). Значения, полученные для релаксации, выражают в процентах от максимального сокращения, вызванного РНЕ. Защитное действие соединений по настоящему изобретению при эндотелиальной дисфункции соответствует разности максимальной релаксации, наблюдаемой в присутствии продукта, и таковой в его отсутствие в процентном выражении. К примеру, соединение из примера 5 в концентрации 10-7M ингибирует эндотелиальную дисфункцию, вызванную действием LNA,на 27%. Пример 42. Защитное действие в отношении сосудов при эндотелиальной дисфункции,вызванной системой, генерирующей O2-. Этот протокол, составленный на основе экспериментов с аортальными кольцами новозеландских кроликов (2,5-3 кг), сопоставим с предыдущим за исключением следующих моментов: начальное растягивающее усилие составляет 5 г, и вместо LNA используют комбинацию ХО (3 миллиединицы/мл)-Нуро (10-4 М). К примеру, соединение из примера 5 в концентрации 10-7 М ингибирует эндотелиальную дисфункцию, вызванную действием комбинации ХО-Нуро, на 17%. Пример 43. Участие NO в обнаруженном защитном действии в отношении сосудов: оценка продукции cGMP в аорте. 16 Диффундируя в клетки гладкой мышечной ткани, вырабатываемая эндотелиальными клетками NO активирует растворимую гуанилатциклазу, способствующую повышению уровня циклического GMP, отвечающего за релаксацию. Таким образом, в аортальных кольцах крысы определяли содержание этого медиатора,что позволяло продемонстрировать тот факт,что защитное действие соединений при эндотелиальной дисфункции обусловливается повышением уровня NO. Аортальные кольца крысы получают, как описано ранее. Результаты 30 минутного инкубирования с соединениями по настоящему изобретению в различных концентрациях оценивают по интенсивности стимулируемой ACh (10-5M - 1 мин) продукции cGMP в присутствии LNA (3 х 10-6 М). Упомянутые эксперименты проводят в присутствии изобутилметилксантина (10-5 М), что дает возможность избежать расщепления cGMP фосфодиэстразами. Кольца замораживают в жидком азоте и выдерживают при -80 С до момента проведения испытания. Содержание cGMP оценивают методом радиоиммуноэлектрофореза и выражают в отношении к количеству протеинов, содержащихся в ткани (анализ методом Брэдфорда). К примеру, соединение из примера 5 в концентрации 3 х 10-7 М повышает стимулируемую ACh продукцию cGMP в присутствии LNA на 39%. Пример 44. Фармацевтическая композиция таблетка. Состав препарата, включающего 1000 таблеток, каждая из которых содержит дозу,составляющую 10 мг Соединение из примера 5 10 г Гидроксипропилцеллюлоза 2 г Поливинилпирролидон 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г в которой Х обозначает моноциклический или бициклический, насыщенный, частично ненасыщенный либо ароматический гетероцикл с 512 членами кольца, содержащий от 1 до 3 гетероатомов, которые выбирают из кислорода, азота и серы, однако по меньшей мере один атом азота, причем указанный гетероцикл связан с остальной молекулой посредством упомянутого атома азота и необязательно замещен,или группу формулы -NR2R3, в которой R2 представляет собой атом водорода либо линейную или разветвленную (С 1-С 6)алкильную группу, а R3 обозначает необязательно замещенную арильную группу, 1,3-дигидро-2 Н 17 бензимидазолил-2-оновую группу или линейный либо разветвленный (С 1-С 6)алкил, замещенный моноциклическим или бициклическим,насыщенным, частично ненасыщенным либо ароматическим гетероциклом с 5-12 членами кольца, содержащим от 1 до 3 гетероатомов,которые выбирают из кислорода, азота и серы,однако по меньшей мере один атом азота, причем упомянутый гетероцикл необязательно замещен,n равно нулю или 1,R1 обозначает атом водорода или линейную либо разветвленную (С 1-С 6)алкильную группу,Ra представляет собой простую связь или линейную либо разветвленную (С 1-С 6)алкиленовую цепь,А обозначает атом азота или СН-группу,причем СН-группа возможна только в том случае, если Ra обозначает простую связь, а атом азота, если n равно нулю,Е представляет собой атом азота или CReгруппу, в которой Re обозначает либо атом водорода, либо связь с атомом углерода группыW, причем по меньшей мере одна из групп А и Е обозначает атом азота,Rb представляет собой простую связь или линейную либо разветвленную (С 1-С 6)алкиленовую цепь, один из атомов углерода которой необязательно замещен атомом кислорода или серы,W обозначает арильную или гетероарильную группу, каждая из которых необязательно замещена,их оптические изомеры, гидраты, сольваты и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты,причем "арильная группа" обозначает группу, которую выбирают из фенила, бифенила, бицикло[4,2,0]окта-1,3,5-триенила, нафтила,дигидронафтила, тетрагидронафтила, инданила и инденила,под "гетероарильной группой" подразумевается указанная выше арильная группа, содержащая 1-3 идентичных или отличающихся друг от друга гетероатома, которые выбирают из кислорода, азота и серы,определение "необязательно замещенный",если оно употребляется применительно к "гетероциклу", "арильной группе" или "гетероарильной группе", обозначает, что они необязательно замещены одной или несколькими идентичными либо отличающимися друг от друга группами, которые выбирают из галогеновой, линейной или разветвленной (С 1-С 6)алкильной, гидрокси-, линейной либо разветвленной (С 1-С 6)алкокси-, меркапто-, линейной или разветвленной(С 1-С 6)тригалоалкильной, циано-, нитро-, амино-, линейной или разветвленной (С 1-С 6)алкиламино-, диалкиламиногруппы, в которой 18 каждая алкильная часть имеет 1-6 атомов углерода и является линейной или разветвленной, и метилендиоксигруппы,под "оптическими изомерами" подразумеваются энантиомеры и диастереомеры. 2. Соединения формулы (I) по п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) в которой X, R1, Ra, А, Е, Rb и W принимают значения, приведенные для формулы (I), их оптические изомеры, гидраты, сольваты и соли,получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 3. Соединения формулы (I) по п.1, отличающиеся тем, что Х обозначает гетероцикл,приведенный для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 4. Соединения формулы (I) по п.1, отличающиеся тем, что Х представляет собой группу формулы -NR2R3, приведенную для формулы(I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 5. Соединения формулы (I) по п.1 или 3,отличающиеся тем, что Х обозначает 1-индолинильную группу, необязательно замещенную одной или несколькими группами, приведенными для формулы (I), их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 6. Соединения формулы (I) по п.1 или 3,отличающиеся тем, что Х представляет собой 2,3-дигидро-1 Н-пирроло[2,3-с]пиридин-1-ильную группу, необязательно замещенную одной или несколькими группами, приведенными для формулы (I), их оптические изомеры и соли,получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 7. Соединения формулы (I) по п.1 или 4,отличающиеся тем, что Х обозначает группу формулы -NR2R3, в которой R2 представляет собой атом водорода, а R3 обозначает необязательно замещенную фенильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 8. Соединения формулы (I) по п.1, отличающиеся тем, что W обозначает гетероарильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 9. Соединения формулы (I) по п.1 или 8,отличающиеся тем, что W представляет собой 19 бензофурильную или индолильную группу, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 10. Соединения формулы (I) по п.1, отличающиеся тем, что -Rb-W совместно обозначают арилоксиалкильную группу, в которой алкильная часть имеет 1-5 атомов углерода и является линейной или разветвленной, а арильная часть необязательно замещена, их оптические изомеры и соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 11. Соединения формулы (I) по п.1, представляющие собой 3-анилино-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен-1,2-дион и его метансульфонат,3-(4-хлороанилино)-4-(2-[4-(феноксиметил)-1-пиперидинил]этиламино)-3-циклобутен-1,2-дион и его метансульфонат,3-(2,3-дигидро-1 Н-индол-1-ил)-4-(2-[4(феноксиметил)-1-пиперидинил]этиламино)-3 циклобутен-1,2-дион и его метансульфонат,3-(1-[2-(1-бензофуран-3-ил)этил]-4 пиперидиниламино)-4-(4-фтороанилино)-3 циклобутен-1,2-дион и его метансульфонат,4-[2-(1-[2-(1-бензофуран-3-ил)этил]-4 пиперидиниламино)-3,4-диоксо-1-циклобутен 1-ил]аминобензонитрил и его метансульфонат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-[(2-оксо-2,3 дигидро-1 Н-бензимидазол-5-ил)амино]-3 циклобутен-1,2-дион и его метансульфонат,3-(5-метокси-2,3-дигидро-1 Н-пирроло[2,3 с]пиридин-1-ил)-4-(2-[4-(феноксиметил)-1 пиперидинил]этиламино)-3-циклобутен-1,2 дион и его дихлоргидрат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(5-метокси-2,3 дигидро-1 Н-пирроло[2,3-с]пиридин-1-ил)-3 циклобутен-1,2-дион и его дихлоргидрат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(4,5,6-триметокси 2,3-дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2 дион и его метансульфонат,3-(6-хлоро-2,3-дигидро-1 Н-индол-1-ил)-4[(2-4-[2-(4-фторофенокси)этил]-1-пиперидинилэтил)амино]-3-циклобутен-1,2-дион и его метансульфонат,3-(2,3-дигидро-1 Н-индол-1-ил)-4-[(1-[2(1 Н-индол-3-ил)этил]-3-пиперидинилметил)амино]-3-циклобутен-1,2-дион и его хлоргидрат,3-(5,6-диметокси-2,3-дигидро-1 Н-индол-1 ил)-4-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат,3-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-4-(6-метокси-2,3 дигидро-1 Н-индол-1-ил)-3-циклобутен-1,2-дион и его метансульфонат и 20 3-(4,5-диметокси-2,3-дигидро-1 Н-индол-1 ил)-4-[(2-4-[2-(4-фторофенокси)этил]-1 пиперидинилэтил)амино]-3-циклобутен-1,2 дион и его метансульфонат. 12. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного материала используют соединение формулы (II) в которой G обозначает линейную или разветвленную (С 1-С 4)алкильную группу, вводя соединение формулы (II) в реакцию с амином формулы (III) Х-НIII) в которой Х принимает значения, приведенные для формулы (I), и получая соединение формулы (IV) в которой Х и G принимают приведенные выше значения,после чего соединение формулы (IV) обрабатывают соединением формулы (V) в которой n, R1, Ra, Rb, А, Е и W принимают значения, указанные для формулы (I), получая соединения формулы (I) после чего соединения формулы (I), если это необходимо, очищают с помощью традиционной методики очистки, при желании, обычным методом разделения разделяют на различные оптические изомеры и, при желании, переводят в их соли, получаемые путем присоединения к этим соединениям фармацевтически приемлемой кислоты. 13. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп.1-11 в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми экспипиентами или носителями. 14. Фармацевтические композиции по п.13,включающие по меньшей мере один активный ингредиент по любому из пп.1-11, предназначенные для применения при лечении заболеваний и патологических состояний, при которых наблюдается эндотелиальная дисфункция. 15. Фармацевтические композиции по п.13,включающие по меньшей мере один активный ингредиент по любому из пп.1-11, предназначенные для применения с целью предупреждения развития и увеличения площади атеросклеротических повреждений, а также связанных с ними осложнений, предупреждения сосудистых осложнений после операций по сосудистому шунтированию, расширению сосудов, операций,направленных на возобновление проходимости 22 сосудов, или таковых по трансплантации сердца, либо лечения ишемии миокарда или периферической ишемии, сердечной недостаточности и гипертензии легочной артерии.
МПК / Метки
МПК: C07D 405/12, C07D 405/14, C07D 401/12, A61P 9/00, A61K 31/4523
Метки: способ, производные, композиции, получения, циклобутендиона, фармацевтические, содержащие
Код ссылки
<a href="https://eas.patents.su/12-4268-proizvodnye-ciklobutendiona-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные циклобутендиона, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Присадка для стабилизации водосодержащего топлива и топливо, стабилизированное такой присадкой
Случайный патент: Способ получения комплексного органоминерального удобрения












