Производные эхинокандина, способ их получения и их применение в качестве противогрибковых средств
Номер патента: 2706
Опубликовано: 29.08.2002
Авторы: Куртэн Оливье, Мишель Жан-Марк, Шио Лоран, Мелон Мангер Доминик, Фово Патрик, Маркус Астрид
Формула / Реферат
1. Соединения формулы (I)
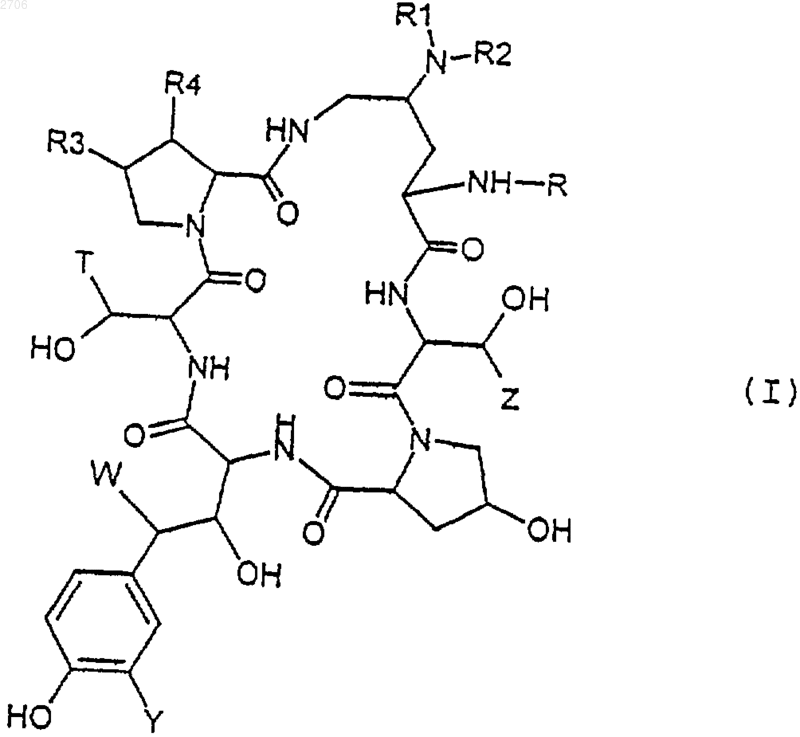
их возможные изомерные формы или их смеси, в которых
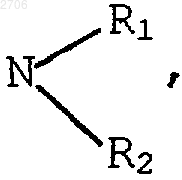
или R1 и R2, одинаковые или отличающиеся друг от друга, означают атом водорода, гидроксил; линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, возможно прерываемый атомом кислорода, возможно замещенный атомом галогена, гидроксилом, радикалом
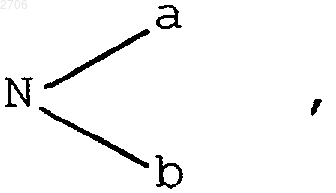
где а и b, одинаковые или отличающиеся друг от друга, означают атом водорода или алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем а и b при известных условиях вместе с атомом азота могут образовывать гетероцикл, возможно включающий один или несколько дополнительных гетероатомов;
или R1 с эндоциклическим атомом углерода, несущим радикал
образует двойную связь и
или R2 означает радикал XRa,
где Х означает атом кислорода или радикал NH или N-алкил, алкенил или алкинил, содержащий до 8 атомов углерода; и
Ra означает атом водорода, линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, возможно замещенный одним или несколькими атомами галогена, одним или несколькими радикалами ОН, СO2Н, СО2алк, радикалом
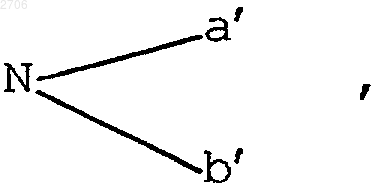
где а' и b' означают атом водорода, алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем а' и b' могут образовывать гетероцикл, возможно включающий один или несколько дополнительных гетероатомов;
и/или гетероциклом, включающим один или несколько гетероатомов;
или R2 означает радикал
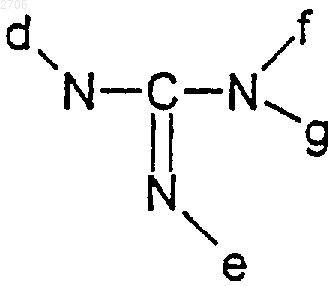
в котором d, e, f и g означают атом водорода или алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем f и g, кроме того, могут означать ацильный радикал, содержащий до 8 атомов углерода; е и f также могут образовывать цикл, возможно включающий один или несколько гетероатомов;
R3 означает атом водорода, метил или гидроксил;
R4 означает атом водорода или гидроксил;
R означает линейную, или разветвленную, или циклическую цепь, содержащую до 30 атомов углерода, возможно включающую один или несколько гетероатомов, один или несколько гетероциклов; или линейный, разветвленный или циклический ацильный радикал, содержащий до 30 атомов углерода, возможно включающий один или несколько гетероатомов и/или один, или несколько гетероциклов;
Т означает атом водорода, метил, радикал CH2CONH2, CH2CуN, радикал (CH2)2NH2 или (CH2)2Naлк+X-, причем Х означает атом галогена и алк означает алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода;
Y означает атом водорода, гидроксил или атом галогена, или радикал ОSО3Н, или одну из солей этого радикала;
W означает атом водорода или радикал ОН;
Z означает атом водорода или метил;
а также соли присоединения кислот соединений формулы (I).
2. Соединения формулы (I) по п.1, в которых Т означает атом водорода.
3. Соединения формулы (I) по п.1 или 2, в которых W означает атом водорода.
4. Соединения формулы (I) по любому из пп.1-3, в которых Z означает метил.
5. Соединения формулы (I) по любому из пп.1-4, в которых Y означает атом водорода.
6. Соединения формулы (I) по любому из пп.1-5, в которых R3 означает метил.
7. Соединения формулы (I) по любому из пп.1-6, в которых R4 означает гидроксил.
8. Соединения формулы (I) по любому из пп.1-7, в которых R означает радикал
9. Соединения формулы (I) по п.8, в которых R означает цепь
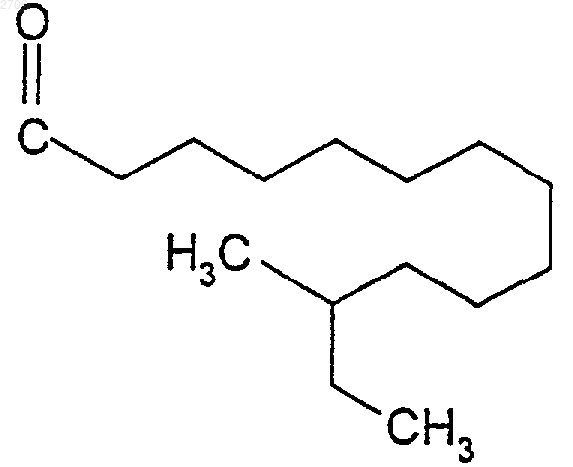
10. Соединения формулы (I) по п.8, в которых R означает цепь
11. Соединения формулы (I) по любому из пп.1-10, в которых R1 вместе с эндоциклическим атомом углерода, несущим радикал NR1R2, образует двойную связь.
12. Соединения формулы (I) по п.11, в которых R2 означает радикал O(CH2)nNY'2, в котором n означает целое число от 1 до 8 и Y' означает атом водорода или алкильный радикал, содержащий до 8 атомов углерода.
13. Соединения формулы (I) по п.12, в которых n означает число 2.
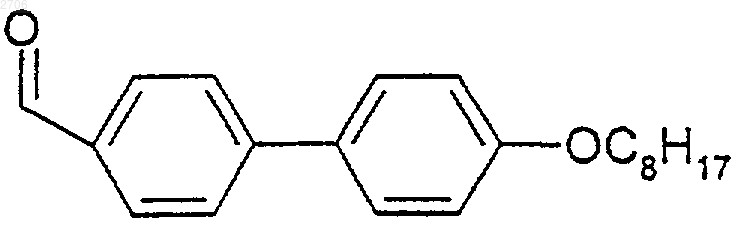
14. Соединения формулы (I) по п.8, в которых R2 означает радикал
15. Соединения формулы (I) по любому из пп.1-10, в которых R2 означает радикал (СН2)рNY"', в котором Y" означает атом водорода или алкильный радикал, содержащий до 8 атомов углерода, и р означает целое число, изменяющееся от 1 до 8.
16. Соединения формулы (I) по любому из пп.1-10 и 15, в которых R1 означает атом водорода.
17. Соединения формулы (I) по п.15, в которых р означает число 2.
18. Соединения формулы (I) по п.1, представляющие собой
1-[(S)-N2-(12-метил-1-оксотетрадецил)-4-[[(3-пиперидинил)окси]имино]-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В;
1-[4-[(2-аминоэтил)амино]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В (изомер А и изомер В);
1-[4-[(аминоиминометил)гидразоно]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В;
1-[4-[(2-аминоэтокси)имино]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В и соответствующий изомер Z;
1-[4-[(2-аминоэтил)амино]-N2-[[4'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-cepинэхинокандин В (изомер А);
а также их соли присоединения кислот.
19. Способ получения соединений формулы (I) по любому из пп.1-18, заключающийся в том, что соединение формулы (II)
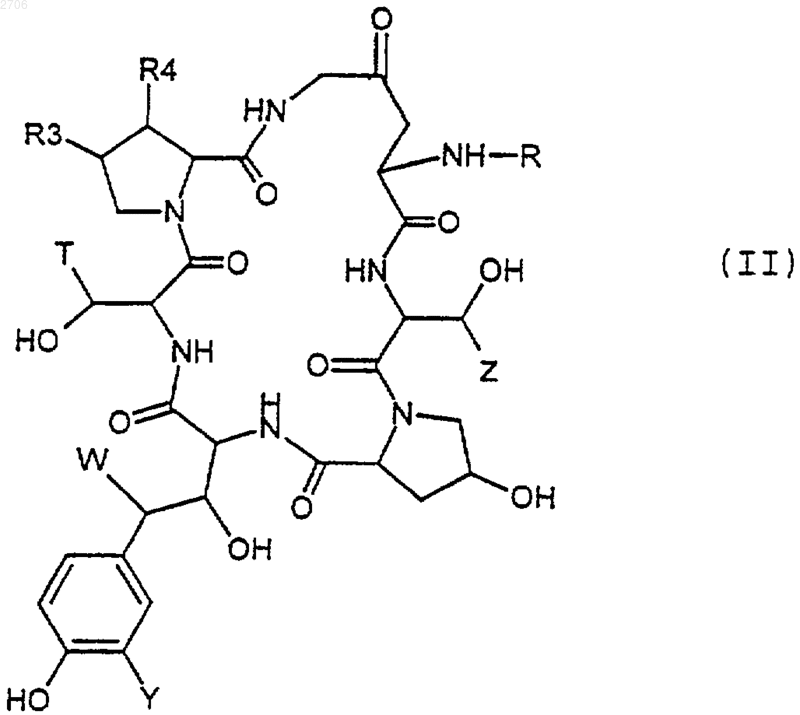
в которой R, R3, R4, Т, Y, W и Z имеют вышеуказанные значения, подвергают воздействию амина или производного амина, способного вводить радикал

в котором R1 и R2 имеют вышеуказанные значения, и, при желании, воздействию восстановителя, и/или агента функционализации амина, и/или кислоты для образования соли полученного продукта, и/или агента для разделения различных полученных изомеров, и таким образом получают целевое соединение формулы (I)
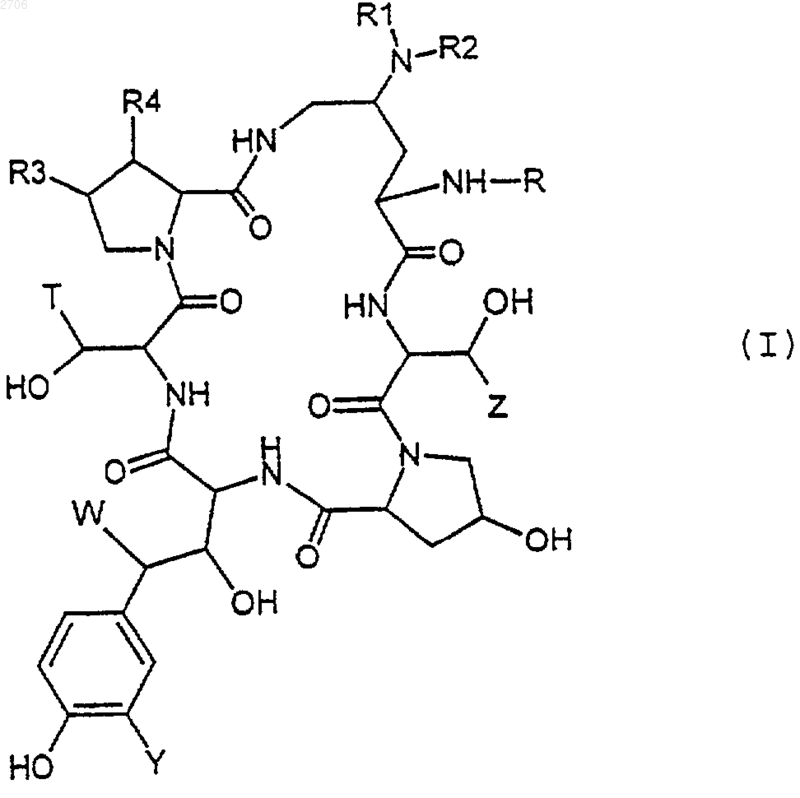
в которой R1, R2, R3, T, Y, W, R и Z имеют вышеуказанные значения, затем, при желании, соединение формулы (I) подвергают воздействию кислоты для образования соли и, при желании, разделяют различные полученные изомеры.
20. Соединения формулы (II), описанные в п.19 в качестве новых химических продуктов.
21. Соединение формулы (II) по п.20, представляющее собой
1-[4-oксo-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В;
1-[N2-[[4'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]-4-окco-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В;
1-[N2-[[4-[4-[4-(пентилокси)фенил]-1-пиперазинил]фенил]карбонил]-4-оксо-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В.
22. Способ по п.19, заключающийся в том, что соединение формулы (II) получено путем обработки соединения формулы (III)
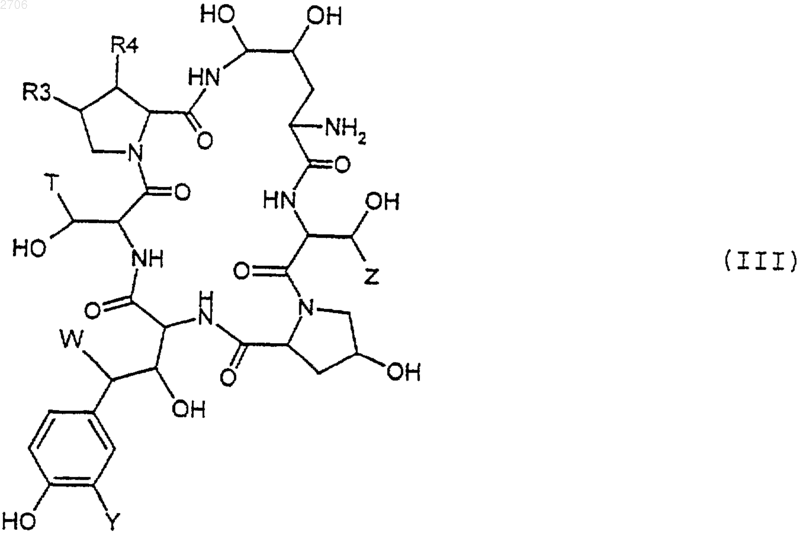
в которой различные заместители имеют вышеуказанные значения, агентом, способным заменять NH2 на NHR, где R имеет вышеуказанное значение, для получения соединения формулы (IV)
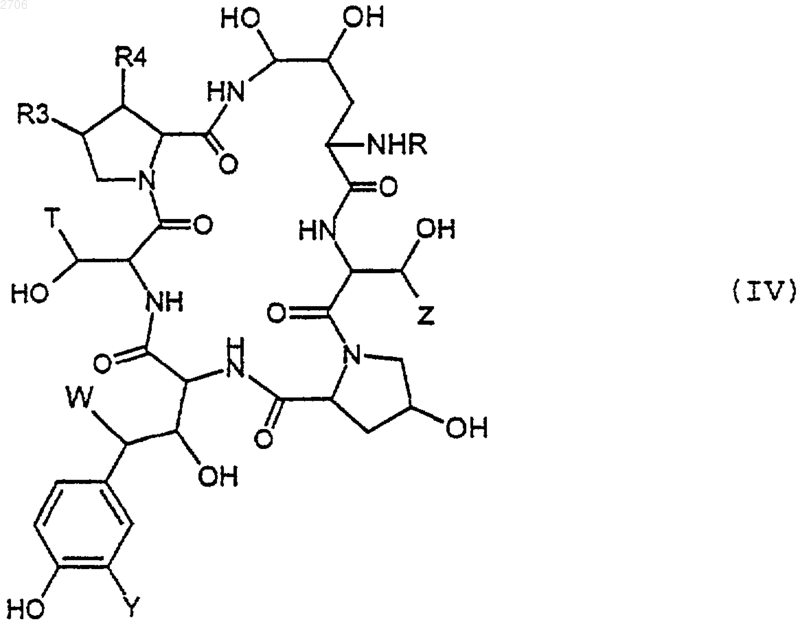
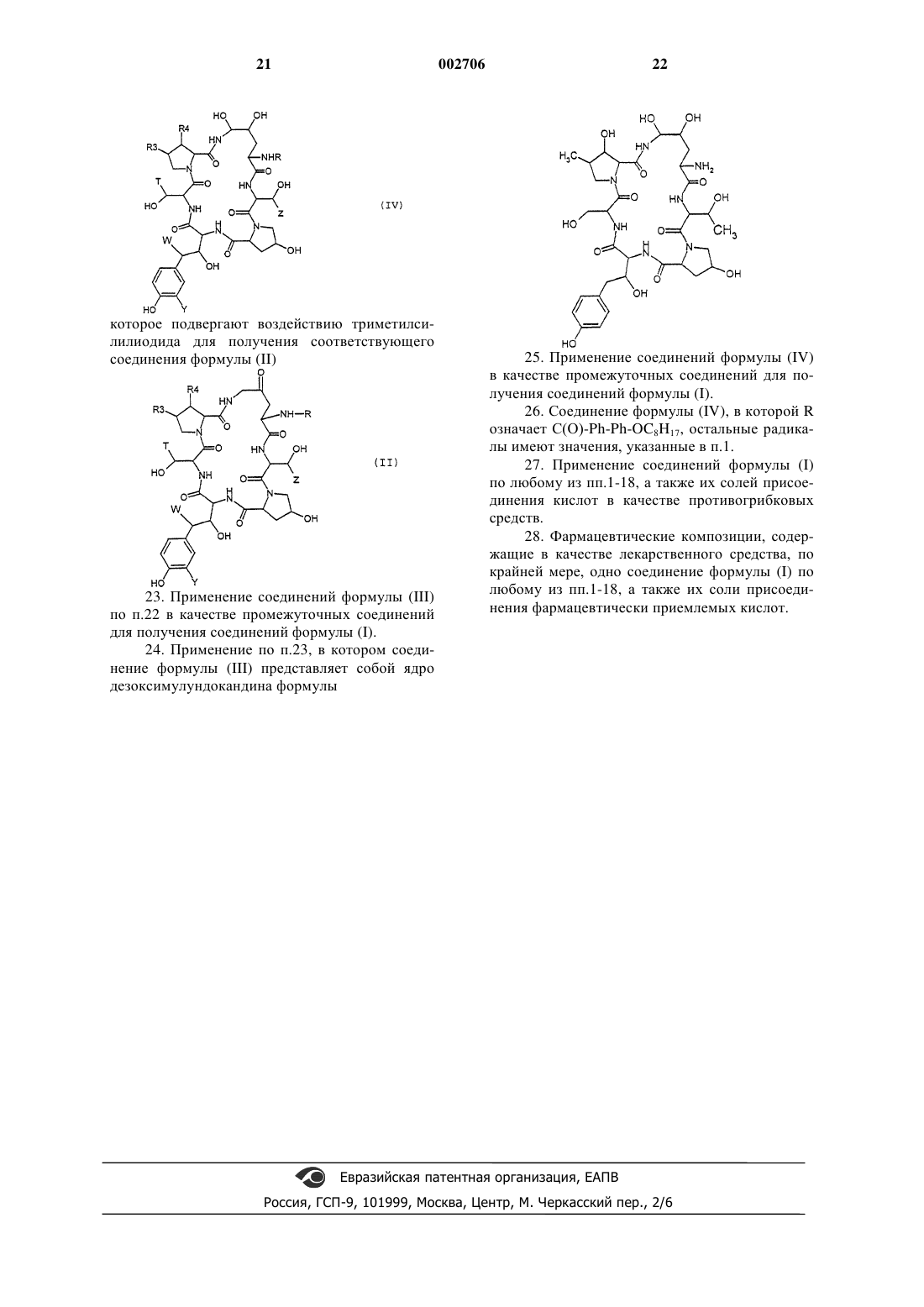
которое подвергают воздействию триметилсилилиодида для получения соответствующего соединения формулы (II)
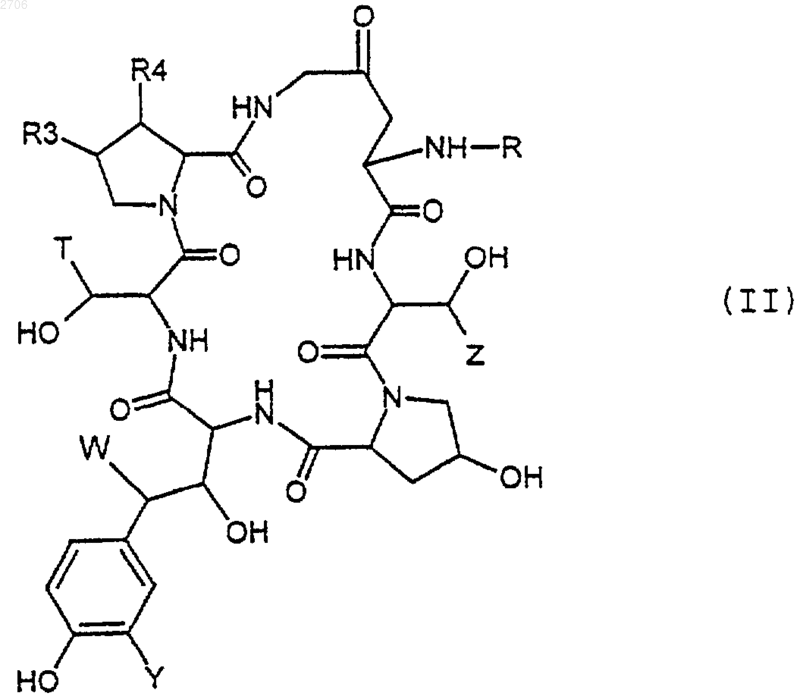
23. Применение соединений формулы (III) по п.22 в качестве промежуточных соединений для получения соединений формулы (I).
24. Применение по п.23, в котором соединение формулы (III) прeдставляет собой ядро дезоксимулундокандина формулы
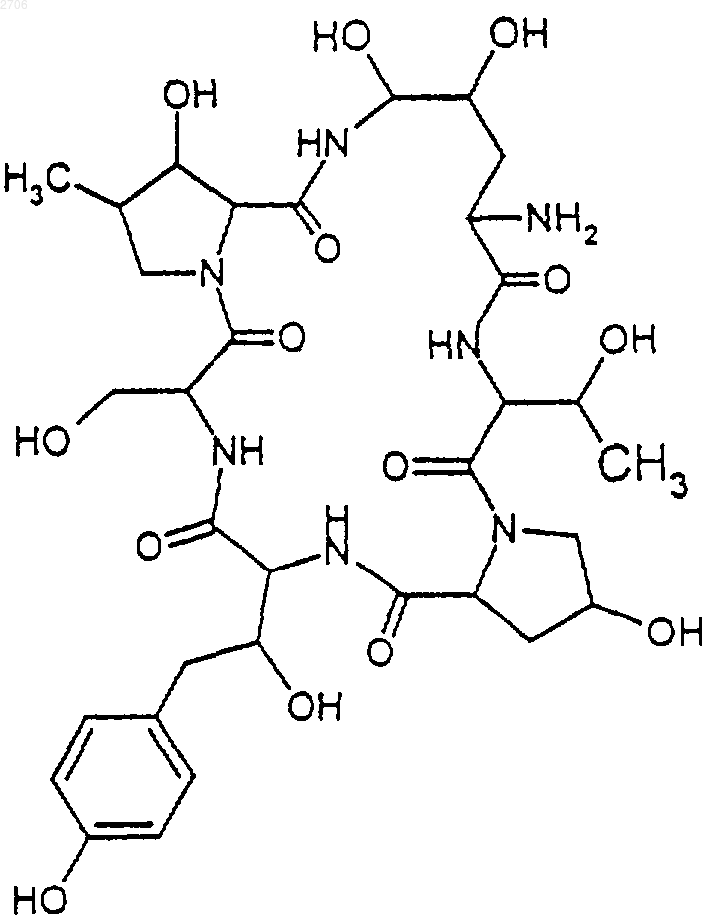
25. Применение соединений формулы (IV) в качестве промежуточных соединений для получения соединений формулы (I).
26. Соединение формулы (IV), в которой R означает С(О)-Ph-Ph-OC8H17, остальные радикалы имеют значения, указанные в п.1.
27. Применение соединений формулы (I) по любому из пп.1-18, а также их солей присоединения кислот в качестве противогрибковых средств.
28. Фармацевтические композиции, содержащие в качестве лекарственного средства, по крайней мере, одно соединение формулы (I) по любому изпп.1-18, а также их соли присоединения фармацевтически приемлемых кислот.
Текст
1 Настоящее изобретение относится к новым производным эхинокандинов, способу их получения и их применению в качестве противогрибковых средств. Более конкретно, объектом изобретения являются соединения формулы (I) во всех возможных изомерных формах, а также в виде их смесей, в которой или R1 и R2, одинаковые или отличающиеся друг от друга, означают атом водорода, гидроксил; линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода,возможно прерываемый атомом кислорода, возможно замещенный атомом галогена, гидроксилом, радикалом где а и b, одинаковые или отличающиеся друг от друга, означают атом водорода или алкильный, алкенильный или алкинильный радикал,содержащий до 8 атомов углерода, причем а и b могут вместе с атомом азота образовывать гетероцикл, возможно включающий один или несколько дополнительных гетероатомов; или R1 с эндоциклическим атомом углерода, несущим радикал образует двойную связь и или R2 означает радикал XRa,где Х означает атом кислорода или радикал NH или N-алкил, алкенил или алкинил, содержащий до 8 атомов углерода; иRa означает атом водорода; линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, возможно замещенный одним или несколькими атомами галогена,одним или несколькими радикалами ОН, СО 2 Н,СО 2 алк, радикалом где а' и b' означают атом водорода, алкильный,алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем а' и b' могут образовывать гетероцикл, который может включать один или несколько дополнительных гетероатомов; 2 и/или гетероциклом, включающим один или несколько гетероатомов; или R2 означает радикал в котором d, e, f и g означают атом водорода или алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем f и g, кроме того, могут означать ацильный радикал, содержащий до 8 атомов углерода; е иf также могут образовывать цикл, который может включать один или несколько гетероатомов;R4 означает атом водорода или гидроксил;R означает линейную, разветвленную или циклическую цепь, содержащую до 30 атомов углерода, возможно включающую один или несколько гетероатомов, один или несколько гетероциклов; или линейный, разветвленный или циклический ацильный радикал, содержащий до 30 атомов углерода, возможно включающий один или несколько гетероатомов и/или один,или несколько гетероциклов; Т означает атом водорода, метил, радикал(СН 2)2Naлк+X-, причем Х означает атом галогена и алк означает алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода;Y означает атом водорода, гидроксил или атом галогена, или радикал ОSО 3 Н, или одну из солей этого радикала;W означает атом водорода или радикал ОН;Z означает атом водорода или метил; а также соли присоединения кислот соединений формулы (I). Из солей присоединения кислот можно назвать соли, образующиеся с неорганическими кислотами, такими как соляная, бромоводородная, серная или фосфорная кислоты; или с органическими кислотами, такими как муравьиная,уксусная, трифторуксусная, пропионовая, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, щавелевая, глиоксиловая, аспарагиновая кислоты, алкансульфокислоты, такие как метан- или этансульфокислоты, арилсульфокислоты, такие как бензол- или птолуолсульфокислоты. В определении заместителей- алкильный, алкенильный или алкинильный радикал представляет собой предпочтительно метил, этил, пропил, изопропил, н-бутил,изобутил, трет-бутил, децил или додецил, винил, аллил, этинил, пропинил, циклобутил, циклопентил или циклогексил;- галогеном является предпочтительно фтор, или хлор, или бром;- арильный радикал представляет собой предпочтительно фенил;- гетероциклический радикал представляет собой предпочтительно пирролил, пирролидинил, пиридил, пиразинил, пиримидил, пиперидинил, пиперазинил, хинуклидинил, оксазолил,изоксазолил, морфолинил, индолил, имидазолил, бензимидазолил, триазолил, тиазолил, азетидинил, азиридинил. В качестве соли радикала SО 3 Н можно назвать соли натрия, калия или соли аминов. Из предпочтительных соединений согласно изобретению можно в особенности назватьO(CH2)nNY'2,в котором n означает целое число от 1 до 8, и в особенности такие, в которых n означает число 2, и Y' означает атом водорода или алкильный радикал, содержащий до 8 атомов углерода, и такие, в которых R2 означает радикал Объектом изобретения также являются соединения формулы (I), в которых R2 означает радикал(CH2)pNY",в котором Y" означает атом водорода или алкильный радикал, содержащий до 8 атомов углерода, и р означает целое число, изменяющееся от 1 до 8, и особенно соединения, в которых р означает число 2. В особенности объектом изобретения являются соединения, в которых R1 означает атом водорода. Из предпочтительных соединений согласно изобретению можно назвать продукты примеров 8, 9, 11, 13 и 14. Соединения формулы (I) обладают ценными противогрибковыми свойствами; они особенно активны в отношении Candida albicans и других Candida, таких как Candida glabrata,krusei, tropicalis, pseudotropicalis, parapsilosis иAspergillus fumigatus, Aspergillus flavus, Cryptococcus neoformans. Соединения формулы (I) могут быть использованы в качестве лекарственных средств как для человека, так и для животного в борьбе,в частности, с пищеварительными, мочевыми,влагалищными или кожными кандидозами,криптококкозами, например с нейроменингеальными, легочными или кожными криптококкозами, бронхиальным и легочным аспергиллзом и инвазивными иммунодепрессионными аспергиллзами. Соединения согласно изобретению также могут быть использованы для профилактики микотических поражений у субъектов с врожденным или приобретенным ослабленным иммунитетом. Соединения согласно изобретению не ограничены применением в фармацевтике, их также можно использовать в качестве фунгицидов в других областях помимо фармацевтических. Следовательно, объектом изобретения являются соединения формулы (I), а также их соли присоединения кислот, в качестве противогрибковых соединений. 5 Объектом изобретения также являются соединения формулы (I) в качестве лекарственных средств. Объектом изобретения являются фармацевтические композиции, включающие в качестве действующего начала, по крайней мере,одно соединение формулы (I) или одну из его солей присоединения фармацевтически приемлемых кислот. Эти композиции можно вводить перорально, ректально, парентерально или локально путем местного нанесения на кожу и слизистые оболочки, но предпочтительным путем введения является пероральный. Они могут быть твердыми или жидкими и находиться в фармацевтических формах, обычно используемых в медицине человека, как, например, простые или дражированные таблетки,желатиновые капсулы, гранулы, суппозитории,препараты для инъекций, мази, кремы, гели; их получают обычными способами. Действующее начало или действующие начала могут быть включены туда с эксципиентами, обычно используемыми в этих фармацевтических композициях, такими как тальк, гуммиарабик, лактоза,крахмал, стеарат магния, масло какао, водные или неводные растворители, жиры животного или растительного происхождения, парафиновые производные, гликоли, различные смачиватели, диспергаторы или эмульгаторы, консерванты. Эти композиции также могут находиться в форме порошка, предназначенного для растворения в момент употребления в соответствующем растворителе, например в стерильной апирогенной воде. Вводимая доза изменяется в зависимости от болезненного состояния, которое нужно лечить, конкретного субъекта, пути введения и конкретного соединения. Она может составлять,например, от 50 до 300 мг в день при введении перорально взрослому для продуктов примеров 8, 9, 11, 13 и 14. Объектом изобретения также является способ получения соединений формулы (I), заключающийся в том, что соединение формулы в которой R, R3, R4, Т, W, Y и Z имеют вышеуказанные значения, подвергают воздействию амина или производного амина, способного вводить радикал в котором R1 и R2 имеют вышеуказанные значения, и, при желании, воздействию восстановителя, и/или агента функционализации амина,и/или кислоты для образования соли полученного продукта, и/или агента для разделения различных полученных изомеров, и таким образом получают целевое соединение формулы (I) в которой R1, R2, Т, W, Y, R и Z имеют вышеуказанные значения, во всех его возможных изомерных формах, а также в виде их смесей,и/или в форме солей с кислотами. Используемые в качестве исходных соединений в способе согласно изобретению соединения формулы (II) представляют собой новые продукты и сами по себе являются объектом настоящего изобретения; их получение, указанное в экспериментальной части, может быть схематически представлено следующим образом: Можно использовать ISi-(СН 3)3 или любую другую кислоту Льюиса. В экспериментальной части приведен подробный пример получения соединения формулы(II), и в особенности нового химического соединения 1-[4-оксо-N2-(12-метил-1-оксотетраде 7 цил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серин-эхинокандина В. Соединение формулы (IV), соответствующее исходному соединению препаративного примера 1, представляет собой известный продукт, описанный и заявленный в европейском патенте 438813. Следующие примеры иллюстрируют изобретение, однако, не ограничивая его объема. Объектом изобретения является также способ получения, заключающийся в том, что соединение формулы (III) в которой различные заместители имеют вышеуказанные значения, подвергают воздействию агента, способного заменять NH2 на NHR, где R имеет вышеуказанное значение, для получения соединения формулы (IV) в которой различные заместители имеют вышеуказанные значения, которое подвергают воздействию триметилсилилиодида для получения соединения формулы (II). Соединения формулы (III), используемые в качестве исходного продукта, представляют собой новые соединения и сами по себе являются объектом настоящего изобретения. Пример получения соединения формулы (III) приводится ниже в экспериментальной части. Особенно объектом изобретения является"ядро" дезоксимулундокандина, соединение формулы (III), получение которого указывается ниже в экспериментальной части. Соединения формулы (IV), указанные выше, за исключением мулундокандина и дезоксимулундокандина, представляют собой новые соединения и сами по себе являются объектом настоящего изобретения. В особенности объектом изобретения являются соединения формулы (IV), получение которых указывается ниже в экспериментальной части. 8 Эти нижеследующие примеры иллюстрируют изобретение, однако, не ограничивая его объема. Препаративный пример 1. 1-[N2-(12 Метил-1-оксотетрадецил)-4-оксо-L-орнитин]-4[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В. При перемешивании с помощью магнитной мешалки и в атмосфере азота в 25 мл ацетонитрила вводят 1 г 1-[(4R,5R)-4,5-дигидроксиN2-(12-метил-1-оксотетрадецил)-L-орнитин]-4[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандина В. Добавляют 455 мкл триметилсилилиодида. Нагревают при температуре 55 С в течение 40 мин. Гидролизуют с помощью 3%ного раствора тиосульфата натрия. После перемешивания в течение 10 мин доводят до сухого состояния при пониженном давлении и очищают путем хроматографии на диоксиде кремния. Получают 62% целевого продукта. ТСХ: Rf=0,25 (элюент: СН 2 Сl2-СН 3 ОНН 2O=86-13-1). Пример 1. 1-[4-Амино-N2-(12-метил-1 оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серин-эхинокандин Втрифторацетат (изомер В). Вводят 50 мг полученного в препаративном примере 1 продукта в 2,5 мл метанола в присутствии активированного силипорита 4. При температуре 20 С добавляют 158 мг ацетата аммония. Полученный раствор нагревают до температуры 50 С и добавляют 5,5 мгNаВН 3 СN. Перемешивают в течение 3 ч 15 мин. Добавляют 1 мл деминерализованной воды и раствор концентрируют досуха. Получают 166 мг продукта, который очищают путем ВЭЖХ(C18), элюируя смесью СН 3 СN-Н 2 О-ТФУ (50-500,02). Получают 17 мг целевого продукта. МH+=975. Пример 2. 1-[4-2-Диметиламиноэтиламино-N2-(12-метил-1-оксотетрадецил)-L-орнитин]4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В-трифторацетат (изомеры А и В). При температуре 20 С 80 мг полученного в препаративном примере 1 продукта вводят в раствор, содержащий 1 мл метанола, 160 мкл 2 диметиламиноэтиламина, 8 мл 1 М раствора хлороводорода в метаноле, в присутствии силипорита 4 . Вводят 35 мг цианоборгидрида натрия и перемешивают в течение 20 ч при температуре 20 С. Отфильтровывают, промывают метанолом и концентрируют досуха. Получают 325 мг продукта, который очищают путем ВЭЖХ (C18) (элюент: СН 3 СN-Н 2 О-ТФУ=45-550,02, затем CH3CN-Н 2 О-ТФУ=42-58-0,02). Получают 8,1 мг изомера А целевого продукта и 9,4 мг изомера В целевого продукта. Масс-спектр: МH+=1046; MNa+=1068. Пример 3. 1-[4-[(3-Аминопропил)амино]N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В-трифторацетат (изомеры А и В). 9 При температуре 0 С 30 см 3 1 М раствора хлороводорода в метаноле добавляют в раствор,содержащий 200 мг полученного в препаративном примере 1 продукта, 2 мл метанола и 300 мкл диаминопропана. Перемешивают в течение 15 мин при температуре 0 С и добавляют 84 мг 95%-ного цианоборгидрида натрия. Перемешивают в течение 6 ч при комнатной температуре и доводят до сухого состояния при пониженном давлении. Полученный остаток обрабатывают ацетонитрилом, отфильтровывают в вакууме и сушат при пониженном давлении. Получают 312 мг продукта, который очищают путем ВЭЖХ (C18) (элюент: СН 3 СN-Н 2 ОТФУ=45-55-0,02) и получают 15 мг изомера А и 10 мг изомера В. Масс-спектр: MH+=1032. Пример 4. (Z+E)-1-[4-[(4,5-Дигидро-1 Н-имидазол-2-ил)гидразоно]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серин-эхинокандин В-трифторацетат. В течение 2 ч при перемешивании кипятят с обратным холодильником 350 мг полученного в препаративном примере 1 продукта, 12 мл метанола и 130 мг 2-гидразино-2-имидазолингидробромида. После выпаривания досуха получают 510 мг продукта, который очищают путем хроматографии на диоксиде кремния, элюируя смесью СН 2 Сl2-СН 3 ОН-Н 2O (86-13-1), затем с помощью полупрепаративной ВЭЖХ (C18),элюируя смесью СН 3 СN-Н 2 О-ТФУ (55-45-0,02). Таким образом получают 133 мг целевого продукта. Масс-спектр: МH+=1056; MNa+=1078. Пример 5. (Z)-1-[4-[(2-Гидроксиэтокси) имино]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-Lсерин-эхинокандин В и соответствующий изомер Е. В течение 4 ч кипятят с обратным холодильником смесь 36 мг О-(2-гидроксиэтил)гидроксиламина, 5 мл этанола, 12 мкл пиридина,4 мкл чистой уксусной кислоты и 150 мг полученного в препаративном примере 1 продукта. Получают 205 мг продукта, который очищают путем хроматографии на диоксиде кремния,элюируя смесью дихлорметан-метанол-вода (8613-1). Выделяют 2 продукта с Rf=0,2 и 0,25(изомер Z и изомер Е). Масс-спектр: МН+=1033; MNa+=1055. Пример 6. (Е)-1-[4-(Гидроксиимино)-N2(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4(4-гидроксифенил)-L-треонин]-5-L-серин-эхинокандин В и соответствующий изомер Z. В течение 1 ч при перемешивании кипятят с обратным холодильником смесь, содержащую 200 мг полученного в препаративном примере 1 продукта, 8 мл этанола, 36 мг гидроксиламингидрохлорида. Доводят до сухого состояния и очищают путем ВЭЖХ (C18) (элюент: CH3CNH2O=60-40). Получают 72 мг изомера Z и 60 мг изомера Е. 10 Масс-спектр: МH+=989; MNa+=1011. Пример 7. 1-[4-(Гидроксиамино)-N2-(12 метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4 гидроксифенил)-L-треонин]-5-L-серинэхинокандин В-трифторацетат (изомер А и изомер В). В течение 3 ч перемешивают 70 мг смеси оксимов Е+Z, полученной в предыдущем примере, 1 см 3 трифторуксусной кислоты, 12 мг 95%-ного цианоборгидрида натрия. Доводят до сухого состояния при пониженном давлении. Очищают путем ВЭЖХ (C18). Получают целевые продукты. Масс-спектр: МН+=991; MNa+=1013. Пример 8.(Z)-1-[(S)-N2-(12-Метил-1 оксотетрадецил)-4-(3-пиперидинил)окси]имино]-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-L-серин-эхинокандин В-гидрохлорид. Стадия А. Добавляют 146 мг полученного в препаративном примере 1 продукта и 60 мкл уксусной кислоты в раствор, содержащий 45 мг фенилметилового эфира R-3-(аминоокси)-1-пиперидинкарбоновой кислоты и 2 мл метанола. Перемешивают в течение 2 ч при комнатной температуре. Концентрируют, очищают путем хроматографии на диоксиде кремния, элюируя смесью дихлорметанметанол=98-2. Таким образом получают целевой продукт. Масс-спектр: МН+=1206; MNa+=1228. Стадия В. Выдерживают в атмосфере водорода и при интенсивном перемешивании в течение 5 ч смесь, включающую 61 мг полученного на стадии А продукта, 20 мг палладия-на-угле и 1 мл уксусной кислоты. Отфильтровывают и концентрируют. Получают 65% целевого продукта. Масс-спектр: MH+=1072. Пример 9. 1-[4-[(2-Аминоэтил)амино]-N2(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В-трифторацетат (изомер А и изомер В). К раствору 300 мг полученного в препаративном примере 1 продукта в 6 мл метанола в присутствии 375 мкл этилендиамина добавляют 63 мл 1 М раствора хлороводорода в метаноле. После перемешивания в течение 15 мин добавляют 126 мг цианоборгидрида натрия (NaBH3CN). Реакционную среду перемешивают в течение 5 ч. Отфильтровывают и доводят до сухого состояния, причем продукты очищают путем ВЭЖХ (C18), элюируя смесью СН 3 СN-Н 2 О-ТФУ(40-60-0,02). Таким образом получают целевые продукты. Масс-спектр: МН+=1018; MNa+=1040. Пример 10. (Е)-1-[4-[(2-Бромэтокси)имино]N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В и соответствующий изомер Z. Добавляют 402 мг 2-бромэтоксиамингидробромида в раствор, содержащий 710 мг полученного в препаративном примере 1 продукта и 28 мл абсолютного этанола. Смесь кипятят с 11 обратным холодильником в течение 55 мин. Концентрируют при пониженном давлении. Полученный продукт очищают путем флэшхроматографии на диоксиде кремния, элюируя смесью дихлорметан-метанол (9-1). Получают целевые продукты: изомер A: Rf=0,54; изомер В:Rf=0,47. Масс-спектр: МН+=1095; MNa+=1117. Пример 11. -1-[4-[(Аминоиминометил) гидразоно]-N2-(12-метил-1-оксотетрадецил)-Lорнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5L-серин-эхинокандин B-трифторацетат. Добавляют 162 мг аминогуанидингидрохлорида в раствор, содержащий 260 мг полученного в препаративном примере 1 продукта и 10 мл н-бутанола. Реакционную среду кипятят с обратным холодильником в течение 2 ч 30 мин. Концентрируют при пониженном давлении. Полученный продукт очищают путем полупрепаративной ВЭЖХ. Получают 225 мг продукта в виде смеси изомеров 50/50. Масс-спектр: МН+=1030; MNa+=1052. Пример 12. (Z)-1-[4-2-(Диметиламино) этоксиимино]-N2-(12-метил-1-оксотетрадецил)L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]5-L-серин-эхинокандин В-трифторацетат и соответствующий изомер Е. Вводят 80,5 мг продукта примера 10 в 32 мл этанольного раствора диметиламина. Реакционную смесь кипятят с обратным холодильником в течение 45 мин. Концентрируют. Полученный продукт очищают путем ВЭЖХ (C18) (СН 3 СNН 2 О-ТФУ=60-40-0,02). Таким образом получают целевые продукты. Масс-спектр: MH+=1060. Пример 13. (Е)-1-[4-[(2-Аминоэтокси) имино]-N2-(12-метил-1-оксотетрадецил)-L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]-5-Lсеринэхинокандин В-трифторацетат и соответствующий изомер Z. Вводят 50 мг продукта примера 10 в аммиак. Перемешивают под давлением в течение 16 ч при возврате температуры до комнатной. Реакционную среду обрабатывают смесью СН 3 СNН 2 О (45-55) для очистки с помощью ВЭЖХ(C18). Получают целевые продукты. Масс-спектр: MH+=1032. Препаративный пример 2. "Ядро" дезоксимулундокандина. Растворяют 2 г дезоксимулундокандина в 20 мл диметилсульфоксида. Этот раствор выливают в суспензию, содержащую 120 г Actinoplanes utahensis FH2264 в 870 мл буфераKН 2 РO4, K2 НРO4 (рН=6,8). Реакционную смесь перемешивают в течение 70 ч при температуре 30 С. Отфильтровывают. Мицелий промывают фосфатным буфером (рН=6,8) Промывные жидкости и фильтрат объединяют. Полученный продукт хроматографируют на смоле DIAIONHP 20 и получают продукт, который используют далее таким, какой есть. 12 Пример 14. 1-[4-[(2-Аминоэтил)амино]-N24'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]5-L-серинэхинокандин В-трифторацетат (изомер А). Стадия А. 1-[(4R,5R)-4,5-Дигидрокси-N24'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]5-L-серинэхинокандин В. 1. Получение сложного эфира. К 1 г 4'-октилокси-[1,1'-бифенил]-4-карбоновой кислоты в 22 мл тетрагидрофурана добавляют 632 г 2,3,4,5,6-пентафторфенола в 695 мг N,N'-дициклогексилкарбодиимида, перемешивают в течение 22 ч при комнатной температуре, отфильтровывают, удаляют растворители при пониженном давлении, остаток обрабатывают диэтиловым эфиром, перемешивают при температуре примерно 35 С, отфильтровывают, растворитель выпаривают, сушат и выделяют 1,46 г целевого продукта, используемого таким, какой есть. 2. Сочетание. В 16 мл диметилформамида вводят 677 мг"ядра" дезоксимулундокандина, полученного в препаративном примере 2. Полученный раствор перемешивают в течение 5 мин и добавляют 793 мг полученного выше пентафторфенилового эфира 4'-(октилокси)-[1,1'-бифенил]-4-карбоновой кислоты. Реакционную смесь выдерживают при перемешивании и в атмосфере азота в течение 24 ч. Отфильтровывают и концентрируют. Остаток обрабатывают диэтиловым эфиром, порошкуют, перемешивают в течение 25 мин, отфильтровывают в вакууме, промывают диэтиловым эфиром, хроматографируют на диоксиде кремния, элюируя смесью дихлорметанметанол-вода (86/13/1), затем (80/20/1). Таким образом получают целевой продукт. Выход составляет 73%. Стадия В. 1-[N2-4'-(Октилокси)-[1,1'-бифенил]-4-ил]карбонил]-4-oкco-L-орнитин]-4-[4(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В. Добавляют 311 мкл триметилсилилиодида в суспензию, содержащую 809 мг продукта стадии А и 19 мл ацетонитрила. Реакционную смесь перемешивают в течение 15 мин при температуре 60 С и в атмосфере азота. Смесь выливают в насыщенный раствор тиосульфата натрия. Выпаривают и полученный остаток хроматографируют на диоксиде кремния, элюируя смесью дихлорметан-метанол-вода=86/13/1. Получают целевой продукт. Выход составляет 55%. Стадия С. 1-[4-[(2-Аминоэтил)амино]-N24'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]L-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]5-L-серинэхинокандин В-трифторацетат (изомер А). 13 В раствор, содержащий 900 мг полученного на предыдущей стадии продукта, 16 мл метанола и 250 мкл этилендиамина, добавляют 560 мкл уксусной кислоты. Перемешивают в течение 15 мин и добавляют 64 мг цианоборгидрида натрия. Перемешивают в течение 18 ч. Отфильтровывают и концентрируют. Остаток обрабатывают минимальным количеством воды,порошкуют, отфильтровывают в вакууме и очищают путем препаративной ВЭЖХ, элюируя смесью СН 3 СN/Н 2 О/ТФУ (55-45-0,02). Получают целевой продукт. Выход составляет 26%. ЯМР-спектр (CDCl3)в м.д.: 9,07 (уш. м,1 Н); 8,48 (д, J=8, 1 Н); 8,00 (д, J=8, 2H); 7,96 (д,J=8,5, 2H); 7,71 (д, J=8,5, 2 Н); 7,64 (д, J=8,5, 2H); 7,60 (д, J=9, 1H); 7,37 (д, J=9,5, 1 Н); 7,02 (д,J=8,5, 2H); 6,97 (д, J=8,5, 2H); 6,65 (д, J=8,5, 2H); 4,90 (м, 1H); 4,77 (м, 1H); 4,66 (м, 1H); 4,45 (м,1H); 4,42 (м, 1H); 4,39 (м, 1H); 4,34 (с, 1H); 4,26N,N'-дициклогексилкарбодиимида в смесь 100 мг [4-[4-[4-(пентилокси)фенил]-1-пиперазинил] фенил]карбоновой кислоты и 3 мл тетрагидрофурана. Реакционную смесь перемешивают при температуре 20 С в течение 16 ч, отфильтровывают, промывают тетрагидрофураном и концентрируют досуха. Обрабатывают диэтиловым эфиром, отфильтровывают, промывают и концентрируют. Получают 71 мг продукта. 2. Сочетание. В течение ночи при температуре 20 С перемешивают суспензию, содержащую 71 мг полученного выше сложного эфира, 70 мг "ядра" дезоксимулундокандина, полученного как указано в препаративном примере 2, 2,5 мл диметилформамида в присутствии активированного силипорита 4 . Концентрируют, полученный продукт обрабатывают диэтиловым эфиром и отфильтровывают. Получают продукт, который хроматографируют на диоксиде кремния, элюируя смесью ацетонитрил/вода/трифторуксусная кислота (60-40-0,02). Таким образом получают 30 мг целевого продукта. 14 Стадия В. 1-[N2-4-[4-[4-(Пентилокси) фенил]-1-пиперазинил]фенил]карбонил]-4-оксоL-орнитин]-4-[4-(4-гидроксифенил)-L-треонин]5-L-серин-эхинокандин В. 1. Получение сложного эфира. Нагревают до температуры 55 С смесь 1 г продукта, полученного на стадии А, 25 мл ацетонитрила, в присутствии активированного силипорита 4. Добавляют 430 мл триметилсилилиодида. Перемешивают в течение 45 мин,затем добавляют 150 мкл 30%-ного водного раствора тиосульфата натрия. Перемешивают в течение 40 мин при температуре 20 С и концентрируют. Сухой экстракт обрабатывают водой, перемешивают в течение 1 ч при температуре 20 С, отфильтровывают в вакууме и промывают. Получают продукт, который хроматографируют на диоксиде кремния, элюируя смесью дихлорметанметанол-вода (86/13/1). Получают 497 мг целевого продукта. Выход составляет 42%. Стадия С. 1-[4-[(Аминоиминометил)гидразоно]-N2-4-[4-[4-(пентилокси)фенил]-1-пиперазинил]фенил]карбонил]-L-орнитин]-4-[4-(4 гидроксифенил)-L-треонин]-5-L-серин-эхинокандин В. В течение 3 ч при температуре 130 С нагревают суспензию, содержащую 400 мг продукта, полученного на стадии В, 4,8 мл нбутанола и 221 мг аминогуанидингидрохлорида. Концентрируют и получают 705 мг продукта,который хроматографируют на диоксиде кремния, элюируя смесью дихлорметана с метанолом в соотношении 85/15, затем путем полупрепаративной ВЭЖХ (Кромасил C18) с помощью смеси ацетонитрил/вода/трифторуксусная кислота (40-60-0,02). Таким образом получают 64 мг целевого продукта. ЯМР-спектр (CDCl3)в м.д.: 10,75 (с,0,66 Н); 10,45 (с, 0,33 Н); 8,39 (д, J=8, 0,33 Н); 8,34L-треонин]-5-L-серин-эхинокандин В (изомер А и изомер В). Следуя предыдущей методике, из "ядра" дезоксимулундокандина, полученного как указано в препаративном примере 2, получая в качестве промежуточного продукта 1-[(4R,5R)4,5-дигидрокси-N2-4"-(пентилокси)[1,1':4',1"терфенил]-4-ил]карбонил]-L-орнитин]-4-[4-(4 гидроксифенил)-L-треонин]-5-L-серинэхинокандин В и соответствующее 4-оксо-производное,получают целевой продукт. ЯМР-спектр (CDCl3)в м.д.: 9,00 (широкая, 1H); 8,37 (д, J=8,5, 1H); 8,28 (м, 1H); 8,10 (д,J=6, 1H); 8,02 (д, J=8, 2H); 7,82 (м, 4 Н); 7,73 (д,J=8, 2H); 7,66 (д, J=8, 2H); 7,38 (д, J=9, 1H); 7,32Chemother., 35, 99-103, 1991. 22,5 мкг мембранных протеинов инкубировали в смеси 2 ммоль 14 Суридиндифосфатглюкозы (удельная активность= 0,34 мКи/ммоль), 50 мкг -амилазы, 1 ммоль дитиотреитола (DTT), 1 ммоль этилендиаминтетрауксусной кислоты (EDTA), 100 ммоль NaF,7 мкмоль гуанозин-5'-трифосфатS (GTPS),1 моль сахарозы и 50 ммоль DE Трис-НСl(рН=7,8) в объеме 100 мкл. Среду инкубировали при температуре 25 С в течение 1 ч и реакцию прекращали путем добавления трихлоруксусной кислоты с конечной концентрацией 5%. Реакционную смесь переносили на предварительно увлажненный фильтр из стекловолокна. Фильтр промывали, сушили и подсчитывали его радиоактивность. Мулундокандин использовали в качестве положительного контроля. Контроль растворителя осуществляли с одинаковым количеством 1%-ного диметилсульфоксида. Полученные результаты показывают, что продукты согласно изобретению проявляют в 16 этом тесте хорошую активность, в особенности продукты примеров 9, 11 и 14. В. Активность в отношении фермента Aspergillus fumigatus. Фермент получали по способу Beaulieu и др. (Antimicrob. Agents Chemother., 38, 937-944,1994). Используемый протокол эксперимента идентичен протоколу, описанному выше для фермента Candida albicans, за исключением того, что не используют дитиотреитол в реакционной смеси. В этом тесте продукты проявляют хорошую активность. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) их возможные изомерные формы или их смеси,в которых или R1 и R2, одинаковые или отличающиеся друг от друга, означают атом водорода, гидроксил; линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода,возможно прерываемый атомом кислорода, возможно замещенный атомом галогена, гидроксилом, радикалом где а и b, одинаковые или отличающиеся друг от друга, означают атом водорода или алкильный, алкенильный или алкинильный радикал,содержащий до 8 атомов углерода, причем а и b при известных условиях вместе с атомом азота могут образовывать гетероцикл, возможно включающий один или несколько дополнительных гетероатомов; или R1 с эндоциклическим атомом углерода, несущим радикал образует двойную связь и или R2 означает радикал XRa,где Х означает атом кислорода или радикал NH или N-алкил, алкенил или алкинил, содержащий до 8 атомов углерода; иRa означает атом водорода, линейный, разветвленный или циклический алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, возможно замещен 17 ный одним или несколькими атомами галогена,одним или несколькими радикалами ОН, СO2 Н,СО 2 алк, радикалом 18 7. Соединения формулы (I) по любому из пп.1-6, в которых R4 означает гидроксил. 8. Соединения формулы (I) по любому из пп.1-7, в которых R означает радикал где а' и b' означают атом водорода, алкильный,алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем а' и b' могут образовывать гетероцикл, возможно включающий один или несколько дополнительных гетероатомов; и/или гетероциклом, включающим один или несколько гетероатомов; или R2 означает радикал в котором d, e, f и g означают атом водорода или алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода, причем f и g, кроме того, могут означать ацильный радикал, содержащий до 8 атомов углерода; е иf также могут образовывать цикл, возможно включающий один или несколько гетероатомов;R4 означает атом водорода или гидроксил;R означает линейную, или разветвленную,или циклическую цепь, содержащую до 30 атомов углерода, возможно включающую один или несколько гетероатомов, один или несколько гетероциклов; или линейный, разветвленный или циклический ацильный радикал, содержащий до 30 атомов углерода, возможно включающий один или несколько гетероатомов и/или один, или несколько гетероциклов; Т означает атом водорода, метил, радикал(CH2)2Naлк+X-, причем Х означает атом галогена и алк означает алкильный, алкенильный или алкинильный радикал, содержащий до 8 атомов углерода;Y означает атом водорода, гидроксил или атом галогена, или радикал ОSО 3 Н, или одну из солей этого радикала;W означает атом водорода или радикал ОН;Z означает атом водорода или метил; а также соли присоединения кислот соединений формулы (I). 2. Соединения формулы (I) по п.1, в которых Т означает атом водорода. 3. Соединения формулы (I) по п.1 или 2, в которых W означает атом водорода. 4. Соединения формулы (I) по любому из пп.1-3, в которых Z означает метил. 5. Соединения формулы (I) по любому из пп.1-4, в которых Y означает атом водорода. 6. Соединения формулы (I) по любому из пп.1-5, в которых R3 означает метил. 11. Соединения формулы (I) по любому из пп.1-10, в которых R1 вместе с эндоциклическим атомом углерода, несущим радикал NR1R2, образует двойную связь. 12. Соединения формулы (I) по п.11, в которых R2 означает радикалO(CH2)nNY'2,в котором n означает целое число от 1 до 8 и Y' означает атом водорода или алкильный радикал,содержащий до 8 атомов углерода. 13. Соединения формулы (I) по п.12, в которых n означает число 2. 14. Соединения формулы (I) по п.8, в которых R2 означает радикал 15. Соединения формулы (I) по любому из пп.1-10, в которых R2 означает радикал(СН 2)рNY",в котором Y" означает атом водорода или алкильный радикал, содержащий до 8 атомов уг 19 лерода, и р означает целое число, изменяющееся от 1 до 8. 16. Соединения формулы (I) по любому из пп.1-10 и 15, в которых R1 означает атом водорода. 17. Соединения формулы (I) по п.15, в которых р означает число 2. 18. Соединения формулы (I) по п.1, представляющие собой- 1-[4-[(2-аминоэтил)амино]-N2-4'-(октилокси)-[1,1'-бифенил]-4-ил]карбонил]-L-орнитин]4-[4-(4-гидроксифенил)-L-треонин]-5-L-cepинэхинокандин В (изомер А); а также их соли присоединения кислот. 19. Способ получения соединений формулы (I) по любому из пп.1-18, заключающийся в том, что соединение формулы (II) в которой R, R3, R4, Т, Y, W и Z имеют вышеуказанные значения, подвергают воздействию амина или производного амина, способного вводить радикал в котором R1 и R2 имеют вышеуказанные значения, и, при желании, воздействию восстановителя, и/или агента функционализации амина,и/или кислоты для образования соли получен 002706 20 ного продукта, и/или агента для разделения различных полученных изомеров, и таким образом получают целевое соединение формулы (I) в которой R1, R2, R3, T, Y, W, R и Z имеют вышеуказанные значения, затем, при желании,соединение формулы (I) подвергают воздействию кислоты для образования соли и, при желании, разделяют различные полученные изомеры. 20. Соединения формулы (II), описанные в п.19 в качестве новых химических продуктов. 21. Соединение формулы (II) по п.20,представляющее собой- 1-[N2-4-[4-[4-(пентилокси)фенил]-1-пиперазинил]фенил]карбонил]-4-оксо-L-орнитин]4-[4-(4-гидроксифенил)-L-треонин]-5-L-серинэхинокандин В. 22. Способ по п.19, заключающийся в том,что соединение формулы (II) получено путем обработки соединения формулы (III) в которой различные заместители имеют вышеуказанные значения, агентом, способным заменять NH2 на NHR, где R имеет вышеуказанное значение, для получения соединения формулы которое подвергают воздействию триметилсилилиодида для получения соответствующего соединения формулы (II) 23. Применение соединений формулы (III) по п.22 в качестве промежуточных соединений для получения соединений формулы (I). 24. Применение по п.23, в котором соединение формулы (III) прeдставляет собой ядро дезоксимулундокандина формулы 25. Применение соединений формулы (IV) в качестве промежуточных соединений для получения соединений формулы (I). 26. Соединение формулы (IV), в которой R означает С(О)-Ph-Ph-OC8H17, остальные радикалы имеют значения, указанные в п.1. 27. Применение соединений формулы (I) по любому из пп.1-18, а также их солей присоединения кислот в качестве противогрибковых средств. 28. Фармацевтические композиции, содержащие в качестве лекарственного средства, по крайней мере, одно соединение формулы (I) по любому из пп.1-18, а также их соли присоединения фармацевтически приемлемых кислот.
МПК / Метки
МПК: A61K 38/12, C07K 7/56, A61P 31/10
Метки: эхинокандина, способ, применение, качестве, противогрибковых, получения, средств, производные
Код ссылки
<a href="https://eas.patents.su/12-2706-proizvodnye-ehinokandina-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-protivogribkovyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные эхинокандина, способ их получения и их применение в качестве противогрибковых средств</a>
Предыдущий патент: Комбинационная терапия, включающая в себя амлодипин и статиновое соединение
Следующий патент: Фармацевтические композиции, предназначенные для направленного восполнения дефицита эстрогена в центральной нервной системе
Случайный патент: Грузовой контейнер