Кристаллические формы цинковой соли розувастатина
Номер патента: 24416
Опубликовано: 30.09.2016
Авторы: Марковитш Имре, Катаине Фаддьяш Каталин, Шипош Эва, Хаваши Балаж, Хамори Чаба, Лукач Дьюла, Юрак Ференц, Вольк Балаж, Кованьине Лах Дьёрдьи, Фодорне Кочмар Кристина, Мезёвари Моника, Рунге Жольт
Формула / Реферат
1. Кристаллическая форма V цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I)
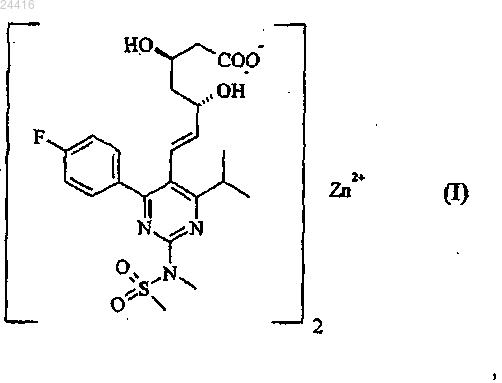
отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuKα, со следующим углом дифракции 2θ (±0,2° 2θ): 4,746°.
2. Кристаллическая форма V цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I) по п.1, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuKα, со следующими углами дифракции 2θ (±0,2° 2θ): 4,746 и 15,371°.
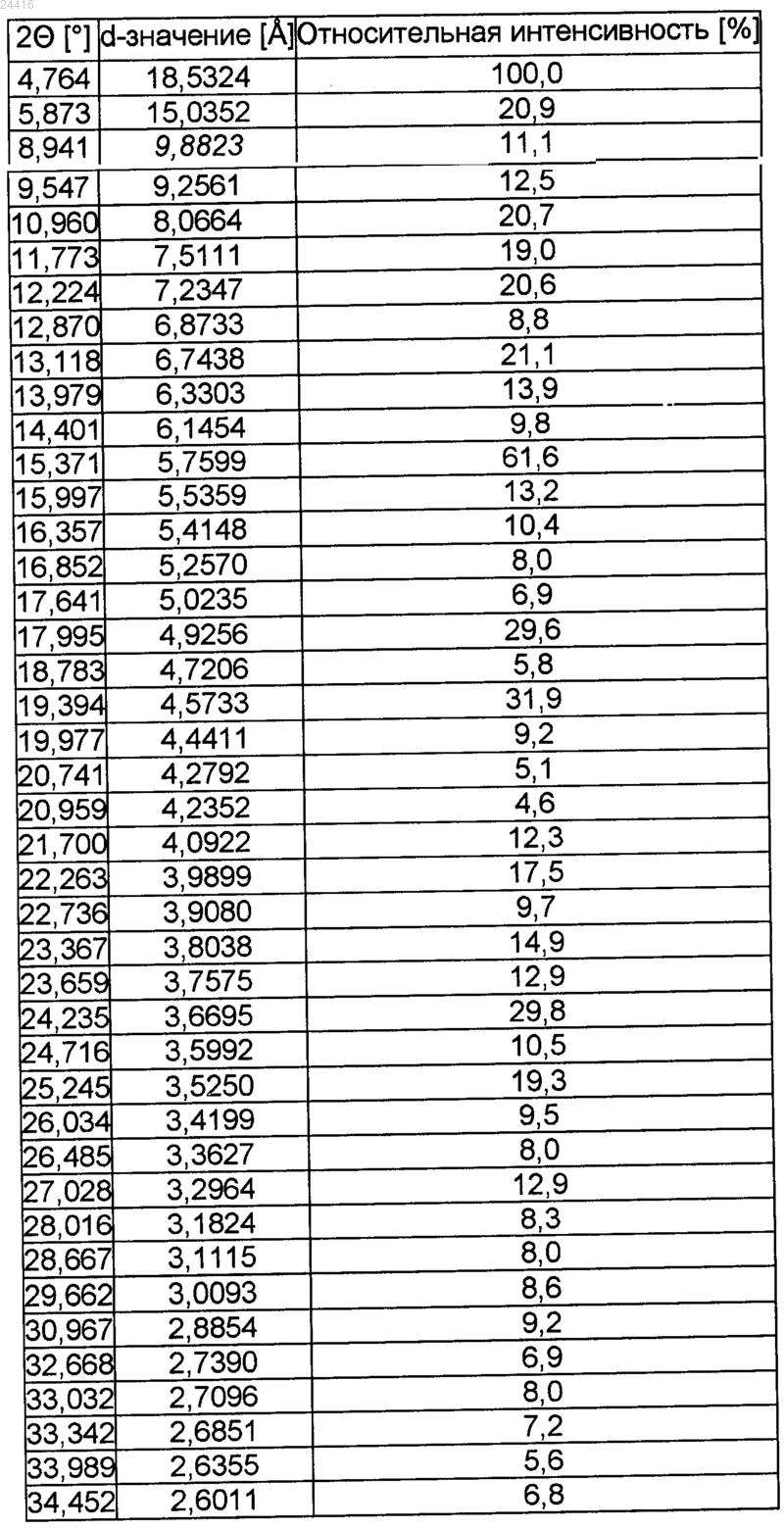
3. Кристаллическая форма V цинковой соли розувастатина (2:1) по п.1 или 2, имеющая порошковую рентгеновскую дифрактограмму, представленную на фиг. 1, и следующие линии рентгеновской дифракции, измеренные с помощью излучения CuKα:
4. Цинковая соль розувастатина (2:1) по любому из пп.1-3, содержащая от 1 до 10 моль воды.
5. Смесь кристаллической цинковой соли розувастатина (2:1) по любому из пп.1-3 с аморфной цинковой солью розувастатина (2:1).
6. Лекарственные средства, содержащие кристаллическую форму V цинковой соли розувастатина (2:1) по любому из пп.1-3 в терапевтически эффективном количестве.
7. Способ получения лекарственных средств по п.6, включающий переведение кристаллической формы V цинковой соли розувастатина по любому из пп.1-3 в фармацевтическую лекарственную форму.
8. Кристаллическая форма V цинковой соли розувастатина (2:1) по любому из пп.1-3 для применения в терапии.
9. Применение кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3 для лечения метаболизма липидов.
10. Применение кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3 для лечения расстройств метаболизма липидов.
11. Способ лечения расстройств метаболизма липидов, включающий введение пациенту, нуждающемуся в таком лечении, лекарственного средства, содержащего терапевтически эффективное количество кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3.
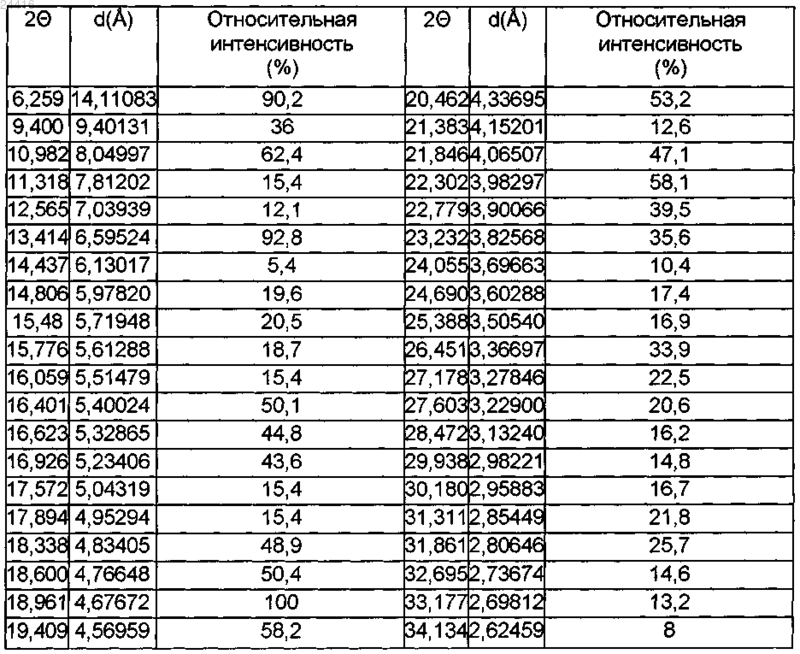
12. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I), отличающаяся рентгеновской дифракционной линией, измеренной с использованием излучения CuKα, со следующим углом дифракции 2θ (±0,2° 2θ): 18,961°.
13. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuKα, со следующими углами дифракции 2θ (±0,2° 2θ): 6,259, 13,414 и 18,961°.
14. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuKα, со следующими углами дифракции 2θ (±0,2° 2θ): 6,259; 10,982; 13,414; 16,401; 18,600; 18,961; 19,409; 20,462 и 22,302°.
15. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuKα, со следующими углами дифракции 2θ (±0,2° 2θ): 6,259; 9,400; 10,982; 13,414; 15,480; 16,401; 16,623; 16,926; 18,338; 18,600; 18,961; 19,409; 20,462; 21,846; 22,302; 22,779; 23,232; 26,451; 27,178; 27,603; 31,311 и 31,861°.
16. Кристаллическая форма III цинковой соли розувастатина (2:1) по п.12, отличающаяся тем, что она имеет порошковую рентгеновскую дифрактограмму, представленную на фиг. 2, измеренную с использованием излучения CuKα.
17. Кристаллическая форма III цинковой соли розувастатина (2:1) по п.12, имеющая характеристические показатели отражения в порошковой рентгеновской дифрактограмме, измеренные с использованием излучения CuKα, в соответствии со следующей таблицей:
18. Способ получения кристаллической формы III цинковой соли розувастатина (2:1), включающий перемешивание аморфной цинковой соли розувастатина (2:1) при температуре от -10 до 40°С в 5-100-кратном избытке массы воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, в течение периода от 1 до 48 ч, фильтрование суспензии.
19. Способ получения кристаллической формы V цинковой соли розувастатина (2:1), включающий преобразование аморфной цинковой соли розувастатина (2:1) в кристаллическую форму III цинковой соли розувастатина (2:1) путем перемешивания аморфной цинковой соли розувастатина (2:1) при температуре от -10 до 40°С в 5-100-кратном избытке массы воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, в течение периода от 1 до 48 ч, фильтрование суспензии; перемешивание полученного таким путем продукта в 2-100-кратном избытке воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40°С в течение периода от 1 до 168 ч, выделение продукта.
20. Способ получения кристаллической формы V цинковой соли розувастатина (2:1) формулы (I), включающий перемешивание кристаллической формы III цинковой соли розувастатина (2:1) в 2-100-кратном избытке воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40°С в течение периода от 1 до 168 ч, выделение продукта.
21. Способ по п.19 или 20, отличающийся тем, что перемешивание и выделение выполняют в атмосфере инертного газа.
22. Способ по п. 19 или 20, отличающийся тем, что дополнительно выполняют высушивание выделенного продукта при температуре от 0 до 30°С.
Текст
КРИСТАЛЛИЧЕСКИЕ ФОРМЫ ЦИНКОВОЙ СОЛИ РОЗУВАСТАТИНА Харин А.В., Котов И.О. (RU) Настоящее изобретение относится к кристаллическим формам III и V цинковой соли розувастатина (2:1). Полиморфы подходят для применения в качестве фармацевтически активных ингредиентов при лечении заболеваний, обусловленных метаболизмом липидов,включающих гиперхолестеринемию, гиперлипидемию, дислипидемию или атеросклероз. Кроме того, изобретение относится к способам получения указанных кристаллических форм, смеси кристаллической формы V и аморфной формы цинковой соли розувастатина (2:1),лекарственному средству, содержащему кристаллическую форму V, способу его получения,применению кристаллической формы V, способу лечения.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ (HU) Настоящее изобретение относится к кристаллическим формам цинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты формулы (I). известно под международным непатентованным названием розувастатин и применяется в медицине в качестве фармацевтически активного ингредиента при лечении расстройств метаболизма липидов. Активность розувастатина осуществляется посредством ингибирования 2-гидрокси-2-метилглутарилкоэнзим А редуктазы, присутствующей в печени, результатом чего является снижение скорости биосинтеза холестерина в печени и концентрации холестерина в крови. Розувастатин, в основном, в форме его солей, можно применять для лечения гиперхолестеринемии, гиперлипопротеинемии и атеросклероза. Объект настоящего изобретения составляет кристаллическая форма V цинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты (2:1) формулы (I), способ ее получения и ее применение при получении лекарственных средств. Другой объект настоящего изобретения составляет кристаллическая форма III цинковой соли(+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты (2:1) формулы (I), которую можно успешно применять в качестве исходного вещества в процессе получения кристаллической формы V розувастатина. Предшествующий уровень техники(+)-7-[4-(4-Фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)дигидрокси-гепт-6-еновая кислота формулы (II) (розувастатин) известна из уровня техники. Розувастатин впервые раскрыт в европейском патенте 521471 в виде свободной кислоты и некоторых ее фармацевтически приемлемых солей, таких как кальциевая соль формулы (III) и аммониевая соль. В публикации международной заявки на патент WO 01/060804 раскрыты кристаллические литиевые, магниевые соли розувастатина и кристаллические соли данного соединения с определенными аминами. В публикациях международных заявок на патент WO 2005023779, WO 2006079611 иWO 2008036286 раскрыто несколько различных кристаллических форм гидратов розувастатина кальция формулы (III). Международные заявки на патент WO 2005051921 и WO 2008038132 относятся к дополнительным солям розувастатина с аминами или диаминами. В международной заявке на патент WO 2005077917 раскрыта аморфная магниевая соль розувастатина. В публикации международной заявки на патент WO 2007086082 раскрыта аморфная и кристаллическая калиевая соль и способ ее получения. Цинковая соль розувастатина (2:1) формулы (I) впервые раскрыта в заявке на патент Венгрии Р 0600293 и в соответствующей международной заявке на патент WO 2007119085. Заявка на патент Венгрии Р 0600293 и соответствующая публикация международной заявки на патент WO 2007119085 относятся к дополнительным способам получения цинковой соли розувастатина формулы (I), где в качестве ис-1 024416 ходных веществ используют розувастатин формулы (II), его натриевую соль, его алкиловый эфир, лактон розувастатина или сложный эфир кеталя розувастатина. В международной заявке на патент WO 2008015563 раскрыт способ получения цинковой соли розувастатина формулы (I), который включает преобразование трет-бутиламиновой соли розувастатина в натриевую соль розувастатина и получение цинковой соли путем взаимодействия указанной натриевой соли розувастатина с ионами цинка и отфильтровывание продукта из водного растворителя. Заявка на патент Венгрии Р 0900019 относится к дополнительному способу получения цинковой соли розувастатина формулы (I), где цинковую соль розувастатина формулы (I) получают непосредственно, начиная с трет-бутиламиновой соли розувастатина и выделяя указанный продукт из органического растворителя. Цинковая соль розувастатина формулы (I), полученная способами, описанными в заявках на патенты Венгрии Р 0600293, Р 070667 и Р 0900019, или способом, раскрытым в международной заявке на патентWO 2008015563, имеет аморфную морфологию. Международная заявка на патент PCT/HU 2009/00064 относится к кристаллической форме I розувастатина цинка (2:1). Качество фармацевтически активных ингредиентов, применяемых в лекарственных препаратах, определяется строгими критериями, установленными органами здравоохранения. Некоторые из этих критериев относятся к химической чистоте и стабильности активного ингредиента. Дополнительные критерии применимы к качеству и стабильности лекарственного препарата. Эти критерии установлены и опубликованы в фармакопеях. Основным условием для выдачи регистрационного свидетельства является соблюдение требований качества, касающихся как фармацевтически активных ингредиентов, так и лекарственных препаратов. При применении розувастатина при изготовлении лекарственных средств существует необходимость в получении фармацевтически активного ингредиента высокой чистоты, химически стабильного и находящегося в форме, которой можно легко манипулировать при изготовлении готовой лекарственной формы. Недавно в фармацевтической промышленности возникла определенная потребность в предоставлении воспроизводимых способов получения фармацевтически активных ингредиентов в химически и морфологически чистой форме. Получение фармацевически активного ингредиента в гомогенном твердом состоянии составляет непременное условие соблюдения требований промышленного производства готовых лекарственных форм. Хорошо известен факт, что твердые формы одного и того же активного ингредиента, имеющие различную морфологию, могут проявлять значительные различия в скорости растворения, биодоступности и химической стабильности. С точки зрения промышленной химической и фармацевтической технологии важно, чтобы различные твердые формы активного ингредиента могли обладать значительно различающимися свойствами в отношении технологических операций, например скорости фильтрования или высушивания, растворимости, поведения во время таблетирования. Упомянутые выше свойства непосредственно влияют на эффективность, экономичность, воспроизводимость и сложность процесса промышленного производства, и в то же время результатом является морфологически однородный продукт. В целом принято считать, что кристаллические формы фармацевически активных ингредиентов обладают улучшенной химической стабильностью по сравнению с аморфной формой. Вследствие различных процессов разложения при изготовлении и хранении готовой лекарственной формы данное допущение имеет огромную значимость. Следовательно, изготовители лекарственных препаратов при фармацевтической разработке предпочитают применять кристаллические формы активных ингредиентов. Поскольку активные ингредиенты, принадлежащие к группе статинов, явно склонны к разложениюHydrolytic Products of Atorvastatin, Proceedings of 12th ISMAS Symposium cum Workshop on Mass Spectrometry, March 25-30, 2007, Cidade de Goa, Dona Paula, Goa), существует определенная потребность в разработке форм активных ингредиентов, принадлежащих к данной группе, которые проявляют повышенную химическую стабильность. Например, известно, что аморфная форма аторвастатина, имеющего структуру, подобную структуре розувастатина (то есть оба соединения имеют общую группировку 3,5 дигидроксиалкановой кислоты), или даже морфологически неоднородная смесь аморфной и кристаллической форм, раскрытая в европейском патенте 409281, менее стабильны, чем кристаллические формы того же соединения. Таким образом, разработка кристаллических форм I, II и IV аторвастатина, проявляющих улучшенные свойства во время химических или фармацевтических манипуляций (например,легкость фильтрования) и повышенную стабильность, как раскрыто в публикации международной заявки на патент WO 97/03959, инициировала работу по разработке от лица нескольких фармацевтических фирм, результатом которой явилась разработка более сорока кристаллических форм аторвастатина. Розувастатин особенно склонен к разложению в результате воздействия света, кислорода и тепла. Например, под действием света продукты разложения, описанные Astrarita с соавторами, образуются даже в твердом состоянии (J. Photochem. Photobiol. A. Chem. 2007, 187, 263-268). Полиморфизм фармацевтически активного ингредиента можно использовать несколькими путями. Как обсуждается выше, первостепенную важность имеет применение кристаллической формы, обла-2 024416 дающей надлежащей стабильностью и составом примесей (чистотой), при изготовлении готовой лекарственной формы. Также важно, чтобы кристаллический активный ингредиент обладал надлежащими свойствами для манипуляций широкомасштабного изготовления и фармацевтической технологии в промышленном масштабе. Тем не менее, в процессе разработки различных готовых лекарственных форм можно также использовать различные свойства полиморфов, например скорость растворения, размер частицы и т.д. Полиморф, имеющий более низкую скорость растворения, может вносить вклад в свойства лекарственной формы с замедленным высвобождением, в то же время, специалист в данной области техники может высоко оценивать форму, имеющую более высокую растворимость или более высокую скорость растворения при изготовлении в виде препарата лекарственной формы с немедленным высвобождением. Краткое описание изобретения В связи с вышеупомянутыми фактами существует крайняя необходимость в разработке кристаллических солей розувастатина формулы (II). Задача научно-исследовательской и опытно-конструкторской разработки состояла в разработке цинковой соли розувастатина (2:1) в кристаллической форме, которая является пригодной для изготовления лекарственных средств и которая может быть получена сообразно высокого качества в промышленных условиях. Вышеуказанная задача решена настоящим изобретением. Неожиданно обнаружили, что цинковая соль розувастатина (2:1) может быть синтезирована более чем в одной морфологически однородной кристаллической форме, обладающей надлежащей стабильностью, предпочтительным составом примесей и предпочтительными физико-химическими свойствами,которая может быть воспроизводимо изготовлена в промышленном масштабе при использовании простого способа. Известно, что кристаллические формы розувастатина кальция, впервые раскрытые в 1991 г., стали доступны только спустя более 10 лет после открытия аморфной формы. Несмотря на тот факт, что кристаллические формы розувастатина кальция были получены, указанные кристаллические формы до сих пор не применяют для изготовления лекарственных средств. Это явление отражает тот факт, что даже оригинальный продукт CRESTOR содержит розувастатин кальций в аморфной форме. Неожиданно, что цинковая (2:1) соль розувастатина может быть получена в кристаллической форме, поскольку хорошо известно образование комплексов переходного металла цинка как с органическими лигандами, так и с водой или с другими неорганическими соединениями и ионами. Кроме того, на уровне техники не существует способа, который можно было бы применять как для предсказания вероятностей образования кристалла для химического соединения или соли, известных только в аморфной форме, так и для оценки физико-химических свойств новой кристаллической формы. Согласно первому аспекту настоящего изобретения предложена кристаллическая форма V цинковой соли (2:1) (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил](3R,5S)-дигидрокси-гепт-6-еновой кислоты формулы (I). Согласно второму аспекту настоящего изобретения предложены способы изготовления кристаллической формы V цинковой соли розувастатина (2:1). Согласно третьему аспекту изобретения предложены способы применения кристаллической формыV цинковой соли розувастатина (2:1) формулы (I) для изготовления лекарственных средств. Следующий аспект настоящего изобретения составляет применение кристаллической формы V цинковой соли розувастатина (2:1) для лечения расстройств, обусловленных нарушенным метаболизмом холестерина и липидов. Согласно еще одному другому аспекту настоящего изобретения предложена кристаллическая форма III цинковой соли розувастатина (2:1) формулы (I), которая является предпочтительным исходным веществом для изготовления кристаллической формы V цинковой соли розувастатина (2:1), и предложен способ ее получения. Подробное описание изобретения Цинковая соль розувастатина (2:1) формулы (I), полученная согласно способу, раскрытому в заявках на патенты Венгрии Р 0600293, Р 070667 и Р 0900019, не имеет четкой, хорошо определенной точки плавления, что указывает на аморфное вещество. Плавление начинается при 137 С и происходит на протяжении широкого температурного диапазона. Цинковая соль розувастатина (2:1), полученная способом,описанным в международной заявке на патент WO 2008015563, охарактеризована с помощью анализа методом порошковой рентгеновской дифракции. Результаты анализа, раскрытые в указанной заявке на патент, четко указывают на то, что полученный продукт имеет аморфную морфологию. Точка плавления не раскрыта. Теперь неожиданно обнаружили, что существуют новые кристаллические формы цинковой соли розувастатина (2:1) формулы (I). Согласно первому аспекту настоящего изобретения предложена кристаллическая форма V цинковой соли (2:1) (+)-7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил](3R,5S)-дигидрокси-гепт-6-еновой кислоты формулы (I). Кристаллическая форма V цинковой соли розу-3 024416 вастатина (2:1) является новой. Порошковая рентгеновская дифрактограмма, полученная для кристаллической формы V цинковой соли розувастатина (2:1) (определенная с использованием излучения CuK), представлена на фиг. 1. Характеристические углы и соответствующие относительные интенсивности рентгеновской дифрактограммы для кристаллической формы V соли розувастатина цинка (2:1) приведены ниже в табл. 1. Таблица 1. Данные по порошковой рентгеновской дифракции кристаллической формы V цинковой соли розувастатина (2:1) Условия измерения при анализе методом порошковой рентгеновской дифракции были следующими: Прибор: Порошковый рентгеновский дифрактометр BRUKER D8 ADVANCE Излучение: CuK1, ( = 1,54060 ), CuK2 ( = 1,54439 ) Напряжение: 40 кВ Анодный ток: 40 мА Вспомогательное оборудование: зеркало Гбеля, щелевой коллиматор Соллера (2,5), прибор для отбора образцов, положение пропускания Детектор: LynxEye Измерение: непрерывное сканирование /: 4-35 2 Скорость снятия: 1,27 мин Шаг: 0,02 Образец: без предварительной обработки заключен между майларовыми пластинами, комнатная температура Вращение образца: 1 об/мин Стандартный образец: Quarzprobe RA450 (Bruker AXS) Воспроизводимость: 0,2 2 Из уровня техники хорошо известно, что предварительная обработка образца (например, распыление) может очень значительно воздействовать на относительные интенсивности порошковой рентгеновской дифрактограммы. Поэтому предварительную обработку образца не применяли. Специалист в данной области техники способен идентифицировать морфологию твердого состояния известного вещества с помощью порошковых рентгеновских дифрактограмм. Эта идентификация может быть выполнена просто путем определения положения (угла дифракции) нескольких интенсивных сигналов рентгеновской дифракции. Такая идентификация очень важна для тестирования морфологии активного ингредиента в твердых лекарственных формах, поскольку в процессе изготовления твердой готовой лекарственной формы могут происходить изменения морфологии вследствие перехода кристаллического активного ингредиента либо в другую кристаллическую модификацию, либо в аморфную форму. Угол дифракции, соответствующий самому интенсивному сигналу дифракции кристаллической формы V цинковой соли розувастатина (2:1), равен 4,764 2. Данный сигнал рентгеновской дифракции можно удобнее всего использовать для идентификации кристаллической формы I цинковой соли розувастатина (2:1). На дифрактограмме кристаллической формы V цинковой соли розувастатина (2:1) углы дифракции дифракционных линий, где относительная интенсивность превышает 50%, равны 4,764 и 15,371 2. Углы дифракции, принадлежащие сигналам дифракции кристаллической формы V цинковой соли розувастатина (2:1), имеющим относительную интенсивность по меньшей мере 20%, имеют следующие значения: 4,764, 5,873, 10,960, 12,224, 13,118, 15,371, 17,995, 19,394, 24,235 2. Кристаллическая форма V цинковой соли розувастатина (2:1) по настоящему изобретению может содержать от 1 до 10, предпочтительно от 1 до 6 молярных эквивалентов воды, либо в форме воды гидратов, воды канальных гидратов или физически адсорбированной воды. Согласно второму аспекту настоящего изобретения предложен способ получения кристаллической формы V цинковой соли розувастатина (2:1) формулы (I). На протяжении всего настоящего описания выражение "спирт, содержащий от 1 до 6 атомов углерода", означает прямоцепочечные или разветвленные насыщенные алифатические спирты, имеющие от 1 до 6 атомов углерода, например метанол, этанол, 2-пропанол, 1-пропанол, 1-бутанол, 2-бутанол и т.п. Способ получения кристаллической формы V цинковой соли розувастатина (2:1) формулы (I) включает перемешивание цинковой соли розувастатина (2:1) кристаллической формы III в 2-100 кратном, предпочтительно 2-50-кратном, наиболее предпочтительно 2,5-25-кратном избытке воды, или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40 С, предпочтительно от 10 до 30 С, в течение периода от 1 до 168 ч, предпочтительно от 4 до 120 ч, в атмосфере инертного газа. Продукт выделяют и при желании высушивают при температуре от 0 до 30 С в инертной атмосфере. Подходящие инертные газы включают, но не ограничиваются азотом и аргоном. Исходным веществом по вышеупомянутому способу получения вышеописанной формы V цинковой соли розувастатина (2:1) является кристаллическая форма III цинковой соли розувастатина (2:1). Указанная кристаллическая форма характеризуется данными рентгеновской дифракции табл. 2, и рентгеновская дифрактограмма указанной формы представлена на фиг. 2. Измерения рентгеновской дифракции выполняли в условиях, идентичных описанным выше условиям для кристаллической формы V. Кристаллическая форма III цинковой соли розувастатина (2:1) может быть получена, начиная с аморфной цинковой соли розувастатина. Таблица 2. Положение дифракционных линий (0,2) и их относительная интенсивность (выше 5%) в кристаллической форме III цинковой соли розувастатина (2:1) Кристаллическая форма III цинковой соли розувастатина (2:1) может быть идентифицирована с помощью ее главного (основного) показателя отражения при 18,961 2 или с помощью ее характеристических показателей отражения, превышающих 70% относительной интенсивности при 6,259, 13,414 и 18,961 2. Характеристические показатели отражения кристаллической формы III цинковой соли розувастатина (2:1), показывающего относительную интенсивность более 50%, обнаружены при 6,259,10,982, 13,414, 16,401, 18,600, 18,961, 19,409, 20,462 и 22,302 2. Кристаллическая форма III цинковой соли розувастатина (2:1) демонстрирует дополнительные показатели отражения, имеющего относительную интенсивность выше 20%, при 6,259, 9,400, 10,982, 13,414, 15,480, 16,401, 16,623, 16,926, 18,338,18,600, 18,961, 19,409, 20,462, 21,846, 22,302, 22,779, 23,232, 26,451, 27,178, 27,603, 31,311 и 31,861 2. Следующими объектами настоящего изобретения являются способы получения кристаллической формы III цинковой соли розувастатина (2:1). Первый способ получения кристаллической формы III цинковой соли розувастатина (2:1) включает перемешивание аморфной цинковой соли розувастатина (2:1) при температуре от -10 до 40 С, предпочтительно от 0 до 10 С, в 5-100-кратном, предпочтительно 20-60-кратном избытке массы воды, или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, возможно, содержащей 0,0001-0,01, предпочтительно 0,005-0,01 молярных эквивалентов гидроксида натрия, рассчитанное на молярное количество цинковой соли розувастатина формулы (I), в течение периода от 1 до 48 ч, предпочтительно от 2 до 8 ч,наиболее предпочтительно в течение 4 ч, фильтрование суспензии и возможно промывание и высушивание продукта. Второй способ получения кристаллической формы III цинковой соли розувастатина (2:1) состоит в перемешивании аморфной цинковой соли розувастатина (2:1) в 5-100-кратном, предпочтительно 20-60 кратном избытке массы воды, или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40 С, предпочтительно от 0 до 10 С, в течение периода от 1 до 48 ч, предпочтительно от 2 до 8 часов, наиболее предпочтительно в течение 4 часов, фильтровании продукта, повторении перемешивания в 5-100-кратном, предпочтительно 20-60-кратном избытке массы воды, или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40 С, предпочтительно от 0 до 10 С, в течение периода от 1 до 48 ч, предпочтительно от 2 до 8 ч, наиболее предпочтительно в течение 4 ч, фильтровании суспензии и возможно промывании и высушивании кристаллической формыIII цинковой соли розувастатина (2:1). Согласно другому аспекту настоящего изобретения предложены лекарственные средства, содержащие кристаллическую форму V цинковой соли розувастатина (2:1) формулы (I). Такие лекарственные средства могут также содержать один или более чем один известный носитель или вспомогательный агент. Лекарственное средство согласно настоящему аспекту изобретения в большинстве случаев содержит от 0,1 до 95 мас.% кристаллической формы V фармацевически активного ингредиента формулы (I). Доля активного ингредиента предпочтительно составляет от 5 до 75 мас.%. Лекарственные средства согласно настоящему изобретению можно вводить перорально (например,порошки, таблетки, таблетки с покрытием или пленочным покрытием, капсулы, микрокапсулы, гранулы,пеллеты, драже, растворы, суспензии или эмульсии), парентерально (например, в форме внутривенных,внутримышечных, подкожных или интраперитонеальных инъекций или в виде инфузии), ректально (на-6 024416 пример, в форме суппозиториев) или местно (например, в виде кремов, мазей или пластырей). Твердые,полутвердые или жидкие лекарственные средства согласно настоящему изобретению могут быть получены согласно способам, известным из предшествующего уровня техники. Лекарственные средства, подходящие для перорального введения, содержащие кристаллическую форму V цинковой соли розувастатина (2:1) формулы (I), могут находиться в твердой форме, которая может содержать кроме активного ингредиента один или более чем один носитель или наполнитель (например, лактозу, глюкозу, крахмал, фосфат кальция, микрокристаллическую целлюлозу), связующее вещество (например, желатин, сорбит, поливинилпирролидон), разрыхлитель (например, кроскармеллозу,натриевую соль карбоксиметилцеллюлозы, кросповидон), вспомогательные агенты для таблетирования(например, стеарат магния, тальк, полиэтиленгликоль, кремнезем или диоксид кремния) или поверхностно-активные вещества (например, лаурилсульфат натрия). Жидкие лекарственные средства, предназначенные для перорального применения, содержащие кристаллическую форму V цинковой соли розувастатина (2:1) по настоящему изобретению, могут находиться в виде растворов, суспензий или эмульсий и могут содержать суспендирующие агенты (например,желатин, карбоксиметилцеллюлозу), эмульгирующие агенты (например, сорбитан моноолеат), растворители или жидкие носители (например, воду, масла, глицерин, пропиленгликоль, этанол), агенты, регулирующие рН (например, ацетатные, фосфатные, цитратные буферы) или стабилизирующие агенты (например, метил-4-гидроксибензоат), смешанные с активным ингредиентом. Лекарственные средства, содержащие кристаллическую форму V соединения формулы (I), предназначенные для парентерального применения, обычно представляют собой стерильные изотонические водные растворы или суспензии, которые могут содержать агент, регулирующий рН, и консерванты в качестве вспомогательных агентов. Лекарственные средства, находящиеся в виде полутвердых препаратов, содержащие кристаллическую форму V соединения формулы (I), такие как суппозитории, содержат активный ингредиент, гомогенно диспергированный в полутвердой основе (например, в полиэтиленгликоле, масле какао). Лекарственные средства, содержащие кристаллическую форму V цинковой соли розувастатина(2:1) по настоящему изобретению, могут быть получены в виде препаратов с модифицированным высвобождением, контролируемым высвобождением или пролонгированным высвобождением. Таким образом, можно достигать длительного эффекта, или можно увеличивать интервалы между введением лекарственного средства. Лекарственные средства с модифицированным высвобождением, контролируемым высвобождением или пролонгированным высвобождением могут быть получены согласно способам,известными из предшествующего уровня техники. Согласно другому аспекту настоящего изобретения предложен способ изготовления лекарственных средств, содержащих кристаллическую форму V цинковой соли розувастатина (2:1) формулы (I), который возможно включает смешивание кристаллической формы V цинковой соли розувастатина (2:1) с фармацевтически приемлемым носителем и вспомогательным агентом и превращение полученного таким путем продукта в фармацевтическую лекарственную форму, используя способы, известные в данной области техники. Подходящие фармацевтически приемлемые носители и вспомогательные агенты, а также способы получения препаратов описаны на предшествующем уровне техники (Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Easton, USA, 1990). Лекарственные средства, содержащие кристаллическую форму V соединения формулы (I), предпочтительно содержат активный ингредиент в стандартных лекарственных формах. Согласно другому аспекту настоящего изобретения предложено применение кристаллической формы V цинковой соли розувастатина (2:1) формулы (I) для лечения заболеваний или расстройств, обусловленных метаболизмом липидов, включающих гиперхолестеринемию, гиперлипопротеинемию, дислипидемию и атеросклероз. Согласно другому аспекту настоящего изобретения предложен способ лечения заболеваний или расстройств, обусловленных метаболизмом липидов, включающих гиперхолестеринемию, гиперлипопротеинемию, дислипидемию и атеросклероз, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества кристаллической формы V цинковой соли розувастатина (2:1) формулы (I). Подобно форме V цинковой соли розувастатина (2:1), соль формы III можно применять в качестве активного ингредиента фармацевтических препаратов. Другие аспекты настоящего изобретения продемонстрированы приведенными ниже примерами без какого-либо ограничения изобретения указанными примерами. Пример 1. Аморфная цинковая соль (2:1) 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 50,0 г (0,09 моль) трет-бутиламиновой соли 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты растворяют в смеси 500 см 3 этилацетата и 153 см 3 дистиллированной воды при перемешивании при 25 С. В полученную таким путем двухслойную смесь добавляют по каплям 55 см 3 2,23 М раствора сульфата цинка (соответствующего 0,122 моль ZnSO4H2O) в течение 15 мин при температуре 25 С. После 1-часового интенсивного перемешивания слои разделяют, органический слой дважды промывают 100 см 3 2,23 М раствора сульфата цинка каждый раз и, наконец, 100 см 3 воды (во время конечной стадии промывания водой добавляют 12 см 3 этанола, что способствует разделению слоев). Высушивание органического слоя выполняют путем азеотропной перегонки в вакууме при температуре 50 С и при давлении 50-70 мбар (приблизительно 5,0-7,0 кПа) согласно следующему способу. На первой стадии отгоняют почти все количество растворителя. Полученный таким путем остаток имеет массу 102,0 г и выглядит как масло, содержащее следовые количества твердых веществ. Данный остаток растворяют в 500 см 3 этилацетата при температуре приблизительно 30 С и растворитель повторно отгоняют до получения густой суспензии, содержащей твердую кристаллическую фазу. Остаток,имеющий массу 154 г, растворяют в 300 см 3 этилацетата и смесь перемешивают до гомогенности, и растворитель выпаривают до образования густой суспензии. Эту суспензию, имеющую массу 182 г, смешивают с 200 см 3 этилацетата и тщательно перемешивают. Смесь фильтруют, фильтрат тщательно отделяют путем отсасывания и суспендируют на фильтре три раза 90 см 3 этилацетата каждый раз. Продукт осторожно укладывают слоями в вакуумный сушильный шкаф, защищенный от света, и высушивают в течение 24 ч при 25 С при давлении 5 мбар (приблизительно 0,5 кПа). Продукт измельчают в порошок и повторно высушивают в течение 6 ч при температуре 50 С и при давлении 5 мбар(приблизительно 0,5 кПа). Таким образом, получают 41,74 г (90%) продукта. ИК (KBr): 3425 (широкий), 2969, 1605, 1547, 1510, 1381, 1230, 1197, 1156, 965, 901, 844, 811, 776,576, 567, 520 см-1. Точка плавления: начинает плавиться при 137 С. Вода: 0,85%. Пример 2. Аморфная цинковая соль (2:1) 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 12,4 г трет-бутиламиновой соли розувастатина суспендируют в смеси 40 см 3 2-пропанола и 5 см 3 воды. К этой суспензии добавляют раствор 4,4 г ZnSO4 и 15 мл воды, затем образуется почти прозрачный раствор. Этот раствор добавляют к 320 см 3 воды при 4-6 С в течение 5 мин. После 0,5-часового периода перемешивания при 4-6 С раствор фильтруют, затем осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 3. Аморфная цинковая соль (2:1) 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 10,0 г аморфной или кристаллической формы I цинковой соли розувастатина (2:1) растворяют в смеси 35 см 3 2-пропанола и 15 см 3 воды. Этот раствор добавляют к 320 см 3 воды при 4-6 С в течение 5 мин. После 0,5-часового периода перемешивания при 4-6 С раствор фильтруют, затем осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 4. Аморфная цинковая соль (2:1) 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 10,0 г трет-бутиламиновой соли розувастатина растворяют в 600 см 3 воды. Раствор охлаждают до 05 С, затем к охлажденному раствору добавляют раствор 3,6 г ZnSO4 и 15 мл воды. Суспензию перемешивают в течение 0,5 часов при 4-6 С, затем ее фильтруют, осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 5. Аморфная цинковая соль (2:1) 7-[4-(4-фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 10,0 г трет-бутиламиновой соли розувастатина растворяют в смеси 36 см 3 2-пропанола и 340 см 3 воды. Раствор охлаждают до 0-5 С, затем к охлажденному раствору добавляют раствор 3,6 г ZnSO4 и 15 мл воды. Суспензию перемешивают в течение 0,5 ч при 4-6 С, затем ее фильтруют, осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 6. Кристаллическая форма III цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метан-сульфонил-метиламино)-пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 1,0 г (0,97 ммоль) аморфной цинковой соли розувастатина (2:1), полученной согласно примеру 1,добавляют к раствору 0,2 мг (0,005 ммоль) гидроксида натрия в 40 см 3 дистиллированной воды. Смесь перемешивают в течение 4 ч при температуре 40 С в атмосфере аргона, фильтруют и промывают раствором, имеющим такую же композицию, как суспендирующий агент. Влажный осадок на фильтре, полученный таким путем, повторно перемешивают в течение 4 ч в таких же условиях, как и в первый период. Суспензию фильтруют, промывают раствором, имеющим такую же композицию, как суспендирующий раствор, и высушивают в вакуумном сушильном шкафу при температуре от 25 до 27 С при давлении 5 мбар (0,5 кПа) в течение 24 ч. Таким образом, получают 0,75 г (75%) продукта, имеющего порошковую рентгеновскую дифрактограмму, показанную на фиг. 2. Точка плавления: 110-120 С. Чистота (по ВЭЖХ (Высокоэффективная жидкостная хроматография: 99,71%. Содержание цинка: 6,25% (98,4% теоретического). Пример 7. Кристаллическая форма III цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 10,0 г аморфной цинковой соли розувастатина (2:1), полученной согласно примеру 1, суспендируют в 600 см 3 воды в течение 24 ч при 4-6 С. Затем ее фильтруют и осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 8. Кристаллическая форма III цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метан-сульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 10,0 г аморфной цинковой соли розувастатина (2:1), полученной согласно примеру 1, суспендируют в смеси 36 см 3 2-пропанола и 350 см 3 воды в течение 24 ч при 4-6 С. Затем ее фильтруют и осадок на фильтре высушивают при 25 С в вакууме в инертной атмосфере. Пример 9. Кристаллическая форма V цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 2,0 г цинковой соли розувастатина (2:1), полиморфа формы III, растворяют в воде при 25 С и смесь перемешивают в течение 24 ч в атмосфере аргона. Затем смесь охлаждают до 3 С и перемешивание продолжают дополнительно в течение 96 ч. Твердый продукт фильтруют и высушивают при 25 С в атмосфере аргона. Пример 10. Кристаллическая форма V цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 2,0 г цинковой соли розувастатина (2:1), полиморфа формы III, суспендируют в 7 см 3 2-пропанола и 70 см 3 воды при 25 С и смесь перемешивают в течение 24 ч в атмосфере аргона. Твердый продукт фильтруют и высушивают при 25 С в вакууме в инертной атмосфере. Пример 11. Кристаллическая форма V цинковой соли (2:1) 7-[4-(4-фторфенил)-6-изопропил-2(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6-еновой кислоты 2,0 г цинковой соли розувастатина (2:1), полиморфа формы III, суспендируют в 20 см 3 воды при 25 С и смесь перемешивают в течение 24 ч в атмосфере аргона. Затем смесь охлаждают до 3 С и перемешивание продолжают дополнительно в течение 96 ч. Твердый продукт фильтруют и высушивают при 25 С в вакууме в инертной атмосфере. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма V цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R5S)-дигидрокси-гепт-6 еновой кислоты] формулы (I) отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuK, со следующим углом дифракции 2 (0,2 2): 4,746. 2. Кристаллическая форма V цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты] формулы (I) по п.1, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuK, со следующими углами дифракции 2 (0,2 2): 4,746 и 15,371. 3. Кристаллическая форма V цинковой соли розувастатина (2:1) по п.1 или 2, имеющая порошковую рентгеновскую дифрактограмму, представленную на фиг. 1, и следующие линии рентгеновской дифракции, измеренные с помощью излучения CuK: 4. Цинковая соль розувастатина (2:1) по любому из пп.1-3, содержащая от 1 до 10 моль воды. 5. Смесь кристаллической цинковой соли розувастатина (2:1) по любому из пп.1-3 с аморфной цинковой солью розувастатина (2:1). 6. Лекарственные средства, содержащие кристаллическую форму V цинковой соли розувастатина(2:1) по любому из пп.1-3 в терапевтически эффективном количестве. 7. Способ получения лекарственных средств по п.6, включающий переведение кристаллической формы V цинковой соли розувастатина по любому из пп.1-3 в фармацевтическую лекарственную форму. 8. Кристаллическая форма V цинковой соли розувастатина (2:1) по любому из пп.1-3 для применения в терапии. 9. Применение кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3 для лечения метаболизма липидов. 10. Применение кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3 для лечения расстройств метаболизма липидов. 11. Способ лечения расстройств метаболизма липидов, включающий введение пациенту, нуждающемуся в таком лечении, лекарственного средства, содержащего терапевтически эффективное количество кристаллической формы V цинковой соли розувастатина (2:1) по любому из пп.1-3. 12. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты] формулы (I), отличающаяся рентгеновской дифракционной линией, измеренной с использованием излучения CuK, со следующим углом дифракции 2 (0,2 2): 18,961. 13. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6- 10024416 еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuK, со следующими углами дифракции 2 (0,2 2): 6,259,13,414 и 18,961. 14. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuK, со следующими углами дифракции 2 (0,2 2): 6,259; 10,982; 13,414; 16,401; 18,600; 18,961; 19,409; 20,462 и 22,302. 15. Кристаллическая форма III цинковой соли розувастатина (2:1) [полуцинковой соли (+)-7-[4-(4 фторфенил)-6-изопропил-2-(метансульфонилметиламино)пиримидин-5-ил]-(3R,5S)-дигидрокси-гепт-6 еновой кислоты] формулы (I) по п.12, отличающаяся рентгеновскими дифракционными линиями, измеренными с использованием излучения CuK, со следующими углами дифракции 2 (0,2 2): 6,259; 9,400; 10,982; 13,414; 15,480; 16,401; 16,623; 16,926; 18,338; 18,600; 18,961; 19,409; 20,462; 21,846; 22,302; 22,779; 23,232; 26,451; 27,178; 27,603; 31,311 и 31,861. 16. Кристаллическая форма III цинковой соли розувастатина (2:1) по п.12, отличающаяся тем, что она имеет порошковую рентгеновскую дифрактограмму, представленную на фиг. 2, измеренную с использованием излучения CuK. 17. Кристаллическая форма III цинковой соли розувастатина (2:1) по п.12, имеющая характеристические показатели отражения в порошковой рентгеновской дифрактограмме, измеренные с использованием излучения CuK, в соответствии со следующей таблицей: 18. Способ получения кристаллической формы III цинковой соли розувастатина (2:1), включающий перемешивание аморфной цинковой соли розувастатина (2:1) при температуре от -10 до 40 С в 5-100 кратном избытке массы воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, в течение периода от 1 до 48 ч, фильтрование суспензии. 19. Способ получения кристаллической формы V цинковой соли розувастатина (2:1), включающий преобразование аморфной цинковой соли розувастатина (2:1) в кристаллическую форму III цинковой соли розувастатина (2:1) путем перемешивания аморфной цинковой соли розувастатина (2:1) при температуре от -10 до 40 С в 5-100-кратном избытке массы воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, в течение периода от 1 до 48 ч, фильтрование суспензии; перемешивание полученного таким путем продукта в 2-100-кратном избытке воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40 С в течение периода от 1 до 168 ч, выделение продукта. 20. Способ получения кристаллической формы V цинковой соли розувастатина (2:1) формулы (I),включающий перемешивание кристаллической формы III цинковой соли розувастатина (2:1) в 2-100 кратном избытке воды или в смеси воды и спирта, содержащего от 1 до 6 атомов углерода, при температуре от -10 до 40 С в течение периода от 1 до 168 ч, выделение продукта. 21. Способ по п.19 или 20, отличающийся тем, что перемешивание и выделение выполняют в атмосфере инертного газа. 22. Способ по п.19 или 20, отличающийся тем, что дополнительно выполняют высушивание выделенного продукта при температуре от 0 до 30 С. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61P 3/06, A61K 31/505, C07D 239/42
Метки: цинковой, кристаллические, розувастатина, соли, формы
Код ссылки
<a href="https://eas.patents.su/12-24416-kristallicheskie-formy-cinkovojj-soli-rozuvastatina.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллические формы цинковой соли розувастатина</a>
Предыдущий патент: Извлечение воды из воздуха
Следующий патент: Способ получения метаксалона
Случайный патент: Способ разделения тетрахлоридов циркония и гафния с помощью расплавленного растворителя