Новые соединения тиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 9240
Опубликовано: 28.12.2007
Авторы: Лестаж Пьер, Ренар Пьер, Грэндорж Эмманюэль, Данобер Лоранс, Пиротт Бернар, Бовери Стефан, Франкотт Пьер, Де Тюллио Паскаль, Кенар Даньель-Анри
Формула / Реферат
1. Соединения тиадиазина формулы

в которой A вместе с двумя атомами углерода, к которым он присоединен, образует тиенильную группу, выбранную из групп A1, A2, A3
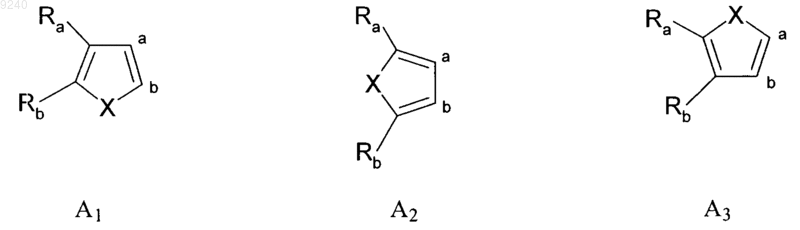
где X представляет собой атом серы,
Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой атом водорода, линейную или разветвленную C1-C6алкильную группу или атом галогена,
![]() представляет собой простую или двойную связь,
представляет собой простую или двойную связь,
R1 представляет собой атом водорода, линейную или разветвленную C1-C6алкильную группу, необязательно замещенную одним атомом фтора, или C1-C6алкоксиC1-C6алкильную группу, где каждая алкильная часть может быть линейной или разветвленной,
R2 представляет собой атом водорода,
R3 представляет собой атом водорода или группу CONHR', где R' представляет собой линейную или разветвленную C1-C6алкильную группу,
а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения тиадиазина формулы (I) по п.1, в которых A представляет собой тиенильную группу, выбранную из групп A1 и A2, где X представляет собой атом серы, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения тиадиазина формулы (I) по п.2, в которых Ra и Rb, каждый независимо друг от друга, представляет собой атом водорода или атом хлора, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения тиадиазина формулы (I) по п.1, в которых R1 представляет собой атом водорода или линейную или разветвленную C1-C6алкильную группу, предпочтительно метильную, этильную или изопропильную, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, выбранные из
6-хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида,
6-хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида и
5,7-дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксида.
6. Фармацевтические композиции для применения для приготовления лекарственных средств для лечения заболеваний, при которых существует потребность в AMPA-модуляторах, которые содержат в качестве активного компонента соединение по любому из пп.1-5 в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми носителями.
7. Фармацевтические композиции по п.6 для применения в качестве лекарственных средств, улучшающих память и распознавание.
8. Фармацевтические композиции по п.6 для применения в качестве лекарственных средств для лечения шизофрении.
Текст
009240 Настоящее изобретение относится к новым соединениям тиадиазина, к способу их получения и к фармацевтическим композициям, которые их содержат. В настоящее время установлено, что инициирующие аминокислоты, особенно глутамат, играют очень важную роль в физиологических процессах приспосабливаемости нейронов к воздействиям внешней среды и в механизмах, лежащих в основе обучения и памяти. Патофизиологические исследования свидетельствуют о том, что нарушение в глутаматэргической нейротрансмиссии тесно связано с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews, 1992, 16, 13-24; Progress inNeurobiology, 1992, 39, 517-545). Кроме того, в некоторых исследованиях в последние годы было показано наличие подтипов рецепторов инициирующих аминокислот и их функциональное взаимодействие (MolecularNeuropharmacology, 1992, 2, 15-31). Среди этих рецепторов рецептор AMPA (-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота) в наибольшей степени вовлечен в процессы физиологической возбудимости нейронов и в особенности в те процессы, которые связаны с запоминанием. Например, было показано, что обучаемость связана с увеличением связывания AMPA с его рецептором в гиппокампе, одном из участков головного мозга, который отвечает за процессы памяти и распознавания. Также в последнее время описаны ноотропные средства, такие как анирацетам, в качестве положительных модуляторов рецепторов AMPA нейронов (Journal of Neurochemistry, 1992, 58, 1199-1204). В литературе рассмотрены соединения, имеющие бензамидную структуру, в качестве средств,имеющих такой же механизм действия и улучшающих память (Synapse, 1993, 15, 326-329). Из этих новых фармакологических средств наиболее активным является, в частности, соединение BA 74. Дополнительно, в патентной заявке EP 692484 приведено описание соединения бензотиадиазина,которое способствует току, вызываемому AMPA, и в международной патентной заявке WO 99/42456 приведено описание частных соединений бензотиадиазина в качестве модуляторов рецепторов AMPA. Соединения тиадиазина, раскрытые в настоящем изобретении, кроме того, что являются новыми,неожиданно обнаруживают фармакологическое действие на ток, вызываемый AMPA, которое значительно превышает такое действие соединений, обладающих подобной структурой и известных из уровня техники. Они являются пригодными в качестве модуляторов AMPA для лечения или предотвращения нарушений памяти и распознавания, которые связаны со старением, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, с болезнью Альцгеймера, с болезнью Пика (предстарческая органическая атрофия мозга), с хореей Хантингтона, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с последствиями ишемии и с последствиями эпилепсии. Сущность изобретения Настоящее изобретение относится к соединениям тиадиазина формулы где X представляет собой атом серы;Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу или атом галогена; представляет собой простую или двойную связь;R1 представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу, необязательно замещенную одним атомом фтора, или C1-C6 алкоксиC1-C6 алкильную группу, где каждая алкильная часть может быть линейной или разветвленной;R2 представляет собой атом водорода;R3 представляет собой атом водорода или группу CONHR', где R' представляет собой линейную или разветвленную C1-C6 алкильную группу,а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием.-1 009240 Предпочтительно в соединениях тиадиазина формулы (I) A представляет собой тиенильную группу,выбранную из групп A1 и A2, где X представляет собой атом серы; Ra и Rb, каждый независимо друг от друга, представляет собой атом водорода или атом хлора; R1 представляет собой атом водорода или линейную или разветвленную C1-C6 алкильную группу, предпочтительно метильную, этильную или изопропильную группу. Предпочтительно соединения тиадиазина формулы (I) выбирают из следующих соединений: 6-хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида,6-хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида и 5,7-дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксида. Также изобретение относится к фармацевтическим композициям для применения для приготовления лекарственных средств для лечения заболеваний, при которых существует потребность в AMPA модуляторах, которые содержат в качестве активного компонента соединение тиадиазина формулы (I) в сочетании с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями. Предпочтительно указанные фармацевтические композиции используют для применения в качестве лекарственных средств, улучшающих память и распознавание, и в качестве лекарственных средств для лечения шизофрении. Раскрытие изобретения В перспективе соединения тиадиазина могут представлять собой в которой A вместе с двумя атомами углерода, к которым он присоединен, образует тиенильную, фурильную или пирролильную группу, выбранную из групп A1, A2, A3 где X в каждом случае представляет собой атом серы, кислорода или азота;Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу (необязательно замещенную одним или несколькими атомами фтора), линейную или разветвленную C1-C6 алкоксигруппу,атом галогена, гидроксигруппу, аминогруппу (необязательно замещенную линейной или разветвленнойC1-C6 алкилкарбонильной группой, одной или двумя линейными или разветвленными C1-C6 алкильными группами), карбоксильную группу или линейную или разветвленную C1-C6 алкоксикарбонильную группу; оксатиольную группу, выбранную из групп A4, A5, A6, A7 где Ra имеет значения, указанные выше; тиазольную группу, выбранную из групп A8, A9 где Ra имеет значения, указанные выше; изотиазольную группу, выбранную из групп A10, A11 где Ra имеет значения, указанные выше; оксазольную группу, выбранную из групп A12, A13, A14, A15 где Ra имеет значения, указанные выше; или имидазольную группу формулы A16 где Ra имеет значения, указанные выше,представляет собой простую или двойную связь,R1 представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу, необязательно замещенную одним или несколькими атомами фтора, одним или несколькими атомами галогена, которые отличаются от фтора, или C1-C6 алкоксиC1-C6 алкильную группу, где каждая алкильная часть может быть линейной или разветвленной,R2 представляет собой атом водорода или линейную или разветвленную C1-C6 алкильную группу,необязательно замещенную одним или несколькими атомами фтора либо несколькими атомами галогена,которые отличаются от фтора,R3 представляет собой атом водорода или группу, выбранную из линейного или разветвленногоC1-C6 алкила, CONHR' и SO2NHR', где R' представляет собой линейную или разветвленнуюC1-C6 алкильную группу,а также их энантиомеры и диастереоизомеры, их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную, бромисто-водородную, серную, фосфоновую, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую, винную, малеиновую, лимонную, аскорбиновую, щавелевую, метансульфокислоту, камфорную кислоты и т. д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т. д. Группа A предпочтительно представляет собой тиенильную группу, выбранную из групп A1, A2 иA3, где X представляет собой атом серы. Более предпочтительно группа A представляет собой тиенильную группу, выбранную из групп A1 иA2, где X представляет собой атом серы. Группы Ra и Rb независимо друг от друга предпочтительно представляют собой атом водорода и атом хлора. Группа R1 предпочтительно представляет собой атом водорода либо линейную или разветвленнуюC1-C6 алкильную группу, предпочтительно метильную, этильную или изопропильную группу. Группа R2 предпочтительно представляет собой атом водорода. Группа R3 предпочтительно представляет собой атом водорода или CONHR' группу, где R' имеет значения, указанные для формулы (I). Предпочтительные соединения согласно настоящему изобретению: 6-хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид,6-хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид,5,7-дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид.-3 009240 Также описан способ получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют следующие соединения: соединение формулы имеют значения, указанные для формулы (I); в которой A и соединение формулы (II) циклизуют в присутствии соединения формулыR2 - C(OMe)3,где R2 имеет значения, указанные для формулы (I), получая соединение формулы имеют значения, указанные выше; в которой A, R2 и соединение формулы (IV) или подвергают реакции с восстановителем, получая соединение формулы (I/а), которое представляет собой частный случай соединений формулы (I) имеют значения, указанные выше; в которой A, R2 и соединение формулы (I/а) необязательно подвергают реакции с ди(трет-бутил)дикарбонатом, получая соединение формулыR'3 - Y3,где R3 представляет собой линейную или разветвленную C1-C6 алкильную группу или CONHR' либоSO2NHR' группу, R'3 имеет значения, указанные для формулы (I), и Y3 представляет собой уходящую группу, получая, после снятия защиты, соединение формулы (I/b), которое представляет собой частный случай соединений формулы (I) имеют значения, указанные выше; в которой A, R2, R3 и или подвергают взаимодействию в щелочной среде с соединением формулы где R'1 представляет собой линейную или разветвленную C1-C6 алкильную группу, необязательно замещенную одним или несколькими атомами фтора или несколькими атомами галогена, и Y1 представляет собой уходящую группу, получая соединение формулы(I/с), которое представляет собой частный случай соединений формулы (I) имеют значения, указанные выше; в которой A, R'1, R2 и соединение формулы (I/с) необязательно подвергают реакции с соединением формулы (VI), как определено выше, получая соединение формулы (I/d), которое представляет собой частный случай соединений формулы (I) имеют значения, указанные выше; в которой A, R'1, R2, R3 и соединения формул (I/a)-(I/d), которые представляют собой совокупность соединений формулы (I),очищают, при необходимости, в соответствии с обычным способом очистки, разделяют, если это является желательным, на их энантиомеры или диастереоизомеры в соответствии с обычным способом разделения и превращают, если это является желательным, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Указанные соединения являются новыми, а также обладают активирующим действием по отношению к рецептору AMPA, что делает их пригодными для лечения расстройств познавательной способности, связанных со старением головного мозга и с нейродегенеративными патологиями, такими как болезнь Альцгеймера, болезнь Паркинсона, болезнь Пика, корсаковский психоз, деменция лобной доли и подкорковая деменция, а также для лечения шизофрении. Также описана фармацевтическая композиция, которая содержит в качестве активного компонента по крайней мере одно соединение формулы (I) совместно с одним или несколькими подходящими инертными нетоксичными наполнителями. Среди фармацевтических композиций особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки, драже, подъязычные таблетки, желатиновые капсулы, лепешки,суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и т.д. Полезная дозировка может изменяться в зависимости от природы и тяжести расстройства, пути введения, а также от возраста и веса пациента. Дозировка изменяется от 0,01 до 500 мг в сутки на одно или более введений. Последующие примеры подтверждают изобретение, но никоим образом его не ограничивают. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (ИК, ЯМР, масс-спектрометрия). Приготовление 1. 6-Хлор-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 250 мг гидрохлорида 3-амино-5-хлор-2-тиофенсульфоноамида (J. Med. Chem., 2002, 4171-4187) помещали в 2,5 мл триэтил о-формиата. Раствор нагревали приблизительно при 60C в течение 30 мин. Образовывался желтый зернистый осадок, который собирали путем фильтрации, промывали диэтиловым эфиром и затем высушивали. Точка плавления: 260-262C. ИК (KBr): 3214, 3103, 3061, 2926, 1602, 1569, 1515, 1446, 1378, 1366, 1287, 1220, 1177, 1147, 978,840, 824, 750, 628, 543 см-1. Приготовление 2. 5,7-Дихлор-4H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 2,5-Дихлор-4-нитро-3-тиофенсульфонилхлорид. Смесь 30 мл серной кислоты и 30 мл дымящей азотной кислоты охлаждали при помощи ледяной-5 009240 солевой бани. К смеси медленно добавляли 10 г 2,5-дихлор-3-тиофенсульфонилхлорида. Раствор перемешивали при температуре окружающей среды в течение 3 ч. Затем раствор вливали в лед. Образованный желтый осадок собирали путем фильтрации, промывали водой и высушивали. ИК (KBr): 3525, 3410, 2917, 1673, 1552, 1442, 1388, 1176, 1085 см-1. Стадия B. 2,5-Дихлор-4-нитро-3-тиофенсульфонамид. 11 г соединения с вышеописанной стадии A растворяли в 150 мл диоксана. Этот раствор по каплям добавляли к 300 мл 10% раствора гидроксида аммония. Через 1 ч аммиак и диоксан упаривали при пониженном давлении. Образованный белый осадок собирали путем фильтрации, промывали водой и высушивали. Точка плавления: 125-126C. ИК (KBr): 3390, 3291, 1541, 1505, 1440, 1369, 1170, 1090 см-1. Стадия C. 4-Амино-2,5-дихлор-3-тиофенсульфоноамид. 7,25 г соединения с вышеописанной стадии B помещали в 375 мл смеси 1:1 этанол/вода. Раствор нагревали до растворения продукта. После этого добавляли 4,5 г хлорида аммония, затем 15 г порошкообразного железа. Через 10 мин флегмы реакцию останавливали. Нерастворимое вещество удаляли путем фильтрации и промывали небольшим количеством горячего этанола. Фильтрат упаривали при пониженном давлении. Образованный бежевый осадок собирали путем фильтрации, промывали водой и затем высушивали. Точка плавления: разложение приблизительно при 120C. ИК (KBr): 3440, 3412, 3354, 3290, 1600, 1557, 1336, 1318, 1166, 1125 см-1. Стадия D. 5,7-Дихлор-4H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 250 мг соединения с вышеописанной стадии C растворяли в 2,5 мл триметилортоформиата. Раствор доводили до кипения в открытом сосуде. Реакция завершалась через 1,5 ч. Раствор оставляли охлаждаться, получая бежевый осадок, который собирали путем фильтрации, промывали диэтиловым эфиром и высушивали. Точка плавления: 200-203C. Пример 1. 6-Хлор-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 196 мг соединения из приготовления 1 помещали в 4 мл воды. Медленно добавляли 500 мг NaBH4. Реакция завершалась через 15 мин. Затем pH раствора устанавливали на 5-6 и продукт экстрагировали при помощи дихлорметана. Органическую фазу высушивали над сульфатом магния и затем упаривали при пониженном давлении. Остаток ресуспендировали в минимальном количестве метанола и добавляли воду для осаждения продукта. Продукт собирали путем фильтрации, промывали водой и затем высушивали. Точка плавления: 154-156C. Пример 2. 6-Хлор-4-метил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 6-Хлор-4-метил-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 250 мг соединения из приготовления 1 помещали в 5 мл ацетонитрила и 0,5 мл диметилформамида. Добавляли 500 мг карбоната калия, а также 0,3 мл метилйодида. Раствор нагревали приблизительно при 55C приблизительно в течение 7 ч. При завершении реакции растворитель удаляли при пониженном давлении и остаток ресуспендировали в воде. Нерастворимое вещество быстро собирали путем фильтрации, промывали водой и затем высушивали. Точка плавления: 252-254C. ИК (KBr): 3091, 2943, 1607, 1519, 1485, 1434, 1390, 1297, 1150, 1107, 1059, 1015, 835, 778, 754, 570,541 см-1. Стадия B. 6-Хлор-4-метил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 200 мг соединения с вышеописанной стадии A растворяли в 5 мл изопропанола. Раствор нагревали приблизительно при 60C и добавляли 400 мг NaBH4. Через 20 мин растворитель удаляли при пониженном давлении и остаток ресуспендировали в воде. Значение pH устанавливали приблизительно на 5-6 и продукт экстрагировали 310 мл хлороформа. Затем органическую фазу высушивали над сульфатом магния, фильтровали и после этого концентрировали при пониженном давлении. Остаток ресуспендировали в минимальном количестве хлороформа и затем продукт осаждали путем добавления гексана. После этого продукт собирали путем фильтрации, промывали гексаном и высушивали. Точка плавления: 174-176C. ИК (KBr): 3236, 3089, 2923, 2867, 2807, 1562, 1419, 1407, 1358, 1322, 1284, 1154, 1077, 1002, 814,742, 680, 569, 504 см-1. Пример 3. 6-Хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 6-Хлор-4-этил-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Это соединение получали согласно способу, описанному на стадии A примера 2, используя бромэтан вместо метилйодида. Точка плавления: 189-190C. ИК (KBr): 3098, 2982, 2943, 2878, 1609, 1518, 1480, 1464, 1437, 1400, 1300, 1255, 1173, 1161, 1121,1015, 973, 943, 805, 766, 740, 567, 542 см-1.-6 009240 Стадия B. 6-Хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Это соединение получали согласно способу, описанному на стадии B примера 2, используя соединение вышеописанной стадии A. Точка плавления: 119-120C. ИК (KBr): 3235, 2980, 2931, 2872, 1558, 1462, 1448, 1407, 1360, 1324, 1154, 1082, 1010, 798, 742, 678,570, 501 см-1. Пример 4. 6-Хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 6-Хлор-4-изопропил-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 400 мг соединения из приготовления 1 растворяли в 8 мл ацетонитрила и нескольких каплях диметилформамида. После этого добавляли 800 мг карбоната калия, затем 0,6 мл 2-йодпропана. Смесь нагревали приблизительно до 55C. Через 8 ч дополнительно добавляли 0,6 мл 2-йодпропана и реакционную смесь перемешивали всю ночь. Растворитель упаривали при пониженном давлении и остаток ресуспендировали в воде. Полученное нерастворимое вещество быстро собирали путем фильтрации, промывали водой и растворяли в минимальном количестве горячего метанола. При охлаждении получали белые кристаллы, которые собирали путем фильтрации, промывали метанолом и затем высушивали. Точка плавления: 149-150C. ИК (KBr): 3112, 2983, 1605, 1515, 1458, 1442, 1407, 1392, 1306, 1284, 1170, 1141, 1095, 1010, 805,778, 717, 696, 670, 565, 538 см-1. Стадия B. 6-Хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Это соединение получали согласно способу, описанному на стадии B примера 2, используя соединение вышеописанной стадии A. Точка плавления: 100-102C. ИК (KBr): 3267, 3241, 2970, 2954, 1545, 1460, 1445, 1409, 1332, 1301, 1156, 1123, 1025, 786, 742, 692,678, 566, 502 см-1. Пример 5. 5,7-Дихлор-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 800 мг соединения из приготовления 2 суспендировали в 15 мл воды и к этой смеси медленно добавляли 2 г тонко измельченного NaBH4. Через 10 мин перемешивания при температуре окружающей среды значение pH реакционной смеси доводили до 6, используя 6 н. соляную кислоту, и дважды экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом магния и растворитель удаляли при пониженном давлении. Остаток растворяли в минимальном количестве метанола и обрабатывали активированным углем, затем добавляли воду до завершения осаждения. После этого осадок собирали путем фильтрации и два раза очищали путем растворения в минимальном количестве метанола и добавления воды. Точка плавления: 125-130C. Пример 6. 5,7-Дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 5,7-Дихлор-4-метил-4H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 200 мг соединения из приготовления 2 растворяли в 2 мл нитроэтана и 2 мл диметилформамида. Раствор нагревали до 60C. После этого добавляли 0,2 г карбоната калия, затем 0,2 мл йодметана. Раствор перемешивали в течение 2 ч. Затем растворители удаляли при пониженном давлении. Остаток ресуспендировали в воде. Нерастворимое вещество быстро собирали путем фильтрации, промывали водой и высушивали. Точка плавления: 202-207C. ИК (KBr): 3436, 3043, 2960, 1607, 1551, 1472, 1439, 1400, 1356, 1347, 1308, 1202, 1145, 1101, 1060,862, 789, 744, 664, 573, 527 см-1. Стадия B. 5,7-Дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 500 мг соединения с вышеописанной стадии A растворяли в 15 мл изопропанола при 60C. Затем к раствору добавляли 1,5 г тонко измельченного NaBH4. Через 30 мин изопропанол упаривали при пониженном давлении. Затем остаток ресуспендировали в воде и pH раствора устанавливали на 7. После этого раствор экстрагировали хлороформом (340 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и затем упаривали насухо при пониженном давлении. Остаток ресуспендировали в минимальном количестве хлороформа и медленно добавляли гексан для осаждения продукта. Продукт собирали путем фильтрации, промывали гексаном и затем высушивали. Точка плавления: 145-155C разложение. ИК (KBr): 3447, 3231, 2972, 2821, 1547, 1465, 1414, 1328, 1232, 1180, 1146, 1090, 1034, 1002, 975,746, 661, 565, 556, 525 см-1. Пример 7. 5,7-Дихлор-4-этил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 5,7-Дихлор-4-этил-4H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 4 г соединения со стадии C приготовления 2 помещали в 20 мл триэтил ортоформиата и нагревали при 170C в течение 30 мин в открытом сосуде. Затем суспензию охлаждали на льду. Образованный осадок собирали путем фильтрации, промывали н-гексаном и высушивали. Точка плавления: 172-175C.-7 009240 Стадия B. 5,7-Дихлор-4-этил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксид. 0,5 г соединения с вышеописанной стадии A растворяли в 20 мл изопропанола. Раствор нагревали до 60C и к нему добавляли 1,5 г тонко измельченного NaBH4. Через 30 мин растворитель удаляли при пониженном давлении. Затем остаток ресуспендировали в 30 мл воды и суспензию нейтрализовали путем добавления 6 н. соляной кислоты. Раствор два раза экстрагировали хлороформом. Органическую фазу высушивали над сульфатом магния и растворитель удаляли при пониженном давлении. Остаток ресуспендировали в гексане, собирали путем фильтрации, промывали н-гексаном и высушивали. Точка плавления: 144-147C. Пример 8. 6-Хлор-N,4-диэтил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин-2-карбоксамид 1,1-диоксид. 200 мг соединения из примера 3 растворяли в 1,5 мл CH3CN. Затем к раствору добавляли 1 мл этилизоцианата и 0,2 мл триэтиламина. Реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. После этого растворители удаляли в вакууме. Остаток растворяли в минимальном количестве ацетона. После этого продукт осаждали путем постепенного добавления воды. Продукт быстро собирали путем фильтрации, промывали водой и затем высушивали. Точка плавления: 80-81C. Пример 9. 6-Хлор-N-этил-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]-тиадиазин-2 карбоксамид 1,1-диоксид. Это соединение получали согласно способу, описанному в примере 8, используя соединение из примера 4 вместо соединения из примера 3. Точка плавления: 72-74C. Пример 10. 5,7-Дихлор-N-этил-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]-тиадиазин-2 карбоксамид 1,1 диоксид. Это соединение получали согласно способу, описанному в примере 8, используя соединение из примера 6 вместо соединения из примера 3. Точка плавления: 87-88C. Пример 11. 6-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-тиено[3,2-е][1,2,4]-тиадиазин 1,1-диоксид. Стадия A. 6-Хлор-4-(2-фторэтил)-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 500 мг соединения из приготовления 1 суспендировали в 10 мл ацетонитрила. К суспензии добавляли 10 капель ДМФА, 1 г карбоната калия и 0,3 мл 1-фтор-2-йодэтана. Реакционную смесь нагревали при 70C в течение 35 ч при перемешивании. После охлаждения реакционной смеси нерастворимое вещество удаляли путем фильтрации. Растворители удаляли путем упаривания при пониженном давлении. Полученное твердое вещество ресуспендировали в 10 мл воды и сразу собирали путем фильтрации. Продукт,полученный таким образом, перекристаллизовывали из этилацетата. Точка плавления: 185-187C. Стадия B. 6-Хлор-4-(2-фторэтил)-3,4-дигидро-2H-тиено[3,2-е][1,2,4]-тиадиазин 1,1-диоксид. 100 мг соединения, полученного на вышеописанной стадии A, растворяли в 4 мл изопропанола. Смесь нагревали до 60C, затем добавляли 200 мг борогидрида натрия. Через 10 мин при этой температуре растворитель упаривали при пониженном давлении. Полученный при этом остаток ресуспендировали в 10 мл воды, охлаждали на ледяной бане и pH доводили до 4 при помощи 6 н. соляной кислоты. Нерастворимое вещество собирали путем фильтрации и промывали водой. После этого продукт растворяли в минимальном количестве хлороформа и осаждали путем добавления н-гексана. Затем осадок собирали путем фильтрации. Точка плавления: 141-144C. Пример 12. 4,7-Диметил-3,4-дигидро-2H-тиено[2,3-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 7-Метил-4H-тиено[2,3-е][1,2,4]тиадиазин 1,1-диоксид. 200 мг 2-Амино-4-метилтиофен-3-сульфоноамида, получение которого описано в международной заявке WO 99/03861, растворяли в 1,5 мл триметил ортоформиата. Смесь нагревали при 90C в течение 2 ч в открытом сосуде. После упаривания растворителя при пониженном давлении остаток ресуспендировали в 3 мл этилацетата. Полученное нерастворимое вещество собирали путем фильтрации, промывали диэтиловым эфиром и высушивали. Точка плавления: 195-198C. Стадия B. 4,7-Диметил-4H-тиено[2,3-е][1,2,4]тиадиазин 1,1-диоксид. 150 мг соединения, полученного на вышеописанной стадии A, суспендировали в 5 мл ацетонитрила. К этой смеси добавляли 300 мг карбоната калия и 0,15 мл йодметана. Реакционную смесь нагревали при 65C в течение 30 мин при перемешивании. После упаривания растворителей при пониженном давлении остаток ресуспендировали в 5 мл воды и затем собирали путем фильтрации, промывали водой и высушивали. Точка плавления: 265-270C. Стадия C. 4,7-Диметил-3,4-дигидро-2H-тиено[2,3-е][1,2,4]тиадиазин 1,1-диоксид. 240 мг борогидрида натрия добавляли к 120 мг соединения, полученного на вышеописанной стадииB, растворенного в 6 мл изопропанола. Смесь нагревали при 50C в течение 10 мин. Растворитель удаляли при пониженном давлении, затем полученный таким образом остаток ресуспендировали в 5 мл воды.pH раствора доводили до 4 путем добавления 6 н. соляной кислоты. Осадок собирали путем фильтрации,промывали водой и высушивали. Точка плавления: 171-173C. Пример 13. 6-Хлор-4-изопропоксиметил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. Стадия A. 6-Хлор-4-фторметил-4H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 500 мг соединения из приготовления 1 суспендировали в 15 мл ацетонитрила. К этой смеси добавляли 500 мг карбоната калия и 1 мл бромфторметана. Смесь помещали в герметичный автоклав и нагревали при 70C в течение 8 ч. Затем нерастворимое вещество удаляли путем фильтрации. После упаривания растворителя остаток ресуспендировали в 20 мл воды и собирали на фильтре. Твердое вещество, полученное таким способом, перекристаллизовывали из метанола. Стадия B. 6-Хлор-4-изопропилметил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксид. 400 мг борогидрида натрия добавляли к 200 мг соединения, полученного на вышеописанной стадииA, суспендированного в 8 мл изопропанола. Смесь нагревали при 50C в течение 10 мин при перешивании. Нерастворимое вещество удаляли путем фильтрации. После упаривания растворителя при пониженном давлении остаток ресуспендировали в 1 мл смеси этилацетат/н-гексан (15/5) и очищали путем колоночной хроматографии на такой же подвижной фазе. После упаривания растворителей остаток растворяли в 1 мл метанола и осаждали в воде. Твердый продукт, полученный таким образом, собирали путем фильтрации, промывали водой и высушивали. Точка плавления: 65-68C. Фармакологическое исследование соединений по изобретению Пример A. Исследования возбуждающих токов, вызванных AMPA, на ооцитах лягушки. Получали мРНК из коры головного мозга самцов крыс Wistar при помощи способа с использованием тиоцианата гуанидиния/фенола/хлороформа. Выделяли поли(A+) мРНК путем хроматографии на олиго-dT целлюлозе и вводили в дозе 50 нг на ооцит. Ооциты инкубировали 2-3 дня при 18C, чтобы позволить проявиться экспрессии рецепторов, и затем хранили при 8-10C. Электрофизиологическую регистрацию осуществляли в камере Plexiglass при 20-24C в средеOR2 (J. Exp. Zool., 1973, 184, 321-334) при помощи 2-электродного "voltage-clamp" метода, третий электрод, помещенный в ванну, был контрольным, как описано в ссылке. Все соединения применяли при помощи инкубационной среды и электрический ток измеряли в конце периода введения. (S)-AMPA использовали в концентрации 10 мкМ. Для каждого исследуемого соединения определяли концентрацию, которая вызывает двукратное увеличение (EC2X) или пятикратное увеличение (EC5X) интенсивности тока, вызванного одним AMPA (5-50 нА). Соединения по изобретению в значительной степени усиливают возбуждающие действия, которые вызываются (S)-AMPA. Например, соединения из примеров 4, 6 проявляют значения EC2X и EC5X, приведенные в таблице. Пример B. Исследование возбуждающих постсинаптических потенциалов (EPSP), вызываемых электростимуляцией срезов гиппокампа у крыс. Поперечные срезы гиппокампа (500 мкМ) самцов крыс Wistar получали при помощи тканевого ножа и затем инкубировали в течение 45 мин в питательной среде без кальция, содержащей Mg2+ (10 мМ). После этого их стабилизировали в Krebs, устанавливая значение pH на 7,35, и оксигенировали O2/CO2(95%/5%) при температуре окружающей среды. Срезы погружали в воду при 30C и записывали возбуждающие постсинаптические потенциалы(EPSP) в области дендритов нервных зернистых клеток зубчатой извилины при стимуляции (50-100 мкА,50 мкс) каждые 30 с перфорантного проводящего пути при помощи биполярного вольфрамового электрода. Получали значения EPSP и анализировали при помощи A-D преобразователя, интерфейса TL-1 и программного обеспечения "pCLAMP". Определяли амплитуду и длительность EPSP на отрицательном зубце относительно базового тока. Соединения применяли в течение 10 мин в переохлаждающей бане, содержащей MgSO4 (1 мМ), для блокирования активации NMDA рецепторов. Для каждого соединения определяли концентрацию, которая вызывает увеличение на 50% амплитуды (A50) или длительности (D50) PSEP. Соединения согласно изобретению значительно повышают амплитуду и длительность возбуждающих потенциалов в постсинаптической области, зарегистрированных на срезах гиппокампа крыс.-9 009240 Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит 10 мг: Соединение из примера 3 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения тиадиазина формулы где X представляет собой атом серы,Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу или атом галогена,представляет собой простую или двойную связь,R1 представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу, необязательно замещенную одним атомом фтора, или C1-C6 алкоксиC1-C6 алкильную группу, где каждая алкильная часть может быть линейной или разветвленной,R2 представляет собой атом водорода,R3 представляет собой атом водорода или группу CONHR', где R' представляет собой линейную или разветвленную C1-C6 алкильную группу,а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединения тиадиазина формулы (I) по п.1, в которых A представляет собой тиенильную группу,выбранную из групп A1 и A2, где X представляет собой атом серы, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения тиадиазина формулы (I) по п.2, в которых Ra и Rb, каждый независимо друг от друга,представляет собой атом водорода или атом хлора, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения тиадиазина формулы (I) по п.1, в которых R1 представляет собой атом водорода или линейную или разветвленную C1-C6 алкильную группу, предпочтительно метильную, этильную или изопропильную, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, выбранные из 6-хлор-4-этил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида,6-хлор-4-изопропил-3,4-дигидро-2H-тиено[3,2-е][1,2,4]тиадиазин 1,1-диоксида и 5,7-дихлор-4-метил-3,4-дигидро-2H-тиено[3,4-е][1,2,4]тиадиазин 1,1-диоксида. 6. Фармацевтические композиции для применения для приготовления лекарственных средств для лечения заболеваний, при которых существует потребность в AMPA-модуляторах, которые содержат в качестве активного компонента соединение по любому из пп.1-5 в сочетании с одним или несколькими инертными нетоксичными фармацевтически приемлемыми носителями. 7. Фармацевтические композиции по п.6 для применения в качестве лекарственных средств, улучшающих память и распознавание. 8. Фармацевтические композиции по п.6 для применения в качестве лекарственных средств для лечения шизофрении. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: A61K 31/549, C07D 513/04
Метки: получения, соединения, фармацевтические, новые, способ, композиции, содержат, которые, тиадиазина
Код ссылки
<a href="https://eas.patents.su/11-9240-novye-soedineniya-tiadiazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения тиадиазина, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Фунгицидные смеси
Следующий патент: Способ получения оптически чистых производных 2-(4-гидроксифенокси)пропионовой кислоты
Случайный патент: Производные тетрагидроизохинолина для повышения функции памяти















