Производные гуанидина (варианты), способ их получения (варианты), фармацевтическая композиция для ингибирования протеолиза у млекопитающего, способ лечения, способ ингибирования: протеолиза у млекопитающего, тромбин-индуцированной агрегации тромбоцитов и образования сгустков фибриногена в плазме, тромбина в крови, образования аггрегатов тромбоцитов в крови, образования тромбов в крови, устройстводля сбора, циркуляции и хранения крови
Номер патента: 2740
Опубликовано: 29.08.2002
Авторы: Иллиг Карл Р., Маркоутэн Томас П., Федде Синтия Л., Солл Ричард М., Стэгнейро Томас П., Лу Тианбао, Томкзук Брюс Э.
Формула / Реферат
1. Соединение формулы I
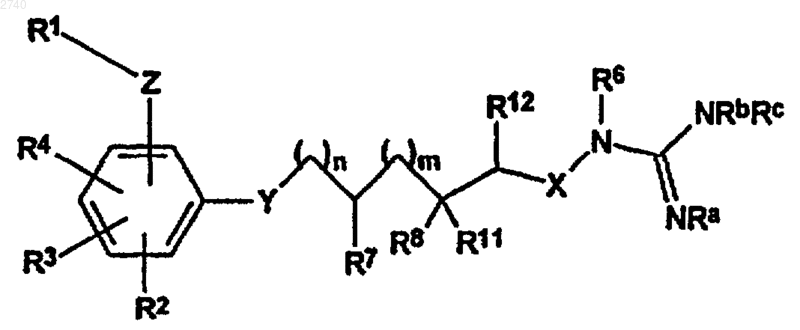
или его сольват, гидрат, фармацевтически приемлемая соль или пролекарство, где
R1 является фенильной, нафтильной, дигидродиоксобензо[b]тиофенильной или гетероарильной группой, каждая из которых может быть необязательно замещена, по крайней мере, одним заместителем, независимо выбранным из группы, состоящей из С1-6алкила, гидрокси, нитро, трифторметила, трифторметокси, галогена, С1-6алкокси, циано, амино, гидроксиамино, моно(С1-6)алкиламино, ди(С1-6)алкиламино, гетероцикла, арил(С1-6)алкокси, С1-6алкилсульфонила, С1-6алкилсульфинила, С1-6алкилкарбонила, арилсульфонила и R13R14NSO2, где
R13 и R14 независимо выбраны из группы, состоящей из водорода, С1-6алкила, С2-6алкенила, арила, необязательно замещенного С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, ар(С1-6)алкила, в котором арильная группа необязательно замещена С1-6 алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, гетероцикла, необязательно замещенного бензилом или С1-6алкилом, гетероцикло(С1-6)алкила, карбокси(С1-6)алкила, С1-6алкоксикарбонил(С1-6)алкила, циано(С1-6)алкила, гидрокси(С1-6)алкила, С1-6алкокси(С1-6)алкила, моно- и ди(С1-6)алкиламино-(С1-6)алкила, или R13 и R14 могут быть объединены с атомом азота, к которому они присоединены, с образованием четырех-семичленного цикла, необязательно содержащего, по крайней мере, один гетероатом, кроме указанного азота, такой как кислород, сера или азот (NR15), причем указанный цикл является насыщенным и содержит, по крайней мере, один необязательный заместитель, причем указанные необязательные заместители и R15 независимо выбраны из группы, состоящей из водорода, С1-6алкила, арила, необязательно замещенного С1-6алкокси, ар(С1-6)алкила, гетероцикла, карбокси(С1-6)алкила, С1-6алкоксикарбонил(С1-6)алкила, карбокси, С1-6 алкоксикарбонила, карбоксамидо, С1-6алкоксисульфонамидо, сульфонамидо, С1-6алканоила и С1-6алкилсульфонила;
Z представлена одной из групп -NR10SO2-, -SO2NR10-, -OSO2-, -SO2O-, -OCH2-, -СН2О-, -NR10CO- или -CONR10-;
R4 представлен водородом, алкилом, галогеном, гидроксиалкилом, амино, алкокси или гидрокси;
R2 и R3 каждый являются водородом;
Y обозначает одну из групп -О-, -NH-, -S- или -СН2-;
Х - кислород или NH;
R6 и R7 обозначают водород;
R12 обозначает водород или С1-6алкил;
R8 и R11, каждый независимо, являются водородом, гидрокси, гидрокси метилом, алкокси или R8 и R11 объединены с образованием -(CH2)r-, где r равно от 2 до 5;
R10 - водород или С1-6алкил;
Ra, Rb и Rc независимо являются водородом, С1-6алкилом или -CO2Rw группой;
Rw - С1-6алкил;
n равно от 0 до 8, m равно от 0 до 4.
2. Соединение по п.1, отличающееся тем, что R1 обозначает фенил или нафтил, каждый из которых необязательно может быть замещен, как определено в п.1.
3. Соединение по п.1, отличающееся тем, что R1 обозначает гетероарил, необязательно имеющий, по крайней мере, один заместитель, выбранный из группы, включающей гидрокси, нитро, трифторметил, трифторметокси, галоген, С1-6алкокси, С1-6алкил, амино, моно(С1-6)алкиламино, ди(С1-6)алкиламино или цианогруппу.
4. Соединение по п.1, отличающееся тем, что R1 обозначает пиридил, пиразолил, тиофенил, хроменил, бензоксазолил, бензтиадиазолил, хиназолинил, хинолинил, изохинолинил или тетрагидрохинолинил, каждый из которых необязательно может иметь один или два заместителя, независимо выбранных из группы, состоящей из гидрокси, нитро, трифторметила, трифторметокси, галогена, С1-6алкокси, С1-6алкила, амино, моно(С1-6)алкиламино, ди(С1-6)алкиламино и циано.
5. Соединение по п.1, отличающееся тем, что Y является -О- или -NH-.
6. Соединение по п.5, отличающееся тем, что Y является -О-.
7. Соединение по п.1, отличающееся тем, что Z обозначает -SO2NR10-, -SO2O- или -CH2O-.
8. Соединение по п.1, отличающееся тем, что Ra, Rb и Rc являются атомом водорода.
9. Соединение по п.1, отличающееся тем, что n равно от 1 до 4.
10. Соединение по п.1, отличающееся тем, что m равно 0, 1, 2 или 3.
11. Соединение по п.1, отличающееся тем, что m и n каждый равен нулю, a R7, R8, R11 и R12 каждый является атомом водорода.
12. Соединение по п.1, отличающееся тем, что R2 и R3 являются атомом водорода и R4 - метил или хлор.
13. Соединение по п.1, отличающееся тем, что R1 является одной из следующих групп: фенил, нафтил, пиридинил, тиофенил (то есть тиофен), хиназолинил, хинолинил или тетрагидрохинолинил, каждая из которых необязательно имеет один или два заместителя, выбранных из гидрокси, нитро, трифторметил, трифторметокси, галоген, С1-6алкил, фенил, С1-6алкокси, амино, моно(С1-4)алкиламино, ди(С1-4) алкиламино, гидроксиамино, С6-10ар(С1-6)алкокси, С1-6алкилкарбонил, С1-6алкилсульфонил, С1-6 алкилсульфинил, циано и R13R14NSO2-;
R13 и R14 независимо выбирают из группы, включающей водород, С1-6алкил, С2-6алкенил, арил, необязательно замещенный С1-6алкил, С1-6 алкокси, С1-6алкоксикарбонил или карбоксигруппой, арС1-6алкил, в котором арильная группа необязательно замещена С1-6алкил, С1-6 алкокси, С1-6алкоксикарбонил или карбоксигруппой, гетероцикла, необязательно замещенного бензилом или С1-6алкилом, гетероцикло(С1-6)алкила, карбокси(С1-6)алкила, С1-6алкоксикарбонил(С1-6)алкила, циано(C2-6)алкил, гидрокси (С2-6)алкил, С1-6алкокси(С2-6)алкил, моно- и диалкиламино(С2-6)алкил, или R13 и R14 могут быть объединены с атомом азота, к которому они присоединены, с образованием четырех-семичленного цикла, необязательно содержащего, по крайней мере, один гетероатом, кроме указанного азота, такой как кислород, сера или азот (NR15), причем указанный цикл является насыщенным и содержит один или два необязательных заместителя, причем указанные необязательные заместители и R15 независимо выбраны из группы, включающей водород, С1-6алкил, ар(С1-6)алкил, гетероцикл, С1-6алкоксикарбонил (С1-6)алкил, карбокси, (С1-6)алкоксикарбонил, карбоксамидо, С1-6алканоил, С1-6алкилсульфонил, С1-6алкоксисульфонил и сульфонамидо;
Z представлена одной из следующих групп: -SO2O-, -SO2NR10-, -СH2O- или -OCH2-;
R4 обозначает водород, С1-4алкил, галоген, гидрокси(С1-4)алкил или С1-4алкокси;
R10 - водород или алкил;
Y является одной из групп: -О-, -S- или -NH-; и
Ra, Rb и Rc каждый представлен водородом или С1-4алкилоксикарбонилом.
14. Соединение по п.1, отличающееся тем, что R1 - одна из следующих групп: фенил, нафтил, пиридил, тиофенил, хинолинил или изохинолинил, необязательно замещенные одной или двумя группами: хлор, метокси, метил, трифторметил, циано, нитро или амино;
Z - одна из групп: -SO2O-, -SO2NR10-, -CH2O- или -ОСН2-;
R2 и R3 обозначают водород;
R4 - водород, метил или метокси;
Y - одна из групп: -О- или -NH-;
Ra, Rb и Rc являются водородом;
R6 и R7 обозначают водород;
R12 обозначает водород или С1-6алкил;
R8 и R11 независимо представлены водородом, гидрокси, гидроксиметилом или С1-4алкокси, или R8 и R11 объединены с образованием -(СН2)r-, где r равно 2, 3 или 4;
R10 является водородом или С1-6алкилом;
n равно от 0 до 4, m равно 0, 1, 2 или 3.
15. Соединение по п.1, отличающееся тем, что R1 обозначает фенил, замещенный С1-6 алкилсульфонилом, фенилсульфонилом или R13R14NSO2-, где R13 и R14 независимо выбирают из группы, включающей водород, С1-6алкил, С2-6алкенил, С6-10арил, необязательно замещенного С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, С6-10ар(С1-4)алкил, в котором арильная группа необязательно замещена С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, пиридил, пиридил(С1-4)алкил, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, циано(С2-6)алкил, гидрокси(С2-6)алкил, С1-4алкокси(С2-6)алкил, моно- и ди(С1-4)алкиламино(С2-6)алкил или R13 и R14 могут быть объединены вместе с атомом азота, к которому они присоединены с образованием гетероциклического цикла, который выбирают из группы, включающей N-морфолино, N-пиперазинил (причем N' необязательно замещен следующими группами: С1-6алкил, С6-10арил, С6-10арил(С1-6) алкил, С1-6алкилсульфонил или С1-6алкилкарбонил), N-пирролил, N-пиперидинил, N-пирролидинил, N-дигидропиридил, N-индолил, в которых указанный гетероциклический цикл может быть необязательно замещен одним или двумя заместителями С1-4алкил, С6-10арил, необязательно замещенный С1-6алкокси, С6-10ар(С1-4)алкил, гетероцикл, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, карбокси, С1-6алкоксикарбонил, карбоксамидо, С1-6алканоил или С1-6алкилсульфонил;
Z - одна из групп: -SO2O-, -SO2NR10-, -CH2O- или -OCH2-;
R2 и R3 - водород;
R4 - одна из групп: водород, метил или метокси;
Y - одна из групп: -О- или -NH-;
Ra, Rb и Rc являются водородом, С1-6 алкилом или группой -CO2Rw;
Rw - С1-6алкил;
R6 и R7 обозначают водород;
R12 обозначает водород или С1-6алкил;
R8 и R11 независимо являются водородом, гидрокси, гидроксиметилом или С1-4алкокси, или R8 и R11 объединены с образованием -(CH2)r-, где
r равно 2, 3 или 4;
R10 является водородом или алкилом;
n равно от 0 до 4, a m равно 0, 1, 2 или 3.
16. Соединение по п.1, отличающееся тем, что фрагмент -Z-R1 присоединен к бензольному кольцу в мета-положении относительно Y.
17. Соединение формулы
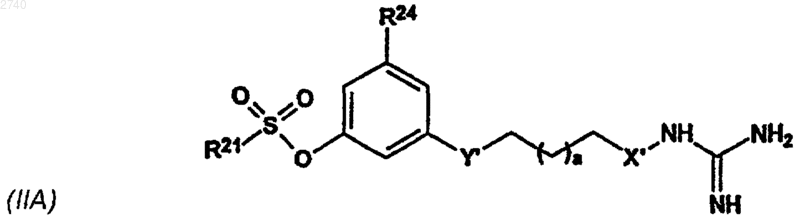
или его сольват, гидрат, фармацевтически приемлемая соль или пролекарство, где
R21 - фенил, нафтил, тиофенил, хинолинил или изохинолинил, необязательно замещенные одним или двумя заместителями, которые независимо выбраны из группы, включающей галоген, С1-4алкил, С1-4алкокси, метокси, трифторметил, циано, нитро или амино; и если R21 является фенильной группой, то указанная фенильная группа необязательно может быть замещена С1-6 алкилсульфонилом, арилсульфонилом или R22R23NSO2-группой, где R22 и R23 независимо выбраны из группы, включающей водород, С1-6 алкил, С6-10арил, необязательно замещенный С1-6 алкил, С1-6алкокси, С1-6алкоксикарбонил или карбокси группой, C6-10ap(С1-4)алкил, в котором арильная группа необязательно замещена С1-6 алкил, С1-6алкокси, С1-6алкоксикарбонил или карбокси группой, пиридил, пиридил(С1-4)алкил, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4) алкил, циано(С2-6)алкил, гидрокси(С2-6)алкил, С1-4алкокси(С2-6)алкил, моно- и ди(С1-4)алкиламино(С2-6)алкил, или R22 и R23 могут быть объединены вместе с атомом азота, к которому они присоединены, с образованием гетероциклического цикла, который выбран из группы, включающей N-морфолино, N-пиперазинил (причем N' необязательно может быть замещен на С1-6алкил, С6-10арил, С6-10арил(С1-6)алкил, С1-6алкилсульфонил или C1-6-алкилкарбонил), N-пирролил, N-пиперидинил, N-пирролидинил, N-дигидропиридил, N-индолил, в которых указанный гетероциклический цикл может быть необязательно замещен одной или двумя группами, такими как С1-4алкил, С6-10арил, необязательно замещенный С1-6алкокси, C6-10ap(С1-4) алкил, гетероцикл, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, карбокси, С1-6алкоксикарбонил, карбоксамидо, С1-6алканоил или С1-6алкилсульфонил;
R24 - водород или С1-4алкил;
Y' - одна из групп -О- или -NH-;
а равно 0, 1 или 2;
X' представлен -О- или -NH-.
18. Соединение по п.17, отличающееся тем, что R24 обозначает метил, Y'- О и а равно 1.
19. Соединение формулы
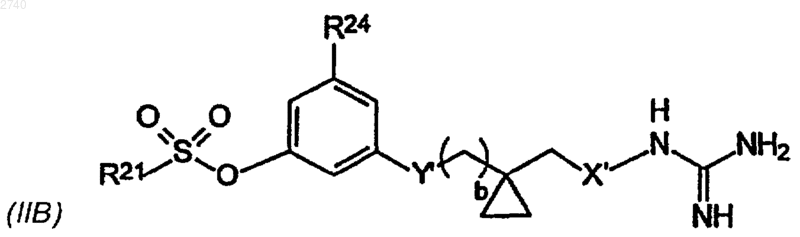
или его сольват, гидрат, фармацевтически приемлемая соль или пролекарство, где
R21 обозначает одну из групп: фенил, нафтил, тиофенил, хинолинил или изохинолинил, необязательно замещенную одним или двумя заместителями, которые выбраны из группы, включающей галоген, С1-4алкил, С1-4алкокси, метокси, трифторметил, циано, нитро или амино, и если R21 является фенильной группой, то указанная фенильная группа необязательно может быть замещена следующими заместителями: С1-6алкилсульфонил, С6-10арилсульфонил или R22R23NSO2-, где R22 и R23 независимо выбраны из группы, включающей водород, С1-6 алкил, С6-10арил, необязательно замещенный С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, С6-10ар(С1-4)алкил, в котором арильная группа необязательно замещена С1-6 алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, пиридил, пиридил(С1-4)алкил, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, циано(С2-6)алкшы, гидрокси(С2-6)алкил, С1-4алкокси(С2-6)алкил, моно- и ди(С1-4)алкиламино(С2-6)алкил, или R22 и R23 могут быть объединены вместе с атомом азота, к которому они присоединены, с образованием гетероциклического цикла, который выбран из группы, включающей N-морфолино, N-пиперазинил (причем N' необязательно замещен следующими группами: С1-6алкил, С6-10арил, С6-10арил(С1-6)алкил, С1-6алкилсульфонил или С1-6алкилкарбонил), N-пирролил, N-пиперидинил, N-пирролидинил, N-дигидропиридил, N-индолил, в которых указанный гетероциклический цикл может быть необязательно замещен одной или двумя группами, такими как С1-4алкил, С6-10арил, необязательно замещенный С1-6алкокси, C6-10ap(С1-4) алкил, гетероцикл, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, карбокси, С1-6алкоксикарбонил, карбоксамидо, С1-6алканоил, С1-6алкилсульфонил;
R24 - водород или С1-4алкил;
X' - -О- или -NH-,
Y' - одна из групп: -О- или -NH- , a
b равно 0, 1 или 2.
20. Соединение по п.1, отличающееся тем, что оно представляет собой
3-[3-(2-хлорфенилсульфонилокси)-5-метилфенокси]пропоксигуанидин;
3-[3-(2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидин;
3-[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[3-(5-изохинолинилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-[2-(метилсульфонил)фенилсульфонилокси]фенокси]пропоксигуанидин гидрохлорид;
1-[[5-метил-3-(2-метилсульфонилфенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-морфолинилсульфонил) фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(фенилсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-этилоксикарбонил)пиперидин-1-илсульфонилфенилсульфонилокси) фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-карбоксилпиперидин-1-илсульфонил)фенилсульфонилокси)фенокси] пропоксигуанидин;
3-[5-метил-3-(3-метилхинолинил-8-сульфонилокси)фенокси]пропоксигуанидин диацетат;
3-[5-метил-3-(2-(4-метилсульфонилпиперазин-1-илсульфонил)фенилсульфонилокси) фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-(2-пиримидинил)пиперазин-1-илсульфонил)фенилсульфонилокси) фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-этил-N-(4-пиридилметил)аминосульфонил)фенилсульфонилокси) фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(4-этилпиперазин-1-илсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-(2-цианоэтил)-N-(3-пиридилметил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-(2-этоксикарбонилэтил)-N-бензиламиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-(этоксикарбонилметил)-N-(2-пиридилметил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(4-(этоксикарбонилметил)пиперазин-1-илсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(4-(карбоксиметил)пиперазин-1-илсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(4-(2-пиридил)пиперазинилсульфонил)фенилсульфонилокси)фенок-
си]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-фенилпиперазинилсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-бензилпиперазинилсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-(2-метоксифенил)пиперазинилсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-(2-цианоэтил)-N-(2-фуранилметил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(4-метилпиперазинилсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-бензил-N-(2-(N,N-диметиламино)этил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(3-пиридилметил)аминосульфонил)фенилсульфонилокси) фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(2-(4-морфолинил)этиламиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(4-этоксикарбонил-1-пиперазинилсульфонил)фенилсульфонилокси)фе-
нокси]пропоксигуанидин гидрохлорид или
3-[5-метил-3-(2-(4-пиридилметиламиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин
или их гидрохлориды или ацетаты.
21. Соединение по п.1, отличающееся тем, что оно представляет собой 1-[[5-метил-3-(2-(метилсульфонил)фенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин или его сольват, гидрат или фармацевтически приемлемую соль.
22. Соединение по п.1, отличающееся тем, что оно представляет собой 1-[[5-метил-3-(2-(метилсульфонил)фенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин гидрохлорид.
23. Соединение по п.1, отличающееся тем, что Z представлен группой -NR10CO-.
24. Соединение по п.23, отличающееся тем, что R1 является одной из следующих групп: фенил, нафтил, пиридинил, тиофенил (то есть тиофен), хиназолинил, хинолинил или тетрагидрохинолинил, каждая из которых необязательно имеет один или два заместителя, выбранных из гидрокси, нитро, трифторметил, трифторметокси, галоген, С1-6алкил, С1-6алкокси, фенил, амино, моно(С1-4)алкиламино, ди(С1-4)алкиламино, гидроксиамино, C6-10aр(C1-6) алкокси, С1-6алкилкарбонил, С1-6алкилсульфонил, С1-6алкилсульфинил, циано и R13R14NSO2-;
R13 и R14 независимо выбирают из группы, включающей водород, C1-6алкил, С2-6алкенил, арил, необязательно замещенный С1-6алкил, С1-6 алкокси, С1-6алкоксикарбонил или карбоксигруппой, ар(С1-6)алкил, в котором арильная группа необязательно замещена С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, гетероцикл, необязательно замещенный бензилом или С1-6алкилом, гетероцикло(С1-6)алкил, карбокси(С1-6)алкил, С1-6алкоксикарбонил(С1-6)алкил, циано(С2-6)алкил, гидрокси (С2-6)алкил, С1-6алкокси(С2-6)алкил, моно- и ди-(С1-6)алкиламино(С2-6)алкил, или R13 и R14 могут быть объединены с атомом азота, к которому они присоединены, с образованием четырех-семичленного цикла, необязательно содержащего, по крайней мере, один гетероатом, кроме указанного азота, такой как кислород, сера или азот (NR15), причем указанный цикл является насыщенным и необязательно содержит один или два заместителя, причем указанные необязательные заместители и R15 независимо выбраны из группы, включающей водород, С1-6алкил, ар(С1-6)алкил, гетероцикл, С1-6алкоксикарбонил (C1-6)алкил, карбокси, С1-6алкоксикарбонил, карбоксамидо, С1-6алканоил, С1-6алкилсульфонил, С1-6алкоксисульфонил и сульфонамидо;
R4 обозначает водород, С1-4алкил, галоген, гидрокси(С1-4)алкил или С1-4алкокси;
Y является одной из групп: -О-, -S- или -NH-; и
Ra, Rb и Rc каждый представлен водородом или С1-4алкилоксикарбонилом.
25. Соединение по п.24, отличающееся тем, что R1 является одной из следующих групп: фенил, нафтил, пиридил, тиофенил, хинолинил или изохинолинил, каждая из которых необязательно имеет один или два заместитеыя, выбранных из хлора, метокси, метила, трифторметила, трифторметокси, циано-, нитро- или аминогруппы,
R4 обозначает водород, метил, метокси или хлор;
Y является одной из групп: -О- или -NH-;
Ra, Rb и Rc представлены водородом;
n равно от 0 до 4, а m равно 0, 1, 2 или 3.
26. Соединение по п.23, отличающееся тем, что R1 является фенилом, который замещен С1-6алкилсульфонилом, фенилсульфонилом или R13R14NSO2-, где R13 и R14 независимо выбирают из группы, включающей водород, С1-6алкил, С2-6алкенил, С6-10арил, необязательно замещенного С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, C6-10ap(С1-6)алкил, в котором арильная группа необязательно замещена С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, пиридил, пиридил(С1-4)алкил, карбокси(С1-6)алкил, С1-4алкоксикарбонил(C1-4)алкил, циано(С2-6)алкил, гидрокси(С2-6)алкил, С1-4алкокси(С2-6)алкил, моно- и ди(С1-4)алкиламино(С2-6)алкил или R13 и R14 могут быть объединены вместе с атомом азота, к которому они присоединены с образованием гетероциклического цикла, который выбирают из группы, включающей N-морфолино, N-пиперазинил (причем N' необязательно замещен следующими группами: С1-6алкил, С6-10арил, С6-10арил(С1-6) алкил, С1-6алкилсульфонил или С1-6алкилкарбонил), N-пирролил, N-пиперидинил, N-пирролидинил, N-дигидропиридил, N-индолил, в которых указанный гетероциклический цикл может быть необязательно замещен одним или двумя заместителями С1-4алкил, С6-10арил, необязательно замещенный С1-6алкокси, С6-10ар (С1-4)алкил, гетероцикл, карбокси(С1-6)алкил, С1-4алкоксикарбонил(С1-4)алкил, карбокси, С1-6 алкоксикарбонил, карбоксамидо, С1-6алканоил или С1-6алкилсульфонил;
R4 - водород, метил, хлор или метокси;
Y - одна из групп: -О- или -NH-;
Ra, Rb и Rc являются водородом, алкилом или группой -CO2Rw,
Rw - С1-6алкил;
R6 и R7 обозначают водород;
R12 обозначает водород или С1-6алкил;
R8 и R11 независимо являются водородом, гидрокси, гидроксиметилом или С1-4алкокси, или R8 и R11 объединены с образованием -(СН2)r-, где r равно 2, 3 или 4;
n равно от 0 до 4, a m равно 0, 1, 2 или 3.
27. Соединение по п.1, отличающееся тем, что оно представляет собой
3-[3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[3-(2-цианофенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(1,2,3,4-тетрагидрохинолинил-8-сульфонилокси)фенокси]пропоксигуанидин ацетат;
соль 3-[5-гидроксиметил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксигуанидина и уксусной кислоты;
1-[[5-метил-3-(2-цианофенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин ацетат;
1-[[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]метил]циклопропилметоксигуанидин ацетат;
3-[5-метил-2-(2-(4-ацетилпиперазин-1-илсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-метилфенетиламиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метокси-3-(2-метилсульфонилфенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-этил-3-(2-метилсульфонилфенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
2-гидрокси-3-[5-метил-3-(2-метилсульфонил)фенилсульфонилоксифенокси]пропоксигуанидин;
3-[3-(2,4-бис(метилсульфонил)фенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(3-метилсульфонил)фенилсульфонилоксифенокси]пропоксигуанидин гидрохлорид;
3-[3-((2-хлор-4-метилсульфонил)фенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
3-[(3-(6-(2,3-дигидро-1,1-диоксобензо[b]тиофен)сульфонилокси)-5-метилфенокси)пропокси]гуанидин трифторацетат;
3-[5-метил-3-[2-(N-гидрокси)аминофенил сульфонилокси]фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-[2-аминофенилсульфонилокси]фенокси]пропоксигуанидин гидрохлорид;
3-[3-(2-(4-бифенилметокси)фенилсульфонилокси)-5-метилфенокси]пропоксигуанидин;
3-[3-(2-(3-бифенилметокси)фенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид;
1-[(3-бензилокси-5-метилфенокси)метил] циклопропилметоксигуанидин;
3-[5-метил-3-(бис(2-метоксиэтил)аминосульфонилфенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(N-этил-3,4-(метилендиокси)анилиносульфонилфенилсульфонилокси) фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-N-метил-(3,4-диметоксифенил)этиламиносульфонилфенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-((3-этоксикарбонил-1-пиперидиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-((3-карбоксипиперидиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-((2-метоксикарбонил-1-пирролидиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(2-карбокси-1-пирролидиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-метил-N-этоксикарбонилметил)аминосульфонилфенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-мeтил-3-(2-(N-мeтил-N-(2-(2-пиpидил)этил)aминocyльфoнил)фeнилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-пропил-N-(2-(2-пиридил)этил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(4-метоксифенил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(4-метоксикарбонилфенил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N,N-бис(2-цианоэтил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-(пиперидин-1-ил)пиперидин-1-илсульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(2-(4-пиридил)этил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N,N-бис(этоксикарбонилметил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(N,N-бис(карбоксиметил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(N-метил-N-(4-карбоксифенил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(N-(2-карбоксиэтил)-N-бензиламиносульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(N-этил-N-(1-бензил-3-пирролидинил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(1-метил-4-пиперидинил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-мeтил-3-(2-(N-этил-N-(2-(N,N-димeтилaминo)этил)aминocyльфoнил)фенилсульфонилокси)фенокси]пропоксигуанидин дигидрохлорид;
3-[5-метил-3-(2-(N-метил-N-(2-(N,N-диметиламино)этил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин гидрохлорид;
3-[5-метил-3-(2-(4-(пирролидин-1-ил)пиперидин-1-илсульфонил)фенилсульфонилокси) фенокси]пропоксигуанидин;
3-[5-метил-3-(2-(N-метил-N-(3-(N,N-диметиламино)пропил)аминосульфонил)фенилсульфонилокси)фенокси]пропоксигуанидин;
N-мeтил-N-{3-[5-мeтил-3-(2-(мeтилcyльфoнил)фeнилcyльфoнилoкcи)фенокси]пропокси} гуанидин гидрохлорид;
3-[3-метил-5-(N-метил-2-(метилсульфонил)фенилсульфониламино)фенокси]пропоксигуанидин гидрохлоЁшф;
3-[3-(2-хлорфенилсульфонилокси)-5-метилфенокси]пропиламиногуанидин диацетат;
3-[5-метил-3-(2-трифторметилфенилсульфонилокси)фенокси]пропиламиногуанидин гидрохлорид;
3-[3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропиламиногуанидин ацетат;
3-[3-(2-метоксифенилсульфонилокси)-5-метилфенокси]пропиламиногуанидин диацетат;
3-[3-(2-цианофенилсульфонилокси)-5-метилфенокси]пропиламиногуанидин ацетат;
или их гидрохлорид или ацетат.
28. Соединение формулы IX
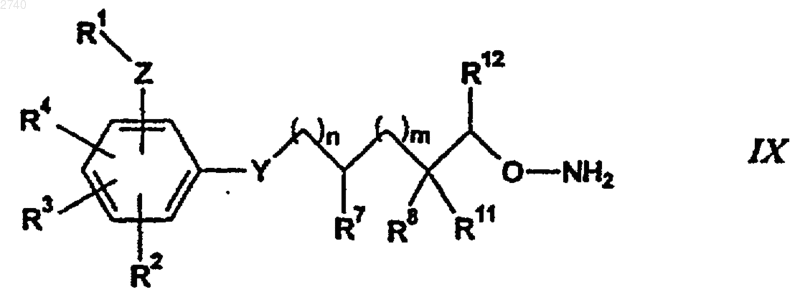
где R1 является фенильной, нафтильной, дигидродиоксобензо[b]тиофенильной или гетероарильной группой, каждая из которых может быть необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из С1-6алкила, гидрокси, нитро, трифторметила, трифторметокси, галогена, С1-6алкокси, циано, амино, гидроксиамино, моно(С1-6)алкиламино, ди(С1-6)алкиламино, гетероцикла, арил(С1-6)алкокси, С1-6алкилсульфонила, С1-6алкилсульфинила, С1-6алкилкарбонила, арилсульфонила и R13R14NSO2, где
R13 и R14 независимо выбраны из группы, состоящей из водорода, С1-6алкила, С2-6алкенила, арила, необязательно замещенного С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, ар(С1-6)алкила, в котором арильная группа необязательно замещена С1-6алкил, С1-6алкокси, С1-6алкоксикарбонил или карбоксигруппой, гетероцикла, необязательно замещенного бензилом или С1-6алкилом, гетероцикло(С1-6)алкила, карбокси(С1-6)алкила, С1-6алкоксикарбонил(С1-6)алкила, циано(С1-6)алкила, гидрокси (С1-6)алкила, С1-6алкокси(С1-6)алкила, моно- и ди(С1-6)алкиламино(С1-6)алкила, или R13 и R14 могут быть объединены с атомом азота, к которому они присоединены, с образованием четырех-семичленного цикла, необязательно содержащего, по крайней мере, один гетероатом, кроме указанного азота, такой как кислород, сера или азот (NR15), причем указанный цикл является насыщенным и необязательно содержит один или два заместителя, причем указанные необязательные заместители и R15 независимо выбраны из группы, состоящей из водорода, С1-6алкила, арила, необязательно замещенного С1-6алкокси, ар(С1-6)алкила, гетероцикла, карбокси (С1-6)алкила, С1-6алкоксикарбонил(C1-6) алкила, карбокси, С1-6алкоксикарбонила, карбоксамидо, С1-6алкоксисульфонамидо, сульфонамидо, С1-6 алканоила и С1-6алкилсульфонила;
Z представлена одной из групп -NR10SO2-, -SO2NR10-, -OSO2-, -SO2O-, -ОСН2-, -СН2О-, -NR10CO- или -CONR10-;
R4 представлен водородом, С1-6алкилом, галогеном, гидрокси(С1-6)алкилом, амино, С1-6 алкокси или гидрокси;
R2 и R3 представлены водородом;
Y обозначает одну из групп -О-, -NH-, -S- или -CH2-;
R7 обозначает водород;
R12 обозначает водород или С1-6алкил;
R8 и R11, каждый независимо, является одной из следующих групп: водород, гидрокси, гидроксиметил или С1-6алкокси; или R8 и R11 объединены с образованием -(СН2)r-, где r равно от 2 до 5;
R10 представлен водородом или С1-6алкилом;
n равно от 0 до 8, а m равно от 0 до 4.
29. Фармацевтическая композиция для ингибирования протеолиза у млекопитающего, отличающаяся тем, что она содержит одно из соединений по пп. 1, 13, 14, 15, 17, 19 или 20 в количестве, эффективном для ингибирования протеолиза, и фармацевтически приемлемый носитель или разбавитель.
30. Фармацевтическая композиция по п.29, отличающаяся тем, что она содержит указанное соединение в количестве, эффективном для ингибирования трипсин-подобной протеазы.
31. Способ ингибирования протеолиза у млекопитающего, отличающийся тем, что млекопитающему вводят композицию по п.29.
32. Способ по п.31, отличающийся тем, что ингибируют трипсин-подобную протеазу.
33. Способ лечения тромбоза, ишемии, кровоизлияний или рестеноза у млекопитающего, отличающийся тем, что млекопитающему вводят композицию по п.29.
34. Способ ингибирования тромбин-индуцированной агрегации тромбоцитов и образования сгустков фибриногена в плазме, отличающийся тем, что млекопитающему вводят композицию по п.29.
35. Способ ингибирования тромбина в крови, отличающийся тем, что соединение по п.1 добавляют в кровь.
36. Способ ингибирования образования агрегатов тромбоцитов в крови, отличающийся тем, что соединение по п.1 добавляют в кровь.
37. Способ ингибирования образования тромбов в крови, отличающийся тем, что соединение по п.1 добавляют в кровь.
38. Устройство для сбора, циркуляции и хранения крови, содержащее эффективное количество соединения, ингибирующего тромбин, или макромолекулы в качестве антикоагулянта, включенные в материалы или физически связанные, по крайней мере, с одним материалом, из которых изготовлено указанное устройство, отличающееся тем, что в качестве указанного ингибитора тромбина в нем использовано, по крайней мере, одно соединение по п.1.
39. Устройство по п.38, отличающееся тем, что оно представляет собой катетер, устройство для диализа крови, шприцы и пробирки для сбора крови, соединительные линии для циркуляции крови или устройство для искусственного кровообращения.
40. Устройство по п.39, отличающееся тем, что оно представляет собой стент, который можно ввести млекопитающему хирургическим способом.
41. Способ получения аминогуанидинсодержащего соединения по п.1, заключающийся в том, что проводят реакцию взаимодействия аминогуанидина формулы
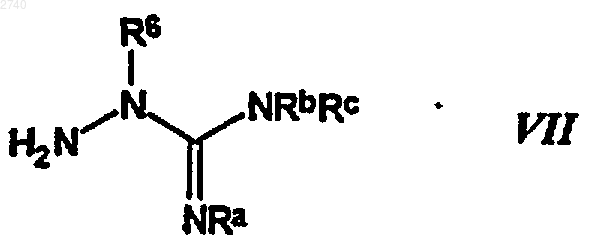
где R9, Ra, Rb и Rc определены в п.1, с карбонилсодержащим соединением формулы
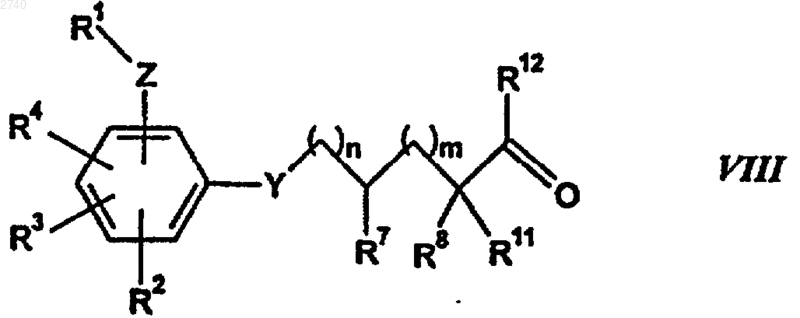
где R1 - R4, Z, Y, n, m, R7, R8, R11 и R12 определены в п.1, с образованием амидиногидразона и затем избирательно восстанавливают двойную связь в амидиногидразоне между атомами углерода и азота.
42. Способ по п.41, отличающийся тем, что аминогуанидин формулы VII используют в виде соли как гидрохлорид, ацетат или нитрат.
43. Способ по п.41, отличающийся тем, что реакцию проводят при температуре окружающей среды, а в качестве растворителя используют спирт.
44. Способ по п.41, отличающийся тем, что в реакционную смесь добавляют кислоту.
45. Способ получения алкоксигуанидина по п.1, заключающийся в том, что проводят реакцию взаимодействия алкоксиамина формулы
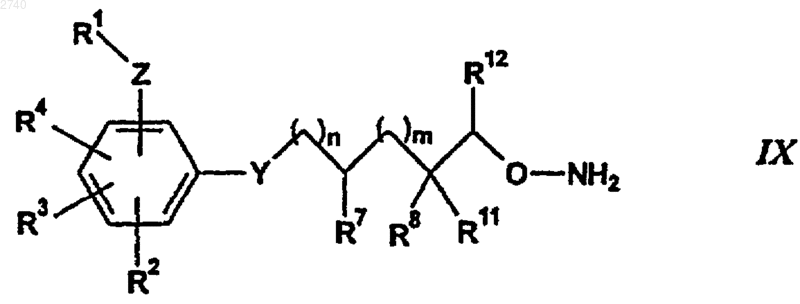
где R1-R4, Z, Y, n, m, R7, R8, R11 и R12 определены в п.1, с гуанидинилирующим реагентом.
46. Способ по п.45, отличающийся тем, что в качестве указанного гуанидинилирующего реагента используют аминоиминосульфоновую кислоту, необязательно замещенную 1Н-пиразол-1-карбоксамидинами или N,N'-бис (трет-бутилоксикарбонил)-S-метилизотиомочевиной.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, которые проявляют активность ингибиторов ферментов, и, в частности, к новому классу непептидных ингибиторов протеолитических ферментов. Уровень техники Протеазами называются ферменты, которые расщепляют белки по одной специфической пептидной связи. Протеазы принято подразделять на четыре основных класса: сериновые,тиоловые или цистеиновые, кислые или аспарагиновые и металлопротеазы (статья Cuypers и др. в журнале J. Biol. Chem. 257:7086 (1982. Протеазы играют важную роль в реализации ряда биологических функций, таких как пищеварение, образование и растворение сгустков крови, воспроизведение и иммунный ответ на чужеродные клетки и организмы. Аберрантный(нарушенный) протеолиз связан с рядом болезненных состояний у человека и других млекопитающих. Протеазы из нейтрофильных лейкоцитов человека - эластаза и катепсин G принимают участие в болезненных состояниях, характеризующихся разрушением ткани. К таким болезням относятся эмфизема, ревматоидный артрит, язва роговицы и гломерулярный нефрит(книга Barret "Enzyme Inhibitors as Drugs" под редакцией Sandler, University Park Press, Baltimore, (1980. Другие протеазы, такие как плазмин, эстераза С-1, конвертаза С-3, урокиназа,активатор плазминогена, акрозин и калликреины играют ключевую роль в проявлении нормальных функций в организме млекопитающих. Во многих случаях при терапевтическом лечении млекопитающих представляется целесообразным блокирование функционирования одного или более протеолитических ферментов. Сериновые протеазы включают такие ферменты, как эластаза (лейкоцитов человека), катепсин G, плазмин, эстераза С-1, конвертаза С 3, урокиназа, активатор плазминогена, акрозин,химотрипсин, трипсин, тромбин, фактор Ха и калликреины. Эластаза лейкоцитов человека высвобождается из полиморфноядерных лейкоцитов в очагах воспаления и, таким образом, вносит вклад в возникновение ряда болезненных состояний. Катепсин G является другой сериновой протеазой нейтрофильных лейкоцитов человека. Можно ожидать, что соединения, обладающие ингибиторной активностью по отношению к указанным ферментам, будут оказывать противовоспалительное действие, которое можно использовать при лечении подагры, ревматоидного артрита и других воспалительных заболеваний, а также для лечения эмфиземы. Химотрипсин и трипсин являются пищеварительными ферментами. Ингибиторы этих ферментов используют при лечении панкреатита. Ингибиторы урокиназы и активатора плазминогена ис 002740 2 пользуют при лечении болезней, сопровождающихся избыточным ростом клеток, таких как доброкачественная гипертрофия простаты, карцинома простаты и псориаз. Сериновая протеаза тромбин играет центральную роль в процессах гемостаза и тромбоза, а также является многофункциональным белком, оказывающим ряд воздействий на тромбоциты, эндотелиальные клетки, клетки гладкой мускулатуры, лейкоциты, сердце и нейроны (статья Tapparelli и др. в журнале Trends inS47-S58 (1994. Активация каскада реакций свертывания крови по внутреннему пути (контактная активация) или по внешнему пути (активация путем экспозиции плазмы на неэндотелиальной поверхности, путем повреждения клеток сосудов или путем выделения тканевого фактора) приводит к серии биохимических реакций, которые регулируются тромбином. Тромбин расщепляет фибриноген, что в конечном итоге приводит к образованию гемостатической пробки (сгустка), существенно активирует тромбоциты с помощью уникального протеолитического расщепления рецептора тромбина на поверхности клеток (статья Coughlin в журнале Seminars in Hematology 31(4):270-277(1994, а также приводит к инициированию образования самого фермента по механизму обратной связи. Таким образом, ингибиторы тромбина могут быть потенциальными терапевтическими средствами для лечения сердечнососудистых и несердечно-сосудистых заболеваний, включающих инфаркт миокарда; неустойчивую стенокардию; кровоизлияния; рестеноз; глубокий венный тромбоз; обширную внутрисосудистую коагуляция, вызванную травмой, сепсисом или метастазами; гемодиализ; хирургическое шунтирование; респираторный дистресссиндром взрослых; эндотоксиновый бактериально-токсический шок; ревматоидный артрит; неспецифический язвенный колит; индурацию; метастазы; гиперкоагуляцию при хемотерапии; болезнь Альцгеймера; синдром Дауна; образование фибрина в глазной ткани и ранозаживление. Другой областью применения упомянутых ингибиторов тромбина является их использование в качестве антикоагулянтов, включенных в материалы или физически связанных с материалами, которые используются для производства медицинского оборудования для сбора, циркуляции и хранения крови, таких как катетеры,устройства для диализа крови, шприцы и пробирки для сбора крови, соединительные линии для циркуляции крови и стенты. Фактор Ха является другой сериновой протеазой, включенной в путь свертывания крови. Фактор Ха связывается с фактором Va и кальцием на фосфолипидной мембране, при 3 этом образуется комплекс протромбиназы, который превращает протромбин в тромбин (статья Claeson в журнале Blood Coagulation and(Suppl 1):S47-S58 (1994. Предполагают, что ингибиторы фактора Ха обладают преимуществом по сравнению с агентами, которые напрямую ингибируют тромбин, так как прямые ингибиторы тромбина стимулируют образование значительного количества новой порции тромбина (статья Lefkovits и Topol в журнале Circulation 90(3): 1522-1536 (1994); статья Harker в журнале Blood Coagulation and Fibrinolysis 5(Suppl 1): S47-S58(1994. Таким образом, до настоящего времени существует потребность в соединениях непептидной природы, являющихся потенциальными и селективными ингибиторами протеаз и характеризующихся большей биологической доступностью и незначительными побочными действиями по сравнению с современными известными ингибиторами протеаз. Соответственно,новый класс потенциальных ингибиторов протеаз, обладающих высокой ингибиторной способностью и низкой токсичностью для млекопитающих, является ценным терапевтическим средством для использования в различных условиях, включающих лечение ряда болезненных состояний млекопитающих, связанных с нарушением протеолиза. В статье Ozawa H. и др. в журнале Yakugaku Zasshi, 95(8):966-74 (1975) описан ряд производных бензили бензилидинаминогуанидина и амидиногидразона. Например, описаны следующие соли: Было исследовано действие этих соединений на кровяное давление у крыс. В статье Augstein J. и др. в журнале J.Med.Chem., 10(3):391400 (1967) рассмотрен ряд производных арилоксиалкиламиногуанидинов формулы В некоторых соединениях R1 является метоксигруппой, в то время как R2 - водородом, R3 и R4 - или водородом, или метильной группой. Было показано, что несколько таких аминогуанидинов, содержащих хлор и метил в качестве заместителей в ароматическом кольце, обладают блокирующими свойствами по отношению к адренэргическим нейронам и ингибируют допамин -оксидазу in vitro. Описан также синтез и тестирование аминогуанидинов, содержащих 4 один или более метоксизаместителей в ароматическом кольце. Сущность изобретения Настоящее изобретение относится к новым соединениям формулы I (см. ниже). Представлены также способы получения соединений формулы I. Новые соединения согласно изобретению являются потенциальными ингибиторами протеаз, особенно сериновых протеаз, подобных трипсину, таких как химотрипсин, трипсин,тромбин, плазмин и фактор Ха. Некоторые соединения проявляют антитромботическую активность, благодаря прямому селективному ингибированию тромбина, или являются промежуточными соединениями, которые используют для образования соединений с антитромботической активностью. Изобретение включает композицию, ингибирующую потерю тромбоцитов, агрегацию тромбоцитов крови, образование фибрина, ингибирующую образование тромбов и образование эмбола у млекопитающих, которая содержит соединение согласно изобретению на фармацевтически приемлемом носителе. Такие композиции могут во выбору включать антикоагулянты, антитромбоцитарные агенты и тромболитические агенты. Чтобы получить требуемый ингибирующий эффект, композиции можно добавлять в кровь, в продукты крови или органы млекопитающих. В изобретении описаны также способы ингибирования или лечения нарушенного протеолиза у млекопитающих и способы лечения инфаркта миокарда; неустойчивой стенокардии; кровоизлияний; рестеноза; глубокого венозного тромбоза; обширной внутрисосудистой коагулопатии, вызванной травмой, сепсисом или метастазами; применение при гемодиализе; при хирургическом шунтировании; лечение респираторного дистресс-синдрома взрослых; эндотоксинового бактериально-токсического шока; ревматоидного артрита; неспецифического язвенного колита; индурации; метастазов; гиперкоагуляции при хемотерапии; болезни Альцгеймера; синдрома Дауна; образования фибрина в глазной ткани и при ранозаживлении. Другой областью применения упомянутых ингибиторов тромбина является их использование в качестве антикоагулянтов, включенных в материалы или физически связанных с материалами, которые используются для производства медицинского оборудования для сбора и хранения крови, таких как катетеры, устройство для диализа крови,шприцы и пробирки для сбора крови, соединительные линии для циркуляции крови и стенты. В изобретение включен также способ снижения тромбогенности поверхностей в организме млекопитающих путем ковалентного или нековалентного связывания соединения согласно изобретению с поверхностью, предназначенной для введения в организм. 5 Сведения, подтверждающие возможность осуществления изобретения Соединения согласно настоящему изобретению включают соединения формулы I или их сольваты, гидраты или фармацевтически приемлемые соли, гдеR1 является одной из алкильных, циклоалкильных, алкенильных, алкинильных, арильных,аралкильных или гетероарильных групп, каждая из которых может быть необязательно замещена;Z представлена одним из заместителейRy и Rz независимо представлены одной из следующих групп; водород, алкил, циклоалкил,арил, аралкил, гидроксиалкил, карбоксиалкил,аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или карбокси;R2, R3 и R4 каждый независимо является одной из следующих групп: водород, алкил,циклоалкил, алкенил, алкинил, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенный гетероарил, трифторметил, галоген, гидроксиалкил,циано, нитро, карбоксамидо, -CO2Rx, -CH2ORx или -ORx или, если присутствуют соседние атомы углерода, R2 и R3 могут быть объединены с образованием группы -СН=СН-СН=СН- илиRx в каждом случае независимо представлен одной из следующих групп: водород, алкил или циклоалкил, причем указанные алкильные или циклоалкильные группы могут по выбору содержать одну или более ненасыщенных связей;R9 является одной из следующих групп: водород, алкил, циклоалкил или арил, причем указанный алкил, циклоалкил или арил может быть необязательно замещен амино, моноалкиламино, диалкиламино, алкокси, гидрокси, карбокси, алкоксикарбонил, арилоксикарбонил,аралкоксикарбонил, арил, гетероарил, ациламино, циано или трифторметильной группой;R6 является одной из следующих групп: водород, алкил, аралкил, арил, гидроксиалкил,аминоалкил, моноалкиламино(С 2-10)алкил, диалкиламино(C2-10)алкил или карбоксиалкил или в другом варианте R6 и R12 объединены с образованием группы -(CH2)w-, где w равно от 1 до 5;R7 - одна из следующих групп: водород,алкил, аралкил, арил, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил, карбоксиалкил, гидрокси, алкокси, аралкокси, арилокси, гетероарилокси или моно- или диалкиламино, при условии, что n не равно нулю, если R7 является гидрокси, алкокси, аралкокси, арилокси, гетероарилокси или моно- или диалкиламино;R8, R11 и R12 каждый независимо является одной из следующих групп: водород, алкил,аралкил, арил, гидроксиалкил, аминоалкил, моноалкиламиноалкил, диалкиламиноалкил или карбоксиалкил; или R7 и R8 объединены с образованием-(CH2)y-, где у равно нулю (связь), 1 или 2, в то время как R11 и R12 определены выше; или R7 иR8 и R11 определены выше; или R8 и R11 объединены с образованием -(СН 2)r-, где r равно от 2 до 8, в то время как R7 и R12 определены выше;R10 в каждом случае независимо является одной из следующих групп: водород, алкил,аралкил, арил, гидрокси(С 2-10)алкил, аминоRw - алкил, циклоалкил, фенил, бензил, где Rd и Re независимо являются водородом,С 1-6 алкилом, С 2-6 алкенилом или фенилом, Rf водород, С 1-6 алкил, С 2-6 алкенил или фенил, Rg водород, С 1-6-алкил, С 2-6 алкенил или фенил и Rhn равно от 0 до 8, m равно от 0 до 4. Предпочтительной группой соединений,включенных в область настоящего изобретения,являются соединения формулы I, в которых R1 является одной из следующих групп: С 6-10 арил,пиридинил, тиофенил (то есть тиофен), хиназолинил, хинолинил или тетрагидрохинолинил,каждая из которых необязательно замещена одной или двумя гидрокси, нитро, трифторметильными группами, галогеном, С 1-6 алкил, С 6-10 арил, С 1-6 алкокси, C6-10ap(C1-6)алкокси, С 1-6 аминоалкил, С 1-6 аминоалкокси, амино, моно(С 1-4) алкиламино, ди(С 1-4)алкиламино, С 2-6 алкоксикарбониламино, C2-6-алкоксикарбонил, карбокси, С 1-6 гидроксиалкил, С 2-6 гидроксиалкокси,(С 1-6)алкокси(С 2-6)алкокси, моно- и ди- С 1-4 алкиламино(С 2-6)алкокси,С 2-10 моно(карбоксиалкил) амино, ди(С 2-10 карбоксиалкил)амино, С 6 С 2-6 алкинилкарбо 14 ар(C1-6)алкоксикарбонил,нил,С 1-6 алкилсульфонил, С 2-6 алкенилсульфонил,С 2-6 алкинилсульфонил, С 6-10 арилсульфонил, 7R13 и R14 независимо выбирают из группы,включающей водород, алкил, циклоалкил, алкенил, алкинил, арил, аралкил, гетероцикл, гетероциклоалкил, карбоксиалкил, алкоксикарбонилалкил, циано(С 2-10)алкил, гидрокси(С 2-10)алкил,алкокси(С 2-10)алкил, моно- и диалкиламино(С 2-10)алкил или R13 и R14 могут быть объединены с атомом азота, к которому они присоединены, с образованием трех-семи-членного цикла,необязательно содержащего один или более гетероатомов, кроме указанного азота, таких как кислород, сера или азот (NR15), причем указанный цикл предпочтительно является насыщенным и необязательно содержит один или два заместителя, которые выбирают из группы,включающей гидрокси, ацилокси, алкокси, арилокси, амино, моно- и диалкиламино, ациламино, алкил, циклоалкил, алкенил, алкинил, арил,аралкил, гетероцикл, гетероциклоалкил, карбоксиалкил, алкоксикарбонилалкил, циано(С 2-10) алкил, гидрокси(С 2-10)алкил, алкокси(С 2-10) алкил, моно- и диалкиламино(С 2-10)алкил, карбокси, алкоксикарбонил, карбоксамидо, формил,алканоил, ароил, аралканоил, сульфонил, алкилсульфонил, алкоксисульфонил, сульфонамидо,фосфонил, фосфорамидо и фосфинил, причемZ представлена одной из -SO2O-, -SO2NR10-,y zR2, R3 и R4 каждый независимо представлен одной из следующих групп: водород, С 1-4 алкил, С 3-8 циклоалкил, фенил, бензил, трифторметил, галоген, гидрокси(С 1-4)алкил, циано,нитро, карбоксамидо, карбокси, С 1-4 алкоксикарбонил, С 1-4 алкоксиметил или С 1-4 алкокси; или в другом варианте, если присутствуют соседние атомы углерода, R2 и R3 могут быть также объединены с образованием группыY обозначает одну из групп: -О-, -S-,-NR10- или ковалентную связь; 8 С 1-4 алкилоксикарбонил,цианогруппами, бензилоксикарбонил, где R является бензил, метил, этил, изопропил,втор-бутил или трет-бутильной группой, а Rf является водородом или С 1-6 алкильной группой;R6 представлен одной из групп: водород,С 1-6 алкил, С 6-10 ар(С 1-6)алкил, С 6-10 арил, С 2-10 гидроксиалкил, С 2-10 аминоалкил, моно(С 1-4)алкиламино(С 2-8)алкил, ди(С 1-4)алкиламино(С 2-8)алкил или С 2-10 карбоксиалкил;R7, R8, R11 и R12 независимо представляют собой водород, С 1-6 алкил, С 2-10 карбоксиалкил или С 2-10 гидроксиалкил или R7 и R8 объединены с образованием -(СН 2)y-, где у равно нулю, 1 или 2, в то время как R11 и R12 определены выше; или R7 и R12 объединены с образованием-(CH2)q-, q равно нулю (связь) или 1, 2 или 3, в то время как R8 и R11 определены выше; или R8 и R11 объединены с образованием -(CH2)r-, где r равно 2, 3 или 4, в то время как R7 и R12 определены выше;R9 является водородом или С 1-10 алкил группой, необязательно замещенной амино, моно(С 1-4)алкиламино, С 1-6 алкокси, гидрокси, карбокси, фенил, С 1-4 алкилоксикарбонил, С 6-10 ар(C1-4)алкоксикарбонил, С 1-6 ациламино, циано или трифторметильной группой;R10 в каждом случае независимо представлен водородом, С 1-6 алкил, бензил, фенил, С 2-10 гидроксиалкил, С 2-10 аминоалкил, С 1-4 моноалкиламино(С 2-8)алкил,С 1-4 диалкиламино(С 2-8) алкил или C2-10 карбоксиалкильной группой;n равно от нуля до 8 и m равно от нуля до 4. В указанном предпочтительном варианте воплощения изобретения R1 может обозначать одну из групп: С 6-10 арил, пиридинил, тиофенил(то есть тиофен), хиназолинил, хинолинил или тетрагидрохинолинил, каждая из которых необязательно замещена одной или двумя группами, которые выбирают из гидрокси, нитро,трифторметил, галоген, С 1-6 алкил, С 1-6 алкокси,С 1-6 аминоалкил, С 1-6 аминоалкокси, амино, моно(С 1-4)алкиламино, ди(С 1-4)алкиламино, С 2-6 алкоксикарбониламино, С 2-6 алкоксикарбонил,карбокси, С 1-6 гидроксиалкил, С 2-6 гидроксиалкокси, С 2-10 моно(карбоксиалкил)амино, бис(С 2-10 карбоксиалкил)амино, С 6-14 ар(C1-6)алкоксикарбонил, С 2-6 алкинилкарбонил, С 1-6 алкилсульфонил, C2-6 алкенилсульфонил, С 2-6 алкинилсульфонил, С 1-6 алкилсульфинил, С 1-6 алкилсульфонамидо, амидино, гуанидино, С 1-6 алкилиминоамино, формилиминоамино, С 2-6 карбоксиалкокси, С 2-6 карбоксиалкил, карбоксиалкиламино,циано, трифторметокси и перфторэтокси групп. Особенно предпочтительная группа соединений включает соединения формулы I, гдеR1 - одна из групп: фенил, нафтил, пиридил, тиофенил, хинолинил или изохинолинил,необязательно замещенные одним или двумя заместителями, выбранными из хлор, метокси,метил, трифторметил, циано, нитро, амино или диметиламино;Z - одна из групп -SO2O-, -SO2NR10-,-СН 2 О- или -OCH2-;R2 и R3 обозначают водород или С 1-4 алкил или R2 и R3 могут быть объединены с образованием -СН=СН-СН=СН-;R4 является одной из групп: водород, метил, метокси или трифторметил;R7, R8, R11 и R12 независимо представляют собой водород, С 1-6 алкил, С 2-10 гидроксиалкил или С 2-10 карбоксиалкил, или R7 и R8 объединены с образованием -(СН 2)y-, где у равно нулю, 1 или 2, в то время как R11 и R12 определены выше; или R7 и R12 объединены с образованием-(CH2)q-, где q равно нулю (связь) или 1, 2 или 3,в то время как R8 и R11 определены выше; или R8 и R11 объединены с образованием-(CH2)r-, где r равно 2, 3 или 4, в то время как R7 и R12 определены выше;R10 в каждом случае независимо представляет собой водород, С 1-4 алкил, С 2-4 гидроксиалкил, С 2-4 карбоксиалкил, С 2-4 аминоалкил, диметиламино(С 2-8)алкил, метиламино(С 2-8)алкил;n равно от нуля до 4, m равно нулю, 1, 2 или 3. Другой особенно предпочтительной группой соединений являются соединения формулыR1 является фенильной группой, замещенной одной из групп: алкилсульфонил, арилсульфонил и R13R14NSO2-, где R13 и R14 независимо выбирают из группы, включающей водород, С 1-6 алкил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, C6-10 арил, С 6-10 ар(С 1-4)алкил, пиридил,пиридил-(С 1-4)алкил, карбокси(С 1-6)алкил, С 1-4 алкоксикарбонил(C1-4)алкил, циано(С 2-6)алкил,гидрокси(С 2-6)алкил,С 1-4 алкокси(С 2-6)алкил,моно- и ди(С 1-4)алкиламино(С 2-6)алкил или R13 иR14 могут быть объединены с атомом азота, к которому они присоединены с образованием гетероциклического цикла, который выбирают из группы,включающей 10 зательно может быть замещен следующими группами: С 1-6 алкил, С 1-6 гидроксиалкил, С 6-10 арил, С 6-10 арил(С 1-6)алкил, С 1-6 алкилсульфонил,С 6-10 арилсульфонил, С 1-6 алкилкарбонил, морфолино или С 6-10 арилкарбонил), N-пирролилсульфонил, N-пиперидинилсульфонил, N-пирролидинилсульфонил, N-дигидропиридилсульфонил,N-индолилсульфонил, в которых указанный гетероциклический цикл может быть необязательно замещен одной или двумя группами гидрокси, С 1-8 алканоилокси, С 1-6 алкокси, С 6-10 арилокси, амино, моно- и ди-С 1-6 алкиламино, С 1-8 алканоиламино, С 1-4 алкил, С 3-7 циклоалкил, С 6-10 арил, С 6-10 ар(С 1-4)алкил, гетероциклом, гетероциклоалкил, карбокси-(С 1-6)алкил, С 1-4 алкоксикарбонил(С 1-4)алкил, циано(С 2-6)алкил, гидрокси(С 2-6)алкил, С 1-4 алкокси(С 2-6)алкил, моно- и ди(С 1-4)алкиламино(С 2-6)алкил, карбокси, С 1-6 алкоксикарбонил, карбоксамидо, формил, С 1-6 алканоил, С 6-10 ароил, С 6-10 ар(С 1-4)алканоил,сульфонил, С 1-6 алкилсульфонил, С 1-6 алкоксисульфонил, сульфонамидо, фосфонил, фосфорамидо или фосфинил;R2 и R3 - водород или С 1-4 алкил или R2 и R3 могут быть объединены с образованиемR7, R8, R11 и R12 независимо представляют собой водород, С 1-6 алкил, С 2-10 гидроксиалкил или С 2-10 карбоксиалкил или R7 и R8 объединены с образованием -(СН 2)y-, где у равно нулю, 1 или 2, в то время как R11 и R12 определены выше; или R7 и R12 объединены с образованием-(СН 2)q-, где q равно нулю (связь) или 1, 2 или 3,в то время как R8 и R11 определены выше; или R8 и R11 объединены с образованием-(СН 2)r-, где r равно 2, 3 или 4, в то время как R7 и R12 определены выше;R10 в каждом случае независимо обозначает водород, С 1-4 алкил, С 2-4 гидроксиалкил, С 2-4 карбоксиалкил, С 2-4 аминоалкил, диметиламиноn равно от нуля до 4, m равно нулю, 1, 2 или 3. 11 Фрагмент -Z-R1 в формуле I присоединен к бензольному кольцу в положении орто-, метаили пара- по отношению к Y, причем предпочтительным является мета-положение. Предпочтительными соединениями согласно изобретению являются соединения формулы I, где Y является двухвалентным кислородом (-O-), -NR10- или ковалентной связью, наиболее предпочтительно -О- и Z является одной из групп: -SO2NR10-, -SO2O- или -CH2O-, наиболее предпочтительно -SO2O-. Предпочтительными соединениями согласно изобретению являются соединения формулы I, где R1 обозначает С 1-12 алкил, особенно С 3-8 алкил, С 4-7 циклоалкил, С 2-8 алкенил, С 2-8 алкинил или С 6-14 арил, в частности, C6-10 арил, каждый из которых не обязательно может быть замещен. Необязательные заместители остаткаR1 включают одну или более групп, предпочтительно одну или две из следующих групп: гидрокси, нитро, трифторметил, галоген, алкокси,аралкокси, аминоалкокси, аминоалкил, гидроксиалкил, гидроксиалкокси, алкоксиалкокси,моно- и диалкиламиноалкокси, циано, арил,амино, моноалкиламино, диалкиламино, карбокси, карбоксиалкил, карбоксиалкокси, моно(гидроксиалкил)амино, бис(гидроксиалкил)амино, моно(карбоксиалкил)амино, бис(карбоксиалкил)амино, алкоксикарбониламино, алкоксикарбонил, аралкоксикарбонил, алкенилкарбонил,алкинилкарбонил, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, арилсульфонил,аралкилсульфонил, алкилсульфинил, алкилсульфонамидо, арилсульфонамидо, аралкилсульфонамидо, амидино, гуанидино, алкилиминоамино, формилиминоамино, трифторметокси,перфторэтокси или аминосульфонильную группу R13R14NSO2-, где R13 и R14 определены выше. Дополнительные заместителями фрагментов R1(арила, циклоалкила, алкенила, алкинила и аралкила) являются один или более, предпочтительно один или два алкильных остатка. Предпочтительными заместителями R1 (по выбору) являются гидрокси, нитро, трифторметил, галоген, С 1-6 алкил, С 1-6 алкокси, С 1-6 аминоалкил, С 6-10 арил, С 6-10 ар(С 1-6)алкокси, бифенил(С 1-6)алкокси, С 1-6 аминоалкокси, амино, моно(С 1-4)алкиламино, ди(С 1-4)алкиламино, С 2-6 алкоксикарбониламино, С 2-6 алкоксикарбонил,карбокси, С 1-6 гидроксиалкил, С 2-10 моно(карбоксиалкил)амино, биc(C2-10 карбoкcиaлкил)aминo,С 6-14 ар(С 1-6)алкоксикарбонил, С 2-6 алкинилкарбонил, С 1-6 алкилсульфонил, С 6-10 арилсульфонил,С 2-6 алкенилсульфонил, С 2-6 алкинилсульфонил,С 1-6 алкилсульфинил,С 1-6 алкилсульфонамидо,амидино, гуанидино, С 1-6 алкилиминоамино,формилиминоамино, С 2-6 карбоксиалкокси, карбоксиалкиламино, циано, трифторметокси и перфторэтокси группами. Дополнительными предпочтительными необязательными заместителями остатка R1 являются С 1-6 алкилсульфонил, С 6-10 арилсульфо 002740R14 независимо выбирают из группы, включающей водород, С 1-6 алкил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, С 6-10 арил, С 6-10 ар(С 1-4)алкил, пиридил, пиридил(С 1-4)алкил, карбокси С 1-4 алкоксикарбонил(С 1-4)алкил,(С 1-6)алкил,циано(С 2-6)алкил,гидрокси(С 2-6)алкил,С 1 алкоксиN-морфолиносульфонил, N-пиперазинилсульфонил (N' необязательно замещен следующими группами: С 1-6 алкил, С 1-6 гидроксиалкил, С 6-10 арил, С 6-10 арил(С 1-6)алкил, С 1-6 алкилсульфонил, С 6-10 арилсульфонил, С 1-6 алкилкарбонил, морфолино или С 6-10 арилкарбонил), N-пирролилсульфонил, Nпиперидинилсульфонил, N-пирролидинилсульфонил, N-дигидропиридилсульфонил, N-индолилсульфонил, в которых указанный гетероциклический цикл может быть необязательно замещен одной или двумя гидрокси, С 1-8 алканоилокси, С 1-6 алкокси, С 6-10 арилокси, амино, монои диС 1-6 алкиламино, С 1-8 алканоиламино, С 1-4 алкил, С 3-7 циклоалкил, C6-10 арил, С 6-10 ар(С 1-4) алкил, гетероциклом, гетероциклоалкил, карбокси(С 1-6)алкил, С 1-4 алкоксикарбонил(С 1-4)алкил, циано(С 2-6)алкил, гидрокси(С 2-6)алкил, С 1-4 алкокси(С 2-6)алкил, моно- и ди(С 1-4)алкиламино(С 2-6)алкил, карбокси, С 1-6 алкоксикарбонил, карбоксамидо, формил, С 1-6 алканоил,С 6-10 ароил, С 6-10 ар(С 1-4)алканоил,сульфонил,С 1-6 алкилсульфонил,С 1-6 алкоксисульфонил,сульфонамидо, фосфонил, фосфорамидо или фосфинильной группой. Дополнительной предпочтительной группой соединений являются соединения формулыI, где R1 - гетероарил или замещенный гетероарил. Предпочтительные гетероарильные группыR1 включают пиридил, пиразолил, тиофенил,хроменил, бензоксазолил, бензтиадиазолил, хиназолинил, хинолинил, изохинолинил и тетрагидрохинолинил, причем наиболее предпочтительными являются тиофенил, хиназолинил,хинолинил и тетрагидрохинолинил и особенно предпочтительными являются тиофенил, изохинолинил и хинолинил. Предпочтительные соединения, в которых R1 является замещенным гетероарилом, включают соединения с одной из перечисленных предпочтительных гетероарильных групп, в которой имеются один или более,предпочтительно один или два заместителя, перечисленных в предыдущем абзаце. Если R1 является замещенным гетероарилом, имеющим один или более заместителей, предпочтительно от одного до трех заместителей, то предпочтительные заместители независимо выбирают из следующих: галоген, С 1-6 алкил, С 1-6 алкокси, 13 амидино, гуанидино, карбоксиалкокси, карбоксиалкиламино, амино, моно(С 1-6)алкиламино и/или ди(С 1-6)алкиламино. В качестве R1 можно использовать фенил,хлорфенил, иодфенил, дихлорфенил, бромфенил, трифторметилфенил, метилсульфонилфенил, ди(трифторметил)фенил, метилфенил,трет-бутилфенил, метоксифенил, диметоксифенил, гидроксифенил, карбоксифенил, аминофенил, метиламинофенил, н-бутиламинофенил,амидинофенил, гуанидинофенил, формилиминоаминофенил, ацетимидоиламинофенил, метоксикарбонилфенил,этоксикарбонилфенил,карбоксиметоксифенил, нафтил, гидроксинафтил, циклогексил, циклопентил, 2-пропилбутил,5-хлор-2-метоксифенил, 2-цианофенил, 2-(Nгидрокси)аминофенил,2-(4-бифенилметокси) фенил, 2-(3-бифенилметокси)фенил, бензил, 3(6-(2,3-дигидро-1,1-диоксобензо[b]тиофенфенил, 2-(фенилсульфонил)фенил, 2,4-бис(метилсульфонил)фенил и 2-хлор-4-метилсульфонил фенил. В качестве дополнительных R1 можно использовать 8-хинолинил, 5-метил-8-хинолинил, 4-бензо-2,1,3-тиадиазолил, 5-хлор-2-тиофенил, 5-хлор-1,3-диметил-4-пиразолил, пиридил, изохинолинил и тетрагидрохинолинил. Если R1 является фенильной группой, замещенной R13R14NSO2-, то в качестве R1 можно использовать 2-(N-метилфенэтиламиносульфонил)фенил, бис(2-метоксиэтил)аминосульфонилфенил,2-N-метил-(3,4-диметоксифенил) этиламиносульфонилфенил, N-метил-N-(этоксикарбонилметил)аминосульфонилфенил,2-(Nметил-N-(2-(2-пиридил)этил)аминосульфонил) фенил, 2-(N-пропил-N-(2-(2-пиридил)этил)аминосульфонил)фенил, 2-(N-этил-N-(4-пиридилметил)аминосульфонил)фенил, 2-(N-метил-N-(4 метоксифенил)аминосульфонил)фенил,2-(Nметил-N-(4-метоксикарбонилфенил)аминосульфонил)фенил,2-(N-(2-цианоэтил)-N-(3-пиридилметил)аминосульфонил)фенил, 2-(N,N-бис(2-цианоэтил)аминосульфонил)фенил, 2-(N-(2 этоксикарбонилэтил)-N-бензиламиносульфонил)фенил, 2-(N-метил-N-(2-(4-пиридил)этил) аминосульфонил)фенил, 2-(N-(этоксикарбонилметил)-N-(2-пиридилметил)аминосульфонил) фенил, 2-(N,N-бис-(этоксикарбонилметил)аминосульфонил)фенил, 2-(N,N-бис-(карбоксиметил)аминосульфонил)фенил, 2-(N-метил-N-(4 карбоксифенил)аминосульфонил)фенил, 2-(N(2-карбоксиэтил)-N-бензиламиносульфонил) фенил, 2-(N-(2-цианоэтил)-N-(2-фуранилметил) аминосульфонил)фенил, 2-(N-этил-N-(1-бензил 3-пирролидинил)аминосульфонил)фенил, 2-(Nбензил-N-(2-(N,N-диметиламино)этил)аминосульфонил)фенил,2-(N-метил-N-(1-метил-4 пиперидинил)аминосульфонил)фенил,2-(Nметил-N-(3-пиридилметил)аминосульфонил) фенил,2-(N-этил-N-(2-(N,N-диметиламино) этил)аминосульфонил)фенил, 2-(2-(4-морфолинил)этиламиносульфонил)фенил, 2-(N-метил-N 002740R1 можно использовать 2-морфолинилсульфонилфенил, 2-(ацетилпиперазинилсульфонил) фенил,2-(4-этилоксикарбонил)пиперидинилсульфонил, 2-(4-карбоксил)пиперидинилсульфонилфенил, 3-этоксикарбонил-1-пиперидиносульфонилфенил, 3-карбоксипиперидиносульфонилфенил, 2-метоксикарбонил-1-пирролидиносульфонилфенил, 2-карбокси-1-пирролидиносульфонилфенил,2-(4-метилсульфонилпиперазин-1-илсульфонил)фенил, 2-(4-(2-пиримидинил)пиперазин-1-илсульфонил)фенил,2-(4 этилпиперазин-1-илсульфонил)фенил, 2-(4-(пиперидин-1-ил)пиперидин-1-илсульфонил)фенил,(2-(4-этоксикарбонилметил)пиперазин-1-илсульфонил)фенил, 2-(4-(карбоксиметил)пиперазин-1-илсульфонил)фенил,2-(4-(2-пиридил)пиперазинилсульфонил)фенил,2-(4-фенилпиперазинилсульфонил)фенил, 2-(4-бензилпиперазинилсульфонил)фенил,2-(4-(2-метоксифенил) пиперазинилсульфонил)фенил,2-(4-метилпиперазинилсульфонил)фенил, 2-(4-(пирролидин 1-ил)пиперидин-1-илсульфонил)фенил и 2-(4 этоксикарбонил-1-пиперазинилсульфонил)фенил. Остальные атомы водорода в бензольном кольце формулы I могут быть заменены на группы R2, R3 и R4 после присоединения остатка-Z-R1. Предпочтительными соединениями являются соединения, где R2, R3 и R4 - независимо водород, С 1-4 алкил, С 4-7 циклоалкил, С 6-14 арил,особенно C6-10 арил, С 6-10 ар(С 1-4)алкил, трифторметил, галоген, гидроксиалкил, циано, нитро,карбоксамид, карбокси, алкоксикарбонил, карбоксиметил, алкоксикарбонилметил или циклоалкилоксикарбонил. В другом варианте R2 и R3, если они присоединены к соседним атомам углерода бензольного кольца, являются -СН=СН-СН=СНили -(CH2)q-, где q равно от 2 до 6 и, таким образом, образуют конденсированный цикл. Предпочтительными общими значениями для R2 и R3 являются -СН=СН-СН=СН-, -СН 2-СН 2-СН 2- и-СН 2-СН 2-СН 2-СН 2-. Если R2 и R3 образуют конденсированный цикл, R4 предпочтительно является водородом. В качестве R2, R3 и R4 можно использовать водород, метил, этил, хлор, бром, трифторметил, гидроксиметил, метокси, этокси, карбоксамид, нитро, фенил, циклопропил, гидрокси, изопропил, метоксикарбонил, этоксикарбонил и бензил. R2 и R3 могут быть также объединены с образованием -СН=СН-СН=СН- или -CH2-CH2CH2- и R4 - водород. 15 Предпочтительными соединениями являются соединения формулы I, где R6 - водород или С 1-6 алкил. Предпочтительными соединениями являются соединения формулы I, где R7, R8, R11 и R12 независимо - водород, С 1-6 алкил, С 6-10 ар(С 1-6) алкил, С 6-10 арил, С 2-10 гидроксиалкил или С 2-7 карбоксиалкил. В качестве R7, R8, R11 и R12 можно использовать водород, метил, этил, пропил, н-бутил, бензил, фенилэтил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 2 карбоксиметил, 3-карбоксиэтил и 4-карбоксипропил. Кроме того, предпочтительными соединениями являются соединения, в которых R7 иR8 объединены с образованием -(СН 2)y-, где у наиболее предпочтительно равно 2. Другой группой предпочтительных соединений являются соединения, в которых R8 и R11 объединены с образованием -(СН 2)r-, где r наиболее предпочтительно равно 2. Предпочтительными соединениями являются соединения формулы I, где R9 - водород или С 1-6 алкил, необязательно замещенный одной, двумя или тремя, предпочтительно одной амино, моноалкиламино, диалкиламино, алкокси, гидрокси, алкоксикарбонил, арилоксикарбонил, аралкоксикарбонил, карбоалкокси, фенил,циано, трифторметил, ацетиламино, пиридил,тиофенил, фурил, пирролил или имидазолильными группами. Подходящие значения R9 включают водород, метил, этил, пропил, н-бутил, бензил, фенэтил, 2-гидроксиэтил, 3-гидроксипропил, 4 гидроксибутил, карбоксиметил и карбоксиэтил. Предпочтительные значения R10 в формулеR в формуле I являются водород, гидрокси, С 1-6 алкил, С 1-6 алкокси, циано или -СО 2Rw, где Rw в каждом случае предпочтительно является одной из следующих групп: С 1-4 алкил, С 4-7 циклоалкил или бензилоксикарбонил. Подходящими значениями Ra, Rb и Rc являются водород, метил,этил, пропил, н-бутил, гидрокси, метокси, эток-СО 2 СН 2 СH3 и си,циано,-СО 2 СН 3,-СО 2 СН 2 СH2 СH3. В наиболее предпочтительном варианте воплощения изобретения каждый изRa, Rb и Rc предпочтительно могут быть также группой -CO2Rw, где Rw002740 16 где Rd-Rh определены выше. Если Ra, Rb и Rc являются -CO2Rw, где Rw представлен одним из указанных остатков, полученные соединения являются пролекарствами, которые обладают свойствами, необходимыми для составления композиций и обеспечения биодоступности. Каждый из Rd, Re и Rg предпочтительно является водородом, Rf - метильной группой и Rh предпочтительно является бензильной и третбутильной группой. Коэффициент n в формуле I предпочтительно равен от 0 до 6, более предпочтительно от 0 до 4, и наиболее предпочтительно 0, 1 или 2. Предпочтительные значения m включают от 0 до 4, наиболее предпочтительно 0, 1, 2 или 3. Было обнаружено, что соединения, имеющие следующие формулы (формулу IIА и формулу IIВ), проявляют исключительно высокую ингибирующую активность по отношению к сериновым протеазам: или их сольват, гидрат, фармацевтически приемлемая соль или пролекарство, где R21 - фенил,нафтил, тиофенил, хинолинил или изохинолинил, необязательно замещенные одним или двумя заместителями, которые независимо выбирают из группы, включающей галоген, С 1-4 алкил, С 1-4 алкокси, метокси, трифторметил,циано, нитро, амино или диметиламино; и еслиR21 является фенильной группой, то указанная фенильная группа необязательно замещена в орто-положении следующими заместителями: С 1-6 алкилсульфонил, С 6-10 арилсульфонил, С 6-10 ар(C1-6)алкилсульфонил,С 6-10 арилсульфонамидо, С 6-10 ар(С 1-6)алкилсульфонамидо, N-морфолиносульфонил или R22R23NSO2-, где R22 иR23 независимо выбирают из группы, включающей водород, С 1-6 алкил, С 3-7 циклоалкил, С 2-6 алкенил, С 2-6 алкинил, С 6-10 арил, С 6-10 ар(С 1-4)алкил, пиридил, пиридил(С 1-4)алкил, карбокси(С 1-6)алкил,С 1-4 алкоксикарбонил(С 1-4)алкил,циано(С 2-6)алкил, гидрокси(С 2-6)алкил, С 1-4 алкокси(С 2-6)алкил, моно- и ди(С 1-4)алкиламино(С 2-6) алкил или R22 и R23 могут быть объединены с атомом азота, к которому они присоединены с образованием гетероциклического цикла, который выбирают из группы, включающей Nморфолиносульфонил,N-пиперазинилсульфонил(N' необязательно замещен следующими группами: С 1-6 алкил, С 1-6 гидроксиалкил, C6-10 арил, С 6-10 арил(C1-6)алкил, С 1-6 алкилсульфонил,С 6-10 арилсульфонил, С 1-6 алкилкарбонил, морфолино или С 6-10 арилкарбонил), N-пирролилсульфонил, N-пиперидинилсульфонил, N-пирроли 17 динилсульфонил, N-дигидропиридилсульфонил,N-индолилсульфонил, в которых указанный гетероциклический цикл может быть необязательно замещен одной или двумя гидрокси, С 1-8 алканоилокси, С 1-6 алкокси, С 6-10 арилокси, амино, моно- и ди-С 1-6 алкиламино, С 1-8 алканоиламино, С 1-4 алкил, С 3-7 циклоалкил, С 6-10 арил, С 6-10 ар(С 1-4)алкил, гетероцикло, гетероциклоалкил,карбокси(С 1-6)алкил, С 1-4 алкоксикарбонил(С 1-4) алкил, циано(С 2-6)алкил, гидрокси(С 2-6)алкил,С 1-4 алкокси(С 2-6)алкил, моно- и ди(С 1-4)алкиламино(С 2-6)алкил, карбокси, С 1-6 алкоксикарбонил, карбоксамидо, формил, С 1-6 алканоил,С 6-10 ароил, С 6-10 ар(С 1-4)алканоил, сульфонил,С 1-6 алкилсульфонил,С 1-6 алкоксисульфонил,сульфонамидо, фосфонил, фосфорамидо или фосфинил;R29 - водород или С 1-4 алкил. Предпочтительными или подходящими значениями для R21 являются значения, определенные выше для R1; Y' предпочтительно является О; а предпочтительно равно 1 и X' предпочтительно О или NH. Конкретными соединениями, включенными в область изобретения, являются следующие: 3-[3-(2-хлорфенилсульфонилокси)-5-метилфенокси]пропоксигуанидин; 3-[3-(2-метоксифенилсульфонилокси)-5 метилфенокси]пропоксигуанидин; 3-[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксигуанидин гидрохлорид; 3-[3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид; 3-[3-(5-хлортиофенил-2-сульфонилокси)-5 метилфенокси]пропоксигуанидин гидрохлорид; 3-[3-(2-цианофенилсульфонилокси)-5 метилфенокси]пропоксигуанидин гидрохлорид; 3-[3-(5-изохинолинилсульфонилокси)-5 метилфенокси]пропоксигуанидин гидрохлорид; 3-[5-метил-3-[2-(метилсульфонил)фенилсульфонилокси]фенокси]-пропоксигуанидин гидрохлорид; 3-[5-метил-3-(1,2,3,4-тетрагидрохинолинил-8-сульфонилокси)фенокси]пропоксигуанидин ацетат; уксусно-кислая соль 3-[5-гидроксиметил 3-(хинолинил-8-сульфонилокси)фенокси]пропоксигуанидина; 1-5-метил-3-(2-метилсульфонилфенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин гидрохлорид; 1-5-метил-3-(2-цианофенилсульфонилокси)фенокси]метил]циклопропилметоксигуанидин ацетат;[3-[3-(2-цианофенилсульфонилокси)-5 метилфенокси]пропиламино]гуанидин ацетат; а также фармацевтически приемлемые соли указанных соединений, например гидрохлориды и ацетаты. Структуры указанных соединений представлены на схемах, представленных до формулы изобретения. Другим вариантом воплощения настоящего изобретения являются соединения формулыI, в которых две "R" группы объединены с образованием насыщенного или ненасыщенного углеводородного мостика, таким образом, в полученном соединении образуется дополнительный циклический фрагмент. Другим вариантом воплощения изобретения являются соединения формулы I, где Z, R1-R4, Y, m и n определены выше и А. R7 и R12 объединены с образованием-(СН 2)o, где о равно 1, 2 или 3, R11 - водород,алкил, аралкил, арил, гидроксиалкил или кар 002740 где, R1-R4, Z, Y, R6-R12, Ra-Rc, n, m, о, р, r и s определены выше. Предпочтительные значения этих переменных аналогичны определенным для формулы I. Конкретные соединения, соответствующие указанным формулам, включают: Следует также отметить, что настоящее изобретение включает как стереоизомеры, так и оптические изомеры, например, как смеси энантиомеров, так и индивидуальные энантиомеры и диастереомеры, которые образуются вследствие структурной ассиметрии в некоторых соединениях представленных серий. Соединения формулы I также могут быть в виде сольватов, особенно в виде гидратов. Гидратирование может произойти в процессе получения соединений или композиций, содержащих соединения, или гидратирование может произойти вследствие гигроскопичности самих соединений. Некоторые соединения формулы I являются производными, названными пролекарством. Термин "пролекарство" означает производное известного лекарства прямого действия, причем указанное производное обеспечивает более эффективную доставку и обладает высокими терапевтическими свойствами по сравнению с исходным лекарством: в организме пролекарства транформируются в активные лекарства за счет ферментативных или химических реакций; см. статью Notari R.E. "Theory and Practice of Prodrug Kinetics" (Теория и практика изучения кинетики пролекарств), в ежегоднике Methods inChemical Еntites" (Создание пролекарств: биообратимых производных для различных функциональных групп и химических форм) в книгеDesign of Prodrugs (под ред. H. Bundgaard), Elsevier, New York (1985). В качестве пролекарств используют соединения, в которых Ra, Rb и/илиRc являются -CO2Rw, где Rw определено выше. См. патент США N 5466811 и статью Saulnier и др. в журнале Bioorg. Med. Chem. Lett. 4: 19851990 (1994). Термин "алкил" используется в данном тексте как для обозначения отдельной группы,так и для обозначения части другой группиров 002740 24 ки, относящейся к радикалам с линейной или разветвленной цепью, включающей до 12 углеродных атомов, например, метил, этил, пропил,изопропил, бутил, трет-бутил, изобутил, пентил,гексил, изогексил, гептил, 4,4-диметилпентил,октил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил. Термин "алкенил" используется для обозначения радикалов с линейной или разветвленной цепью из 2-20 углеродных атомов, если длина цепи специально не ограничена, включающих, но не ограничиваясь, этенил, 1 пропенил, 2-пропенил, 2-метил-1-пропенил, 1 бутенил, 2-бутенил и т.п. Предпочтительно акенильная цепь включает 5-10 атомов углерода,более предпочтительно 2-8 атомов углерода,наиболее предпочтительно 2-4 атома углерода. Термин "алкинил" используется для обозначения радикалов с линейной или разветвленной цепью из 2-20 углеродных атомов, если длина цепи специально не ограничена, в которой имеется, по крайней мере, одна тройная связь между двумя углеродными атомами в цепи, включающих, но не ограничиваясь, ацетилен, 1-пропилен, 2-пропилен и т.п. Предпочтительно акинильная цепь включает 5-10 атомов углерода, более предпочтительно 2-8 атомов углерода, наиболее предпочтельно 2-4 атома углерода. Во всех случаях, где в качестве заместителя выступают алкенильная или алкинильная группы, ненасыщенная связь, в том числе виниленовая или ацетиленовая предпочтительно связана с атомом азота, кислорода или серы опосредованно. Термин "алкокси" используется для обозначения радикала с линейной или разветвленной цепью из 1-20 углеродных атомов, если длина цепи специально не ограничена, связанной с атомом кислорода, включая, но не ограничиваясь группами метокси, этокси, н-пропокси,изопропокси и т.п. Предпочтительно алкокси группа включает 1-10 атомов углерода, более предпочтительно 1-8 атомов углерода. Термин "арил" используется как для обозначения отдельной группы, так и для обозначения части другой группировки, относящейся к моноциклическим или бициклическим ароматическим группам, содержащим в циклическом фрагменте от 6 до 12 атомов углерода, предпочтительно 6-10 атомов углерода, например, фенил, нафтил или тетрагидронафтил. Термин "гетероарил" используется для обозначения групп, имеющих в цикле от 5 до 14 атомов, при этом 6, 10 или 14 электронов находятся в области цикла, и содержащих углеродные атомы и 1, 2 или 3 гетероатома кислорода, азота или серы (примерами гетероарильной группы являются: тиенил, бензо[b]тиенил, нафто[2,3-b]тиенил, тиантренил, фурил, пиранил,изобензофуранил, бензоксазолил, хроменил,ксантенил, феноксатиинил, 2H-пирролил, пир 25 ролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, 3 Н-индолил, индолил, индазолил, пуринил, 4 Н-хинолизинил, изохинолил,хинолил, фталазинил, нафтиридинил, хиназолинил, циннолинил, птеридинил, 4 Н-карбазолил,карбазолил, -карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил, изоксазолил,фуразанил, и феноксазинильная группы). Термин "аралкил" или "арилалкил" используется как для обозначения отдельной группы, так и для обозначения части другой группировки, относящейся к С 1-6 алкильным группам, как указано выше, имеющим арильный заместитель, такой как бензил, фенилэтил или 2 нафтилметил. Термин "циклоалкил" используется как для обозначения отдельной группы, так и для обозначения части другой группировки, относящейся к циклоалкильным группам, содержащим 3-9 атомов углерода. Типичными примерами являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и циклононил. Термин "алкокси" относится к любой из указанных выше алкильных групп, связанных с атомом кислорода. Термин "галоген" или "гало" используется как для обозначения отдельной группы, так и для обозначения части другой группировки,включающей хлор, бром, фтор или иод, предпочтительно хлор. Термин "моноалкиламин" используется как для обозначения отдельной группы, так и для обозначения части другой группировки,относящейся к аминогруппе, имеющей в качестве заместителя алкильную группу из 1-6 углеродных атомов. Термин "диалкиламин" используется как для обозначения отдельной группы, так и для обозначения части другой группировки, относящейся к аминогруппе, имеющей в качестве заместителей две алкильных группы, каждая из которых включает 1-6 углеродных атомов. Термин "гидроксиалкил" относится к указанным ранее алкильным группам, имеющим одну или более гидроксильных групп. Термин "карбоксиалкил" относится к указанным ранее алкильным группам, имеющим одну или более карбоксильных групп. Термин "гетероциклический" используется для обозначения насыщенной или полностью/частично ненасыщенной 3-7-членной моноциклической или 7-10-членной бициклической системы, которая включает атомы углерода и от одного до четырех гетероатомов независимо выбранных из группы, включающей О, N,S, причем гетероатомы азота и серы могут быть необязательно окислены, а атом азота может присутствовать в виде четвертичного основа 002740 26 ния, и включающими любую бициклическую группировку, в которой любая из вышеуказанных гетероциклических систем может быть сконденсирована с бензольным кольцом, и где гетероциклические кольца могут иметь заместители по атомам углерода или азота при условии образования устойчивого соединения. Наиболее подходящими являются кольца, содержащие один атом кислорода или серы, от одного до трех атомов азота, или один атом кислорода или серы в сочетании с одним или двумя атомами азота. Примерами таких гетероциклических группировок являются пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2 оксопирролодинил, 2-оксоазепинил, азепинил,пирролил, 4-пиперидонил, пирролидинил, пиразолил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил,хинуклидинил, изотиазолидинил, индолил, хинолинил, изохинолинил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензоксазолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон и оксадиазолил. Группа морфолино идентична морфолинилу. Термин "гетероатом" используется для обозначения атома кислорода ("О"), атома серы("S"), или атома азота ("N"). Следует иметь ввиду, что гетероатом азота может присутствовать в виде фрагмента NRyRz, где Ry и Rz независимо друг от друга являются атомом водорода илиC1-C8 алкил, или вместе с атомом азота, к которому они присоединены, образуют насыщенное или ненасыщенное 5-, 6- или 7-членное кольцо. Другим предметом настоящего изобретения является способ получения производного аминогуанидина формулы I, заключающийся во взаимодействии аминогуанидина формулы VII где R6, Ra, Rb и Rc определены ранее, с карбонил содержащим соединением формулы VIII где R1-R4, Z, Y, n, m, R7, R8, R11 и R12 определены выше, с образованием амидиногидразона, и последующего избирательного восстановления двойной связи между атомом углерода и азота в молекуле амидиногидразона. Аминогуанидин обычно выпускается в виде соли, предпочтительно нитрата. Первая стадия проводится при комнатной температуре с использованием спирта в качестве растворителя. 27 К реакционной смеси прибавляют кислоту, например 4 н. НСl в диоксане. Более полно условия реакции приведены в тексте заявки. Другим предметом настоящего изобретения является способ получения производного гидроксигуанидина формулы I, заключающийся во взаимодействии алкоксиамина формулы IX где R1-R4, Z, Y, n, m, R7, R8, R11 и R12 определены ранее, с реагентом, способствующим образованию гуанидильной группировки. Предпочтительным реагентом являются аминоиминосульфоновые кислоты, необязательно замещенные 1 Н-пиразол-1-карбоксамидины или N,N'бис(трет-бутоксикарбонил) S-метил изотиомочевина. Изобретение также относится к алкоксиамино промежуточным соединениям, которые могут быть использованы для синтеза ингибиторов протеаз формулы I. Эти промежуточные соединения представлены формулой IX, где R1-R4, Z, Y, n, m, R7, R8, R11 и R12 определены выше для формулы I. На схемах Ia, Ib и Ic представлены стадии синтеза с образованием соединений настоящего изобретения, где R1-Z является R1-C(RyRz)2Oили R1-SO2O-. Схема Ia иллюстрирует, но не ограничивает, получение соединений согласно примерам 1-8, 10-18, 21-22, 28-33 и 82-86. Схема Ia Фенолы 1 (где Рa = Н) переводят в моносульфонаты путем обработки подходящими сульфонилхлоридами. Предпочтительные условия включают обработку фенола 1 сульфонилхлоридом в двухфазной системе из органического растворителя, например, этилового эфира и водной фазы, представляющей собой насыщенный раствор NаНСО 3. В альтернативном варианте вначале проводится депротонизация 1 с помощью эквивалентного количества сильно 002740N,N-диметилформамиде или тетрагидрофуране,а затем последующая обработка депротонированного фенола сульфонилхлоридом. В другом варианте методики фенол 1 в обычном органическом растворителе, например в дихлорметане,превращают в 2 путем обработки сульфонилхлоридом в присутствии азотистого основания,например 4-метилморфолина. Гидроксильная группа в фенолах 1 может быть защищена различными известными в уровне техники защитными группировками (Рa защитная группировка), например, может быть представлена сложным эфиром или простым бензиловым эфиром (Greene, T.W. and Wuts,P.G.M., в книге Protective Groups in OrganicNew York (1991. Снятие защиты проводится в условиях хорошо известных специалистам. Например, отщепление бензильной группы проводят путем каталитического гидрогенолиза в присутствии катализатора палладия на угле в таких растворителях, как этанол и тетрагидрофуран. Отщепление ацетильной группы проводят путем гидролиза основаниями, предпочтительно гидроксидом натрия в водном тетрагидрофуране. Фенолы 2 конденсируют с соединением 3(где L = ОН) по методу Мицунобу (Mitsunobu,О., в журнале Synthesis 1 (1981, где Рb в 3 подходящая гидроксил защитная группа. В реакции Мицунобу могут использоваться и подходящие диолы (Рb = Н). Предпочтительные условия реакции включают присутствие триалкилфосфина или триарилфосфина, например,трифенилфосфина или три-н-бутилфосфина, в подходящем растворителе, например в тетрагидрофуране или дихлорметане, и азодикарбонильного реагента, например азодикарбоксилата или 1,1'-(азодикарбонил)дипиперидина. Типичные Рb (где Рb - гидроксилзащитная группа) хорошо известны специалистам, например, это сложные эфиры или простые бензиловые эфиры(см. в книге Greene, T.W. and Wuts, P.G.M.). Когда L представлена отщепляемой реактивной группой, такой как галоид или сульфонат, фенол 2 обрабатывают основанием, таким как гидрид натрия, в растворителе, например в N,Nдиметилформамиде, а затем вводят в реакцию с соединением 3. Отщепление Рb обычно проводят в условиях, хорошо известных специалистам. Например, отщепление бензильной группы проводят путем каталитического гидрогенолиза в присутствии катализатора палладия на угле в таких растворителях, как этанол и тетрагидрофуран. Отщепление ацетильной группы проводят путем гидролиза основаниями, предпочтительно гидроксидом натрия в водном тетрагидрофуране. Спирт 4 может быть получен по альтернативной методике путем восстановления соот 29 ветствующего альдегида или кетона 7 (полученного из 2 как указано далее) подходящим восстанавливающим агентом, например боргидридом натрия или лития (Wallbridge, J., в журналеProg. Inorg. Chem. 11:99-231 (1970. Спирт 4 превращают в соединение 9 по реакции Мицунобу с производным N-гидроксициклоимида, например N-гидроксифталимидом. Снятие фталимидной защитной группы проводится в стандартных условиях (см. в книгеGreene, T.W. and Wuts, P.G.M.), например, боргидридом натрия в смеси с соответствующим спиртом (в том числе, этанол или 2 пропанол)/вода с последующим подкислением. Отщепление защитной группы может также проводиться с помощью гидразина или метиламина. Гуанидинилирование образующегося алкоксиамина с образованием соединения 10 проводится с помощью стандартных реагентов, например аминоиминосульфоновой кислоты(Miller, A.E. and Bischoff, J.J. в журнале Synthesis 777(1986, солянокислого 1 Н-пиразол-1 карбоксамидина (Bernatowicz, M.S. и др. в журнале J. Org. Chem. 57(8):2497 (1992, или замещенных гуанидилинирующих реагентов, таких как N,N'-бис(трет-бутоксикарбонил)-S-метилизотиомочевина (Bergeron, R.J. and McManis,J.S., в журнале J.Org.Chem. 52:1700(1987 илиN-Ra, N-Rb, N'-Rc-1H-пиразол-1-карбоксамидин,где Ra, Rb и Rc определены ранее согласно формуле I. Подходящие 1 Н-пиразол-1-карбоксамидины включают N,N'-бис(трет-бутоксикарбонил)-1 Н-пиразол-1-карбоксамидин и N,N'бис(трет-бензилоксикарбонил)-1 Н-пиразол-1 карбоксамидин (эти соединения могут быть синтезированы согласно Bernatowicz, M.S. и др.,в журнале Tetrahedron Letters 34:3389(1993. Конверсия спирта 4 в соответствующий альдегид или кетон 7 проводится по обычным методикам окисления спиртов (см. напримерOrganic Chemistry, Part B: Reactions and Synthesis, 3-ье издание, Plenum Pres, New York (1990,таким как окисление по Сверну (Mancuso, A.J. и др., в журнале Journal of Organic Chemistry 3329and Suggs, J.W., в журнале Tetrahedron Letters 2647 (1975, пиридиний бихроматом (Corey,E.J. and Schmidt,G., в журнале Tetrahedron Letters 399 (1979, или комплексом пиридин+трехокись серы/диметилсульфоксид (в журнале Tetrahedron Letters 28:1603 (1987. По альтернативной методике соединение 2 может быть конденсировано непосредственное соединением 5, где L= ОН или отщепляемая группировка, такая как галоид, алкилсульфонат или арилсульфонат. В случае, если L= ОН может использоваться конденсация Мицунобу. В случае, когда L- реактивная отщепляемая группировка, например галоид или сульфонат, фенол 2 может быть обработан основанием, на 002740 30 пример гидридом натрия, в растворителе, например N,N'-диметилформамиде, а затем введен в реакцию с соединением 5. Альтернативно, фенол 2 может быть конвертирован в соединение 7 по реакции Мицунобу с участием соединения 6, где L= ОН, а Рc хорошо известная защитная группа по альдегидной и кето группе (см. в книге Greene, T.W.and Wuts, P.G.M.), например диметилкеталь или ацеталь, 1,3-диоксолановая группа или 1,3 диоксановая группа. В другом варианте, когда L в соединении 6 отщепляемая группа, например галоид или сульфонат, фенол 2 может быть обработан основанием, таким как гидрид натрия, в растворителе, например N,N-диметилформамиде, а затем введен в реакцию с соединением 6. Для получения соединения 7 Рc отщепляют в стандартных условиях хорошо известных специалистам, например, п-толуолсульфокислотой в ацетоне (см. в книге Greene, T.W. and Wuts,P.G.M.). Затем соединение 7 превращают в амидиногидразон 8 в стандартных условиях, например путем взаимодействия с аминогуанидином, например аминогуанидином или 2-гидразиноимидазолином, необязательно в присутствии кислоты, например азотистой, соляной, бромисто-водородной, в подходящем растворителе,например этаноле или метаноле, который дополнительно может содержать другие растворители, такие как дихлорметан или тетрагидрофуран. Конверсию амидиногидразона 8 в соединение 11 проводят в восстанавливающих условиях хорошо известных специалистам, например,боргидридом лития в подходящем растворителе,например в тетрагидрофуране или метаноле,при различной температуре вплоть до кипячения с обратным холодильником. В качестве альтернативного метода может использоваться каталитическое гидрирование в присутствии палладия на угле. Защитные группы Rа, Rb и/или Rc, например, трет-бутилоксикарбонильную (БОК) необязательно отщепляют путем обработки кислотой,обычно трифторуксусной в подходящем растворителе, например дихлорметане или воде, или газообразным НСl, растворенным в подходящем растворителе, например 1,4-диоксане. Схема Ib 31 Вариант схемы Ia (схема Ib) включает использование монозащищенных фенолов в синтезах, приведенных в примерах 19-20, 23-26 и 80. Фенолы 1 -монозащищенные соединения (Рa- защитная группировка) с различными защитными группами, известными в уровень техники,например, сложные эфиры и простые бензиловые эфиры (см. в книге Greene, T.W. and Wuts,P.G.M.). Монозащищенные фенолы 1 конденсируют с соединением 3 как указано на схеме Ia. Снятие защитной группы и последующая конденсация Мицунобу с производным Nгидроксиимида, например N-гидроксифталимидом, приведенные на схеме Ia, приводят к образованию алкоксифталимидов 16. Отщепление фталимидной группы по схеме Ia дает алкоксиамин. Соответственно, алкоксиамины конвертируют в необязательно замещенные алкоксигуанидины с использованием стандартных гуанидилирующих реагентов, например аминоиминосульфоновой кислоты (см. Miller, A.E. и Bischoff, J.J., в журнале, цитированном ранее) или солянокислого 1 Н-пиразол-1-карбоксамидина (см. Bernatowicz, M.S.и др., в журнале),или замещенных гуанидилирующих реагентов,таких как N,N'-бис(трет-бутоксикарбонил)-Sметилизотиомочевина (см.Веrgeron, R.J. andMcManis, J.S., в журнале) или N-Ra, N-Rb, N'-Rc1 Н-пиразол-1-карбоксамидины, включая N,N'бис(трет-бутоксикарбонил)-1 Н-пиразол-1-карбоксамидин и N,N'-бис(трет-бензилоксикарбонил)-1 Н-пиразол-1-карбоксамидин (эти соединения могут быть синтезированы согласноBernatowicz, M.S. и др.), где Ra, Rb и Rc определены выше. Фенольная защитная группа Рa может быть отщеплена с образованием соединения 17, а освободившаяся фенольная группа вступает в реакцию с сульфонилхлоридом. По выбору защищенные алкоксигуанидины могут быть алкилированы по незащищенным атомам азота гуанидиновой группы по реакции Мицунобу в присутствии спирта R6OH (в случае метанола продуктом реакции является производное Nметил-алкоксигуанидина). Наконец, защитные группы по гуанидину Ra, Rb, Rc могут быть отщеплены согласно схеме Ia.Perkin II 98 (1973 с вторичными аминами,R13R14NH, в присутствии оснований, например третичных аминов, где R13 и R14 определены ранее, при условии, что оба радикала не являются водородом. Образующаяся соль моносульфоновой кислоты конвертируется в сульфонилхлорид in situ в реакции с одним эквивалентом оксалилхлорида. Образующийся сульфонилхлорид взаимодействует in situ с фенолом 17. Защитные группы гуанидиновой части молекулы, Ra, Rb, Rc, могут быть удалены по выбору как указано на схеме Ia с образованием соединения 19. Соединения в примерах 68-79 синтезированы по альтернативной реакции бензодисульфоангидрида 18 с O-фталимидом 16 (Рa =Н). Образующаяся соль моносульфоновой кислоты конвертируется в сульфонилхлорид in situ в реакции с одним эквивалентом оксалилхлорида. Образующийся сульфонилхлорид взаимодействует с аминами, в частности с первичными и диаминами, с образованием сульфонамидов. Следующим незащищенным и гуанидинилированным соединением, полученным по схеме Ia,является O-амин. Наконец, необязательные защитные группы гуанидиновой части молекулы,Ra, Rb, Rc могут быть удалены как указано на схеме Iа с образованием соединения 19. На схемах IIа и IIb приведен синтез первичных и вторичных сульфонамидофенокси и карбоксамидных производных, где R1-Z- является R1-SO2NR10- или R1-CONR10-. На схеме IIа приведен синтез промежуточных 1,3-аминофенолов, которые затем конвертируются в сульфонамидофенокси производные, где R1-Z является R1-SO2NR10-, a R10 является предпочтительно алкильной группой, представленной в примере 81, или по альтернативному пути переводятся в карбоксамидофеноксипроизводные, где R1-Z является R1-CONR10-. Фенолы 1 вводят в реакцию с 2-бром-2 метилпропанамидом в присутствии основания,например гидрида натрия, в высококипящем растворителе, например 1,3-диметил-3,4,5,6 тетрагидро-2(1 Н)-пиримидиноне, при повышенной температуре (например, при 100 С в течение 3 ч) и подвергают перегруппировке Смайла в анилиды 21 (CottsSouthcott, в журналеJ.Chem.Soc.PT 1 767 (1990. Для получения соответствующих анилинов 22 анилиды 21 гидролизуют сильным основанием при повышенной температуре (например, 10 н. гидроксидом натрия при кипячении с обратным холодильником) продолжительное время (например, в течение 2 суток). Анилины 22 конвертируют в сульфонамиды 23 по реакции с сульфонилхлоридами в присутствии подходящего основания, например третичного амина. Сульфонамиды вводят в реакцию с основанием (например,карбонатом цезия) и R10L, где L отщепляемая группа, например галоген или сульфонат. По альтернативной методике анилины 22 конвертируют в карбоксамиды по реакции с ацилхлоридами (R1COCl) в присутствии подходящего основания, например, третичного амина. Альтернативным путем получения карбоксамидов является реакция аналинов 22 с карбоновыми кислотами (R1COOH) в присутствии конденсирующих агентов, используемых в химии пепти 002740 34 дов, например, 1,3-дициклогексилкарбодиимида или реагента Кастро (ВОР) (Castro В., и др., в журнале Tetrahedron Lett. 1219 (1975. Затем фенольную защитную группу Рa отщепляют и полученный фенол конденсируют с соединением 3, как указано на схеме Iа. После отщепления гидроксил защитной группы Рb полученный спирт конденсируют с N-гидроксиимидами, например с N-гидроксифталимидом, как указано на схеме Iа. Отщепление фталимидной группы по схеме Iа приводит к образованию алкоксиамина. Затем алкоксиамины конвертируют в защищенные алкоксигуанидины с использованием стандартных гуанидинилирующих реагентов,приведенных на схеме Iа. Наконец, по выбору отщепляют защитные группировки Ra, Rb и RcIa, как указано на схеме Iа с образованием целевого соединения 27. Схема IIb Альтернативный метод синтеза сульфонамидов, в особенности неалкилированных сульфонамидов (где R10 = Н) приведен на схеме IIb. Нитрофенол 28 конденсируют с соединением 3 по обычной методике. Предпочтительно реакция проводится согласно реакции Мицунобу (где L= ОН). По альтернативной методике фенол вводят в реакцию с основанием, например NaH, в подходящем растворителе, напримерN,N-диметилформамиде или тетрагидрофуране,с последующим добавлением соединения 3 (гдеPb спирт 29 подвергают конденсации Мицунобу с N-гидроксиимидом, например с N-гидроксифталимидом, как указано на схеме Iа. Затем восстанавливают нитрогруппу в соединении 30,например, путем каталитического восстановления над палладием на угле в подходящем растворителе, например этаноле или тетрагидрофуране. Полученное соединение вводят в реакцию с подходящим сульфонилхлоридом (R1SO2Cl) с образованием сульфонамида 31. После этого не обязательно алкилируют сульфонамидную группу как указано на схеме IIа. По альтернативной методике после восстановления нитрогруппы промежуточное соединение обрабатывают подходящим ацилхлоридом (R1COCl), по 35 лучая соответствующий карбоксамид 31. По другому варианту карбоксамиды 31 могут быть получены путем взаимодействия промежуточного продукта после восстановления нитрогруппы с карбоновыми кислотами (R1COOH) в присутствии конденсирующих реагентов, используемых в химии пептидов, таких как 1,3 дициклогексилкарбодиимид или реактив Кастро(ВОР). Удаление O-амин защитной группировки и гуанидинилирование O-амина проводятся, как указано на схеме Ia. Наконец, отщепляют Oгуанидин-защитные группы Ra, Rb и Rc, как указано на схеме Ia, с образованием целевого соединения 32. Схема IIc Соединения согласно настоящему изобретению, где R1-Z является R1-CH(RyRz)NR10- могут быть синтезированы в несколько стадий,приведенных на схеме IIc. Анилин 22 конвертируют в соединение 33, где Rx = Н, путем восстановительного аминирования в присутствии подходящего карбонилсодержащего соединенияR1CORy. Предпочтительным восстанавливающим реагентом является триацетоксиборгидрид тетраметиламмония. Кроме того, восстановление может проводиться триацетоксиборгидридом натрия или цианогидридом натрия. По альтернативной методике восстановительное аминирование может проводиться путем получения имина (основания Шиффа) при взаимодействии амина и карбонильного соединения в присутствии каталитического количества кислоты, например, п-толуолсульфокислоты, с последующим восстановлением боргидридом натрия. По альтернативной методике имин может быть восстановлен путем каталитического гидрирования над палладием на угле в стандартном растворителе, например этаноле. В качестве альтернативы восстановительному аминированию анилин 22 может быть введен в реакцию с R1(RyRx)L,где L - отщепляемая группировка, например галоген или сульфонат. Последующая конверсия соединения 33 в соединение 37, заключающаяся в отщеплении Рa, конденсации с соединением 3, удалении Рb и конденсации с N 002740 36 гидроксиимидом, снятии защитной группы с Oамина, гуанидинилировании и необязательно удалении защитных группировок с гуанидиновой группы, аналогичны подобным стадиям,подробно описанным для конверсии 23 в 27 на схеме IIа. Схема III Кроме того, соединения настоящего изобретения, где Y = NR10, a R1-Z = R1-SO2NR10 или R1-CONR10- могут быть получены по схемеIII. Нитроанилин 38 конвертируют в сульфонамид путем обработки соответствующим сульфонилхлоридом R1SО 2 Сl в присутствии слабого основания, например, третичного амина. Образующийся сульфонамид или карбоксамид могут быть алкилированы по атому азота подходящим алкилирующим агентом R10L как указано на схеме IIа с образованием промежуточного соединения 39. По альтернативной методике 38 обрабатывают подходящим ацилхлоридом(R1COCl) с образованием соответствующего карбоксамида 39. Карбоксамид 39 может быть получен путем взаимодействия соединения 38 с карбоновыми кислотами (R1COOH) в присутствии конденсирующих агентов, таких как 1,3 дициклогексилкарбодиимид или реагент Кастро(ВОР). После восстановления нитрогруппы по схеме IIb образующийся анилин конденсируют с альдегидом 40 предпочтительно в условиях восстановительного аминирования с образованием соединения 41. Предпочтительным восстанавливающим агентом является триацетоксиборгидрид тетраметиламмония. В качестве восстанавливающих реагентов могут быть использованы триацетоксиборгидрид натрия и цианборгидрид натрия. По альтернативной методике восстановительное аминирование может проводиться путем образования имина (основания Шиффа) между амином и карбонилсодержащим соединением в присутствии каталитического количества кислоты, например, птолуолсульфокислоты, и последующего восстановления боргидридом натрия. По другой альтернативной методике имин может быть восстановлен путем каталитического гидрирования над палладием на угле в стандартном растворителе, например этаноле. Наконец, в соответствие со схемой Ia у соединения 41 могут быть удалены O-гуанидин-защитные группировки Ra,Rb и Rc с образованием соединения 42. В качестве альтернативной схемы получения O-фталамидсодержащих промежуточных соединений 9, 16, 26, 31 и 36, соответствующие фенолы 2, 1, 24, 28 и 34 вводят в реакцию в щелочной среде с реагентом 43, содержащим отщепляемую группу L. Эта схема ограничена получением соединений, где R12 является атомом водорода. Реагент 43 получают путем взаимодействия соединения с двумя отщепляемыми группами,L иJ.Chem.Sec.B 1137 (1993. Соединения, в которых Ra и Rc вместе образуют цикл, например имидазолин, могут быть синтезированы по тем же схемам при условии,что вместо аминогуанидина используется имидазолин. Соединения, в которых R7 и R12 или R8 и 12R вместе образуют метиленовый мостик, могут быть синтезированы путем взаимодействия с циклическим кетоном, имеющим реакционноспособную группу L, связанную непосредственно или опосредованно с карбоциклическим фрагментом. Примеры подходящих реагентов включают 2-гидроксициклопентанон, 3-гидроксициклопентанон, 2-гидроксициклогексанон и 3-гидроксициклогексанон. Соединения VI, у которых R6 и Rb вместе с атомом азота, к которому они присоединены,образуют кольцо, получают по приведенным схемам при условии, что вместо гетероциклического амина 12 (см.ниже) в реакции используется аминогуанидин. Соединения V, у которых R9 и Rb вместе с атомом азота, к которому они присоединены,образуют имидазолиновый фрагмент, получают по приведенными схемами при условии, что в реакции вместо 2-гидразиноимидазолина 13 (см. выше) используются аминогуанидины. Для медицинского применения предпочтительны фармацевтически приемлемые кислые 38 аддитивные соли, т.е. такие соли, анион которых не вносит заметный вклад в токсичность или фармакологическую активность органического катиона. Кислые аддитивные соли получают или по реакции органического основания формулы I с органической или неорганической кислотой, предпочтительно в растворе, или с помощью любых стандартных методов, подробно описанных в литературе и доступных практикующему специалисту в данной области. Примерами подходящих органических кислот являются карбоновые кислоты, такие как малеиновая, уксусная, винная, пропионовая, фумаровая,2-гидроксиэтансульфокислота(isethionic), янтарная, коричная, пивалоновая и т.п.; подходящими неорганическими кислотами являются галоидоводородные кислоты, такие как HCl, HBr, HI; серная кислота, фосфорная и т.п. Предпочтительные кислоты для получения кислых аддитивных солей включают соляную и уксусную. Вещества согласно изобретению представляют собой новый класс потенциальных ингибиторов металлосодержащих, кислых, тиоловых и сериновых протеаз. Примеры сериновых протеаз, ингибируемых веществами согласно изобретению, включают эластазу нейтрофильных лейкоцитовв, протеолитический фермент, связанный с патогенезом при эмфиземе; химотрипсин и трипсин, ферменты пищеварительного тракта; панкреатическую эластазу и катепсин G,химотрипсин-подобную протеазу, также ассоциированную с лейкоцитами; тромбин и факторX, протеолитические ферменты системы свертывания крови. Ингибирование термолизина,металлопротеазы и пепсина, кислой протеазы также предусматривает использование соединений настоящего изобретения. Вещества настоящего изобретения предпочтительно применяются для ингибирования трипсин-подобных протеаз. Конечной целью применения веществ, ингибирующих химотрипсин и трипсин, является лечение панкреатита. Для целевого применения активность и другие биохимические параметры ингибирующих свойств веществ настоящего изобретения легко определяются с помощью обычных биохимических методов, хорошо известных специалистам. Фактические дозы целевого применения несомненно зависят от природы и степени тяжести заболевания пациента или животного, подлежащего лечению, в соответствии с данными диагностики. Предполагается,что для достижения эффективного терапевтического результата диапазон доз составляет приблизительно 0,01-10 мг/кг/сутки. Вещества согласно настоящему изобретению, различающиеся по способности ингибировать фактор Ха или тромбин, могут использоваться для различных терапевтических целей. Как ингибиторы фактора Ха или тромбина, вещества настоящего изобретения подавляют об 39 разование тромбина. Следовательно, эти вещества могут использоваться для лечения и профилактики состояний, характеризующихся аномальным венозным или артериальным тромбозом, связанным с образованием или действием тромбина. Эти состояния включают, но не ограничивают область изобретения, глубокий венный тромбоз, обширную внутрисосудистую коагулопатию, которая наступает во время септического шока, вирусных инфекций и развития опухолей; инфаркт миокарда; кровоизлияния; шунтирование коронарной артерии; образование фибрина в глазной ткани; вправление тазобедренного сустава; тромбообразование вследствие тромболитической терапии или чрескожной внутрипросветной коронарной ангиопластики (РСТА). Другие пути применения указанных ингибиторов тромбина включают их использование в качестве антикоагулянтов, включенных или физически связанных с материалами, используемыми в системах для сбора, циркуляции и хранения крови, например катетеров, устройств для диализа крови, шприцов и пробирок, систем циркуляции крови и устройств для реконструкции просветов органов (стентов). Вещества согласно настоящему изобретению могут также использоваться в качестве антикоагулянтов в экстракорпоральных системах циркуляции крови. Показано, что металлические стенты уменьшают повторное сужение просвета органа(рестеноз), но являются тромбогенными. Стратегия снижения тромбогенности стентов заключается в покрытии, обволакивании, адсорбции или ковалентном связывании тромбинингибирующих агентов на поверхности стентов. Для этих целей могут использоваться вещества согласно настоящему изобретению. Вещества согласно настоящему изобретению могут быть привязаны или погружены в водные или биодеградируемые полимеры и после этого нанесены на материал стента. Такие полимеры могут включать поливинилпирролидон, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксидполилизин, замещенные остатками пальмитиновой кислоты, полимолочную и полигликолевую кислоты, сополимеры полимолочной и полигликолевой кислот, полиэпсилон капролактон, полигидроксимасляную кислоту, полиортоэфиры,полиацетали, полидигидрофураны, полицианоакрилаты и гидрогели сшитых или амфипатических блок-сополимеров. См. Европейские заявки 761251, 604022, канадский патент 2164684 и опубликованные заявки РСТ WO 96/11668, WO 96/32143 и WO 96/38136. Благодаря воздействию фактора Ха и тромбина на клетки организма-хозяина, такие как клетки гладких мышц, эндотелиальные клетки и нейтрофилы, вещества согласно настоящему изобретению могут также использо 002740 40 ваться для лечения и профилактики респираторного дистресс-синдрома взрослых (отек легких,ARDS), воспалительных реакций, ранозаживлении, реперфузионных травм, атеросклероза,повторного сужения сосудов (рестеноза) из-за травм при баллоной ангиопластике, атерэктомии и артериальном введении стента. Вещества согласно настоящему изобретению могут использоваться при лечении неоплазии и метастазов, а также при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и Паркинсона. При применении в качестве ингибиторов тромбина или фактора Ха вещества согласно настоящему изобретению могут вводиться в эффективном количестве в дозах приблизительно от 0,1 до 500 мг/кг, предпочтительно между 0,1-10 мг/кг веса тела, по схеме от одной до 2-4 раздельных дневных доз. При применении в качестве ингибиторов тромбина, вещества согласно изобретению могут использоваться в сочетании с тромболитическими агентами, такими например, как тканевой активатор плазминогена, стрептокиназа и урокиназа. Кроме того, вещества согласно настоящему изобретению могут применяться в сочетании с другими антитромботическими или антикоагулянтными препаратами, например,антагонистами фибриногена или антагонистами тромбоксанового рецептора. Эластаза лейкоцитов человека высвобождается полиморфно-ядерными лейкоцитами в очаге воспаления и таким образом является одной из причин ряда болезненных состояний. Предполагается, что вещества согласно настоящему изобретению будут оказывать противовоспалительное действие, важное для лечения подагры, ревматоидного артрита и других воспалительных заболеваний, а также при лечении эмфиземы. Ингибиторное действие соединений согласно настоящему изобретению на лейкоцитарную эластазу определяют методом, описанным ниже. Катепсин G связан с такими заболеваниями как артрит, подагра и эмфизема, а,кроме того, гломерулонефрит и легочная инвазия, вызванная инфекцией легких. При целевом применении ингибиторные свойства соединений формулы I легко определяются стандартными биохимическими методами, хорошо известными специалистам. Ингибиторные свойства веществ согласно настоящему изобретению в отношении катепсина G определяют по следующей методике. Препарат частично очищенного катепсина человека получают по методу Baugh и др., описанному в журнале Biochemistry 15: 836 (1979). Основным источником получения эластазы лейкоцитов и катепсина G (обладающего химотрипсинподобной активностью) являются лейкоцитарные гранулы, которые выделяют после лизиса лейкоцитов. Лейкоцитарные гранулы экстрагируют 0,20 М ацетатом натрия с рН 4,0, получен 41 ный экстракт диализуют против 0,05 М трис буфера с рН 8,0, содержащего 0,05 М NaCl в течение ночи при 4 С. Белковую фракцию, выпадающую в осадок во время диализа, отделяют на центрифуге. В этой фракции содержится большая часть химотрипсин-подобной активности лейкоцитарных гранул. Для каждого фермента готовят специфический субстрат, а именно N-Suc-Аlа-Аlа-Рrо-/al-п-нитроанилид и SucAla-Ala-Pro-Рhе-п-нитроанилид. Последнее вещество не гидролизуется эластазой лейкоцитов. Ферментативную активность определяют в 2,00 мл 0,10 М буфера Хепес с рН 7,5, содержащим 0,50 М NaCl, 10% диметилсульфоксид и 0,0020 М Suc-Ala-Ala-Pro-Рhе-п-нитроаналид в качестве субстрата. За гидролизом субстрата следят по поглощению при 405 нм при 25 С. Дозы применения веществ согласно настоящему изобретению, таких как ингибиторы эластазы нейтрофилов и катепсина G, зависят от природы и степени заболевания, определяемыми путем диагностики. В случае ранее перечисленных заболеваний дозы составляют 0,01-10 мг/кг веса тела/сутки. Вещества согласно настоящему изобретению, ингибирующие урокиназу или активатор плазминогена, потенциально применимы для лечения состояний, связанных с чрезмерным ростом клеток. Например, вещества согласно настоящему изобретению могут применяться для лечения доброкачественной гипертрофии простаты и карциномы простаты, псориаза, а также в качестве средств, вызывающих аборт. Для целевого применения активность и другие биохимические параметры ингибирующих свойств веществ согласно настоящему изобретению легко определяются с помощью обычных биохимических методов, хорошо известных специалистам. Фактические дозы целевого применения несомненно зависят от природы и степени тяжести заболевания пациента или животного, подлежащего лечению, в соответствии с данными диагностики. Предполагается, что для достижения эффективного терапевтического результата диапазон доз составляет приблизительно 0,01-10 мг/кг. Дополнительное применение веществ согласно настоящему изобретению включает определение активности коммерческих препаратов ферментов. Например, химотрипсин поставляется в качестве стандартного реагента для применения в клинических анализах по определению химотрипсина в панкреатическом соке и кале. Такой анализ используется для диагностики желудочно-кишечных и панкреатических заболеваний. Панкреатическая эластаза также поставляется в качестве реагента для определения 1-антитрипсина в плазме. Концентрация 1-антитрипсина возрастает при ряде воспалительных заболеваний, дефицит 1-антитрипсина связан с возрастающей частотой легочных забо 002740 42 леваний. Вещества согласно настоящему изобретению могут применяться для повышения точности и воспроизводимости такого рода анализов при титрометрической стандартизации коммерческих препаратов эластазы. См. патент США 4499082. Наличие протеазной активности в экстрактах при выделении и очистке некоторых белков является постоянной проблемой, которая может осложнить и поставить под сомнение используемые методы выделения. Некоторые протеазы, присутствующие в таких экстрактах, могут быть ингибированы в процессе очистки соединениями согласно настоящему изобретению,которые устойчиво связываются с рядом протеолитических ферментов. Фармацевтические композиции согласно изобретению могут вводиться любым видам животных, что может свидетельствовать о преимуществе соединений настоящего изобретения. Более того, перечень возможных пациентов включает и человека, хотя в задачу изобретения не входило вводить какие-либо ограничения. Фармацевтические композиции согласно изобретению могут вводиться с помощью любых средств, которые соответствуют поставленным задачам. Например, введение может быть парентеральным, подкожным, внутривенным,внутримышечным, внутрибрюшинным, трансдермальным, трансбуккальным (через рот) и др. Альтернативно или одновременно вещества могут вводиться перорально. Вводимая доза будет зависеть от возраста, состояния здоровья,веса реципиента, способа сопутствующего введения, частоты введения и природы ожидаемого эффекта. Кроме фармакологически активных веществ новые фармацевтические препараты могут содержать подходящие фармацевтически приемлемые носители, представляющие собой наполнители и вспомогательные вещества, усиливающие воздействие основных действующих веществ препаратов, предназначенных для фармацевтического использования. Фармацевтические препараты настоящего изобретения производятся с помощью известных технологических операций, например, путем смешивания соответствующих компонентов, гранулирования, таблетирования, растворения, лиофилизации. Таким образом препараты для орального применения могут быть приготовлены путем смешивания активных компонентов с твердыми наполнителями, возможного размола приготовленной смеси, приготовления гранул после добавления подходящих вспомогательных веществ, если это желательно или необходимо для получения таблеток или драже. Подходящие наполнители, особенно носители, такие как сахара, например, лактоза или сахароза, маннит или сорбит, производные целлюлозы и/или фосфаты кальция, например, трикальций фосфат или кислый фосфат кальция, а 43 также связующие агенты, такие как крахмал,например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон. При необходимости в композицию добавляют дезинтегрирующие агенты, такие как вышеуказанный крахмал, а также карбоксиметил-производное крахмала, сшитый поливинилпирролидон, агар, альгиновая кислота или ее соли, такие как альгинат натрия. Вспомогательные вещества включают в том числе регулирующие выход активного начала и смазочные вещества, например, силикагель, тальк, стеариновая кислота и ее соли, например, стеараты магния или кальция, и/или полиэтиленгликоль. Драже производятся путем подходящего покрытия, устойчивого, если это необходимо, к действию желудочного сока. Для этих целей могут использоваться концентрированные растворы сахаридов, которые по выбору могут содержать гуммиарабик, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, раствор лака и подходящие органические растворители или их смеси. Для получения покрытий устойчивых к действию желудочного сока используются растворы подходящих препаратов целлюлозы,например, фталат ацетил целлюлозы или фталат гидроксипропилметилцеллюлозы. В композицию для покрытия могут быть добавлены красители или пигменты, например, для идентификации препарата или для указания комбинации доз активных компонентов. Другие фармацевтические препараты, которые могут применяться перорально, включают штампованные (push-fit) капсулы, выполненные из желатина, а также мягкие, запаянные капсулы, выполненные из желатина и пластификатора, например, глицерина или сорбита. Штампованные капсулы могут содержать активные вещества в форме гранул или в виде смеси с носителями, такими как лактоза, связующими, такими как крахмалы, и/или смазывающими материалами, такими как тальк или стеарат магния, или по выбору стабилизаторами. В мягких капсулах активные компоненты предпочтительно растворены или суспендированы в подходящих растворителях, таких как жирные масла или жидкий парафин. Кроме того, в композицию могут быть добавлены стабилизаторы. Подходящие составы для парэнетрального введения включают водные растворы активных веществ в водорастворимой форме, например,водорастворимые соли, растворы с основным рН, и комплексы включения в циклодекстрин. Наиболее предпочтительными солями являются гидрохлориды и ацетаты. С целью стабилизации и увеличения растворимости в воде соединений настоящего изобретения могут использоваться один или несколько модифицированных или 44 немодифицированных циклодекстринов. Подходящие для этого циклодекстрины приведены в патентах США 4727064, 4764604 и 5024998. Кроме того, суспензии активных веществ могут вводиться в форме, предназначенной для масляной инъекции. Подходящие липофильные растворители или носители включают жирные кислоты, например, кунжутное масло или эфиры синтетических жирных кислот, например,этилолеат, триглицериды или полиэтиленгликоль-400 (вещества, растворимые в ПЕГ-400). Суспензии для водных инъекций могут включать вещества, увеличивающие вязкость суспензии, например, натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран. По выбору суспензия может также содержать стабилизаторы. Следующие примеры приведены для иллюстрации способов получения веществ и составления композиций согласно настоящему изобретению, но не ограничивают область изобретения. Другие варианты и модификации условий и параметров воплощения изобретения,очевидные для специалистам в данной области техники, входят в предмет и объем изобретения. Пример 1. 3-[3-(2-Хлорфенилсульфонилокси)-5-метилфенокси]пропоксигуанидин. а) 3-(2-Хлорфенилсульфонилокси)-5-метилфенол. Орсинол моногидрат (1,42 г, 10 ммоль) и 2-хлорбензолсульфонилхлорид (2,43 г, 11 ммоль) смешивают в насыщенном раствореNаНСО 3 (30 мл) и диэтиловом эфире (30 мл). Полученную двухфазную смесь тщательно перемешивают при комнатной температуре в течение 2 дней. Реакцию останавливают добавлением 50 мл воды и реакционную смесь экстрагируют этилацетатом (3 х 50 мл). Органическую фазу промывают раствором соли (2 х 50 мл) и сушат над Na2SO4. После упаривания растворителя в вакууме остаток очищают с помощью колоночной хроматографии (2% этилацетат в дихлорметане) и получают требуемое соединение в виде светло-желтой жидкости (2,15 г,71%). 1H-ЯМР (300 МГц, CDCl3)2,22 (с, 3 Н),5,24 (с, 1 Н), 6,43 (с, 1 Н), 6,52 (s, 2H), 7,38 (м,1 Н), 7,60 (м, 2H) и 7,96 (мм, 1 Н, J=3,9, 0,6 Гц). б) 1-(2-Хлорфенилсульфонилокси)-3-(3 бензилокси)пропокси-5-метилбензол. Диэтилазодикарбоксилат (230 мкл, 1,46 ммоль), медленно добавляют при 0 С к раствору 3-(2-хлорфенилсульфонилокси)-5-метилфенола(253 мг, 0,866 ммоль), полученного на предыдущей стадии, 3-бензилоксипропанола (363 мг,1,24 ммоль) и трифенилфосфина (385 мг, 1,47 ммоль) в дихлорметане (7 мл). Охлаждающую баню удаляют и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Реакцию останавливают добавлением 10 мл воды и экстрагируют диэтиловым эфиром (3 х 20 мл). Объединенные органические экстракты 45 сушат (Mg2SO4) и полученный продукт очищают хроматографией (дихлорметан/петролейный эфир от 2:1 до 100:0). Целевой продукт получают в виде бесцветного масла (328,5 мг, выход 85%). 1(328,5 мг, 0,736 ммоль), приготовленного на предыдущей стадии, 66 мг 10%-ного палладия на угле и 180 мкл (0,72 ммоль) 4 н. раствора HCl в диоксане в 5 мл тетрагидрофурана гидрируют при атмосферном давлении в течение 1 ч при комнатной температуре. Реакционную смесь фильтруют через фильтр Целит 545 и затем концентрируют. Требуемое соединение получают в виде масла 217 мг (83 %) с помощью очистки хроматографией с использованием в качестве элюента смеси диэтиловый эфир/дихлорметан 2-10%. 1H-ЯМР (300 МГц, CDCl3)7,97 (дд, 1 Н,J=7,8, 1,4 Гц), 7,56-7,65 (м, 2 Н), 7,36-7,41 (м,1 Н), 6,60 (ушир.с, 1 Н), 6,54 (ушир.с, 1 Н), 6,50 (т,1 Н, J=2 Гц), 4,03 (т, 2 Н, J=4,7 Гц), 3,92 (с, 1 Н),3,82 (к, 2 Н, J=6,7 Гц), 2,24 (с, 3 Н) и 1,99(пентет,2 Н, J=6 Гц). г) N-[3-[3-(2-Хлорфенилсульфонилокси)-5 метилфенокси]пропокси]фталимид. Диэтилазодикарбоксилат (4,0 мл, 0,024 моль) добавляют по каплям к раствору 3-[3-(2 хлорфенилсульфонилокси)-5-метилфенокси] пропанола (8,5 г, 0,024 моль), полученного на предыдущей стадии, трифенилфосфина (6,26 г,0,024 моль) и N-гидроксифталимида (4,01 г,0,024 моль) в безводном тетрагидрофуране (240 мл). Полученный раствор перемешивают в течение ночи при комнатной температуре. После упаривания тетрагидрофурана осадок очищают с помощью хроматографии на силикагеле. Элюирование проводят с использованием градиента концентраций от 50 до 100% дихлорметана в гексане. Соответствующие фракции объединяют, упаривают досуха и высушивают в высоком вакууме и получают целевой продукт в виде масла (6,5 г, выход 54%). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C24H20ClNO7S: 524,1 (M+Na). Найдено 524,2. д) 3-[3-(2-Хлорфенилсульфонилокси)-5 метилфенокси]пропоксиамин.(6,5 г, 0,013 моль), приготовленного на предыдущей стадии, в смеси 2-пропанол/вода (6:1, 690 мл) обрабатывают боргидридом натрия (2,46 г,0,065 моль). Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Реакцию останавливают добавлением 2 н. соляной кислоты и полученную смесь выдерживают при температуре 50 С в течение 2 дней. Реакционную смесь охлаждают в бане, содержащей лед и воду, и доводят рН до 8,0 с помощью 2 н. гидроксида натрия. 2-пропанол отгоняют на роторном испарителе и оставшийся водный раствор экстрагируют этилацетатом (3 х 75 мл). Объединенные экстракты в этилацетате промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают досуха. Полученное вещество очищают на колонке с силикагелем элюированием в градиенте 50% дихлорметан/гексан - 100% дихлорметан, а затем 90% дихлорметан/10% ацетонитрил. Соответствующие фракции объединяют и упаривают до состояния масла, которое кристаллизуется под высоким вакуумом, при этом получают требуемый продукт (4,1 г, выход 85%). 1H-ЯМР (300 МГц, CDCl3)7,97 (дд, 1 Н,J=7,9, 1,5 Гц), 7,55-7,65 (м, 2 Н), 7,37 (тд, 1 Н,J=7,8, 1,6 Гц), 6,59 (ушир.с, 1 Н), 6,53 (м, 1 Н),6,49 (т, 1 Н, J=2,2 Гц), 5,39 (ушир.д, 2 Н), 3,92 (т,2 Н, J=6,3 Гц), 3,79 (т, 2 Н, J=6,2 Гц), 2,24 (с, 3 Н) и 2,00 (пентет, 2 Н, J=6,2 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C16H18ClNO5S: 372,1 (М+Н). Найдено 371,5. е) 3-[3-(2-Хлорфенилсульфонилокси)-5 метилфенокси]пропоксигуанидин. Раствор 3-[3-(2-хлорфенилсульфонилокси)-5-метилфенокси]пропоксиамина (0,43 г,0,0012 моль), приготовленного на предыдущей стадии, в безводном N,N-диметилформамиде(15 мл) обрабатывают 1 Н-пиразол-1 карбоксамидин гидрохлоридом (0,34 г, 0,0034 моль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют дополнительные 100 мг 1 Н-пиразол-1 карбоксамидин гидрохлорида и реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь упаривают досуха под высоким вакуумом. Осадок обрабатывают ацетонитрилом и полученный кристаллический осадок отфильтровывают и отбрасывают. Фильтрат упаривают досуха и экстрагируют водно-эфирной смесью (4 х 25 мл). Водную фазу отделяют и подщелачивают с помощью 2 н. гидроксида натрия, полученную водную фазу экстрагируют этилацетатом (4 х 50 мл). Объединенные экстракты в этилацетате промывают солевым раствором, сушат, упари 47 вают и получают 0,46 г требуемого соединения в виде масла. 1(ушир.с, 1 Н), 6,48 (м, 2 Н), 5,75 (ушир.м, 2 Н),3,96 (т, 4 Н, J=6,2 Гц), 2,21 (с, 3 Н) и 2,05 (пентет,2 Н, J=6,2 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C17H20ClN3O5S: 414,1 (М+Н). Найдено 414,2. Пример 2. 3-[3-(2-Метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидин. а) 3-(5-Хлор-2-метоксифенилсульфонилокси)-5-метилфенол. Насыщенный водный раствор NаНСО 3 (70 мл), добавляют к раствору 5-хлор-2-метоксибензилсульфонилхлорида (3,83 г, 15,9 ммоль) и моногидрата орсинола (3,39 г, 23,9 ммоль) в дин-бутиловом эфире (53 мл) и тетрагидрофуране(17 мл). Полученный двухфазный раствор тщательно перемешивают при 50 С в течение 7 ч, и при комнатной температуре в течение ночи. Реакционную смесь объединяют с реакционной смесью из предыдущей реакции, которую получают с использованием 4,53 г, 18,8 ммоль 5 хлор-2-метоксибензилсульфонилхлорида, полученные фазы разделяют и водную фазу экстрагируют этилацетатом (2 х 100 мл). Объединенные органические экстракты промывают солевым раствором (250 мл), сушат над Na2SO4,фильтруют, упаривают и получают 18,25 г прозрачного коричневого масла. Полученный продукт очищают с помощью колоночной хроматографии (1-4%этилацетата в дихлорметане), получают требуемое соединение (9,86 г, 86%) в виде светло-желтого масла, кристаллизующегося при хранении. 1H-ЯМР (300 МГц, CDCl3)7,81 (д, 1 Н,J=2,6 Гц), 7,55 (дц, 1 Н, J=8,9, 2,6 Гц), 7,02 (д,1 Н, J=8,9 Гц), 6,53 (м, 2 Н), 6,41 (т, 1 Н, J=2,2 Гц),3,99 (с, 3 Н), 2,24 (с, 3 Н). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C14H13ClO5S: 351,0 (M+Na). Найдено 351,1. б) 3-(2-Метоксифенилсульфонилокси)-5 метилфенол. 4-Метилморфолин (3,2 мл, 29,1 ммоль) добавляют к смеси 3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенола (8,82 г, 26,8 ммоль,полученного на предыдущей стадии) и 10% палладия на угле (2,23 г) в деоксигенированном метаноле (15 мл). Смесь перемешивают при комнатной температуре в токе водорода (баллон) в течение 3 ч, фильтруют через Целит (диатомовая земля) с метанолом. Растворитель отгоняют в вакууме и необработанный продукт очищают с помощью колоночной хроматографии (CH2Cl2 - 5% этилацетат в дихлорметане) и 48 получают требуемое соединение (4,97 г, 63%) в виде бесцветного сиропа. 1(ушир.с, 1 Н), 6,26 (т, 1 Н, J=2,2 Гц), 4,00 (с, 3 Н),2,15 (с, 3 Н). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C14H14O5S: 317,0 (M+Na). Найдено 316,9. в) 3-[3-(2-Метоксифенилсульфонилокси)5-метилфенокси]пропанол. Три-н-бутилфосфин (8,4 мл, 34 ммоль) добавляют по каплям в течение 5 мин к смеси 3(2-метоксифенилсульфонилокси)-5-метилфенола (4,97 г, 16,9 ммоль, приготовленного на предыдущей стадии), 1,3-пропандиола (12 мл, 170 ммоль) и 1,1'-(азодикарбонил)дипиперидина(8,54 г, 33,8 ммоль) в безводном тетрагидрофуране (75 мл) при 0 С в атмосфере азота. Для улучшения перемешивания после добавления половины три-n-бутилфосфина добавляют дихлорметан (75 мл). Взвесь перемешивают при комнатной температуре в течение 1 ч, затем смесь охлаждают до 0 С и добавляют дополнительно 1,1'-(азодикарбонил)дипиперидин (4,27 г,16,9 ммоль) и три-н-бутилфосфин (4,2 мл, 16,9 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем добавляют диэтиловый эфир (200 мл) и смесь отфильтровывают. Фильтрат концентрируют в вакууме и осадок очищают колоночной хроматографией (25% этилацетата в гексане - 60% этилацетата в гексане, затем 2% ацетона в дихлорметане - 7% ацетона в дихлорметане) с использованием двух отдельных стадий хроматографического разделения и получают требуемое соединение (3,79 г, 64 %) в виде золотистого масла. 1(пентет, 2 Н, J=6,0 Гц) и 1,72 (т, 1 Н, J=5,0 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C17H20O6S: 375,1 (M+Na). Найдено 375,1. г) N-[3-[3-(2-Метоксифенилсульфонилокси)-5-метилфенокси]пропокси]фталимид. Диэтилазодикарбоксилат (67 мкл, 0,40 ммоль) добавляют по каплям в течение 5,5 мин к смеси 3-[3-(2-метоксифенилсульфонилокси)-5 метилфенокси]пропанола (118 мг, 0,33 ммоль),полученнного на предыдущей стадии, трифенилфосфина (106 мг, 0,40 ммоль) и Nгидроксифталимида (55 мг, 0,33 ммоль) в без 49 водном тетрагидрофуране (3 мл) при 0 С в атмосфере азота. Раствор перемешивают при 0 С еще 20 мин, затем при комнатной температуре в течение ночи. Реакционную смесь концентрируют, остаток очищают колоночной хроматографией (дихлорметан) и получают целевое соединение (116 мг, 69%) в виде бесцветной смолы. 1(ушир.с, 1 Н), 6,56 (ушир.с, 1 Н), 6,42 (т, 1 Н,J=2,2 Гц), 4,36 (т, 2 Н, J=6,2 Гц), 4,09 (т, 2 Н,J=6,2 Гц), 4,04 (с, 3 Н), 2,25 (с, 3 Н), 2,18 (пентет,2 Н, J=6,2 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C25H23NO8S: 520,1 (M+Na). Найдено 520,2. д) 3-[3-(2-Метоксифенилсульфонилокси)5-метилфенокси]пропоксиамин. Смесь боргидрида натрия (45 мг, 1,1 ммоль) и N-[3-[3-(2-метоксифенилсульфонилокси)-5-метилфенокси]пропокси]фталимида(113 мг, 0,23 ммоль, приготовленного на предыдущей стадии) в 2-пропаноле (12 мл) и воде (2 мл) перемешивают в течение ночи при комнатной температуре. Доводят рН реакционной смеси до 1 с помощью водного раствора HCl (3,5 мл, 2 н.) и раствор перемешивают при 50 С в течение 2 ч. Раствор охлаждают до 0 С, рН среды доводят до 12 с помощью 2 н. NaOH, раствор перемешивают при комнатной температуре в течение 2 ч и отгоняют 2-пропанол на роторном испарителе. Полученную смесь экстрагируют этилацетатом (2 х 30 мл). Объединенные органические экстракты промывают солевым раствором (40 мл), сушат над Na2SO4, отфильтровывают, упаривают и получают требуемое соединение (79 мг, 95%) в виде бесцветного масла. 1(ушир.с, 3 Н), 3,92 (т, 2 Н, J=6,3 Гц), 3,79 (т, 2 Н,J=6,2 Гц), 2,23 (с, 3 Н), 2,00 (пентет, 2 Н, J=6,2 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C17H21NO6S: 390,1 (M+Na). Найдено 390,1. д) 3-[3-(2-Метоксифенилсульфонилокси)5-метилфенокси]пропоксигуанидин. Раствор 3-[3-(2-Метоксифенилсульфонилокси)-5-метилфенокси]пропоксиамина (74 мг, 0,20 ммоль, полученного в соответствии с предыдущей стадией) и 1 Н-пиразол-1-карбоксамидин гидрохлорида (60 мг, 0,41 ммоль) в безводном N,N-диметилформамиде (2 мл) перемешивают при комнатной температуре в тече 002740 50 ние ночи. Затем добавляют дополнительное количество 1 Н-пиразол-1-карбоксамидин гидрохлорида (30 мг, 0,20 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 3 дней. N,N-диметилформамид отгоняют в вакууме и полученный остаток обрабатывают ацетонитрилом. Для удаления избытка 1 Н-пиразол-1-карбоксамидин гидрохлорида смесь фильтруют и фильтрат концентрируют в вакууме. Полученное масло экстрагируют смесью диэтилового эфира (10 мл) и воды (10 мл). Водную фазу промывают диэтиловым эфиромNaOH и экстрагируют этилацетатом (2 х 10 мл). рН среды доводят до 8 с помощью 2 н. NaOH и экстрагируют этилацетатом (2 х 10 мл). Экстракты в этилацетате промывают буфером с рН=7(2 х 15 мл) и солевым раствором (15 мл), сушат над Na2SO4, фильтруют, упаривают и получают требуемое соединение (64 мг, 78%) в виде бесцветного масла. 1(M+Na). Найдено 410,1, 432,6. Пример 3. 3-[5-Метил-3-(хинолинил-8 сульфонилокси)фенокси]пропоксигуанидин гидрохлорид. а) 5-Метил-3-(хинолинил-8-сульфонилокси)фенол. Смесь орсина моногидрата (4,0 г, 28 ммоль) и 8-хинолинсульфонилхлорида (6,1 г,26,7 ммоль) в диэтиловом эфире(120 мл)и насыщенного бикарбоната натрия (120 мл) тщательно перемешивают при комнатной температуре в течение 4 дней. Реакционную смесь экстрагируют этилацетатом, сушат (МgSO4) и концентрируют. Кристаллизуют из смеси диэтиловый эфир-этилацетат-гексан и получают требуемое соединение (4,48 г, 50%) в виде желтокоричневого порошка. 1 51 Три-н-бутилфосфин (3,36 мл, 13,5 ммоль) медленно добавляют к 5-метил-3-(хинолинил-8 сульфонилокси)фенолу (3,0 г, 9,0 ммоль), полученному на предыдущей стадии, 1,3-пропандиолу (4 мл, 55,2 ммоль) и 1,1'-(азодикарбонил) дипиперидину (3,42 г, 13,6 ммоль) при 0 С в тетрагидрофуране (60 мл). Ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение ночи. По данным тонкослойной хроматографии смесь содержит исходный продукт. К реакционной смеси последовательно добавляют 1,1'-(азодикарбонил)дипиперидин (1,9 г) и три-н-бутилфосфин(1,7 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют диэтиловым эфиром и полученную суспензию отфильтровывают. Фильтрат концентрируют и очищают хроматографией с использованием в качестве элюента смесь дихлорметан/этилацетат (3:1, затем 2:3) и получают 3,19 г (выход 95 %) требуемого соединения в виде масла. 1(M+Na). Найдено 374,0, 396,2. в) N-[3-[5-Метил-3-(хинолинил-8-сульфонилокси)фенокси]пропокси]фталимид. Диэтилазодикарбоксилат (136 мкл, 0,81 ммоль) добавляют по каплям в течение 7 мин к раствору 3-[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]пропанола (252 мг, 0,68 ммоль,полученному на предыдущей стадии), Nгидроксифталимида (111 мг, 0,68 ммоль) и трифенилфосфина (213 мг, 0,81 ммоль) в безводном тетрагидрофуране (6 мл) при 0 С в атмосфере азота. Раствор перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 3 дней. Растворитель отгоняют в вакууме, необработанный продукт очищают колоночной хроматографией (от 100% дихлорметана до 1% ацетона в дихлорметане), при этом получают требуемое соединение (332 мг, 92%) в виде бесцветной пены. 1(M+Na). Найдено 518,7, 540,8. г) 3-[5-Метил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксиамин. Боргидрид натрия (107 мг, 2,8 ммоль) добавляют к N-[3-[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]пропокси]фталимиду (292 мг, 0,56 ммоль, полученному в соответствии с предыдущей стадией) в 2-пропаноле (10 мл),тетрагидрофуране (1,7 мл) и воде (1,7 мл). Газообразный водород выделяется в течение 40 мин. Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси по каплям добавляют водный раствор HCl (8,4 мл,2 н.) (при этом выделяется водород) и раствор нагревают при 50 С в течение 2 ч. Раствор охлаждают до 0 С и доводят до рН=10 с помощью 2 н. раствора NaOH. Органический растворитель отгоняют в вакууме и полученную смесь экстрагируют этилацетатом (2 х 30 мл). Объединенные органические экстракты промывают солевым раствором (50 мл), сушат над Na2SO4, фильтруют и упаривают до получения светло золотистого масла. Необработанный продукт очищают колоночной хроматографией (от 60:40 до 80:20 этилацетат/гексан), при этом получают требуемое соединение (166 мг, 76 %). 1(M+Na). Найдено 388,7, 410,9. д) 3-[5-Метил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксигуанидин гидрохлорид. Раствор 3-[5-метил-3-(хинолинил-8-сульфонилокси)фенокси]пропоксиамина (162 мг,0,42 ммоль, полученного на предыдущей стадии) и 1 Н-пиразол-1-карбоксамидин гидрохлорида (184 мг, 1,25 ммоль) в безводном N,Nдиметилформамиде (2,0 мл) перемешивают при комнатной температуре в атмосфере азота в течение 18 ч. Затем добавляют дополнительное количество 1 Н-пиразол-1-карбоксамидин гидрохлорида (61,4 мг, 0,42 ммоль) и реакционную смесь перемешивают в течение ночи. N,Nдиметилформамид отгоняют в вакууме, затем добавляют ацетонитрил (5 мл). Для кристаллизации избытка 1 Н-пиразол-1-карбоксамидин гидрохлорида раствор охлаждают при 0 С. Смесь фильтруют и фильтрат концентрируют в вакууме и получают светло-золотистокоричневое масло. Необработанный продукт растворяют в воде (15 мл) и экстрагируют диэтиловым эфиром (2 х 15 мл). Водную фазу ней 53 трализуют (рН=7) раствором 2 н. NaOH и экстрагируют этилацетатом (2 х 15 мл). Объединенные экстракты в этилацетате промывают буфером с рН=7 (2 х 15 мл) и солевым раствором (15 мл), сушат над Na2SO4, фильтруют, упаривают и получают свободное основание требуемого соединения(147 мг, 82%) в виде бесцветного масла. Целевое соединение получают добавлением раствора свободного основания, т.е. 3-[5 метил-3-(хинолинил-8-сульфонилокси)фенокси] пропоксигуанидина, (143 мг, 0,33 ммоль, полученного, как указано выше) в этаноле (1 мл) к раствору HCl в этаноле (1,06 мл, 1,1 М, 1,2 ммоль) в безводном диэтиловом эфире (100 мл). Требуемое соединение получают фильтрованием в атмосфере азота (120 мг, 77%) в виде гигроскопичного желтого твердого вещества. 1(с,3 Н), 1,95 (пентет, 2 Н, J=6 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для С 20H22N4O5S: 431,1 (М+Н). Найдено 430,9. Пример 4. 3-[3-(5-Хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид. а) 3-[3-(5-Хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропанол. Три-н-бутилфосфин (7,6 мл, 30,4 ммоль) добавляют по каплям в течение 20 мин к раствору 3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенола (5,00 г, 15,2 ммоль, приготовленного согласно стадии а в примере 2), 1,3 пропандиола (3,3 мл, 45,6 ммоль) и 1,1'(азодикарбонил)дипиперидина (7,68 г, 30,4 ммоль) в безводном тетрагидрофуране (80 мл) при 0 С в атмосфере азота. Для улучшения перемешивания после добавления половины трин-бутилфосфина добавляют дихлорметан (150 мл). Взвесь перемешивают при 0 С в течение дополнительных 5 мин, а затем при комнатной температуре в течение 3 ч. Добавляют диэтиловый эфир (400 мл) и смесь перемешивают в течение 10 мин, затем смесь отфильтровывают. Фильтрат концентрируют и остаток очищают колоночной хроматографией (25% этилацетата в гексане - 60% этилацетата в гексане), при этом получают требуемое соединение (4,07 г, 69 %) в виде золотистого масла. 1N-[3-[3-(5-Хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропокси]фталимид. Диэтилазодикарбоксилат (0,16 мл, 0,95 ммоль) добавляют по каплям в течение 6 мин к раствору 3-[3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропанола (0,31 г,0,79 ммоль), полученному на предыдущей стадии, трифенилфосфина (0,25 г, 0,93 ммоль) и Nгидроксифталимида (0,13 г, 0,80 ммоль) в безводном тетрагидрофуране (7,9 мл) при 0 С в атмосфере азота. Раствор дополнительно перемешивают при 0 С в течение 15 мин и при комнатной температуре в течение ночи. Реакционную смесь концентрируют и необработанный продукт очищают колоночной хроматографией(1% ацетона в дихлорметане), при этом получают требуемое соединение (0,417 г, 99%) в виде бесцветной пены. 1(пентет, 2 Н, J=6,1 Гц). Масс-спектр (MALDI-TOF, гинтизиновая кислота в качестве матрицы), рассчитано для С 25 Н 22 СlNO8S: 554,1 (M+Na). Найдено 553,7. в) 3-[3-(5-Хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксиамин. Боргидрид натрия (145 мг, 3,84 ммоль) добавляют к раствору N-[3-[3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропокси]фталимида (407 мг, 0,76 ммоль, приготовленного на предыдущей стадии) в 2-пропаноле(25 мл), тетрагидрофуране (5 мл) и воде (4 мл). Водород выделяется в течение 20 мин. Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют по каплям водный раствор HCl (11,4 мл, 2 н.,22,8 ммоль), при этом выделяется водород. Раствор перемешивают при 50 С в течение 2 ч,охлаждают до 0 С и доводят до рН=10 2 н. раствором NaOH. Органический растворитель отгоняют на роторном испарителе при комнатной температуре и полученную смесь экстрагируют этилацетатом (2 х 30 мл). Объединенные органические экстракты промывают солевым раствором (50 мл), сушат над Na2SO4, отфильтровывают и получают 365 г необработанного продукта в виде бесцветного масла. Необработанный продукт очищают колоночной хроматографией (от 50% этилацетата в гексане до 100% этилацетата) и получают требуемое соединение(265 мг, 0,66 ммоль, полученного на предыдущей стадии) и 1 Н-пиразол-1-карбоксамидин гидрохлорида (196 мг, 1,33 ммоль) в безводномN,N-диметилформамиде (3 мл) перемешивают при комнатной температуре в течение 2,5 ч. Затем добавляют дополнительное количество 1 Нпиразол-1-карбоксамидин гидрохлорида (97 мг,0,66 ммоль) и реакционную смесь перемешивают в течение 3 дней при комнатной температуре. N,N-диметилформамид отгоняют в вакууме и полученный остаток обрабатывают ацетонитрилом (1 мл) для осаждения избытка 1 Нпиразол-1-карбоксамидин гидрохлорида. Смесь фильтруют и фильтрат концентрируют в вакууме. Полученное масло экстрагируют смесью воды (20 мл) и диэтилового эфира (20 мл). Водную фазу промывают диэтиловым эфиром (2 х 20 мл). Водную фазу нейтрализуют (рН=7) 2 н. раствором NaOH и экстрагируют этилацетатом(2 х 30 мл). Объединенные экстракты в этилацетате промывают буфером с рН=7 (2 х 20 мл) и солевым раствором (30 мл), сушат над Na2SO4,фильтруют, упаривают и получают свободное основание требуемого соединения (281 мг, 96%) в виде бесцветного масла. Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы) рассчитан для C18H22ClN3O6S: 444,1 (М+Н), 466,1(M+Na). Найдено 444,6, 466,7. Конечное соединение (гидрохлорид) получают добавлением раствора свободного основания, т.е. 3-[3-(5-хлор-2-метоксифенилсульфонилокси)-5-метилфенокси]пропоксигуанидина,(261 мг, 0,59 ммоль) в 2-пропаноле (6 мл) в диэтиловый эфир (100 мл), содержащий растворHCl в этаноле (1,1 мл, 1,1 М, 1,2 ммоль). Растворитель отгоняют в вакууме и получают требуемое соединение (285 мг) в виде бесцветного масла. 1 56 считано для С 18 Н 22 СlN3O6S: 444,1 (М+Н). Найдено 443,5. Пример 5. 3-[3-(5-Хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропоксигуанидин гидрохлорид. а) 3-(5-Хлортиофенил-2-сульфонилокси)-5 метилфенол. Смесь орсина моногидрата (5,0 г, 35,2 ммоль) и 5-хлортиофен-2-сульфонилхлоридаNаНСО 3 (50 мл), диэтиловом эфире (50 мл) и 15 мл тетрагидрофурана тщательно перемешивают при 60 С в течение 2 ч и затем при 40 С в течение ночи. Реакционную смесь экстрагируют диэтиловым эфиром, сушат (МgSO4) и пропускают через толстый слой силикагеля (приблизительно 500 мл) с использованием в качестве элюента дихлорметан и затем смесь 3% диэтиловый эфир/дихлорметан, при этом получают 5,49 г (51%) требуемого соединения в виде светло-оранжевого масла. 1H-ЯМР (300 МГц, CDCl3)7,40 (д, 1 Н,J=4 Гц), 6,94 (д, 1 Н, J=4 Гц), 6,59 (ушир. с, 1 Н),6,49 (ушир. с, 1 Н), 6,40 (т, 1 Н, J=2 Гц), 5,38 (s,1H), 2,26 (s, 3 Н). Масс-спектр (MALDI-TOF, гинтизиновая кислота в качестве матрицы), рассчитано для С 11 Н 9 СlO4S2: 327,0 (M+Na). Найдено 327,0. б) 3-[3-(5-Хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропанол. Три-н-бутилфосфин (6,1 мл, 24 ммоль) добавляют по каплям в течение 5 мин к раствору 3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенола (3,49 г, 11,5 ммоль, приготовленного на предыдущей стадии), 1,3-пропандиола (2,2 мл,30 ммоль) и 1,1'-(азодикарбонил)дипиперидина(6,16 г, 24 ммоль) в безводном тетрагидрофуране (45 мл) при 0 С в атмосфере азота. Для улучшения перемешивания после добавления половины три-н-бутилфосфина в реакционную смесь добавляют дихлорметан (70 мл) и дополнительное количество тетрагидрофурана (10 мл). Взвесь перемешивают при комнатной температуре в течение 2,5 ч, затем добавляют диэтиловый эфир (300 мл) и смесь отфильтровывают. Фильтрат концентрируют и осадок очищают колоночной хроматографией (25% этилацетата в гексане - 40% этилацетата в гексане),при этом получают требуемое соединение (3,11 г, 75%) в виде золотистого масла. 1 57 Диэтилазодикарбоксилат (115 мкл, 0,68 ммоль) добавляют по каплям в течение 8,5 мин к раствору 3-[3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропанола (207 мг, 0,57 ммоль), полученного на предыдущей стадии,трифенилфосфина (180 мг, 0,68 ммоль) и Nгидроксифталимида (93 мг, 0,57 ммоль) в безводном тетрагидрофуране (5,1 мл) при 0 С в атмосфере азота. Раствор дополнительно перемешивают при 0 С в течение 30 мин. Реакционную смесь концентрируют и промежуточный продукт очищают колоночной хроматографией(дихлорметан), при этом получают требуемое соединение (272 мг, 94%) в виде бесцветной смолы. 1(ушир.с, 1 Н), 4,39 (т, 2 Н, J=6,1 Гц), 4,16 (т, 2 Н,J=6,1 Гц), 2,29 (с, 3 Н), 2,21 (пентет, 2 Н, J=6,1 Гц). Масс-спектр (MALDI-TOF, -циано-4 оксикоричная кислота в качестве матрицы), рассчитано для C22H18ClNO7S2: 530,0 (M+Na). Найдено 529,5. г) 3-[3-(5-Хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропоксиамин. Боргидрид натрия (85 мг, 2,2 ммоль) добавляют к раствору N-[3-[3-(5-хлортиофенил-2 сульфонилокси)-5-метилфенокси]пропокси] фталимида (227 мг, 0,45 ммоль, приготовленного на предыдущей стадии) в 2-пропаноле (23,2 мл), тетрагидрофуране (5,8 мл) и воде (3,9 мл). При этом выделяется водород. Смесь перемешивают при комнатной температуре в течение ночи. К реакционной смеси добавляют по каплям водный раствор HCl (6,6 мл, 2 н.) и перемешивают при 50 С в течение 2 ч. Раствор охлаждают до 0 С и нейтрализуют (рН=7) 2 н. раствором NaOH. Органический растворитель отгоняют на роторном испарителе и полученную смесь экстрагируют этилацетатом (2 х 15 мл). Объединенные органические экстракты промывают солевым раствором (15 мл), сушат над Na2SO4,отфильтровывают и упаривают. Осадок очищают колоночной хроматографией (25% этилацетата в гексане) и получают требуемое соединение (141 мг, 84%) в виде бесцветного масла. 1 58 Раствор 3-[3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропоксиамина (129 мг, 0,34 ммоль, полученного на предыдущей стадии) и 1 Н-пиразол-1-карбоксамидин гидрохлорида (103 мг, 0,70 ммоль) в безводном N,Nдиметилформамиде (1,5 мл) перемешивают при комнатной температуре в течение ночи. Затем добавляют дополнительное количество 1 Нпиразол-1-карбоксамидин гидрохлорида (103 мг, 0,70 ммоль) и реакционную смесь перемешивают в течение ночи при комнатной температуре. N,N-диметилформамид отгоняют в вакууме и полученный остаток обрабатывают ацетонитрилом (3 мл). Смесь фильтруют для удаления избытка 1 Н-пиразол-1-карбоксамидин гидрохлорида и фильтрат концентрируют. Полученное масло экстрагируют смесью воды (10 мл) и диэтилового эфира (15 мл). Водную фазу промывают диэтиловым эфиром (2 х 15 мл),подщелачивают (рН=8) 2 н. раствором NaOH и экстрагируют этилацетатом (2 х 20 мл). Объединенные экстракты в этилацетате промывают буфером с рН=7 (2 х 25 мл) и солевым раствором (25 мл), сушат над Na2SO4, фильтруют, упаривают и получают свободное основание требуемого соединения (129 мг, 90%) в виде бесцветного масла. Конечное соединение (гидрохлорид) получают добавлением раствора свободного основания, т.е. 3-[3-(5-хлортиофенил-2-сульфонилокси)-5-метилфенокси]пропоксигуанидина, (114 мг, 0,27 ммоль, приготовленного, как указано выше) в минимальном объеме тетрагидрофурана к раствору безводного диэтилового эфира(100 мл), содержащего НСl в этаноле (0,75 мл,1,1 М, 0,82 ммоль). Растворитель отгоняют в вакууме и получают требуемое соединение (130 мг) в виде светло-желтого масла. 1NаНСО 3 (30 мл) и диэтиловом эфире (30 мл). Полученную двухфазную смесь тщательно перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют 50 мл воды и экстрагируют этилацетатом (3 х 50 мл). Органическую фазу промывают раствором 59 соли (2 х 50 мл) и сушат над Na2SO4. После упаривания растворителя в вакууме остаток очищают с помощью колоночной хроматографии(дихлорметан - 5% этилацетата в дихлорметане) и получают целевое соединение в виде твердого вещества белого цвета (1,65 г, 57%). 1(с, 1 Н), 6,49 (с, 1 Н), 5,69 (ушир.с, 1 Н), 2,22 (с,3 Н). б) 3-[3-(2-Цианофенилсульфонилокси)-5 метилфенокси]пропанол: 1,1'-(азодикарбонил) дипиперидин (757 мг, 3,0 ммоль) добавляют к раствору 3-(2-цианофенилсульфонилокси)-5 метилфенола (580 мг, 2,0 ммоль), приготовленного на предыдущей стадии,три-нбутилфосфина (607 мг, 3,0 ммоль), 1,3 пропандиола (760 мг, 10 ммоль) в тетрагидрофуране (20 мл). Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют гексан (30 мл) и полученный остаток отделяют фильтрованием. Фильтрат упаривают в вакууме и остаток очищают колоночной хроматографией (10% этилацетат в дихлорметане),при этом получают требуемое соединение (560 мг, 80%) в виде бесцветного масла. 1(ушир.с, 1 Н). в) N-[3-[3-(2-Цианофенилсульфонилокси)5-метилфенокси]пропокси]фталимид. Диэтилазодикарбоксилат (700 мг, 4,0 ммоль) добавляют к раствору 3-[3-(2-цианофенилсульфонилокси)-5-метилфенокси]пропанола (1,04 г, 3,0 ммоль), приготовленного на предыдущей стадии, трифенилфосфина (1,05 г,4,0 ммоль) и N-гидроксифталимида (490 мг, 3,0 ммоль) в тетрагидрофуране при 0 С. Полученный раствор перемешивают в течение ночи. В реакционную смесь добавляют воду (50 мл) и экстрагируют этилацетатом (3 х 50 мл). Раствор в этилацетате промывают солевым раствором (2 х 50 мл) и сушат над Na2SO4. Растворитель отгоняют в вакууме, осадок очищают колоночной хроматографией (дихлорметан/гексан 2:1 - дихлорметан), при этом получают требуемое соединение (1,12 г, 76%) в виде бесцветной пены. 1 60 смеси этанол/тетрагидрофуран/вода (2:1:1). Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь подкисляют (рН=1-2) и раствор нагревают при 50 С в течение 2 ч. Раствор охлаждают до комнатной температуры и доводят до рН=8-9 с помощью 2 н. раствора NaOH. Полученную смесь экстрагируют этилацетатом (3 х 50 мл). Органическую фазу промывают солевым раствором (50 мл),сушат над Na2SO4. После испарения растворителя осадок очищают колоночной хроматографией (дихлорметан - 2% метанола в дихлорметане), при этом получают требуемое соединениеH-ЯМР (300 МГц, CDCl3)8,06 (м, 1 Н),7,93 (м, 1 Н), 7,76 (м, 2 Н), 6,61 (с, 1 Н), 6,53 (с,2 Н), 5,36 (ушир.с, 2 Н), 3,94 (т, 2 Н, J=6,3 Гц),3,78 (т, 2 Н, J=6,2 Гц), 2,23 (с,3 Н), 1,99 (м, 2 Н). д) 3-[3-(2-Цианофенилсульфонилокси)-5 метилфенокси]пропоксигуанидин гидрохлорид: 1 Н-пиразол-1-карбоксамидин гидрохлорид (590 мг, 4,0 ммоль) добавляют к раствору 3-[3-(2 цианофенилсульфонилокси)-5-метилфенокси] пропоксиамина (362 мг, 1,0 ммоль), полученного на предыдущей стадии, в N,N-диметилформамиде (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. N,N-диметилформамид отгоняют в вакууме. К полученному осадку добавляют ацетонитрил (10 мл) и удаляют осадок с помощью фильтрования, фильтрат концентрируют в вакууме и полученный остаток сушат в высоком вакууме. Полученный остаток экстрагируют смесью воды (30 мл + 2 мл солевого раствора) и диэтилового эфира (20 мл). Водную фазу экстрагируют диэтиловым эфиром (20 мл) и объединенные экстракты в диэтиловом эфире экстрагируют подкисленной водой (рН=5). рН объединенных водных растворов доводят до 8-9 раствором 2 н. NaOH и экстрагируют этилацетатом(3 х 50 мл). Раствор в этилацетате промывают буфером с рН=7 (2 х 30 мл) и солевым раствором (30 мл), сушат над Na2SO4. После упаривания растворителя добавляют 0,6 н. раствор HCl в метаноле (10 мл) и после концентрирования раствора получают требуемое соединение в виде бесцветного масла (340 мг, 77%). 1
МПК / Метки
МПК: C07D 217/22, C07C 309/73, C07C 317/14, C07D 295/22, A61K 31/47, A61K 31/505, A61K 31/155, A61K 31/44, A61K 31/255, C07C 309/75, C07D 215/36
Метки: протеолиза, фибриногена, лечения, тромбоцитов, хранения, образования, аггрегатов, тромбин-индуцированной, млекопитающего, сгустков, крови, циркуляции, способ, устройстводля, агрегации, получения, ингибирования, тромбов, фармацевтическая, производные, сбора, варианты, плазме, тромбина, гуанидина, композиция
Код ссылки
<a href="https://eas.patents.su/30-2740-proizvodnye-guanidina-varianty-sposob-ih-polucheniya-varianty-farmacevticheskaya-kompoziciya-dlya-ingibirovaniya-proteoliza-u-mlekopitayushhego-sposob-lecheniya-sposob-ingibirovani.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гуанидина (варианты), способ их получения (варианты), фармацевтическая композиция для ингибирования протеолиза у млекопитающего, способ лечения, способ ингибирования: протеолиза у млекопитающего, тромбин-индуцированной агрегации тромбоцитов и образования сгустков фибриногена в плазме, тромбина в крови, образования аггрегатов тромбоцитов в крови, образования тромбов в крови, устройстводля сбора, циркуляции и хранения крови</a>
Предыдущий патент: Новые гидратные формы алендроната натрия, способы их получения и фармацевтические композиции
Следующий патент: Жидкие производные бензизохинолина
Случайный патент: Флюид и способ высвобождения заклинившей в буровой скважине трубы или инструмента












