Необратимые ингибиторы тирозинкиназ
Номер патента: 1595
Опубликовано: 25.06.2001
Авторы: Денни Уиллием Александер, Фрай Дейвид В., Мэкнамара Деннис Джозеф, Бриджес Александер Джеймс, Доэрти Аннет Мэриэн, Шовольтер Хауард Дэниель Холлис, Зоу Хэйронг, Добрусин Эллен Мира, Смайлл Джеффри Б.
Формула / Реферат
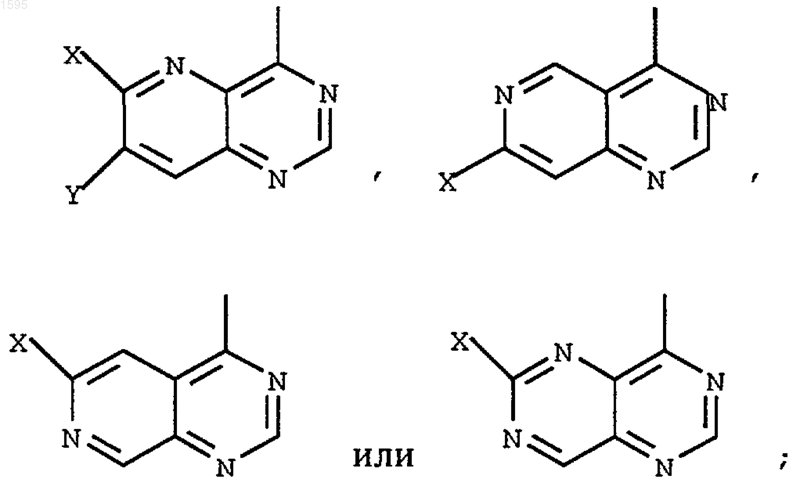
1. Азотсодержащее гетероциклическое соединение формулы I
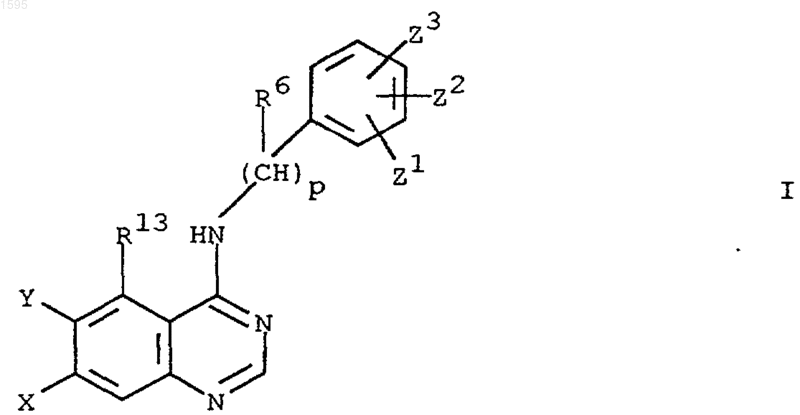
где Х означает -D-E-F, a Y означает -SR4, -OR4, -NHR3 или водород или Х означает -SR4, -OR4, -NHR3 или водород и Y означает -D-E-F;
D означает
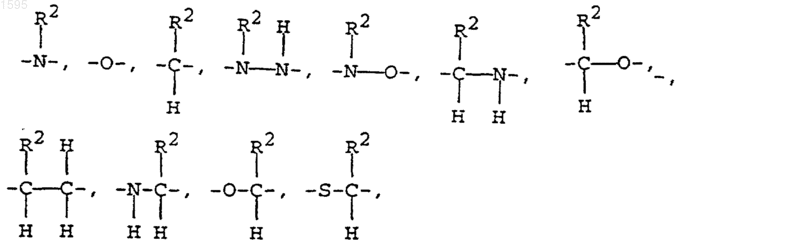
или отсутствует;
Е означает
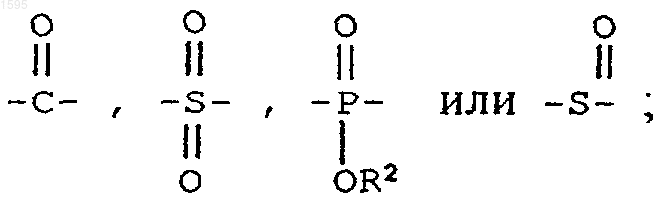
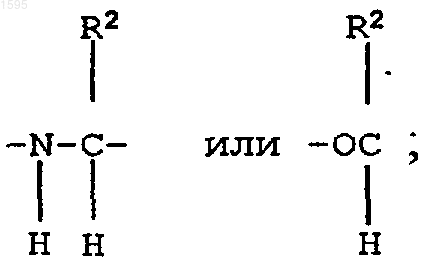
F означает
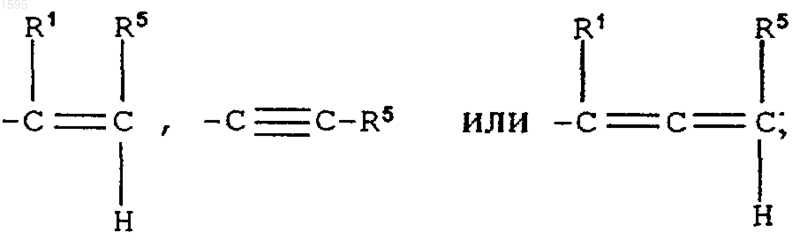
при этом, когда Е означает
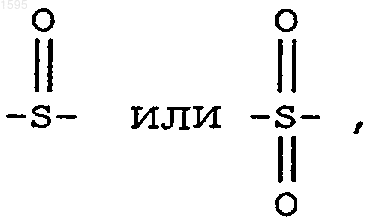
D не означает
R1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;
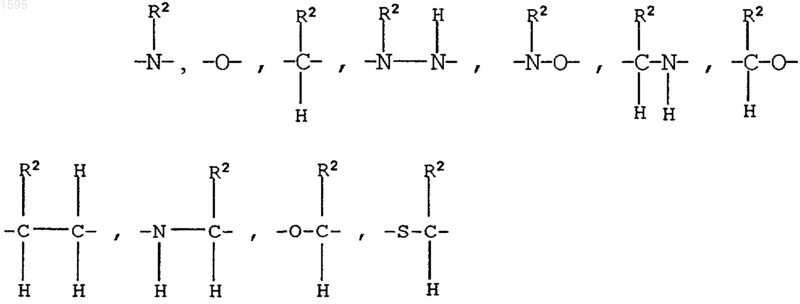
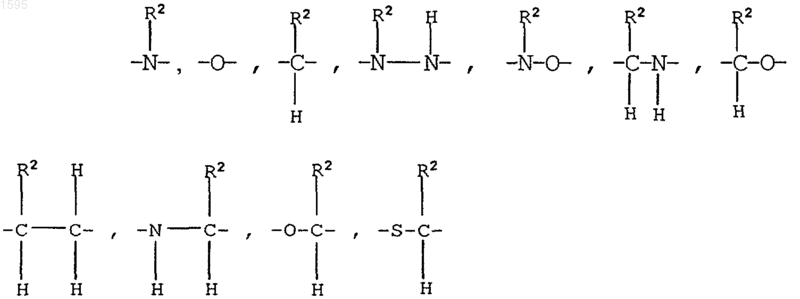
R2, R3 и R4 означают независимо водород, алкил с числом углеродных атомов от 1 до 6,
-(СН2)n-N-пиперидинил, -(СH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил[N4-(С1-С6)алкил], -(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-имидазолил,
-(CH2)n-N-морфолино-, -(CH2)n-N-тиоморфолино-,
-(CH2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2 или 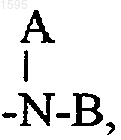
А и В означают независимо водород, алкил с числом водородных атомов от 1 до 6, -(CH2)nОН,
-(CH2)n-N-пиперидинил, -(CH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-N-пиридил,
-(CH2)n-имидазолил или -(CH2)n-N-имидазолил;
Z1, Z2 или Z3 означают независимо водород, галоген, алкил с числом углеродных атомов от 1 до 6, циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6, гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6алкил), -N(C1-C6алкил)2, -NH(C3-C8циклоалкил), -N(C3-C8циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4; и
R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1-дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6,
-(CH2)n-N-пиперидинил, -(CH2)n-пиперазинил,
-(CH2)n-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-N-морфолино-,
-(CH2)n-N-тиоморфолино-, 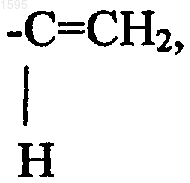
-СН=СН-(С1-С6)алкил, -(CH2)n-N-гексагидроазепин,
-(CH2)nNH2, -(CH2)nNH(C1-C6алкил),
-(CH2)nN(C1-C6алкил)2, -1-оксо(С1-С6)алкил,
карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, N-алкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2, Z3 или моноциклической гетероарильной группы с 5 или 6 кольцевыми атомами, содержащей, по меньшей мере, один гетероатом из числа N, О, S и Р, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена -ОН, -NH2 или NAB, где А и В определены так же, как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6,
n означает число от 1 до 4,
р означает 0 или 1,
и их фармацевтически приемлемые соли, эфиры, амиды и пролекарства.
2. Азотсодержащее гетероциклическое соединение формулы II
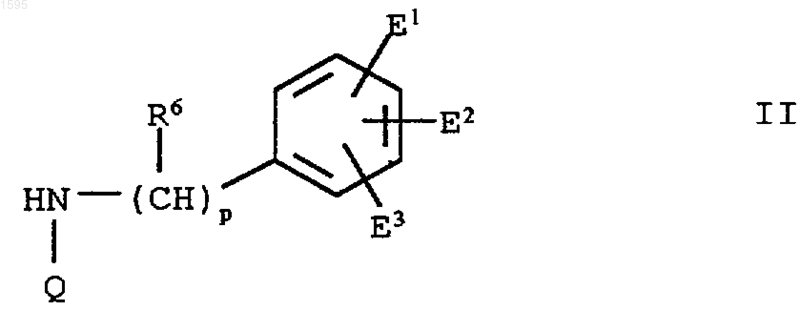
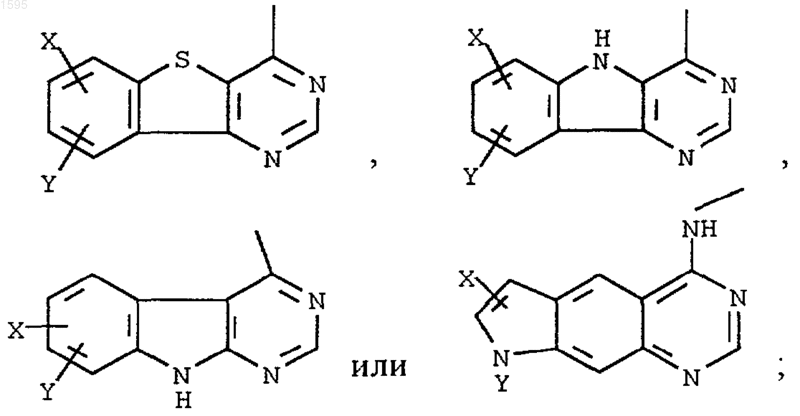
где Q означает
Х означает -D-E-F, a Y означает -SR4, -OR4, -NHR3 или водород или Х означает -SR4, -OR4, -NHR3 или водород, а Y означает -D-E-F;
D означает
или отсутствует;
Е означает
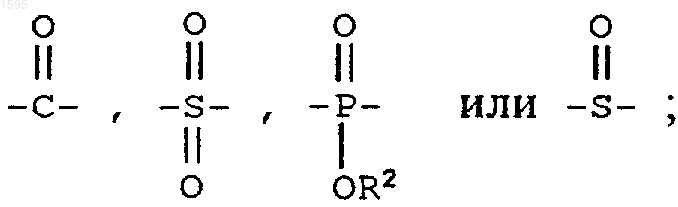
F означает
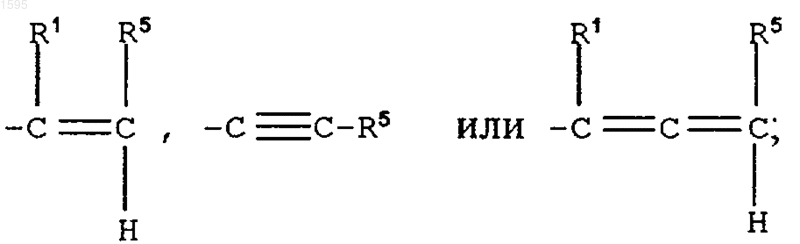
при этом, когда Е означает
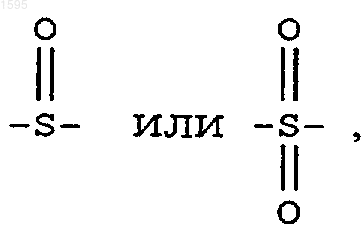
D не означает
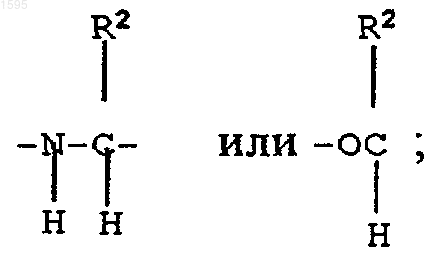
R1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;
R2, R3 и R4 означают независимо водород, алкил с числом углеродных атомов от 1 до 6,
-(CH2)n-N-пиперидинил, -(CH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-имидазолил,
-(CH2)n-N-морфолино-, -(CH2)n-N-тиоморфолино-,
-(CH2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2 или 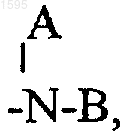
А и В означают независимо водород, алкил с числом водородных атомов от 1 до 6, -(CH2)nОН,
-(CH2)n-N-пиперидинил, -(CH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-N-пиридил,
-(CH2)n-имидазолил или -(CH2)n-N-имидазолил;
Е1, Е2 и Е3 означают независимо галоген, алкил с числом углеродных атомов от 1 до 6, циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6, гидроксил, ацилоксигруппу с числом углеродных атомов от 1 фю 6, -NH2, -NH(C1-C6алкил), -N(C1-С6алкил)2, -NH(C3-C8циклоалкил), -N(C3-C8циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8, сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4 и
R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1-дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6,
-(CH2)n-N-пиперидинил, -(CH2)n-пиперазинил,
-(CH2)n-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-N-морфолино-,
-(CH2)n-N-тиоморфолино-, 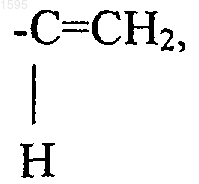
-СН=СН-(С1-С6)алкил, -(CH2)n-N-гексагидроазепин,
-(CH2)nNH2, -(CH2)nNH(C1-C6алкил),
-(CH2)nN(C1-C6алкил)2, -1-оксо(С1-С6)алкил,
карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, N-алкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2, Z3 или моноциклической гетероарильной группы с 5 или 6 кольцевыми атомами, содержащей, по меньшей мере, один гетероатом из числа N, O, S и Р, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена -ОН, -NH2 или NAB, где А и В определены так же как и выше,
R6 означает водород или алкил с числом углеродных атомов от 1 до 6;
n означает число от 1 до 4,
р означает 0 или 1,
и их фармацевтически приемлемые соли, эфиры, амиды и пролекарства.
3. Азотсодержащее гетероциклическое соединение формулы III
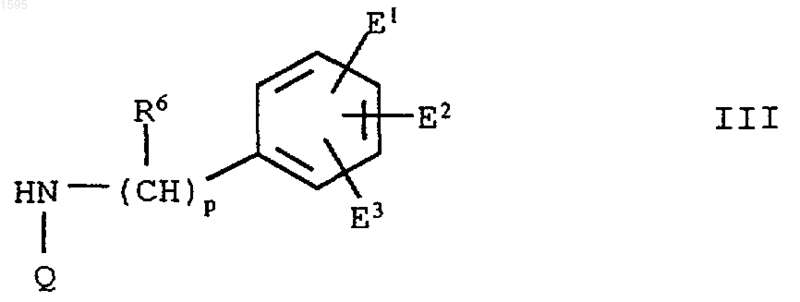
где Q означает
Х означает -D-E-F, a Y означает -OR4, -NHR3 или водород, или Х означает -OR4, -NHR3 или водород, а Y означает -D-E-F;
D означает
или отсутствует;
Е означает
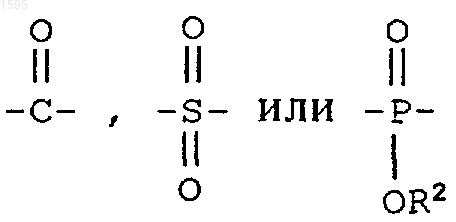
F означает
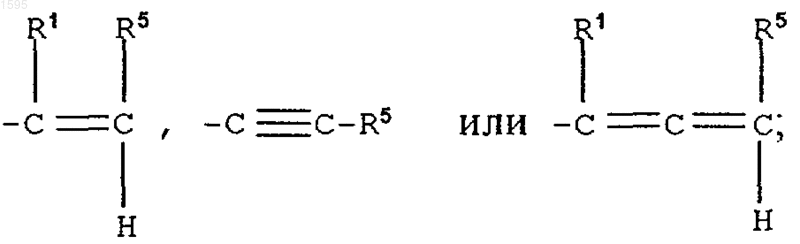
при этом, когда Е означает
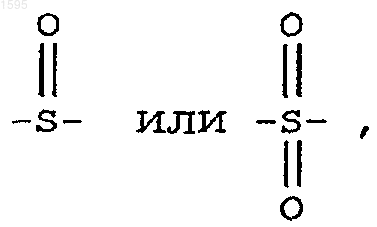
D не означает
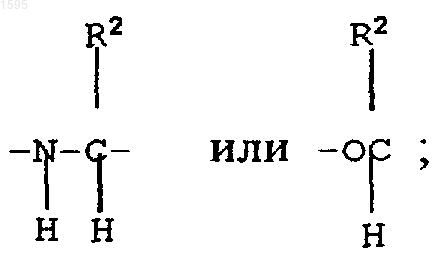
R1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;
R2, R3 и R4 означают независимо водород, алкил с числом углеродных атомов от 1 до 6, -(CH2)n-N-пиперидинил,
-(CH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-имидазолил,
-(CH2)n-N-мopфoлинo-, -(CH2)n-N-тиоморфолино-,
-(CH2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2 или 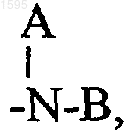
А и В означают независимо водород, алкил с числом водородных атомов от 1 до 6, -(CH2)nОН,
-(CH2)n-N-пиперидинил, -(CH2)n-N-пиперазинил,
-(CH2)n-N1-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-N-пиридил,
-(CH2)n-имидазолил или -(CH2)n-N-имидазолил;
Е1, Е2 и Е3 означают независимо галоген, алкил с числом углеродных атомов от 1 до 6, циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6, гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6алкил), -N(C1-С6алкил)2, -NH(C3-C8циклоалкил), -N(C3-C8циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8, сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;
R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1-дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6,
-(CH2)n-N-пиперидинил, -(CH2)n-пиперазинил,
-(CH2)n-пиперазинил [N4-(С1-С6)алкил],
-(CH2)n-N-пирролидил, -(CH2)n-пиридинил,
-(CH2)n-N-имидазолил, -(CH2)n-N-морфолино-,
-(CH2)n-N-тиоморфолино-, 
-СН=СН-(С1-С6)алкил, -(CH2)n-N-гексагидроазепин,
-(CH2)nNH2, -(CH2)nNH(C1-C6алкил),
-(CH2)nN(C1-C6алкил)2, -1-оксо(С1-С6)алкил,
карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, N-алкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2, Z3 или моноциклической гетероарильной группы с 5 или 6 кольцевыми атомами, содержащей, по меньшей мере, один гетероатом из числа N, O, S и Р, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена -ОН, -NH2 или NAB, где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов ют 1 до 6;
n означает число от 1 до 4,
р означает 0 или 1,
и их фармацевтически приемлемые соли, эфиры, амиды и пролекарства.
4. Азотсодержащие гетероциклические соединения по пп.1-3, выбранные из группы, включающей
N-[4-(3-бромфениламино)хиназолин-7-ил]акриламид;
3-[4-(3-бромфениламино)хиназолин-7-ил-карбамоил]акриловая кислота,
этиловый эфир 3-[4-(3-бромфениламино)хиназолин-7-ил-карбамоил]акриловой кислоты;
[4-(3-бромфениламино)хиназолин-7-ил]амид бут-2-еноевой кислоты;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]акриламид;
N-[4-(3-метилфениламино)хиназолин-7-ил]акриламид;
N-[4-(3-xлopфeнилaминo)xинaзoлин-7-ил]aкpилaмид;
N-[4-(3-бромфениламино)хиназолин-7-ил]метакриламид;
N-[4-(3-бромфениламино)хиназолин-7-ил]этенилсульфонамид;
N-[4-[(3-xлopфeнил)aминo]xинaзoлин-6-ил]aкpилaмид,
N-[4-[(3-метилфенил)амино]хиназолин-6-ил]акриламид;
N-[4-[(3-(трифторметил)фенил)амино]xиназолин-6-ил]акриламид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]метакриламид;
N-[4-(3-бромфениламино)хиназолин-7-ил]этенилсульфонамид,
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-Е-бут-2-енамид,
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-4,4,4-трифтор-Е-бут-2-енамид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил)пропинамид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]бут-2-инамид;
N-[4-(3-бромфениламино)пиридо[4,3-d]пиримидин-7-ил]акриламид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]акриламид,
N-[4-(3-мeтилфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aкpилaмид;
N-[4-(3-бpoмфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]-N-метилакриламид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]метакриламид,
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]этенилсульфонамид;
N-[4-(3-бромфениламино)бензо[b]тиен[3,2-d]пиримидин-8-ил]акриламид;
N-[4-(3-бромфениламино)бензо[b]тиен[3,2-d]пиримидин-6-ил]aкриламид;
N-[4-(3-бромфениламино)бензо[b]тиен[3,2-d]пиримидин-7-ил]акриламид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]бута-2,3-диенамид;
N-[4-[(3-бpoмфeнил)aминo]xинaзoлин-6-ил]-E,4-oкcoпeнт-2-eнaмид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-Е,4-этокси-4-оксобут-2-енамид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]-пента-2,4-диенамид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]-Е-бут-2-енамид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]циннамид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]-Е,3-хлоракриламид;
N-[4-(3-бромфениламино)пиридо[3,4-d]пиримидин-6-ил]пропинамид;
3-[4-(3-бромфениламино)хиназолин-6-илкарбамоил]акриловая кислота (Z);
4-[(3-бромфенил)амино)-6-(этенсульфонил)пиридо[3,4-d]пиримидин;
1-[4-(3-бромфениламино)хиназолин-6-ил]пиррол-2,5-дион;
1-[4-(3-бромфениламино)хиназолин-6-ил]проп-2-ен-1-он;
4-(3-бромфениламино)хиназолин-6-иловый эфир акриловой кислоты;
метил-N-[4-[(3-бромфенил)амино]-Р-этенилпиридо[3,4-d]пиримидин-6-ил]фосфонамидат;
4-(3-бромфениламино)хиназолин-7-иловый эфир акриловой кислоты;
1-[4-(3-бромфениламино)хиназолин-6-ил]-бут-3-ен-2-он;
4-(3-хлор-4-фторфениламино)-7-метоксихиназолин-6-иловый эфир акриловой кислоты;
[4-(3-бромфениламино)хиназолин-6-ил]амид пента-2,3-диеновой кислоты;
[4-(3-бромфениламино)(хиназолин-6-ил]амид пропа-1,2-диен-1-сульфоновой кислоты;
метил-N-[4-[(3-бромфенил)амино]-6-хиназолинил]-Р-(1,2-пропадиенил) фосфонамидат;
N-[1-(3-бромфениламино)-9Н-2,4,9-триазафторен-7-ил]акриламид;
N-[4-(3-бромфениламино)-9Н-1,3,9-триазафторен-6-ил]акриламид;
N-[4-(3-хлор-4-фторфениламино)хиназолин-6-ил]акриламид;
N-(4-фенилметиламинохиназолин-6-ил)акриламид;
(S)-N-[4-(1-фенилэтиламино)хиназолин-6-ил]акриламид;
(R)-N-[4-(1-фенилэтиламино)хиназолин-6-ил]акриламид;
N-[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aкpилaмид;
N-[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]-N-метилакриламид;
(3-хлор-4-фторфенил)-(6-этенсульфинилпиридо[3,4-d]пиримидин-4-ил]амин;
(3-бpoмфeнил)-(6-этeнcyльфинилпиpидo[3,4-d]пиpимидин-4-ил)aмин;
N-[4-(3-бромфениламино)пиридо[4,3-d]-пиримидин-7-ил]-N-(3-морфолин-4-ил-пропил)акриламид;
N-[4-(3-бpoмфeнилaминo)пиpидo[4,3-d]-пиpимидин-6-ил]-N-(3-мopфoлин-4-ил-пропил)акриламид;
N-[4-[(3-бpoмфeнил)aминo]xинaзoлин-7-ил]-N-[3-мopфoлинпpoпил]акриламид;
N-[4-(3-бромфениламино)-6-(3-морфолин-4-ил-пропиламино)хиназолин-7-ил]акриламид;
N-[4-[(3-бромфенил)амино]-7-[3-(4-морфолин)пропокси]хиназолин-6-ил]акриламид;
N-[4-[(3-метилфенил)амин]-7-[3-(4-морфолин)пропокси]хиназолин-6-ил]акриламид;
N-[4-[(3-метилфенил)амино]-7-[3-(4,N-метил-1,N-пиперазин)пропокси]хиназолин-6-ил]акриламид;
N-[4-[(3-бромфенил)амино]-7-[3-(4,N-метил-1,N-пиперазин)пропокси]хиназолин-6-ил]акриламид;
N-[4-[(3-бромфенил)амино]-7-[3-(1,N-имидазил)пропокси]хиназолин-6-ил]акриламид;
N-[4-[(3-бромфенил)амино]-7-[4-(N,N-диметиламино)бутокси]хиназолин-6-ил]акриламид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-N-[3-морфолинпропил] акриламид;
N-[4-(3-бpoмфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]-N-(2-(N,N-диметиламино)этил)акриламид;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-Е,4-(3-(N,N-диметиламино)пропокси-4-оксобут-2-енамида трис-трифторацетат;
N-[4-[(3-бромфенил)амино]хиназолин-6-ил]-Е,4-(3-(N,N-диметиламино)пропиламино-4-оксобут-2-енамид;
N-[4-(3-бромфениламино)-7-(3-морфолин-4-илпропокси)пиридо[3,2-d]пиpимидин-6-ил]aкpилaмид;
[4-(3-хлор-4-фторфениламино)хиназолин-6-ил]-амид (3-диметиламинопропил)амид-бут-2-ендиоевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид (3-диметиламинопропил)амид бут-2-ендиоевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид (3-имидазол-1-ил-пропил)амид бут-2-ендиоевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 4,4-дифтор-8-морфолин-4-ил-окт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 8-диметиламино-4,4-дифтор-окт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 7-диметиламино-4,4-дифтор-гепт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 6-диметиламиногекс-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 6-морфолин-4-ил-гекс-2-иноевой кислоты;
[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид 7-диметиламиногепт-2-иноевой кислоты;
[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид 7-морфолин-4-ил-гепт-2-иноевой кислоты;
[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид 5-диметиламинопент-2-иноевой кислоты;
[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид 5-морфолин-4-ил-пент-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 5-имидазол-1-ил-пент-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]амид 5-(4-метилпиперазин-1-ил-пент-2-иноевой кислоты;
2-(4-метилпиперазин-1-ил)этиловый эфир 4-[4-(3-хлор-4-фторфениламино)пиpидo[3,4-d]пиpимидин-6-илкapбaмoил]-бyт-3-eнoeвoй кислоты;
2-(имидaзoл-1-ил)этилoвый эфир 4-[4-(3-хлор-4-фторфениламино) пиpидo[3,4-d]пиpимидин-6-илкapбaмoил]бyт-3-eнoeвoй кислоты;
1-{[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид} 5-[(3-морфолин-4-ил-пропил)амидo]пент-2-ендиоевой кислоты;
1-{[4-(3-хлор-4-фторфениламино)пиридо[3,4-d]пиримидин-6-ил]-амид} 5-[(3-диэтиламинoпропил)амидo]пент-2-ендиоевой кислоты;
2-морфолин-4-ил-этиловый эфир 4-[4-(3-хлор-4-фторфениламино)пиpидo[3,4-d]пиpимидин-6-илкapбaмoил]бyт-3-eнoeвoй кислоты;
1-{[4-(3-xлop-4-фтopфeнилaминo)пиpидo[3,4-d]пиpимидин-6-ил]aмид} 5-{[3-(4-метил-пиперазин-1-ил)пропил]амид}пент-2-ендиоевой кислоты;
(3-хлор-4-фторфенил)-{6-[2-(3-диметиламинопропокси)этенсульфонил]-пиридо[3,4-d]пиримидин-4-ил}амин;
(3-xлop-4-фтopфeнил)-(6-{2-[4-(4-мeтилпипepaзин-1-ил)бyтилaминo]-этeнcyльфoнил}пиpидo[3,4-d]пиpимидин-4-ил)aмин;
2-морфолин-4-ил-этиловый эфир 3-[4-(1-фенилэтиламино)хиназолин-6-илкарбамоил]акриловой кислоты;
(4-имидазол-1-ил-бутил)амид[4-(1-фенилэтиламино)хиназолин-6-ил]амид бут-2-ендиоевой кислоты;
3-диэтиламинопропиловый эфир 4-[4-(1-фенилэтиламино)хиназолин-6-илкарбамоил]бут-3-еноевой кислоты;
5-{[2-(4-метилпиперазин-1-ил)этил]амид} 1-{[4-(1-фенилэтиламин)хиназолин-6-ил]амид}пент-2-ендиоевой кислоты;
[4-(1-фенилэтиламин)хиназолин-6-ил]амид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(1-фенилэтиламин)хиназолин-6-ил]амид 7-диметиламино-4,4-дифтор-гепт-2-еноевой кислоты;
[4-(1-фенилэтиламин)хиназолин-6-ил]амид 7-имидазол-1-ил-гепт-2-иноевой кислоты;
[4-(1-фенилэтиламин)хиназолин-6-ил]амид 6-диметиламиногекс-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид (3-диметиламинопропил)амид бут-2-ендиоевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид(3-имидазол-1-илпропил)амид бут-2-ендиоевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 4,4-дифтор-8-морфолин-4-ил-окт-2-еноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 8-диметиламино-4,4-дифтор-окт-2-еноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 7-диметиламино-4,4-дифторгепт-2-еноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 6-диметиламиногекс-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 6-морфолин-4-ил-гекс-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 7-диметиламиногепт-2-иноевой кислоты;
[4-(3-бpoмфeнилaмин)пиpидo[3,4-d]пиpимидин-6-ил]aмид 7-морфолин-4-ил-гепт-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 5-диметиламинопент-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 5-морфолин-4-ил-пент-2-иноевой кислоты;
[4-(3-бpoмфeнилaмин)пиpидo[3,4-d]пиpимидин-6-ил]aмид 5-имидазол-1-илпент-2-иноевой кислоты;
[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид 5-(4-метилпиперазин-1-ил)пент-2-иноевой кислоты;
2-(4-метилпиперазин-1-ил)этиловый эфир 4-[4-(3-бромфениламин)-пиридо[3,4-d]пиримидин-6-илкарбамоил]бут-3-еноевой кислоты;
2-имидазол-1-ил-этиловый эфир 4-[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-илкарбамоил]бут-3-еноевой кислоты;
1-{[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид}5-[(3-морфолин-4 ил-пропил)амид]пент-2-ендиоевой кислоты;
1-{[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид} 5-[(3-диэтиламинопропил)амид] пент-2-ендиоевой кислоты;
2-морфолин-4-ил-этиловый эфир 4-[4-(3-бромфениламин)пиридо[3,4-d]пиpимидин-6-илкapбaмoил]бyт-3-eнoeвoй кислоты;
1-{[4-(3-бромфениламин)пиридо[3,4-d]пиримидин-6-ил]амид} 5-{[3-(4-метилпиперазин-1-ил)пропил]амид}пент-2-ендиоевой кислоты;
(3-бромфенил)-{6-[2-(3-диметиламинпропокси)этенсульфонил]пиридо[3,4-d]пиримидин-4-ил}амин;
(3-бромфенил)-(6-{2-[4-(4-метилпиперазин-1-ил)бутиламин]этeнcyльфoнил}пиpидo[3,4-d]пиpимидин-4-ил)aмин;
(3-бромфенил)-[6-(5-морфолин-4-ил-пент-1-ен-1-сульфонил)пиридо[3,4-d]пиримидин-4-ил]амин;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид(3-диметиламинопропил)амид бут-2-ендиоевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид(3-имидазол-1-илпропил)амид бут-2-ендиоевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 4,4-дифтор-8-морфолин-4-ил-окт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 8-диметиламино-4,4-дифторокт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]aмид 7-диметиламино-4,4-дифторгепт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]aмид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 6-диметиламиногекс-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 6-морфолин-4-ил-гекс-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 7-диметиламиногепт-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 7-морфолин-4-ил-гепт-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 5-диметиламинопент-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 5-морфолин-4-ил-пент-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 5-имидазол-1-ил-пент-2-иноевой кислоты;
[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид 5-(4-метилпиперазин-1-ил)пент-2-иноевой кислоты;
1-{[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид} 5-[(3-морфолин-4-илпропил)амид]пент-2-ендиоевой кислоты;
1-{[4-(3-хлор-4-фторфениламин)хиназолин-6-ил]амид} 5-[(3-диэтиламинопропил)амид]пент-2-ендиоевой кислоты;
2-морфолин-4-ил-этиловый эфир 4-[4-(3-хлор-4-фторфениламин)хиназолин-6-илкарбамоил]бут-3-еноевой кислоты;
1-{[4-(3-хлор-4-фторфениламин)xиназолин-6-ил]амид} 5-{[3-(4-метилпиперазин-1-ил)пропил]амид}пент-2-ендиоевой кислоты;
(3-хлор-4-фторфенил)-{6-[2-(3-диметиламинопропокси)этенсульфонил]хиназолин-4-ил}амин;
(3-хлор-4-фторфенил)-(6-{2-[4-(4-метилпиперазин-1-ил)бутиламин]этенсульфонил}хиназолин-4-ил)амин;
[4-(3-бромфениламин)хиназолин-6-ил]амид(3-диметиламинопропил)амид бут-2-ендиоевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид(3-имидазол-1-ил-пропил)-амид бут-2-ендиоевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 4,4-дифтор-8-морфолин-4-ил-окт-2-еноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 8-диметиламино-4,4-дифтор-окт-2-еноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 7-диметиламино-4,4-дифтор-гепт-2-еноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 6-диметиламингекс-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 6-морфолин-4-ил-гекс-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 7-диметиламингепт-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]aмид 7-морфолин-4-ил-гепт-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 5-диметиламинпент-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 5-морфолин-4-ил-пент-2-иноевой кислоты;
(4-(3-бромфениламин)хиназолин-6-ил]амид 5-имидазол-1-ил-пент-2-иноевой кислоты;
[4-(3-бромфениламин)хиназолин-6-ил]амид 5-(4-метилпиперазин-1-ил)-пент-2-иноевой кислоты;
2-(4-метилпиперазин-1-ил)этиловый эфир 4-[4-(3-бромфениламин)хиназолин-6-илкарбамоил]бут-3-еноевой кислоты;
2-имидазол-1-ил-этиловый эфир 4-[4-(3-бромфениламин)хиназолин-6-ил-карбамоил]бут-3-еноевой кислоты;
1-{[4-(3-бромфениламин)хиназолин-6-ил]амид} 5-[(3-морфолин-4-илпропил)амид]пент-2-ендиоевой кислоты;
1-{[4-(3-бромфениламин)хиназолин-6-ил]амид} 5-[(3-диэтиламинопропил)-амид]пент-2-ендиоевой кислоты;
2-морфолин-4-ил-этиловый эфир 4-[4-(3-бромфениламин)хиназолин-6-илкарбамоил]бут-3-еноевой кислоты;
1-{[4-(3-бромфениламин)хиназолин-6-ил]амид} 5-{[3-(4-метилпиперазин-1-ил)пpoпил]aмид}пент-2-ендиоевой кислоты;
2-морфолин-4-ил-этиловый эфир 3-[4-(1-фенилэтиламин)пиридо[3,4-d]пиримидин-6-илкарбамоил]акриловой кислоты;
(4-имидазол-1-ил-бутил)-амид [4-(1-фенилэтиламин)пиридо[3,4-d]пиримидин-6-ил]амид бут-2-ендиоевой кислоты;
3-диэтиламинопропиловый эфир 4-[4-(1-фeнилэтилaмин)пиpидo[3,4-d]пиpимидин-6-илкapбaмoил]бyт-3-eнoeвoй кислоты;
5-{[2-(4-метилпиперазин-1-ил)этил]амид}1-{[4-(1-фенилэтиламин) пиридо[3,4-d]пиримидин-6-ил]амид}пент-2-ендиоевой кислоты;
[4-(1-фенилэтиламин)пиридо[3,4-d]пиримидин-6-ил]амид 4,4-дифтор-7-морфолин-4-ил-гепт-2-еноевой кислоты;
[4-(1-фенилэтиламин)пиридо[3,4-d]пиримидин-6-ил]амид 7-диметиламиэ-4,4-дифторгепт-2-еноевой кислоты;
[4-(1-фенилэтиламин)пиридо[3,4-d]пиримидин-6-ил]амид 7-имидазол-1-ил-гепт-2-иноевой кислоты;
(3-хлор-4-фторфенил)-[6-(5-морфолин-4-ил-пент-1-ен-1-сульфонил)-пиридо[3,4-d]пиримидин-4-ил]амин и
[4-(1-фенилэтиламино)пиридо[3,4-d]пиримидин-6-ил]амид 6-диметиламиногекс-2-иноевой кислоты.
5. Фармацевтический состав, содержащий активное вещество и фармацевтически приемлемый носитель, отличающийся тем, что в качестве активного вещества состав содержит эффективное количество, как минимум, одного соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли, эфира, амида или пролекарства.
6. Способ лечения рака, псориаза, атеросклероза, эндометриоза или лечения и предотвращения рестеноза, включающий назначение пациенту активного вещества, отличающийся тем, что в качестве активного вещества используют эффективное количество, как минимум одного, соединения по пп.1, 2 или 3 или его фармацевтически приемлемой соли, эфира, амида или пролекарства.
Текст
1 Область техники Настоящее изобретение относится к соединениям, которые являются необратимыми ингибиторами тирозинкиназ. Настоящее изобретение относится также к способу лечения рака, атеросклероза, рестеноза, эндометриоза и псориаза, а также к фармацевтической композиции, которая включает соединение, являющееся необратимым ингибитором тирозинкиназ. Предпосылки создания изобретения Рак рассматривается как заболевание внутриклеточной сигнальной системы или механизма передачи сигнала. Клетки получают инструкции из многих внеклеточных источников, заставляющих их либо пролиферировать,либо не пролиферировать. Целью системы передачи сигнала является получение этих и других сигналов клеточной поверхностью, передача их внутрь клетки и затем в ядро, цитоскелет, в транспортную систему и механизм синтеза белка. Наиболее общий случай рака представляет собой серию дефектов либо в этих белках, когда они, к примеру, мутируют, либо в регуляции количества конкретного белка в клетке, что приводит к его пере- или недопроизводству. Чаще всего возникают ключевые повреждения в клетке, которые приводят к такому состоянию,когда клеточное ядро получает сигнал к пролиферации, хотя реально такой сигнал не существовал. Это может осуществляться через различные механизмы. Иногда клетка может начать производство аутентичного фактора роста для своих собственных рецепторов, хотя не должна этого делать, это так называемый аутокринный петлевой механизм. Мутации рецепторов клеточной поверхности, которые обычно передают сигнал внутрь клетки посредством тирозинкиназ, могут приводить к активации киназы в отсутствие лиганда и пропускать сигнал, который в действительности не существует. С другой стороны, многие поверхностные киназы могут быть избыточно экспрессированы на клеточной поверхности, что приводит к непропорционально сильному ответу на слабый сигнал. Существует много уровней в клетке, на которых мутация или избыточная экспрессия может приводить к такому же ложному сигналу, возникающему в клетке, и, кроме того, существует много других видов сигнальных дефектов, вовлеченных в канцерогенез. Настоящее изобретение касается тех видов рака, которые развиваются с помощью трех описанных выше механизмов и которые вовлекают рецепторы клеточной поверхности из тирозинкиназного семейства рецептора фактора роста эпидермиса (EGFR). Это семейство включает рецептор EGF (известный также как Erb-B1), рецептор Erb-B2 и его мутантный онкобелок Neu с нерегулируемой активностью, рецепторы Erb-В 3 и Erb-B4. Кроме того, другие биологические процессы, проистекающие через посредство рецепторов семействаEGF, также могут быть подвержены лечению соединениями настоящего изобретения, описанными ниже. Двумя наиболее важными лигандами рецептора EGF являются фактор роста эпидермиса(TGF-). Эти рецепторы выполняют минимальные функции у взрослых людей, но очевидно вовлечены в канцерогенез всех видов рака, особенно раков кишечника и молочной железы. Для близкородственных рецепторов Erb-B2,Erb-В 3 и Erb-B4 основными лигандами являются члены семейства хирегулинов, поэтому и избыточная экспрессия рецептора, и его мутация недвусмысленно рассматриваются как главный фактор риска для труднопредсказуемого рака молочной железы. Кроме того, было показано,что все четыре члена этого семейства рецепторов могут формировать гетеродимерные сигнальные комплексы с другими членами семейства и что это может приводить к объединению трансформирующей способности, если более,чем один член семейства экспрессируется избыточно при малигнизации. Было показано, что избыточная экспрессия более чем одного члена семейства является частым явлением при малигнизации у человека. Помимо рака еще одним заболеванием,при котором осуществляется нежелательная пролиферация клеток, является рестеноз. При рестенозе в пролиферацию вовлечены клетки гладкой мускулатуры сосудов. Рестеноз - это основная клиническая проблема, связанная с коронарной ангиопластикой и другими медицинскими процедурами. Рестеноз обычно проявляется в пределах примерно от 0 до 6 месяцев у примерно 30%-50% пациентов, подвергавшихся баллонной ангиопластике для прочистки закупоренных коронарных артерий при лечении заболеваний сердца, обусловленных закупоркой артерий. Возникающий при этом рестеноз вызывает увеличение заболеваемости и расходов на здравоохранение. Развитие рестеноза инициируется повреждением кровяных сосудов, включая артерии и вены, с последующим высвобождением тромбообразующих, вазоактивных и митогенных факторов. Эндотелиальные и глубокие повреждения сосудов приводят к агрегации тромбоцитов,формированию тромбов, воспалению, к активации макрофагов и клеток гладкой мускулатуры. Эти события индуцируют производство и высвобождение факторов роста и цитокинов, которые, в свою очередь, могут способствовать своему собственному синтезу и высвобождению в целевых клетках. Таким образом, инициируется процесс самоувековечивания, вовлекающий факторы роста, такие как EGF, тромбоцитарный фактор роста (PDGF) или фактор роста фибробластов (FGFs). Итак, было бы полезным иметь необратимые ингибиторы путей передачи сиг 3 нала, в особенности, ингибиторы тирозинкиназ таких факторов как EGF, PDGF, FGF или онкобелка src. Пролиферативное заболевание кожи псориаз в настоящее время не имеет надежного способа лечения. Часто его лечат противоопухолевыми средствами, такими как метотрексат,у которого есть весьма серьезные побочные эффекты и который не очень эффективен в силу ограничения дозировки из-за его токсичности. Известно, что TGF- - это основной фактор роста, избыточно производимый при псориазе, так как у 50% трансгенных мышей с избыточной экспрессией TGF-a развивается псориаз. Это позволяет предположить, что хороший ингибитор передачи сигнала через EGFR может быть использован в качестве средства от псориаза,предпочтительно, но необязательно в местных формах дозировки. Особенно выгодно иметь необратимые ингибиторы тирозинкиназ в сравнении с обратимыми ингибиторами, поскольку необратимые ингибиторы могут быть использованы для длительного подавления тирозинкиназ, ограниченного лишь нормальной скоростью ресинтеза рецептора, то есть скоростью его обмена. Дополнительная информация о роли тирозинкиназ src в биологических процессах, относящихся к раку и рестенозу, может быть представлена в следующих документах, настоящим включенных в виде ссылки.Antibodies, Cancer Res, 1984; 44:1002-1007. Кроме того, следующие документы демонстрируют противоопухолевую активность ингибиторов тирозинкиназ белков. Настоящим эти документы включены в виде ссылки.Antitumor Activity, Clinical Cancer Research,1995; 1:813-821. Соединения, являющиеся обратимыми ингибиторами тирозинкиназ, описаны в патентах США 5457105, 5475001 и 5409930 и в публикациях РСТWO 9519774 и WO 9519970. Соединения, описанные здесь, структурно отличаются от ингибиторов тирозинкиназ, описанных в упомянутых выше документах, и являются необратимыми ингибиторами тирозинкиназ. 5 Краткое описание изобретения Настоящее изобретение включает соединения формулы IR1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(CH2)n-N-пиперидинил, -(СH2)n-N-пиперазинил,-(CH2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,-(СH2)n-N-пиридинил,-(СН 2)n-имидазоил,-(СН 2)n-N-имидазоил,-(СН 2)n-N-морфолино-,-(СН 2)n-N-тиоморфолино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН,-NH2, или А и В означают независимо водород, алкил с числом углеродных атомов от 1 до 6, -(СН 2)nОН, -(СН 2)n-N-пиперидинил, -(СН 2)nN-пиперазинил, -(СН 2)n-N1-пиперазинил[N4-(С 1 С 6)алкил], -(СН 2)n-N-пирролидил, -(СН 2)n-Nпиридил, -(СН 2)n-имидазоил или -(СН 2)n-Nимидазоил;Z1, Z2 или Z3 означают независимо водород, галоген, алкил с числом углеродных атомов от 1 до 6, циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6, гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2,-NH(C1-C6 алкил), -N(C1-C6 алкил)2, -NН(С 3-С 8 циклоалкил), -N(C3-C8 циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6,тиоциклоалкил с числом углеродных атомов от 3 до 8, сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил[N4-(С 1-С 6)алкил], -(СН 2)nN-пирролидил, -(СН 2)n-пиридинил, -(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-N-СН=СН-(С 1-С 6)алкил,тиоморфолино-,-(СН 2)n-N-гексагидроазепин,-(СН 2)nNH2,-(CH2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксo(C1-C6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, Nалкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2,Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6, указанная выше дляR5, может быть замещена -ОН, -NH2 или NAB,где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6; R13 означает водород или галоген;n означает число от 1 до 4, р означает 0 или 1,и их фармацевтически приемлемые соли, эфиры, амиды, и пролекарства. В предпочтительном случае соединения формулы I, Z1 и Z2 означают водород, а Z3 означает галоген. В более предпочтительном случае соединения формулы I, Z3 означает бром. 7 В другом более предпочтительном случае соединения формулы I, бром расположен в позиции 3 или мета-положении фенильного кольца. В другом предпочтительном случае Z1 означает водород, Z2 означает фтор, а Z3 означает хлор. В другом более предпочтительном случаеZ1 означает водород, Z2 означает фтор,а Z3 означает хлор, где Z2 расположен в позиции 4, а Z3 - в позиции 3 фенильного кольца. В еще одном предпочтительном случае соединения формулы I,X означает В еще одном предпочтительном случае соединения формулы I, Y означает -D-E-F, a -D-EF означает 8 В еще одном предпочтительном случае соединения формулы I, Y означает -D-E-F, а Х означает -O-(СН 2)n-имидазоил. В другом случае настоящее изобретение относится к соединениям, имеющим формулу II или отсутствует; Е означает В еще одном предпочтительном случае соединения формулы I, X означает -D-E-F, a -D-EF означаетD не означает В еще одном предпочтительном случае соединения формулы I, R2 означает водород. В еще одном предпочтительном случае соединения формулы I, Y означает -D-E-F, а Х означает -O(СН 2)n-морфолиногруппу. В еще одном предпочтительном случае соединения формулы I, R5 означает карбоксил,(C1-C6 алкил)оксикарбонил или алкил с числом углеродных атомов от 1 до 6. В еще одном предпочтительном случае соединения формулы I, Y означает -D-E-F, а Х означает -O(СН 2)n-морфолиногруппу. В еще одном предпочтительном случае соединения формулы I, Y означает -D-E-F, а Х означает -O-(СН 2)n-N1-пиперазинил[N4-(С 1-С 6) алкил].R1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(СН 2)n-N-пиперидинил, -(СН 2)n-N-пиперазинил,-(СН 2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,-(СН 2)n-пиридинил,-(СН 2)n-N-имидазоил,-(СН 2)n-N-имидазоил,-(СН 2)n-N-тиоморфо-(СН 2)n-N-морфолино-,лино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН,-NH2, или А и В означают независимо во 9 дород, алкил с числом водородных атомов от 1 до 6, -(СН 2)nОН, -(СН 2)n-N-пиперидинил, (СН 2)n-N-пиперазинил, -(СН 2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,(СН 2)n-N-пиридил, -(СН 2)n-N-имидазоил, или (СН 2)n-N-имидазоил; Е 1, Е 2 и Е 3 означают независимо галоген,алкил с числом углеродных атомов от 1 до 6,циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6,гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6 алкил),-N(C1-C6 алкил)2, -NH(C3-C8 циклоалкил), -N(C3C8 циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидо-группу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8,сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил [N4-(С 1-С 6)алкил], -(СН 2)nN-пирролидил,-(СН 2)n-пиридинил,-(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-Nтиоморфолино-,-СН=СН-(С 1-С 6)алкил,-(СН 2)nNH2,-(СН 2)n-N-гексагидроазепин,-(СН 2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксо(С 1-С 6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6,N-алкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил,где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных изZ1, Z2, Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена -ОН, -NH2 или NAB, где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6;n означает число от 1 до 4, р означает 0 или 1; и их фармацевтически приемлемые соли,эфиры, амиды, и пролекарства. В предпочтительном случае соединений формулы II, Е 1 и Е 2 означают водород, а Е 3 означает галоген. 10 В более предпочтительном случае соединений формулы II галоген означает бром. В другом более предпочтительном случае соединений формулы II бром расположен в позиции 3 или мета-положении фенильного кольца. В другом более предпочтительном случае Е 1 означает водород, Е 2 означает хлор, а Е 3 означает фтор. В еще одном предпочтительном случае соединений формулы II, Q означает В еще одном предпочтительном случае соединений формулы II, Q означает В еще одном предпочтительном случае соединений формулы II, Q означает В еще одном предпочтительном случае соединений формулы II, Q означает В еще одном предпочтительном случае соединений формулы II, Х означает В еще одном предпочтительном случае соединений формулы II, Х означает В еще одном случае, настоящее изобретение относится к соединениям, имеющим формулу IIIR1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(СН 2)n-N-пиперидинил, -(СН 2)n-N-пиперазинил, -(СН 2)n-N1-пиперазинил [N4-(С 1-С 6) алкил], -(СН 2)n-N-пирролидил, -(СН 2)n-пиридинил,-(СН 2)n-N-имидазоил,-(СН 2)n-имидазоил,-(СН 2)n-N-морфолино-, -(СН 2)n-N-тиоморфолино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2,А и В означают независимо водород,или алкил с числом водородных атомов от 1 до 6,-(СН 2)nОН, -(СН 2)n-N-пиперидинил, -(СН 2)n-Nпиперазинил, -(СН 2)n-N1-пиперазинил [N4-(С 1 С 6)алкил], -(СН 2)n-N-пирролидил, -(СН 2)n-N-(СН 2)n-Nпиридил,-(СН 2)n-имидазоил,имидазоил; Е 1, Е 2 и Е 3 означают независимо галоген,алкил с числом углеродных атомов от 1 до 6,циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6,гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6 алкил),-N(C1-C6 алкил)2, -NH(C3-C8 циклоалкил), -N(C3C8 циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8, 001595 12 сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил [N4-(С 1-С 6)алкил], -(СН 2)nN-пирролидил, -(СН 2)n-пиридинил, -(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-Nтиоморфолино,-СН=СН-(С 1-С 6)алкил,-(СН 2)nNH2,-(СН 2)n-N-гексагидроазепин,-(CH2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксо(С 1-С 6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, Nалкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2,Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена ОН, -NH2 или NAB, где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6;n означает число от 1 до 4; и их фармацевтически приемлемые соли, эфиры, амиды, и пролекарства. В предпочтительном случае соединений формулы III, Q означает В другом предпочтительном случае соединений формулы III, Q означает В еще одном предпочтительном случае соединений формулы III, X означает В еще одном предпочтительном случае соединений формулы III, E1 и Е 2 означают водород, а Е 3 означает бром. В еще одном предпочтительном случае соединений формулы III, Е 1 означает водород, Е 2 означает хлор, а Е 3 означает фтор. В еще одном предпочтительном случае соединений формулы III, X означает В еще одном предпочтительном случае Q означает 6-замещенный бензотиено[3,2-d]пиримид-4-ил. Настоящее изобретение включает также фармацевтически приемлемые композиции, в состав которых входит соединение формулы I,II или III. Настоящее изобретение включает также способ лечения рака, который заключается в назначении пациенту, страдающему раком, терапевтически эффективного количества соединения формулы I, II или III. Настоящее изобретение также включает способ лечения или предотвращения рестеноза,который заключается в назначении пациенту,страдающему рестенозом, или рискующему заболеть рестенозом, терапевтически эффективного количества соединения формулы I, II или III. Настоящее изобретение включает также способ лечения псориаза, который заключается в назначении пациенту, страдающему псориазом, терапевтически эффективного количества соединения формулы I, II или III. Настоящее изобретение включает также способ лечения атеросклероза, который заключается в назначении пациенту, страдающему атеросклерозом, терапевтически эффективного количества соединения формулы I, II или III. Настоящее изобретение включает также способ лечения эндометриоза, который заключается в назначении пациенту, страдающему эндометриозом, терапевтически эффективного количества соединения формулы I, II или III. Настоящее изобретение включает также способ необратимого ингибирования тирозинкиназ, который заключается в назначении пациенту, нуждающемуся в ингибировании тирозинкиназ, количества соединения формулы I, II илиIII, ингибирующего тирозинкиназу. Настоящее изобретение включает следующие соединения:N-[4-[(3-бромфенил)амино]хиназолин-6 ил]-Е,4-(3-(N,N-диметиламино)пропиламино-4 оксобут-2-енамид; 4-[(3-бpoмфeнил)aминo)-6-(этeнcyльфoнил)пиpидo[3,4-d]пиpимидин; 1-[4-(3-бромфениламино)хиназолин-6-ил]пиррол-2,5-дион; 1-[4-(3-бромфениламино)-хиназолин-6-ил]проп-2-ен-1-он; 4-(3-бромфениламино)-хиназолин-6 иловый эфир акриловой кислоты; мeтил-N-[4-[(3-бpoмфeнил)aминo]-Pэтeнилпиpидo[3,4-d]пиpимидин-6-ил]фосфонамидат; 4-(3-бромфениламино)хиназолин-7 иловый эфир акриловой кислоты; 1-[4-(3-бромфениламино)хиназолин-6-ил]бут-3-ен-2-он; 4-(3-хлор-4-фторфениламино)-7-метоксихинзолин-6-иловый эфир акриловой кислоты;N-[4-[(3-(хлор-4-фторфенил)амин]-5-фтор 7-(1,N-имидазоил)пропокси]хиназолин-6-ил] акриламид. Подробное описание изобретения Настоящее изобретение включает соединения формулы IR1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(СН 2)n-N-пиперидинил, -(СН 2)n-N-пиперазинил,-(СН 2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,-(СН 2)n-пиридинил,-(СН 2)n-N-имидазоил,-(СН 2)n-имидазоил,-(СН 2)n-N-морфолино-, -(СН 2)n-N-тиоморфолино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2,или А и В означают независимо водород,алкил с числом водородных атомов от 1 до 6,-(СН 2)nОН, -(СН 2)n-N-пиперидинил, -(СН 2)n-Nпиперазинил, -(СН 2)n-N1-пиперазинил [N4-(С 1 С 6)алкил], -(СН 2)n-N-пирролидил, -(СН 2)n-Nпиридил, -(СН 2)n имидазоил, или -(СН 2)n-Nимидазоил; Z1, Z2 или Z3 означают независимо водород, галоген, алкил с числом углеродных атомов от 1 до 6, циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8,нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6, гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6,-NH2,-NH(C1-C6 алкил),-N(C1-C6 алкил)2,-NH(C3-C8 циклоалкил), -N(C3-C8 циклоалкил)2,гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6,сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8, сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил [N4-(C1-С 4)алкил], -(СН 2)nN-пирролидил, -(СН 2)n-пиридинил, -(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-N 23-СН=СН-(С 1-С 6)алкил,тиоморфолино-,-(СН 2)n-N-гексагидроазепин,-(CH2)nNH2,-(CH2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксо(С 1-С 6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, Nалкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2,Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6, указанная выше дляR5, может быть замещена -ОН, -NH2 или NAB,где А и В определены так же как и выше, R6 значает водород или алкил с числом углеродных атомов от 1 до 6; R13 означает водород или галоген;n означает число от 1 до 4, р означает 0 или 1,и их фармацевтически приемлемые соли,эфиры, амиды, и пролекарства. В другом случае, настоящее изобретение также включает соединения формулы IIR1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(СН 2)n-N-пиперидинил, -(СН 2)n-N-пиперазинил,-(СН 2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,-(СН 2)n-пиридинил,-(СН 2)n-имидазоил,-(СН 2)n-N-имидазоил,-(СН 2)n-N-морфолино-, -(СН 2)n-N-тиоморфолино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2,А и В означают независимо водород, алкил с числом водородных атомов от 1 до 6,-(СН 2)nОН, -(СН 2)n-N-пиперидинил, -(СН 2)n-Nпиперазинил, -(СН 2)n-N1-пиперазинил [N4-(С 1-(СН 2)n-N-пирролидил,-(СН 2)nС 6)алкил],пиридил,-(СН 2)n-имидазоил,-(СН 2)n-Nимидазоил; Е 1, Е 2 и Е 3 означают независимо галоген,алкил с числом углеродных атомов от 1 до 6,циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6,гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6 алкил),-N(C1-C6 алкил)2, -NН(С 3-С 8 циклоалкил), -N(C3C8 циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8,сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил [N4-(С 1-С 6)алкил], -(СН 2)nN-пирролидил, -(СН 2)n-пиридинил, -(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-N 25-СН=СН-(С 1-С 6)алкил,тиоморфолино-,-(СН 2)nNH2,-(СН 2)n-N-гексагидроазепин,-(CH2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксо(С 1-С 6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6,N-алкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил,где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных изZ1, Z2, Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена -ОН, -NH2 или NAB, где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6,n означает число от 1 до 4, р означает 0 или 1,и их фармацевтически приемлемые соли, эфиры, амиды, и пролекарства В другом случае, настоящее изобретение также включает соединения формулы IIIR1 означает водород, галоген или алкил с числом углеродных атомов от 1 до 6;R2, R3 и R4 означают независимо водород,алкил с числом углеродных атомов от 1 до 6,-(СН 2)n-N-пиперидинил, -(СН 2)n-N-пиперазинил,-(СН 2)n-N1-пиперазинил[N4-(С 1-С 6)алкил],-(СН 2)n-N-пирролидил,-(СН 2)n-пиридинил,-(СН 2)n-N-имидазоил,-(СН 2)n-имидазоил,-(СН 2)n-N-морфолино-, -(СН 2)n-N-тиоморфолино-, -(СН 2)n-N-гексагидроазепин или замещенный алкил с числом углеродных атомов от 1 до 6, где заместители выбраны из ряда: -ОН, -NH2 или А и В означают независимо водород,алкил с числом водородных атомов от 1 до 6,-(СН 2)nОН, -(СН 2)n-N-пиперидинил, -(СН 2)n-Nпиперазинил, -(СН 2)n-N1-пиперазинил [N4-(С 1 С 6)алкил], -(CH2)n-N-пирролидил, -(СН 2)n-Nпиридил, -(СН 2)n-имидазоил, или -(СН 2)n-Nимидазоил; Е 1, Е 2 и Е 3 означают независимо галоген,алкил с числом углеродных атомов от 1 до 6,циклоалкил с числом углеродных атомов от 3 до 8, алкоксигруппу с числом углеродных атомов от 1 до 6, циклоалкоксигруппу с числом углеродных атомов от 3 до 8, нитрогруппу, перфторалкил с числом углеродных атомов от 1 до 6,гидроксил, ацилоксигруппу с числом углеродных атомов от 1 до 6, -NH2, -NH(C1-C6 алкил),-N(C1-C6 алкил)2, -NH(C3-C8 циклоалкил), -N(C3C8 циклоалкил)2, гидроксиметил, ацил с числом углеродных атомов от 1 до 6, цианогруппу, азидогруппу, тиоалкил с числом углеродных атомов от 1 до 6, сульфинилалкил с числом углеродных атомов от 1 до 6, сульфонилалкил с числом углеродных атомов от 1 до 6, тиоциклоалкил с числом углеродных атомов от 3 до 8,сульфинилциклоалкил с числом углеродных атомов от 3 до 8, сульфонилциклоалкил с числом углеродных атомов от 3 до 8, меркаптогруппу, алкоксикарбонил с числом углеродных атомов от 1 до 6, циклоалкоксикарбонил с числом углеродных атомов от 3 до 8, алкенил с числом углеродных атомов от 2 до 4, циклоалкенил с числом углеродных атомов от 4 до 8 или алкинил с числом углеродных атомов от 2 до 4;R5 означает водород, галоген, перфторалкил с числом углеродных атомов от 1 до 6, 1,1 дифторалкил с числом углеродных атомов от 1 до 6, алкил с числом углеродных атомов от 1 до 6, -(СН 2)n-N-пиперидинил, -(СН 2)n-пиперазинил,-(СН 2)n-пиперазинил [N4-(С 1-С 6)алкил], -(СН 2)nN-пирролидил, -(СН 2)n-пиридинил, -(СН 2)n-Nимидазоил, -(СН 2)n-N-морфолино-, -(СН 2)n-N-СН=СН-(С 1-С 6)алкил,тиоморфолино-,-(СН 2)nNH2,-(СН 2)n-N-гексагидроазепин, 27-(CH2)nNH(C1-C6 алкил), -(CH2)nN(C1-C6 алкил)2,-1-оксо(С 1-С 6)алкил, карбокси-, алкилоксикарбонил с числом углеродных атомов от 1 до 6, Nалкилкарбамоил с числом углеродных атомов от 1 до 6, фенил или замещенный фенил, где замещенный фенил может иметь от одного до трех заместителей, независимо выбранных из Z1, Z2,Z3 или моноциклической гетероарильной группы, и каждая алкильная группа с числом углеродных атомов от 1 до 6 может быть замещена ОН, -NH2 или NAB, где А и В определены так же как и выше, R6 означает водород или алкил с числом углеродных атомов от 1 до 6;n означает число от 1 до 4, р означает 0 или 1; и их фармацевтически приемлемые соли,эфиры, амиды, и пролекарства. Термин алкил означает линейную или разветвленную углеводородную цепь. Представительными примерами алкильных групп являются метил, этил, пропил, изопропил, изобутил,бутил, трет-бутил, втор-бутил, пентил и гексил. Термин алкоксигруппа означает алкильную группу, соединенную с атомом кислорода. Представительные примеры алкоксигрупп включают метокси-, этокси-, трет-бутокси-,пропокси- и изобутоксигруппы. Термин галоген включает хлор, фтор,бром и иод. Термин алкенил означает разветвленную или линейную углеводородную цепь с одной или более двойными углерод-углеродными связями. Термин циклоалкил означает циклический углеводород. Примеры циклоалкильных групп включают циклопропил, циклобутил,циклопентил и циклогексил. Термин циклоалкокси означает циклоалкильную группу, соединенную с атомом кислорода. Термин перфторалкил означает алкильную группу, в которой все атомы водорода замещены атомами фтора. Термин ацил означает группу, полученную из органической кислоты путем удаления гидроксила (-ОН). Термин ацилоксигруппа означает ацильную группу, соединенную с атомом кислорода. Термин тиоалкил означает алкильную группу, соединенную с атомом серы. Термин сульфинилалкил означает сульфинильную группу, соединенную с алкильной группой. Термин сульфонилалкил означает сульфонильную группу, соединенную с алкильной группой. Термин тиоциклоалкил означает циклоалкильную группу, соединенную с атомом серы. Термин сульфинилциклоалкил означает сульфинильную группу, соединенную с циклоалкильной группой. 28 Термин сульфонилциклоалкил означает сульфонильную группу, соединенную с циклоалкильной группой. Термин меркаптогруппа означает группу-SH. Термин алкоксикарбонил означает алкоксигруппу, соединенную с карбонильной группой. Термин циклоалкоксикарбонил означает циклоалкоксигруппу, соединенную с карбонильной группой. Термин циклоалкенил означает циклический углеводород, содержащий одну или более двойных углерод-углеродных связей. Термин алкинил означает углеводород с одной или более тройных углерод-углеродных связей. Термин моноциклический гетероарил означает гетероциклическое арильное соединение, имеющее только одну кольцевую структуру. Такое циклическое соединение является ароматическим и содержит один или более гетероатомов. Примеры гетероатомов включают,но не ограничиваются ими: азот, кислород, серу и фосфор. Примеры моноциклических гетероарильных групп включают, но не ограничиваются ими: пиридил, тиенил и имидазоил. Символ - означает ковалентную связь. Соединения формул I, II и III являются необратимыми ингибиторами тирозинкиназ, в особенности, тирозинкиназ EGF. Терапевтически эффективные количества соединений формул I, II или III назначают пациентам, страдающим раком, пациентам, страдающим рестенозом или рискующим заболеть рестенозом или пациентам, страдающим псориазом, атеросклерозом или эндометриозом. Опытный специалист вполне способен идентифицировать пациентов,страдающих раком, рестенозом, псориазом, атеросклерозом или эндометриозом, и пациентов,рискующих заболеть рестенозом. Термин пациент означает животных, таких как собаки,кошки, коровы, овцы, а также включает и человека. Соединения настоящего изобретения назначают людям и животным для приема оральным, ректальным, парентеральным (внутривенно, внутримышечно, или подкожно), внутриполостным, внутривлагалищным, внутрибрюшинным, внутрипузырным, местным (порошки, мази или капли) путем или буккальным или назальным распылением. Эти соединения назначают сами по себе или как часть фармацевтически приемлемой композиции, которая включает фармацевтически приемлемые наполнители. Замечено, что более чем одно соединение формулы I, II или Ш могут быть назначены либо одновременно, либо последовательно. Композиции, подходящие для парентеральных инъекций, содержат физиологически приемлемые водные или неводные растворы,дисперсии, суспензии или эмульсии и стериль 29 ные порошки для перевода их в стерильные инъецируемые растворы или дисперсии. Примеры подходящих водных и неводных носителей,разбавителей, растворителей или наполнителей включают воду, этанол, полиспирты (полипропиленгликоль, полиэтиленгликоль, глицерин и им подобные), соответствующие их смеси, растительные масла (как, например, оливковое масло) и подходящие для инъекций органические эфиры, такие как этилолеат. Соответствующую текучесть поддерживают, например, за счет использования специальных добавок, таких как лецитин, за счет контроля размера частиц в случае дисперсий и за счет использования поверхностно-активных веществ. Эти композиции могут также содержать адьюванты, такие как консерванты, увлажнители, эмульгаторы и диспергирующие компоненты. Предотвращение деятельности микроорганизмов может быть достигают с помощью различных антибактериальных и противогрибковых веществ, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты и им подобных. При необходимости вводят в композицию изотонические компоненты, например, сахар, хлорид натрия и им подобные. Продолжительное всасывание инъецируемых фармацевтических форм достигают путем использования компонентов, задерживающих всасывание, таких как моностеарат алюминия и желатин. Твердые формы дозировки для орального назначения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых формах дозировки активное соединение смешивают с как минимум одним обычным наполнителем(или носителем), такими как цитрат натрия или дикальцийфосфат или (а) сухими разбавителями, как например, крахмал, лактоза, сахароза,глюкоза, маннитол и кремниевая кислота; (б) связующими веществами, как, например, карбоксиметилцеллюлоза, альгинат, желатин, поливинилпирролидон, сахароза, и арабская камедь; (в) увлажнителями, как, например, глицерин; (г) разрыхляющими компонентами, как,например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые комплексные силикаты и карбонат натрия; (д) замедлителями растворения, как, например, парафин; (е) усилителями всасывания, как, например, соединения четвертичного аммония; (ж) смачивающими веществами, как например, цетиловый спирт и моностеарат глицерина; (з) адсорбентами, как, например, каолин и бентонит и (и) смазывающими веществами, как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае капсул, таблеток и пилюль, формы дозировки могут также включать буферные компоненты. Твердые композиции подобного типа также используют в качестве содержимого в мягко 30 и твердо заполненных желатиновых капсулах с использованием таких наполнителей как лактоза или молочный сахар, а также высокомолекулярнные полиэтиленгликоли и им подобные вещества. Твердые формы дозировки, такие как таблетки, драже, капсулы, пилюли и гранулы изготавливают с покрытием и скорлупой, например,с покрытием для растворения в кишечнике и другими, хорошо известными специалистам. Они могут содержать омутняющие вещества, и имеют такой состав, который допускает высвобождение активного соединения или соединений в определенной точке пищеварительного тракта путем задержки растворения. Для этого используют полимерные вещества и воски. Активные соединения также назначают в микроинкапсулированной форме с одним или более упомянутыми наполнителями, если необходимо. Жидкие формы дозировки для орального назначения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие формы дозировки содержат инертные разбавители, обычно используемые в фармацевтике, такие как вода или другие растворители,солюбилизирующие вещества,эмульгаторы, как, например, этиловый спирт,изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, в особенности, хлопковое масло,арахисовое масло, кукурузное масло, оливковое масло, касторовое масло и кунжутное масло,глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и жирнокислотные эфиры сорбитана, или смеси этих веществ и им подобные. Помимо таких инертных разбавителей композиции могут также включать адьюванты,такие как смачивающие вещества, эмульгаторы и суспендирующие вещества, осладители, вкусовые добавки, ароматизаторы. Суспензии, вдобавок к активным соединениям содержат суспендирующие вещества, как,например, этоксилированный изостеариловый спирт, сорбитоловые или сорбитановые эфиры полиоксиэтилена, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит,агар-агар и трагакант или смеси этих веществ, и им подобные. Композиции ректального назначения предпочтительно являются суппозиториями,которые изготовляют путем смешивания соединений настоящего изобретения с подходящим не раздражающим наполнителем или носителем, такими как какао-масло, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при обычных температурах, но плавятся в прямой кишке и вагинальной полости, высвобождая активный компонент. 31 Формы дозировки местного назначения соединений настоящего изобретения включают мази, порошки, аэрозоли и ингаляции. Активный компонент смешивают в стерильных условиях с физиологически приемлемым носителем и какими-либо консервантами, буферами или,при необходимости, пропеллантами. Офтальмологические составы, глазные мази, порошки и растворы также рассматриваются как включенные в рамки настоящего изобретения. Термин фармацевтически приемлемые соли, эфиры, амиды и пролекарства, в том смысле, как он используется здесь, относится к тем карбоксилатным солям, солям присоединения аминокислот, эфирам, амидам и пролекарствам соединений настоящего изобретения, которые являются, с медицинской точки зрения,подходящими для использования в контакте с тканями пациента без чрезмерной токсичности,раздражающей способности, аллергогенности и т. д., с приемлемым соотношением выгода/ риск и эффективными в их области применения, также, когда это возможно, и форме цвиттерионов, веществами настоящего изобретения. Термин соли относится к относительно нетоксичным солям присоединения неорганических и органических кислот и соединений настоящего изобретения. Эти соли могут быть приготовлены in situ в ходе окончательного выделения и очистки соединений или в отдельной реакции очищенных соединений в их свободной основной форме с соответствующими органическими или неорганическими кислотами и последующим выделением полученных таким образом солей. Представительные соли включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, фосфаты, тозилаты,цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты,лактобионаты, лаурилсульфонаты и им подобные. Они могут включать катионы на основе щелочных и щелочно-земельных металлов, таких как натрий, литий, калий, кальций, магний и им подобные, а также нетоксичный аммоний,четвертичный аммоний и амин-катион, включая,но не ограничиваясь ими, тетраметиламмоний,тетраэтиламмоний, метиламин, диметиламин,триметиламин, триэтиламин, этиламин, и им подобные (см., например, S. М. Berge, et al.,"Pharmaceutical Salts", J. Pharm. Sci., 1977; 66:119, включенную сюда в виде ссылки). Примеры фармацевтически приемлемых нетоксичных эфиров соединений настоящего изобретения включают алкильные с числом углеродных атомов от 1 до 6 эфиры, где алкил может быть линейный или разветвленный. Приемлемые эфиры также включают циклоалкильные с числом углеродных атомов от 5 до 7 эфиры, а также арилалкильные эфиры, такие как (но не ограничиваясь им) бензил. Предпочтительны 32 алкильные с числом углеродных атомов от 1 до 4 эфиры. Эфиры соединений настоящего изобретения получают в соответствии с известными способами. Примеры фармацевтически приемлемых нетоксичных амидов соединений настоящего изобретения включают амиды, полученные из аммиака, первичные алкильные с числом углеродных атомов от 1 до 6 амины и вторичные диалкильные с числом углеродных атомов от 1 до 6 амины, где алкильные группы линейные или разветвленные. В случае вторичных аминов,амин может быть также в форме 5- или 6 членного гетероцикла, содержащего 1 атом азота. Предпочтительны амиды, полученные из аммиака, первичные алкильные с числом углеродных атомов от 1 до 3 амины и вторичные диалкильные с числом углеродных атомов от 1 до 2 амины. Амиды соединений настоящего изобретения получают известными способами. Термин пролекарство относится к соединениям, которые in vivo быстро превращаются в соединения упомянутых выше формул,например, путем гидролиза в крови. Основательное обсуждение вопроса содержится в Т.Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе публикации включены здесь в виде ссылки. Соединения настоящего изобретения назначают пациенту с дозировкой в диапазоне от примерно 0.1 до примерно 1000 мг в день. Для нормального взрослого человека с весом тела около 70 кг, дозировка в пределах от примерно 0.01 до примерно 100 мг на килограмм веса тела в день является достаточной. В специальных случаях, однако, дозировки варьируют. Например, дозировка может зависеть от множества факторов, включая состояние пациента, условия лечения и фармакологическая активность конкретного используемого соединения. Определение оптимальной дозировки для конкретного пациента является обычной задачей для специалиста в данной области. Соединения настоящего изобретения находятся в различных стереоизомерных формах в силу наличия в них ассиметричных центров. Подразумевается, что все стереоизомерные формы этих соединений, а также их смеси, включая рацемические, являются частью настоящего изобретения. Кроме того, соединения настоящего изобретения находятся как в несольватированной,так и в сольватированной фармацевтически приемлемыми растворителями, такими как вода,этанол и им подобные, формах. В общем случае,сольватированные формы рассматриваются как эквивалентные несольватированным формам для целей настоящего изобретения.I, II или III могут быть либо синтетического,либо биологического происхождения. Следующие ниже примеры иллюстрируют конкретные случаи воплощения настоящего изобретения, но ни коим образом не ограничивают их полный перечень, включенный в формулу изобретения. Общие схемы синтеза Алкилирование через амин с помощью акцептора боковых цепей по Михаэлу Амин ацилируют либо кислотой в присутствии вспомогательного агента, такого какEDAC, либо кислым хлоридом. Амин, в свою очередь получают восстановлением соответствующего нитро-соединения, замещением галогена амином или аммонийным эквивалентом или, в случае пиридо[4,3-d]пиримидинов, непосредственным включением в ходе синтеза. 2 галоидалкилсульфонилгалоиды образуют винилсульфонамиды, когда их обрабатывают ариламинами и избытком основных третичных аминов.C/N означает атом либо углерода, либо азота в указанном положении.означает связь, которая может существовать, но может и не существовать. Алкилирование через кислород с помощью акцептора боковых цепей по Михаэлу Гидроксильную группу ацилируют либо кислотой в присутствии вспомогательного агента, такого как EDAC, или кислым хлоридом. Гидроксильное соединение может, в свою очередь, получают расщеплением соответствующего метального эфира. 3-метилтиоалканоевая кислота или ее кислые хлориды могут быть использованы для ацилирования по кислороду с последующим 8-алкилированием или окислением и щелочным или термическим элиминированием. 34 Аr и R означают арильную группу, a R означает органическую группу, как указано в примерах. Алкилирование через углерод с помощью акцептора боковых цепей по Михаэлу Для присоединения боковой цепи к соответствующим образом замещенному хиназолин/пиридопиримидин/пиримидинопиримидино вому трициклу используют присоединение поStille или Suzuki. Последний, в свою очередь,получают в виде арилогалоида известным способом, в виде арилтрифлята путем трифляции гидроксильного соединения, описанного выше,в виде арилстаннанов путем реакции упомянутых трифлятов с гексаметилдистаннаном или в виде арилборных кислот путем превращения арилиодидов в арилорганометаллические соединения с последующей обработкой боратными эфирами и гидролизом. Альтернативным путем арилиодиды могут быть превращены в арилцинковые вещества и соединены с активированными галоидными соединениями. Алкилирование через серу с помощью акцептора боковых цепей по Михаэлу Активированные галоиды в пиридопиримидинах и пиримидинопиримидинах могут быть замещены соответствующими 2-гидрокситиолатами. Которые, в свою очередь, могут быть окислены до сульфонов и дегидрированы обработкой мезилхлоридом и несколькими эквивалентами основания. Для хиназолинов и упомянутых трициклов, либо в только что описанной последовательности для пиридопиримидинов используют активированный галоген,особенно фтор, либо арилйодный предшественник металлируют, гасят серой или подходящим источником электрофильной серы, и полученный в результате арилтиол используют, чтобы открыть терминальный эпоксид с получением 2 гидрокситиоэфира, который может быть превращен в винилсульфон окислением и дегидрированием, как описано выше. Алкилирование через гидразин с помощью акцептора боковых цепей по Михаэлу Активированные галоиды в пиридопиримидинах и пиримидинпиримидинах и соответствующим образом замещенных хиназолинах замещают (N-алкил)-гидразином. Альтернативным образом, аминопроизводное желаемого цикла диазотируют и затем восстановливают до гидразина. Дистальный азот гидразина можно затем ацилировать, сульфонилировать и фосфорилировать способами хорошо известными специалистам. Алкилирование через метиленамин с помощью акцептора боковых цепей по Михаэлу Активированные галоиды в пиридопиримидинах и пиримидинпиримидинах и соответствующим образом замещенных хиназолинах замещают цианидом, предпочтительно в присутствии медной или никелевой соли в качестве катализатора. Альтернативным образом, аминопроизводное желаемого циклического соединения диазотируют и затем превращают в нитрил,как описано выше. В некоторых случаях нитрильная функциональность может быть включена в гетероцикл на ранних этапах синтеза либо сама по себе, либо через карбоксильную кислоту или альдегид, которые легко превращаются в нитрильные соединения способами, известными любому специалисту. Восстановление нитрила до метиленамина сопровождается ацилированием по азоту, сульфонилированием или фосфорилированием, способами, хорошо известными специалистам в данной области. Алкилирование через метиленокси-O с помощью акцептора боковых цепей по Михаэлу Гидроксиметильные соединения включают в соответствующие гетероциклы различными путями, очевидными для опытных специалистов. Например, йодхиназолины карбонилируют по реакции Гека (Heck), а затем восстанaвливают NaBH4 до желаемого предшественника. Аминопиридопиримидины диазотируют, превращают в нитрил, частично восстановливают до имина, гидролизуют, и полученный в результате альдегид восстановливают до гидроксиметила. Кислород гидроксиметила затем ацилируют, сульфонилируют или фосфорилируют способами, хорошо известными специалистам. Алкилирование через этан с помощью акцептора боковых цепей по Михаэлу Михаэлевское присоединение купрата, полученного через органоцинкат из йодхиназолина, к дивинилкетону или соответствующим образом маскированному по одной функциональной группе его производному с последующим размаскированием второй ненасыщенной функциональности, если это необходимо, даст соединение желаемого типа. Альдегиды, полученные из пиридопиримидинов или пиримидинпиримидинов, как описано выше, могут быть гомологизированы до желаемого соединения применением широкого разнообразия методик, одна из которых проиллюстрирована ниже, любым специалистом в данной области. Алкилирование через аминометил-С с помощью акцептора боковых цепей по Михаэлу Аминогетероциклы описанного в данной заявке типа могут быть алкилированы различными эквивалентами 1-бромбут-3-ен-2-она,маскированными по двойной связи, с после 37 дующим размаскированием ненасыщенности способами, известными специалистам. Алкилирование через гидроксиметил-С с помощью акцептора боковых цепей по Михаэлу Гидрокси-гетероциклы, полученные, как было описано ранее, из метокси-гетероциклов,могут быть алкилированы различными эквивалентами 1-бромбут-3-ен-2-она, маскированными по двойной связи, с последующим размаскированием ненасыщенности способами, известными специалистам. Альтернативным образом,алкилирование фенола осуществляют хлоруксусной кислотой с последующим превращением в ацилхлорид и присоединением Стилла (Stille) такого ацилгалоида к соответствующему алкенил-станнану. Алкилирование через тиометил-С с помощью акцептора боковых цепей по Михаэлу. Соответствующие меркапто-гетероциклы,полученные замещением активированных галоидов на гетероароматические кольца, могут быть алкилированы различными эквивалентами 1-бромбут-3-ен-2-она,маскированными по двойной связи, с последующим размаскированием ненасыщенности способами, известными специалистам. Альтернативным образом, алкилирование тиола может быть осуществлено хлоруксусной кислотой, с последующим превращением в ацилхлорид и присоединением СтиллаN-[4-(3-бромфениламин)-пиридо[4,3-d] пиримидин-7-ил]-N-(3-морфолин-4-ил-пропил)акриламид может быть получен ацилированием 38 7-амино-4-[(3-бромфенил)амино]пиридо[4,3-d] пиримидина [J. Med. Chem., 1995:3780] способами известными специалистами в данной области. Например, ацилирование акриловой кислотой может быть осуществляют путем использования стандартного конденсирующего агента, такого как 1-(3-диметиламинопропил)-3 этилкарбодиимид НСl (EDAC) или путем использования акрилоилхлорида и третичного основания, такого как диизопропилэтиламин, в качестве поглотителя кислоты. Последующее N-алкилирование акриламидов может быть осуществлено способами, хорошо известными специалистам. Например,превращение амида в его моноанион с помощью стандартных реагентов, таких как гидрид натрия, с последующим замещением на соответствующий галоид, такой как N-(3-хлорпропил) морфолин или N-(4-хлорбутил)морфолин, дает желаемый алкилированный амид. Общий способ Б. Альтернативным образом, N-[4-(3-бромфениламин)пиридо[4,3-d]пиримидин-7-ил]-N-(3 морфолин-4-ил-пропил)-акриламид получают обработкой 7-фтор-4-[(3-бромфенил)амин]пиридо-[4,3-d]-пиримидинаN-(3-аминопропил) морфолином в диметилсульфоксиде с последующим ацилированием акриловой кислотой и связующим агентом, таким как 1-(3 диметиламинопропил)-3-этилкарбодиимид НСl(приготовленного из 4-[(3-бромфенил)-амин]-6 фторпиридо[3,4-d]пиримидина и 3-морфолинпроп-1-иламина), ДМАП (40 мг) и EtaN (избыток, 2,0 мл) при 0 С в атмосфере азота добавляют акрилоилхлорид (1,2 мол. экв., 1.08 мМоль,89 мкл). После 1 ч перемешивания добавляют еще две порции (по 89 мкл каждая) кислого хлорида в течении последующих двух часов,после чего смесь перемешивают еще 1 ч при 20 С, разбавляют водой и экстрагируют EtOAc. Объединенный органический экстракт промывают соляным раствором, сушат над Na2SO4, и концентрируют под вакуумом, после чего хроматографируют на силикагеле с градиентной элюцией смесью МеОН/ЕtOАс с соотношением от 1:9 до 1:5, с получением N-[4-[(3-бромфенил) амино]пиридо[3,4-d]пиримидин-6-ил]-N-[3 морфолинпропил]акриламида] (142 мг, 32%) в виде порошка кремового цвета, Тпл(СН 2 Сl2/ гексан)=178-180 С.(s, 1H, NH), 9.15 (s, 1H, ароматика), 8.80 (s, 1H,ароматика), 8.47 (s, 1H, ароматика), 8.21 (br s,1H, H-2'), 7.92 (br d, J=7.6 Гц, 1H, H-6'), 7.41 (t,J=8.0 Гц, 1H, H-5'), 7.37 (dt, J=8.1 Гц, J=1.6 Гц,J=1.6 Гц, 1H, H-4'), 6.25 (m, 2H, CH2CHCO,CH2CHCO), 5.66 (m, 1H, CH2CHCO), 3.98 (t,J=7.5 Гц, 2 Н, CH2NRCO), 3.46 (t, J=4.5 Гц, 4H,морфолинометилен), 2.29 (t, J=7.1 Гц, 2H,CH2CH2CH2NRCO), 2.24 (br s, 4H, морфолинометилен), 1.73 (квинтет, J=7.2 Гц, 2H,СН 2 СН 2 СН 2). 13 С ЯМР-спектроскопия:164.84, 156.69,155.80, 151.83, 150.05, 143.01, 140.02, 130.51,129.27, 127.88, 126.76, 124.32, 121.19, 120.82,113.02, 66.02 (х 2), 55.05, 53.02 (х 2), 45.85, 24.63. Результаты анализа для C23H25BrN6O2H2O: Расчетные величины: С 53.6; Н 5.3; N 16.3%. Полученные величины: С 53.8; Н 5.0; N 16.3%. Пример 3. N-[4-(3-бромфениламин)хиназолин-7-ил]акриламид. К охлажденному до температуры льда раствору 0.158 г (0.5 мМ) 7-амин-4-(3-броманилин) хиназолина [J. Med. Chem., 1995: 3482] и 0.108 г акриловой кислоты в 5.0 мл сухого диметилформамида (ДМФ) добавляют 0.288 г 1-(3 диметиламинопропил)-3-этилкарбодиимида НСl(EDAC). После перемешивания в течение 5 минут смесь превращается в раствор, и ледяную баню удаляют. Реакция продолжается при перемешивании при комнатной температуре в течение 3 ч. Реакционную смесь затем выливают в смесь льда и воды и подщелачивают добавлением насыщенного раствора бикарбоната натрия. Полученную водную смесь трижды экстрагируют этилацетатом, и объединенные экстракты сушат над сульфатом магния. Раствор фильтруют и концентрируют под вакуумом с получением твердого вещества светло-желтого цвета. Вещество растворяют в 100 мл метанола,фильтруют и концентрируют под вакуумом до примерно 10 мл. Вещество, выпадавшее в осадок из раствора, собирают и сушат под вакуумом при 80 С с получением 50 мг N-[4-(3 бромфениламин)-хиназолин-7-ил]акриламида,Tпл 265C. Масс-спектрометрия (химическая ионизация): m/е 369. 1(s, 1H, -NH), 10.61 (s, 1H, -NH). Результаты анализа для C17H13BrN4O: Расчетные величины: С, 55.30; Н, 3.55; N, 15.17. Полученные величины: С, 55.49; Н, 3.63; N,15.26. 1 40 Пример 4 N-[4-[(3-бромфенил)амино] хиназолин-7-ил]-N-[3-морфолинпропил]акриламид. К раствору 4-[(3-бромфенил)амино]-7 фторхиназолина (0.60 г, 1.89 мМоль) в диметилсульфоксиде (ДМСО) (10 мл) добавляют 4-(3 аминопропил)морфолин (7.54 мМоль, 1.10 мл). Реакционную смесь прогревают при 110 С в течение 26 ч, и затем разбавляют водой, подщелаченной добавлением насыщенного NаНСО 3 и затем экстрагируют EtOAc. Объединенный органический экстракт промывают солевым раствором, сушат над безводным Na2SO4 и концентрируют под вакуумом. Колоночная хроматография на окиси алюминия Grade III с градиентной элюцией отEtOAc до ЕtOАс/МеОН (98:2) с последующей перекристаллизацией из смеси EtOAc/гексан,дала 4-[3-бромфенил)амин]-7-[(3-морфолинпропил)амино]-хиназолин (0.65 г, 78%) в виде кристаллов кремового цвета с Тпл= 162162.5 С. 1(0.10 г, 0.230 мМоль) в сухом ДМФ (5 мл) под азотом добавляют акриловую кислоту (0.565 мМоль, 39 мкл), Et3N (100 мкл) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, (EDCl'HCl) (0.565 мМоль, 108 мг), реакционную смесь перемешивают при комнатной температуре в течение 4 дней с дополнительными акриловой кислотой (40 мкл), триэтиламином Et3N (100 мкл) и EDCl'HCL (100 мг), которые добавляют каждый день. Затем ДМФ удаляют под вакуумом, а остаток разбавляют насыщенным NaHCO3 и экстрагируют EtOAc. Объединенные органические экстракты промывают солевым раствором, сушат над безводнымNa2SO4 и концентрируют под вакуумом. Колоночная хроматография на силикагеле с градиентной элюцией от MeOH/EtOAc/CH2Cl2 (1:4:5) до MeOH/EtOAc/CH2Cl2 (2:4:4) дает при высоких значениях Rf N-[4-[(3-бромфенил)амин] хиназолин-7-ил]-N-[3-морфолинпропил]акриламид (39 мг, 35%) в виде белого порошка с Тпл(dt, J=7.3 Гц, J=2.0 Гц, J=2.0 Гц, 1 Н, H-6'), 7.687.58 (m, 2H, ароматика), 7.42-7.31 (m, 2H, ароматика), 6.18 (m, 2H, СН 2 СНСО, CH2CHCO),5.63 (dd, J=2.0 Гц, J=10.0 Гц, 1H, CH2CHCO),3.90 (t, J=7.1 Гц, 2 Н, CH2CH2CH2NCO), 3.51 (t,J=4.3 Гц, 4H, морфолинметилен), 2.50 (br s. 2H,СH2CH2 СН 2NCO), 2.28 (br s, 4H, морфолинметилен), 1.67 (квинтет, J=6.5 Гц, 2 Н,СН 2 СН 2 СН 2). Получаемый при низких значениях Rf стартовый материал, 4-[(3-бромфенил) амин]-7-[(3-морфолинпропил)амино]хиназолин(43%), идентичен исходному образцу. Пример 5. 3-[4-(3-бромфениламин)-хиназолин-7-илкарбамоил]акриловая кислота. К раствору 0.158 г 7-амино-4-(3-броманилин)хиназолина при 5 С (J. Med. Chem. 1995:3482) в 10 мл тетрагидрофурана добавляют 0.059 г малеинового ангидрида. Холодный раствор перемешивают в течении 15 мин, затем ледяную баню удаляют. Реакционную смесь прогревают до комнатной температуры и перемешивают в течение 15 ч. Суспензию прогревают с обратным холодильником в течении 30 мин и затем перемешивают при комнатной температуре в течении 15 ч. Добавляют еще 0.059 г малеинового ангидрида и 20 г тетрагидрофурана и кипятят с обратным холодильником еще 2 часа. Через 15 ч при комнатной температуре,реакционную смесь кипятят с обратным холодильником еще 15 ч. Смесь фильтруют, и светло-коричневое вещество перекристаллизовывают сначала из диметилформамида и второй раз из метанола с получением 0.036 г желаемого продукта. 1(23), 413.3 (100), 414.3 (21). Результаты анализа для C18H13BrN4O3: Расчетные величины: С, 52.32; Н, 3.17; N, 13.56. Полученные величины: С, 52.57; Н, 3.51; N,13.16. Пример 6. Этиловый эфир 3-[4-(3-бромфениламин)хиназолин-7-илкарбамоилакриловой кислоты. К ледяному раствору 0.158 г 7-амин-4-(3 броманилин)хиназолина и 0.216 г моноэтилфумарата в 3 мл сухого диметилформамида добавляют 0.288 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDAC). 7-амино 4-(3-броманилин)хиназолин получают способа 001595 42 ми, хорошо известными специалистам. См., например, J. Med. Chem., 1995:3482, указанный в ссылке. После перемешивания при 5 С в течение 5 мин, ледяную баню удаляют, смеси позволяют прогреться до комнатной температуры и перемешивают затем в течение 15 ч. Затем смесь выливают в холодную воду, и получившуюся суспензию подщелачивают добавлением насыщенного раствора бикарбоната натрия. Получившееся в результате твердое вещество собирают фильтрованием, промывают водой и затем перекристаллизовывают из 50 мл этанола с получением 0.052 г желаемого продукта с Тпл 260 С. 1(100), 442 (37), 443 (78). Результаты элементного анализа дляMed. Chem., 1995;38(18):3482-3487. Пример 8. 4-(3-бромфениламин)-6,7-диметоксихиназолин. 4-(3-бромфениламин)-6,7-диметоксихиназолин синтезируют в соответствии со способами, хорошо известными специалистам. См., например, заявку на Европатент 566226 A1. Пример 9. [4-(3-бромфениламин)хиназолин-7-ил]амид бут-2-еноевой кислоты. К ледяному раствору 0.158 г 7-амино-4-(3 броманилин)-хиназолина (J. Med. Chem.,1985:3482) в 5 мл тетрагидрофурана добавляют по каплям раствор 0.105 г хлорида кротоновой кислоты в 5 мл тетрагидрофурана. После завершения добавления, ледяную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Смесь фильтруют, отфильтрованное твердое желтое вещество промывают тетрагидрофураном и перекристаллизовывают из 20 мл кипящего метанола с получением 0.060 г желаемого продукта с Тпл 250 С. 1J=1.7 Гц, 15.1 Гц, 1H), 1.92 (dd, J=1.6 Гц, 6.9 Гц,3 Н); Масс-спектрометрия (химическая ионизация): 382 (21), 383 (100), 384 (34), 385 (64). Результаты анализа для C18H15BrN4O 1HCl0.5H2O: Расчетные величины: С 50.43; Н 4.00; N 13.07; Br 18.64; Cl 8.27. Полученные величины: С 50.71; Н 4.00; N 12.98; Br 18.93; Cl 7.51. Пример 10. N-[4-(3-бромфениламин)-6-(3 морфолин-4-ил-пропиламин)-хиназолин-7-ил]акриламид. Обработка 6-хлор-7-нитрохиназолин-4-она(Aust. J. Chem., 1995; 48: 227-232) тионилхлоридом или РОСl3 приводит к получению 4,6 дихлор-7-нитрохиназолина. Реакция с 3-броманилином дает смесь 4-(3-бромфениламин)-6 хлор-7-нитрохиназолина и 4-хлор-6-(3-бромфениламин)-7-нитрохиназолина, которую делят с помощью колоночной хроматографии. Обработка полученного таким образом 4-(3 бромфениламин)-6-хлор-7-нитрохиназолина N(3-аминопропил)морфолином и последующее восстановление нитрогруппы, например, железом в уксусной кислоте, приводит к получению 7-амин-4-(3-бромфениламин)-6-(3-морфолин-4 ил-пропиламин)хиназолина. Ацилирование для получения акриламида осуществляется в соответствии со способом примера 3. Пример 11. N-[4-[(3-бромфенил)амин]хиназолин-6-ил]акриламид. К раствору 6-амин-4-[(3-бромфенил)амин] хиназолина (2.0 г, 6.35 мМоль) в сухом ДМФ(20 мл) под азотом добавляют акриловую кислоту (12.7 мМоль, 0.87 мл). Полученный раствор охлаждают до 0 С и добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCIHCl) (7.62 мМоль, 1.46 г). Реакционную смесь перемешивают при 0 С в течение 15 мин, дают прогреться до комнатной температуры и перемешивают еще 2 ч, после чего добавляют еще акриловой кислоты (0.30 мл) иEDCIHCl (0.30 г). Еще через 2 ч реакцию прекращают tlc, растворитель удаляют под вакуумом, получившийся остаток разбавляют насыщенным NaHCO3 и несколько раз экстрагируютEtOAc. Объединенные органические экстракты промывают солевым раствором, сушат над безводным Na2SO4 и концентрируют под вакуумом. Колоночная хроматография на окиси алюминияGrade III при элюции смесью EtOAc/MeOH(95:5), с последующей перекристаллизацией из смеси EtOAc/гексан, дают губчатое белое твердое вещество, которое через несколько часов содержания под высоким вакуумом образует N[4-[(3-бромфенил)амин]хиназолин-6-ил]акриламид (1.06 г, 45%) в виде порошка кремового цвета с Тпл=258-261 С. 1(100, 79BrMH+), 368 (33, 79BrM+). Результы анализа для C17H13BrN4O: Расчетные величины: С 55.30; Н 3.55; N 15.17%. Полученные величины: С 55.19; Н 3.34; N 14.88%. Пример 12. N-[4-(N,N-диметиламин) хиназолин-6-ил]акриламид. Суспензию 6-нитрохиназолина (3.50 г, 18.5 мМоль) в чистом SOCl2 (30 мл), содержащую 2 капли ДМФ, кипятят с обратным холодильником в течение 3 ч, пока она не становится прозрачной. Избыток SOCl2 удаляют под вакуумом,затем добавляют сухой бензол и выпаривают под вакуумом для удаления следовых остатковSOCl2. Получившийся в результате сырой препарат 4-хлор-6-нитрохиназолина растворяют в сухом СН 2 Сl2 (50 мл), промывают насыщеннымNа 2 СО 3 (дважды) и полученный раствор добавляют к раствору 4-амино-2-бром-N,N-диметилбензиламина (20.3 мМоль, 4.64 г) в i-РrОН (60 мл), содержащем Et3N (избыток, 7.0 мл). Полученную реакционную смесь нагревают с обратньм холодильником 3 часа и затем концентрируют под вакуумом, разбавляют водой и экстрагируют ЕtOАс. Объединенные органические экстракты сушат над безводным Na2SO4, концентрируют под вакуумом и подвергают хроматографии на силикагеле с градиентной элюцией от смеси СН 2 Сl2/ЕtOАс (1:1) до смеси МеОН/СН 2 Сl2/ЕtOАс (2:9:9), с получением 4-N,Nдиметиламин-6-нитрохиназолина (2.56 г, 64%) в виде желтых кристаллов с Тпл (СН 2 Сl2)=131133 С. 1(d, J=9.2 Гц, 1H, Н-8), 3.46 (s, 6H, N(СН 3)2). Дальнейшая элюция дала 2-бром-N,Nдиметил-4-(6-нитрохиназолин-4-ил)бензиламин(0.62 г, 8%) в виде желтого порошка с ТплH ЯМР-спектроскопия [(СD3)2SO], (400 МГц):10.47 (br s, 1H, NH), 9.66 (d, J=2.4 Гц,1H, H-5), 8.77 (s, 1H, H-2), 8.57 (dd, J=9.2 Гц,J=2.5 Гц, 1H, H-7), 8.21 (d, J=2.0 Гц, 1H, H-2'),7.95 (d, J=9.1 Гц, 1H, H-8), 7.91 (dd, J=8.4 Гц, 1H,H-6'), 7.49 (d, J=8.5 Гц, 1 Н, H-5'), 3.46 (s, 2H,СH2N(СН 3)2), 2.22 (s, 6H, N(CH3)2). Результаты анализ для C17H16BrN5O2 1,5H2O: Расчетные величины: С 47.6; Н 4.5; N 16.3%. Полученные величины: С 47.7; Н 4.2; N 15.7%. К кипящему с обратным холодильником раствору упомянутого выше 4-N,N-диметил 45 амин-6-нитрохиназолинамина (1.20 г, 5.50 мМоль) в ЕtOН/Н 2O (2:1, 90 мл), содержащему ледяную уксусную кислоту (4.0 мл), добавляют порциями свежепромытый (1N HCl, затем дистиллированной водой) железный порошок (4 мол. экв., 1.24 г). Идентичная описанной выше реакционная процедура и обработка дает, после хроматографии на силикагеле с градиентной элюцией от смеси СН 2 Сl2/ЕtOАс (1:1) до смеси MeOH/CH2CI2/ EtOAc (1:4:5), 4-N,N-диметиламин-6 аминохиназолин (0.87 г, 84%) в виде бледнокоричневого порошка с Тпл (дигидрохлорид из(s, 1H, H-2), 7.79 (m, 2H, H-5, H-8), 7.57 (dd,J=2.1 Гц, J=8.9 Гц, 1H, H-7), 5.70 (br s, 3H,NH3+), 3.55 (s, 6H, N(CH3)2). К перемешиваемому раствору, содержащему упомянутый выше 4-N,N-диметиламино 6-аминохиназолин (0.65 г, 3.45 мМоль), акриловую кислоту (4 мол. экв., 13.8 мМоль, 0.95 мл) и пиридин (избыток, 1.3 мл) в DMA (20 мл), под азотом, добавляют 1-(3-диметиламинопропил)3-этилкарбодиимид (EDCIHCl) (2 мол. экв.),6.90 мМоль, 1.32 г). Далее проводят стандартную процедуру, описанную выше, с получением после хроматографии на силикагеле с градиентной элюцией от смеси EtOAc/CH2Cl2 (1:1) до смеси MeOH/CH2Cl2/EtOAc (1:4:5), [4-(N,Nдиметиламино)хиназолин-6-ил]акриламида (350 мг, 42%) в виде порошка кремового цвета с Тпл(123 мг, 0.64 мМоль). Полученную при этом светло-желтую смесь перемешивают при 25 С в течение 20 часов и гасят водой. Осадок собирают и очищают обработкой ультразвуком в смеси СH2 Сl2/ЕtOАс/МеОН с получением желаемого продукта в виде твердого вещества желтого цвета (75 г, 49%) с Tпл=269.7-270C. 1H2', Н 6'), 7.32 (t, J=8.3 Гц, 1H, H5'), 6.99 (d, J=7.1 Гц, 1H, Н 4'), 6.56 (dd. J=16.8, 10.0 Гц, 1H,CH=CH2), 6.40 (dd, J=17.1, 5.0 Гц, 1 Н, СН=СН 2),5.9 (dd, J=10.3, 2.0 Гц, 1 Н, CH=CH,), 2.39 (s, 3 Н,СН 3). Масс-спектрометрия (химическая ионизация): 305 (100, МH+), 304 (31.84, M+). Результаты анализа для C18H16N4O0.4H2O: Расчетные величины: С 69.39; Н 5.44; N 17.94%. Полученные величины: С 69.19; Н 5.19; N 17.67%. Пример 14. N-[4-(3-хлорфениламин)хиназолин-7-ил]акриламид. Гидрохлорид 1-(3-диметилам инопропил)3-этилкарбодиимида (288 мг, 1.5 мМоль) добавляют к раствору 6-амино-4[(3-хлорфенил)амин] хиназолина (136 мг, 0.5 мМоль и акриловой кислоты (108 мг, 1.5 мМоль) в диметилформамиде(ДМФ) (5 мл) и перемешивают под азотом при 0 С. Через 15 мин реакционную смесь прогревают до 25 С и перемешивают при этой температуре в течение 18 ч, после чего выливают смесь в ледяную воду (50 мл) и через час собирают осадок фильтрацией на воронке Бюхнера. Осадок промыли, подсушивают воздухом, растворяют в минимальном объеме метанола (МеОН) при 25 С (60 мл), концентрируют при 25 С под вакуумом до менее чем 10 мл и перекристаллизовывают при 0 С с получением N-[4-[3 хлорфенил)-амино]хиназолин-7-ил]акриламида(33 мг, 20%) в виде твердого вещества светлооранжевого цвета с Тпл=296.5-298.5 С. Расчетные величины для С 17 Н 13 СlN4 О 0.08 СН 3 ОН 0.25 Н 2 О: С 61.82; Н 4.20; N 116.89%. Полученные величины: С 61.92; Н 4.23; N 116.72%. 1(200 мг) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCIHCl) (2.5 моль, 228 мг), реакционную смесь перемешивают в течение ночи, затем добавляют еще 230 мгEDCIHCl и 200 мг метакриловой кислоты. После 2 дней перемешивания растворитель удаляют под вакуумом, а остаток разводят насыщен 47 ным НаНСО 3, экстрагируют этилацетатом(ЕЮАс), затем объединенные органические экстракты сушат над безводным Na2SO4, концентрируют под вакуумом и подвергают хроматографии на силикагеле с градиентной элюцией от смеси MeOH/CH2Cl2/EtOAc (5:45:50) до смеси МеОН/СН 2 Сl2/ЕtOАс (10:40:50) с получениемN-[4-[(3-бромфенил)амин]хиназолин-7-ил]-2 метилакриламида (43 мг, 24%) в виде твердого вещества бледно-коричневого цвета с Тпл(m, 2H, H-2', 8), 7.92 (m, 2H, H-6', 6), 7.36 (t,J=8.0 Гц, 1H, H-5'), 7.30 (br d, J=8.3 Гц, 1H, H-4'),5.92 (s, 1H, СН 2 С(СН 3)СО), 5.63 (s, 1H,СН 2 С(СН 3)СО), 2.00 (s, 3 Н, СН 2 С(СН 3)СО). Результаты анализа для C18H15BrN4O: Расчетные величины: С 56.4; Н 4.0; N 14.6%. Полученные величины: С 56.1; Н 4.0; N 14.1%. Пример 16 N-[4-(3-бромфениламин)хиназолин-7-ил]этенилсульфонамид. Раствор 7-амино-4-[(3-бромфенил)амино] хиназолина (J. Med. Chem. 1995;38:3482) (500 мг, 1.59 мМоль), триэтиламина (Et3N) (0.60 мл) и диметиламинпиридина (ДМАП) (каталитический) в тетрагидрофуране (ТГФ) (30 мл) реагировал с хлорэтансульфонилхлоридом (1.6 мол. экв., 2.54 мМоль, 265 мкл) при 25 С в течение 1 ч при помешивании под азотом. Реакционную смесь разбавляют затем насыщенным NаНСО 3 и экстрагируют EtOAc. Объединенные органические экстракты прoмывали солевым раствором,сушат над безводным Na2SO4, концентрируют под вакуумом и хроматографировали на силикагеле с элюцией смесью МеОН/CH2Cl2/EtOAc(3:47:50). Кристаллизация из смеси СН 2 Сl2/гексан давала N-[4-[(3-бромфенил)амино]хиназолин-7 ил]винилсульфонамид (80 мг, 12%) в виде порошка кремового цвета с Тпл=218 С (распад). 1(br s, 1H, H-2'), 7.87 (br d, J=8.0 Гц, 1 Н, H-6'),7.47 (d, J=2.1 Гц, 1H, H-8), 7.40 (dd, J=9.0 Гц,J=2.2 Гц, 1H, H-6), 7.36 (t, J=8.0 Гц, 1H, H-5'),7.30 (br d, J=8.0 Гц, 1H, H-4'), 6.93 (dd, J=16.4 Гц, J=9.9 Гц, 1 Н, СН 2 СНSО 2), 6.28 (d, J=16.4 Гц,1H, CH2CHSO2), 6.15 (d, J=9.9 Гц, 1 Н,CH2CHSO2). Результаты анализа для C16H13BrN4O2S: Расчетные величины: С, 47.4; Н, 3.2%. Полученные величины: С, 47.3; Н, 3.5%. Пример 17. N-[4-(3-бромфениламин)хиназолин-7-ил]пропанамид. К раствору 7-амино-4-[(3-бромифенил) амино]хиназолина (163 мг, 0,52 мМоль) в сухом ТГФ (3 мл) при помешивании при 25 С добавляют по каплям пропионилхлорид (0.05 мл, 0.58 48 мМоль). При этом образовывалось твердое вещество желтого цвета. Через час вещество собирают фильтрацией на воронке Бюхнера, промывают эфиром, затем сушат. Перекристаллизация из влажного метанола дает желаемый продукт в виде твердого вещества светложелтого цвета (81 мг, 38%) с Тпл=282-283 С. 1BrMH+), 372 (21, 81BrM+), 371 (96, 79BrMH+). Результаты анализа для C17H15N4BrOHCl 0.2H2 О: Расчетные величины: С, 49.64; Н, 4.02;N, 13.63%. Полученные величины: С, 49.48; Н,3.91; N, 13.57%. Пример 18. N-[4-[(3-хлорфенил)амино]хиназолин-6-ил]акриламид. Гидрохлорид 1-3-диметиламинопропил)-3 этилкарбодиимида (1902 мг, 1 мМоль) добавляют к раствору 6-амино-4[(3-хлорфенил)амино] хиназолина (136 мг, 0.5 мМоль), акриловой кислоты (74 мг, 1.0 мМоль) и пиридина (201 мг,2.5 мМоль) в ТГФ/ДМФ (4:1, 2.5 мл) и перемешивают под азотом при 0 С. Через 20 мин температуру поднимают до 25 С и перемешивают в течение 3 ч, затем выливают в воду (12.5 мл) и экстрагируют EtOAc (2 х 10 мл). Объединенные экстракты обрабатывают разбавленной соляной кислотой (0.5 М, 10 мл), после чего осадок собирают фильтрацией на воронке Бюхнера, промывают водой (10 мл), эфиром (2 х 10 мл) и подсушивают воздухом с получением гидрохлоридаN-[4-[(3-хлорфенил)амино]хиназолин-6-ил]акриламида (93 мг, 48%) в виде твердого вещества тускло-желтого цвета с Тпл 223-227 С. Расчетные величины для C18H13ClN4OHCl 1.5H2O: С 52.59; Н 4.41; N 14.43%. Полученные величины: С 52.43; Н 4.37; N 14.27%. 1(brs, 1H, NH), 11.05 (s, 1H, NH), 9/13 (d, J=2.0 Гц, 1H, H5), 8.90 (s, 1H, H2), 8.12 (dd, J=2.0, 9.0 Гц, 1H, Н 7), 7.99 (d, J=9.0 Гц, 1H, Н 8), 7.88 (t,J=2.0 Гц, 1H, H2'), 7.68 (dd, J=6.1, 2.0 Гц, 1H,Н 6'), 7.51 (t, J=8.0 Гц, 1H, H5'), 7.37 (dd, J=8.1,1.2 Гц, 1H, Н-4'), 65.63 (dd, J=10.3, 17.1 Гц, 1H,СН=СН 2), 6.37 (dd, J=1.6, 17.1 Гц, 1H, СН=СН 2),5.87 (dd, J=1.7, 10. Гц, 1H, СН=СН 2). Масс-спектрометрия, химическая ионизация (CI): 327 (8, 37CIMH+), 325 (37, 35CIMH+),135 (100). Пример 19. N-[4-[(3-метилфенил)амино] хиназолин-6-ил]акриламид. Изобутилхлороформат (20.35 г, 0.15 Моль) добавляют по каплям в течение 20 минут к раствору акриловой кислоты (10.82 г, 0.15 Моль) и триэтиламина (30.19 г, 0.30 Моль) в ТГФ (400 49 мл) и перемешивают под азотом при 0 С. Получаемую взвесь перемешивают при такой температуре в течение 30 мин, затем по каплям в течение 45 мин добавляют 6-амино-4[(3-метилфенил)амино]хиназолин (27.71 г, 107 мМоль) в ДМФ (80 мл). Спустя 4 ч добавляют смесь ангидрида (из акриловой кислоты) (3.61 г, 50 мМоль), изобутилхлороформата(6.80 г, 50 мМоль) и триэтиламина (10.1 г, 100 мМоль) в ТГФ (100 мл) при 0 С, одной порцией. Еще через 15 мин реакционную смесь перемешивают при 25 С в течение 30 мин и затем выливают в ледяную воду (1 л). Затем добавляют эфир (200 мл) и разделяют фазы. Водную фазу экстрагируют EtOAc (500 мл) и объединенную органическую фазу промывают водой (500 мл) и насыщенным солевым раствором (250 мл). Раствор перемешивают с безводным MgSO4 в течение 2 мин, фильтруют и добавляют силикагель(150 г). Смесь отпаривают до сухости и наносят на хроматографическую колонку с силикагелем(25% 4 л, 35% 8 л, 40% 4 л). Собирают нужные фракции, растворитель отпаривают, а остаток суспендируют в EtOAc (200 мл), кипятят под обратным холодильником 5 минут и обрабатывают ультразвуком при 60 С 20 мин, затем собирают фильтрацией на воронке Бюхнера, промывают EtOAc (3 х 25 мл) и сушат в вакуумной печи при 75 С 16 ч с получением N-[4-(3-метилфенил)амино]хиназолин-6-ил]акриламида (11.38 г, 35%) в виде твердого вещества светложелтого цвета с Тпл=247-8 С. Расчетные величины для C18H16N4O 0.1H2O: С, 70.61; Н, 5.33; N, 18.30%. Полученные величины: С, 70.33; Н, 5.19; N, 18.17%. 1(m, 2 Н, Н 6'Н 2'), 7.26 (dt, Jd=1.4 Гц, Jt=7.5 Гц,1H, H5'), 6.94 (d, J=7.2 Гц, 1 Н, H4'), 6.53 (dd,J=10.1, 16.9 Гц, 1H, СН=СН 2), 6.34 (dd, J=1.9,16.9 Гц, 1H, СН=СН 2), 5.84 (dd, J=1.9, 10.1 Гц,1H, СН=СН 2), 2.34 (s, 3 Н, Me). Масс-спектрометрия (химическая ионизация): 305 (100, МН+), 304 (49, M+). Пример 20. N-[4-[(3-(трифторметил)фенил) амино]хиназолин-6-ил]акриламид. Гидрохлорид 1-(3-диметиламинопропил)3-этилкарбодиимида (212 мг, 1.1 мМоль) добавляют к раствору 6-амино-4[(3-(трифторметил) фенил)амино]хиназолина (153 мг, 0.% мМоль),акриловой кислоты (73 мг, 1.0 мМоль) и пиридина (206 мг, 2.5 мМоль) в ТГФ/ДМФ (4:1, 2.5 мл) и перемешивают под азотом при 0 С. Через 15 мин температуру смеси поднимают до 25 С и перемешивают еще 1 ч, затем снова охлаждают до 0 С. Затем добавляют разбавленную соляную кислоту (0.5 M, 10 мл) и через 15 мин собирают 50 образовавшийся осадок фильтрацией на воронке Бюхнера. Осадок промывают водой (5 мл) и эфиром(2 х 5 мл) и сушат в вакуумной печи при 75 С в течение ночи с получением гидрохлорида N-[4[(3-(трифторметил)фенил)амино]хиназолин-6 ил]акриламида (87 мг, 45%) в виде твердого вещества светло-зеленоватого оттенка с Тпл=195-199 С. Расчетные величины для С 18 Н 13F3N4OНСl 0.5 Н 2O: С 53.54; Н 3.74; N 13.88%. Полученные величины: С 53.70; Н 3.72; N 13.73%. 1(dd. J=2.0, 9.2 Гц, 1H, Н 7), 8.04 (d, J=8.0 Гц, 1H,Н 6'), 7.98 (d, J=9.0 Гц, 1H, H8), 7.74 (t, J=7.9 Гц,1H, H5'), 7.68 (d, J=7.8 Гц, 1H, Н 4'), 6.60 (dd,J=10.1, 16.9 Гц, 1H, СН=СН 2), 6.38 (dd, J=1.6,16.9 Гц, 1H, СН-СН 2), 5.89 (dd, J=1.6, 10.1 Гц,1H, СН=СН 2). Масс-спектрометрия (химическая ионизация): 359 (45, МН+), 134 (100). Пример 21 N-[4-[(3-бромфенил)амино]-7[3-(4-морфолин)пропокси]хиназолин-6-ил]акриламид Металлический натрий (27.6 мМоль, 0.63 г) добавляют к раствору 3-морфолинпропан-1 ола (22.0 мМоль, 3.20 г) в ТГФ (60 мл) под азотом. Получившуюся суспензию перемешивают при 20 С 2 часа и затем подают через трубочку в раствор 4-[(3-бромфенил)амино]-7-фтор-6 нитрохиназолина, J. Med. Chem., 1996(39):918(2.0 г, 5.51 мМоль) в ТГФ (50 мл) под азотом. Затем раствор кипятят с обратным холодильником 24 часа , разводят водой и экстрагируютEtOAc. Объединенные органические экстракты сушат над безводным Nа 2SO4, концентрируют под вакуумом и хроматографируют на окиси алюминия с градиентной элюцией от смеси ЕtOАс/гексан(1:1) до смеси МеОН/CH2 Сl2/ЕtOАс (2:3:5) с получением 4-[(3 бромфенил)амино]-7-[(3-морфолин)пропокси]6-нитрохиназолина (1.75 г, 65%) в виде желтого порошка с Тпл (МеОН)=216-220 С. 1(s, 1H, NH), 9.24 (s, 1H, ароматика), 8.69 (s, 1H,ароматика) 8.19 (t, J=1.8 Гц, 1H, Н-2'), 7.88 (dt,Jd=7.8 Гц, Jt=1.4 Гц, 1H, H-6'), 7.49 (s, 1H, ароматика), 7.38 (t, J=8.0 Гц, 1H, H-5'), 7.34 (dt, Jd=8.1 Гц, Jt=1.4 Гц, 1H, Н-4'), 4.35 (t, J=6.2 Гц, 2H,СН 2 СН 2 СН 2 О), 3.58 (t, J=4.6 Гц, 4 Н, морфолинметилен), 2.45 (t, J=7.0 Гц, 2 Н, NCH2CH2CH2),2.37 (br s, 4H, морфолинметилен), 1.94 (квинтет,J=6.6 Гц, 2 Н, СН 2 СН 2 СН 2). 13 С ЯМР-спектроскопия:157.76, 157.26,153.76, 153.21, 140.32, 138.86, 130.37, 12638,124.26, 121.70, 121.13, 120.72, 110.11, 107.88,67.87, 66.13 (х 2), 54.42, 53.28 (х 2), 25.30. Результаты анализа для C21H22BrN5O4 0.75H2O: Расчетные величины: С, 50.3; Н, 4.7;N, 13.8%. Свежепромытый (1N HCl, затем дистиллированной Н 2 О) порошок железа добавляют порциями к кипящему с обратным холодильником раствору упомянутого нитрохиназолина (1.50 г,3.07 мМоль) в EtOAc/H2O (2:1, 80 мл), содержащему ледяную уксусную кислоту (2.0 мл). Полученную суспензию нагревают с обратным холодильником при тщательном перемешивании в течение 20 мин, затем охлаждают, подщелачивают добавлением концентрированногоNН 3 и фильтруют через слой целита. Целитовый слой промывают EtOH, фильтрат концентрируют под вакуумом, разбавляют водой и экстрагируют EtOAc. Объединенные органические экстракты сушат над безводным Na2SO4, концентрируют под вакуумом и хроматографируют на окиси алюминия Grade III с градиентной элюцией от смеси CH2Cl2/EtOAc (1:1) до смеси МеОН/ЕtOАс (2:98) с получением 6-амино-4-[(3 бромфенил)-амино]-7-[(3-морфолин)пропилокси]хиназолина (1.08 г, 77%) в виде бледнокоричневого порошка с Тпл (ЕtOАс/гексан)(t, J=4.6 Гц, 4H, морфолинметилен), 2.50 (t,J=7.3 Гц, 2H, NCH2CH2CH2), 2.39 (br s, 4H, морфолинметилен), 1.99 (квинтет, J=6.7 Гц, 2H,СН 2 СН 2 СН 2). 13 С ЯМР-спектроскопия:154.88. 151.94,150.19, 144.84, 141.94. 138.50, 130.16, 124.66 123.02, 121.09, 119.65, 110.42, 106.37, 11.81,66.45, 66.14 (х 2), 54.77, 53.29 (х 2), 25.50. Результаты анализа для C21H24BrN5O2 0.25H2O: Расчетные величины: С, 54.5; Н, 5.3;N, 15.0%. К перемешиваемому раствору упомянутого 6-аминохиназолина (0.50 г, 1.09 мМоль), акриловой кислоты (6 Моль, 6.54 мМоль, 449 мкл) и Et3N (избыток, 2.0 мл) в ДМФ (20 мл) под азотом добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI'HCl)(3 Моль, 3.27 мМоль, 627 мг). Реакционную смесь перемешивают при 0 С 15 мин, затем дают прогреться до комнатной температуры и перемешивают еще 2 ч. Растворитель удаляют под вакуумом, а остаток разбавляют насыщеннымNaHCO3 и несколько раз экстрагируют EtOAc. Объединенные органические экстракты промывают солевым раствором, сушат над безводнымNa2SO4 и концентрируют под вакуумом. После хроматографии на окиси алюминия Grade III с градиентной элюцией от смеси EtOAc/гексан(9:1) до смеси MeOH/EtOAc (2:98) получают N[4-[(3-бромфенил)амино]-7-[(3-морфолин)пропилокси]хиназолин-6-ил]акриламид (329 мг,59%) в виде порошка кремового цвета с Тпл(t, J=8.1 Гц, 1H, Н-5'), 7.30 (s, 1H, ароматика),7.27 (ddd, J=7.9, 1.4, 0.8 Гц, 1H, Н 4'), 6.72 (dd,J=17.0, 10.2 Гц, 1H, СН 2 СНСО), 6.33 (dd, J=17.0,1.9 Гц, 1H, CH2CHCO), 5.83 (dd, J=10.2, 1.9 Гц,1H, CH2CHCO), 4.27 (t, J=6.3 Гц, 2H,CH2CH2CH2O), 3.58 (t, J=4.6 Гц, 4 Н, морфолинметилен), 2.48 (t, J=7.1 Гц, 2 Н, NCH2CH2CH2),2.38 (br s, 4H, морфолинметилен), 1.99 (квинтет,J=6.7 Гц, 2H, СН 2 СН 2 СН 2). 13 С ЯМР-спектроскопия:163.49, 156.68,154.96, 153.92, 149.19, 141.20, 131.58, 130.19,127.16, 126.95, 125.52, 123.97, 121.03, 120.52,116.78, 108.80, 107.28, 66.96, 66.14 (х 2), 54.54,53.28 (х 2), 25.31. Результаты анализа для С 24 Н 26 ВrN5O3 0.5 Н 2O: Расчетные величины: С, 55.3; Н, 5.2; N,13.4%. Полученные величины: С, 55.3; Н, 4.9; N,13.3%. Пример 22. N-(3-метилфенил)амино]-7-[3(4-морфолин)пропокси]хиназолин-6-ил]акриламид. Суспензию 7-фтор-6-нитрохиназолона(2.40 г, 11.48 мМоль) в чистом SOCl2 (25 мл),содержащую 2 капли ДМФ, кипятят с обратным холодильником 3 ч, пока она не становится прозрачной. Избыток SOCl2 удаляют под вакуумом,затем к остатку добавляют сухой бензол и перегоняют под вакуумом для удаления следовых примесей SOCl2, после чего получают грубый препарат 4-хлор-7-фтор-6-нитрохиназолина,который затем растворяют в сухом CH2Cl2 (50 мл) и добавляют к перемешиваемому раствору м-толуидина в изопропаноле (i-PrOH) (30 мл),реакционную смесь перемешивают при 20 С 30 мин, затем добавляют гексан (200 мл) для осаждения продукта в виде гидрохлорида. Осадок отфильтровывают, промывают гексаном и растворяют в МеОН/Н 2 О (4:1, 150 мл) с осторожным подогревом. Затем к раствору добавляют избыток Et3N, после чего воду (400 мл) для осаждения продукта в виде свободного основания,каковой осадок затем отфильтровывают, промывают водой и сушат под вакуумом с получением 7-фтор-4-[(3-метилфенил)-амино]-6-нитрохиназолина (3.01 г, 88%) в виде желтого порошка с Тпл (СН 2 Сl2/гексан)=191-192 С. 1 53 Результаты анализа для C15H11FN4O2: Расчетные величины: С 60.4; Н 3.7; N 18.8%. Полученные величины: С 60.6; Н 3.6; N 19.0%. К раствору 3-морфолинпропан-1-ола (8.40 мМоль, 1.22 г) в ТГФ (40 мл) под азотом добавляют металлический натрий (11.8 мМоль, 0.27 г). Получившуюся суспензию перемешивают при 20 С 2 ч и затем вводят через трубочку в раствор 7-фтор-4-[(3-метилфенил)амино]-6-нитрохиназолина (0.70 г, 2.35 мМоль) в ТГФ (30 мл) под азотом. Вслед за этим проводят хроматографию на силикагеле с градиентной элюцией от смеси MeOH/CH2Cl2/EtOAc (5:45:50) до смеси MeOH/CH2CO-50/EtOAc (3:7:10) с получением 4-[(3-метилфенил)амино]-7-[(3-морфолин) пропилокси]-6-нитрохиназолина (0.87 г, 88%) в виде желтого порошка с Тпл (СН 2 Сl2/ гексан)=169-170 С. 1(br s, 1H, H-2'), 7.45 (s, 1H, ароматика), 7.29 (t,J=7.8 Гц, 1H, H-5'), 6.99 (br d, J=7.5 Гц. 1H, H-4'),4.34 (t, J=6.1 Гц, 2 Н, CH2CH2CH2O), 3.58 (t,J=4.6 Гц, 4 Н, морфолинметилен), 2.46 (t, J=7.0 Гц, 2 Н, NСН 2 СН 2 СН 2), 2.38 (br s, 4H, морфолинметилен), 2.35 (s, 3H, СН 3 Аr), 1.94 (квинтет,J=6.6 Гц, 2 Н, СН 2 СН 2 СН 2). Результат анализ для C22H25N5O4: Расчетные величины: С, 62.4; Н, 6.0; N, 16.5%. Полученные величины: С, 62.2; Н, 6.1; N, 16.5%. Раствор этого нитрохиназолина (0.71 г,1.68 мМоль) в МеОН/ЕtOАс (2:1, 60 мл) подвергают гидрогенизации (60 psi - фунтов на квадратный дюйм) через Pd-C в течение 6 ч и затем фильтруют через целит. Фильтрат затем концентрируют под вакуумом с получением 6 амино-4-[(3-метилфенил)амино]-7-[(3-морфолин)пропилокси]хиназолина, который используют без дальнейшей характеризации. К перемешиваемому раствору этого соединения (0.7 г,1.8 мМоль), акриловой кислоты (6 Моль, 10.8 мМоль, 776 мкл) и Et3N (избыток, 4 мл) в ДМФ(20 мл) под азотом добавляют гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида(EDCIHCl) (3 Моль, 5.38 мМоль, 1.03 г). Описанную стандартную процедуру завершают хроматографией на силикагеле с градиентной элюцией от смеси СH2 Сl2/ЕtOАс (1:1) до смеси МеОН/СН 2 Сl2/ЕtOАс (3:7:10), с получением N[4-[(3-метилфенил)амино]-7-[(3-морфолин)пропилокси]хиназолин-6-ил]акриламида (175 мг,22%) в виде порошка кремового цвета с Тпл 54 СО), 5.82 (dd, J=10.2, 1.9 Гц, 1H, СН 2 СНСО),4.26 (t, J=6.3 Гц, 2 Н, СН 2 СН 2 СН 2 О), 3.58 (t,J=4.6 Гц, 4 Н, морфолинметилен), 2.48 (t, J=7.1 Гц, 2 Н, NCH2CH2CH2), 2.38 (br s, 4H, морфолинметилен), 2.33 (s, 3 Н, СН 3 Аr), 1.99 (квинтет,J=6.7 Гц, 2 Н, СН 2 СН 2 СН 2). Результаты анализа для С 25 Н 29N5O3 0.25 Н 2O: Расчетные величины: С, 66.4; Н, 6.6;(15 мл) под азотом. Полученную суспензию перемешивают при 20 С 2 ч, затем вводят через трубочку в раствор 7-фтор-4-[(3-метилфенил) амино]-6-нитрохиназолина (0.5 г, 1.68 мМоль) в ТГФ (20 мл) под азотом. Полученный темнокрасный раствор затем кипятят с обратным холодильником 24 ч, разводят водой и экстрагируют EtOAc. Объединенные органические экстракты сушат над безводным Na2SO4, концентрируют под вакуумом и хроматографируют на окиси алюминия с градиентной элюцией от смеси ЕtOАс/гексан (1:1) до EtOAc (2:3:5), с получением 4-[(3-метилфенил)-амино]-7-[3-N-(4-метилпиперазинил)пропилокси]-6-нитрохиназолина (0.67 г, 91%) в виде желтого порошка с Тпл (Еt2O/гексан)=155-156 С. 1(s, 1H, NH), 9.26 (s, 1H, H5, H2H5), 8.61 (s, 1H,H2), 7.64 (br d, J=8.4 Гц, 1H. Н-6'), 7.62 (br s, 1H,H-2'), 7.43 (s, 1H, H8), 7.29 (t, J=7.8 Гц, 1H, H-5'),6.99 (br d, J=7.4 Гц, 1H, H-4'), 4.32 (t, J=6.0 Гц,2H, CH2CH2CH2O), 2.44 (t, J=7.0 Гц, 2H,NCH2CH2CH2), 2.39-2.28n (br s, 8H, пиперазинилметилен), 2.34 (s, 3H, СН 3 Аr), 2,14 (s, 3H,CH3N), 1.92 (квинтет, J=6.6 Гц, 2H,СH2 СН 2 СH2). Результаты анализа для CН 28N6 О 3: Расчетные величины: С, 63.3; Н, 6.5; N, 19.3%. Полученные величины: С, 63.4; Н, 6.8; N, 19.6%. Раствор описанного выше нитрохиназолина (0.61 г, 1 .40 мМоль) в MeOH/EtOAc (2:1, 50 мл) подвергают гидрогенизации (60 psi) черезPd-C в течение 5 ч, затем фильтруют через целит. Фильтрат затем концентрируют под вакуумом и хроматографируют на окиси алюминияGrade III с элюцией смесью MeOH/EtOAc (5:95) с получением 6-амино-4-[(3-метилфенил)-амино]-7-[3-N-(4-метилпиперазинил)пропилокси] хиназолина (361 мг), который быстро обесцвечивается, и используют без дальнейшей характеризации. К перемешиваемому раствору этого соединения (0.36 г, 0.89 мМоль), акриловой кислоты (6 Моль, 5.53 мМоль, 366 мкл) и Et3N(избыток, 2.0 мл) в ДМФ (20 мл) под азотом добавляют гидрохлорид 1-(3-диметиламино 55 пропил)-3-этилкарбодиимида (EDCI'HCl) (3 Моль, 2.66 мМоль, 511 мг). Описанную стандартную процедуру завершают хроматографией на окиси алюминия Grade III с градиентной элюцией от EtOAc до MeOH/EtOAc (2:98) с получением N-[4-[(3-метилфенил)амино]-7-[3-N(4-метилпиперазинил)-пропокси]хиназолин-6 ил]акриламида (65 мг, 16%) в виде бесцветного стеклообразного вещества с(ионизация электронным ударом) (М+): расчетная величина для C26H32N6O2 - 460.2587, полученная величина - 460.2576. Пример 24. N-[4-[(3-бромфенил)амино]-7[3-(4N-метил-1,N-пиперазин)пропокси]хиназолин-6-ил]акриламид. К раствору 3-N-(4-метилпиперазинил) пропан-1-ола (8.81 мМоль, 1.39 г) в ТГФ (40 мл) под азотом добавляют металлический натрий(13.2 мМоль, 0.30 г). Получившуюся суспензию перемешивают при 20 С 2 ч и затем подают через трубочку в раствор 4-[(3-бромфенил)амино]7-фтор-6-нитрохиназолина [J. Med. Chem. 1996(39):918] (0.80 г, 2.20 мМоль) в ТГФ (30 мл) под азотом. Процедура проведения реакции, идентичная той, что описана в предыдущем примере,приводит после хроматографии на силикагеле с градиентной элюцией от смеси MeOH/CH2Cl2/(2:3:5), к получению 4-[(3-бромфенил)амино]-7[3-N-(4-метилпиперазинил)пропилокси]-6 нитрохиназолина (0.36 г, 33%) в виде желтого порошка с Тпл (тригидрохлорид) (МеОН/ Еt2O)=233 С (распад). 1(s, 3 Н, СН 3N), 1.92 (квинтет, J=6.7 Гц, 2H,СН 2 СН 2 СН 2). Результаты анализа для С 22 Н 25 ВrN6 О 3 3 НСlН 2O: Расчетные величины: С, 42.0; Н, 4.8;N, 13.4; Cl, 16.9%. Полученные величины: С,42.1; Н, 4.5; N, 13.3; Cl, 16.9%. Свежепромытый (1N HCl, затем дистиллированной водой) порошок железа (4 мол. экв.,0.138 г) добавляют порциями к кипящему с обратным холодильником раствору описанного выше нитрохиназолина (0.31 г, 0.62 мМоль) вEtOH/H2O (2:1, 50 мл), содержащему ледяную уксусную кислоту (1.0 мл). Полученную суспензию нагревают с обратным холодильником,тщательно перемешивая, в течение 20 мин, затем охлаждают, подщелачивают добавлением концентрированного NН 3 и фильтруют через слой целита. Целит промывают EtOH, фильтрат концентрируют под вакуумом, разбавляют водой и экстрагируют ЕtOАс. Объединенные органические экстракты сушат над безводнымNа 2SO4, концентрируют под вакуумом и хроматографируют на окиси алюминия Grade III с элюцией смесью МеОН/ЕtOАс (5:95) с получением 6-амин-4-[(3-бромфенил)амино]-7-[3-N-(4 метилпиперазинил)пропилокси]хиназолина (238 мг, 82%) в виде порошка кремового цвета с ТплCH2), 2.43-2-29 (br s, 8H, пиперазинилметилен),2.16 (s, 3H, CH3N), 1.97 (квинтет, J=6.8 Гц, 2H,СН 2 СН 2 СН 2). Результаты анализа для C22H27BrN6O 1.25H2O: Расчетные величины: С, 53.5; Н, 6.0;N, 17.0%. Акриловую кислоту (6 Моль, 2.84 мМоль,195 мкл) и Et3N (избыток, 1.0 мл) в ДМФ (20 мл) под азотом добавляют к перемешиваемому раствору описанного выше аминохиназолина (223 мг, 0.47 мМоль) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCIHCl)(3 Моль, 1.42 мМоль, 273 мг). Стандартная процедура, описанная выше, была завершена хроматографией на окиси алюминия Grade III с градиентной элюцией от смеси ЕtOАс/гексан (1:1) до смеси MeOH/EtOAc (2:98) с получением N[4-[(3-бромфенил)амино]-7-[3-N-(4-метилпиперазинил)пропилокси]-хиназолин-6-ил]акриламида (145 мг, 58%) в виде порошка кремового цвета с Тпл (СН 2 Сl2/Et2O/гексан)=105-107 С. 1(квинтет, J=6.7 Гц, 2H, СН 2 СН 2 СН 2). Результаты анализа для С 25 Н 29 ВrN6O2 0.5 Н 2O: Расчетные величины: С, 56.2; Н, 5.7; N,15.7%. Полученные величины: С, 56.3; Н, 5.6; N,15.5%. Пример 25 N-[4-[(3-бромфенил)амино]-7[3-(1,N-имидазил)пропокси]хиназолин-6-ил] акриламид. В суспензию предварительно промытого гексаном гидрида натрия (5.50 мМоль, 220 мг 60% дисперсии в минеральном масле) в ТГФ (20 мл), подают по трубке раствор 3-N-(имидазоил) пропан-1-ола (4.84 мМоль, 0.61 г) в ТГФ (30 мл). Полученную суспензию перемешивают при 20 С под азотом 2 ч, в течение которых требуемый алкоголят натрия частично выпадает в осадок из раствора. К этой суспензии затем добавляют твердый 4-[(3-бромфенил)амино]-7-фтор 6-нитрохиназолин [J. Med. Chem., 1996 (39):918](0.80 г, 2.20 мМоль) с получением темнокрасного раствора, который нагревают с обратным холодильником в течение 24 ч, затем разбавляют водой и экстрагируют ЕtOАс. Объединенные органические экстракты сушат над безводным Na2SO4, концентрируют под вакуумом и хроматографировали на силикагеле с градиентной элюцией от смеси СН 2 Сl2/ЕtOАс (1:1) до смеси MeOH/CH2Cl2/EtOAc (3:7:10) с получением 4-[(3-бромфенил)амино]-7-[3-N-(имидазоил) пропилокси]-6-нитрохиназолина (524 мг, 51%) в виде желтого порошка с Тпл (СН 2 Сl2/ гексан)=212-215 С. 1(s, 1H, NH), 9.30 (s, 1H, H5), 8.70 (s, 1H, H2),8.19 (t, J=1.6 Гц, 1H, H-2'), 7.88 (dt, Jd=7.8 Гц,Jt=1.5 Гц, 1H, H-6'), 7.63 (s, 1H, имидазоилметин), 7.48 (s, 1H, H8), 7.39 (t, J=7.9 Uw, 1H, H-5'),7.35 (dt, Jd=8.0 Гц, Jt=1.6 Гц, 1H, H-4'), 7.21 (s,1H, имидазоилметин), 6.90 (s, 1H, имидазоилметин), 4.22 (t, J=6.0 Гц, 2H, СН 2 СН 2 СН 2), 4.18 (t,J=6.8 Гц, 2 Н, СН 2 СН 2 СН 2, 2.26 (квинтет, J=6.4 Гц, 2 Н, CH2CH2CH2). Результаты анализа для С 20 Н 17 ВrN6 О 3: Расчетные величины: С 51.2; Н 3.6; N 17.9%. Полученные величины: С 51.0; Н 3.6; N 17.6%. Свежепромытый (1N HCl, затем дистиллированной водой) порошок железа (4 Моль, 0.241 г) добавляют порциями к раствору, кипящему с обратным холодильником и содержащему описаный выше 6-нитрохиназолин (0.51 г, 1.08 мМоль) в ЕtOН/Н 2O (2:1, 60 мл) и ледяную уксусную кислоту (0.7 мл). Процедура проведения реакции, идентичная описанной в предыдущем примере, дала, после хроматографии на окиси алюминия Grade III с элюцией смесью MeOH/(br d, J=7.7 Гц, 1H, H-4'), 7.06 (s, 1H, Н 8), 6.90 (s,1H, имидазоилметин), 5.45 (s, 2H, NH2), 4.28 (t,J=7.1 Гц, 2 Н, СН 2 СН 2 СН 2), 4.10 (t, J=5.8 Гц, 2H,CH2CH2CH2), 2.27 (квинтет, J=6.5 Гц, 2H, СН 2 СН 2 СН 2). Результаты анализа для C20H19BrN6O 0.5H2O: Расчетные величины: С, 53.6; Н, 4.5; N,18.7%. Полученные величины: С, 53.6; Н, 4.5; N,18.6%. К перемешиваемому раствору 6-амино-4[(3-бромфенил)амино]-7-[3-N-(имидазоил)пропилокси]хиназолина (383 мг, 0.87 мМоль),акриловой кислоты (6 Моль, 5.23 мМоль, 359 мкл) и пиридина (избыток, 1.0 мл) в DMA (20 мл) под азотом добавляют гидрохлорид 1-(3 диметиламинопропил)-3-этилкарбодиимида(EDCIHCl) (5 Моль, 4.36 мМоль, 838 мг). Стандартная процедура, описанная выше, была продолжена хроматографией на окиси алюминияGrade III градиентной элюцией от смеси ЕtOAс/гексан (1:1) до смеси МеОН/ЕtOAc(5:95), с получением N-[4-[(3-бромфенил) амино]-7-[3-N-(имидазоил)пропилокси]хиназолин 6-ил]акриламида (9 мг, 2%) в виде порошка кремового цвета с Tпл (CH2Cl2/Et2O/reкcaн)=235237C. 1(ddd, J=8.2, 1.8, 1.0 Гц, 1H, Н-6'), 7.64 (s, 1H,имидазоилметин), 7.34 (t, J=8.0 Гц, 1H, H-5'),7.28 (br dt, Jd=8.0 Гц, Jt=1.2 Гц, 1H, H-4'), 7.27 (s,1H, H8), 7.21 (t, J=1.3 Гц, 1H, имидазоилметин),6.89 (br s, 1H, имидазоил метин), 6.73 (dd,J=17.0, 10.2 Гц, 1H, CH2 СНСО), 6.34 (dd, J=17.0,1.8 Гц, 1H, СH2 СНСО), 5.85 (dd, J=10.2, 1.8 Гц,1H, CH2 СНСО), 4.22 (t, J=6.9 Гц, 2H. СН 2CH2 СH2), 4.14 (t, J=6.0 Гц, 2H, CH2CH2CH2),2.27 (квинтет, J=6.4 Гц, 2H, СН 2 СH2 СН 2). Результаты анализ для C23H21BrN6O2 0.75H2O: Расчетные величины: С, 54.5; Н, 4.5;N, 16.2%. Пример 26. N-[4-[(3-бромфенил)амино]-7[4-(N,N-диметиламино)бутокси]хиназолин-6 ил]акриламид. В суспензию предварительно промытого гексаном гидрида натрия (11.0 мМоль, 440 мг 60% дисперсии в минеральном масле) в ТГФ (20 мл) по трубке подают раствор 4-(N,Nдиметиламино)бутан-1-ола (8.80 мМоль, 1.03 г) в ТГФ (30 мл). Получившуюся суспензию перемешивают при 20 С под азотом 2 ч и затем подают по трубке в раствор 4-[(3-бромфенил) амино]-7-фтор-6-нитрохиназолина 59 ТГФ (30 мл) под азотом. Полученный темнокрасный раствор затем нагревают до кипения с обратным холодильником в течение ночи. Идентичная описанной выше процедура дает,после хроматографии на окиси алюминия GradeIII с градиентной элюцией от EtOAc до смеси МеОН/ЕtOАс (5:95), 6-амино-4-[(3-бромфенил) амино]-7-[4-(N,N-диметиламино)бутилокси] хиназолин (310 мг, 33%) в виде бледнокоричневого порошка с Тпл (СН 2 Сl2/ гексан)=155-156 С. 1H ЯМР-спектроскопия [(СD3)2SO], (400 МГц):9.36 (s, 1H, NH), 8.39 (s, 1H, ароматика),8.23 (t, J=2.0 Гц, 1H, H-2'), 7.86 (br d, J=8.0 Гц,1H, H-6'), 7.41 (s, 1H, ароматика), 7.30 (t, J=8.1 Гц, 1H, H-5'), 7.20 (ddd, J=8.2 Гц, J=0.8 Гц, J=1.8 Гц, 1H, H-4'), 7.09 (s, 1H, ароматика), 5.32 (s, 2H,NH2), 4.17 (t, J=6.2 Гц, 2 Н, CH2CH2CH2CH2O),2.47 (t, J=7.3 Гц, 2H, NCH2CH2CH2CH2), 2.15 (s,6H, N(CH3)2), 1.84 (квинтет, J=6.4 Гц, 2H,СН 2 СН 2 СН 2 СН 2), 1.62 (квинтет, J=6.9 Гц, 2H,СН 2 СН 2 СН 2 СН 2). Результаты анализа для C20H24BrN5O 0.5H2O: Расчетные величины: С, 54.7; Н, 5.7; N,15.9%. Полученные величины: С, 54.3; Н, 5.8; N,15.8%. К перемешиваемому раствору описанного выше 6-аминохиназолина (276 мг, 0.64 мМоль),акриловой кислоты (6 мол. экв., 3.85 мМоль, 264 мл) и Еt3N (избыток, 1.0 мл) в DMA (10 мл) под азотом, добавляют гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI'HCl)(3 мол. экв., 1.92 мМоль, 369 мг). Описанную выше стандартную процедуру завершают хроматографией на окиси алюминия Grade III с градиентной элюцией от смеси ЕtOАс/гексан (1:1) до смеси MeOH/EtOAc (3:97) с получением N[4-[(3-бромфенил)амино]-7-[4-(N,N-диметиламино)бутилокси]хиназолин-6-ил]акриламида(98 мг, 32%) в виде кремового порошка сТплH ЯМР-спектроскопия [(СD3)2SO], (400 МГц):9.77 (s, 1H, CONH), 9.62 (s, 1H, NH),8.88 (s, 1H, ароматика), 8.56 (s, 1H, ароматика),8.17 (t, J=1.9 Гц, 1H, H-2'). 7.87 (ddd, J=8.2 Гц,J=1.8 Гц, J=1.0 Гц, 1H, Н-6'), 7.34 (t, J=8.0 Гц,1Hб H-5'), 7.29 (s, 1H, ароматика), 7.27 (ddd,J=8.2 Гц, J=1.8 Гц, J=1.0 Гц, 1H, Н-4'), 6.71 (dd,J=17.1 Гц, J=10.2 Гц, 1 Н, СН 2 СНСО), 6.32 (dd,J=17.0 Гц, J=1.9 Гц, 1H, CH2CHCO), 5.82 (dd,J=10.2 Гц, J=1.9 Гц, 1H, СН 2 СНСО), 4.24 (t,J=6.6 Гц, 2 Н, СН 2 СН 2 СН 2 СН 2 О), 2.27 (t, J=7.2 Гц, 2 Н, NCH2CH2CH2CH2), 2.12 (s, 6 Н, N(CH3)2),1.85 (квинтет, J=6.9 Гц, 2 Н, CH2CH2 СH2 СH2,1.60 (квинтет, J=7.4 Гц, 2 Н, СН 2 СН 2 СH2 СН 2). Результаты анализа для C23H26BrN5O2 1.25H2O: Расчетные величины: С, 54.5; Н, 5.7;(1.78 г, 4.82 мМоль), морфолина (избыток, 4.0 мл) и п-толуолсульфоновой кислоты (каталитически) в ТГФ (50 мл) греют при 50 С в течение 4 ч, после чего концентрируют под вакуумом ,разбавляют водой и экстрагируют EtOAc. Объединенные органические экстракты промывают солевым раствором, сушат над безводнымNa2SO4, концентрируют под вакуумом и хроматографируют на силикагеле с элюцией смесью МеОН/CH2 Сl2/ЕtOАс (15:40:45) после чего получают N-[4-[(3-бромфенил)амино]хиназолин-6 ил]-N-[3-морфолинпропиламид (1.86 г, 78%) в виде кремового порошка с Tпл (EtOAc)=184186C. 1C ЯМР-спектроскопия:170.24, 157.18,152.86, 146.48, 141.13, 136.87, 130.21, 128.39,127.01, 125.74, 124,21, 121.03, 120.79, 115.40,111.46, 66.09 (х 2), 54.04, 53.00 (х 2), 33.66. Результаты анализа C21H22BrN5O2: Расчетные величины: С, 55.3; Н, 4.9; N, 15.3%. Полученные величины: С, 55.1; Н, 5.2; N, 15.2%. К перемешиваемому раствору описанного выше амида (0.85 г, 1.86 мМоль) в ТГФ (30 мл) под азотом при 0 С добавляют ВН 3' DMS (2 мол. экв., 372 мкл 10 М раствора) по каплям. Полученному раствору позволяют прогреться до 25 С и перемешивают его 2 ч, после чего погасят осторожным добавлением 1N HCl (40 мл). Реакционную смесь затем перемешивают при 50 С 2 ч, подщелачивают добавлением насыщенного Na2CO3 и экстрагируют ЕtOАс. Объединенные органические экстракты промывают солевым раствором, сушат над безводнымNa2SO4, концентрируют под вакуумом и хроматографируют на силикагеле с элюцией смесьюMeOH/CH2Cl2/EtOAc (3:8:8) с получением [4[(3-бромфенил)амино]-6-[(3-морфолинпропил) амино]хиназолина (130 мг, 16%) в виде желтого стеклообразного вещества (90% чистоты по ЯМР). Это соединение используют без дальнейшей очистки. 1
МПК / Метки
МПК: A61P 9/10, A61K 31/498, C07D 239/94
Метки: необратимые, ингибиторы, тирозинкиназ
Код ссылки
<a href="https://eas.patents.su/30-1595-neobratimye-ingibitory-tirozinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Необратимые ингибиторы тирозинкиназ</a>












