Способ и промежуточные соединения для получения ненуклеозидных ингибиторов ревертазы вируса вич-1
Формула / Реферат
1. Способ получения соединения формулы I
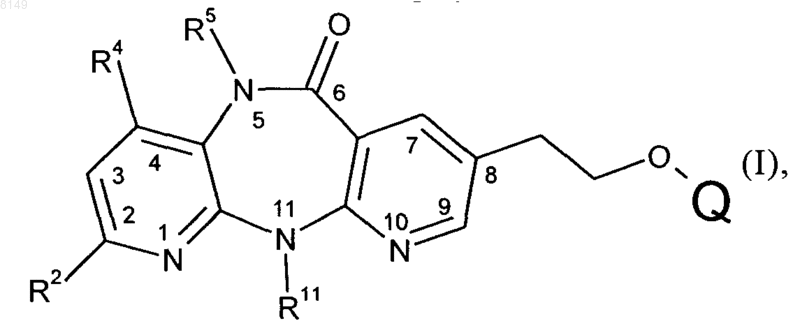
в которой
R2 выбран из группы, включающей Н, F, Cl, C1-C4алкил, C3-C4диклоалкил и CF3,
R4 обозначает Н или Me,
R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,
R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил и Q выбран из группы, включающей
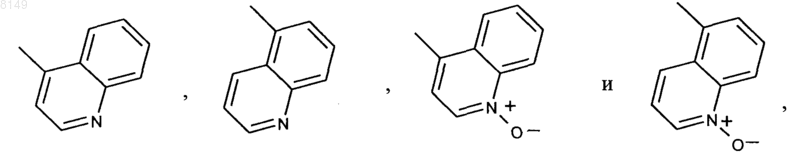
заключающийся в том, что
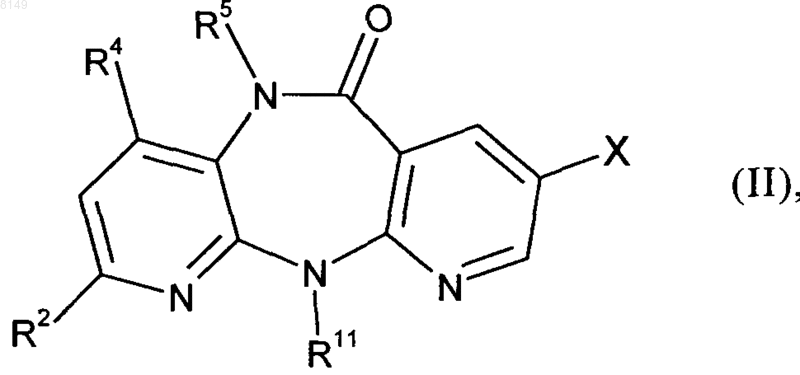
(а) исходное соединение формулы II
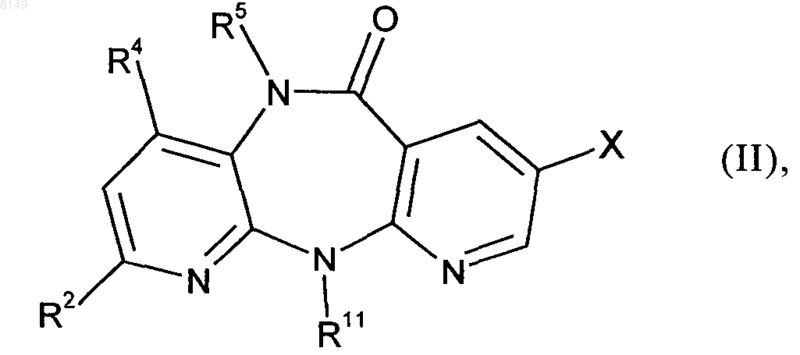
в которой R2, R4, R5 и R11 имеют указанные выше для соединения формулы I значения, а X обозначает хлор, йод или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и -OSO2(CF2)nCF3, где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы III
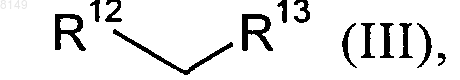
в которой
R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, а
R13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4алкильную группу, С1-C4алкилокси-С1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), с получением промежуточного соединения формулы IV
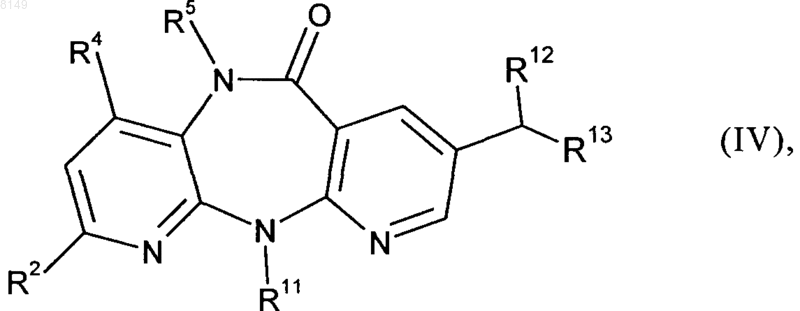
в которой R2, R4, R5, R11, R12 и R13 имеют указанные выше в этом пункте значения,
(б) при наличии в промежуточном соединении формулы IV серо- или фосфорсодержащей группы ее отщепляют под действием восстановителя,
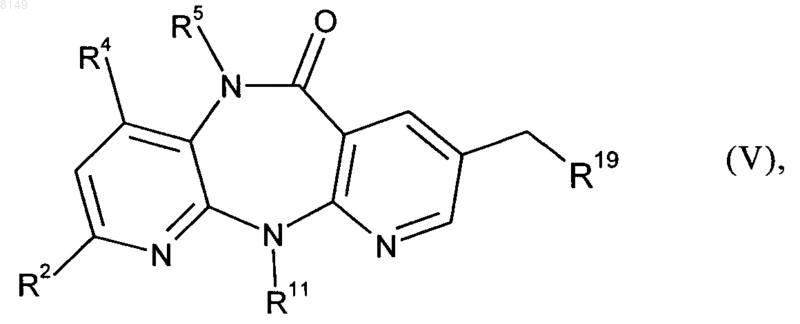
(в) промежуточное соединение формулы IV подвергают гидролизу с получением следующего промежуточного соединения формулы V

в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, a R19 обозначает -СООН или при использовании в качестве реагента формулы III малоната и мягких условий гидролиза R19 дополнительно может обозначать группу формулы -COOR14, где R14 имеет указанные выше в этом пункте значения,
(г) промежуточную карбоновую кислоту или ее промежуточный эфир формулы V восстанавливают до спирта формулы VI

в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, и (д) спирт формулы VI подвергают конденсации с реагентом формулы
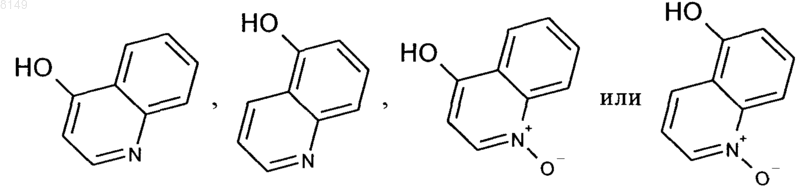
с получением конечного продукта формулы I.
2. Способ получения соединения формулы IV
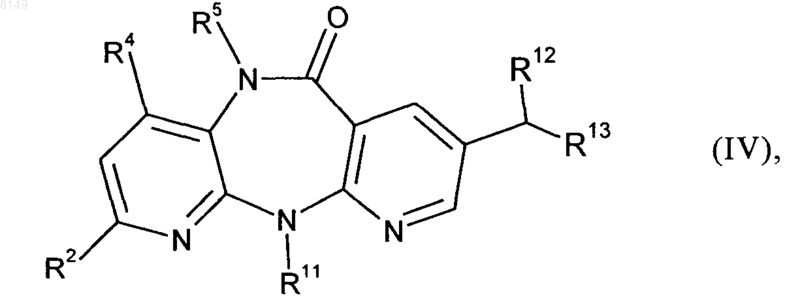
в которой
R2 выбран из группы, включающей Н, F, Cl, C1-C4алкил, C3-C4циклоалкил и CF3,
R4 обозначает Н или Me,
R5 обозначает Н, Me или Et при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,
R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил,
R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, и
R13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R (где R16 представляет собой C1-C4алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), заключающийся в том, что
(а) исходное соединение формулы II
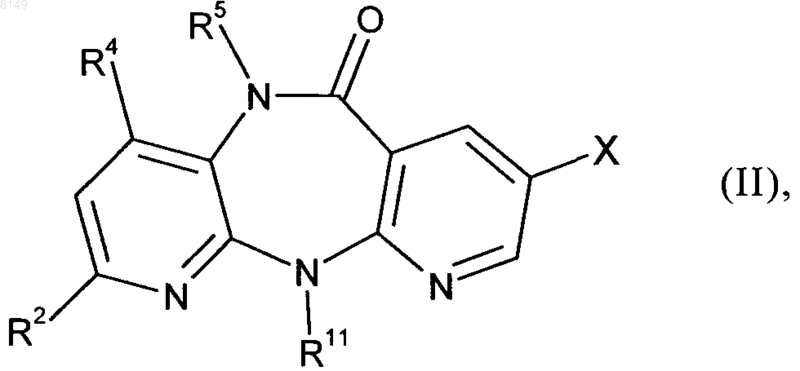
в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, а X обозначает хлор, йод, или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и -OSO2(CF2)nCF3, где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы III
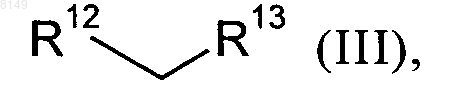
в которой
R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-С4алкильную группу, C1-С4алкилокси-C1-С4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, а
R13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-С4алкильную группу, C1-С4алкилокси-C1-С4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-С4алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-С4алкильную группу, C1-С4алкилокси-C1-С4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), с получением соединения формулы IV.
3. Способ получения соединения формулы V
в которой
R2 выбран из группы, включающей Н, F, О, C1-C4алкил, C3-C4циклоалкил и CF3,
R4 обозначает Н или Me,
R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,
R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил и
R19 обозначает -СООН или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, заключающийся в том, что
(а) исходное соединение формулы II
в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, а X обозначает хлор, йод или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и -OSO2(CF2)nCF3, где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы III
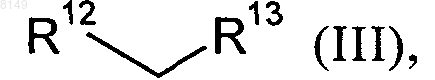
в которой
R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, а
R13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил),
с получением промежуточного соединения формулы IV
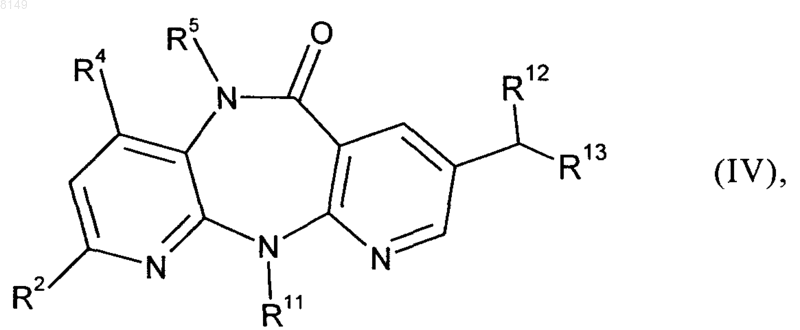
в которой R2, R4, R5, R11, R12 и R13 имеют указанные выше в этом пункте значения,
(б) при наличии в промежуточном соединении формулы IV серо- или фосфорсодержащей группы (когда R13 в соединении формулы III представляет собой группу формулы -SO2R16 или -P(O)(OR17)2) ее отщепляют под действием восстановителя и
(в) промежуточное соединение формулы IV подвергают гидролизу с получением соединения формулы V.
4. Способ по п.3, в котором в качестве реагента формулы III используют малонат, а в качестве лиганда используют трет-Bu3P или ферроценилфосфин.
5. Способ по п.3, в котором в качестве реагента формулы III используют заменитель малоната, а в качестве лиганда используют трет-Bu3P, ферроценилфосфин или триарилфосфин.
6. Способ по п.5, в котором в качестве лиганда используют PPh3, o-Tol3Р, п-Tol3P или о-Fur3Р.
7. Соединение формулы IV
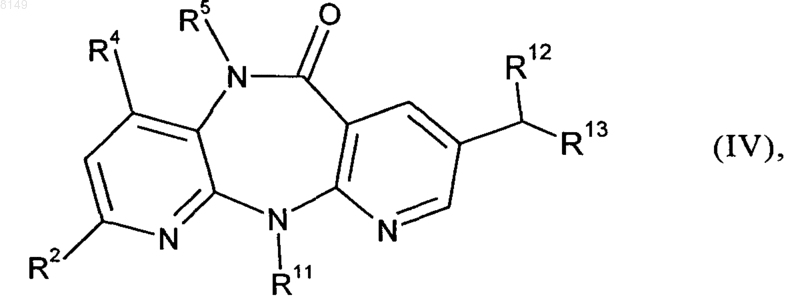
в которой
R2 выбран из группы, включающей Н, F, Cl, C1-C4алкил, C3-C4циклоалкил и CF3,
R4 обозначает Н или Me,
R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,
R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил,
R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, и
R13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил).
8. Соединение формулы V
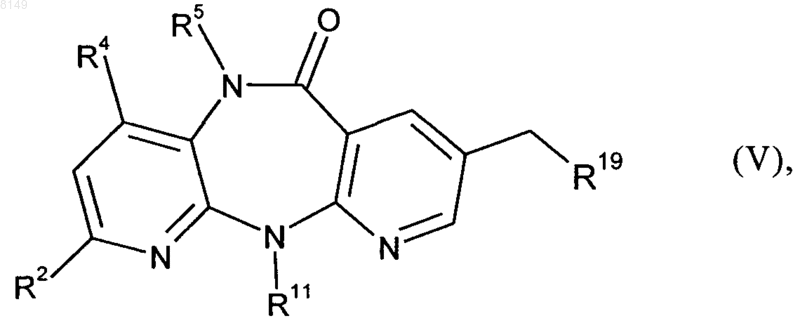
в которой
R2 выбран из группы, включающей Н, F, О, C1-C4алкил, C3-C4циклоалкил и CF3,
R4 обозначает Н или Me,
R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,
R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил и
R19 обозначает -СООН или группу формулы -COOR14, где R14 представляет собой C1-C4алкильную группу, C1-C4алкилокси-C1-C4алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил.
Текст
008149 Область техники, к которой относится изобретение Настоящее изобретение относится к новому способу получения некоторых ненуклеозидных ингибиторов ревертазы и к новым промежуточным соединениям для их синтеза. Предпосылки создания изобретения Заболевание, известное как синдром приобретенного имммунодефицита (СПИД), вызывается вирусом имммунодефицита человека (ВИЧ), в частности штаммом, известным как ВИЧ-1. Необходимым условием репликации ВИЧ клеткой-хозяином является встраивание информации, содержащейся в вирусном геноме, в ДНК клетки-хозяина. Однако ВИЧ является ретровирусом, и поэтому его генетическая информация представлена в виде РНК. По этой причине в цикле репликации ВИЧ требуется стадия транскрипции вирусного генома (РНК) в ДНК. Транскрипция вирусной РНК в ДНК катализируется ферментом, который соответственно получил название "обратная транскриптаза" ("ревертаза"). Вирион ВИЧ наряду с вирусной РНК содержит также копию ревертазы. Ревертаза выполняет три известные ферментативные функции. Так, в частности, ревертаза выполняет функцию РНК-зависимой ДНК-полимеразы, рибонуклеазы и ДНК-зависимой ДНК-полимеразы. Выполняя функцию РНК-зависимой ДНК-полимеразы, ревертаза обеспечивает транскрипцию вирусной РНК с получением ее копии в виде однонитевой ДНК. Выполняя функцию рибонуклеазы, ревертаза катализирует расщепление исходной вирусной РНК и обеспечивает отделение ДНК сразу же после ее синтеза от исходной РНК. И, наконец, выполняя функцию ДНК-зависимой ДНК-полимеразы, ревертаза катализирует образование второй, комплементарной нити ДНК с использованием в качестве матрицы первой нити ДНК. Обе эти нити или цепи образуют двунитевую ДНК, которая встраивается в геном клеткихозяина посредством другого фермента, называемого интегразой. Соединения, которые ингибируют ферментативные функции ревертазы ВИЧ-1, подавляют репликацию ВИЧ-1 в инфицированных им клетках. Подобные соединения могут использоваться для профилактики или лечения вызванной ВИЧ-1 инфекции у человека, о чем свидетельствуют данные исследований известных ингибиторов ревертазы, в качестве примера которых можно назвать 3'-азидо-3'дезокситимидин (AZT), 2',3'-дидезоксиинозин (ddI), 2',3'-дидезоксицитидин (ddC), d4T, 3TC, невирапин,делавирдин, эфавиренц и абакавир и которые тем самым хорошо зарекомендовали себя как пригодные для лечения ВИЧ-инфекции лекарственных веществ. При применении ингибиторов ревертазы при лечении ВИЧ-инфекции вирус, как и при любой противовирусной терапии, в конечном итоге становится менее чувствительным к соответствующему лекарственному веществу. Такая резистентность (пониженная чувствительность) к подобным лекарственным веществам является результатом мутаций, происходящих в ревертазной единице гена pol. К настоящему времени охарактеризовано несколько подобных мутантных штаммов ВИЧ, резистентность которых к известным терапевтическим средствам обусловлена мутациями в кодирующем ревертазу гене. К числу некоторых наиболее часто встречающихся в клинической практике мутантов относятся мутант Y181C, у которого тирозин Y в положении кодона 181 заменен в результате мутации на остаток цистеина С, и мутант K103N, у которого лизин K в положении 103 заменен на аспаргин N. К другим мутантам, которые появляются с возрастающей частотой при лечении известными противовирусными средствами, относятся мутанты с одиночными заменами V106A, G190A, Y188C и P236L и мутанты с двойными заменамиK103N/Y181C, K013N/P225H, K103N/V108I и K103N/L100I. Ожидается, что при продолжающемся применении противовирусных средств для терапии ВИЧинфекции количество вновь появляющихся резистентных штаммов будет возрастать. По этой причине сохраняется необходимость в новых ингибиторах ревертазы, обладающих иными механизмами действия,направленным против различных мутантных штаммов ВИЧ. Особое значение в контексте настоящего изобретения имеют ингибиторы ревертазы ВИЧ, описанные в патенте US 6420359. Все эти соединения, которые относятся к семейству дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-онов, несущих 2-(хинолинил)оксиэтильную или 2-(1-оксидохинолинил)оксиэтильную группу в положении 8, обладают более высокой активностью в отношении некоторых клинически важных мутантных штаммов ВИЧ-1. В соответствии с этим в основу настоящего изобретения была положена задача разработать альтернативный способ получения соединений, описанных в патенте US 6420359. Краткое изложение сущности изобретения В настоящем изобретении предлагается усовершенствованный способ получения соединений общей формулы IR5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, еслиR обозначает Me, то R5 не может обозначать Et, R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил и Q выбран из группы, включающей 4 а также их фармацевтически приемлемых солей. Подробное описание изобретения При осуществлении предлагаемого в изобретении способа синтеза в качестве исходного используют соединение формулы II в которой R2, R4, R5 и R11 имеют указанные выше для соединения формулы I значения, а X обозначает хлор, иод или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и-OSO2(CF2)nCF3, где n представляет собой целое число в интервале от 0 и 10. Методы получения исходных соединений формулы II, в которой X обозначает бром, описаны в US 6420359. Соединения, в которых X имеет отличные от брома значения, можно получать аналогичными методами, очевидными для специалистов в данной области. Согласно изобретению предпочтительно использовать соединение формулы II, в которой X обозначает бром. Исходное соединение формулы II сначала подвергают катализируемой палладием реакции сочетания путем арилирования малоната или его "заменителя" формулы III в которойR12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил, аR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4 алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4 алкильную группу, C1C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил). При осуществлении предлагаемого в изобретении способа предпочтительно использовать "заменитель" малоната формулы III в которойR12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил, а R13 обозначает цианогруппу, группу формулы -SO2R16 (где R16 представляет собой C1-C4 алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собойC1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил). Реакцию между соединениями формул II и III проводят в органическом растворителе, в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания. В качестве примера пригодных для применения в этих целях растворителей можно назвать, но не ограничиваясь только ими,толуол, этилбензол, ксилол, диметилформамид (ДМФ), N,N-диметилацетамид (ДМА), N-метилпирролидон (N-МП), диоксан и тетрагидрофуран (ТГФ), среди которых предпочтителен толуол. В качестве палладиевого катализатора фактически можно использовать любой палладиевый катализатор, такой, например, как Pd(OAc)2, PdCl2, Pd2dba3 и Pd на угле, среди которых предпочтителен Pd(OAc)2. В качестве примера пригодных для применения в указанных выше целях оснований можно назвать гидриды металлов, такие, например, как NaH, алкоксиды металлов, такие, например, как трет-BuOK, трет-BuONa и Na-2 008149 трет-амилат, карбонаты металлов, такие, например, как Na2CO3, K2 СO3 и Cs2CO3, среди которых предпочтителен NaH, и фосфаты металлов, такие, например, как K3 РО 4. Если реагентом формулы III служит малонат (соединения, в которых R12 и R13 оба обозначают карбоксилатные группы), то в качестве соответствующих лигандов могут использоваться трет-Bu3P, один из лигандов, описанных в патенте US 6307087, или ферроценилфосфин, такой как описанный в US 6057456 и US 6072073. Если же реагент формулы III не является малонатом, а представляет собой его "заменитель" (соединение, в котором R12 иR13 оба не обозначают карбоксилатные группы), то в этом случае помимо упомянутых выше лигандов дополнительно можно также использовать триарилфосфин, в качестве не ограничивающих примеров которого можно назвать PPh3, o-Tol3P, n-Tol3P и о-Fur3P. Среди таких лигандов предпочтителен PPh3. Реакцию предпочтительно проводить при повышенной температуре, более предпочтительно при температуре в интервале от примерно 50 до 150 С. В результате описанной выше реакции сочетания соединений формул II и III получают промежуточное соединение формулы IV в которой R2, R4, R5, R11, R12 и R13 имеют указанные выше значения. Выделение промежуточного соединения формулы IV перед его использованием на следующей стадии процесса в принципе является не обязательной стадией. Согласно изобретению было установлено,что вполне приемлемо проводить реакцию по методу синтеза в одном реакционном сосуде без выделения промежуточного соединения формулы IV. Если промежуточное соединение формулы IV не выделяют, а в качестве сильного основания используют гидрид металла, такой как NaH, некоторое количество которого остается неизрасходованным в реакционной смеси, то подобное основание перед переходом к следующей стадии целесообразно быстро "гасить" добавлением такого агента, как изопропиловый спирт. Если промежуточное соединение формулы IV содержит серу или фосфор (когда в использовавшемся реагенте формулы III R13 представляет собой группу формулы -SO2R15 или -P(O)(OR16)2), то на следующей стадии процесса серо- или фосфорсодержащую группу отщепляют под действием восстановителя. Методы такого восстановительного отщепления известны специалистам в данной области. Так, например, отщеплять серо- или фосфорсодержащую группу можно за счет использования никеля Ренея или за счет реакции с растворимыми соединениями металлов. Затем промежуточное соединение формулы IV либо после предварительного восстановительного отщепления серо- или фосфорсодержащей группы, либо непосредственно, если это промежуточное соединение формулы IV не содержит серу или фосфор, подвергают гидролизу с получением следующего промежуточного соединения формулы V в которой R2, R4, R5 и R11 имеют указанные выше значения, a R19 обозначает -СООН или при использовании в качестве реагента формулы III малоната и мягких условий гидролиза R19 дополнительно может обозначать группу формулы -COOR14, где R14 имеет указанные выше значения. Гидролиз можно проводить в соответствии с традиционной методикой, хорошо известной специалистам в данной области. Так,например, гидролиз можно проводить с использованием водного основания, такого как NaOH, предпочтительно при комнатной или более высокой температуре. Промежуточные соединения формул IV и V являются новыми и в соответствии с этим составляют еще один объект настоящего изобретения. Перед проведением следующей стадии сначала предпочтительно выделять промежуточное соединение формулы V. После этого промежуточную карбоновую кислоту или ее промежуточный эфир формулы V восстанавливают до спирта формулы VI-3 008149 в которой R2, R4, R5 и R11 имеют указанные выше значения. Подобное восстановление проводят традиционным методом, хорошо известным специалистам в данной области. Вне зависимости от того, является ли промежуточное соединение формулы V кислотой или ее эфиром, восстановление можно проводить с использованием боранов, боргидридов либо иных гидридов металлов или растворимых соединений металлов в качестве восстановителей, при этом в случае кислот предпочтительно использовать бораны, а в случае эфиров предпочтительно использовать боргидриды. При использовании борана его предпочтительно получать in situ из боргидрида, такого как боргидрид натрия, и электрофильного реагента, такого,например, как НСl. На завершающей стадии спирт формулы VI превращают в конечный продукт формулы I путем конденсации с реагентом формулы Подобную конденсацию можно проводить по методу, описанному в US 6420359. Ниже изобретение более подробно рассмотрено на примерах. Пример 1. Арилирование малононитрила с получением соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, a R12 и R13 обозначают CN. В колбу загружали 10,0 г трициклического бромида (соединения формулы II, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, а X обозначает Br; 30 ммолей, 1 экв.), 0,95 г трифенилфосфина (3,6 ммоля, 0,12 экв.), 0,55 г Pd2dba3 (0,6 ммоля, 0,04 экв.) и 40 мл 1,4-диоксана. К этой смеси затем в течение 15 мин порциями добавляли 2,16 г гидрида натрия (90 ммолей, 3 экв.), а затем 40 мл 1,4-диоксана. После этого добавляли раствор 2,57 г малононитрила (39 ммолей, 1,3 экв.) в 5 мл 1,4 диоксана и смесь нагревали до 90 С. По истечении 18 ч смесь охлаждали до комнатной температуы и реакцию прекращали осторожным добавлением 100 мл насыщенного раствора хлорида аммония. После этого значение рН реакционной смеси устанавливали на 6 с помощью 1 н. НСl и смесь экстрагировали дихлорметаном. Органический раствор сушили (сульфат магния) и растворители удаляли в вакууме с получением 7,03 г (73%) продукта в виде коричневого масла. Данные ЯМР- и МС-анализа подтверждали получение целевого продукта (соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначаетMe, R11 обозначает этил, а R12 и R13 обозначают CN). Пример 2. Арилирование диэтилмалоната с получением соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, a R12 и R13 обозначают CO2Et. 500-миллилитровую двугорлую круглодонную колбу, оснащенную механической мешалкой, парциальным конденсатором горячего орошения и термопарой, в течение 20 мин продували аргоном, после чего в нее загружали 404 мг Pd(OAc)2 (1,80 ммоля, 0.03 экв.), 1,08 г 2-(ди-трет-бутилфосфино)бифенила(3,60 ммоля, 0,06 экв.) и 20,0 г трициклического бромида (соединения формулы II, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, а X обозначает Br; 60,0 ммолей, 1 экв.). К этой смеси в инертизированной (продутой инертным газом) колбе затем добавляли 25,5 г K3 РО 4 (120 ммолей, 2 экв.),100 мл PhMe и 13,8 мл диэтилмалоната (90,0 ммолей, 1,5 экв.). Перемешиваемую суспензию после этого помещали в масляную баню и в течение 24 ч кипятили с обратным холодильником в атмосфере азота до израсходования бромида по данным ЖХВР. Далее реакционную смесь охлаждали до комнатной температуры, разбавляли водой (150 мл) и добавляли толуол (50 мл). После этого смесь перемешивали в течение 1 ч при комнатной температуре до растворения всего твердого вещества. Затем двухфазный раствор переносили в делительную воронку и слои разделяли. Водный слой экстрагировали толуолом (50 мл). Объединенные органические слои фильтровали через слой целита и концентрировали в вакууме с получением вязкого масла, которое упаривали досуха, получая оранжевое твердое вещество. После хроматографии на силикагеле (с использованием смеси EtOAc/гексан в соотношении 1:1) получили 20,5 г чистого аддукта малоната (соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, a R12 и R13 обозначают CO2Et) (83%) в виде бесцветного твердого вещества.-4 008149 В продутый инертным газом реактор объемом 800 л загружали 12,0 кг 60%-ного NaH в масле (300 молей, 2,5 экв.), 0,27 кг Pd(OAc)2 (1,2 моля, 0,01 экв.), 1,26 кг PPh3 (4,8 моля, 0,04 экв.) и 40 кг трициклического бромида (соединения формулы II, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, а X обозначает Br; 120 молей, 1 экв.). Затем реактор вновь продували инертным газом, после чего в него загружали 70 кг PhMe и смесь нагревали до 60 С. К этой смеси затем в течение 2 ч с помощью дозирующего насоса с постоянным расходом добавляли раствор 17,4 л цианоизопропилацетата(138 молей, 1,15 экв.) в 20 л PhMe (при проведении этой операции следует соблюдать осторожность в связи с выделением газообразного H2). Далее содержимое реактора нагревали до 100 С и выдерживали при этой температуре в течение 1,5 ч. По истечении этого промежутка времени ЖХВР-анализ аликвотного количества показал завершение процесса арилирования до соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, R12 обозначает CN, a R13 обозначает CO2-изо-Pr. Затем смесь охлаждали до 35 С и реакцию прекращали добавлением 19 кг изопропанола (308 молей, 2,6 экв.) в течение 20 мин (при проведении этой операции следует соблюдать осторожность в связи с выделением газообразного H2). После этого добавляли 438 кг 1-молярного раствора NaOH (417 молей, 3,5 экв.), смесь нагревали до 80 С и выдерживали при этой температуре в течение 8 ч. По истечении этого промежутка времени ЖХВР-анализ аликвотного количества показал завершение процесса гидролиза до требуемой карбоновой кислоты. Далее смесь охлаждали до 25 С и фазы разделяли. Верхнюю фазу направляли в отход, а нижнюю водную фазу возвращали в реактор. Затем в реактор загружали 218 кг ЕtOАс и смесь перемешивали в течение 15 мин, после чего фазам давали разделиться. Нижнюю водную фазу вновь возвращали в реактор и охлаждали до 10 С. К этой смеси затем медленно добавляли 6 н.H2SO4, непрерывно контролируя значение рН до достижения им конечной величины, равной 3,3, для чего потребовалось израсходовать 1,33 кг раствора H2SO4. Образовавшуюся суспензию затем нагревали до 25 С и выдерживали при этой температуре в течение 1 ч. После этого содержимое реактора центрифугировали и дважды промывали 40 кг H2O. Твердое вещество затем сушили в полном вакууме при 40 С до достигавшего предела чувствительности измерительной аппаратуры остаточного влагосодержания менее 1% с получением 36,0 кг карбоновой кислоты (соединения формулы V, в которой R2 и R4 обозначают Н,R5 обозначает Me, R11 обозначает этил, a R19 обозначает CO2H; 96%) в виде беловатого твердого вещества.(d, J=2,3 Гц, 1 Н), 7,81 (dd, J=8,0, 1,6 Гц, 1 Н), 7,24 (m, J=4,6, 8,0 Гц, 1 Н), 4,08 (q, J=7,0 Гц, 2 Н), 3,63 (s, 3 Н),3,43 (s, 3 Н), 1,17 (t, J=7,0 Гц, 3 Н). 13 С-ЯМР (125 МГц, ДМСО):= 172,22 (s), 166,26 (s), 157,47 (s), 153,96 (s), 151,32 (d), 144,06 (d),141,59 (d), 131,72 (d), 131,14 (s), 126,01 (s), 120,28 (d), 120,12 (s), 40,45 (t), 36,74 (q), 36,34 (t), 13,42 (q). Элементный анализ: рассчитано для Cl6H16N4O3: С 61,53, Н 5,16, N 17,94; обнаружено: С 61,28, Н 4,94, N 17,56. Пример 4. Арилирование метилфенилсульфонилацетата с получением соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, R12 обозначает CO2Me, a R13 обозначает SO2Ph. В колбу загружали 165 мг Pd2dba3 (0,18 ммоля, 0,02 экв.), 577 мг трифенилфосфина (2,2 ммоля, 0,12 экв.) и 45 мл 1,4-диоксана. После 15-минутного перемешивания в атмосфере инертного газа порциями добавляли 647 мг NaH (27 ммолей, 3 экв.). Далее к этой смеси добавляли 3,00 г трициклического бромида (соединения формулы II, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, а X обозначает Br; 9,00 ммолей, 1 экв.), а затем 2,50 г (11.7 ммоля, 1.3 экв.) метилфенилсульфонилацетата. После этого смесь нагревали до 60 С и выдерживали при этой температуре в течение 18 ч, после чего охлаждали до комнатной температуры и реакцию прекращали добавлением 0,5 мл H2O. Диоксан удаляли в вакууме с получением сырого продукта в виде серого твердого вещества с выходом 3,5 г (около 90%). Данные ЯМР- и МС-анализа подтверждали получение целевого продукта арилирования (соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, R12 обозначаетCO2 Ме, a R13 обозначает SO2Ph). Пример 5. Арилирование диэтилфосфонилацетонитрила с получением соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, R12 обозначает CN, a R13 обозначает P(O)(OEt)2. В колбу загружали 1,00 г трициклического бромида (соединения формулы II, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, а X обозначает Br; 3,00 ммоля, 1 экв.), 55 мг Pd2dba3(0,06 ммоля, 0,02 экв.), 95 мг трифенилфосфина (0,36 ммоля, 0,12 экв.) и 0,69 г диэтилфосфонилацетонитрила (3,90 ммоля, 1,3 экв.). Далее к этой смеси добавляли 15 мл 1,4-диоксана, а затем 216 мг NaH(9,00 ммолей, 3 экв.). Полученную смесь после этого нагревали до 70 С и выдерживали при этой температуре в течение 3 ч. Затем смесь охлаждали до комнатной температуры, реакцию прекращали осторожным добавлением 25 мл H2O и затем добавляли 20 мл дихлорметана. После этого значение рН устанавливали на 2,5 с помощью 1 н. водной HCl и разбавляли добавлением дополнительного количества H2O(25 мл) и дихлорметана (25 мл). По завершении этой операции фазы разделяли и органическую фазу концентрировали с получением коричневого масла. Это масло затем растирали с 10 мл третбутилметилового эфира с получением выпавшего в осадок продукта, который отфильтровывали, получая 0,95 г продукта в виде беловатого твердого вещества. Данные ЯМР- и МС-анализа подтверждали получение целевого продукта арилирования (соединения формулы IV, в которой R2 и R4 обозначают Н, R5 обозначает Me, R11 обозначает этил, R12 обозначает CN, a R13 обозначает P(O)(OEt)2). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы IR2 выбран из группы, включающей Н, F, Cl, C1-C4 алкил, C3-C4 диклоалкил и CF3,R4 обозначает Н или Me,R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если 4R обозначает Me, то R5 не может обозначать Et,R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил и Q выбран из группы,включающей(а) исходное соединение формулы II в которой R2, R4, R5 и R11 имеют указанные выше для соединения формулы I значения, а X обозначает хлор, йод или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и OSO2(CF2)nCF3, где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы III в которойR12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил, аR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4 алкильную группу,фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил,фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4 алкильную группу,С 1-C4 алкилокси-С 1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), с получением промежуточного соединения формулы IV в которой R2, R4, R5, R11, R12 и R13 имеют указанные выше в этом пункте значения,(б) при наличии в промежуточном соединении формулы IV серо- или фосфорсодержащей группы ее отщепляют под действием восстановителя,-6 008149(в) промежуточное соединение формулы IV подвергают гидролизу с получением следующего промежуточного соединения формулы V в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, a R19 обозначает -СООН или при использовании в качестве реагента формулы III малоната и мягких условий гидролиза R19 дополнительно может обозначать группу формулы -COOR14, где R14 имеет указанные выше в этом пункте значения,(г) промежуточную карбоновую кислоту или ее промежуточный эфир формулы V восстанавливают до спирта формулы VI в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, и (д) спирт формулы VI подвергают конденсации с реагентом формулы с получением конечного продукта формулы I. 2. Способ получения соединения формулы IVR2 выбран из группы, включающей Н, F, Cl, C1-C4 алкил, C3-C4 циклоалкил и CF3,R4 обозначает Н или Me,R5 обозначает Н, Me или Et при условии, что оба R4 и R5 одновременно не обозначают Me и, если R4 обозначает Me, то R5 не может обозначать Et,R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил,R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, иR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил), группу формулы -SO2R (где R16 представляет собой C1-C4 алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил, фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4 алкильную группу, C1C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил),заключающийся в том, что(а) исходное соединение формулы II в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, а X обозначает хлор, йод, или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и -OSO2(CF2)nCF3,где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы IIIR12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1-С 4 алкильную группу, C1-С 4 алкилокси-C1-С 4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил, аR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1-С 4 алкильную группу, C1-С 4 алкилокси-C1-С 4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил,имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-С 4 алкильную группу,фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил,фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-С 4 алкильную группу,C1-С 4 алкилокси-C1-С 4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), с получением соединения формулы IV. 3. Способ получения соединения формулы VR2 выбран из группы, включающей Н, F, О, C1-C4 алкил, C3-C4 циклоалкил и CF3,R4 обозначает Н или Me,R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если 4R обозначает Me, то R5 не может обозначать Et,R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил иR19 обозначает -СООН или группу формулы -COOR14, где R14 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, заключающийся в том, что(а) исходное соединение формулы II в которой R2, R4, R5 и R11 имеют указанные выше в этом пункте значения, а X обозначает хлор, йод или бром либо фторсульфонатный остаток, выбранный из группы, включающей -OSO2F и -OSO2(CF2)nCF3,где n представляет собой целое число в интервале от 0 и 10, подвергают в органическом растворителе в присутствии палладиевого катализатора, приемлемого лиганда и сильного основания взаимодействию с малонатом или его заменителем формулы III в которойR12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, аR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4 алкильную группу,фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил,фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4 алкильную группу,C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил),с получением промежуточного соединения формулы IV в которой R2, R4, R5, R11, R12 и R13 имеют указанные выше в этом пункте значения,-8 008149(б) при наличии в промежуточном соединении формулы IV серо- или фосфорсодержащей группы(когда R13 в соединении формулы III представляет собой группу формулы -SO2R16 или -P(O)(OR17)2) ее отщепляют под действием восстановителя и(в) промежуточное соединение формулы IV подвергают гидролизу с получением соединения формулы V. 4. Способ по п.3, в котором в качестве реагента формулы III используют малонат, а в качестве лиганда используют трет-Bu3P или ферроценилфосфин. 5. Способ по п.3, в котором в качестве реагента формулы III используют заменитель малоната, а в качестве лиганда используют трет-Bu3P, ферроценилфосфин или триарилфосфин. 6. Способ по п.5, в котором в качестве лиганда используют PPh3, o-Tol3 Р, п-Tol3P или о-Fur3 Р. 7. Соединение формулы IVR2 выбран из группы, включающей Н, F, Cl, C1-C4 алкил, C3-C4 циклоалкил и CF3,R4 обозначает Н или Me,R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если 4R обозначает Me, то R5 не может обозначать Et,R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил,R12 обозначает цианогруппу или группу формулы -COOR14, где R14 представляет собой C1C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил, иR13 обозначает цианогруппу, группу формулы -COOR15 (где R15 представляет собой C1C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил), группу формулы -SO2R16 (где R16 представляет собой C1-C4 алкильную группу, фенил, фурил, пиридил или бензил), группу формулы -P(O)(OR17)2 (где R17 представляет собой фенил,фурил или пиридил) или группу формулы -SOR18 (где R18 представляет собой C1-C4 алкильную группу,C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил). 8. Соединение формулы VR2 выбран из группы, включающей Н, F, О, C1-C4 алкил, C3-C4 циклоалкил и CF3,R4 обозначает Н или Me,R5 обозначает Н, Me или Et, при условии, что оба R4 и R5 одновременно не обозначают Me и, если 4R обозначает Me, то R5 не может обозначать Et,R11 обозначает Me, Et, циклопропил, пропил, изопропил или циклобутил иR19 обозначает -СООН или группу формулы -COOR14, где R14 представляет собой C1-C4 алкильную группу, C1-C4 алкилокси-C1-C4 алкильную группу, фенил, нафтил, тиофенил, фурил, пиридил, имидазол или бензил.
МПК / Метки
МПК: C07D 243/00, C07D 221/00, C07D 471/14
Метки: вируса, получения, вич-1, промежуточные, соединения, ингибиторов, способ, ненуклеозидных, ревертазы
Код ссылки
<a href="https://eas.patents.su/10-8149-sposob-i-promezhutochnye-soedineniya-dlya-polucheniya-nenukleozidnyh-ingibitorov-revertazy-virusa-vich-1.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и промежуточные соединения для получения ненуклеозидных ингибиторов ревертазы вируса вич-1</a>
Предыдущий патент: Новые соединения, их применение и получение
Следующий патент: Фармацевтическая композиция
Случайный патент: Транспортировочная секция для живой птицы на борту грузового автомобиля














