25-гидрокси-16-ен-26,27-бисгомохолекальциферолы
Номер патента: 2772
Опубликовано: 29.08.2002
Формула / Реферат
1. Производные 25-гидрокси-16-ен-26,27-бисгомохолекальциферола формулы
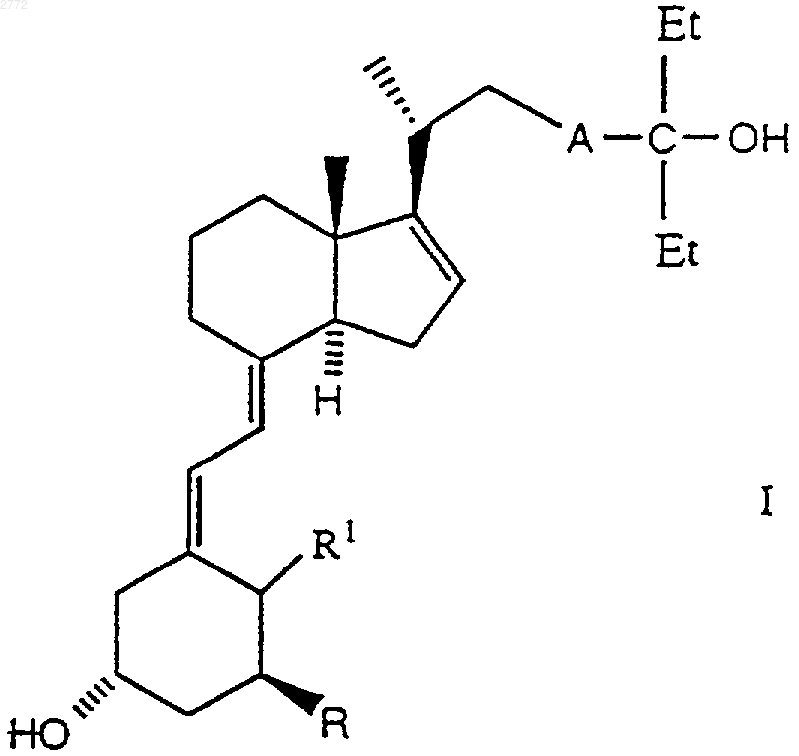
где А обозначает углерод-углеродную двойную связь, характеризующуюся стереохимической Е- или Z-конфигурацией, или А обозначает углерод-углеродную тройную связь, Et обозначает этил, R обозначает гидроксил, a R1 обозначает водород или = СН2 либо R обозначает водород или фтор, а R1 обозначает =СН2.
2. Соединение по п.1, в котором А обозначает углерод-углеродную двойную связь с Е-конфигурацией, в частности, в котором R обозначает гидроксил, прежде всего в котором R1 обозначает =СН2, предпочтительно 1,25-дигидрокси-16,23Е-диен-26,27-бисгомохолекальциферол.
3. Соединение по п.1, в котором А обозначает углерод-углеродную двойную связь с Z-конфигурацией, в частности, в котором R обозначает гидроксил, прежде всего в котором R1 обозначает =СН2, предпочтительно 1,25-дигидрокси-16,23Z-диен-26,27-бисгомохолекальциферол.
4. Соединение по п.1, в котором А обозначает углерод-углеродную тройную связь, в частности, в котором R обозначает гидроксил, прежде всего, в котором R1 обозначает =СН2, предпочтительно 1,25-дигидрокси-16-ен-23-ин-26,27 -бисгомохолекальциферол.
5. Соединение по п.1, представляющее собой 1a-фтор-25-гидрокси-16,23Е-диен-26,27-бисгомохолекальциферол.
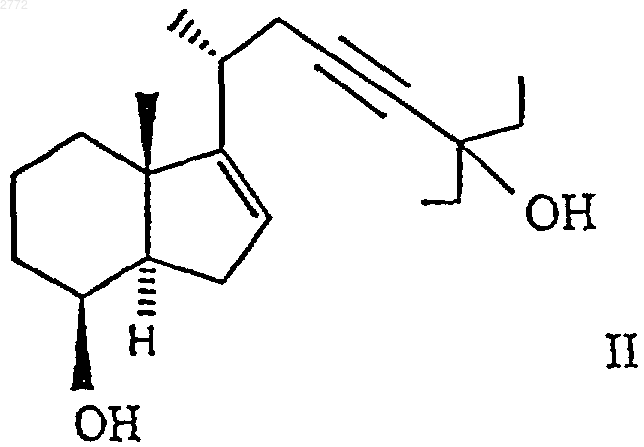
6. Соединение формулы II
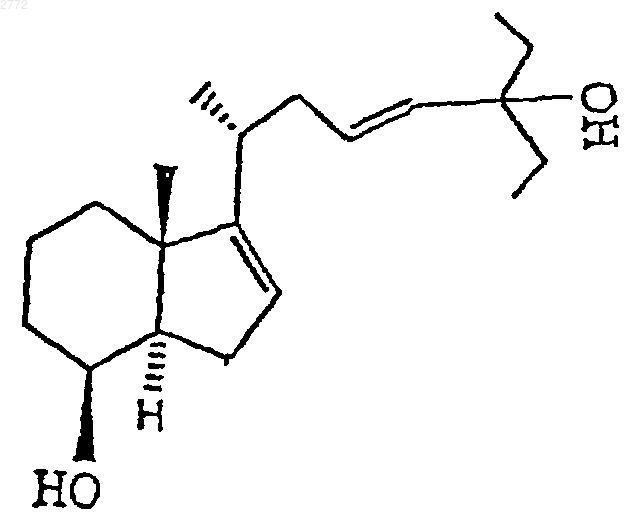
7. Соединение общей формулы
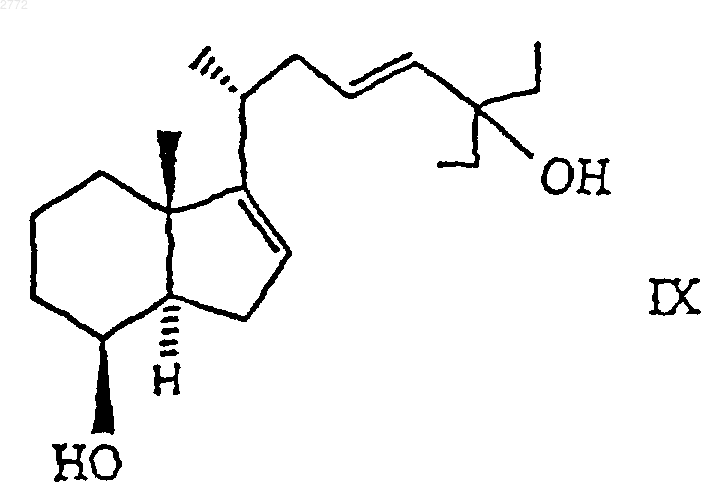
8. Соединение по п.7 общей формулы IX
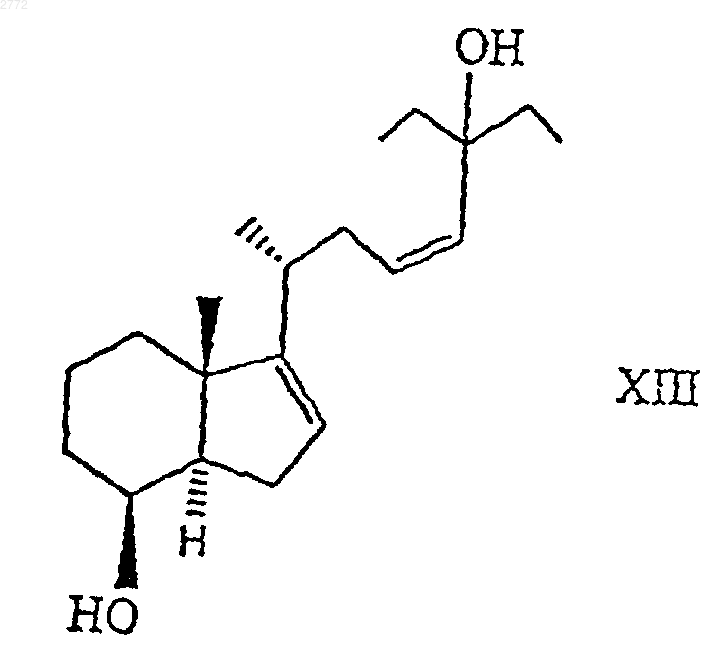
9. Соединение по п.7 общей формулы XIII
10. Фармацевтическая композиция, в частности, для лечения опухолевых заболеваний, таких как лейкоз, включающая эффективное количество одного, двух или большего числа соединений формулы I по п.1, 2, 3, 4 или 5 и инертный наполнитель.
11. Применение соединений по п.1, 2, 3, 4 или 5 при приготовлении лекарственного средства для лечения неопластических заболеваний, таких как лейкоз.
Текст
1 Настоящее изобретение относится к производным 25-гидрокси-16-ен-26,27-бисгомохолекальциферола формулы где А обозначает углерод-углеродную двойную связь, характеризующуюся стереохимической Е- или Z-конфигурацией, или А обозначает углерод-углеродную тройную связь, Et обозначает этил, R обозначает гидроксил, a R1 обозначает водород или = СН 2 либо R обозначает водород или фтор, a R1 обозначает =СН 2. Соединения формулы I стимулируют дифференцирование клеток HL-60 и, соответственно, могут быть использованы в качестве средств для лечения неопластических заболеваний, таких как лейкоз. В контексте данного описания термин"низший алкил", соответственно "(низш.)алкил" обозначает прямоцепочечную или разветвленную алкильную группу, содержащую 1-4 углеродных атома, например метил, этил, пропил,изопропил, бутил, трет-бутил и т.п. Термин"арил-(низш.)алкил" означает п-толил, бензил,фенилэтил, фенилпропил и т.п. Термин "арил" обозначает группу, являющуюся производным ароматического углеводорода, который может быть незамещенным или замещенным одной или несколькими (низш.)алкильными группами. Примерами "арила" являются фенил и пметилфенил. Далее, изобретение относится к композиции, включающей соединение формулы I или смесь двух или большего числа соединений формулы I, а также к применению этих соединений при приготовлении лекарственных препаратов для стимуляции дифференцирования клеток HL-60 и для лечения опухолевых заболеваний, таких как лейкоз. Кроме того, изобретение относится к применению соединений формулы I в качестве средств для лечения вышеупомянутых заболеваний. Изобретение относится также к способу получения соединений формулы I и к промежуточным продуктам, образующимся при его осуществлении. Предпочтительными являются соединения формулы I, в которых R обозначает гидроксил, аR1 обозначает =СН 2, прежде всего соединения А, Б и В, т.е. соответственно: 1,25-дигидрокси-16-ен-23-ин-26,27-бисгомохолекальциферол,1,25-дигидрокси-16,23Z-диен-26,27-бисгомохолекальциферол,1,25-дигидрокси-16,23 Е-диен-26,27-бисгомохолекальциферол. 2 Соединения формулы I, в которых А обозначает -СС-, получают согласно описанному ниже способу с конкретными ссылками на схему реакций I и приведенные ниже примеры. Схема реакций I где R1 имеет указанные выше значения, В обозначает -CCC(Et)2-, Y обозначает -OSi(R4,R5,R6), Et обозначает этил, R4 и R6 обозначают (низш.)алкил,а R5 обозначает (низш.)алкил, арил или арил(низш.)алкил. В приведенной выше схеме реакций I соединение формулы II превращают в соединение формулы III обработкой окисляющим агентом,таким как 2,2'-бипиридинийхлорхромат или пиридинийдихромат, при комнатной температуре в апротонном растворителе, таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы III обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы III превращают в соединение формулы IV взаимодействием, например, с (триалкилсилил)имидазолом, таким как 1(триметилсилил)имидазол, в апротонном органическом растворителе, таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы IV обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы IV превращают в соединение формулы Va, Vb или Vc взаимодействием с соответствующим соединением формулы 3 где Рh обозначает фенил; R7 обозначает водород, фтор или Y; а Y и R1 имеют указанные выше значения. Реакцию проводят при температуре от -60 до -90 С, предпочтительно при -78 С, в полярном апротонном органическом растворителе,таком как сухой диэтиловый эфир или предпочтительно сухой тетрагидрофуран, в присутствии сильного основания, такого как алкиллитий, в частности бутиллитий. Соединение формулыVa, Vb или Vc обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединения формулы VI известны или могут быть получены в соответствии с известными методами. Защитные группы соединения формулыVa, Vb или Vc удаляют взаимодействием с фторсодержащей солью, такой, как тетрабутиламмонийфторид, в полярном органическом растворителе, таком как сухой диэтиловый эфир или предпочтительно сухой тетрагидрофуран, с получением соответствующего соединения формулы Iа, Ib или Iс. Промежуточный продукт формулы II, который описан выше, получают по описанной ниже технологии с конкретной ссылкой на схему реакций II и приведенные ниже примеры. Схема реакций II где Y и В имеют указанные выше значения. В приведенной выше схеме реакций II соединение формулы VII превращают в соединение формулы VIII взаимодействием с 3-пентаноном. Эту реакцию проводят при температуре от -60 до-90 С, предпочтительно при -78 С, в полярном апротонном органическом растворителе, таком как сухой диэтиловый эфир или предпочтительно сухой тетрагидрофуран, в присутствии сильного основания, такого как алкиллитий, в частности бутиллитий. Соединение формулы VIII обрабатывают с применением обычных средств,таких как экстракция с последующей хроматографией. Соединение формулы VII известно из патентов США 5087619 и 5145846, которые включены в настоящее описание в качестве ссылок. Соединение формулы VIII превращают в соединение формулы II взаимодействием с фторсодержащей солью, такой как тетрабутиламмонийфторид, в полярном органическом растворителе, таком как сухой диэтиловый эфир 4 или предпочтительно тетрагидрофуран. Соединение формулы II обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединения формулы I, в которых А обозначает углерод-углеродную двойную связь с Еконфигурацией, получают по описанной ниже технологии с конкретной ссылкой на схему реакций III и приведенные ниже примеры. Схема реакций III где Y, В и R1 имеют указанные выше значения. Согласно вышеприведенной схеме реакцийIII соединение формулы II частично восстанавливают, получая соединение формулы IX, взаимодействием с восстановителем, таким как алюмогидрид лития, предпочтительно в присутствии алкоксида щелочного металла, в частности метоксида натрия, в апротонном органическом растворителе, в частности в сухом диэтиловом эфире или предпочтительно в сухом тетрагидрофуране, с кипячением с обратным холодильником (приблизительно 80 С для тетрагидрофурана) в течение примерно 24 ч и охлаждением до примерно 0 С. Соединение формулы IX обрабатывают с применением обычных средств,таких, как экстракция с последующей хроматографией. Конечное соединение формулы IX окисляют до соединения формулы Х обработкой окислителем, таким как 2,2'-бипиpидинийxлopxpoмaт или пиридинийдихромат, при комнатной температуре в апротонном растворителе, таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы Х обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы Х превращают в соединение формулы XI взаимодействием, например, с (триалкилсилил)имидазолом, таким как 1(триметилсилил)имидазол, в апротонном органическом растворителе, таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы XI обрабаты 5 вают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы XI превращают в соединение формулы ХIIа, XIIb или ХIIс взаимодействием с соответствующим соединением формулы VI. Эту реакцию проводят при температуре от -60 до -90 С, предпочтительно при -78 С, в полярном апротонном органическом растворителе, таком как сухой диэтиловый эфир или предпочтительно сухой тетрагидрофуран, в присутствии сильного основания, такого как алкиллитий, в частности бутиллитий. Соединение формулы ХIIа,XIIb или ХIIс обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Защитные группы соединения формулыXIIa, XIIb или XIIc удаляют взаимодействием с фторсодержащей солью, такой как тетрабутиламмонийфторид, в органическом растворителе,таком как сухой диэтиловый эфир или предпочтительно тетрагидрофуран, с получением соответствующего соединения формулы Id, Ie или If. Соединения формулы I, в которых А обозначает углерод-углеродную двойную связь с Zконфигурацией, получают по описанной ниже технологии с конкретной ссылкой на схему реакций IV и приведенные ниже примеры. Схема реакций IV где Y, В и R1 имеют указанные выше значения,D обозначает группу -CH=CHC(Et)2- с Zконфигурацией, a Et обозначает этил. Согласно вышеприведенной схеме реакцийIV соединение формулы II гидрогенизуют до соединения формулы XIII взаимодействием с водородом с использованием катализатора Линдлара в органическом растворителе, таком как сочетание этилацетата, гексана и этанола, в присутствии хинолина. Соединение формулыXIII обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Конечное соединение формулы XIII окисляют до соединения формулы XIV обработкой окислителем, таким как 2,2'-бипиридиний 002772 6 хлорхромат или пиридинийдихромат, при комнатной температуре в апротонном растворителе,таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы XIV обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы XIV превращают в соединение формулы XV взаимодействием, например, с (триалкилсилил)имидазолом, таким как 1-(триметилсилил)имидазол, в апротонном органическом растворителе, таком как сухой тетрагидрофуран или предпочтительно сухой метиленхлорид. Соединение формулы XV обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Соединение формулы XV превращают в соединение формулы XVIa, XVIb или XVIc взаимодействием с соответствующим соединением формулы VI. Эту реакцию проводят при температуре от -60 до -90 С, предпочтительно при -78 С, в полярном апротонном органическом растворителе, таком как сухой диэтиловый эфир или предпочтительно сухой тетрагидрофуран, в присутствии сильного основания, такого как алкиллитий, в частности бутиллитий. Соединение формулы XVIa, XVIb или XVIc обрабатывают с применением обычных средств, таких как экстракция с последующей хроматографией. Защитные группы соединения формулыXVIIa, XVIIb или XVIIc удаляют взаимодействием с фторсодержащей солью, такой как тетрабутиламмонийфторид, в органическом растворителе, таком как сухой диэтиловый эфир или предпочтительно тетрагидрофуран, с получением соответствующего соединения формулы Ig,Ih или Ii. Соединения формулы I, описанные выше,для лечения опухолевых заболеваний, таких как лейкоз, можно вводить в организм теплокровных животных, которые нуждаются в таком лечении, перорально. В частности описанные выше соединения формулы I для лечения опухолевых заболеваний, таких как лейкоз, взрослым людям можно вводить перорально в ежедневных дозах от примерно 0,05 до 50 мкг. Эффективность соединений формулы I в качестве средств для лечения опухолевых заболеваний можно продемонстрировать с применением следующих методов испытаний. Дифференцирование клеток HL-60 Индукцию дифференцирования клеток HL60 оценивали путем определения их окислительно-восстановительного потенциала восстановлением голубого нитротетразолия (ГНТ). Клетки HL-60 содержали в среде RPMI 1640, дополненной 10% фетальной телячьей сыворотки (ФТС), 2 мМ L-глутамина, 1 мМ пирувата натрия, 1% заменимых аминокислот, 50 ед/мл пенициллина и 50 мкг/мл стрептомицина. Клетки HL-60 (30000 клеток в 90 мкл дополненной среды RPMI) высевали в плоскодонные микролитровые сосуды. Непосредственно после посева в сосуды добавляли по 10 мкл перечисленных ниже в таблице тестируемых соединений, разбавленных дополненной средой RPMI таким образом, чтобы конечные концентрации составляли 10-11-10-6M (начиная с концентрации исходных растворов в этаноле 10-2 М, которые хранили при -20 С и защищали от света). По истечении 3 дней с помощью многоканальной пипетки среду из сосудов удаляли и заменяли 100 мкл раствора ГНТ (1 мг/мл в забуференном фосфатом физиологическом растворе с 200 нМ форболмиристатацетатом). По завершении дополнительной часовой инкубации при 37 С раствор ГНТ удаляли и добавляли 100 мкл 10%ного додецилсульфата натрия в 0,01 н. НСl. Количество восстановленного ГНТ определяли фотометрически при 540 нм с помощью автоматизированного планшет-ридера. Средние значения рассчитывали для 3 сосудов. Значения среднеквадратичного отклонения составляли 510%. Данные выражали в процентах от максимального дифференцирования, достигнутого при проведении такого же эксперимента с использованием 100-1000 нМ кальцитриола (соединение X). Концентрацию (в нМ), приводящую к достижению 50%-ного уровня от такого максимального значения, определяли графически, и она представлена в приведенной ниже таблице в колонке ЭД 50. Соединение Х А Б В Из приведенных выше результатов можно видеть, что соединения формулы I индуцируют дифференцирование клеток HL-60 и, следовательно, останавливают рост этих опухолевых клеток. Таким образом, соединения формулы I могут быть использованы для лечения опухолевых заболеваний, таких как лейкоз. Тест на мышах на толерантность к кальцию Глубокие изменения кальциевого гомеостаза оказывают сильное влияние на прирост веса у мышей. Мышам (весом 25-30 г) ежедневно в течение 4 дней подряд подкожно вводили тестируемое соединение. Непосредственно перед и по завершении 5-дневного периода обработки фиксировали вес тела. "Максимально допустимой дозой" (МДД) является доза, которая за такой период обработки прироста веса не вызывает. Полученные результаты представлены в приведенной выше таблице. Из приведенных выше данных очевидно,что толерантность к соединениям формулы I выше, чем к 1,25-дигидроксихолекальциферолу. 8 Дозированные препараты для перорального применения, включающие соединения формулы I по изобретению, можно изготавливать в виде капсул, таблеток и т.п. в сочетании с фармацевтически приемлемыми наполнителями. Примерами фармацевтически приемлемых наполнителей, которые можно заключать в капсулы и т.п., являются следующие продукты: связующие добавки, такие как трагакантовая камедь, аравийская камедь, кукурузный крахмал и желатин; наполнители, такие как вторичный кислый фосфат кальция; способствующие дезинтеграции агенты, такие как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; замасливатели, такие как стеарат магния; подслащивающее вещество, такое как сахароза, лактоза и сахарин; корригенты, такие как перечная мята, винтергреновое и вишневое масла. В качестве покрытия или для модификации физической формы дозированного препарата каким-либо другим образом может быть использовано множество других материалов. Так,например, таблетки можно покрывать шеллаком, сахаром или и тем, и другим. Сироп или эликсир может включать действующее вещество, сахарозу в качестве подслащивающего вещества, метил-и пропилпарабены в качестве консервантов, краситель и корригент, такой как вишневый или апельсиновый ароматизатор. Ниже настоящее изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Пример 1.[1(R),3aR-(3 а,4,7 а)]3 а,4,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5 гидрокси-3-гептинил)-7 а-метил-4-[(триметилсилил)окси]-3 Н-инден. В раствор 1,02 г (3,51 ммоля) 3aS[1(R)3 а,7,7 а]-3 а,4,5,6,7,7 а-гексагидро-3-(1 метил-3-бутинил)-3 а-метил-7-[(триметилсилил)окси]-1H-индена в 10 мл безводного тетрагидрофурана при -78 С медленно добавляли 2,5 мл (3,861 ммоля) 1,6 М раствор н-бутиллития в гексане. После перемешивания при -78 С в течение одного часа вводили 2,5 мл 3-пентанона и перемешивание продолжали еще в течение 15 мин. Реакционную смесь разбавляли водой и экстрагировали 4 порциями по 50 мл гексана. Объединенные экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с получением 273 мг выделенного исходного материала и 1 г (75%) указанного в заголовке соединения. 1 9 В перемешиваемый раствор 1,178 г (3,12 ммоля) [1(R),3aR(3 а,4,7 а)]-3 а,4,5,6,7,7 агексагидро-1-(1-метил-5-этил-5-гидрокси-3 гептинил)-7 а-метил-4-[(триметилсилил)окси]3 Н-индена в 15 мл безводного тетрагидрофурана добавляли 6 мл (6 ммолей) 1 М тетрабутиламмонийфторида. Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем ее разбавляли 150 мл смеси воды с рассолом в соотношении 1:1 и тщательно экстрагировали этилацетатом. Объединенные экстракты промывали 2 порциями по 30 мл воды, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с получением в виде белого кристаллического твердого вещества 900 мг (94,5%) указанного в заголовке соединения.(s, 1H, СН). Данные элементного анализа: рассчитано для С 20 Н 32 О 2: С 78,90, Н 10,59; обнаружено: С 78,92, Н 10,30. Пример 3. [1(R),3 аR-(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5-гидрокси-3 гептинил)-7 а-метил-4 Н-инден-4-он. В перемешиваемый раствор 253 мг (0,83 ммоля) [1(R),3aR-(3 а,4,7 а)]-3 а,4,5,6,7,7 агексагидро-1-(1-метил-5-этил-5-гидрокси-3 гептинил)-7 а-метил-3 Н-инден-4-ола в 15 мл безводного метиленхлорида при комнатной температуре в атмосфере аргона добавляли 1 г(2,65 ммоля) пиридинийдихромата. Реакционную смесь перемешивали в течение двух часов. Добавляли 0,5 г молекулярных сит с размером пор 3 и перемешивание продолжали в течение одного часа. После добавления 25 мл диэтилового эфира и перемешивания в течение 15 мин смесь фильтровали через подушку из целита. Эту подушку промывали 3 порциями по 50 мл этилацетата. Объединенные фильтраты промывали 2 н. раствором бикарбоната калия,водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с получением 157 мг (62%) указанного в заголовке соединения. Пример 4. [1(R),3aR-(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро-1-1-метил-5-этил-5-[(триметилсилил)окси]-3-гептинил-7 а-метил-4 Н-инден-4-он. В раствор 223 мг (0,737 ммолей)[1(R),3aR-(3a,7a)]-3,3 а,5,6,7,7 а-гексагидро 1-(1-метил-5-этил-5-гидрокси-3-гептинил)-7 аметил-4-инден-4-она в 10 мл безводного метиленхлорида добавляли 0,67 мл (4,42 ммоля) 1 002772(триметилсилил)имидазола. Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Реакцию прекращали добавлением воды и экстрагировали гексаном. Гексановые экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 10:1, получая 272 мг (98%) указанного в заголовке соединения. 1[3S-(1Z,3,5)-[2-[3,5-бис(1,1-диметилэтил)диметилсилил]окси]-2-метиленциклогексилиден]этилдифенилфосфиноксида в 10 мл безводного тетрагидрофурана при -78 С добавляли 0,75 мл (1,2 ммоля) 1,6 М раствора нбутиллития в гексане. Реакционная смесь немедленно становилась красной, и эта окраска сохранялась во время добавления 270 мг (0,72 ммоля)[1(R),3aR(3 а,7 а)]-3,3 а,5,6,7,7 агексагидро-1-(1-метил-5-этил-5-[(триметилсилил)окси]-3-гептинил)-7 а-метил-4 Н-инден-4 она в 8 мл безводного тетрагидрофурана. Реакционную смесь перемешивали при -78 С в течение 90 мин, а затем реакцию прекращали добавлением рассола и смесь экстрагировали этилацетатом. Объединенные экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой промежуточный продукт очищали экспресс-хроматографией смесью гексана с этилацетатом в соотношении 40:1, получая 498 мг трисилилированного промежуточного продукта. В раствор 498 мг трисилилированного промежуточного продукта в 10 мг безводного тетрагидрофурана добавляли 5,04 мл (5,04 ммоля) 1 М тетрабутиламмонийфторида. Реакционную смесь перемешивали при комнатной температуре в токе аргона в течение 48 ч, а затем разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 1:3 и препаративной жидкостной хроматографией высокого разрешения (ЖХВР) с использованием смеси гексана с этилацетатом в соотношении 1:4, получая 267 мг (84,5%) указанного в заголовке соединения.[1(R),3 аR-(3 а,4,7 а)]3 а,4,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5 гидрокси-3 Е-гептенил)-7 а-метил-3 Н-инден-4-ол. В перемешиваемую суспензию 190 мг (5 ммолей) алюмогидрида лития в 15 мл безводного тетрагидрофурана, охлажденного в ледяной бане, вначале осторожно добавляли 270 мг (5 ммолей) твердого метоксида натрия, а затем вводили 252 мг (0,852 ммоля) [1(R),3aR(3a,4,7a)]-3 а,4,5,6,7,7 а-гексагидро-1-(1 метил-5-этил-5-гидрокси-3-гептинил)-7 а-метил 3 Н-инден-4-ола и реакционную смесь кипятили с обратным холодильником в течение 24 ч. После охлаждения в ледяной бане реакцию прекращали осторожным добавлением 1 мл воды, а затем введением 1 мл 2 н. раствора NaOH. После добавления 20 мл диэтилового эфира смесь перемешивали в течение 0,5 ч, добавляли 2,2 гMgSO4 и перемешивали еще в течение 0,5 ч. Далее смесь фильтровали, промывали диэтиловым эфиром и объединенные эфирные фильтраты упаривали досуха. Сырой продукт очищали экспресс-хроматографией и препаративной ЖХВР с использованием смеси гексана с этилацетатом в соотношении 2:1, получая 133 мгH-ЯМР (CDCl3):0,84 (t, 6H, J = 7,5 Гц,2 СН 3), 0,99 (d, 3H, J = 6 Гц, СН 3), 1,03 (s, 3H,СН 3), 1,51 (q, 4H, J = 7,5 Гц, 2 СH2), 4,17 (широк.s, 1 Н, СH), 5,32 (широк.s, 1 Н, СН), 5,38 (d. 1H, Jtrans = 16,5 Гц, СН), 5,52 (dt, 1H, Jvic 6,5 Гц, Jtrans = 16,5 Гц, СН). Пример 7. [1(R),3aR-(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5-гидрокси 3 Е-гептенил)-7 а-метил-4 Н-инден-4-он. К 133 г (0,434 ммоля) [1(R),3aR(3a,4,7a)]-3a,4,5,6,7,7a-гексагидро-1-(1 метил-5-этил-5-гидрокси-3 Е-гептенил)-7 аметил-3 Н-инден-4-ола, перемешиваемого при комнатной температуре в атмосфере аргона в 4 мл безводного метиленхлорида, добавляли 950 мг (2,527 ммоля) пиридинийдихромата. Реакционную смесь перемешивали в течение 5 ч. Затем добавляли 25 мл диэтилового эфира и перемешивали в течение 15 мин, фильтровали через подушку из целита и эту подушку промывали 3 порциями по 40 мл этилацетата. Объединенные фильтраты упаривали досуха. Сырой продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 5:3, получая 111 мг (84%) указанного в заголовке соединения. Пример 8.[1(R),3aR-(3a,7a)]-3,3 а,5,6,7,7 а-гексагидро 1-(1-метил-5-этил-5-гидрокси-3 Е-гептенил)-7 аметил-4-инден-4-она в 4 мл безводного метиленхлорида добавляли 0,375 мл (2,56 ммоля) 1(триметилсилил)имидазола. Реакционную смесь перемешивали в атмосфере аргона в течение 23 ч. Затем реакцию прекращали добавлением 10 мл воды, перемешивали в течение 15 мин, добавляли 20 мл рассола и экстрагировали 3 порциями по 90 мл этилацетата. Органические слои пять раз промывали смесью воды и рассола в соотношении 1:1, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 10:1, получая 131 мг (95%) указанного в заголовке соединения. Пример 9. 1,25-дигидрокси-16,23 Е-диен 26,27-бисгомохолекальциферол. В перемешиваемый раствор 405 мг (0,695 ммоля) [3S-(1Z,3,5)]-[2-[3,5-бис(1,1-диметилэтил)диметилсилил]окси]-2-метиленциклогексилиден]этилдифенилфосфиноксида в 5 мл безводного тетрагидрофурана при -78 С по каплям в атмосфере аргона добавляли 0,434 мл(0,694 ммоля) 1,6 М раствора н-бутиллития в гексане. После перемешивания в течение 5 мин в полученный таким образом красный раствор по каплям в течение 10 мин добавляли раствор 131 мг (0,348 ммоля) [1(R),3aR(3a,7a)]3,3 а,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5[(триметилсилил)окси]-3 Е-гептенил)-7 а-метил 4 Н-инден-4-она в 4 мл безводного тетрагидрофурана. Далее реакционную смесь перемешивали при -78 С в течение 2 ч. Реакцию прекращали добавлением 10 мл 2 н. раствора сегнетовой соли и смесь нагревали до комнатной температуры, а затем экстрагировали 3 порциями по 90 мл этилацетата. Объединенные экстракты три раза промывали рассолом, сушили над сульфатом натрия и упаривали досуха. Остаток очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 30:1, получая 220 мг трисилилированного промежуточного продукта. В раствор 220 мг трисилилированного промежуточного продукта в 3 мл безводного тетрагидрофурана добавляли 3,2 мл (3,2 ммоля) 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране и эту реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 19 ч. Затем добавляли 5 мл воды, перемешивали в течение 15 мин, разбавляли 20 мл рассола и экстрагировали 3 порциями по 90 мл этилацетата. Объединенные экстракты промывали смесью воды и рассола в соотношении 1:1, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали 13 экспресс-хроматографией и препаративной ЖХВР с использованием смеси гексана с этилацетатом в соотношении 1:5, получая 126 мг(82%) указанного в заголовке кристаллического соединения. tпл: 133-135 С (после перекристаллизации из смеси тетрагидрофурана с метилформиатом в соотношении 4:6).(АВ; 2H, J = 11,5 Гц, СН СН); данные элементного анализа: рассчитано для C29H44O3: С 79,04, Н 10,06; обнаружено: С 78,78, Н 10,21. Пример 10. [1(R),3 аR-(3 а,4,7 а)]3 а,4,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5 гидрокси-3Z-гептенил)-7 а-метил-3 Н-инден-4-ол. Смесь 215 мг (0,71 ммоля) [1(R),3aR(3a,4,7a)]-3 а,4,5,6,7,7 а-гексагидро-1-(1 метил-5-этил-5-гидрокси-3-гептинил)-7 а-метил 3-инден-4-ола, 5 мл этилацетата, 12,5 мл гексана, 0,35 мл абсолютного этанола, 0,0175 мл хинолина и 35 мг катализатора Линдлара при комнатной температуре и под нормальным давлением гидрогенизовали в течение 1,5 ч. Реакционную смесь фильтровали через подушку из целита и эту подушку промывали этилацетатом. Объединенные фильтраты промывали 1 н. раствором НСl, водой, 2 н. раствором бикарбоната калия, водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали препаративной ЖХВР (в колонкеH-ЯМР (CDCl3):0,90 (t, 6H, J = 7,5 Гц,2 СН 3), 1,01 (d, 3H, J = 6,5 Гц, СН 3), 1,05 (s, 3H,СН 3), 1,57 (q, 4H, J = 7,5 Гц, 2CH2), 4,17 (широк.s, 1 Н, СН), 5,22 (широк.dt, 1H, Jvic = 1,5 Гц,Jcis = 12 Гц, СН), 5,38 (dt, 1H, Jvic = 7 Гц, Jcis = 12 Гц, СН). Пример 11. [1(R),3aR-(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро-1-(1-метил-5-этил-5 гидрокси-3Z-гептенил)-7 а-метил-4 Н-инден-4 он. В перемешиваемый раствор 200 мг (0,652 ммоля) [1(R),3aR-(3 а,4,7 а)]-3 а,4,5,6,7,7 агексагидро-1-(1-метил-5-этил-5-гидрокси-3Zгептенил)-7 а-метил-3 Н-инден-4-ола в 10 мл безводного метиленхлорида при комнатной температуре в атмосфере аргона добавляли 1,286 г(3,301 ммоля) пиридинийдихромата. Реакционную смесь перемешивали в течение 6 ч. Добавляли 25 мл диэтилового эфира и перемешивали 14 в течение 15 мин, фильтровали через подушку из целита и эту подушку промывали 3 порциями по 25 мл этилацетата. Объединенные фильтраты упаривали досуха. Сырой продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 3:1, получая 182 мг (91,5%) указанного в заголовке соединения. 1[1(R),3aR-(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро 1-(1-метил-5-этил-5-гидрокси-3Z-гептенил)-7 аметил-4 Н-инден-4-она в 10 мл безводного метиленхлорида добавляли 0,542 мл (3,58 ммоля) 1(триметилсилил)имидазола. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Далее реакционную смесь разбавляли гексаном, промывали водой и рассолом,сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали экспрессхроматографией с использованием смеси гексана с этилацетатом в соотношении 10:1, получая 218 мг (97%) указанного в заголовке соединения. 1= 11,5 Гц, СН), 5,25 (dt, 1H, Jvic = 6,5 Гц, Jcis = 11,5 Гц, СН), 5,31 (широк.s, 1H, СН). Пример 13. 1,25 -дигидрокси-16,23Z-диен 26,27-бисгомохолекальциферол. В перемешиваемый раствор 578 мг (0,992 ммоля) [3S-(1Z,3,5)]-[2-[3,5-бис(1,1-диметилэтил)диметилсилил]окси]-2-метиленциклогексилиден]этилдифенилфосфиноксида в 8 мл безводного тетрагидрофурана при -78 С по каплям в атмосфере аргона добавляли 0,62 мл(0,992 ммоля) 1,6 М раствора н-бутиллития в гексане. Реакционная смесь становилась красной, и эта окраска сохранялась во время добавления 218 мг (0,578 ммоля) [1(R),3aR(3 а,7 а)]-3,3 а,5,6,7,7 а-гексагидро-1-(1-метил-5 этил-5-[(триметилсилил)окси]-3Z-гептенил)-7 аметил-4 Н-инден-4-она в 8 мл безводного тетрагидрофурана. Реакционную смесь перемешивали при -78 С в течение 2 ч, а затем реакцию прекращали добавлением воды и тщательно экстрагировали этилацетатом. Объединенные экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. 15 Сырой промежуточный продукт очищали экспресс-хроматографией с использованием смеси гексана с этилацетатом в соотношении 20:1,получая 328 мг трисилилированного промежуточного продукта. В раствор 328 мг трисилилированного промежуточного продукта в 10 мл безводного тетрагидрофурана добавляли 4 мл (4 ммоля) 1 М раствора тетрабутиламмонийфторида в тетрагидрофуране и эту реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем смесь разбавляли водой и экстрагировали этилацетатом. Объединенные экстракты промывали водой и рассолом, сушили над сульфатом натрия и упаривали досуха. Сырой продукт очищали препаративной ЖХВР (в колонкеYMC) с использованием смеси гексана с этилацетатом в соотношении 1:4, получая в виде белой пены 191 мг (75%) указанного в заголовке соединения.(CDCl3):0,7 (s, 3H, СН 3), 0,9 (t, 6H, J = 7,3 Гц,2 СН 3), 1,05 (d, 3H, J = 6,8 Гц, СН 3), 1,57 (m, 4H,2 СН 2), 1,91 (ddd, 1H, Jvic 3,5 и 8,5 Гц, Jgem = 12,5 Гц, СН у СН 2), 2,48 (m, 2H, СН 2), 2,61 (широк.d, 1H, Jgem = 12,5 Гц, СН у СН 2), 2,82 (широк.m, 1H, СН у СН 2), 4,24 (широк.m, 1H, СН),4,45 (широк.m, 1H, СН), 5,02, 5,34 (2s, 2H, СН 2),5,23 (d, 1H, Jcis = 12,3 Гц, СН), 5,35 (s, 1H, СН),5,37 (dt, 1H, Jvic = 7 Гц, Jcis = 12,3 Гц, СН), 6,11,6,38 (АВ; 2H, J = 11,3 Гц, СН СН). Пример А. Дозированный препарат для перорального применения в форме мягкой желатиновой капсулы. мг/капсулу Соединение В 0,0005-0,050 Бутилированный гидрокситолуол (БГТ) 0,016 Бутилированный гидроксианизол (БГА) 0,016Myglyol-812 в количестве, достаточном до 160 Пример Б. Дозированный препарат для перорального применения в форме мягкой желатиновой капсулы. мг/капсулу Соединение В 0,0005-0,050 0,016 1. БГТ и БГА (в примере А) или токоферол (в примере Б) суспендируют в продукте Myglyol-812. Подогревают до примерно 50 С и перемешивают до растворения. 2. Соединение В растворяют в растворе со стадии 1. 3. Раствором со стадии 2 наполняют колпачок мягкой желатиновой капсулы. Все стадии осуществляют в атмосфере азота с защитой от света. где А обозначает углерод-углеродную двойную связь, характеризующуюся стереохимической Е- или Z-конфигурацией, или А обозначает углерод-углеродную тройную связь, Et обозначает этил, R обозначает гидроксил, a R1 обозначает водород или = СН 2 либо R обозначает водород или фтор, а R1 обозначает =СН 2. 2. Соединение по п.1, в котором А обозначает углерод-углеродную двойную связь с Еконфигурацией, в частности, в котором R обозначает гидроксил, прежде всего в котором R1 обозначает =СН 2, предпочтительно 1,25 дигидрокси-16,23 Е-диен-26,27-бисгомохолекальциферол. 3. Соединение по п.1, в котором А обозначает углерод-углеродную двойную связь с Zконфигурацией, в частности, в котором R обозначает гидроксил, прежде всего в котором R1 обозначает =СН 2, предпочтительно 1,25 дигидрокси-16,23Z-диен-26,27-бисгомохолекальциферол. 4. Соединение по п.1, в котором А обозначает углерод-углеродную тройную связь, в частности, в котором R обозначает гидроксил,прежде всего, в котором R1 обозначает =СН 2,предпочтительно 1,25-дигидрокси-16-ен-23-ин 26,27-бисгомохолекальциферол. 5. Соединение по п.1, представляющее собой 1-фтор-25-гидрокси-16,23 Е-диен-26,27 бисгомохолекальциферол. 6. Соединение формулы II 10. Фармацевтическая композиция, в частности, для лечения опухолевых заболеваний,таких как лейкоз, включающая эффективное 18 количество одного, двух или большего числа соединений формулы I по п.1, 2, 3, 4 или 5 и инертный наполнитель. 11. Применение соединений по п.1, 2, 3, 4 или 5 при приготовлении лекарственного средства для лечения неопластических заболеваний,таких как лейкоз.
МПК / Метки
МПК: A61P 35/02, A61K 31/59, C07C 401/00
Метки: 25-гидрокси-16-ен-26,27-бисгомохолекальциферолы
Код ссылки
<a href="https://eas.patents.su/10-2772-25-gidroksi-16-en-2627-bisgomoholekalciferoly.html" rel="bookmark" title="База патентов Евразийского Союза">25-гидрокси-16-ен-26,27-бисгомохолекальциферолы</a>












