Терапевтическое применение конъюгатов интерферон-пэг
Формула / Реферат
1. Способ лечения заболевания, включающий введение субъекту, нуждающемуся в этом, эффективного количества конъюгата с чистотой 70% и более, имеющего по меньшей мере один фрагмент полиэтиленгликоля, белковый фрагмент, представляющий собой фрагмент интерферона-α, и линкер, в котором по меньшей мере один фрагмент полиэтиленгликоля соединен с линкером и атом азота N-конца фрагмента интерферона-α соединен с линкером, где линкер представляет собой связь, C1-10алкилен, C2-10алкенилен или C2-10алкинилен, а заболевание является идиопатическим миелофиброзом, истинной полицитемией и идиопатической тромбоцитемией.
2. Способ по п.1, в котором фрагмент фрагмента интерферона-α является модифицированным фрагментом интерферона-α2b и содержит 1-4 дополнительных аминокислотных остатка на N-конце.
3. Способ по п.1, где заболевание представляет собой идиопатический миелофиброз.
4. Способ по п.1, где заболевание представляет собой истинную полицитемию.
5. Способ по п.1, где заболевание представляет собой идиопатическую тромбоцитемию.
6. Способ лечения заболевания, включающий введение субъекту, нуждающемуся в этом, эффективного количества конъюгата формулы I
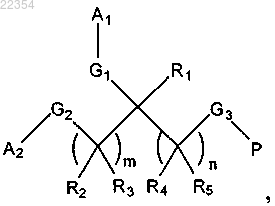
в которой каждый R1, R2, R3, R4 и R5 независимо представляет собой Н, C1-5алкил, C2-5алкенил, C2-5алкинил, арил, выбранный из фенила, нафтила и пиренила, гетероарил, выбранный из фурила, пирролила, тиенила, оксазолила, имидазолила, тиазолила, пиридинила, пиримидинила, хиназолинила и индолила, C3-8циклоалкил или C3-8гетероциклоалкил;
каждый A1 и A2 независимо представляет собой полиэтиленгликоль;
каждый G1, G2 и G3 независимо представляет собой связь или соединяющую функциональную группу;
Р представляет собой фрагмент интерферона-α;
m является 0 или целым числом 1-10;
n является целым числом 1-10,
где заболевание является идиопатическим миелофиброзом, истинной полицитемией и идиопатической тромбоцитемией.
7. Способ по п.6, согласно которому G3 представляет собой связь, а Р представляет собой фрагмент интерферона-α, в котором аминогруппа на N-конце соединяется с G3.
8. Способ по п.7, согласно которому каждый A1 и A2 представляет собой фрагмент mPEG, имеющий молекулярную массу 10-30 кДа.
9. Способ по п.8, согласно которому каждый G1 и G2 представляет собой
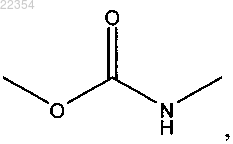
где О соединяется с A1 или А2, a NH соединяется с атомом углерода, как показано в формуле I.
10. Способ по п.9, согласно которому Р представляет собой модифицированный фрагмент интерферона, содержащий 1-4 дополнительных аминокислотных остатка на N-конце.
11. Способ по п.10, согласно которому n представляет собой 2.
12. Способ по п.11, согласно которому конъюгат представляет собой

в котором mPEG имеет молекулярную массу 20 кДа;
IFN представляет собой фрагмент интерферона-α2b.
13. Способ по п.6, где заболевание представляет собой идиопатический миелофиброз.
14. Способ по п.6, где заболевание представляет собой истинную полицитемию.
15. Способ по п.6, где заболевание представляет собой идиопатическую тромбоцитемию.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ 2010.12.09 ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТОВ ИНТЕРФЕРОН-ПЭГ Изобретение имеет отношение к применению конъюгатов интерферона с полимером, описанных в подробном описании, для лечения идиопатического миелофиброза, истинной полицитемии и идиопатической тромбоцитемии. Примечание: библиография отражает состояние при переиздании Уровень техники Успехи клеточной биологии и методов рекомбинантных белков влекут за собой развитие белковых терапевтических средств. Тем не менее, все еще существуют значительные препятствия. Большинство белков являются чувствительными к протеолитической деградации и поэтому имеют короткий период полужизни в системе циркуляции. Другие недостатки включают низкую водорастворимость и стимулирование нейтрализующих антител. Присоединение полимера, например полиэтиленгликоля (PEG), к белку препятствует доступу протеолитических ферментов к белковому остову, что приводит к увеличению стабильности белка. Кроме того, это улучшает водорастворимость и сводит к минимуму иммуногенность. Имеется необходимость в эффективных методах присоединения полимера к белку. В документе US2006/0166932 описаны иммуномодулирующие соединения для лечения миелопролиферативных заболеваний типа первичной тромбоцитемии. Предпочтительно используемыми соединениями являются малые органические молекулы, но не белки или пептиды. Эти соединения могут быть скомбинированы с дополнительными активными агентами, предпочтительно для подавления сверхпродукции гемопоэтических стволовых клеток или для уменьшения проявления одного или нескольких симптомов МПЗ. В документе WO 2009/023826 описаны различные конъюгаты интерферона альфа-2b с полимерами. Раскрытие изобретения Один аспект данного изобретения имеет отношение к применению конъюгата интерферона с полимером для лечения различных заболеваний. Конъюгат содержит по меньшей мере один полимерный фрагмент, фрагмент интерферона- и линкер. Общая молекулярная масса конъюгата составляет 2-200 кДа (предпочтительно 40 кДа), а число полимерных фрагментов в конъюгате составляет не более чем 10. Полимерный фрагмент или фрагменты прикрепляются к линкеру; атом азота N-конца фрагмента интерферона- соединяется с линкером; а линкер представляет собой ковалентную связь, C1-10 алкилен,C2-10 алкенилен или C2-10 алкинилен. Данный конъюгат имеет чистоту более чем 70, 80 или 90%. Заболеваниями, которые можно лечить с помощью конъюгата, являются идиопатический миелофиброз, истинная полицитемия и идиопатическая тромбоцитемия. Другой аспект настоящего изобретения имеет отношение к применению конъюгата интерферона с полимером формулы I, представленной ниже, для лечения перечисленных выше заболеваний: Формула I в которой каждый R1, R2, R3, R4 и R5 независимо представляет собой Н, C1-5 алкил, C2-5 алкенил,C2-5 алкинил, арил, гетероарил, C3-8 циклоалкил или C3-8 гетероциклоалкил; каждый A1 и A2 независимо представляет собой полимерный фрагмент; каждый G1, G2 и G3 независимо представляет собой химическую связь или линкерную функциональную группу; Р представляет собой фрагмент интерферона-;m представляет собой 0 или целое число 1-10;n представляет собой целое число 1-10. В отношении вышеприведенной формулы конъюгат интерферона с полимером может иметь одну или более из следующих особенностей: G3 представляет собой химическую связь, а Р представляет собой фрагмент интерферона-, в котором аминогруппа на N-конце соединяется с G3; A1 и A2 представляют собой полиалкиленоксидные фрагменты, имеющие молекулярную массу 2-100 кДа (предпочтительно 10-30 кДА), каждый G1 и G2 представляют собойNH присоединяется к атому углерода, как показано в формуле I) или каждый G1 и G2 представляет собой мочевину, сульфонамид или амид (в котором N присоединяется к атому углерода, как показано в формуле I); m представляет собой 4; n представляет собой 2; каждый R1, R2, R3, R4 и R5 является H; а Р представляет собой модифицированный фрагмент интерферона-, содержащий 1-4 дополнительных аминокислотных остатка. Термин "алкил" относится к одновалентному углеводородному радикалу с прямой или разветвленной цепью. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, трет-бутил и н-пентил. Аналогично, термин "алкенил" или "алкинил" относится к одновалентному углеводородному радикалу с прямой или разветвленной цепью, содержащему одну или более двойных связей C=C или одну или более тройных связей CC. Термин "алкилен" относится к двухвалентному радикалу с прямой или разветвленной цепью. Аналогично, термин "алкенилен" или "алкинилен" относится к двухвалентному углеводородному радикалу с прямой или разветвленной цепью, содержащему одну или более двойных связей C=C или одну или более тройных связей CC. Термин "арил" относится к системе углеводородных колец (моноциклической или бициклической),имеющей по меньшей мере одно ароматическое кольцо. Примеры арильных фрагментов включают, но не ограничиваются этим, фенил, нафтил и пиренил. Термин "гетероарил" относится к системе углеводородных колец (моноциклической или бициклической), имеющей по меньшей мере одно ароматическое кольцо, содержащее по меньшей мере один гетероатом, такой как O, N или S, как часть кольцевой системы, а остальные атомы в кольце являются углеродом. Примеры гетероарильных фрагментов включают, но не ограничиваются этим, фурил, пирролил, тиенил, оксазолил, имидазолил, тиазолил, пиридинил, пиримидинил, хиназолинил и индолил. Термин "циклоалкил" относится к частично или полностью насыщенной моноциклической или бициклической кольцевой системе, имеющей в кольце только атомы углерода. Примеры включают, но не ограничиваются этим, циклопропанил, циклопентанил и циклогеканил. Термин "гетероциклоалкил" относится к частично или полностью насыщенной моноциклической или бициклической кольцевой системе, имеющей в дополнение к углероду один или более гетероатомов(например, O, N или S), в качестве кольцевых атомов. Примеры включают, но не ограничиваются этим,пиперидин, пиперазин, морфолин, тиоморфолин и 1,4-оксазепан. Упомянутые в описании алкил, алкенил, алкинил, арил, гетероарил, циклоалкил и гетероциклоалкил включают и замещенные и незамещенные фрагменты. Примеры заместителей включаютC2-C10-алкенил,C2-C10-алкинил,C3-C8-циклоалкил,C5-C8-циклоалкенил,C1-C10-алкил,C1-C10-алкоксигруппу, арил, арилоксигруппу, гетероарил, гетероарилоксигруппу, аминогруппу,C1-C10-алкиламиногруппу, C1-C20-диалкиламиногруппу, ариламиногруппу, диариламиногруппу, гидроксиаминогруппу, алкоксиаминогруппу, C1-C10-алкилсульфонамид, арилсульфонамид, гидроксигруппу,галоген, тиогруппу, C1-C10-алкилтиогруппу, арилтиогруппу, цианогруппу, нитрогруппу, ацил, ацилоксигруппу, карбоксил и сложный эфир карбоновой кислоты. Термин "фрагмент полиалкиленоксида" относится к одновалентному радикалу, полученному от линейного, разветвленного или звездообразного полиалкиленоксида. Молекулярная масса фрагмента полиалкиленоксида может составлять 2-100 кДа. Фрагмент полиалкиленоксида является насыщенным или ненасыщенным. Примеры фрагмента полиалкиленоксида включают, но не ограничиваются этим, полиэтиленоксид, полиэтиленгликоль, полиизопропиленоксид, полибутиленоксид и их сополимеры. Также могут использоваться другие полимеры, такие как декстран, поливиниловые спирты, полиакриламиды или полимеры на углеводной основе, чтобы заменить полиалкиленоксидный фрагмент, при условии, что они не являются аллергенными, токсичными или вызывающими иммунный ответ. Полиалкиленоксидный фрагмент является замещенным или незамещенным. Например, он может быть метоксиполиэтиленгликолем (mPEG). Термин "фрагмент интерферона-" относится к одновалентному радикалу, полученному от любого интерферона-. "Интерферон-" относится к семейству высокогомологичных видоспецифических белков, ингибирующих репликацию вирусов и клеточную пролиферацию и модулирующих иммунный ответ. См. Bonnem et al., J. Biol. Response Mod., 1984, 3(6):580-598 и Finter, J. Hepatol., 1986, 3 Suppl 2:S157160. Он может находиться в природной или модифицированной форме. Модифицированный интерферон- может быть, например, белком, содержащим интерферон- и 1-4 дополнительных аминокислотных остатков на N-конце интерферона. Примером такого модифицированного интерферона является, IFN представляет фрагмент интерферона-2b, аминогруппа которого на N-конце соединяется с карбонильной группой. Многие типы интерферонов- являются коммерчески доступными, включая интерферон Интрон-А, предоставляемый компанией Schering Corporation, Kenilworth, N.J., интерферон Роферон, предоставляемый компанией Hoffmann-La Roche, Nutley, N.J., Берофор интерферон альфа 2, предоставляемый компанией Boehringer Ingelheim Pharmaceutical, Inc., Ridgefield, Conn., Сумиферон, предоставляемый компанией Sumitomo, Japan, и Велферон интерферон альфа-n1 (INS), предоставляемый компанией Glaxo-Wellcome Ltd., London, Great Britain. Ниже перечислены аминокислотные последовательности пяти типичных человеческих белковинтерферонов- или в форме предшественника, или в зрелой форме: В одном примере белок интерферон-, использованный для получения конъюгата этого изобретения, имеет аминокислотную последовательность, по меньшей мере на 80% (например, 85, 90, 95 или 99%) идентичную одной из перечисленных выше аминокислотных последовательностей, или ее фрагменту, соответствующему зрелому интерферону альфа."Процент идентичности" двух аминокислотных последовательностей определяется с помощью алгоритма Karlin and Altschul Proc. Natl. Acad. Sci. USA, 87:2264-68, 1990, модифицированного, как указано в Karlin and Altschul Proc. Natl. Acad. Sci. USA, 90:5873-77, 1993. Такой алгоритм встраивается в программы NBLAST и XBLAST (версия 2.0) Altschul, et al. J. Mol. Biol. 215:403-10, 1990. Поиск белковBLAST может быть осуществлен с использованием программы XBLAST оценка=50 длина слова=3 для получения аминокислотных последовательностей, гомологичных белковым молекулам изобретения. Когда между двумя последовательностями существуют расхождения, можно использовать Gapped BLAST,как описано в Altschul et al., Nucleic Acids Res. 25(17):3389-3402, 1997. При применении программBLAST и Gapped BLAST могут использоваться параметры по умолчанию соответствующих программ(например, XBLAST и NBLAST). Термин "соединяющая функциональная группа" относится к двухвалентной функциональной группе, соединенной одним концом с фрагментом полимера, а другим концом с фрагментом белка. Примеры включают, но не ограничиваются этим, -O-, -S-, эфир карбоновой кислоты, карбоил, карбонат, амид, карбамат, мочевину, сульфонил, сульфинил, аминогруппу, иминогруппу, гидроксиаминогруппу, фосфонат или фосфатную группу. Описанный выше конъюгат интерферона с полимером может находиться в свободной форме или в форме соли, если необходимо. Соль, например, может быть образована между анионом и положительно заряженной группой (например, аминогруппой) на конъюгате интерферон-полимер этого изобретения. Подходящие анионы включают хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат и ацетат. Аналогично этому, соль также может быть образована между катионом и отрицательно заряженной группой (например, карбоксилатом) на конъюгате интерферон-полимер этого изобретения. Подходящие катионы включают ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Кроме того, конъюгат интерферон-полимер может иметь одну или более двойных связей или один или более центров асимметрии. Такой конъюгат может встречаться в виде рацематов, рацемических смесей, отдельных энантиомеров, одиночных диастереомеров, смесей диастереомеров и цис- или транс-3 022354 изомерных форм с Е- или Z-двойной связью. Пример конъюгата интерферона с полимером этого изобретения показан ниже: в котором mPEG имеет молекулярную массу 20 кДа;IFN представляет собой фрагмент интерферона-2b. Кроме того, в рамках данного изобретения находится применение конъюгата для производства медикамента для лечения одного из упомянутых выше заболеваний. Подробности одного или более вариантов осуществления изобретения изложены в описании ниже. Другие признаки, цели и преимущества изобретения станут понятны из описания и пунктов формулы изобретения. Подробное описание Конъюгаты интерферона с полимером, применяемые с целью осуществления на практике настоящего изобретения, можно получить синтетическими методами, хорошо известными в области химии,например, методами, описанными в US 12/192,485. Схема 1 показывает пример получения конъюгатов интерферона с полимером данного изобретения. Диаминовое соединение 1, содержащее ацетальную группу, взаимодействует с N-гидроксисукцинимидил карбонатом mPEG (т.е., соединение 2) с образованием ди-пегилированного соединения 3, которое позже преобразовывается в альдегид 4. Этот альдегид взаимодействует с белком, имеющим свободную аминогруппу, путем восстановительного алкилирования с получением конъюгата интерферон-полимер данного изобретения. Схема 1 Синтезированный таким образом конъюгат интерферон-полимер может быть дополнительно очищен, например, с помощью ионообменной хроматографии, гельфильтрационной хроматографии, электрофореза, диализа, ультрафильтрации или ультрацентрифугирования. Описанные выше химические реакции включают использование растворителей, реактивов, катализаторов, защитных групп и реагентов, снимающих защиту, и определенные условия реакции. Они могут включать дополнительные стадии (или до или после специально описанных здесь стадий), предназначенные для добавления или удаления подходящих защитных групп, в конечном счете, с целью создания возможности для синтеза конъюгата интерферон-полимер. Кроме того, различные стадии синтеза могут проводиться в переменной последовательности или порядке, чтобы получить желаемые конъюгаты интерферона с полимером. Синтетические химические преобразования и методы применения защитных групп (защита и снятие защиты), используемые в синтезе соответствующих конъюгатов интерферонполимер, известны в данной области техники и включают, например, методы, описанные в R. Larock,Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Конъюгат изобретения может иметь очень высокую чистоту. А именно, 70, 80 или 90% молекул конъюгата являются идентичными во всех аспектах, включая последовательность фрагмента интерферона и его место связывания с полимерным фрагментом. Конъюгат этого изобретения может быть фармацевтически активным в форме конъюгата. Альтернативно, он может высвобождать фармацевтически активный интерферон- in vivo (например, посредством гидролиза) при ферментативном расщеплении связи между белковым фрагментом и полимерным фрагментом. Примеры ферментов, участвующих в расщеплении связей in vivo, включают окислительные ферменты (например, пероксидазы, аминоксидазы или дегидрогеназы), восстановительные ферменты(например, кеторедуктазы) и гидролитические ферменты (например, протеазы, эстеразы, сульфатазы и фосфатазы). Конъюгат этого изобретения можно использовать для лечения идиопатического миелофиброза, истинной полицитемии и идиопатической тромбоцитемии. Он имеет неожиданно длительный период полужизни, уменьшенную лечебную дозу и/или продолжительный интервал дозирования. При использовании в описании термин "лечение" определяется как применение или введение композиции, включающей конъюгат интерферон-полимер, субъекту (человеку или животному), у которого имеется нарушение, симптом нарушения или заболевание или нарушение на фоне заболевания или предрасположенность к заболеванию с целью улучшить состояние, вылечить, облегчить, ослабить или исправить нарушение, симптом нарушения или заболевание или нарушение на фоне заболевания или предрасположенность к заболеванию. "Эффективное количество" относится к количеству конъюгата интерферон-полимер, дающему терапевтический эффект у субъекта, которого лечат. Терапевтический эффект может быть объективным (т.е. может быть измерен с помощью некоторых тестов или маркеров) или субъективным (т.е. у субъекта появляются признаки эффекта или пациент чувствует эффект). Кроме того, в рамках данного изобретения находится фармацевтическая композиция, содержащая эффективное количество по меньшей мере одного из конъюгатов интерферон-полимер, описанных выше,и фармацевтически приемлемый носитель. Кроме того, данное изобретение включает способ введения эффективного количества одного или более из конъюгатов интерферона с полимером пациенту, имеющему одно или более заболеваний. Как установлено специалистами в данной области техники, эффективные дозы будут варьировать, например, в зависимости от скорости гидролиза конъюгата интерферонполимер, типов заболеваний, которые нужно лечить, способа введения, использования вспомогательных веществ (инертных наполнителей) и возможности совместного применения с другим терапевтическим воздействием. Для применения на практике способа настоящего изобретения композиция, содержащая одно или более из вышеупомянутых соединений, может быть введена парентерально, перорально, назально, ректально, местно или трансбуккально. Термин "парентерально" при использовании в описании относится к подкожному, внутрикожному, внутривенному, внутримышечному, внутрисуставному, внутриартериальному, внутригрудинному, подоболочечному, внутриочаговому (введению внутрь пораженных тканей),внутрибрюшинному, внутритрахеальному или внутричерепному введению, а также к любому подходящему методу вливания. Стерильная инъецируемая композиция может представлять собой раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, таким как раствор в 1,3-бутандиоле. К числу приемлемых носителей и растворителей, которые могут использоваться, относятся маннитол, вода,раствор Рингера и изотонический раствор хлорида натрия. В дополнение к этому в качестве растворителя или суспендирующей среды обычно используют нелетучие масла (например, синтетические моно- и диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются пригодными для приготовления инъекционных препаратов, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать разбавитель на основе спирта с длинной цепью или диспергирующее вещество, или карбоксиметилцеллюлозу или подобные диспергирующие вещества. При приготовлении лекарственных форм также можно использовать обычно применяемые поверхностно-активные вещества, такие как твины, спаны или другие подобные эмульгаторы или вещества, повышающие биодоступность, которые обычно используются в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм. Композиция для перорального введения может быть любой приемлемой для перорального введения лекарственной формой, включая капсулы, таблетки, эмульсии, водные суспензии, дисперсии и растворы. В случае таблеток носители, которые обычно используют, включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие вещества, такие как стеарат магния. Для перорального введения в виде капсул пригодные разбавители включают лактозу и сухой кукурузный крахмал. В том случае, когда для перорального применения требуются водные суспензии или эмульсии, активный ингредиент можно суспендировать или растворить в масляной фазе в сочетании с эмульгаторами или суспендирующими агентами. Если желательно, то также можно добавить определенные подсластители, вкусовые вещества или красители. Назальный аэрозоль или композицию для ингаляции можно приготовить с использованием способов, хорошо известных в области приготовления фармацевтических препаратов. Например, такие композиции можно приготовить в виде раствора в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, веществ, способствующих всасыванию для повышения биодоступности, фторуглеродов и/или других обычных солюбилизирующих или диспергирующих агентов, известных в данной области техники. Композиция, содержащая одно или более из перечисленных выше соединений, также может быть введена в виде суппозиториев для ректального применения. Вместе с одним или более упомянутыми выше активными соединениями обычно используется фармацевтически приемлемый носитель. Носитель в фармацевтической композиции должен быть "приемлемым" в том смысле, что он является совместимым с активным ингредиентом композиции (и предпочтительно, в состоянии стабилизировать активный ингредиент) и не является вредным для субъекта,которого лечат. В качестве фармацевтических вспомогательных веществ (эксципиентов) для доставки вышеупомянутого соединения можно использовать один или более солюбилизирующих агентов. Примеры других носителей включают коллоидную двуокись кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и DC Yellow 10. Для предварительной оценки описанных выше конъюгатов при лечении различных заболеваний могут использоваться подходящие методы исследования. Например, можно оценить эффективность конъюгата при лечении истинной полицитемии и идиопатической тромбоцитемии, следуя способам,описанным в Kiladjian et al., Blood, 2008; 112(8):3065-72 and Langer et al., Haetatologica, 2005; 90:13331338 соответственно. Представленные далее примеры следует рассматривать только как иллюстративные и не ограничивающие остальную часть раскрытия, каким бы то ни было образом. Предполагается, что специалист в данной области, исходя из представленного описания, может без дополнительных уточнений использовать настоящее изобретение в полном объеме. Все цитированные здесь публикации полностью включаются в описание путем отсылки. Получение ди-PEG альдегида. 20 кДа PEGO(C=O)OSu было получено из 20 кДа mPEGOH, купленного у (SunBio Inc., Калифорния, США), согласно способу, описанному в Bioconjugate Chem. 1993, 4, 568-569. Раствор 6-(1,3-диоксолан-2-ил)гексан-1,5-диамина в дихлорметане (11,97 г раствора, содержащего 9,03 мг диамина, 47,8 мкмоль) добавили в колбу с 20 кДа PEGO(C=O)OSu (1,72 г; 86,0 мкмоль). После того как PEGO(C=O)OSu полностью растворился, добавили N,N-диизопропилэтиламин (79 мкл,478 мкмоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч, а затем добавили по каплям метил-трет-бутиловый эфир (200 мл) при перемешивании. Получившийся осадок собрали и высушили под вакуумом с получением ди-PEG ацеталя (1,69 г; 98%) в виде белого твердого вещества. 1 Ди-PEG ацеталь (4,0 г; 0.2 ммоль) суспендировали в буфере pH 2,0 (лимонная кислота, 40 мл). Реакционную смесь перемешивали при 35C в течение 24 ч и затем экстрагировали дихлорметаном(350 мл). Объединенные органические слои высушивали над сульфатом магния, концентрировали, а затем вновь растворяли в дихлорметане (20 мл). Раствор добавили по каплям к метил-трет-бутиловому эфиру (400 мл) при перемешивании. Получившийся осадок собрали и высушили при пониженном давлении с получением ди-PEG альдегида (3,8 г; 95%) в виде белого твердого вещества. 1 Модифицированный рекомбинантный человеческий интерферон-2b клонировали с помощью метода ПЦР с использованием человеческой геномной ДНК в качестве матрицы. Олигонуклеотиды были синтезированы на основе фланкирующих последовательностей человеческого интерферона-2b (GenBank(Promega). IFN-вариант вновь амплифицировали с помощью ПЦР за счет использования клонов pGEM-T и потом субклонировали в вектор экспрессии белка рЕТ-24 а (Novagen), вектор, запускаемый промотором РНК-полимеразы Т 7, используя NdeI/BamHI в качестве сайтов клонирования. Затем вектор рЕТ-24 а был трансформирован в штамм Е.coli BL21-CodonPlus (DE 3)-RIL (Stratagene). Клоны с высокой экспрессией отобрали путем культивирования трансформированных Е.coli BL21-CodonPlus (DE 3)-RIL в присутствии карамицина (50 мкг/мл) и хлорамфеникола (50 мкг/мл). Бульонную питательную среду (BD, 200 мл) использовали для размножения BL21-CodonPlus(DE 3)-RIL с Pro-IFN геном в 1000 мл колбе. Колбу встряхивали при 37C и 230 об/мин в течение 16 ч. Периодическую ферментацию и периодическую ферментацию с добавлением субстрата проводили в 5-литровом сосуде для ферментации (Bioflo 3000; New Brunswick Scientific Co., Edison, NJ). Для периодической ферментации использовали 150 мл инокулума прекультуры и 3 л бульонной питательной среды с карамицином (50 мкг/мл), хлорамфениколом (50 мкг/мл), 0,4% глицерином и 0,5% (об./об.) микроэлементами (10 г/л FeSO47H2O; 2,25 г/л ZnSO47H2O; 1 г/л CuSO45H2O; 0,5 г/л MnSO4H2O; 0,3 г/л Н 3 ВО 3; 2 г/л CaCl22 Н 2 О; 0,1 г/л (NH4)6Mo7O24; 0,84 г/л EDTA, 50 мл/л HCl). Концентрацию растворенного кислорода обеспечивали на уровне 35% и поддерживали значение pH 7,2 путем добавления 5 н. водного раствора NaOH. Приготовили питательный раствор, содержащий 600 г/л глюкозы и 20 г/л MgSO47H2O. Когда значение pH поднималось до значения больше, чем заданное, добавляли соответствующий объем питательного раствора, чтобы увеличить концентрацию глюкозы в культуральной жидкости. Экспрессию генаPro-IFN индуцировали добавлением IPTG до окончательной концентрации 1 мМ, и собирали культуральную жидкость после инкубации в течение 3 ч. Собранный клеточный осадок ресуспендировали с буфером TEN (50 мМ Трис-HCl (pH 8,0), 1 мМ ЭДТА, 100 мМ NaCl) в приблизительном соотношении 1:10 (сухой вес г/мл) и разбивали с помощью микрофлюидайзера, а затем центрифугировали при 10000 об/мин в течение 20 мин. Осадок, содержащий тельца включения (IB), дважды промыли буфером TEN и центрифугировали, как описано выше. Затем осадок, содержащий IB, суспендировали в 150 мл 4 М водного раствора гуанидин-HCl (GuHCl) и центрифугировали при 20000 об/мин в течение 15 мин. Затем IB солюбилизировали в 50 мл 6 М раствораGuHCl. Солюбилизированный GuHCl материал центрифугировали при 20000 об/мин в течение 20 мин. Рефолдинг вызывали разбавлением денатурированных IB в 1,5 л свежеприготовленного буфера для рефолдинга (100 мМ Трис-HCl (pH 8,0), 0,5 М L-аргинин, 2 мМ ЭДТА), который перемешивали только во время добавления. Реакционную смесь для рефолдинга выдерживали в течение 48 ч без перемешивания. Подвергнутый рефолдингу рекомбинантный человеческий интерферон-2b (т.е. Pro-IFN) был диализирован против 20 мМ Трис-буфера (с 2 мМ ЭДТА и 0,1 М мочевиной, pH 7,0) с целью дополнительной очистки с помощью колоночной хроматографии на Q-Сефарозе. Подвергнутый рефолдингу рекомбинантный человеческий белок Pro-IFN загружали в колонку сQ-сефарозой (GE Amersham Pharmacia, Pittsburgh, PA). Колонка была предварительно уравновешена и промыта 20 мМ буфером Трис-HCl (pH 7,0). Продукт элюировали смесью 20 мМ буфера Трис-HCl(pH 7,0) и 200 мМ NaCl. Фракции, содержащие Pro-IFN, собирали, исходя из их оптической плотности при 280 нм. Концентрацию Pro-IFN определяли с помощью набора для анализа белков, используя метод Брэдфорда (Pierce, Rockford, IL). Получение конъюгата интерферона с полимером. К раствору полученного ранее ди-PEG альдегида (1,2 г; 0,03 ммоль) в воде (72 мл) добавили 2 М натрий-фосфатный буфер (pH 4,0; 5 мл) и Pro-IFN (200 мг в буфере 22,2 мл pH 7,0, содержащем 20 мМ Трис-HCl и 0,2 М NaCl, 0,01 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин, затем добавляли водный раствор натрий цианоборогидрида (400 мМ; 1,25 мл; 0,5 ммоль). Реакционную смесь перемешивали в темноте в течение 16 ч и очищали с помощью хроматографии на SP XL сефарозе. Фракции, содержащие желательный конъюгат интерферон-полимер, собирали, исходя из времени их удерживания и оптической плотности при 280 нм. Концентрацию конъюгата определяли с помощью набора для анализа белков, используя метод Брэдфорда (Pierce, Rockford, IL). Практический выход конъюгата составлял примерно 40% или выше. Другие варианты осуществления Все признаки, раскрытые в этом подробном описании, могут сочетаться в любой комбинации. Каждый признак, раскрытый в этом подробном описании, может быть заменен альтернативным признаком,служащим той же самой, равноценной или аналогичной цели. Таким образом, если недвусмысленным образом не установлено иное, каждый раскрытый признак является только примером характерного ряда равноценных или аналогичных признаков. Из вышеприведенного описания специалист в данной области техники может легко установить важные характеристики данного изобретения и без отклонения от его объема и сущности может делать различные изменения и модификации изобретения, чтобы приспособить его к различным способам применения и условиям. Таким образом, другие варианты осуществления также находятся в рамках следующих пунктов формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения заболевания, включающий введение субъекту, нуждающемуся в этом, эффективного количества конъюгата с чистотой 70% и более, имеющего по меньшей мере один фрагмент полиэтиленгликоля, белковый фрагмент, представляющий собой фрагмент интерферона-, и линкер, в котором по меньшей мере один фрагмент полиэтиленгликоля соединен с линкером и атом азотаN-конца фрагмента интерферона- соединен с линкером, где линкер представляет собой ковалентную связь, C1-10 алкилен, C2-10 алкенилен или C2-10 алкинилен, а заболевание является идиопатическим миелофиброзом, истинной полицитемией и идиопатической тромбоцитемией. 2. Способ по п.1, в котором фрагмент интерферона- является модифицированным фрагментом интерферона-2b и содержит 1-4 дополнительных аминокислотных остатка на N-конце. 3. Способ по п.1, где заболевание представляет собой идиопатический миелофиброз. 4. Способ по п.1, где заболевание представляет собой истинную полицитемию. 5. Способ по п.1, где заболевание представляет собой идиопатическую тромбоцитемию. 6. Способ лечения заболевания, включающий введение субъекту, нуждающемуся в этом, эффективного количества конъюгата формулы I Формула I в которой каждый R1, R2, R3, R4 и R5 независимо представляет собой Н, C1-5 алкил, C2-5 алкенил,C2-5 алкинил, арил, выбранный из фенила, нафтила и пиренила, гетероарил, выбранный из фурила, пирролила, тиенила, оксазолила, имидазолила, тиазолила, пиридинила, пиримидинила, хиназолинила и индолила, C3-8 циклоалкил или C3-8 гетероциклоалкил; каждый A1 и A2 независимо представляет собой полиэтиленгликоль; каждый G1, G2 и G3 независимо представляет собой связь или соединяющую функциональную группу; Р представляет собой фрагмент интерферона-;m является 0 или целым числом 1-10;n является целым числом 1-10,где заболевание является идиопатическим миелофиброзом, истинной полицитемией и идиопатической тромбоцитемией. 7. Способ по п.6, согласно которому G3 представляет собой связь, а Р представляет собой фрагмент интерферона-, в котором аминогруппа на N-конце соединяется с G3. 8. Способ по п.7, согласно которому каждый A1 и A2 представляет собой фрагмент mPEG, имеющий молекулярную массу 10-30 кДа. 9. Способ по п.8, согласно которому каждый G1 и G2 представляет собой где О соединяется с A1 или А 2, a NH соединяется с атомом углерода, как показано в формуле I. 10. Способ по п.9, согласно которому Р представляет собой модифицированный фрагмент интерферона, содержащий 1-4 дополнительных аминокислотных остатка на N-конце. 11. Способ по п.10, согласно которому n представляет собой 2. 12. Способ по п.11, согласно которому конъюгат представляет собой в котором mPEG имеет молекулярную массу 20 кДа;IFN представляет собой фрагмент интерферона-2b. 13. Способ по п.6, где заболевание представляет собой идиопатический миелофиброз. 14. Способ по п.6, где заболевание представляет собой истинную полицитемию. 15. Способ по п.6, где заболевание представляет собой идиопатическую тромбоцитемию.
МПК / Метки
МПК: A61P 31/00, A61P 35/00, A61K 31/40, A61K 38/21, A61P 31/12
Метки: применение, интерферон-пэг, конюгатов, терапевтическое
Код ссылки
<a href="https://eas.patents.su/10-22354-terapevticheskoe-primenenie-konyugatov-interferon-peg.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтическое применение конъюгатов интерферон-пэг</a>
Предыдущий патент: Триазолопиридины
Следующий патент: Пирролопиримидины в качестве ингибиторов cdk4/6
Случайный патент: Способы лечения множественной миеломы и индуцированной миеломой резорбции костей с помощью антагонистов интегрина












