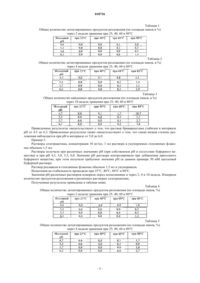
Фармацевтические растворы, способ получения и терапевтическое применение
Номер патента: 18736
Опубликовано: 30.10.2013
Авторы: Фанара Доменико, Пулен Клер, Сенкел Эрик, Доделе Бертран
Формула / Реферат
1. Стабильный фармацевтический раствор производного 2-оксо-1-пирролидина формулы (I)
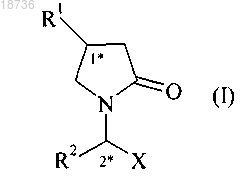
где R1 обозначает н-пропил или 2,2-дифторвинил;
R2 обозначает этил;
X обозначает группу -CONH2;
отличающийся тем, что значение pH составляет от 4,5 до 6,5.
2. Раствор по п.1, отличающийся тем, что значение pH составляет от 5,0 до 6,0.
3. Раствор по п.1 в виде раствора для инъекций, количество фармацевтического соединения в котором составляет от 0,01 до 200 мг/мл.
4. Раствор по п.1 в виде раствора для перорального введения, количество фармацевтического соединения в котором составляет от 0,01 до 100 мг/мл.
5. Раствор по п.1 в виде раствора для инъекций, значение pH которого составляет 5,5±0,2.
6. Раствор по п.1 в виде раствора для перорального введения, значение pH которого составляет 5,5±0,2.
Текст
В изобретении описан стабильный фармацевтический раствор, способ его получения и терапевтического применения. Изобретение относится к стабильным жидким растворам производных 2-оксо-1-пирролидина, способам их получения и терапевтического применения. В заявке WO 01/62726 описаны производные 2-оксо-1-пирролидина и способы их получения. Прежде всего, описано соединение (2S)-2-[(4R)-2-оксо-4-пропилпирролидин-1-ил]бутанамид, известное под международным незапатентованным названием бриварацетам В заявке WO 2005/121082 описан способ получения производных 2-оксо-1-пирролидина, прежде всего, способ получения (2S)-2-[(4S)-4-(2,2-дифторвинил)-2-оксопирролидин-1-ил]бутанамида, известного под международным незапатентованным названием селетрацетам Таким образом, производные 2-оксо-1-пирролидина широко используются в фармацевтической промышленности. Бриварацетам проявляет эффективность при лечении эпилепсии. Бриварацетам также проявляет эффективность при лечении пациентов с резистентными парциальными припадками, сопровождающимися вторичной генерализацией или без нее. В ходе клинических испытаний на подтверждающей стадииIII исследовали эффективность и безопасность бриварацетама в дозе от 5 до 100 мг/сутки в ходе дополнительного лечения взрослых пациентов (16-65 лет). Бриварацетам также показан для лечения прогрессирующей миоклонической эпилепсии и симптоматической миоклонии. Селетрацетам проявляет эффективность при лечении эпилепсии. До настоящего времени бриварацетам и селетрацетам получают в виде твердых композиций (таблетки и гранулы с пленочным покрытием). Однако для перорального введения детям, а также некоторым взрослым пациентам предпочтительными являются растворы для перорального введения. В случае растворов для эпилепсии с миоклоническими приступами предпочтительным является введение инъекций. Кроме того, введение пероральной лекарственной формы является предпочтительным способом для многих лекарственных средств, в связи с его простотой и низкой стоимостью. Однако некоторые пациенты, например дети или пациенты старшего возраста, могут испытывать трудности при глотании твердых составов, таких как таблетки или капсулы. Таким образом, существует необходимость в разработке жидких пероральных составов, так как при этом повышается согласие пациентов с курсом лечения. Однако испытания на стабильность при хранении свидетельствуют о том, что водные растворы производных 2-оксо-1-пирролидина являются нестабильными. В ходе таких испытаний в результате основного или кислотного гидролиза в растворе образуются продукты распада, происходит эпимеризация и/или амидный гидролиз, а также окисление, при этом в растворе обнаруживаются примеси гидроксиамида и оксикислоты. Неожиданно было установлено, что указанные продукты разложения не образуются при значенияхpH от 4,5 до 6,5. Фактически при нормальных условиях (КТ) наблюдается медленная кинетика разложения, если pH раствора лекарственного средства составляет pH от 4,5 до 6,5. Настоящее изобретение относится к стабильному раствору фармацевтического соединения при pH от 4,5 до 6,5, а фармацевтическое соединение представляет собой производное 2-оксо-1-пирролидина формулы (I)R4 обозначает водород или C1-C10-алкил;R5 обозначает водород или C1-C10-алкил. Предпочтительно pH раствора по настоящему изобретению составляет от 5,0 до 6,0. Наилучшие результаты достигаются при pH приблизительно 5,5. Термин "стабильный" в настоящем контексте обозначает оптимальную стабильность при нормальных условиях хранения (КТ). Термин "алкил", использованный в данном контексте, обозначает насыщенные, одновалентные углеводородные радикалы с прямой (неразветвленной), разветвленной цепью или циклические остатки или их комбинации. Предпочтительно алкил содержит от 1 до 10 атомов углерода. Более предпочтительно алкил содержит от 1 до 4 атомов углерода. Необязательно алкильная группа содержит от 1 до 5 заместителей, независимо выбранных из группы, включающей галоген, гидроксигруппу, алкоксигруппу, сложноэфирную группу, ацил, цианогруппу, ацилоксигруппу, кислотную, амидную или аминогруппу. Предпочтительно алкильные группы обозначают метил, этил, н-пропил, трифторметил и трифторэтил. Термин "алкенил", использованный в данном контексте, обозначает незамещенные или замещенные, разветвленные или циклические углеводородные радикалы или их комбинации, содержащие по крайней мере одну двойную связь. Предпочтительно алкенил содержит от 2 до 6 атомов углерода. Более предпочтительно алкенил содержит от 2 до 4 атомов углерода. "Алкенил" необязательно содержит от 1 до 5 заместителей, независимо выбранных из группы, включающей галоген, гидроксигруппу, алкоксигруппу, сложноэфирную группу, ацил, цианогруппу, ацилоксигруппу, карбоксигруппу, амидную или аминогруппу. Термин "галоген", использованный в данном контексте, обозначает атом фтора, хлора, брома или йода. Термин "гидроксигруппа", использованный в данном контексте, обозначает группу формулы -ОН. Термин "алкоксигруппа", использованный в данном контексте, обозначает группу формулы -ORa,a где R обозначает C1-C4-алкил, как определено выше. Термин "ацил", использованный в данном контексте, обозначает группу формулы RbCO-, где Rb обозначает C1-C4-алкил, как определено выше. Термин "сложноэфирная группа", использованный в данном контексте, обозначает группу формулы-COORc, где Rc обозначает C1-C4-алкил, как определено выше. Термин "цианогруппа", использованный в данном контексте, обозначает группу формулы -CN. Термин "ацилоксигруппа", использованный в данном контексте, обозначает группу формулы-O-CORd , где Rd обозначает C1-C4-алкил, как определено выше, или арил. Термин "арил", использованный в данном контексте, обозначает органический радикал, полученный из ароматического углеводорода при удалении одного атома водорода, например фенил. Термин "карбоксигруппа", использованный в данном контексте, обозначает группу формулы-СООН. Термин "аминогруппа", использованный в данном контексте, обозначает группу формулы -NH2,NHRe или NRfRe, где Re и Rf обозначают алкил, как описано выше в данном контексте. Термин "амид", использованный в данном контексте, обозначает группы формулы -CO-NH2, -CONHRg или -CO-NRgRh, где Rg и Rh обозначают алкильные группы, как описано выше в данном контексте. Термин "сульфонатная группа", использованный в данном контексте, обозначает группы формулы-O-SO2-Ri, где Ri обозначает алкил или арил, как определено выше в настоящем контексте. Предпочтительно сульфонатные группы обозначают метансульфонат, пара-толуолсульфонат или трифторметансульфонат. В одном варианте согласно первому объекту настоящего изобретения R1 обозначает C1-C4-алкил или C2-C4-алкенил. В другом варианте согласно первому объекту настоящего изобретения R1 обозначает н-пропил или 2,2-дифторвинил. В еще одном варианте согласно первому объекту настоящего изобретения R2 обозначает C1-C4 алкил. В другом варианте согласно первому объекту согласно первому объекту настоящего изобретенияR2 обозначает этил. В одном варианте согласно первому объекту настоящего изобретения X обозначает -CONR4R5,-СООН или -COOR3, где R3 обозначает C1-C4-алкил. В другом варианте согласно первому объекту на-2 018736 стоящего изобретения X обозначает -CONR4R5. В еще одном варианте согласно первому объекту настоящего изобретения X1 обозначает -CONR4R5 или -COOR3, где R3 обозначает C1-C4-алкил. В другом варианте согласно первому объекту настоящего изобретения X1 обозначает COOR3, где R3 обозначает C1-C4-алкил. В другом варианте согласно первому объекту настоящего изобретения X2 обозначает -CONR4R5 или-COOR3, где R3 обозначает C1-C4-алкил. В еще одном варианте согласно первому объекту настоящего изобретения X2 обозначает COOR3, где R3 обозначает C1-C4-алкил. В предпочтительном варианте R3 обозначает метил. В одном варианте согласно первому объекту настоящего изобретения R4 обозначает водород илиC1-C4-алкил. В другом варианте согласно первому объекту настоящего изобретения R4 обозначает водород. В одном варианте согласно первому объекту настоящего изобретения R5 обозначает водород илиC1-C4-алкил. В другом варианте согласно первому объекту настоящего изобретения R5 обозначает водород. Предпочтительно R1 обозначает н-пропил или 2,2-дифторвинил, R2 обозначает этил, а X обозначает-CONH2. Прежде всего, настоящее изобретение относится к растворам для инъекций или перорального введения. В случае раствора для инъекций pH указанного раствора предпочтительно составляет 5,50,2. В случае раствора для перорального введения pH раствора предпочтительно составляет 5,50,2. Количество фармацевтического соединения в растворе для инъекций обычно составляет от 0,01 до 200 мг/мл, предпочтительно от 0,1 до 50 мг/мл, еще более предпочтительно от 1 до 30 мг/мл. Количество фармацевтического соединения в растворе для перорального введения обычно составляет от 0,01 до 100 мг/мл, предпочтительно от 0,1 до 50 мг/мл, еще более предпочтительно от 1 до 20 мг/мл. Обычно растворителем является вода или спирт. В предпочтительном варианте используют водный раствор, в качестве растворителя используют воду, предпочтительно очищенную воду для пероральных водных растворов и воду для инъекций, а также апирогенную воду для инъекций. Раствор вводят внутривенно, внутримышечно или парентерально, или раствор получают в виде раствора для вливаний или концентратов для получения растворов для вливаний. Соединения для регулировки pH являются физиологическими буферными веществами. ЗначениеpH композиции поддерживают при помощи буферной системы. Буферная система включает смеси соответствующих количеств кислоты, например фосфорной, янтарной, винной, молочной или лимонной, и основания, прежде всего, гидроксида натрия или дигидрофосфата натрия. В идеальном случае буфер обладает достаточной емкостью для поддержания pH в необходимом интервале при разбавлении нейтральным, слабокислым или слабоосновным напитком. Примеры буферных веществ включают уксусную кислоту, фосфаты и лимонную кислоту. Наилучшие результаты достигаются с использованием уксусной и лимонной кислот. В раствор можно добавлять фармацевтически пригодные эксципиенты, например консерванты и другие вспомогательные агенты. Консерванты обеспечивают гибель или замедление роста микроорганизмов, непреднамеренно попавших в состав во время его получения или использования, таким образом,консервант является важным ингредиентом. Выбор пригодного консерванта для получения состава зависит от величины рН, совместимости с остальными ингредиентами, способа введения, дозы и частоты введения состава, коэффициента распределения ингредиентов, типа контейнера, степени и типа загрязнения, требуемой концентрации и антимикробной активности. Настоящее изобретение также относится к способу получения стабильного раствора, при этом pH раствора фармацевтического соединения составляет от 4,5 до 6,5. Согласно настоящему изобретению раствор для инъекций также может содержать хлорид натрия или ацетат натрия и подсластители, ароматизаторы, улучшающие внешний вид агенты для пероральных форм. Кроме того, улучшаются общее вкусовое ощущение и сладость состава. Фармацевтически приемлемые подсластители включают предпочтительно по крайней мере один подсластитель с интенсивным вкусом, такой как сахарин, сахаринат натрия или кальция, аспартам, ацесульфам кальция, цикламат натрия, алитам, сахаристое вещество на основе дигидрохалькона, монеллин,стевиозид или сукралозу (4,1',6'-трихлор-4,1',6'-тридезоксигалактосахарозу), предпочтительно сахарин,сахаринат натрия или кальция, и необязательно сыпучий подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, гидрированный глюкозный сироп, ксилит, карамель или мед. Подсластитель интенсивного вкуса обычно содержится в низкой концентрации. Например, в случае сахарината натрия концентрация составляет от 0,01 до 0,1 мас./об.% в расчете на общий объем конечного состава, предпочтительно приблизительно 0,05 мас./об.%. Сыпучий подсластитель, такой как сорбит, можно эффективно использовать в больших количествах, от приблизительно 10 до приблизительно 35 мас./об.%, предпочтительно от приблизительно 15 до 30 мас./об.%, более предпочтительно приблизительно 25 мас./об.%. При использовании сорбита в качестве сыпучего подсластителя предпочтительно использовать водный раствор, содержащий 70 мас./об.% сорбита. Фармацевтически приемлемые ароматизаторы, которые маскируют горький вкус ингредиентов в составах с низкой дозой, предпочтительно представляют собой вишневый, малиновый, черносмородиновый, клубничный, карамельно-шоколадный, мятный ароматизаторы и другие фармацевтически приемлемые ароматизаторы с резким вкусом. Каждый ароматизатор может содержаться в конечной композиции в количестве от 0,05 до 1 мас./об.%. Предпочтительно используют комбинации указанных подсластителей с резким вкусом. Предпочтительно используют подсластители, которые не изменяются или не теряют вкус и цвет в условиях кислотной среды состава. Предпочтительно растворы для инъекций содержат хлорид натрия. Для получения растворов фармацевтическое соединение и другие эксципиенты при перемешивании растворяют в 80% требуемого количества воды. После завершения растворения в растворе измеряют pH и при необходимости доводят для требуемого значения, предпочтительно приблизительно до pH 5,5(0,5). Объем полученного раствора доводят водой до конечного значения. В случае раствора для инъекций полученный указанным образом раствор стерилизуют при фильтровании через пригодные антимикробные фильтры, разливают в пригодные контейнеры, предназначенные для хранения растворов для инъекций (ампулы или флаконы) и стерилизуют. Для получения указанных составов используют стерильную апирогенную воду. Пероральные растворы фильтруют через пригодные фильтры и разливают в пригодные контейнеры,предназначенные для хранения растворов для перорального введения. Настоящее изобретение также относится к применению стабильного раствора для получения лекарственных средств. Настоящее изобретение также относится к применению стабильного раствора для лечения заболеваний. Настоящее изобретение также относится к способу лечения пациента, который заключается во введении указанному пациенту терапевтически эффективного количества стабильного раствора. Настоящее изобретение также относится к фармацевтической композиции, включающей стабильный раствор, pH которого составляет от 4,5 до 6,5. Настоящее изобретение также относится к жидкому фармацевтическому препарату, включающему стабильный раствор бриварацетама, pH которого составляет от 4,5 до 6,5, указанный препарат содержит менее 0,2 мас.% примесей (указанные примеси включают продукты разложения). Настоящее изобретение также относится к жидкому фармацевтическому препарату, включающему стабильный раствор селетрацетама, pH которого составляет от 4,5 до 6,5, указанный препарат содержит менее 0,2 мас.% примесей (указанные примеси включают продукты разложения). Раствор для перорального введения по настоящему изобретению прежде всего можно использовать для введения детям или взрослым пациентам, для которых прием таблеток является неприемлемым. Другое преимущество настоящего изобретения заключается в том, что раствор для инъекций можно быстро вводить в экстренных случаях или в случае кризиса, или таким пациентам, для которых введение любого перорального состава является невозможным. Указанные характеристики бриварацетама и селетрацетама являются идеальными для введения в виде жидкого состава, в отличие от большинства остальных лекарственных средств, используемых в тех же случаях, но которые характеризуются чрезвычайно низкой растворимостью в воде. Приведенные ниже примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем. Пример 1. Растворы бриварацетама, концентрация 20 мг/мл, 1 мл раствора в укупоренных стеклянных флаконах объемом 1,5 мл. Растворы получали при различных значениях pH (при собственном рН, в отсутствие буферного раствора) и при pH 4,5, 5,0, 5,5, 6,0. Значение pH раствора контролировали добавлением пригодного буферного вещества, при этом получали требуемое значение pH (в данном примере 50 мМ цитратный буферный раствор). Раствор разливали в стеклянные флаконы объемом 1,5 мл и укупоривали. Испытания на стабильность проводили при 25, 40, 60 и 80C. Значения pH различных растворов измеряли перед испытаниями и через 2, 4 и 10 недель. Измеряли количество продуктов разложения в различных растворах биварацетама. Полученные результаты приведены в табл. 1-3 ниже. Таблица 1 Общее количество детектированных продуктов разложения (по площади пиков в %) через 2 недели хранения при 25, 40, 60 и 80C Таблица 2 Общее количество детектированных продуктов разложения (по площади пиков, в %) через 4 недели хранения при 25, 40, 60 и 80C Таблица 3 Общее количество найденных продуктов разложения (по площади пиков, в %) через 10 недель хранения при 25, 40, 60 и 80C Приведенные результаты свидетельствуют о том, что раствор бриварацетама стабилен в интервалеpH от 4,5 до 6,5. Приведенные результаты также свидетельствуют о том, что самая низкая степень разложения наблюдается при pH в интервале от 5,0 до 6,0. Пример 2. Растворы селетрацетама, концентрация 10 мг/мл, 1 мл раствора в укупоренных стеклянных флаконах объемом 1,5 мл. Растворы получали при различных значениях pH (при собственном pH в отсутствие буферного вещества) и при pH 4,5, 5,0, 5,5, 6,0. Значение pH раствора контролировали при добавлении пригодного буферного вещества, при этом получали требуемое значение pH (в данном примере 50 мМ ацетатный буферный раствор). Раствор разливали в стеклянные флаконы объемом 1,5 мл и укупоривали. Испытания на стабильность проводили при 25C, 40C, 60C и 80C. Значения pH различных растворов измеряли перед испытаниями и через 2, 4 и 10 недель. Измеряли количество продуктов разложения в различных растворах селетрацетама. Полученные результаты приведены в таблице ниже. Таблица 4 Общее количество детектированных продуктов разложения (по площади пиков, %) через 2 недели хранения при 25, 40, 60 и 80C Таблица 5 Общее количество детектированных продуктов разложения (по площади пиков, %) через 4 недели хранения при 25, 40, 60 и 80C Таблица 6 Общее количество детектированных продуктов разложения (по площади пиков, %) через 10 недель хранения 25, 40, 60 и 80C Приведенные результаты свидетельствуют о том, что раствор селетрацетама стабилен в интервалеpH от 4,5 до 6,5. Приведенные результаты также свидетельствуют о том, что самая низкая степень разложения наблюдается в интервале pH от 5,0 до 6,0. Пример 3. Раствор для инъекций, содержащий бриварацетам, концентрация 50 мг/мл, во флаконе. Состав раствора: Бриварацетам, хлорид натрия и ацетат натрия растворяли в 80% от требуемого количества воды для инъекций. Значение pH доводили до 5,5 с помощью 0,1 н. раствора уксусной кислоты. Объем раствора доводили водой для инъекций до требуемого объема. Раствор фильтровали через фильтр с диаметром пор 0,22 мкм после предварительного фильтрования. Стеклянные флаконы объемом 6 моль заполняли раствором. Запаянные ампулы или укупоренные флаконы стерилизовали паром (20 мин в автоклаве при 121C). Раствор для инъекций, содержащий бриварацетам и не содержащий дополнительных эксципиентов,получали простым способом. Пример 4. Раствор для перорального введения, содержащий бриварацетам, концентрация 1 мг/мл. Состав раствора: В стальной сосуд помещали 90% глицерина и добавляли метилпарабен. Растворение проводили при нагревании и перемешивании. В другой сосуд добавляли очищенную воду, цитрат натрия и лимонную кислоту, получали раствор. При перемешивании добавляли бриварацетам до полного растворения. Оба раствора смешивали. Добавляли воду до конечного объема и полученную смесь гомогенизировали. Значение pH (рН 5,60,3) измеряли на pH метре. Полученный состав фильтровали через фильтровальный картридж с диаметром пор 40 мкм. Пример 5. Раствор для внутривенного введения, содержащий селетрацетам, концентрация 100 мг/мл - флакон. Состав раствора: Селетрацетам, хлорид натрия и ацетат натрия растворяли в 80% от требуемого количества воды для инъекций. Значение pH доводили до 5,5 с помощью 0,1 н. раствора уксусной кислоты для инъекций. Объем раствора доводили водой для инъекций до требуемого объема. Запаянные ампулы или укупоренные флаконы стерилизовали паром (30 мин в автоклаве при 121C). Пример 6. Раствор бриварацетама для перорального введения, концентрация 10 мг/мл. Состав раствора: Раствор для перорального введения получали, как описано в примере 4. Значение pH измеряли (рН 5,40,2) на pH метре. Получали стабильный раствор для перорального введения. Более того, он представляет собой органолептически приемлемый пероральный водный раствор. Пример 7. Раствор для перорального введения, содержащий бриварацетам, 1 мг/мл. Состав раствора: Раствор для перорального введения получали, как описано в примере 4. Значение pH измеряли (рН 5,50,2) на pH метре. Получали стабильный раствор для перорального введения. Пример 8. Анализ связывания с участками связывания леветирацетама (УСЛ). Участки связывания леветирацетама, М. Noyer и др., Eur. J. Pharmacol., 286, c. 137-146 (1995). Константу ингибирования (Ki) соединения определяли методом конкурентного связывания, по связыванию при определенной концентрации радиоактивного лиганда в равновесных условиях с различными концентрациями немеченных исследуемых соединений. Определяли величину IC50, т.е. концентрацию исследуемого соединения, при которой наблюдается ингибирование специфического связывания с радиолигандом на 50%. Равновесная константа диссоциации Ki пропорциональна величине IC50 и ее рассчитывали по уравнению Ченга-Прусова (Cheng Y. и др., Biochem. Pharmacol., 22, c. 3099-3108 (1972. Диапазон концентраций обычно включает 6 log-единиц с различным шагом (от 0,3 до 0,5 log). Анализ проводили однократно или в двух повторах, каждое значение Ki определяли для двух различных образцов исследуемого соединения. Кору головного мозга самцов крыс линии Sprague-Dawley массой 200-250 г гомогенизировали с использованием гомогенизатора Potter S (10 циклов при 1000 об/мин, Braun, Germany) в буферном растворе следующего состава: трис-HCl, 20 ммоль/л, pH 7,4, 250 ммол/л сахароза (буферный раствор А), все процедуры проводили при 4C. Гомогенизат центрифугировали при 30000 g в течение 15 мин. Полученную неочищенную мембранную фракцию ресуспендировали в трис-HCl (50 ммоль/л, pH 7,4; буферный раствор В) и выдерживали в течение 15 мин при 37C, затем центрифугировали при 30000 g 15 мин и дважды промывали тем же буферным раствором. Полученный осадок ресуспендировали в буферном растворе А при концентрации белка от 15 до 25 мг/мл и хранили в жидком азоте. Мембранную фракцию (150-200 мкг белка/анализ) выдерживали при 4C в течение 120 мин в 0,5 мл трис-HCl буферного раствора (50 ммоль/л pH 7,4), содержащего 2 ммоль/л MgCl2, от 110-9 до 210-9 моль/л [-3H-]-2-[4-(3-азидофенил)-2-оксо-1-пирролидинил]бутанамида и увеличивающиеся концентрации исследуемого соединения. Неспецифическое связывание (НС) определяли как остаточное связывание, наблюдаемое в присутствии определенной концентрации стандартного соединения (например,10-3 моль/л леветирацетама), которое связывается практически со всеми рецепторами. Связанные с мембранной фракцией и свободные радиоактивные лиганды разделяли быстрым фильтрованием через стекловолоконный фильтр (эквивалент бумаги ватман GF/C или GF/B, VEL, Бельгия), предварительно пропитанный в 0,1% раствором полиэтиленимина и 10-3 моль/л леветирацетама для уменьшения неспецифического связывания. Образцы и фильтры промывали по крайней мере 6 мл буферным раствором трисHCl (50 ммоль/л, pH 7,4). Общее время фильтрования не должно превышать 10 с для каждого образца. Связанную на фильтрах радиоактивность регистрировали на Р-сцинцилляционном счетчике (Tri-Carb 1900 или TopCount 9206, Camberra Packard, Бельгия) или любом другом аналогичном счетчике. Данные обрабатывали с использованием программного обеспечения методом нелинейной аппроксимации кривой с использованием набора уравнений, описывающих различные модели связывания при условии существования независимых невзаимодействующих рецепторов, подчиняющихся закону сохранения массы. Соединения по настоящему изобретению, прежде всего, бриварацетам и сеетрацетам, характеризуются значениями pKi в интервале 6,0 или более. Пример 9. Модель звукочувствительных мышей. Цель данных испытаний заключалась в оценке противосудорожного действия соединения у звукочувствительных мышей, генетической модели животных с рефлекторными эпилептическими припадками. В данной модели первичной генерализованной эпилепсии припадки вызываются без электрической или химической стимуляции и типы припадков, по крайней мере частично, являются аналогичными клинической феноменологии припадков у человека (Loscher W. и Schmidt D., Epilepsy Res. 2, с. 145-181(1998), Buchhalter J.R., Epilepsia, 34, c. 31-41(1993. Использовали самцов или самок генетически звукочувствительных мышей (14-28 г, n=10), полученных из штамма DBA, изначально выбранных селекцией (Dr. Lehmann, лаборатория акустической физиологии (Париж и выращиваемых на ферме UCB Pharma Sector с 1978 г. В испытаниях использовали несколько групп, одной группе вводили контроль-носитель, а другим группам вводили различные дозы исследуемого соединения. Соединение вводили внутрибрюшинно за 60 мин до индукции аудиогенного припадка. Величины доз вводимого соединения составляли логарифмическую прогрессию, обычно от 1,010-5 до 1,010-3 моль/кг, при необходимости вводили большие или меньшие дозы. Для испытаний животных помещали в клетки малого размера в звукоизолированном помещении. После периода ориентации в течение 30 с включали акустические стимулы (90 дБ, 10-20 кГц) в течение 30 с через громкоговорители, размещенные над каждой клеткой. В течение указанного интервала мышей обследовали и регистрировали три фазы припадка, а именно метания, клонические судороги и тонические судороги. Рассчитывали процент мышей, у которых не наблюдалось метаний, клонических и тонических судорог. Для активных соединений значение ED50, т.е. дозу, обеспечивающую 50% защиты относительно контрольной группы с доверительным интервалом 95%, рассчитывали с использованием программного обеспечения Probit Analysis (SAS/STAT Software, версия 6,09, метод PROBIT) по количеству защищенных мышей для каждой из 3 фаз активности припадка. Для соединений по настоящему изобретению, прежде всего, бриварацетама и селетрацетама, значения ED50 составляют 1,010-4 или менее. Пример 10. Биодоступность и безопасность составов для внутривенного введения, содержащих бриварацетам. Бриварацетам представляет собой антиэпилептическое лекарственное средство с высокой аффинностью к белку синаптических везикул SV2A. Первую стадию перекрестных испытаний проводили с 3 периодами с участием 24 здоровых субъектов (12 мужчин, 12 женщин). В ходе испытаний сравнивали биодоступность бриварацетама при пероральном введении таблеток, содержащих 10 мг бриварацетама и при введении 10 мг бриварацетама в виде внутривенного вливания в течение 15 мин или в виде внутривенного струйного вливания. На второй стадии проводили испытания при введении увеличивающейся однократной дозы (25 мг, 50 мг, 100 мг и 150 мг) с участием 4 параллельных групп по 6 субъектов (3 женщины, 3 мужчины), а также при быстром внутривенном струйном вливании, при этом оценивали фармакокинетические параметры бриварацетама в ходе указанных курсов лечения и пропорциональность доз. Доза, содержащая 10 мг бриварацетама, введенная внутривенным вливанием в течение 15 мин или струйным вливанием, биоэквивалентна однократной дозе бриварацетама, содержащегося в таблетке для перорального введения (90% доверительный интервал, геометрическое соотношение величин Cmax и AUC находятся в интервале биоэквивалентности 80-125%). Бриварацетам (от 25 мг до 150 мг), введенный в виде внутривенного вливания или в виде струйного вливания, характеризуется безопасностью и достаточно высокой переносимостью. После внутривенного вливания и струйного введения установлены идентичные фармакокинетические параметры бриварацетама. Увеличение времени воздействия пропорционально вводимой дозе в исследованном интервале (25150 мг). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стабильный фармацевтический раствор производного 2-оксо-1-пирролидина формулы (I)X обозначает группу -CONH2; отличающийся тем, что значение pH составляет от 4,5 до 6,5. 2. Раствор по п.1, отличающийся тем, что значение pH составляет от 5,0 до 6,0. 3. Раствор по п.1 в виде раствора для инъекций, количество фармацевтического соединения в котором составляет от 0,01 до 200 мг/мл. 4. Раствор по п.1 в виде раствора для перорального введения, количество фармацевтического соединения в котором составляет от 0,01 до 100 мг/мл. 5. Раствор по п.1 в виде раствора для инъекций, значение pH которого составляет 5,50,2. 6. Раствор по п.1 в виде раствора для перорального введения, значение pH которого составляет 5,50,2.
МПК / Метки
МПК: A61K 31/4015, A61K 9/08
Метки: растворы, применение, фармацевтические, способ, получения, терапевтическое
Код ссылки
<a href="https://eas.patents.su/10-18736-farmacevticheskie-rastvory-sposob-polucheniya-i-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические растворы, способ получения и терапевтическое применение</a>
Предыдущий патент: Опалубка перекрытия со средствами опоры для опалубочных щитов
Следующий патент: Радиально расширяющееся болтовое соединение
Случайный патент: Способ обработки жидкости, в частности нефтепродуктов