Новые производные тиазолидиндиона в качестве противодиабетических средств
Номер патента: 4301
Опубликовано: 26.02.2004
Авторы: Моурелье Мансини Марисабель, Де Рамон Амат Элизабет, Дель Кастильо Нието Хуан Карлос
Формула / Реферат
1. Соединение общей формулы (I)
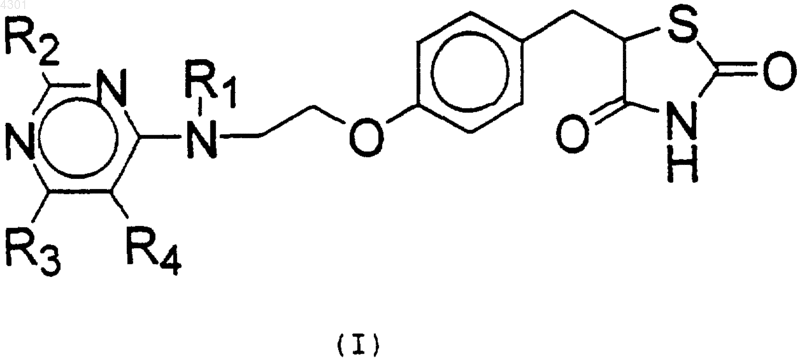
где R1 - агом водорода или C1-C6-алкилгруппа;
R2 - атом водорода, C1-C6-алкилгруппа, атом галогена (фтор, хлор, бром, йод), -OR5, -SR5, -NR5R6, -NO2 или фенилгруппа;
R3 - атом водорода, C1-C6-алкилгруппа, атом галогена (фтор, хлор, бром, йод), -OR5, -SR5, -NR5R6, -NO2 или фенилгруппа;
R4 - атом водорода, C1-C6-алкилгруппа, атом галогена (фтор, хлор, бром, йод), -OR5, -NR5R6 или фенилгруппа;
или R3 и R4, взятые вместе, представляют собой -CH=CH-CH=CH-, -N=CR7-NR8-, или -NR8-CR7=N-группу, образующую конденсированное с пиримидином кольцо;
R5, R6 независимо друг от друга могут быть атомом водорода или C1-C6-алкилгруппой;
R7 - атом водорода или NH2-группа
R8 - атом водорода, C1-C6-алкилгруппа;
а также его фармацевтически приемлемые соли и таутомерные формы.
2. Соединение общей формулы (I) по п.1, отличающееся тем, что
R1 - метилгруппа;
R2 - атом водорода, -OR5, -NR5R6-группы;
R3 - атом водорода, атом галогена (фтор, хлор, бром, йод), -OR5-группа;
R4 - атом водорода;
или R3 и R4, взятые вместе, представляют собой -NR8-CR7=N- или -N=CR7-NR8-группу, где R7 и R8 имеют значения, как указано выше.
3. Соединение общей формулы (I) по п.1, отличающееся тем, что его выбирают из следующих соединений:
5-{4-[2-(метилпиримидин-4-иламино)этокси]бензил}тиазолидин-2,4-диона;
5-(4-{2-[(6-хлорпиримидин-4-ил)метиламино]этокси}бензил)тиазолидин-2,4-диона;
5-(4-{2-[(2-амино-6-хлорпиримидин-4-ил)метиламино]этокси}бензил)тиазолидин-2,4-диона:
5-(4-{2-1(2,6-диметоксипиримидин-4-ил)метиламино]этокси}бензил)тиазолидин-2,4-диона;
5-(4-{2-[метил-(7H-пурин-6-ил)амино]этокси}бензил)тиазолидин-2,4-диона;
5-(4-{2-[метил-(9-метил-9H-пурин-6-ил)амино]этокси}бензил)тиазолидин-2,4-диона;
5-(4-{2-[(6-метоксипиримидин-4-ил)метиламино]этокси}бензил)тиазолидин-2,4-диона;
5-(4-{2-[(6-гидроксипиримидин-4-ил)метиламино]этокси}бензил)тиазолидин-2,4-диона;
4. Способ получения соединения по п.1, отличающийся тем, что соединение общей формулы (III) реагирует с соединением формулы (II)

где R1, R2, R3 и R4 имеют значения, как указано выше; и
X - отщепляемая группа, как например атом галогена, особенно хлор или бром;
в инертной среде в температурном интервале от 10 до 120шC.
5. Способ получения соединения по п.1, который включает восстановление соединения формулы (VI)
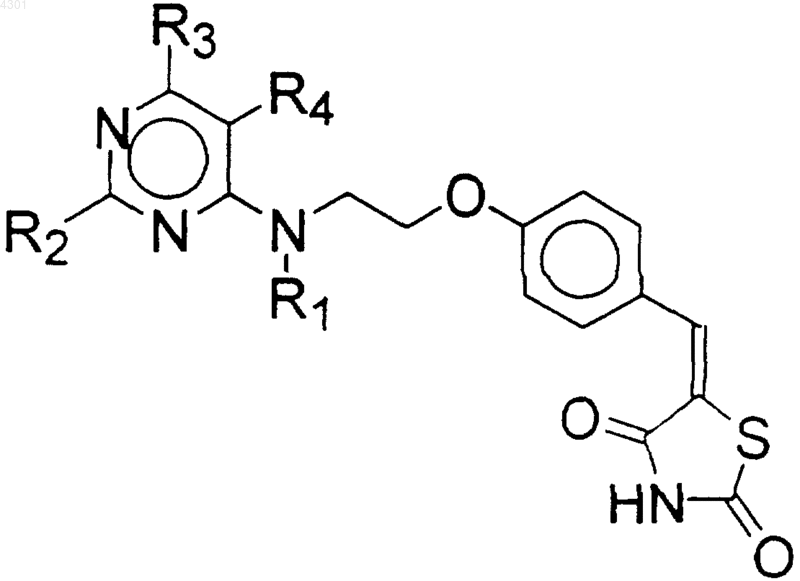
где R1, R2, R3 и R4 имеют значения, как указано выше.
6. Способ по п.5, отличающийся тем, что реакцию восстановления проводят боргидридом натрия, металлами в присутствии донора протонов или без него, ферментативным восстановлением или каталитическим гидрированием.
7. Фармацевтическая композиция, которая включает соединение общей формулы (I) по любому из пп.1-3 и фармацевтически приемлемый носитель, для лечения и/или профилактики гипергликемии и/или гиперлипидемии и/или для лечения осложнений, связанных с резистентностью к инсулину, как например, гипертензии, гиперурикемии или других сердечно-сосудистых, метаболических и эндокринных состояний.
8. Применение соединения общей формулы (I) по любому из пп.1-3 как такового или вместе с одним или несколькими другими противодиабетическими средствами, как например, сульфонилмочевинами или бигуанидинами для получения медикамента для лечения и/или профилактики гипергликемии и/или гиперлипидемии и/или для лечения осложнений, связанных с резистентностью к инсулину, как, например, гипертензии, гиперурикемии или других сердечно-сосудистых, метаболических и эндокринных состояний.
Текст
1 Область изобретения Данное изобретение относится к новым соединениям, которые проявляют высокую гипогликемическую активность и поэтому они потенциально пригодны для лечения и/или профилактики диабета и/или других изменений или осложнений, типичных для диабета, как например, гипергликемии и гиперлипидемии. Предпосылки изобретения Сахарный диабет включает группу синдромов, основной характерной особенностью которых являются высокие уровни глюкозы в крови или гипергликемия. Это вызывает продолжительные осложнения сосудистого типа,как, например, нефропатию, ретинопатию и нейропатию. Различают два типа диабета. Один известен как диабет типа-1 (IDDM), вызванный недостаточностью секреции инсулина - гормона,регулирующего содержание глюкозы в крови; и диабет типа-II (NIDDM), который, главным образом, характеризуется резистентностью к регулирующему эффекту инсулина, причем этот последний тип также или даже более важен, чем первый. Настоящее лечение диабета типа-II сульфонилмочевинами и бигуанидинами далеко от идеального. Сульфонилмочевины могут индуцировать гипогликемию и бигуанидины могут вызывать молочный ацидоз. В последние годы описаны производные тиазолидиндиона с гипогликемической активностью и поэтому, с применением для лечения диабета, главным образом, так называемого"диабета типа-II". Общая структура этих соединений такова: где R является группой обычно ароматического или гетероароматического типа и она может присоединяться или не присоединяться к гетероатому N-типа. Хороший обзор по данному предмету был опубликован B. Hulin et al., Current Pharmaceutical Design (1996), 2, 85-102. В качестве первоначальной ссылки на структуры такого типа можно рассматривать статью T. Sohda et al., Chem. Pharm. Bull., 30(10), 3580-3600 (1982). В данной работе авторы описывают синтез тиазолидиндионовых структур и конкретно структуру циглитазона, подлинной отправной точкой в исследовании тиазолидиндионов в качестве гипогликемических средств, также известных как глитазоны. Были предприняты некоторые изменения структуры этих глитазонов. 2 Изменения были введены в липофильный остаток циглитазона, что привело к синтезу новых соединений, таких как троглитазон (ЕР 139421), росиглитазон (ЕР 306228), пиоглитазон(ЕР 193256). Кроме того, модификации эфирной функциональной группы описаны в работах D.A.R.L. Dow et al., J. Med. Chem., 1991, 34, 15381544; B. Hulin et al., J. Med. Chem., 1992, 35,1853-1864, в которых эту группу включают в конденсированный с ароматическим кольцом цикл, как например, это имеет место в случае Энглитазона (ЕР 207605 В): Энглитазон С другой стороны, ХР 002901546 Cantello et al. относится к "(-(Гетероциклиламино)алкокси]бензил]-2,4-тиазолидиндионы в качестве потенциальных антигипергликемических средств" ("-Heterocyclylamino)alkoxy]benzyl]-2,4-thiazolidinediones asPotent antihyperglycemic Agents" in J. Med. Chem.,1994, 37, 3977-3985). Более сильно действующими антигипергликемическими средствами являлись гетероциклиламино)алкокси]бензил]-2,4-тиазолидиндионы. Однако гетероциклами с лучшей биологической активностью являлись гетероциклы,содержащие пиридилгруппу впереди пиримидинилгруппы, связанной с ее 2-положением к аминоалкоксиуглеродной цепочке. Кроме того, ХР 002901547 Hulin et al., которое относится к "The Glitazone Family of Antidaibetic Agents" in Current Pharmaceutical Design,1996, 2, 85-102, описывает замещенные производные тиазолидиндиона, где гетероциклическая группа может быть пиридинил- или пиримидинилгруппой. Однако в данном документе лучшую биологическую активность достигают с пиридинилгруппой. Данный документ не предлагает применять пиридинилгруппу в 4 положении к аминоалкоксиуглеродной цепочке вследствие того факта, что это изменение делает соединения значительно менее активными. Кроме того, US-A-5002953 - Hindley, 1989 описывает замещенные производные тиазолидиндиона, в которых гетероциклическая группа может быть пиридил- или 2-пиримидинилгруппой. Ни один из этих документов не описывает или не высказывает предположения, что изменение положения пиримидинилгруппы может привести к увеличению биологической активности соединений. Неожиданно авторы данного изобретения нашли новые тиазолидиндионы, которые показывают очень хорошие гипогликемические свойства. Описание изобретения Данное изобретение относится к соединениям общей формулы (I)R1 - атом водорода или C1-С 6-алкилгруппа;R5, R6 независимо друг от друга могут быть атомом водорода или C1-С 6-алкилгруппой;R7 - атом водорода или NH2-гpyппa; к их возможным фармацевтически приемлемым солям и таутомерным формам. Данное изобретение также относится к способу их получения и применению в качестве противодиабетических и гипогликемических средств их как таковых или вместе с другими противодиабетическими средствами, как например, сульфонилмочевинами или бигуанидинами, а также к лечению осложнений, связанных с резистентностью к инсулину, как например, гипертензии, гиперурикемии или других сердечно-сосудистых, метаболических и эндокринных состояний и т.д. Предпочтительными соединениями, описанными в данном изобретении, являются те, в которых 4 5-(4-2-[(2,6-диметоксипиримидин-4 ил)метиламино]этоксибензил)тиазолидин-2,4 дион; 5-(4-2-[метил-(7 Н-пурин-6-ил)амино]этоксибензил)тиазолидин-2,4-дион; 5-(4-2-[метил-(9-метил-9 Н-пурин-6-ил) амино]этоксибензил)тиазолидин-2,4-дион; 5-(4-2-[(6-метоксипиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-дион; 5-(4-2-[(6-гидроксипиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-дион. Соединения общей формулы (I) могут быть получены согласно следующим способам. Способ А. Данный способ состоит во взаимодействии соединения формулы (II), полученного как описано в работе Barrie C.C., Cantello et al., J. Med.Chem., (1994), 37, 3977-85, с пиримидином общей формулы (III), где R1, R2, R3 и R4 имеют такие же значения, как и в соединениях общей формулы (I), Схема I где Х - отщепляемая группа, как, например,атом галогена, особенно хлор или бром. Реакцию проводят в инертной среде в температурном интервале 10-120 С. В качестве инертной среды предпочтительно использовать толуол, диметилформамид и т.д. Способ Б. Данный способ состоит в следующей методике, описанной в схеме (II) ниже: Схема II где пиримидин (III) реагирует с Nалкиламиноэтанолом (R1 - C1-С 6-алкилгруппа) или с этаноламином (R1 - атом водорода) в присутствии растворителя или без него при температурах 10-120 С с получением соединения формулы (IV). Соединения общей формулы (IV) реагируют с п-фторбензальдегидом в инертном рас 5 творителе и в присутствии эквивалентного количества боргидрида натрия. Реакцию проводят при температурах от 0 до 120 С. Таким образом,получают соединения общей формулы (V), которые реагируют с 2,4-тиазолидиндионом в толуоле, при нагреве до кипения, с использованием ацетата пиперидина в каталитических количествах и отделением воды, которая образуется в реакции, с помощью насадки Дина-Старка. Таким образом, получают соединения общей формулы (VI). Соединения общей формулы (VI) подвергают восстановительному процессу с получением соединений общей формулы (I). Данную реакцию восстановления можно проводить с боргидридом натрия, с металлами в присутствии донора протонов или без него, ферментативным восстановлением или каталитическим гидрированием. Восстановление предпочтительно проводить с помощью каталитического гидрирования или с применением раствора боргдрида натрия в воде подщелоченной гидроокисью натрия и прибавлением данного раствора к раствору соединения общей формулы (VI) в THF-DMF и в присутствии каталитических количеств хлорида кобальта и диметилглиоксима. Способ С. Данный способ состоит во взаимодействии соединения общей формулы (I) с получением соединения общей формулы (Iа), в котором один из заместителей R2, R3 или R4 отличается от такового в исходном соединении. Экспериментальная часть Способ А. Пример 1. 5-(4-2-[(6-Хлор-2,5-дифенилпиримидин-4-ил)метиламино]этокситиазолидин-2,4-дион. 0,57 г (1,89 ммолей) 4,6-дихлор-2,5 дифенилпиримидина и 0,53 г (1,89 ммолей) 5-[4(2-метиламиноэтокси)бензил]тиазолидин-2,4 диона в 30 мл диметилформамида нагревают при 80 С в течение 1 ч. Если реакция закончилась, (CCF 90/10/1 СН 2 Сl2/ЕtOН/NH4 ОН), смесь выливают в 300 мл воды и затем экстрагируют 3x300 мл этилацетата. 6 Органическую фазу сушат и концентрируют. Остаток хроматографируют на силикагеле. Элюированием 95/5 CH2Cl2/EtOH получают 0,4 г белого твердого вещества (выход 40%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,36-8,32 (м, 2 Н); 7,60-7,30 (м, 8 Н): 7,12 (д, 2 Н); 6,82 (д, 2 Н); 4,82-4,76 (м, 1 Н); 4,17 (т, 2 Н); 3,83(т, 2 Н); 3,24 (дд, 1 Н); 3,00 (дд, 1 Н); 2,74 (с, 3 Н,NСН 3). Следуя той же самой методике, были получены следующие соединения. Пример 2. 5-(4-2-[Метил-(2-метилсульфанилпиримидин-4-ил)амино]этоксибензил)тиазолидин-2,4-дион. Исходя из 0,83 г (5,3 ммолей) 6 хлорпурина, получают 0,6 г желтого твердого вещества (выход 29%). 1 Н-ЯМР (DMSO-d6): 13,04 (уш.с, 1 Н, NH); 12,00 (уш.с, NH); 8,22 (с, 1 Н); 8,15 (с, 1 Н); 7,17 Исходя из 1 г (9 ммолей) 2-амино-6 хлорпурина, получают 1,28 г желтого твердого вещества (выход 54%). Исходя из 1 г (6 ммолей) 6-хлор-9 метилпурина, полученного метилированием 6 хлорпурина метилйодидом в ацетоне и в присутствии карбоната калия, получают 1,02 г желтого твердого вещества (выход 41%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1H, NH); 8,24 (с, 1H); 8,17 (с, 1 Н); 7,16 (д, 2 Н); 6,84 (д,2 Н); 4,82 (дд, 1H); 4,60-4,10 (уш.с, 2 Н); 4,30-4,20 Исходя из 0,5 г (3 ммолей) 6-хлор-7 метилпурина, полученного в качестве побочного продукта при алкилировании 6-хлорпурина метилйодидом, получают 0,38 г окрашенного в оранжевый цвет твердого вещества (выход 31%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1H, NH); 8,40 (с, 1H); 8,35 (с, 1H); 7,12 (д, 2 Н); 6,81 (д,2 Н); 4,69 (дд, 1H); 4,25 (т, 2 Н); 3,97 (с, 3 Н,NСН 3); 3,90 (т, 2 Н); 3,30 (дд, 1H); 3,20 (с, 3 Н,NСН 3); 2,95 (дд, 1H). Пример 14. 5-(4-2-[(6-хлорпиримидин-4 ил)метиламино]этоксибензил)тиазолидин-2,4 дион. Исходя из 1,1 г (7,4 ммолей) 4,6 дихлорпиримидина, получают 2 г белого твердого вещества (выход 72%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,19 (с, 1 Н); 7,18 (д, 2 Н); 6,85 (с, 1 Н); 6,83 (д,2 Н); 4,82 (дд, 1 Н); 4,17 (т, 2 Н); 4,03-3,82 (уш.с,2 Н); 3,30 (дд, 1 Н); 3,14 (с, 3 Н, NCH3); 3,05 (дд,1 Н). Пример 15. 5-(4-2-[(2-Амино-6-метилпиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-дион. Исходя из 0,8 г (5,3 ммолей) 2-амино-4 хлор-6-метилпиримидина, получают 1,2 г белого твердого вещества (выход 58%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 7,16 (д, 2 Н); 6,87 (д, 2 Н); 6,08 (уш.с, 2 Н, NH2); 5,84 (с, 1 Н); 4,71 (дд, 1 Н); 4,10 (т, 2 Н); 3,85 (т,2 Н); 3,31 (дд, 1 Н); 3,05 (с, 3 Н, NСН 3); 2,98 (дд,1 Н); 2,10 (с, 3 Н, СН 3). Пример 16. 5-(4-2-[Метил-(2-фенилхиназолин-4-ил)амино]этоксибензил)тиазолидин 2,4-дион. Исходя из 1,3 г (5,3 ммолей) 4-хлор-2 фенилхиназолина, получают 1,6 г желтого твердого вещества (выход 62%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,50-8,42 (м, 2 Н); 8,24 (д, 1 Н); 7,84-7,76 (м, 2 Н); 7,52-7,42 (м, 4 Н); 7,16 (д, 2 Н); 6,84 (д, 2 Н); 4,84 Исходную смесь, состоящую из 2,9 г (0,02 молей) 4-хлорметоксипиримидина и 5,6 г (0,02 молей) 5-[4-(2-метиламиноэтокси)бензил]тиазолидин-2,4-диона в 60 мл диметилформамида, и в присутствии 17 г NaHCO3 нагревают при 100 С в течение 24 ч. Если реакция закончилась, смесь выливают в 600 мл воды и экстрагируют 4 х 200 мл этилацетата. Экстракты сушат и концентрируют, остаток хроматографируют на силикагеле. Элюированием 95/5 СН 2 Сl2/ЕtOН получают 2,5 г белого твердого вещества (выход 32%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,22 (с, 1 Н); 7,18 (д, 2 Н); 6,84 (д, 2 Н); 5,92 (с,1 Н); 4,84 (дд, 1 Н); 4,10 (т, 2 Н); 3,90 (т, 2 Н); 3,82(0,02 моля) бикарбоната натрия, нагревают до 120 С в 50 мл диметилформамида в течение 2 ч. Если реакция закончилась, смесь охлаждают и затем выливают в 500 мл воды, в результате чего осаждается твердое вещество, которое затем фильтруют. Маточник экстрагируют 3 х 100 мл этилацетата. Экстракты сушат над сульфатом натрия,фильтруют и концентрируют. Остаток объединяют с ранее отфильтрованным твердым веще 11 ством и перемешивают в 50 мл этанола. Нерастворившееся твердое вещество далее фильтруют с получением 3,4 г (выход 84%) совершенно чистого продукта. 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,05 (уш.с, 1 Н, NH); 7,21 (д, 2 Н); 6,90 (д, 2 Н); 6,24 (с, 1 Н); 4,86 (дд, 1 Н); 4,12 (т, 2 Н); 3,84 (с,3 Н); 3,68 (уш.с, 2 Н); 3,38 (дд, 1 Н); 3,05 (дд, 1 Н). Способ Б. Пример 20. 5-4-[2-(Метилпиримидин-4 ил-амино)этокси]бензилтиазолидин-2,4-дион. 20.1. Синтез 2-[(6-хлорпиримидин-4-ил) метиламино]этанола.(0,15 моля) 2-(N-метиламино)этанола. Полученную смесь перемешивают при комнатной температуре в течение 0,5 ч, далее концентрируют досуха и затем распределяют между СН 2 Сl2 и насыщенным раствором NаНСО 3. Органическую фазу сушат и концентрируют. Остаток перемешивают с 20 мл CH2Cl2 и затем выпавший белый осадок отфильтровывают. Получают 7,7 г. Из маточного раствора дополнительно выделяют 5,8 г чистого продукта с помощью хроматографии на колонке из силикагеля с элюированием смесью 1/1 гептан/этилацетат (выход 72%). Н-ЯМР (CDCl3): 8,30 (с, 1 Н); 6,45 (1, 1 Н); 3,89 (т, 2 Н); 3,78 (т, 2 Н); 3,10 (с, 3 Н, NСН 3). 20.2. Синтез 2-(метилпиримидин-4-иламино)этанола. К 9,4 г (50 ммолей) 2-[(6-хлорпиримидин 4-ил)метиламино]этанола в 50 мл этанола и 10 мл воды прибавляют 1 г пасты 10% Pd/C и полученную смесь подвергают гидрированию под давлением 60 атм при комнатной температуре в течение 8 ч. Раствор фильтруют через декалит. Фильтрат концентрируют досуха и затем распределяют между насыщенным раствором бикарбоната натрия (100 мл) и 100 мл СН 2 Сl2. Водную фазу дополнительно экстрагируют 2 х 100 мл СН 2 Сl2 и экстракты объединяют с предыдущим экстрактом. Экстракты сушат, затем концентрируют и остаток очищают с помощью хроматографии на колонке из силикагеля с элюированием смесью 9/1 CH2Cl2/EtOH. Получают 4,1 г бесцветного масла (выход 54%). Н-ЯМР (CDCl3): 8,48 (с, 1 Н); 8,09 (д, 1 Н); 6,43 (д, 1 Н); 4,90-4,80 (уш.с, 1 Н, ОН); 3,83 (т,2 Н); 3,74 (т, 2 Н); 3,10 (с, 3 Н, NСН 3). В 30 мл диметилформамида прибавляют 0,88 г (22 ммолей) гидрида натрия (60% в минеральном масле) и 2,9 г (19 ммолей) 2-[(6 хлорпиримидин-4-ил)метиламино]этанола. Смесь перемешивают при комнатной температуре в течение 0,5 ч. Затем прибавляют порцию 2,6 г (21 ммолей) п-фторбензальдегида и полученную смесь нагревают при 50 С в течение 15 мин. Реакционную смесь выливают в 300 мл воды и затем экстрагируют 3 х 100 мл AcOEt. Органическую фазу сушат, фильтруют и концентрируют и остаток хроматографируют на колонке с силикагелем. Элюируя смесью 1/1 гептан/этилацетат, получают 2,5 г названного соединения (выход 51%). Н-ЯМР (CDCl3): 9,90 (с, 1 Н, СНО); 8,62 (с,1 Н); 8,28-8,18 (уш.с, 1H); 7,83 (д, 2 Н); 7,00 (д,2 Н); 6,51 (д, 1H); 4,30 (т, 2 Н); 4,08 (т, 2 Н); 3,21 К 2,3 г (8 ммолей) 4-[2-(метилпиримидин 4-ил-амино)этокси]бензальдегида в 40 мл толуола прибавляют 1,06 г (8,9 ммолей) 90% 2,4 тиазолидиндиона. Далее дополнительно прибавляют 0,06 мл (0,78 ммолей) пиперидина и 0,044 мл (0,78 ммолей) уксусной кислоты. Смесь нагревают при кипении в течение 5 ч с отделением образующейся воды с помощью насадки Дина-Старка. Реакционную смесь оставляют охлаждаться и далее твердый осадок отфильтровывают. Получают 2,5 г продукта (выход 88%). 1 Н-ЯМР (DMSO-d6): 8,50 (с, 1 Н); 8,15 (д,1 Н); 7,70 (с, 1 Н); 7,51 (д, 2 Н); 7,07 (д, 2 Н); 6,70 К перемешиваемому раствору 7,5 мг (0,025 ммолей) гексагидрата хлорида кобальта и 116 мг (1 ммоль) диметилглиоксима в 40 мл воды прибавляют 4 капли 1N NaOH, после чего следует прибавление 0,57 г (15 ммолей) боргидрида натрия. В данный раствор, охлажденный до 0 С,прибавляют 1,8 г (5 ммолей) 5-4-[2-(метил 13 пиримидин-4-ил-амино)этокси]бензилидентиазолидин-2,4-диона, растворенного в 30 мл диметилформамида. Реакционную смесь выдерживают при комнатной температуре в течение 24 ч и затем вливают в 300 мл воды и рН доводят до 6-7 с помощью уксусной кислоты. Выпавший белый осадок отфильтровывают, обрабатывают 100 мл метанола и нагревают до кипения. Метанольный раствор фильтруют в горячем виде, чтобы удалить любое остаточное количество исходных веществ. Из маточного раствора перекристаллизацией получают 1,5 г конечного продукта (выход 84%). 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1 Н, NH); 8,48 (с, 1 Н); 8,17 (д, 1 Н); 7,14 (д, 2 Н); 6,84 (д,2 Н); 6,70 (д, 1 Н); 4,82 (дд, 1 Н); 4,12 (т, 2 Н); 3,90 К 1 г (2,5 ммолей) соединения, полученного в примере 14, в 30 мл диметилформамида прибавляют 0,21 г (2,5 ммоль) NаНСО 3 и 1,8 г(25 ммолей) 60% диметиламина в воде. Смесь нагревают при 80 С в течение 24 ч,затем концентрируют досуха и остаток распределяют между 100 мл воды и 100 мл СН 2 Сl2. Органическую фазу сушат и концентрируют. Остаток хроматографируют на силикагеле. Элюированием смесью 96/4 СН 2 Сl2/ЕtOН получают 0,5 г названного соединения. 1 Н-ЯМР (DMSO-d6): 12,00 (уш.с, 1H); 8,06 К 1,9 г (5 ммолей) соединения, полученного в примере 17, в 40 мл уксусной кислоты прибавляют 3,5 мл (20 ммоль) раствора бромистоводородной кислоты в 33% уксусной кислоте. Реакцию нагревают при 80 С в течение 4 ч. Если реакция закончилась, смесь выливают в воду и белый выпавший осадок отфильтровывают и затем перемешивают в течение 30 мин в 50 мл ЕtOН. Полученную суспензию снова фильтруют и получают 1,2 г совершенно чистого белого твердого вещества (выход 64%).(уш.с, 2 Н); 3,32 (дд, 1H); 3,04 (дд, 1H), 2,97 (с,3 Н, NСН 3). Фармакологические методы Фармакологический эффект соединений оценивают на генетически больных диабетом С 57 BL мужских особях мышей db/db 9-11 недельного возраста, а также на контрольных С 57BL db/+ животных той же породы и возраста. Мыши db/db показывают большинство из метаболических изменений, которые появляются при диабете типа-2, в то время как у контрольных животных болезнь не развивалась. В каждой экспериментальной группе используют 8-10 животных, которых обрабатывают (лечат) разными дозами соединений: 1, 5, 10 или 25 мг/кг,которые вводят орально в течение 5 последовательных дней. На "0" день эксперимента отбирают образцы крови в гепаринизированные трубки с помощью пункции ретроорбитальной вены. Плазму отделяют и количественно определяют уровни основной глюкозы и инсулина. После завершения лечений снова отбирают образцы крови каждого животного и определяют количественно уровни глюкозы и инсулина в плазме после лечения. Определение глюкозы проводят с помощью ферментативного метода, который превращает глюкозу в глюкозу-6-фосфат, реакция,связанная с восстановлением никотинамиддинуклеотидфосфатаphosphate, NADP) в NADPH под действием глюкоза-6-Р-дегидрогеназы. NADPH восстанавливает йоднитротетразолий, который определяют количественно спектрофотометрическим методом. Абсорбция при 520 нм пропорциональна концентрации глюкозы: ссылка RandoxGI, 2623 (Berymeyer H.U., Bernt E., Schmidt F.H.,Stork H. In Methods of Enzymatic Analysis, Academic Press: London and New York 1974, p.1196). Результаты выражают в виде процента уменьшения по отношению к основному уровню, определенному до начала лечения. Полученные результаты приведены в таблице. Как видно из таблицы, соединения, описанные в данном изобретении, приводят к большим уровням уменьшения глюкозы, чем это достигается с помощью стандарта (троглитазона), даже с дозами в 100 раз более низкими. Соединение Троглитазон Пример 3 Пример 4 Пример 7 Пример 11 Пример 12 Пример 14 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где R1 - агом водорода или C1-С 6-алкилгруппа;R5, R6 независимо друг от друга могут быть атомом водорода или C1-С 6-алкилгруппой;R7 - атом водорода или NH2-гpyппaR8 - атом водорода, C1-С 6-алкилгруппа; а также его фармацевтически приемлемые соли и таутомерные формы. 2. Соединение общей формулы (I) по п.1, отличающееся тем, чтоR8 имеют значения, как указано выше. 3. Соединение общей формулы (I) по п.1, отличающееся тем, что его выбирают из следующих соединений: 5-4-[2-(метилпиримидин-4-иламино)этокси]бензилтиазолидин-2,4-диона; 5-(4-2-[(6-хлорпиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-диона; 5-(4-2-[(2-амино-6-хлорпиримидин-4 ил)метиламино]этоксибензил)тиазолидин-2,4 диона: 5-(4-2-1(2,6-диметоксипиримидин-4 ил)метиламино]этоксибензил)тиазолидин-2,4 диона; 16 5-(4-2-[метил-(7 Н-пурин-6-ил)амино]этоксибензил)тиазолидин-2,4-диона; 5-(4-2-[метил-(9-метил-9 Н-пурин-6 ил)амино]этоксибензил)тиазолидин-2,4-диона; 5-(4-2-[(6-метоксипиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-диона; 5-(4-2-[(6-гидроксипиримидин-4-ил)метиламино]этоксибензил)тиазолидин-2,4-диона; 4. Способ получения соединения по п.1, отличающийся тем, что соединение общей формулы где R1, R2, R3 и R4 имеют значения, как указано выше; и Х - отщепляемая группа, как например атом галогена, особенно хлор или бром; в инертной среде в температурном интервале от 10 до 120 С. 5. Способ получения соединения по п.1, который включает восстановление соединения формулы (VI) где R1, R2, R3 и R4 имеют значения, как указано выше. 6. Способ по п.5, отличающийся тем, что реакцию восстановления проводят боргидридом натрия,металлами в присутствии донора протонов или без него, ферментативным восстановлением или каталитическим гидрированием. 7. Фармацевтическая композиция, которая включает соединение общей формулы (I) по любому из пп.1-3 и фармацевтически приемлемый носитель,для лечения и/или профилактики гипергликемии и/или гиперлипидемии и/или для лечения осложнений, связанных с резистентностью к инсулину, как например, гипертензии, гиперурикемии или других сердечно-сосудистых, метаболических и эндокринных состояний. 8. Применение соединения общей формулы (I) по любому из пп.1-3 как такового или вместе с одним или несколькими другими противодиабетическими средствами, как например, сульфонилмочевинами или бигуанидинами для получения медикамента для лечения и/или профилактики гипергликемии и/или гиперлипидемии и/или для лечения осложнений, связанных с резистентностью к инсулину, как например, гипертензии, гиперурикемии или других сердечно-сосудистых, метаболических и эндокринных состояний.
МПК / Метки
МПК: C07D 417/12, A61K 31/427, A61P 31/10
Метки: новые, качестве, противодиабетических, средств, производные, тиазолидиндиона
Код ссылки
<a href="https://eas.patents.su/9-4301-novye-proizvodnye-tiazolidindiona-v-kachestve-protivodiabeticheskih-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные тиазолидиндиона в качестве противодиабетических средств</a>
Предыдущий патент: Клеточная везикула, называемая “текзосома”, ее получение и применение для стимуляции иммунного ответа
Следующий патент: β-карболиновые лекарственные продукты
Случайный патент: Бензодиоксановые ингибиторы продуцирования лейкотриена













