Производные 6-деоксиэритромицина, способ их получения и их применение в качестве лекарственных средств
Формула / Реферат
1. Соединения формулы (I)
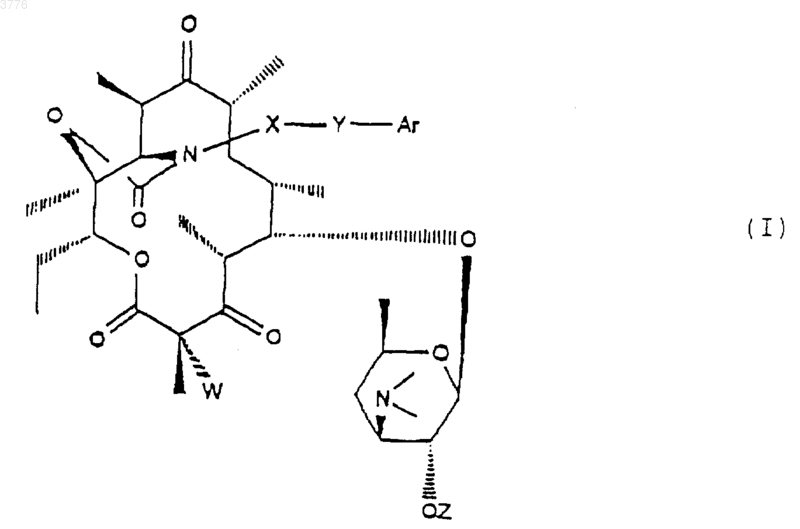
в которой
X представляет собой радикал (NH)a, CH2 или SO2 или атом кислорода, тогда как символ а представляет собой число, равное 0 или 1,
Y представляет собой радикал (CH2)m-(CH=CH)n-(CH2)o, причем m+n+o_ 8, а n=0 или 1,
Ar представляет собой фенил или нафтил,
или гетероарил, представляющий собой тиенил, фурил, пиролил, тиазолил, оксазолил, имидазолил, в частности, 4-(3-пиридинил)-1H-имидазолил, тиадиазолил, пиразолил или изопиразолил, пиридил, пиримидил, пиридазинил, пиразинил, индолил, бензофуранил, бензотиазил или хинолинил, незамещенные или замещенные одной или несколькими группами выбранными из атомов галогена, радикалов гидрокси, NO2, CуN, радикалов алкил, алкенил или алкинил, O-алкил, O-алкенил или O-алкинил, S-алкил, S-алкенил или S-алкинил, N-алкил, N-алкенил или N-алкинил, содержащие до 12 атомов углерода, возможно замещенные одним или несколькими атомами галогена, радикала
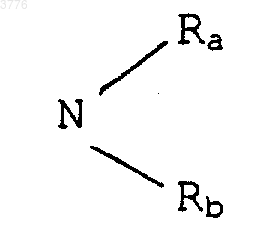
где Ra и Rb, одинаковые или разные, обозначают атом водорода или радикал алкил, содержащий до 12 атомов углерода, радикала
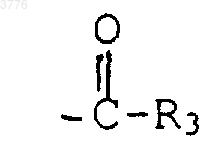
где R3 обозначает алкил, содержащий до 12 атомов углерода, или фенил, или нафтил, или гетероарильный радикал, указанный выше, возможно замещенный одним или несколькими заместителями, перечисленными выше,
W представляет собой атом водорода или галогена,
Z представляет собой атом водорода или остаток кислоты, а также их кислотно-аддитивные соли.
2. Соединения формулы (I) согласно п.1, отличающиеся тем, что Z представляет собой атом водорода.
3. Соединения формулы (I) согласно пп.1 и 2, отличающиеся тем, что W представляет собой атом водорода.
4. Соединения формулы (I) согласно любому из пп.1, 2 и 3, отличающиеся тем, что X представляет собой радикал CH2.
5. Соединения формулы (I) согласно любому из пп.1-4, отличающиеся тем, что Y представляет собой радикал (CH2)3 или (CH2)4.
6. Соединения формулы (I) согласно любому из пп.1-5, отличающиеся тем, что символ Ar представляет собой радикал формулы
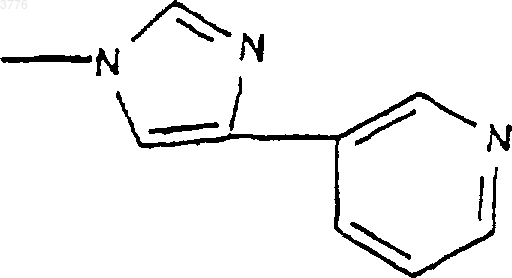
7. Соединение по п.1, представляющее собой 3-де[(2,6-дидеокси-3-C-метил-3-O-метил-альфа-L-рибогексопиранозил)окси]-3-оксо-12,11-[оксикарбонил[[4-(4-(3-пиридинил)-1H-имидазол-1-ил)бутил]имино]]-6,11,12-тридеоксиэритромицин.
8. Лекарственное средство, представляющее собой соединение согласно любому из пп.1-6, а также их фармацевтически приемлемые соли.
9. Лекарственное средство, представляющее собой соединение согласно п.7, а также его фармацевтически приемлемые соли.
10. Фармацевтическая композиция, содержащая в качестве лекарственных средств, по меньшей мере, одно лекарственное средство согласно п.8 или 9.
11. Способ получения соединений формулы (I) согласно любому из пп.1-7, отличающийся тем, что соединение формулы (II)
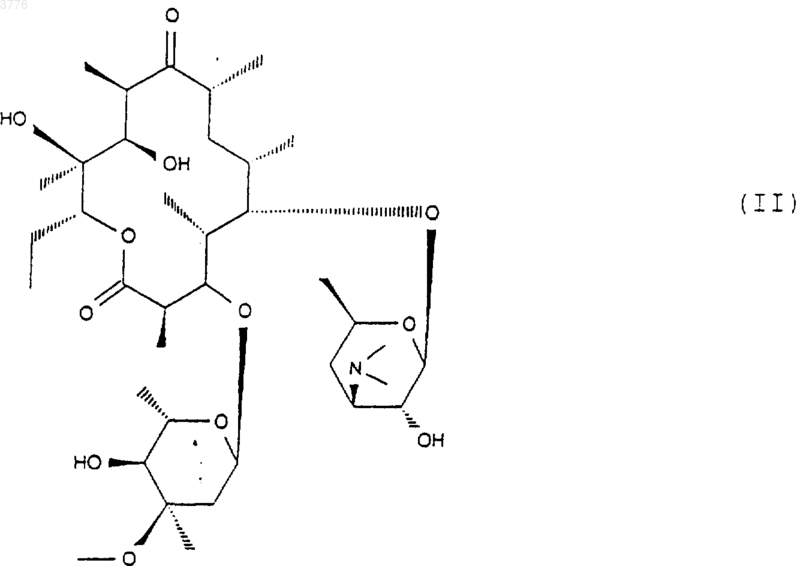
подвергают действию гидролизующего агента-кладинозы в водной среде с получением соединения формулы (III)
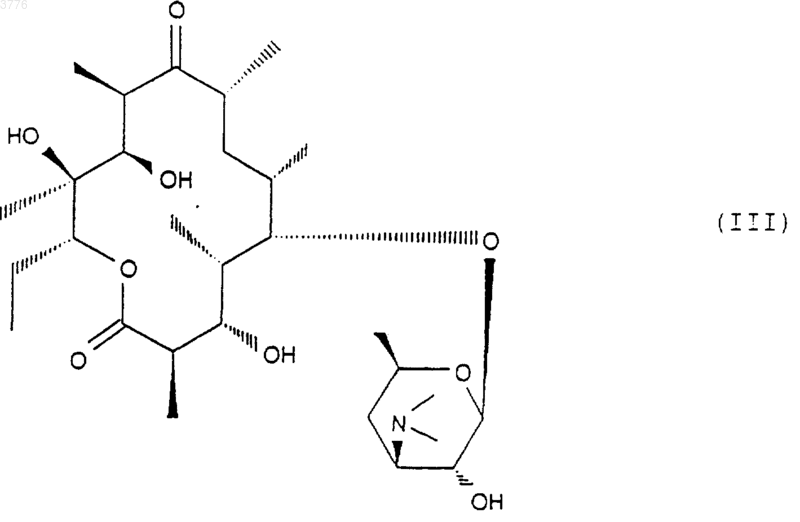
которое подвергают обработке агентом, блокирующим гидроксильную функцию в положении 2' с целью получения соединения формулы (IV)
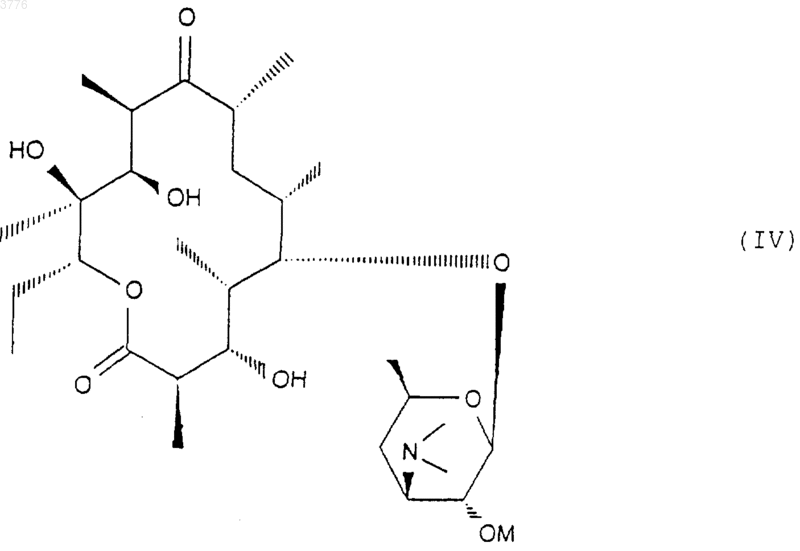
в которой OM представляет собой блокированную гидроксильную группу, которое подвергают действию агента, окисляющего гидроксильную группу в положении 3 с получением соединения формулы (V)

затем, при желании, высвобождают гидроксильную группу в положение 2' для получения соединения формулы (VI)
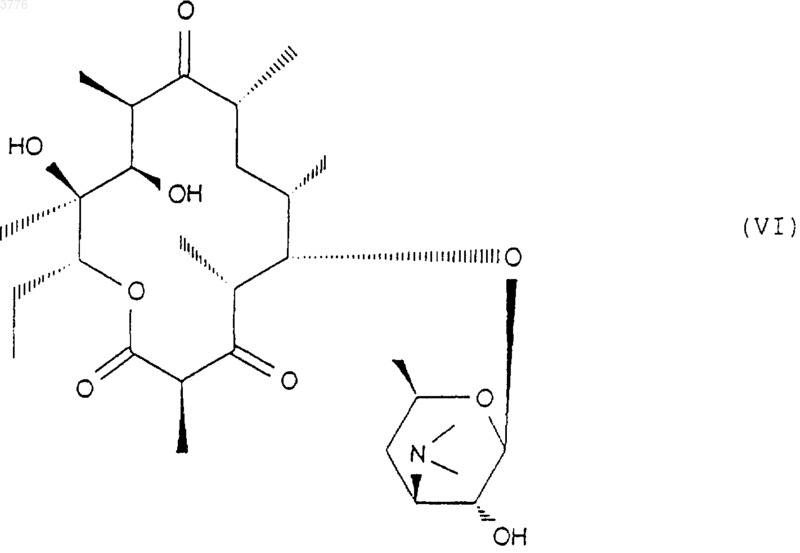
затем, при желании, подвергают любое из соединений формулы (V) или (VI) действию агента, способного образовать двойную связь в положениях 10, 11 для получения соединения формулы (VII)
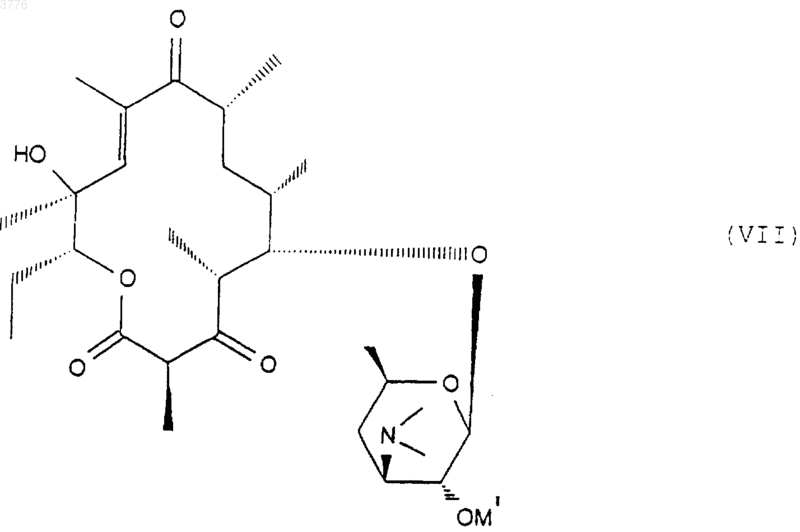
в которой символ OM' представляет собой свободный или блокированный гидроксильный радикал, которое подвергают действию карбонилдиимидазола для получения соединения формулы (VIII)
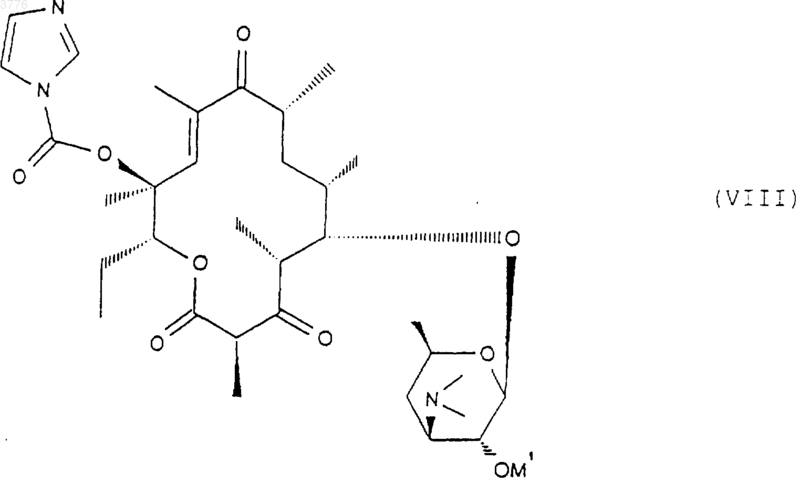
которое обрабатывают соединением формулы ArYXNH2, в которой Y, X и Ar имеют значения, указанные в п.1, для получения соответствующего соединения формулы (IA)
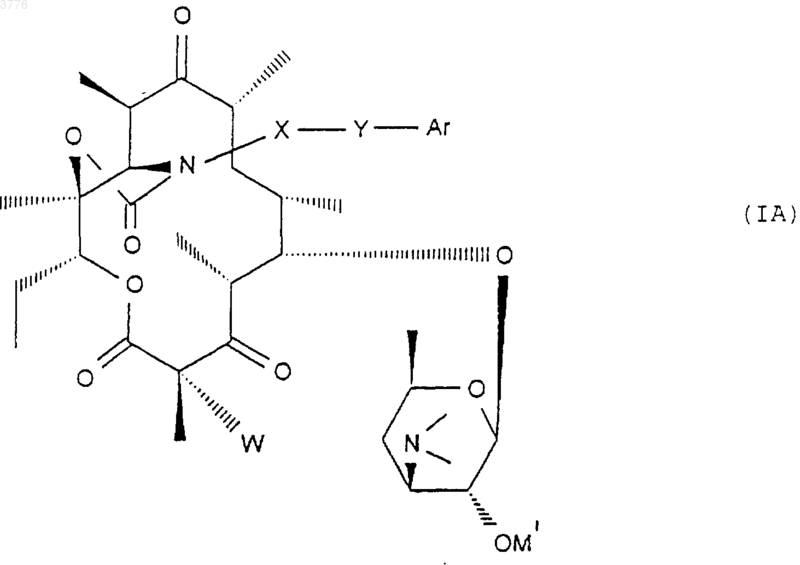
в которой W представляет собой атом водорода, которое, при желании, подвергают действию галогенирующего агента для получения соединения формулы (IB), в которой W означает атом галогена

затем, при желании, деблокируют гидроксильную группу в положении 2' и/или, если необходимо, обрабатывают кислотой с образованием соли.
12. Соединения формулы (V) и (VI), описанные в п.11.
13. Соединения формулы (VII), описанные в п.11.
14. Соединение формулы (VIII), описанные в п.11.
Текст
1 Настоящее изобретение относится к новым производным 6-деоксиэритромицина, к способу их производства и к применению их в качестве лекарственных средств. Известны производные 10-метил-6-метокси 3-оксоэритромицина (см. WO 98/03530). Известны также производные 6-деметокси-10-деметилэритромицина (см. FR А-2 692 579). Известны также производные 3,11,12-тригидроксиэритромицина,используемые в качестве промежуточных продуктов для синтеза антибиотиков (см. WO 97/42205). Настоящее изобретение касается соединений формулы (I)X представляет собой радикал (NH)a, CH2 или SO2 или атом кислорода, а представляет собой число, равное 0 или 1,Y представляет собой радикал (CH2)m(СН=СН)n-(CH2)o, в котором m+n+o8, а n = 0 или 1,Ar представляет собой радикал арил или гетероарил, возможно замещенный,W представляет собой атом водорода или галогена,Z представляет собой атом водорода или остаток кислоты, а также их кислотноаддитивных солей. Из числа кислотно-аддитивных солей можно назвать соли, образованные с уксусной,пропионовой, трифторуксусной, малеиновой,винной, метансульфоновой, бензолсульфоновой, паратолуолсульфоновой кислотой и в особенности со стеариновой, этилянтарной или лаурилсульфоновой кислотой. Ариловый радикал является предпочтительно фенилом или нафтилом. Гетероциклический радикал, замещнный или незамещнный, может быть тиенилом, фурилом, пиролилом, тиазолилом, оксазолилом,имидазолилом, например, радикалом 4-(3 пиридинил)-1 Н-имидазолилом, тиадиазолилом,пиразолилом, или изопиразолилом, радикалом пиридил, пиримидил, пиридазинил или пиразинил, а также радикалом индолилом, бензофуранилом, бензотиазилом или хинолеинилом. Эти ариловые радикалы могут содержать одну или несколько групп, выбранных из числа гидроксильных радикалов, атомов галогена,радикалов NО 2, радикалов СN, радикалов алкил, алкенил или алкинил, O-алкил, O-алкенил или O-алкинил, S-алкил, S-алкенил или Sалкинил, или N-алкил, N-алкенил или Nалкинил, содержащих до 12 атомов углерода и 2 возможно замещенных одним или несколькими атомами галогена, радикал в котором Ra и Rb, одинаковые или различные,представляют собой атом водорода или алкильный радикал, содержащий до 12 атомов углерода; радикал формулы В которой R3 представляет собой алкильный радикал, содержащий до 12 атомов углерода; или арильный или гетероарильный радикал,состоящий из 5-6 звеньев, содержащих один или несколько гетероатомов, возможно замешенные одним или несколькими заместителями, перечисленными выше. В качестве предпочтительного гетероцикла можно среди прочих назвать следующие гетероциклы, 3 а также гетероциклические радикалы, описанные в европейских, патентах 487411,596802, 676409 и 680967. Эти предпочтительные гетероциклические радикалы могут быть замещены одной или несколькими функциональными группами, указанными выше. Символ Hal предпочтительно представляет собой атом фтора, хлора или брома . Из предпочтительных соединений согласно изобретению можно назвать соединения, в которых Z обозначает атом водорода, или соединения, в которых W обозначает атом водорода или соединения, в которых X обозначает радикал СН 2, или соединения, в которых Y обозначает радикал (СH2)3 или (СН 2)4 и, в частности, соединения, в которых Ar представляет собой радикал Более конкретно, настоящее изобретение относится к соединению, описанному в примере 1. Соединения общей формулы (I) проявляют очень высокую антибиотическую активность в отношении грамположительных бактерий, таких как стафилококки, стрептококки и пневмококки. Соединения согласно изобретению могут быть использованы в качестве лекарственных средств для лечения инфекций, вызываемых чувствительными к лекарствам патогенными микроорганизмами, в частности для лечения стафилококковых инфекций, стафилококковых септицимий, злокачественных стафилококковых поражений кожи лица или кожных покровов,пиодермитов, септических или гнойных ран,фурункулов, карбункулов, флегмон, рожистых воспалений, угрей; таких стафилококковых инфекций как первичные острые ангины и послегриппозные ангины, бронхопневмонии, лгочные нагноения; для лечения таких стрептококковых инфекций как острые ангины, отиты, синуситы,скарлатина; для лечения таких пневмококковых инфекций как пневмония, бронхиты, бруцеллз,дифтерит, гонококковые инфекции. Соединения согласно настоящему изобретению также проявляют активность при лечении инфекций, вызываемых такими болезнетворны 003776influenze, Rickettsies, Mycoplasma pneumoniae,Chlamydia, Legionella, Ureaplasma, Toxoplasma, а также микроорганизмами вида Mycobacterium. Настоящее изобретение относится также к применению соединений формулы (I), а также их аддитивных солей с фармацевтически приемлемыми минеральными или органическими кислотами в качестве лекарственных средств,более конкретно, в качестве антибиотических лекарственных средств. Более конкретно, изобретение относится к лекарственным средствам, в частности, к антибиотическим лекарственным средствам, представляющим собой соединения, приведенные в примерах, а также их фармацевтически приемлемые соли. Настоящее изобретение относится также к фармацевтическим композициям, содержащим в качестве биологически активного начала, по меньшей мере, одно из вышеуказанных лекарственных средств. Указанные композиции могут быть введены пациенту различными способами: перорально, ректально, парэнтерально или же топическим путм, т.е. местным нанесением на кожу или слизистые оболочки, однако предпочтительным способом введения их является пероральный способ. Указанные композиции могут быть тврдыми, жидкими и иметь любую фармацевтическую форму, например, они могут быть в форме простых таблеток, драже, желатиновых капсул,гранул, свечей, препаратов для инъекций, помад, кремов и гелей, изготовленных обычными способами. При этом одно или более активных начал могут быть введены в эти формы вместе с общепринятыми наполнителями, традиционно используемыми в фармацевтических композициях, таких как тальк, гуммиарабик, лактоза,крахмал, стеарат магния, масло какао, водные или неводные носители, жировые вещества животного или растительного происхождения,производные парафинов, гликоли, различные смачивающие, диспергирующие или эмульгирующие агенты, консерванты. Указанные композиции могут быть также выполнены в форме порошков, предназначенных для растворения непосредственно перед употреблением в соответствующем носителе,таком как, например, стерильная апирогенная вода. Вводимая пациенту доза может колебаться в зависимости от заболевания, особенностей больного, способа прима лекарства и конкретного соединения. Например, эта доза может составлять от 50 до 300 мг в сутки при пероральном приме взрослым пациентом, если он принимает соединение, содержащееся в лекарстве,согласно примеру 1. Настоящее изобретение касается также способа получения вышеуказанных соединений, 5 способного образовать двойную связь в положениях 10 и 11 для получения соединения формулы (VII) подвергают воздействию гидролизирующего агента-кладинозы в водной среде с получением соединения формулы (III) в котором ОМ' представляет собой гидроксильный радикал, свободный или блокированный,которое подвергают действию карбонилдиимидазола для получения соединения формулы которое подвергают обработке агентом, блокирующим гидроксильную функцию в положении 2' с целью получения соединения формулы (IV) в котором символ ОМ представляет собой блокированную гидроксильную группу, которое подвергают действию агента, окисляющего гидроксильную группу в положении 3 с целью получения соединения формулы (V) затем, при желании, высвобождают гидроксильную группу в положении 2' для получения соединения формулы (VI) затем, при желании, любое из соединений формулы (V) или (VI) подвергают действию агента, которое обрабатывают соединением формулыArYXNH2, в которой Y, X и Ar имеют вышеуказанные значения, для получения соответствующего соединения формулы (IA) в которой W представляет собой атом водорода,полученное соединение, при желании, подвергают действию агента галогенирования для получения соединения формулы (IB), в которой W представляет собой атом галогена если это необходимо, высвобождают гидроксильную группу в положении 2' и/или, если необходимо, обрабатывают кислотой для получения соли. Соединения формулы (II), используемые в качестве исходных продуктов для предлагаемого способа, представляют собой известные соединения, описанные, например, в европейских патентах ЕР 0216169, 41355 и 0180415. 7 Гидролиз кладинозой осуществляют с помощью водного раствора соляной кислоты или в метаноле; блокировку гидроксильной группы в положении 2' осуществляют с помощью кислоты или функционального производного кислоты,например, ангидрида кислоты, галогенангидрида кислоты или производных кремния; окисление гидроксильной группы в положении 3 осуществляют с помощью диимидов в присутствии диметилсульфоксида (ДМСО); соединения формулы (V) или (VI) сначала превращают в карбонат в положениях 11 и 12 с помощью карбонилдиимидазола (CDI) или реагента DBU, после чего полученный продукт переводят в соединение формулы (VII) при перемешивании и температуре 30 С 5 С; взаимодействие соединения формулы(VIII) с соединением формулы ArYXNH2 осуществляют в среде растворителя, такого как,например, ацетонитрил, диметилформамил, тетрагидрофуран, диметоксиэтан или диметилсульфоксид; гидролиз сложноэфирной функции в положении 2' осуществляют с помощью метанола или водного раствора соляной кислоты; солеобразование осуществляют с помощью кислоты, используя классические методы; галогенирование в положении 2 является,например, фторированием, которое можно осуществить с помощью соединения формулы Соединения формул (III), (IV), (V), (VI),(VII) и (VIII), используемые в ходе осуществления предлагаемого способа, являются новыми и являются объектом настоящего изобретения. Нижеследующие примеры иллюстрируют предлагаемое изобретение, ни в коей мере не ограничивая его. Пример 1: Соединения 3-де-[(2,6 дидеокси-3-С-метил-3-О-метил-альфа-L-рибогексопиранозил)-окси]-3-оксо-12,11-[оксикарбонил 4-[4-(3-пиридинил)-1 Н-имидазол-1 ил]бутил]имино-6,11,12-тридеоксиэритромицин и соединение (10S) 3-де-[(2,6-дидеокси-3 С-метил-3-О-метил-альфа-L-рибогексопиранозил)-окси]-3-оксо-12,11-[оксикарбонил-4-[4-(3 пиридинил)-1 Н-имидазол-1-ил]бутил]имино 6,11,12-тридеоксиэритромицин. Стадия А: 6-деокси-3-О-де(2,6-дидеокси-3 С-метил-альфа-L-рибогексопиранозил)-эритромицин 100 мл деминерализованной волы, 50 мл нормального раствора соляной кислоты и 9,58 г смеси 6,12-дидеоксиэритромицина и 3-Oдиметил-6,12-дидеоксиэритромицина подверга 003776 8 ют перемешиванию при комнатной температуре в течение 3 ч. Полученную смесь подвергают экстракции этилацетатом, промывают водой и собирают вместе водные фазы, которые сливают в раствор гидрата окиси аммония при 10 С. Полученный продукт экстрагируют этилацетатом, промывают водой, высушивают, фильтруют и концентрируют. Полученный продукт хроматографируют на диоксиде кремния и подвергают элюированию с помощью смеси CH2Cl2/MeOH/NH4OH (95:5:0,5). Полученные фракции собирают при rf = 0,4 и получают 0,246 г требуемого продукта. Стадия В: 2'-ацетат 6-деокси-3-О-де(2,6 дидеокси-3-С-метил-3-О-метил-альфа-L-рибогексопиранозил)-эритромицина. Подвергают перемешиванию в течение 1 ч 45 мин при комнатной температуре раствор,содержащий 18 мл этилацетата, 0,42 мл уксусного ангидрида и 1,755 г продукта, полученного на стадии А. Раствор выливают в воду, доводят величину рН до 9/10 с помощью насыщенного раствора карбоната натрия, полученную смесь экстрагируют этилацетатом, промывают водным раствором карбоната натрия, а затем водой,высушивают, фильтруют и концентрируют. Получают 1,826 г искомого продукта. Стадия С: 2'-ацетат 6-деокси-3-де[(2,6 дидеокси-3-С-метил-3-О-метил-альфа-L-рибогексопиранозил)окси]-3-оксоэритромицина. При комнатной температуре вводят 3,45 г 1-этил-3-(3-диметиламинопропил)карбодиимида в виде хлоргидрата в раствор, содержащий 55 мл метиленхлорида и 3,5 мл ДМСО. Полученную смесь подвергают перемешиванию в течение 25 мин при комнатной температуре. Далее в полученную смесь добавляют 1,82 г продукта, полученного на предыдущей стадии В, после чего смесь перемешивают в течение 15 мин. Смесь охлаждают до 15 С и добавляют к ней 3,47 г трифторацетата пиридиния в 25 мл хлористого метилена. Полученную смесь перемешивают а течение получаса, после чего подвергают хроматографии на диоксиде кремния,элюируя смесью простого пропилового эфира/изопропанола/реагента TEA (соотношение 8:1:1) (при rf = 0,38). Полученную смесь промывают гидратом окиси аммония, этилацетатом,высушивают и получают 156 мг искомого продукта. Стадия D: 6-деокси-3-О-де-[(2,6-дидеокси 3-С-метил-3-О-метил-альфа-L-рибогексопиранозил)-окси]-3-оксоэритромицин. Раствор, содержащий 0,5 мл метанола и 61 мг продукта, полученного на стадии С, подвергают перемешиванию при 5 С в течение 40 ч. Раствор доводят до комнатной температуры,подвергают перемешиванию при этой температуре в течение 8 ч и выпаривают растворитель. Полученный продукт подвергают хроматографии в колонке из диоксида кремния, элюируя 9 смесью СН 2 Сl2/изопропанол/NН 4 ОН (соотношение 94:4:0,5). Получают 14 мг искомого продукта. Стадия Е: 2'-ацетат и циклический 11,12 карбонат 6-деокси-3-де[(2,6-дидеокси-3-С-метил-2-O-метил-альфа-L-рибогексопиранозил)-окси]-3-оксоэритромицин и 2'-ацетат 10,11 дидегидро-6,11-дидеокси-3-де[2,6-дидеокси-3 С-метил-3-О-метил-альфа-L-рибогексопиранозил)окси]-3-оксоэритромицина. Раствор 3,5 мл этилацетата, 0,346 г продукта стадии С, 9 мкл соединения DBU и 0,127 г 1,1'-карбонилдиимидазола подвергают перемешиванию в течение 5 ч при комнатной температуре, после чего раствор перемешивают ещ 15 ч при 30 С. Раствор выливают в воду, экстрагируют этилацетатом, высушивают, фильтруют и концентрируют. Получают 0,301 г продукта,который хроматографируют на диоксиде кремния, элюируя смесью хлористого метилена, изопропанола и гидрата окиси аммония (соотношение 95:5:05). Гомогенные фракции концентрируют тонкослойной хроматографией, поглощают этилацетатом, высушивают, фильтруют и концентрируют. Получают 0,162 г искомого продукта. Стадия F: 2'-ацетат и 12-[(1 Н-имидазол-1 ил)карбоксилат]-де-10,11-дидегидро-6,11 дидеокси-3-де[(2,6-дидеокси-3-С-метил-3-Ометил-альфа-L-рибогексопиранозил)-окси]-3 оксоэритромицина. Перемешивают при 0 С в течение 3 ч раствор, содержащий 2 мл соединения ТГФ, 0,155 г продукта предыдущей стадии Е, 6 мкл соединения DBU и 0,064 г 1,1'-карбонилдиимидазола. Раствор перемешивают при 10 С в течение 15 ч,после чего выливают раствор в воду, экстрагируют этилацетатом, промывают водой, высушивают, фильтруют и концентрируют. Получают искомый продукт. Стадия G: 3-де[2,6-дидеокси-3-С-метил-3 О-метил-альфа-L-рибогексопиранозил)-окси]-3 оксо-12,11-[оксикарбонил 4-[4-(3-пиридинил)1 Н-имидазол-1-ил]-бутил]-имино-6,11,12 тридеоксиэритромицин (продукт А) и (10S) 3-де[2,6-дидеокси-3-С-метил-3-Ометил-альфа-L-рибогексопиранозил)-окси]-3 оксо-12,11-[оксикарбонил 4-[4-(3-пиридинил)1 Н-имидазол-1-ил]бутил]-имино]-6,11,12 тридеоксиэритромицин (продукт В). Раствор, содержащий 1,5 мл ацетонитрила,0,15 мл воды, 0,17 г продукта от предыдущей стадии и 0,199 г 4-(3-пиридинил)-1 Н-имидазол 1-бутанамина, подвергают перемешиванию в течение 4 ч при 60 С. Раствор выливают в воду,экстрагируют этилацетатом, промывают водой,высушивают, фильтруют и концентрируют. Получают 0,184 г продукта, который выливают в раствор 2 мл метанола и 25 мкл DBU. Полученный раствор перемешивают в течение 16 ч при комнатной температуре, после чего выпаривают метанол и хроматографируют на диоксиде 10 кремния,элюируя смесью метиленхлорид/метанол/гидрат окиси аммония (взятых в соотношении 93:7:0,5). Отбирают фракцию, соответствующую rf = 0,38, промывают гидратом окисиаммония в этилацетате и высушивают над сульфатом магния. Получают 27 мг продукта А. Отбирают также фракцию, соответствующую rf= 0,36, вновь подвергают е хроматографической очистке на диоксиде кремния, элюируя смесью метиленхлорид/метанол/гидрат окиси аммония (соотношение 93:7:1). Промывают смесью метиленхлорида изопропанола и гидрата окиси аммония (соотношение 9:1:0,5). Полученную массу концентрируют, осадок обрабатывают метиленхлоридом, высушивают, фильтруют и вновь концентрируют. В результате получают 13 мг продукта В. Примеры фармацевтических композиций Были изготовлены таблетки, содержащие: Продукт согласно примеру 1 150 мг Экципиент до 1 г Экципиент: крахмал, тальк, стеарат магния. Таким же образом из солей предлагаемых соединений были изготовлены растворы для инъекций. Фармакологическое изучение соединений согласно изобретениюA - Метод разбавлений в жидкой среде Была подготовлена целая серия пробирок,в которых распределили одинаковое количество стерильной питательной среды. В каждую пробирку поместили возрастающие количества изучаемого соединения (продукта), после чего каждую пробирку засеяли бактериальным штаммом. После инкубации в течение 24 ч в печи при 37 С производили оценку ингибирования роста по величине трансиллюминации,что позволяет определить минимальные ингибирующие концентрации (C.M.I.), выраженные в микрограммах/см 3. Следующие результаты были получены в отношении продукта согласно примеру 1 (считывание результатов по истечении 24 ч)X представляет собой радикал (NH)a, CH2 или SO2 или атом кислорода, тогда как символ а представляет собой число, равное 0 или 1,Y представляет собой радикал (СН 2)m(СН=СН)n-(СН 2)o, причем m+n+o8, а n=0 или 1,Ar представляет собой фенил или нафтил,или гетероарил, представляющий собой тиенил,фурил, пиролил, тиазолил, оксазолил, имидазолил,в частности,4-(3-пиридинил)-1 Нимидазолил, тиадиазолил, пиразолил или изопиразолил, пиридил, пиримидил, пиридазинил,пиразинил, индолил, бензофуранил, бензотиазил или хинолинил, незамещенные или замещенные одной или несколькими группами, выбранными из атомов галогена, радикалов гидрокси, NO2,CN, радикалов алкил, алкенил или алкинил, Oалкил, O-алкенил или O-алкинил, S-алкил, Sалкенил или S-алкинил, N-алкил, N-алкенил илиN-алкинил, содержащие до 12 атомов углерода,возможно замещенные одним или несколькими атомами галогена, радикала где Ra и Rb, одинаковые или разные, обозначают атом водорода или радикал алкил, содержащий до 12 атомов углерода, радикала где R3 обозначает алкил, содержащий до 12 атомов углерода, или фенил, или нафтил, или гетероарильный радикал, указанный выше, возможно замещенный одним или несколькими заместителями, перечисленными выше,W представляет собой атом водорода или галогена,Z представляет собой атом водорода или остаток кислоты, а также их кислотноаддитивные соли. 2. Соединения формулы (I) согласно п.1,отличающиеся тем, что Z представляет собой атом водорода. 3. Соединения формулы (I) согласно пп.1 и 2, отличающиеся тем, что W представляет собой атом водорода. 4. Соединения формулы (I) согласно любому из пп.1, 2 и 3, отличающиеся тем, что X представляет собой радикал СН 2. 12 5. Соединения формулы (I) согласно любому из пп.1-4, отличающиеся тем, что Y представляет собой радикал (СН 2)3 или (СН 2)4. 6. Соединения формулы (I) согласно любому из пп.1-5, отличающиеся тем, что символAr представляет собой радикал формулы 7. Соединение по п.1, представляющее собой 3-де[(2,6-дидеокси-3-С-метил-3-О-метилальфа-L-рибогексопиранозил)окси]-3-оксо 12,11-[оксикарбонил 4-(4-(3-пиридинил)-1 Нимидазол-1-ил)бутил]имино-6,11,12 тридеоксиэритромицин. 8. Лекарственное средство, представляющее собой соединение согласно любому из пп.1-6, а также их фармацевтически приемлемые соли. 9. Лекарственное средство, представляющее собой соединение согласно п.7, а также его фармацевтически приемлемые соли. 10. Фармацевтическая композиция, содержащая в качестве лекарственных средств, по меньшей мере, одно лекарственное средство согласно п.8 или 9. 11. Способ получения соединений формулы (I) согласно любому из пп.1-7, отличающийся тем, что соединение формулы (II) подвергают действию гидролизующего агентакладинозы в водной среде с получением соединения формулы (III) которое подвергают обработке агентом, блокирующим гидроксильную функцию в положении 2' с целью получения соединения формулы (IV) в которой ОМ представляет собой блокированную гидроксильную группу, которое подвергают действию агента, окисляющего гидроксильную группу в положении 3 с получением соединения формулы (V) которое обрабатывают соединением формулыArYXNH2, в которой Y, X и Ar имеют значения,указанные в п.1, для получения соответствующего соединения формулы (IA) затем, при желании, высвобождают гидроксильную группу в положение 2' для получения соединения формулы (VI) затем, при желании, подвергают любое из соединений формулы (V) или (VI) действию агента, способного образовать двойную связь в положениях 10, 11 для получения соединения формулы (VII) в которой символ ОМ' представляет собой свободный или блокированный гидроксильный радикал, которое подвергают действию карбонилдиимидазола для получения соединения формулы (VIII) в которой W представляет собой атом водорода,которое, при желании, подвергают действию галогенирующего агента для получения соединения формулы (IB), в которой W означает атом галогена затем, при желании, деблокируют гидроксильную группу в положении 2' и/или, если необходимо, обрабатывают кислотой с образованием соли. 12. Соединения формулы (V) и (VI), описанные в п.11. 13. Соединения формулы (VII), описанные в п.11. 14. Соединение формулы (VIII), описанные в п.11.
МПК / Метки
МПК: C07H 17/08, A61K 31/70
Метки: производные, качестве, лекарственных, средств, получения, способ, 6-деоксиэритромицина, применение
Код ссылки
<a href="https://eas.patents.su/8-3776-proizvodnye-6-deoksieritromicina-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-деоксиэритромицина, способ их получения и их применение в качестве лекарственных средств</a>
Предыдущий патент: Композиции с контролируемым высвобождением пароксетина
Следующий патент: Конъюгаты эритропоэтина, их применение, фармацевтические композиции и способы лечения
Случайный патент: Состав и способ получения керамического расклинивающего агента












