Цианоиндольные соединения-ингибиторы повторного захвата серотонина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 3831
Опубликовано: 30.10.2003
Авторы: Мюллер Оливье, Миллан Марк, Кюссак Дидье, Декейн Анн, Лявьелль Жильбер
Формула / Реферат
1. Соединения общей формулы (I)
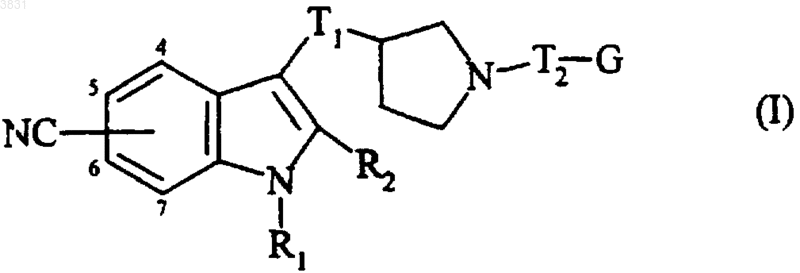
в которой R1 и R2, каждый независимо друг от друга, представляет атом водорода или линейную либо разветвленную (C1-C6)алкильную группу,
T1 и T2 независимо друг от друга представляют линейную или разветвленную (C1-C6)алкиленовую группу,
G представляет гетероциклическую группу формулы (a) или (b)
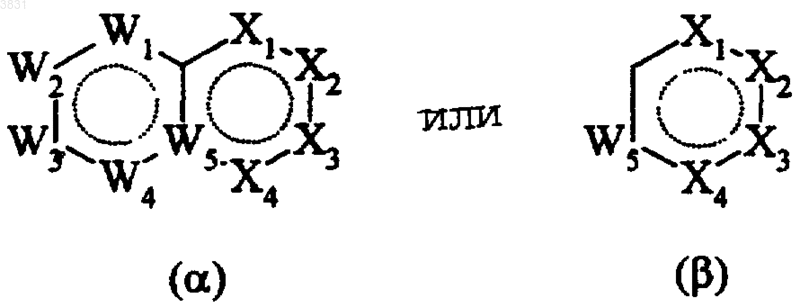
в которых W1-W5 и X1-X4 выбраны таким образом, чтобы образовалась химически стабильная группа, и имеют следующие значения:
W1, W2 и W3, каждый независимо друг от друга, представляет атом азота или группу CR5, NR4 или CO,
W4 представляет атом азота или группу CR3, NR4 или CO,
W5 представляет атом углерода или азота,
X1 представляет связь, атом азота или группу CR3 или NR4,
X2-X4, каждый независимо друг от друга, представляет группу CR3, NR4, CO, SR4 или SO2 либо атомы кислорода, серы или азота,
R3 представляет водород или атом галогена, либо линейную или разветвленную (C1-C6)алкильную группу, гидроксильную группу, линейную или разветвленную (C1-C6)пергалоалкильную группу, нитрогруппу, либо аминогруппу (необязательно замещенную одной или двумя группами, выбранными из линейного или разветвленного (C1-C6)алкила или бензила),
R4 представляет атом водорода или линейную или разветвленную (C1-C6)алкильную группу, необязательно замещенную арильную группу или необязательно замещенную арилалкильную группу,
R5 представляет группу R3 либо две соседние группы R5 совместно с соединенными с ними атомами углерода образуют насыщенную, частично ненасыщенную или ненасыщенную моно- или бициклическую группу, необязательно содержащую от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, причем указанная группа необязательно замещена одной или более группами, выбранными из R3 или оксогруппы,
при этом в формулах (a) и (b) присутствует по крайней мере один гетероатом, пунктирные линии указывают, что группы могут содержать ненасыщенную связь или множество конъюгированных или неконъюгированных ненасыщенных связей и, если ненасыщенная связь отсутствует, оставшиеся валентности занимают атомы водорода, причем группы (a) и (b) соединены с T2 посредством одной из своих кольцевых связей,
их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований.
2. Соединения формулы (I) по п.1, в которой цианогруппa присоединена в 5 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований.
3. Соединения формулы (I) по п.1, в которой цианогруппа присоединена в 6 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований.
4. Соединения формулы (I) по п.1, в котором R1 и R2 каждый представляет атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований.
5. Соединения формулы (I) по п.1, в которой T1 представляет метиленовую группу, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований.
6. Соединения формулы (I) по п.1, в которой G выбран из следующих групп:
2-фурил, 2,4-диоксо-1,4-дигидро-3(2H)-хиназолинил; 3-оксо-[1,2,4]триазоло[4,3-a]пиридин-2(3H)-ил; 1-oксо-2(1H)фталазинил; 7-метил-5-оксо-5H-[1,3]тиазоло[3,2-a]пиримидин-6-ил; 6-хлор-2-оксо-2,3-дигидро-1H-индол-5-ил; 2-оксо-2,3-дигидро-1H-индол-5-ил; 2-оксо-1,2,3,4-тетрагидро-6-хинолинил; 3-бензил-5-метил-2,6-диоксо-3,6-дигидро-1(2H)пиримидинил; 1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил; 1,1,3-триоксо-1,3-дигидро-2H-1,2-бензизотиазол-2-ил; 1,3-диоксо-3,6-дигидропирроло[3,4-c]карбазол-2-(1H)-ил; 1,3-диоксо-1,3-дигидро-2H-бензо[c]изоиндол-2-ил; 3,5-диметил-2,6-диоксо-3,6-дигидро-1(2H)пиримидинил,
а также их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
7. Соединения формулы (I), в которой R1 и R2 каждый представляет атом водорода, T1 представляет метиленовую группу, T2 представляет алкиленовую группу, а G выбран из группы, состоящей из 2-фурила, 2,4-диоксо-1,4-дигидро-3(2H)хиназолинила; 3-оксо-[1,2,4]триазоло[4,3-a]пиридин-2(3H)-ила; 1-оксо-2(1H)-фталазинила; 7-метил-5-оксо-5H-[1,3]тиазоло[3,2-a]пиримидин-6-ила; 6-хлор-2-оксо-2,3-дигидро-1H-индол-5-ила; 2-оксо-2,3-дигидро-1H-индол-5-ила; 2-оксо-1,2,3,4-тетрагидро-6-хинолинила; 3-бензил-5-метил-2,6-диоксо-3,6-дигидро-1(2H)пиримидинила; 1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ила; 1,1,3-триоксо-1,3-дигидро-2H-1,2-бензизотиазол-2-ила; 1,3-диоксо-3,6-дигидропирроло[3,4-c]карбазол-2-(1H)-ила; 1,3-диоксо-1,3-дигидро-2H-бензо-[c]изоиндол-2-ила; 3,5-диметил-2,6-диоксо-3,6-дигидро-1(2H)пиримидинила,
а также их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований.
8. Соединения формулы (I) по п.7, в которых цианогруппа присоединена в 5 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры и соли присоединения фармацевтически приемлемых кислот или оснований.
9. Соединения формулы (I) по п.7, в которых цианогруппа присоединена в 6 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований.
10. Соединение формулы (I) по п.1, представляющее собой гидрохлорид 3-({1-[2-(7-метил-5-оксо-(5H)-[1,3]тиазоло[3,2-a]пиримидин-6-ил)этил]-3-пирролидинил}метил)-1H-индол-5-карбонитрила.
11. Соединение формулы (I) по п.1, представляющее собой гидрохлорид 3-({1-[2-(6-хлор-2-оксо-2,3-дигидро-1H-индол-5-ил)этил]-3-пирролидинил}метил)-1H-индол-5-карбонитрила.
12. Фармацевтические композиции, включающие, в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-11 как таковое или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями.
13. Фармацевтические композиции по п.12, включающие по крайней мере один активный ингредиент по любому из пп.1-11, предназначенные для производства медикаментов, используемых в качестве ингибиторов повторного захвата серотонина при лечении депрессий, обсессивно-компульсивных нарушений, фобий, импульсивных нарушений, связанных с неправильным употреблением лекарственных средств, булимической неврастении и состояния тревоги.
Текст
1 Настоящее изобретение относится к новым цианоиндольным ингибиторам повторного захвата серотонина, способу их получения и содержащим их фармацевтическим композициям. В литературе описаны соединения, характеризирующиеся комбинацией индольной кольцевой системы и кольцевой системы 2,3 дигидро-1,4-бензодиоксина, обладающие свойствами ингибировать повторный захват серотонина (WO 9717343). Индолы, имеющие заместители в ароматическом фрагменте, также были раскрыты в заявке на европейский патент ЕР 814 084 в связи с их действием на уровне сайтов повторного захвата серотонина. Другие соединения, обладающие родственными свойствами,были описаны в заявке на патент WO 9633710 и имели бензопирановую структуру. Ингибиторы повторного захвата серотонина представляют собой гетерогенную группу терапевтических агентов. Они используются для лечения патологий, связанных с дефицитом серотонина на уровне синапсисов центральных нервных клеток. Ингибирование повторного захвата серотонина путем связывания транспорта или пресинаптических рецепторов представляет собой средство восстановления передачи импульсов по нерву. Применение соединений, обладающих такими ингибирующими свойствами, может представлять альтернативу использованию трициклических антидепрессантов или ингибиторов моно-аминоксидазы при лечении депрессий и связанных с ней нарушений (Annals of Pharmacotherapy, 1994, 28, 1359), панических синдромов и обсессивно-компульсивных нарушений(Human Psychopharmacology, 1995, 10, 5199). Эффективность соединений, обладающих такими фармакологическими свойствами (Journal ofPsychopharmacology, 1994, 8, 238), усиливается тем, что они лучше переносимы (InternationalClinical Psychopharmacology, 1995, (9-ое изд. 4,33) и более безопасны при применении (Annalsof Pharmacology, цитированная ссылка). Соединения настоящего изобретения характеризуются наличием индольной кольцевой системы, замещенной на бензольном фрагменте цианогруппой, а в 3-положении N-замещенной 3-пирролилалкильной группой. Такая новая структура обеспечивает указанным соединениям сильную ингибирующую активность в отношении повторного захвата серотонина. В связи с этим, такие соединения находят терапевтическое применение при лечении депрессий, панических синдромов, обсессивно-компульсивных нарушений, фобий, импульсивных нарушений,связанных с неправильным применением лекарств, невротической булимии и состояний тревоги. Настоящее изобретение относится к соединениям общей формулы (I) в которой R1 и R2, каждый независимо друг от друга, представляет собой атом водорода, либо линейную или разветвленную (C1-С 6)алкильную группу,T1 и Т 2, каждый, независимо друг от друга,представляет собой линейную или разветвленную (C1-C6)алкиленовую группу,G представляет собой гетероциклическую группу формулыили в которых W1-W5, а также X1-X4 выбирают таким образом, чтобы создать химически устойчивую группу и они имеют указанные ниже значения:W1, W2 и W3, каждый независимо друг от друга, представляет собой атом азота или группу CR5, NR4 или СО,W4 представляет собой атом азота или группу СR3, NR4 или СО,W5 представляет собой атом углерода или атом азота,X1 представляет собой связь, атом азота или группу СR3 или NR4,Х 2-Х 4, каждый независимо друг от друга,представляет собой группы СR3, NR4, СО, SR4,либо SO2 или атомы кислорода, серы или азота,R3 представляет собой атом водорода или галогена или линейную или разветвленную (C1C6)алкильную группу, гидроксильную группу,линейную или разветвленную (C1-C6)пергалоалкильную группу, нитрогруппу, или аминогруппу (необязательно замещенную одной или двумя группами, выбранными из линейного или разветвленного (C1-C6)алкила, либо бензила),R4 представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу, необязательно замещенную арильную группу или необязательно замещенную арилалкильную группу,R5 представляет собой группу R3, либо две соседние группы R5 совместно с атомами углерода, с которыми они соединены, образуют насыщенную, частично ненасыщенную или ненасыщенную моно- или бициклическую группу,необязательно содержащую 1-5 гетероатомов,выбранных из азота, кислорода и серы, причем указанная группа может быть необязательно замещена одной или более группами, выбранными из R3 и оксогруппы,при этом следует иметь в виду, что в формулахи , присутствует по крайней мере один гетероатом, пунктирные линии указывают на то, что рассматриваемые группы могут содержать ненасыщенную связь или множество 3 конъюгированных или неконъюгированных ненасыщенных связей, и что в случае отсутствия ненасыщенной связи, оставшиеся валентности заняты атомами водорода, причем группыи связаны с T2 одной из своих кольцевых связей, энантиомерам и диастереоизомерам этих соединений, их солям присоединения фармацевтически приемлемых кислот или оснований. Примерами фармацевтически приемлемых кислот, не ограничивающих объем изобретения,могут служить хлористо-водородная кислота,бромисто-водородная кислота, серная кислота,фосфиновая кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота, метансульфокислота, камфорная кислота и т.д. Среди фармацевтически приемлемых оснований, не ограничивая объем изобретения,можно упомянуть гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Под арильной группой следует понимать фенильную или нафтильную группы. Термин необязательно замещенные, относящийся к арильным и арилалкильным группам, обозначает, что рассматриваемые группы необязательно замещены одной или более группами, выбранными из атомов галогена, линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1-C6)пергалоалкильных групп, нитрогрупп и аминогрупп (необязательно замещенных одной или двумя группами, выбранными из линейного или разветвленного (C1-C6)алкила и бензила). Предпочтительно настоящее изобретение относится к соединениям формулы (I), в которой цианогруппа присоединена в 5 положении индольной кольцевой системы. Другой предпочтительный аспект изобретения относится к соединениям формулы (I), в которой цианогруппа присоединена в 6 положении индольной кольцевой системы. Предпочтительно в соединениях формулы(I), R1 и R2 каждый представляет собой атом водорода. Предпочтительные соединения настоящего изобретения представляют собой вещества, в которых T1 представляет собой метиленовую группу. Предпочтительная арильная группа согласно изобретению представляет собой фенильную группу. В предпочтительных группах G согласно изобретению R3, R4 и R5 преимущественно выбраны из линейных или разветвленных (C1C6)алкильных групп, атомов водорода и атомов галогена. 4 Среди предпочтительных групп G согласно настоящему изобретению могут быть упомянуты, без ограничения объема изобретения, следующие группы: 2-фурил,2,4-диоксо-1,4-дигидро-3(2 Н)хиназолинил; 3-оксо-[1,2,4]триазоло[4,3-а]пиридин-2(3 Н)-ил; 1-оксо-2(1 Н)-фталазинил; 7-метил-5-оксо-5 Н-[1,3]тиазоло[3,2-а]пиримидин-6 ил; 6-хлор-2-оксо-2,3-дигидро-1 Н-индол-5-ил; 2-оксо-2,3-дигидро-1H-индол-5-ил; 2-оксо-1,2,3,4-тетрагидро-6-хинолинил; 3-бензил-5-метил 2,6-диоксо-3,6-дигидро-1(2 Н)-пиримидинил; 1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил; 1,1,3-триоксо-1,3-дигидро-2 Н-1,2-бензизотиазол-2 ил; 1,3-диоксо-3,6-дигидропирроло[3,4-с]карбазол-2(1 Н)-ил; 1,3-диоксо-1,3-дигидро-2 Н-бензо[с]изоиндол-2-ил; 3,5-диметил-2,6-диоксо-3,6 дигидро-1(2 Н)-пиримидинил. Особенно предпочтительный аспект настоящего изобретения относится к соединениям формулы (I), в которой R1 и R2 каждый представляет собой атом водорода, T1 представляет собой метиленовую группу, Т 2 представляет собой алкиленовую группу (например, метилен или этилен), а G выбран из группы, состоящей из 2-фурила; 2,4-диоксо-1,4-дигидро-3(2 Н)хиназолинила; 3-оксо[1,2,4]триазоло[4,3-а]пиридин-2(3 Н)-ила; 1-оксо-2(1 Н)-фталазинила; 7 метил-5-оксо-5 Н-[1,3]тиазол[3,2-а]пиримидин 6-ила; 6-хлор-2-оксо-2,3-дигидро-1 Н-индол-5 ила; 2-оксо-2,3-дигидро-1 Н-индол-5-ила; 2-oкco-1,2,3,4-тетрагидро-6-хинолинила; 3-бензил-5 метил-2,6-диоксо-3,6-дигидро-1(2 Н)-пиримидинила; 1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2 ила; 1,1,3-триоксо-1,3-дигидро-2 Н-1,2-бензизотиазол-2-ила; 1,3-диоксо-3,6-дигидропирроло[3,4-с]-карбазол-2(1 Н)-ила; 1,3-диоксо-1,3-дигидро-2 Н-бензо[с]изоиндол-2-ила; 3,5-диметил 2,6-диоксо-3,6-дигидро-1(2 Н)-пиримидинила. Среди перечисленных соединений предпочтительны такие, в которых цианогруппа присоединена в 5- или 6-положениях индольной кольцевой системы, особенно в которых цианогруппа присоединена в положении 5. Среди предпочтительных соединений согласно изобретению особо следует упомянуть следующие: гидрохлорид 3-(1-[2-(7-метил-5-оксо(5 Н)-[1,3]тиазоло-[3,2-а]пиримидин-6-ил)этил]3-пирролидинилметил)-1 Н-индол-5-карбонитрила,гидрохлорид 3-1-[2-(6-хлор-2-оксо-2,3-дигидро-1H-индол-5-ил)этил]-3-пирролидинил метил)-1 Н-индол-5-карбонитрила. Настоящее изобретение относится также к способу получения соединений формулы (I),который характеризуется тем, что в качестве исходного материала используют соединение формулы (II): в которой R1, R2 и T1 имеют значения, указанные для формулы (I),которое подвергают взаимодействию в восстановительной среде, с альдегидом формулы (III)(III) в котором G имеет значения, указанные для формулы (I), a Т 2' представляет связь или линейную, либо разветвленную (C1-C5)алкиленовую группу,или в основной среде с галогенированным соединением формулы (IV)(IV) в котором Т 2 имеет значения, указанные для формулы (I), a Hal представляет собой атом галогена,до получения соединения формулы (I),или подвергают взаимодействию в основной среде с соединением формулы (V)(V) в котором Т 2 имеет значения, указанные для формулы (I), Hal представляет собой галоген, а Р' представляет собой аминозащитную группу,с получением соединения формулы (VI) в которой R1, R2, T1, T2 и Р' имеют указанные выше значения,далее соединение формулы (VI), после защиты первичной аминогруппы, подвергают конденсации с циклической группой, являющейся предшественником группы G в формуле(I), с получением соединения формулы (I/a) особой формы соединения формулы (I), в которой R1, R2, T1 и T2 имеют значения, указанные ранее, а G' представляет собой группу, имеющую значения указанные для G в формуле (I),причем следует имеет в виду, что группа G' присоединена к T2 с помощью атома азота,соединения, соответствующие формулам(I/a) и (I),если необходимо, могут быть очищены в соответствии с традиционной методикой очистки,если необходимо, разделены на изомеры согласно традиционным методам разделения,если желательно, превращены в соли присоединения фармацевтически приемлемых кислот и оснований. Кроме этого, настоящее изобретение относится к фармацевтическим композициям, со 003831 6 держащим, в качестве активного ингредиента,по крайней мере, одно соединение формулы (I),индивидуально или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми наполнителями или носителями. Среди фармацевтических композиций, согласно настоящему изобретению, следует особо упомянуть пригодные для орального, парентерального или назального применения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, свечи, кремы, мази, дермальные гели и т.д. Подходящая дозировка может изменяться в соответствие с возрастом и весом пациента,природой и состоянием нарушения и способа применения, который может быть оральным,назальным, ректальным или парентеральным. Единичная дозировка обычно составляет от 0,1 до 500 мг для лечения, от 1 до 3 приемов в течение 24 ч. Следующие ниже примеры иллюстрируют настоящее изобретение, при этом не ограничивая его объема. В качестве исходных веществ используются известные продукты, или предварительно полученные известными способами. Приготовление А. 3-[(3-Пирролидинил)метил]-1 Н-индол-5-карбонитрил. Гидрогенолиз 0,32 моля (96 г) 3-(1-бензил 3-пирролидинилметил)-1H-индол-5 карбонитрила (описанного в заявке не ЕР 610 134) проводили в 1,7 л этанола в присутствии 9,6 г углерода, содержащего 20% влажного гидроксида палладия (катализатор Pearlman) и 0,32 моля хлористо-водородной кислоты, в среде этанола при 70 С и атмосферном давлении. После поглощения теоретического количества водорода, катализатор отфильтровывали и затем фильтрат концентрировали. Основание осаждали с помощью 1N раствора гидроксида натрия и экстрагировали дихлорметаном с получением целевого продукта. Приготовление В. Трет-бутил 2-бромэтилкарбамат. В инертной атмосфере и при температуре окружающей среды, готовили раствор, содержащий 62 ммоля (10 г) N-(трет-бутоксикарбонил)этаноламина в 100 мл ацетонитрила и в полученный раствор добавляли 74,5 ммоля (24,7 г) тетрабромэтана. После этого прикапывали 68,2 ммоля (17,9 г) трифенилфосфина, растворенного в 150 мл ацетонитрила. Реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин и затем концентрировали. Остаток переносили в изопропиловый эфир и, после фильтрации фильтрат подвергали концентрированию с получением целевого продукта. 7 Пример 1. Оксалат 3-[-1-(2-фурилметил)3-пирролидинил]метил-1 Н-индол-5-карбонитрила. При комнатной температуре и в инертной атмосфере, 47,3 ммоля (10 г) 3-[3-пирролидинилметил]-1 Н-индол-5-карбонитрила (описанного в приготовлении А) растворяли в 650 мл 1,2-дихлорэтана и затем добавляли 47,3 ммоля (4,26 г) фуральдегида. Полученную смесь перемешивали в течение 10 мин и добавляли 66,2 ммоля (13,79 г) триацетоксиборгидрида натрия. Через 30 мин при температуре окружающей среды добавляли 350 мл насыщенного раствора бикарбоната натрия. Органическую фазу отделяли, промывали водой и сушили над сульфатом магния. Очистку проводили методом хроматографии на диоксиде кремния, используя в качестве элюента смесь дихлорметан/метанол/аммиак в соотношении 98/2/0,2. Полученное соединение превращали в соль с помощью одного эквивалента раствора оксалиновой кислоты в этаноле. Температура плавления: 120-122 С Элементный микроанализ: С НN Теорет., % 63,79 5,35 10,63 Практ., % 63,54 5,58 10,37 Пример 2. Гидрохлорид 3-[(1-2-[2,4-диоксо-1,4-дигидро-3(2 Н)-хиназолинил]этил-3-пирролидинил)метил]-1 Н-индол-5-карбонитрила. В инертной атмосфере и при температуре окружающей среды, 47,3 ммоля (10 г) 3-[3 пирролидинилметил]-1 Н-индол-5-карбонитрила, 47,3 ммоля (9,97 г) 3-(2-хлорэтил)-2,4(1 Н,3 Н)хиназолиндиона и 47,3 ммоля (3,73 г) бикарбоната натрия растворяли в 100 мл диметилформамида и полученную смесь перемешивали в течение 6 ч при 100 С. Реакционную смесь концентрировали и остаток переносили в дихлорметан. Органическую фазу промывали водой и затем насыщенным раствором хлористого натрия, после чего сушили над сульфатом магния. Очистку проводили методом хроматографии на диоксиде кремния, с использованием в качестве элюента смеси дихлорметан/метанол/аммиак в соотношении 95/5/0,5. Полученное соединение превращали в соль с помощью одного эквивалента раствора хлористо-водородной кислоты в этаноле. Температура плавления: 152-154 С Элементный микроанализ: С НN Сl Теорет., % 64,07 5,38 15,57 7,88 Практ., % 63,81 5,34 15,20 7,64 Пример 3. Гидрохлорид 3-[(1-2-[3-оксо[1,2,4]триазоло-[4,3-а]пиридин-2(3 Н)-ил]этил 3-пирролидинил)метил]-1 Н-индол-5-карбонитрила. Целевой продукт получали согласно методике, описанной в примере 2, заменяя 3-(2 003831(1H)фталазинил]этил-3-пирролидинил)метил]1 Н-индол-5-карбонитрила. Целевой продукт получали согласно методике, описанной в примере 2, заменяя 3-(2 хлорэтил)-2, 4-(1H,3 Н)хиназолиндион на 2-(2 хлорэтил)-1(2 Н)фталазинон. Температура плавления: 125-127 С Элементный микроанализ: С НN Сl Теорет., % 66,43 5,57 16,14 8,17 Практ., % 66,74 5,63 15,79 8,27 Пример 5. Гидрохлорид 3-(1-[2-(7-метил 5-оксо-(5 Н)-[1,3]тиазоло-[3,2-а]пиримидин-6 ил)этил]-3-пирролидинилметил)-1 Н-иднол-5 карбонитрила. Целевой продукт получали в соответствии с методикой, описанной в примере 2, заменяя 3(2-хлорэтил)-2,4-(1H,3 Н)хиназолиндион на 6-(2 хлорэтил)-7-метил-5 Н-[1,3]тиазоло[3,2-а]пиримидин-5-он. Температура плавления: 234-236 С Элементный микроанализ: С НS Сl Теорет., % 60,85 5,33 15,43 7,06 7,81 Практ., % 59,83 5,38 14,69 6,90 7,69 Пример 6. Гидрохлорид 3-(1-[2-(6-хлор-2 оксо-2,3-дигидро-1 Н-индол-5-ил)этил]-3-пирролидинилметил)-1 Н-индол-5-карбонитрила. Целевой продукт получали в соответствии с методикой, описанной в примере 2, заменяя 3(2-хлорэтил)-2,4-(1 Н,3 Н)хиназолиндион на 6 хлор-5-(2-хлорэтил)-1,3-дигидро-2 Н-индол-2-он. Температура плавления: 115-117 С Элементный микроанализ: С НN Сl Теорет., % 63,30 5,31 12,30 15,57 Практ., % 63,57 5,42 12,06 15,27 Пример 7. Гидрохлорид 3-(1-[2-(2-оксо 2,3-дигидро-1 Н-индол-5-ил)этил]-3-пирролидинилметил)-1 Н-индол-5-карбонитрила. Целевой продукт получали в соответствие с методикой, описанной в примере 2, заменяя 3(2-хлорэтил)-2,4-(1 Н,3 Н)хиназолиндион на 5-(2 хлорэтил)-1,3-дигидро-2 Н-индол-2-он. Температура плавления: 118-120 С Элементный микроанализ: С Н 9 Пример 8. Гидрохлорид 3-(1-[2-(2-оксо 1,2,3,4-тетрагидро-6-хинолинил)этил]-3-пирролидинилметил)-1 Н-индол-5-карбонитрила. Целевой продукт получали в соответствие с методикой, описанной в примере 2, заменяя 3(2-хлорэтил)-2,4-(1 Н,3 Н)хиназолиндион на 6-(2 бромэтил)-3,4-дигидро-2(1 Н)хинолинон. Температура плавления: 110 С (разл.) Элементный микроанализ: С НN Сl Теорет., % 69,03 6,26 12,88 8,15 Практ., % 69,10 6,40 12,31 8,19 Пример 9. 3-[(1-2-[3-Бензил-5-метил-2,6 диоксо-3,6-дигидро-1(2 Н)пиримидинил]этил-3 пирролидинил)метил]-1 Н-индол-5-карбонитрил. Целевой продукт получали в соответствии с методикой, описанной в примере 2, заменяя 3(2-хлорэтил)-2,4-(1 Н,3 Н)-хиназолиндион на 1 бензил-3-(2-хлорэтил)-5-метил-2,4-(1 Н,3 Н)пиримидиндион. Температура плавления: 130-132 С Элементный микроанализ: С Н(10 г) 3-[(3-пирролидинил)метил]-1H-индол-5 карбонитрила, 47,3 ммоля (9,95 г) продукта,описанного в примере приготовления В, и 1,55 мл 2-бутанона смешивали друг с другом и затем добавляли 47,3 ммоля (4,45 г) бикарбоната калия. Полученную смесь перемешивали в течение 2 ч при 80 С. После гидролиза и разделения,органическую фазу промывали насыщенным раствором хлористого натрия, сушили над сульфатом магния, фильтровали и концентрировали. Очистку осуществляли методом хроматографии на диоксиде кремния, используя в качестве элюента смесь дихлорметан/метанол/аммиак в соотношении 97/3/0,3, с получением целевого продукта. Стадия 2. 3-[1-(2-Аминоэтил)-3-пиррoлидинил]метил-1 Н-индол-5-карбонитрил. При температуре окружающей среды 44,4 ммоля (5 г) продукта, описанного на предыдущей стадии, растворяли в смеси 150 мл 3N раствора хлористо-водородной кислоты и 100 мл этилацетата. Полученную смесь перемешивали при указанной температуре в течение 30 мин. После разделения на две фазы, кислотную фазу концентрировали. Остаток переносили в 0,1N раствор гидроксида натрия и затем экстрагировали дихлорметаном. Органическую фазу про 003831 10 мывали водой и затем насыщенным раствором хлористого натрия, после чего сушили над сульфатом магния, фильтровали и концентрировали с получением целевого продукта. Стадия 3. Гидрохлорид 3-(1-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-3-пирролидинилметил)-1 Н-индол-5-карбонитрила. 11,2 ммоля (3 г) продукта, полученного на предыдущей стадии, 12,3 ммоля (1,82 г) фталевого ангидрида и затем 28 мл ледяной уксусной кислоты смешивали в указанной последовательности. Полученную реакционную смесь нагревали с обратным холодильником в течение 1 ч и затем уксусную кислоту выпаривали. Остаток переносили в 1N раствор гидроксида натрия и экстрагировали дихлорметаном. Органическую фазу промывали водой и затем насыщенным раствором хлористого натрия, после чего сушили над сульфатом магния, фильтровали и концентрировали. Очистку осуществляли методом хроматографии на диоксиде кремния,используя в качестве элюента смесь дихлорметан/метанол/аммиак в соотношении 97/3/0,3. Полученный продукт превращали в соль с помощью одного эквивалента хлористоводородной кислоты в этаноле. Температура плавления: 140-142 С Элементный микроанализ: С НN Сl Теорет., % 66,28 5,33 12,88 8,15 Практ., % 65,68 5,42 12,30 8,32 Пример 11. Гидрохлорид 3-(1-[2-(1,1,3 триоксо-1,3-дигидро-2 Н-1,2-бензизотиазол-2 ил)этил]-3-пирролидинилметил)-1 Н-индол-5 карбонитрила. Целевой продукт получали в соответствие с методикой, описанной в примере 10, заменяя фталевый ангидрид на метил 2-хлорсульфонилбензоат. Пример 12. Гидрохлорид 3-(1-[2-(1,3 диоксо-1,3-дигидро-2 Н-бензо[е]изоиндол-2 ил)этил-3-пирролидинилметил)-1 Н-индол-5 карбонитрила. Целевой продукт получали в соответствие с методикой, описанной в примере 10, заменяя фталевый ангидрид, на нафто[1,2-с]фуран-1,3 дион. Температура плавления: 112-116 С Элементный микроанализ: С НN Сl Теорет., % 69,34 5,20 11,55 7,31 Практ., % 68,58 5,49 11,10 6,90 Пример 13. Гидрохлорид 3-[(1-2-[6 метил-1,3-диоксо-3,6-дигидропирроло[3,4-с]карбазол-2(1 Н)-ил]этил-3-пирролидинил)метил]1 Н-индол-5-карбонитрила. Целевой продукт получали в соответствии с методикой, описанной в примере 10, заменяя фталевый ангидрид, на 1 Н-фуро[3,4-с]карбазол 1,3(6 Н)дион. Пример 14. Гидрохлорид 3-(1-[2-(3,5 диметил-2,6-диоксо-3,6-дигидро-1(2 Н)пиримидинил)этил]-3-пирролидинилметил)-1 Н-индол 5-карбонитрила. Целевой продукт получали согласно методике, описанной в примере 2, заменяя 3-(2 хлорэтил)-2,4-(1 Н,3 Н)хиназолиндион на 3-(2 хлорэтил)-1,5-диметил-2,4-(1 Н,3 Н)пиримидиндион. Элементный микроанализ: С НN Сl Терет., % 61,75 6,12 16,37 8,28 Практ., % 61,31 6,54 15,94 8,08 Аналогичным образом получали следующие соединения. Пример 15. Гидрохлорид 3-[(1-2-[2,4 диоксо-1,4-дигидро-3(2 Н)хиназолинил]этил-3 пирролидинил)метил]-1H-индол-6-карбонитрила. Пример 16. Гидрохлорид 3-[1-[2-(7-метил-5-оксо-(5 Н)-[1,3]тиазоло-[3,2-а]пиримидин 6-ил)этил]-3-пирролидинилметил)-1 Н-индол-6 карбонитрила. Пример 17. Гидрохлорид 3-[1-[2-(6-хлор 2-оксо-2,3-дигидро-1H-индол-5-ил)этил]-3-пирролидинилметил)-1H-индол-6-карбонитрила. Пример 18. Гидрохлорид 3-[1-[2-[1,3 диоксо-1,3-дигидро-(2 Н)изоиндол-2-ил)этил]-3 пиролидинилметил)-1H-индол-6-карбонитрила. Пример 19. Гидрохлорид 3-[(1-2-[6 метил-1,3-диоксо-3,6-дигидропирроло[3,4-с]карбазол-2(1 Н)-ил]этил-3-пирролидинил)метил]1 Н-индол-6-карбонитрила. Пример 20. Гидрохлорид 3-(1-[2-(3,5-диметил-2,6-диоксо-3,6-дигидро-1(2 Н)пиримидинил)этил]-3-пирролидинилметил)-1H-индол-6 карбонитрила. Фармакологическое исследование Пример А. Определение сродства к сайтам повторного захвата серотонина у крыс. Сродство соединений согласно изобретению определяли с помощью конкурентных экспериментов с [3 Н]-пароксетином. Мембраны готовили в трех экземплярах из фронтальных участков коры головного мозга крыс и инкубировали в присутствии 0,25 нМ [3 Н]-пароксетина и холодного лиганда в общем объеме 0,4 мл, в течение 2 ч при 25 С. Инкубационный буфер содержал 50 мМ TRIS-НСl (рН 7,4), 120 мМNaCl и 5 мМ KСl. Неспецифическое связывание определяли с использованием 10 мкМ циталопрама. После завершения инкубации, смесь фильтровали через фильтры и трижды промывали холодным буфером, порциями по 5 мл. Радиоактивность на фильтрах определяли с по 12 мощью сцинтилляционного счетчика. Изотермы связывания анализировали методом нелинейной регрессии с целью определения значений IC50. Полученное значение преобразовывали в константу диссоциации (Ki) с использованием уравнения Cheng-Prusoff:(0,13 нМ). Соединения согласно изобретению проявляли очень высокое сродство к сайтам захвата поглощения серотонина. Так например, сродство соединения примера 6 составило 4x10-10M. Пример В. Тест на способность мышей прятать шарики (Marble-burying test). Этот тест позволяет оценить способность фармакологических агентов ингибировать поведение мышей, касающееся укрывания шариков,причем такое ингибирование предсказывает антидепрессантное и/или противоимпульсивное действие. Самцов мышей разновидности NMRJ,весом 20-25 г, в день проведения эксперимента помещали индивидуально в блоки Macrolon(30 х 18 х 19 см), содержащие слой опилок (5 см) и покрытые перфорированной плексигласовой плитой. 24 стеклянных шарика типа тигровый глаз равномерно распределяли на поверхности опилок по периферии бокса. Через 30 мин исследования животных вынимали из бокса и подсчитывали число спрятанных шариков. Результаты. Показано, что соединения настоящего изобретения ингибируют спонтанное поведение мышей, касающееся укрывания шариков. Так,например, соединения примеров 6 и 7 обладают значением ED50 (50% эффективная доза) 3,8 и 1,5 мг/кг соответственно. Пример С. Фармацевтическая композиция. Композиция для приготовления 1000 таблеток содержала 10 мг активного ингредиента: Соединение примера 6 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) в которой R1 и R2, каждый независимо друг от друга, представляет атом водорода или линейную либо разветвленную (C1-C6)алкильную группу, 13T1 и Т 2 независимо друг от друга представляют линейную или разветвленную (C1-C6)алкиленовую группу,G представляет гетероциклическую группу формулыили в которых W1-W5 и X1-X4 выбраны таким образом, чтобы образовалась химически стабильная группа, и имеют следующие значения:W1, W2 и W3, каждый независимо друг от друга, представляет атом азота или группу CR5,NR4 или СО,W4 представляет атом азота или группу СR3, NR4 или СО,W5 представляет атом углерода или азота,X1 представляет связь, атом азота или группу СR3 или NR4,Х 2-Х 4, каждый независимо друг от друга,представляет группу СR3, NR4, СО, SR4 или SO2 либо атомы кислорода, серы или азота,R3 представляет водород или атом галогена, либо линейную или разветвленную (C1C6)алкильную группу, гидроксильную группу,линейную или разветвленную (C1-C6)пергалоалкильную группу, нитрогруппу, либо аминогруппу (необязательно замещенную одной или двумя группами, выбранными из линейного или разветвленного (C1-C6)алкила или бензила),R4 представляет атом водорода или линейную или разветвленную (C1-C6)алкильную группу, необязательно замещенную арильную группу или необязательно замещенную арилалкильную группу,R5 представляет группу R3 либо две соседние группы R5 совместно с соединенными с ними атомами углерода образуют насыщенную,частично ненасыщенную или ненасыщенную моно- или бициклическую группу, необязательно содержащую от 1 до 5 гетероатомов, выбранных из азота, кислорода и серы, причем указанная группа необязательно замещена одной или более группами, выбранными из R3 или оксогруппы,при этом в формулахиприсутствует по крайней мере один гетероатом, пунктирные линии указывают, что группы могут содержать ненасыщенную связь или множество конъюгированных или неконъюгированных ненасыщенных связей и, если ненасыщенная связь отсутствует, оставшиеся валентности занимают атомы водорода, причем группыисоединены с Т 2 посредством одной из своих кольцевых связей,их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований. 2. Соединения формулы (I) по п.1, в которой цианогруппa присоединена в 5 положении 14 индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований. 3. Соединения формулы (I) по п.1, в которой цианогруппа присоединена в 6 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований. 4. Соединения формулы (I) по п.1, в котором R1 и R2 каждый представляет атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований. 5. Соединения формулы (I) по п.1, в которой T1 представляет метиленовую группу, их энантиомеры и диастереоизомеры, а также их соли присоединения фармацевтически приемлемых кислот или оснований. 6. Соединения формулы (I) по п.1, в которой G выбран из следующих групп: 2-фурил, 2,4-диоксо-1,4-дигидро-3(2 Н)-хиназолинил; 3-оксо-[1,2,4]триазоло[4,3-a]пиридин-2(3 Н)-ил; 1-oксо-2(1 Н)фталазинил; 7-метил 5-оксо-5 Н-[1,3]тиазоло[3,2-а]пиримидин-6-ил; 6-хлор-2-оксо-2,3-дигидро-1 Н-индол-5-ил; 2-оксо-2,3-дигидро-1 Н-индол-5-ил; 2-оксо-1,2,3,4 тетрагидро-6-хинолинил; 3-бензил-5-метил-2,6 диоксо-3,6-дигидро-1(2 Н)пиримидинил; 1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил; 1,1,3-триоксо-1,3-дигидро-2 Н-1,2-бензизотиазол-2-ил; 1,3-диоксо-3,6-дигидропирроло[3,4-с]карбазол 2-(1 Н)-ил; 1,3-диоксо-1,3-дигидро-2 Н-бензо[с]изоиндол-2-ил; 3,5-диметил-2,6-диоксо-3,6 дигидро-1(2 Н)пиримидинил,а также их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 7. Соединения формулы (I), в которой R1 иR2 каждый представляет атом водорода, T1 представляет метиленовую группу, Т 2 представляет алкиленовую группу, а G выбран из группы, состоящей из 2-фурила, 2,4-диоксо-1,4 дигидро-3(2 Н)хиназолинила; 3-оксо-[1,2,4]триазоло[4,3-а]пиридин-2(3 Н)-ила; 1-оксо-2(1 Н)фталазинила; 7-метил-5-оксо-5 Н-[1,3]тиазоло[3,2-а]пиримидин-6-ила; 6-хлор-2-оксо-2,3-дигидро-1 Н-индол-5-ила; 2-оксо-2,3-дигидро-1 Ниндол-5-ила; 2-оксо-1,2,3,4-тетрагидро-6-хинолинила; 3-бензил-5-метил-2,6-диоксо-3,6-дигидро-1(2H)пиримидинила; 1,3-диоксо-1,3-дигидро 2 Н-изоиндол-2-ила; 1,1,3-триоксо-1,3-дигидро 2 Н-1,2-бензизотиазол-2-ила; 1,3-диоксо-3,6-дигидропирроло[3,4-с]карбазол-2-(1 Н)-ила; 1,3-диоксо-1,3-дигидро-2 Н-бензо-[с]изоиндол-2-ила; 3,5-диметил-2,6-диоксо-3,6-дигидро-1(2 Н)пиримидинила,а также их энантиомеры и диастереоизомеры и их соли присоединения фармацевтически приемлемых кислот или оснований. 8. Соединения формулы (I) по п.7, в которых цианогруппа присоединена в 5 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры и соли присоединения фармацевтически приемлемых кислот или оснований. 9. Соединения формулы (I) по п. 1, в которых циано-группа присоединена в 6 положении индольной кольцевой системы, их энантиомеры и диастереоизомеры, а также соли присоединения фармацевтически приемлемых кислот или оснований. 10. Соединение формулы (I) по п.1, представляющее собой гидрохлорид 3-(1-[2-(7 метил-5-оксо-(5 Н)-[1,3]тиазоло[3,2-а]пиримидин-6-ил)этил]-3-пирролидинилметил)-1 Н-индол-5-карбонитрила. 11. Соединение формулы (I) по п.1, представляющее собой гидрохлорид 3-(1-[2-(6 хлор-2-оксо-2,3-дигидро-1 Н-индол-5-ил)этил] 16 3-пирролидинилметил)-1 Н-индол-5-карбонитрила. 12. Фармацевтические композиции, включающие, в качестве активного ингредиента по крайней мере одно соединение по любому из пп.1-11 как таковое или в комбинации с одним или более инертными, нетоксичными фармацевтически приемлемыми эксципиентами или носителями. 13. Фармацевтические композиции по п.12,включающие по крайней мере один активный ингредиент по любому из пп.1-11, предназначенные для производства медикаментов, используемых в качестве ингибиторов повторного захвата серотонина при лечении депрессий, обсессивно-компульсивных нарушений, фобий,импульсивных нарушений, связанных с неправильным употреблением лекарственных средств, булимической неврастении и состояния тревоги.
МПК / Метки
МПК: A61P 25/00, A61K 31/404, C07D 401/14
Метки: содержащие, серотонина, соединения-ингибиторы, захвата, способ, цианоиндольные, фармацевтические, композиции, получения, повторного
Код ссылки
<a href="https://eas.patents.su/9-3831-cianoindolnye-soedineniya-ingibitory-povtornogo-zahvata-serotonina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Цианоиндольные соединения-ингибиторы повторного захвата серотонина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Произодное аминотетралина для терапии сердечно-сосудистых заболеваний
Следующий патент: Ген-доставочный комплекс для чрескожной доставки чужеродного генетического материала в антиген-презентирующие клетки и способы его использования
Случайный патент: Твердая дозированная форма в виде таблетки и способ ее приготовления













