Применение димирацетама для лечения остеоартрита и связанных с ним заболеваний
Формула / Реферат
1. Применение димирацетама для лечения и/или профилактики хронической боли, вызванной остеоартритом или ревматоидным артритом.
2. Применение по п.1 в виде единиц дозирования, используемых для введения перорально, в которых количество димирацетама составляет от 10 до 300 мг/кг; внутримышечно, в которых количество димирацетама составляет от 5 до 150 мг/кг; внутривенно, в которых количество димирацетама составляет от 2 до 60 мг/кг.
3. Применение по п.1 в виде единиц дозирования, используемых для введения перорально, в которых количество димирацетама составляет от 500 до 15000 мг; внутримышечно, в которых количество димирацетама составляет от 250 до 7500 мг; внутривенно, в которых количество димирацетама составляет от 100 до 3000 мг.
4. Применение димирацетама для производства лекарственного средства в препаративной форме для лечения и/или профилактики хронической боли, вызванной остеоартритом или ревматоидным артритом.
5. Применение по п.4, в котором препаративную форму выбирают из таблеток, капсул, пероральных форм, порошков, гранул, пилюль, жидких растворов для инъекции или инфузий, суспензий, эмульсий, сиропов, эликсиров, сухих порошков или гранулятов, форм с замедленным высвобождением, мазей, кремов, лосьонов, гелей, паст, мембран для применения через кожу или медицинских пластырей.
Текст
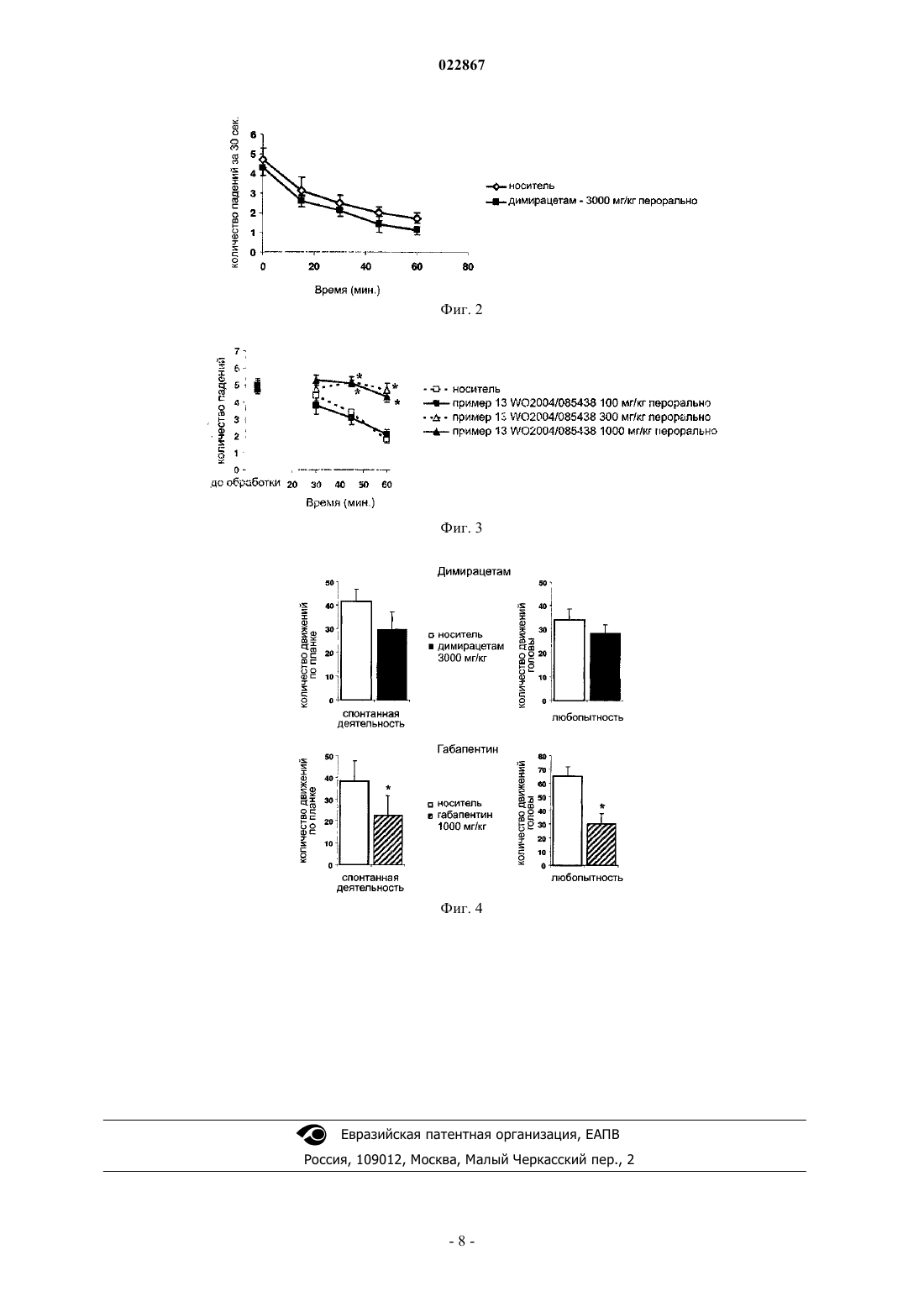
ПРИМЕНЕНИЕ ДИМИРАЦЕТАМА ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА И СВЯЗАННЫХ С НИМ ЗАБОЛЕВАНИЙ Изобретение относится к области фармакологического лечения хронической боли. Димирацетам является хиральным соединением. В объеме настоящего изобретения термин "димирацетам" подразумевает изолированные (R)- или (S)-энантиомеры димирацетама или их смеси, в которых два энантиомера присутствуют в равных или различных количествах. Объектом изобретения является применение димирацетама или его фармацевтически приемлемого сольвата для лечения и/или профилактики хронической боли, вызванной остеоартритом, ревматическим артритом,формами аутоиммунного остеоартроза, а также для производства применяемого для этих целей лекарственного средства в препаративной форме. Область изобретения Настоящее изобретение относится к области фармакологического лечения хронической боли. Предпосылка изобретения В отличие от острых болей, имеющих важное физиологическое значение и предупреждающих организм о приближающейся опасности или повреждении, хронические боли не вовлечены в какие-либо защитные действия. Хронические боли можно разделить на две основные категории: хронические воспалительные боли и невропатические боли. Последние обусловлены прямыми нарушениями нервных путей "noxa" (пагубными для здоровья факторами - лат.), которые могут иметь инфекционный, метаболический, сосудистый или другой характер. При хронических воспалительных болях поврежденные ткани высвобождают альгогенные факторы, которые, в свою очередь, повреждают нервные окончания, создавая паталогический механизм, который поддерживает и усиливает восприятие боли (гиперальгезия) или преобразует в боль другие типы восприятия (аллодиния). Хронические боли невропатологической и воспалительной природы являются важным эпидемиологическим аспектом состояния высокой степени необходимости медицинской помощи; по сути, это терапевтическая область, в настоящее время характеризующаяся лечением невысокой эффективности, которое также плохо переносится. Увеличивается количество пациентов, страдающих от ятрогенных невропатологических болей, индуцированных противоопухолевой терапией, применяемой в современной онкологии. В частности, таксол-производные препараты, цисплатин и винкристин - среди препаратов, наиболее часто индуцирующих болезненную невропатию. В настоящее время не существует эффективного и/или хорошо переносимого лечения для боли таких видов. По сути, классические антиэпилептические или антидепрессантные агенты (вещества), успешно применяемые при других формах невропатических болей, такие как ламотригин (Renno S.I. 2006, J. Clin. Oncol. ASCO Annual Meeting Proceeding, Part I, vol. 24, No. 18, S. 8530),габапентин (Wong G.Y. 2005, J. Clin. Oncol. ASCO Annual Meeting Proceeding, Part I, vol. 23,No. 16S:8001) или нортриптилин (Hammack J.E. 2002, Pain 98: 195-203), совершенно неудовлетворительны на основании их терапевтического индекса. Нуклеозидные аналоги - нуклеозидные ингибиторы обратной транскриптазы (Nucleoside analoguereverse transcriptase inhibitors) (ddC, d4T, AZT) обычно применяются в качестве антивирусных препаратов при лечении СПИД. Эти препараты обычно вызывают сопротивление или периферические невропатологии различной степени тяжести после продолжительного лечения. Как и в случае химиотерапевтических агентов (веществ), эти симптомы могут быть столь сильны, что индуцируют сокращение или перерывы этих терапевтических методов, спасающих жизни. Особенности этих невропатологий четко отличаются от невропатологий, индуцированных прогрессированием СПИД; они, по сути, характеризуются внезапным появлением очень интенсивного дискомфортного жжения в кистях рук и ступнях примерно на десятую неделю лечения. ВИЧ-индуцированные невропатологии, напротив, обладают очень медленным развитием (Dubinsky R.М. 1989, Muscle Nerve, 12:856-860). Как и невропатологии, индуцированные химиотерапией, такой вид боли лечить сложно. Трициклический антидепрессант амитриптилин, и блокатор натриевого канала мексилетин, эффективные при различных формах болезненных периферический невропатологии, не оказали какого-либо значительного эффекта на такой тип невропатологической боли (Kieburtz K. 1998, Neurology, 51:16821688). Габапентин проявил некоторую эффективность, однако у пациентов с тяжелыми синдромами редко достигаются удовлетворительные результаты, и требуется дополнительное введение наркотиковreport,http://www.hopkinsaids.edu/publications/report/may012.html). Другие формы невропатических болей могут быть вызваны вирусными инфекциями. Постгерпетическая невралгия, к примеру, вызывается реактивацией вируса ветряной оспы после долгого периода инфекции. Такой вид невропатии характеризуется развитием сильной механической аллодинии, частой потери чувствительности к тепловым раздражителям, и спонтанной прерывистой боли. Интенсивность боли подвергает риску качество жизни пациентов, страдающих от этого состояния. Высоким эпидемиологическим значением обладает боль, относящаяся к цефалгии (головной боли). Она локализуется на голове, лице и шее. Когда цефалгия наступает в виде приступа, с повторяющимися эпизодами, длящимися от нескольких часов до нескольких дней, и связывается с общим заболеванием(болезненным состоянием), она носит название мигрень. Различают несколько форм мигрени, такие как обычная, классическая, гемиплегическая, вертебробазилярная и т.п. Текущее лечение мигрени влечет применение различных видов болеутоляющих агентов (средств),от нестероидных противовоспалительных препаратов (NSAID) до синтетических наркотических препаратов (опиатов), антигистаминных препаратов и производных эрготамина. В последнее десятилетие применяются антагонисты триптана 5 НТ 2; они часто способны заблокировать приступ при его возникновении, будучи своевременно и быстро введены. Все эти виды лечения показывают серьезные ограничения по срокам эффективности и переносимости. В самых тяжелых случаях, при которых приступы боли повторяются много раз в неделю, выполняется упреждающая терапия противоэпилептическими препаратами, бета-блокаторами и антидепрессантными препаратами. Максимальный результат, которого можно достичь такой упреждающей терапией, - снижение на 50% частоты и интенсивности болевых приступов, но не окончательная ремиссия. Воспалительная боль является другой формой хронической боли. Она вызывается выделением медиаторов, которые либо напрямую активируют болевые рецепторы, локализованные на чувствительных нервах, либо снижают их порог активации, таким образом увеличивая их чувствительность к болевым и неболевым раздражителям другой природы. Возбужденные чувствительные нервы могут, в свою очередь, высвободить нейромедиаторы, которые могут стимулировать иммунные клетки, вовлеченные в процесс воспаления, вызывая тем самым высвобождение дополнительных воспалительных медиаторов. Этот феномен, называемый "нейрогенное воспаление", ведет к автоматическому усилению симптоматики у пациента. Остеоартрит является особенно тяжкой и болезненной формой патологии такого типа. Остеоартрит - форма дегенеративного артрита, вызывающая разрушение и возможную потерю хряща одного или более суставов. Большая часть обычных симптомов, относящихся к этой патологии, - боль в пораженном суставе после периодического использования или длительных периодов бездействия (боль ночью и во время отдыха). Даже если наблюдается определенная корреляция между болью и увеличением повреждений в месте соединения, точная этиология такого вида боли до сих пор неясна; в общем-то пациенты со сравнительно слабыми повреждениями суставов страдают от очень интенсивной боли, и наоборот; это наблюдение позволяет предположить, что это не просто воспалительная боль, а также присутствует и невропатологический компонент. Рекомендуемое лечение включает в себя нестероидные противовоспалительные препараты (NSAID), стероиды и опиаты, но применение таких лекарств связано с возникновением тяжких побочных эффектов; вдобавок, они не проявляют полной эффективности во многих случаях (Altman R.D. 2000, Arthritis Rheum. 43:1905-1915). Синдром фибромиалгии (ревматическое нарушение, характеризующееся мышечными и головными болями) является наиболее частой причиной хронической, обширной боли, связанной с дополнительными симптомами, такими как нарушения сна и хроническая усталость (Rao S.G. 2007, Psychopharmacol.Bull. 40:24-67). Около 2% основного населения США страдают фибромиалгией, причем женщины среднего возраста подвергаются особому риску. Пациенты с фибромиалгией демонстрируют множественные аномалии в восприятии боли в экспериментальных условиях как в форме аллодинии, так и в форме гиперальгезии: эти данные наводят на мысль о состоянии сенсибилизированного восприятия боли или повышенной болевой чувствительности. В последнее время прегабалин (pregabalin) и дулоксетин (duloxetin) показали некоторую эффективность при клинических испытаниях по лечению мышечной боли при фибромиалгии (Crofford L.J. 2005,Arthritis Rheum. 52:1264-1273; Maizels M. 2005, Am. Fam. Physician 71:483-490). Тем не менее, в настоящее время медикаментозное лечение по ослаблению боли при фибромиалгии все еще неудовлетворительно (Offenbaecher M. 2005, CNS Spectr. 10:285-297), и в случае с фибромиалгией наблюдается высокий уровень неудовлетворенности в медицинской помощи. Димирацетам (2,5-диоксогексагидро-1 Н-пирроло[1,2-а]имидазол) является бициклическим пирролидиноновым производным формулы (I) Патентная заявка ЕР-А-335483 заявляет его фармацевтическое применение в качестве ноотропного средства, т.е. способного улучшить обучаемость и память человека и животных. Данные кривой зависимости доза-эффект показывают, что ноотропная активность димирацетама имеет тенденцию к уменьшению для принимаемых орально доз, превышающих 10 мг/кг (J. Med. Chem., 1993, 36:4214-4220). Патентная заявка WO-A-93/09120 заявляет процесс приготовления димирацетама и его энантиомеров.WO-A-2004/085438 заявляет ряд производных 2,5-диоксогексагидро-1 Н-пирроло[1,2-а]имидазола; типичным признаком этих соединений является наличие в позиции 3 имидазольного кольца, ароматического карбоциклического или гетероциклического кольца; эти соединения, не выдерживающие целесообразности в лечении болезненных состояний, показывают не полностью удовлетворительный терапевтический индекс. Ввиду вышеупомянутой предпосылки ощущается необходимость новых лекарств, наделенных высокой антигиперальгезической и антиаллодинической активностью против хронической боли и характеризующихся высоким терапевтическим индексом. Также имеется потребность в лечении отдельных форм невропатологической боли, которые не очень хорошо вылечиваются традиционными антигиперальгезическими агентами. Краткое изложение изобретения Было изучено поведение димирацетама в различных дозах относительно ранее описанных к этому соединению, учитывая также возможные вариации токсичности, связанные с новыми дозами. Во время исследований было найдено "фармакологическое окно", в котором димирацетам проявляет сильный регрессионный эффект по отношению к феномену хронической боли невропатологической или воспалительной природы, без проявления какого либо токсического эффекта. Таким образом, раскрывается возможность лечения таких изнуряющих патологий эффективным и, по существу, нетоксичным соединением. Краткое описание графических материалов Фиг 1. MIA-индуцированная остеоартритная боль у крыс: р 0.01 vs группа MIA/контрольная среда. Каждое значение представляет собой среднее значениеS.Е.М. у 18 крыс в двух экспериментах. Фиг. 2. Моторная координация у крыс (rotarod) (тест на вращающемся стержне): каждое значение представляет среднее значениеS.Е.М. количества падений за 30 с в группе из 8 крыс. Фиг. 3. Моторная координация у крыс (тест на вращающемся стержне): р 0.01 vs группа животных, обработанных средой (контрольная группа). Каждое значение представляет среднее значениеS.Е.М. количества падений за 30 с в группе из 8 крыс. Фиг. 4. Моторная активность у мышей (кассейная доска): р 0.01 vs группа животных, обработанных средой (контрольная группа). Каждое значение представляет среднее значениеS.Е.М. у 18 мышей. Тест выполнялся 30 мин после орального введения препаратов. Подробное описание изобретения Первым объектом настоящего изобретения является использование димирацетама в производстве медикамента, полезного при лечении и профилактике хронической боли, индуцированной остеоартритом или ревматоидным артритом. Также изобретение касается димирацетама для использования в лечении и/или профилактике хронической боли, индуцированной остеоартритом или ревматоидным артритом. Следующим объектом настоящего изобретения является способ лечения и/или предотвращения хронической боли, индуцированной остеоартритом или ревматоидным артритом, состоящий из введения фармацевтически эффективной дозы димирацетама пациенту при необходимости. Димирацетам является хиральным соединением. В объеме настоящего изобретения термин "димирацетам" подразумевает изолированные (R)- или (S)-энантиомеры димирацетама или их смеси, в которых два энантиомера присутствуют в равных или различных количествах. Таким образом, предполагается,что использование, способ и фармацевтические композиции, являющиеся объектом настоящего изобретения, распространяются на эти смеси или отдельные энантиомеры димирацетама. В соответствии с настоящим изобретением димирацетам может вводиться как таковой, самостоятельно или совместно с любым другим активным компонентом, полезным для лечения или профилактики хронической боли или вызывающим ее заболеваний. При помощи заявленных применения и способов возможно лечить эффективно и с высокой безопасностью хроническую боль как невропатологической, так и воспалительной природы, индуцированной остеоартритом или ревматоидным артритом. Особенной эффективностью обладает, и поэтому является предпочтительным в объеме изобретения, лечение боли, индуцированной остеоартритом. В объеме изобретения в настоящем лечении антигиперальгезивный эффект димирацетама проявляется в объемах доз для перорального приема от 10 до 300 мг/кг, предпочтительно от 100 до 300 мг/кг. Антигиперальгезивный эффект также может быть достигнут путями введения, отличными от перорального, т.е. внутримышечно или внутривенно: в этих случаях димирацетам вводится в количествах, позволяющих получить в крови уровень (препарата), сравнимый с таковым при пероральном введении 10-300 мг/кг. Эталонные величины, применимые при внутримышечном введении, - от примерно 5 до примерно 150 мг/кг, эталонные величины, применимые при внутривенном введении, - от примерно 2 до примерно 60 мг/кг. Изобретение, таким образом, охватывает фармацевтические композиции димирацетама, применимые при вышеупомянутых лечениях. Эти композиции содержат количество этого активного вещества,большее, чем ранее предлагалось для ноотропной активности. Количества активного вещества, выраженные в мг/кг, приведены выше. Эти композиции имеют единицу дозировки, применимую для введения вышеуказанных доз. Обычно они содержат от 500 до 15000 мг в случае композиций для перорального применения; от 250 до 7500 мг в случае внутримышечных композиций; от 100 до 3000 мг в случае внутривенных композиций. Димирацетам может быть фармацевтически сформулирован (создан) в соответствии с известными методологиями. Исходя из нужд лечения, могут быть выбраны различные фармацевтические композиции. Такие композиции могут приготавливаться путем смешивания и могут быть надлежащим образом приспособлены для перорального или парентерального введения и, как таковые, могут вводиться в форме таблеток, капсул, препаратов для перорального приема, порошков, гранул, пилюль, жидких растворов для инъекции или вливания, суспензий и суппозиториев. Таблетки и капсулы для перорального введения обычно поставляются в единицах дозировки и могут содержать конвенционные наполнители, такие как связующие вещества, наполнители, разбавители,таблетировочные агенты, лубриканты, детергенты, дезинтегрирующие агенты, красители, вкусовые и увлажняющие агенты. Таблетки могут быть покрыты оболочкой в соответствии с методами, широко известными из уровня техники. Подходящие наполнители включают, к примеру, целлюлозу, маннитол, лактозу и подобные агенты. Подходящие дезинтегрирующие агенты включают крахмал, поливинилпирролидон и производные крахмала, такие как натрия гликолят крахмала. Подходящие лубриканты включают, к примеру, стеарат магния. Подходящие увлажнители включают, к примеру, сульфат лаурила натрия. Эти твердые композиции для перорального введения могут приготавливаться конвенционными методами смешивания, заполнения или таблетирования. Операции смешивания могут повторяться для диспергирования активного агента в композициях с большим количеством наполнителя. Эти операции являются конвенционными. Пероральные жидкие композиции могут предоставляться в виде, к примеру, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или в форме сухого продукта для восстановления водой или подходящим жидким носителем во время использования. Жидкие композиции могут содержать конвенционные добавки, такие как суспендирующие агенты,к примеру сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу,стеарат алюминия в виде геля или гидрогенезованные (гидрированные) съедобные жиры, эмульгирующие агенты, к примеру лецитин, сорбитмоноолеат или гуммиарабик; не водные носители (которые могут включать съедобное масло), к примеру миндальное масло, фракционированное кокосовое масло, масляные эфиры, такие как эфиры глицерина, пропиленгликоль или этиловый спирт; консерванты, к примеру метил- или пропил-р-гидроксибензоат или сорбиновая кислота, а если нужно, то конвенционные вкусовые добавки или красители. Пероральные формулировки также включают конвенционные формы с замедленным высвобождением, такие как таблетки или гранулы с энтеральным покрытием. Для парентерального введения могут приготовляться жидкостные единицы дозировки, содержащие активные соединения и стерильный носитель. Активные соединения, в зависимости от носителя и концентрации, могут суспендироваться или растворяться. Парентеральные растворы обычно приготовляются растворением соединения в носителе и стерилизацией путем фильтрации, до наполнения подходящих сосудов или ампул и запечатывания. Вспомогательные вещества, такие как местные обезболивающие,консерванты и амортизирующие агенты могут быть преимущественно растворены в носителе. Чтобы увеличить стабильность, композиция может быть заморожена после наполнения сосуда, а вода удалена под вакуумом. Парентеральные суспензии приготовляются, по сути, тем же способом, с той разницей,что активные компоненты могут быть скорее взвешены, чем растворены, в носителе и могут быть стерилизованы под действием оксида этилена перед взвешиванием в стерильном носителе. Поверхностноактивное вещество (surfactant - сурфактант) или увлажнитель (humectant - хумектант) может быть преимущественно включено для облегчения равномерного распространения соединения, описанного в данном изобретении. Последующий способ введения соединения по изобретению относится к области местного лечения. Наружные формы могут содержать, к примеру, мази, кремы, лосьоны, гели, растворы, пасты и/или могут содержать липосомы, мицеллы и/или микросферы. Дополнительный способ введения соединений по изобретению - введение через кожу. Типичные кожные формы включают конвенционные водные и неводные носители, такие как кремы, масла, лосьоны или пасты, или могут быть в форме мембран или медицинских пластырей. Как обычно практикуется, композиции обычно сопровождаются письменными или отпечатанными инструкциями по применению в соответствующем лечении. Примеры настоящего изобретения приводятся далее, исключительно в пояснительных, но не ограничительных целях. Экспериментальная часть 1.1. Артритная боль у крыс. Воспаление суставов было индуцировано внутрисуставным введением 0.1 мл полного адъюванта Фрейнда (CFA) у крыс, подвергнутых обезболиванию (взрослые самцы крыс породы Sprague Dawley,150-200 г, поставщик Harlan). Механическая гиперальгезия была измерена использованием теста давления в лапке через 14 дней после введения CFA (Shan S 2006, Pain 129:64- 75). 1.2. Боли у крыс, связанные с остеоартритом. Остеоартрит был индуцирован единовременным введением 2 мг (в объеме 25 мкл) 2-йодацетата натрия в сустав левого колена подвергнутых обезболиванию крыс (взрослые самцы крыс породы SpragueDawley, 150-200 г, поставщик Harlan) (Fernihough J. 2004, Pain 1, 12:83-93). Эта обработка индуцирует прогрессивную дегенерацию сустава и развитие гиперальгезии, имитацию на гистологическом и пове-4 022867 денческом уровнях того же, что наблюдается у людей. Фармакологический тест был выполнен через 7 дней после обработки. 1.3 а. Оценка механической гиперальгезии: тест давления в лапке. Механическая гиперальгезия у крыс (взрослые самцы крыс породы Sprague Dawley, 150-200 г, поставщик Harlan) определялась использованием теста давления в лапке. Болевой порог определялся анальгезиметром (прибором для измерения болевой чувствительности) (Ugo Basile, Italy), приложение силы,увеличивающейся в постоянном режиме (32 г/с) по методу, описанному Leighton G.Е. 1988, Br. J.Pharmacol. 93:553-560. Раздражитель, вызывающий отдергивание лапки, оценивался до и в разное время после обработки. Результаты представляют значения механических порогов, выраженные в граммах. Во избежание любого возможного повреждения лапки животного максимальная применяемая сила была зафиксирована на 240 г. 1.3b. Оценка механической аллодинии: тест фон Фрея. Крысы (взрослые самцы крыс породы Sprague Dawley, 150-200 г, поставщик Harlan) были помещены в камеру с сетчатым металлическим полом, накрытым пластиковым полом, позволявшим животным свободно ходить, но не прыгать. Механический раздражитель доставлялся в кожу середины подошвы левой задний лапки с использованием электронного аппарата фон Фрея. Прерывание было зафиксировано на 50 г, а скорость увеличения силы (длительность нарастания) была установлена на 20 с. 1.4. Тест Ирвина на крысах. Чтобы убедиться, что введение соединения может индуцировать центрально опосредованные (centrally mediated) побочные эффекты, взрослым самцам крыс породы Sprague Dawley (150-200 г, поставщикHarlan) вводился димирацетам подкожно и перорально, и они наблюдались согласно протоколу "теста Ирвина" (Irwin 1968, Psychopharmacologia, 13:222-257) с использованием систематической и количественной процедурой по определению поведенческих и физиологических изменений, индуцированных у животных лечением препаратом. Крысы непрерывно наблюдались в течение 30 мин после введения. Наблюдение повторялось каждое утро в 9 ч в течение 4 дней после введения. 1.5. Моторная координация у крыс. Тест на вращающемся стержне позволяет оценивать эффект соединения на моторную координацию. Взрослых самцов крыс породы Sprague Dawley (150-200 г, поставщик Harlan, Милан) помещали на пластиковый стержень диаметром 6 см и 35 см в длину, крутящийся с постоянной скоростью (16 об/мин) на высоте 25 см. Стержень разделен на 4 равные секции, таким образом можно тестировать до 4 животных одновременно. От животных требовалось идти против направления движения вращающегося барабана в течение 30 с. Время, за которое они падали с вращающегося стержня, записывалось как количество падений за 30 с по методу Vaught et al. 1985, Neuropharmacology, 24:21, 1-216. В каждом эксперименте моторная координация измеряется до (предтестовое измерение) и после введения испытываемого соединения. Крысы, у которых насчитывается менее 3 и более 6 падений на предварительном тесте, отсеиваются. 1.6. Тест на атаксию на вращающемся стержне на крысах (Rotarod/ataxia test). Тест выполнялся по методу, описанному Veneroni et al. 2003, Pain, 102:17-25. Неврологическая недостаточность оценивалась по неспособности крыс оставаться на вращающемся стержне (10 об/мин) в течение периода теста. Токсичная доза рассчитывалась как доза, вызывающая 25%(ТД 25) или 50% (ТД 50) упавших крыс (только для габапентина токсическая доза была ТД 16 = 16% упавших крыс). 1.7. Тест с кассейной доской на мышах. Тест с кассейной доской позволяет изучить поведение грызунов при помещении в новую обстановку (Boissier J.R. 1964, Therapie, 19:571-583). Тест позволяет оценивать начальную исследовательскую активность животных и ее возможные вариации, индуцированные введением препарата. В кассейном тесте применяется квадратная 40-сантиметровая планка с 16 утопленными цилиндрическими отверстиями (диаметр 3 см), распределенными 4 на 4 на равной дистанции, наподобие решетки. Мыши (самцы породы Swiss Webster весом 25-30 г, поставщик Morini) размещаются один за другим в центре доски, и им позволяется свободно двигаться, по 5 мин каждой. Два фотоэлектрических луча, пересекающих планку с середины одной стороны до середины другой противоположной стороны, таким образом, разделяющих планку на четыре равных квадрата, автоматически записывают движения животных на плоской поверхности. Миниатюрные фотоэлементы в каждом из 16 отверстий записывают исследование отверстий (активность по опусканию головы) мышами. 2. Результаты (антигиперальгезивная активность). 2.1. Остеоартритная боль у крыс. Антигиперальгезивный потенциал димирацетама оценивался (тест давления в лапке) в модели остеоартритной боли, индуцированной внутрисуставной инъекцией монойодацетата натрия (MIA). Тестовые результаты изложены на фиг. 4. Димирацетам и его энантиомер (R) при дозе в 150 мг/кг через 15-30 мин после введения показали статистически значимый эффект по обращению (подавлению)MIA-индуцированной гиперальгезии. При дозе в 300 мг/кг димирацетам полностью обратил (подавил)MIA-индуцированную гиперальгезию, механический порог при этом находился на одинаковом уровне у обрабатываемых и контрольных животных в промежутке времени между 15 и 45 мин после введения. Эффект энантиомера (R) оставался все еще статистически значителен в течение 45 мин после введения. 3. Результаты (переносимость). С целью убедиться, может ли димирацетам индуцировать нежелательные побочные эффекты, состав был испытан на модели вращающегося стержня (моторная координация и атаксия) у крыс и на модели с кассейной сеткой (спонтанная и исследовательская активность) у мышей. 3.1. Тест на вращающемся стержне на крысах. В экспериментах с острой токсичностью димирацетам, введенный в дозе в 3000 мг/кг р.о. (перорально) (20- кратная доза, которая использовалась в предыдущих тестах фармакологической активности), не изменяет моторной координации у крыс в тесте на вращающемся цилиндре, как показано на фиг. 2. Напротив, как показано на фиг. 3, контрольный состав (эталонный, или референс-состав) 1-(3-цианофенил)тетрагидропирроло[1,2-а]имидазол-2,5-дион (представитель составов по формуле (I) документа WO 2004/085438, см. пример 13) значительно изменял моторную координацию животных,увеличивая количество падений, начиная с дозы в 300 мг/кг; эти данные показывают меньший уровень переносимости для названных контрольных составов. 3.2. Тест на атаксию/на вращающемся стержне на крысах. ТД 25 димирацетама составила 6000 мг/кг р.о. (перорально), таким образом, показана очень высокая безопасность и переносимость состава. Среди контрольных стандартов трамадол, показавший самую высокую токсичность, при ТД 50S, составившей 253 мг/кг р.о. (перорально), при этом прегабалин и леветирацетам показали ТД 50S, составившие 536 и 2000 мг/кг р.о. (перорально) соответственно. Габапентин показал ТД 16 в 1000 мг/кг р.о. (перорально). 3.3. Тест Ирвина на крысах. Димирацетам вводился в дозе 1000 мг/кг подкожным путем, и доза в 3000 мг/кг р.о. (перорально) не показала никаких эффектов на все наблюдаемые поведенческие параметры. 3.4. Тест на кассейной доске на мышах. В тесте на кассейной доске димирацетам вводился в дозе в 3000 мг/кг р.о. (перорально) и не снижал значительно ни спонтанной активности (количество движений каждого животного по планке) или любопытства (количество движений головой в отверстие), как показано на фиг. 4. Напротив, габапентин, введенный в дозе 1000 мг/кг, вызывает статистически значимое снижение обоих оцениваемых параметров. 3.5. Предварительная токсичность на крысах: одиночная доза пероральным и внутривенным путем. Пероральное или внутривенное введение единичной дозы 3000 мг/кг димирацетама крысам породыSprague Dawley переносится, по существу, хорошо. Во время эксперимента не наблюдалось признаков токсичности. Наблюдения поведения, анализы крови и мочи не показали каких-либо связанных с дозой отклонений измеряемых клинических параметров. 3.6. Повторная токсичность на крысах: 4 и 13 недель р.о. (перорального введения). Неоднократное пероральное введение димирацетама крысам породы Sprague Dawley в течение 4 недель и в максимальной дозе до 2500 мг/кг/день не вызвало никаких изменений в показателях смертности, симптоматологии или изменений нормального поведения. Пероральное неоднократное введение димирацетама в течение 13 недель крысам породы Sprague Dawley в максимальной дозировке до 2500 мг/кг/день прекрасно переносилось. Смертность или релевантные клинические признаки, как и изменения в параметрах веса тела, потребления воды и пищи или в температуре тела, не наблюдались при всех уровнях доз. Гематология, клиническая химия, параметры коагуляции и анализ мочи не выявили связанных с препаратом отклонений различных параметров, оцениваемых при всех испытываемых дозах. Никаких макро- или микроскопических патологических изменений или аномалий, сопоставимых с введением димирацетама, не было замечено. 3.7. Повторная токсичность на яванских макаках: 4 и 13 недель p.o. (перорального введения). Многократное пероральное введение димирацетама яванским макакам в течение 4 недель и до максимальной дозы в 2000 мг/кг/день прекрасно переносилось животными. У некоторых животных, обрабатываемых максимальной дозой в 2000 мг/кг, наблюдалось небольшое уменьшение потребляемой пищи и веса. Неоднократное пероральное введение димирацетама яванским макакам в течение 13 недель и до максимальной дозы в 2000 мг/кг/день прекрасно переносилось животными. Смертность или релевантные клинические признаки, как и изменения в параметрах веса тела, потребления воды и пищи или в температуре тела, не наблюдались при всех уровнях доз. Гематология, клиническая химия, параметры коагуляции и анализ мочи не выявили связанных с препаратом отклонений различных параметров, оцениваемых при всех испытываемых дозах. Никаких макро- или микроскопических патологических изменений или аномалий, сопоставимых с введением димирацетама, не было замечено. Будучи взяты вместе, эти данные показывают возбуждение сильной антигиперальгезивной активности димирацетама в пределах доз, типичных по настоящему изобретению. Высокая эффективность действия подтверждена фактом, что это соединение показало заметно более высокую эффективность,чем габапентин, считающийся в настоящее время "золотым стандартом" в терапии и лечении хронических болей. Активность была обнаружена против хронических болей разного происхождения (т.е. боль,индуцированная химиотерапией, индуцированная антивирусными препаратами, остеоартритная, головная и т.п.), демонстрируя широкий спектр применимости лечения, предлагаемого здесь. Вдобавок, информация показала в указанных моделях на животных, в первую очередь, особую эффективность димирацетама против хронической боли, связанной с антивирусным лечением и остеоартритной болью и связанными с этим патологиями. Вдобавок, при дозах, типичных для настоящего изобретения, димирацетам оказался гораздо более переносимым, чем габапентин или производные пирролоимидазола по уровню техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение димирацетама для лечения и/или профилактики хронической боли, вызванной остеоартритом или ревматоидным артритом. 2. Применение по п.1 в виде единиц дозирования, используемых для введения перорально, в которых количество димирацетама составляет от 10 до 300 мг/кг; внутримышечно, в которых количество димирацетама составляет от 5 до 150 мг/кг; внутривенно, в которых количество димирацетама составляет от 2 до 60 мг/кг. 3. Применение по п.1 в виде единиц дозирования, используемых для введения перорально, в которых количество димирацетама составляет от 500 до 15000 мг; внутримышечно, в которых количество димирацетама составляет от 250 до 7500 мг; внутривенно, в которых количество димирацетама составляет от 100 до 3000 мг. 4. Применение димирацетама для производства лекарственного средства в препаративной форме для лечения и/или профилактики хронической боли, вызванной остеоартритом или ревматоидным артритом. 5. Применение по п.4, в котором препаративную форму выбирают из таблеток, капсул, пероральных форм, порошков, гранул, пилюль, жидких растворов для инъекции или инфузий, суспензий, эмульсий,сиропов, эликсиров, сухих порошков или гранулятов, форм с замедленным высвобождением, мазей, кремов, лосьонов, гелей, паст, мембран для применения через кожу или медицинских пластырей.
МПК / Метки
МПК: A61K 31/70, A61K 31/282, A61K 45/06, A61P 29/00, A61K 31/475, A61K 31/337, A61K 31/4188
Метки: применение, димирацетама, лечения, ним, заболеваний, связанных, остеоартрита
Код ссылки
<a href="https://eas.patents.su/9-22867-primenenie-dimiracetama-dlya-lecheniya-osteoartrita-i-svyazannyh-s-nim-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение димирацетама для лечения остеоартрита и связанных с ним заболеваний</a>
Предыдущий патент: Гетерофазные сополимеры пропилена с улучшенным балансом жесткости/ударопрочности/текучести
Следующий патент: Способ повышения пожароустойчивости сосновых молодняков
Случайный патент: Турбина для преобразования гидродинамической энергии для применения в воздушной и гидравлической окружающих средах и в среде под давлением