Макролидные соединения, обладающие противовоспалительной активностью
Номер патента: 17878
Опубликовано: 29.03.2013
Авторы: Пеллачини Франко, Мориджи Эрманно, Мереу Андреа, Наполетано Мауро
Формула / Реферат
1. Соединение формулы (I)
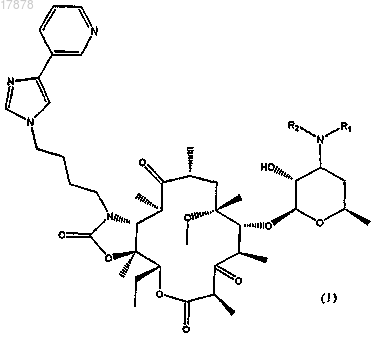
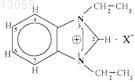
где R1 представляет собой группу -X-R3, где
X представляет собой группу -С(=O)-, -C(=O)-NH- или -SO2- и
R3 представляет собой атом водорода, (C1-C10)алкильную группу, фенил, гетероарил, выбранный из тиофена и пиридина;
R2 представляет собой атом водорода или (C1-C6)алкильную группу,
и его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R2 представляет собой (С1-С6)алкильную группу.
3. Соединение по п.2, в котором R2 представляет собой (C1-С3)алкильную группу.
4. Соединение по п.3, в котором R1 представляет собой группу -X-R3, где X представляет собой группу
-С(=O)- и R3 представляет собой (C1-C6)алкильную группу или фенил.
5. Соединение по п.4, в котором R1 представляет собой группу -X-R3, где X представляет собой группу
-С(=O)- и R3 представляет собой (С1-С4)алкильную группу или фенил.
6. Соединение формулы (I)
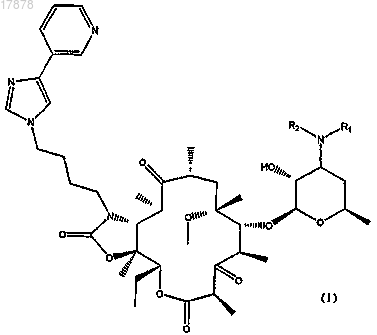
где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу
-С(=O)- и R3 представляет собой метил.
7. Соединение формулы (I)
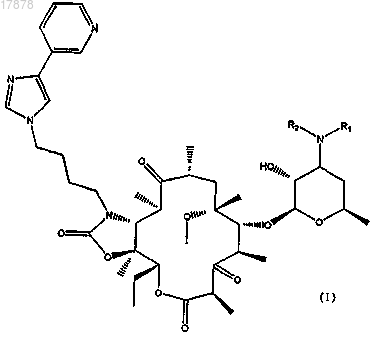
где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу
-С(=O)- и R3 представляет собой фенил.
8. Способ получения соединения формулы (I), который включает:
a) деметилирование диметиламиногруппы телитромицина в положении 3';
b) реакцию амидирования первичной или вторичной аминогруппы, полученной в результате реакции на стадии а).
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1, смешанное с фармацевтически приемлемым носителем.
10. Фармацевтическая композиция по п.9 для лечения воспалительных заболеваний.
11. Фармацевтическая композиция по п.10 для лечения респираторных заболеваний.
12. Фармацевтическая композиция по п.10 для лечения желудочно-кишечных заболеваний.
Текст
Изобретение относится к производным макролидов формулы (I), где R1 и R2 имеют значения,приведенные в описании; которые обладают противовоспалительной активностью и, по существу, не имеют антибиотических свойств, к их фармацевтически приемлемым солям и фармацевтическим композициям, содержащим их в качестве активного ингредиента. Настоящее изобретение относится к макролидам с противовоспалительной активностью и, в частности, относится к 3'-амидным кетолидам с противовоспалительной активностью, их фармацевтически приемлемым солям и фармацевтическим композициям, содержащим их в качестве активного ингредиента. Известно, что различные антибиотики, в частности класс 14-членных макролидов на основе эритромицина, в дополнение к их антибактериальной активности, обладают противовоспалительными свойствами [Clin. Immunother., (1996), 6, 454-464]. Эритромицин является природным макролидом (The Merck Index, 13th edition,3714, p. 654), который имеет очень широкое клиническое применение в лечении инфекций, вызванных грамположительными бактериями, некоторыми грамотрицательными бактериями или микоплазмами. В последнее время интерес научного сообщества направлен на иммуномодулирующее и противовоспалительное действие эритромицина и его производных [Journal of Antimicrobial Chemotherapy,(1998), 41, Suppl. В, 37-46]. Было обнаружено, что макролиды эффективны в лечении воспалительных заболеваний, таких как панбронхиолит [Thorax, (1997), 52, 916-918], бронхиальная астма [Chest, (1991), 99, 670-673] и муковисцидоз [The Lancet, (1998), 351, 420]. Было обнаружено, что действие макролидов in vitro особенно эффективно в отношении модуляции метаболических функций ряда клеток иммунной системы, таких как нейтрофилы [The Journal of Immunology, (1997), 159, 3395-4005] и Т-лимфоциты [Life Sciences, (1992), 51, PL 231-236], и в модуляции воспалительных медиаторов, таких как интерлейкин-8 (IL-8) [Am. J. Respir. Crit Care Med., (1997), 156, 266271] или интерлейкин-5 (IL-5) [патентные заявки ЕР 0775489 и ЕР 0771564, Taisho Pharmaceutical Co.,Ltd]. Нейтрофилы, в частности, являются первой линией клеток, привлекаемых к месту инфекции или повреждения ткани на ранних стадиях воспалительного ответа. Нефизиологическое накопление нейтрофилов в воспаленной ткани, их активация, последующее высвобождение протеаз и увеличение продукции реактивных метаболитов кислорода характеризуют некоторые формы воспалительного ответа, который наиболее часто переходит в патологические состояния. Следовательно, хотя нейтрофилы необходимы для иммунного ответа, известно, что они вовлечены в патологические состояния, возникающие в результате большинства хронических воспалительных состояний и ишемически-реперфузионных повреждений (Inflammation and fever; Viera 'Stvrtinova, Jan Jakubovsky and Ivan Hulin; Academic Electronic Press, 1995). В той же статье описаны патологические состояния, для которых подтверждено влияние нарушенной функции нейтрофилов во время их возникновения и/или развития: среди них упомянуты атеросклероз, ишемически-реперфузионное повреждение, ревматоидный артрит, псориаз, васкулит и аутоиммунный гломерулонефрит, болезнь Крона и хронические воспаления легких, такие как ARDS (респираторный дистресс синдром взрослых). ХОБЛ (COPD) (хронические обструктивные болезни легких) являются хроническим патологическим состоянием, характеризуемым воспалением и постепенным разрушением легочной ткани, вызванными массивным присутствием активированных нейтрофилов с последующим высвобождением металлопротеаз и увеличением продукции радикалов кислорода [Am. J. Respir. Crit Care Med., 1996, 153, 530534] [Chest, 2000, 117 (2 Suppl.), 10S-14S]. Введение макролидов пациентам с астмой сопровождается уменьшением гиперсекреции и гиперчувствительности бронхов вследствие их антиокислительного и противовоспалительного взаимодействия с фагоцитами и, в частности, с нейтрофилами; считают, что такое взаимодействие препятствует осуществлению рядом биоактивных липидов, вовлеченных в патогенез бронхиальной астмы, их провоспалительной мембран-дестабилизирующей активности (Inflammation, vol. 20,6, 1996). Описано, что лечение эритромицином в низких дозах в течение длительного периода является эффективным для уменьшения гиперчувствительности бронхов в случае пациентов с астмой (Miyatake H. etal. Chest, 1991, 99, 670-673, уже цитированное). В другом исследовании продемонстрировано, что такое же лечение, в случае пациентов с ХОБЛ,может существенно уменьшить частоту и риск обострений, вызванных острыми респираторными инфекциями (CHEST 2001, 120, 730-733). Полученные результаты обусловлены не антибиотической активностью макролидов, а ингибированием экспрессии и высвобождения воспалительных цитокинов. Такое лечение в соответствии с вышеупомянутой статьей должно быть предпочтительно ограничено пациентами с высоким риском обострения ХОБЛ из-за потенциального риска развития устойчивых патогенных штаммов. Определенная терапевтическая эффективность макролидов при патологических состояниях, при которых доказана неэффективность обычных противовоспалительных лекарственных средств, например кортикостероидов [Thorax, (1997), 52, 915-918, уже цитировано], объясняет значительный интерес в отношении этого нового потенциального класса противовоспалительных средств. Однако тот факт, что стандартные макролиды обладают антибактериальной активностью, не допускает их широкого использования в лечении хронических воспалительных процессов, не вызванных пато-1 017878 генными микроорганизмами; причиной этого является то, что они могут способствовать быстрому развитию устойчивых штаммов. Следовательно, желательно получить новые вещества со структурой макролидов, которые проявляют противовоспалительную активность и которые одновременно не имеют антибиотических свойств. Для большей ясности дана формула эритромицина, где указана нумерация, применяемая в настоящей патентной заявке. В литературе описан ряд классов производных эритромицина с антибактериальной активностью. В частности, телитромицин (The Merck Index, 13th edition,9199, p. 1627) представляет собой полусинтетическое производное эритромицина А и является первой молекулой, принадлежащей к новому семейству антибактериальных средств широкого спектра, тесно связанных с макролидами, которые известны как кетолиды. Телитромицин используют в качестве препарата второго выбора для лечения внебольничных инфекций, вызванных пенициллиноустойчивыми и макролидустойчивыми штаммами, в частности бетагемолитическими стрептококками группы А, и также он активен в отношении внутриклеточных и атипичных бактерий. В патентной заявке WO 99/16779, Abbott Laboratories описан ряд классов кетолидов на основе эритромицина, модифицированного в положении 3' и 6-O-замещенного, и их солей и сложных эфиров с антибактериальной активностью. В литературе также описан ряд классов производных эритромицина с противовоспалительной активностью. Например, в вышеупомянутой Европейской патентной заявке Taisho в качестве эффективных ингибиторов синтеза IL-5 заявлены производные эритромицина, модифицированные в положениях 3, 9, 11 и 12. Применение эритромицина в качестве противовоспалительного средства, которое действует путем уменьшения высвобождения интерлейкина-1 посредством ингибирования гликопротеина млекопитающих mdr-P, заявлено в патентной заявке WO 92/16226, Smith-Kline Beecham Corporation. В патентной заявке WO 00/42055 того же заявителя, что и настоящая заявка, описаны 3'дездиметиламино-9-оксим макролиды, обладающие противовоспалительной активностью и не имеющие антибиотической активности. В патентной заявке WO 04/013153 того же заявителя, что и настоящая заявка, описаны производные макролидов, не имеющие кладинозы в положении 3, которые обладают противовоспалительной активностью. В патентной заявке WO 04/039821 того же заявителя, что и настоящая заявка, описаны 9 а-азалиды,не имеющие кладинозы в положении 3, которые обладают противовоспалительной активностью. В настоящее время неожиданно было обнаружено, что производные кетолидов, структурно модифицированные по диметиламиногруппе в положении 3', не имеют антибактериальной активности и, в то же время, обладают выраженными противовоспалительными свойствами. В частности, авторы неожиданно обнаружили новый класс 3'-амидных производных телитромицина, обладающих противовоспалительной активностью и, по существу, не имеющих антибиотических свойств. Одним объектом настоящего изобретения, следовательно, являются соединения формулы (I) где R1 представляет собой группу -X-R3, гдеX представляет собой группу -С(=O)-, -C(=O)-NH- или -SO2- иR3 представляет собой атом водорода, (C1-C10)алкильную группу, фенил, гетероарил, выбранный из тиофена и пиридина;R2 представляет собой атом водорода или (C1-C6)алкильную группу,и их фармацевтически приемлемые соли. Соединения формулы (I) представляют собой противовоспалительные макролиды, не имеющие антибиотической активности и, следовательно, применимые в лечении и профилактике патологических воспалительных состояний. Специфическими примерами (C1-C10)алкильных групп являются метил, этил, н-пропил, изопропил,н-бутил, втор-бутил, трет-бутил, н-пентил, 1-метилбутил, 2-этилпропил, 3-метилбутил, 3-метил-2-бутил,н-гексил, гептил, октил, нонил, децил и подобные. Предпочтительными соединениями формулы (I) являются таковые, в которых R2 является (C1C6)алкильной группой. В этой группе еще более предпочтительными являются соединения, в которых R2 представляет собой (C1-C3)алкильную группу. Принадлежа к этой последней группе также предпочтительными являются соединения, в которыхR1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой(C1-C6)алкильную группу или фенил. В рамках этой последней группы еще более предпочтительными являются соединения, в которыхR1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой(C1-C4)алкильную группу или фенил. К предпочтительным группам соединений относятся соединения формулы (I), где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой метил; а также соединения формулы (I), где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой фенил. Примерами фармацевтически приемлемых солей соединений формулы (I) являются соли с органическими или неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, йодоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, уксусная кислота, винная кислота, лимонная кислота, бензойная кислота, янтарная кислота и глутаровая кислота. Соединения формулы (I), которые являются объектом настоящего изобретения, получают в соответствии со схемой синтеза, которая включает деметилирование диметиламиногруппы телитромицина в положении 3', с последующей реакцией амидирования образующейся таким образом первичной или вторичной аминогруппы, для получения соединений формулы (I), которые являются объектом настоящего изобретения. Таким образом, изобретение относится также к способу получения соединения формулы (I), который включает:a) деметилирование диметиламиногруппы телитромицина в положении 3';b) реакцию амидирования первичной или вторичной аминогруппы, полученной в результате реакции на стадии а). Термин "реакция амидирования" обозначает процедуру для введения заместителей X и R3, определенных в формуле (I) в значениях R1 и R2, в одну или более стадий синтеза. Показания для использования вышеупомянутых структурных модификаций производных кетолидов более четко описаны ниже в настоящем описании. Телитромицин представляет собой известное соединение, которое является коммерчески доступным, и его получают в соответствии с обычными методиками, например, описанными в патенте ЕР 0680967, Hoechst Marion Roussel. Исходя из этого субстрата, соединения формулы (I) получают посредством деметилирования диметиламиногруппы в положении 3' в соответствии с обычными методиками. Таким образом, например, телитромицин обрабатывают ацетатом натрия и йодом в присутствии органического растворителя, как описано в патенте US 3725385, Abbott Laboratories. Альтернативно, указанный субстрат подвергают реакции с диалкилазодикарбоксилатом в ацетоне,как описано в патенте US 6433151, Aventis Pharma. Функционализацию первичной или вторичной аминогруппы, полученной в положении 3', проводят посредством использования методик амидирования, известных специалисту в области техники. В частности, такие методики синтеза связаны с обычным получением амидов, сульфонамидов, мочевины, сульфонилмочевины и уретанов из аминных субстратов. Как указано ранее, реакцию амидирования завершают введением заместителей X и R3, определенных в формуле (I). Обычно заместители X и R3 одновременно вводят в молекулу макролида. Следовательно, например, получение амидных или сульфонамидных производных обычно проводят обработкой 3'-деметилированного кетолида подходящими ацилхлоридами или сульфонилхлоридами в соответствии с обычными методиками, например реакцией вышеупомянутых соединений в присутст-3 017878 вии основания, такого как триэтиламин, и органического растворителя, например дихлорметана или тетрагидрофурана. Кроме того, получение производных мочевины предпочтительно проводят с использованием подходящих изоцианатов в присутствии органического растворителя, например дихлорметана. Альтернативно, получение производных с более сложными по структуре амидными цепями обычно проводят синтезом в несколько стадий. Так, например, 3'-деметилированное производное обрабатывают омега-хлоралкановой кислотой(уксусной кислотой, пропионовой кислотой или масляной кислотой) и N-циклогексилкарбодиимидом в присутствии органического растворителя, например тетрагидрофурана, и полученное соединение используют в качестве субстрата для введения конечной части амидной цепи, в частности, соединений формулы (I), где X представляет собой группу -С(=O)- и R3 представляет собой цепь формулы -(СН 2)r-Y(CH2)m-A. Выбор методики определяется, при необходимости, техническими требованиями с целью оптимизации процесса синтеза рассматриваемого продукта. Как указано ранее, соединения формулы (I), которые являются объектом настоящего изобретения,обладают противовоспалительной активностью и не имеют антибиотической активности. Фармакологическую активность соединений формулы (I) оценивали в моделях кожного воспаления по сравнению с известными макролидами, такими как эритромицин, телитромицин и азитромицин, которые обладают и противовоспалительной активностью, и антибиотической активностью. Противовоспалительную активность оценивали посредством ингибирования отека уха мышей, индуцированного РМА (ацетат форболмиристата). Во всех экспериментах было обнаружено, что соединения, которые являются объектом настоящего изобретения, очень активны в качестве противовоспалительных средств и было обнаружено, что их противовоспалительная активность выше сравнительных соединений. Антибиотическую активность оценивали "in vitro" как способность ингибировать рост бактериальных штаммов, чувствительных к эритромицину и телитромицину. В частности, антибиотическую активность соединений оценивали посредством турбидиметрического анализа, при котором оценка бактериального роста проводится по увеличению помутнения/поглощения, записываемого спектрофотометрически в культуральной среде. Одновременно с тестируемыми соединениями в качестве контрольного стандарта активности ингибирования бактериального роста использовали антибиотики эритромицин и телитромицин. Было обнаружено, что все тестируемые соединения являются неактивными в отношении бактериального роста, тогда как для контрольных антибиотиков эритромицина и телитромицина обнаруживали существенное ингибирование развития бактерий, зависимое от используемых концентраций. Соединения по настоящему изобретению не показали антибиотической активности и, следовательно, могут использоваться в лечении хронических воспалительных процессов без развития какой-либо нежелательной устойчивости. Следовательно, специалисту в области техники очевидно, что соединения формулы (I), которые обладают противовоспалительной активностью и не имеют антибиотической активности, могут быть применимы в лечении и профилактике острых и хронических воспалительных заболеваний, в частности заболеваний, связанных с нарушением функции нейтрофилов, например ревматоидного артрита, васкулита, гломерулонефрита, псориаза, атопического дерматита, язвенного колита, болезни Крона, ишемически-реперфузионного повреждения, септического шока, атеросклероза, ARDS, ХОБЛ и астмы. Терапевтически эффективные количества зависят от возраста и общего физиологического состояния пациента, пути введения и используемой фармацевтической формы; терапевтические дозы обычно составляют от около 10 до 2000 мг/сутки и предпочтительно от около 30 до 1500 мг/сутки. Соединения по настоящему изобретению для использования в лечении и/или профилактике заболеваний, указанных выше, предпочтительно используются в фармацевтической форме, подходящей для перорального, ректального, сублингвального, парентерального, местного, трансдермального и ингаляционного введения. Следовательно, следующим объектом настоящего изобретения являются фармацевтические композиции, содержащие терапевтически эффективное количество соединения формулы (I) или его солей, смешанных с фармацевтически приемлемым носителем. Фармацевтические композиции согласно изобретению предпочтительно предназначены для лечения воспалительных заболеваний, респираторных заболеваний или желудочно-кишечных заболеваний. Фармацевтические композиции, которые являются объектом настоящего изобретения, могут быть жидкостями, подходящими для перорального и/или парентерального введения, например каплями, сиропами,растворами или инъекционными растворами, которые готовы для использования или получены разведением лиофилизата, но предпочтительно являются твердыми или полутвердыми, например таблетками,капсулами, гранулами, порошками, шариками, свечами, суппозиториями, кремами, помадами, гелями и мазями; или растворами, суспензиями, эмульсиями или другими формами, подходящими для ингаляционного и трансдермального введения. В зависимости от типа композиции в дополнение к терапевтически эффективному количеству одного или более соединений формулы (I), такие композиции могут содержать подходящие твердые или жидкие вспомогательные вещества или разбавители для фармацевтического применения и необязательно другие добавки, обычно используемые в получении фармацевтических композиций, например загустители, структурообразователи, смазывающие средства, разрыхлители, ароматизаторы и красители. Фармацевтические композиции, которые являются объектом изобретения, могут быть получены в соответствии с обычными методиками. Спектры 1 Н-ЯМР были получены в растворах CDCl3 или d6-DMSO с использованием спектрометраVarian Gemini 200 MHz. Химические сдвиги указаны в 8 единицах с использованием в качестве внутреннего стандарта CHCl3 или DMSO. Исследования ВЭЖХ/МС проводили с использованием прибора Gilson, содержащего колонку Gilson Xterra RP18 (5 мкм, 4,650 мм) и использования в качестве детектора УФ-излучения (220 нм) массспектрометра Finnigan AQA (распыление электронов, положительная или отрицательная ионизация) и детектора ELSD. Используемые условия: скорость тока: 1,2 мл/мин; температура колонки: 40 С; градиент элюции А/В (элюент А: 0,5% муравьиной кислоты в воде; элюент В: 0,5% муравьиной кислоты в ацетонитриле):t=0 мин, А/В=95:5, t=8 мин, А/В=5:95. Далее даны следующие примеры с целью более четкой иллюстрации настоящего изобретения. Пример 1. Получение 3'-деметил-3'-ацетилтелитромицина (соединение 1). К раствору 3'-деметилтелитромицина (200 мг, 0,25 ммоль) и триэтиламина (70 мкл, 0,5 ммоль) вCH2Cl2 (3 мл) добавляли по каплям раствор ацетилхлорида (19,6 мг, 0,25 ммоль) в CH2Cl2 (1 мл) и полученную смесь перемешивали в течение 2 ч. Реакционную смесь разводили этилацетатом (50 мл) и органическую фазу промывали 2 N NH4Cl (330 мл), 10% K2CO3 (230 мл), сушили над безводным Na2SO4, и фильтровали и растворитель выпаривали. Соединение 1 (168 мг, 80% выход) получали в виде белого твердого вещества.CH2Cl2 (3 мл) добавляли по каплям раствор бензоилхлорида (35,2 мг, 0,25 ммоль) в CH2Cl2 (1 мл) и полученную смесь перемешивали в течение 2 ч. Реакционную смесь разводили этилацетатом (50 мл) и органическую фазу промывали 2 N NH4Cl (330 мл) и 10% KaCO3 (230 мл), сушили над безводным Na2SO4,и фильтровали и растворитель выпаривали. После очистки хроматографией Biotage (колонка 12 М картридж, элюент 100/5/0,5 CH2Cl2/MeOH/NH3), соединение 2 (205 мг, 91% выход) получали в виде белого твердого вещества.(дт, 1 Н, J1=8,1, J2=2,0, C4H пиридин); 7,51 (с, 1H, NCHN имидазол); 7,20-7,38 (м, 7H, C5H пиридин + СНС имидазол + фенил); 4,9 (м, 1 Н); 4,7 (м, 1 Н); 3,97 (т, 2 Н, J=7,3, CH2N имидазол); 3,53 (с, 1 Н, Н 11); 3,05 (т,2 Н, J=7,5, СН 2); 2,86 (с, 3H, СН 3 Н); 2,59 (м, 4 Н, СН 2 СН 2); 1,11 (д, 3H, J=6,9); 0,97 (д, 3H, J=6,9); 0,80 (т,3H, J=7,5; H15). Пример 3. Фармакологическая активность in vivo. А. Острый контактный дерматит. Животные. Использовали группы из 5 мышей CD1 (18-24 г). Введение соединений. Все производные макролидов растворяли в Trans-phase Delivery System (TPDS), носителе, содержащем 10% бензилового спирта, 40% ацетона и 50% изопропанола. 15 мкл соединений (500 мкг/ухо), растворенных в TPDS, наносили местно на внутреннюю поверхность уха; через 30 мин на ту же область наносили 12 мкл раствора тетрадеканоилфорболацетата (ТРА) в концентрации 0,01%, растворенного в ацетоне. Через шесть часов животных умерщвляли ингаляцией СО 2. Оценка результатов. Степень отека рассчитывали путем вычитания массы определенного сечения необработанного уха из таковой противоположного обработанного уха. Для определения степени уменьшения отека затем сравнивали различия массы в группах, обработанных ТРА + макролиды, по сравнению с группами, обра-5 017878 ботанными только ТРА. Активность макролидов измеряли с использованием модифицированного метода Zunic et al. (1998):MDL (Lysyl) GDP, a non-toxic muramyl dipeptide derivative inhibits cytokine production by activated macrophages and protects mice from phorbol ester- and oxazolone-induced inflammation (J. Invest. Dermatol., 111(1),77-82). Результаты, полученные для соединений формулы (I), даны ниже в табл. 1. Таблица 1 Пример 4. Фармакологическая активность in vitro. А. Антибиотическая активность. Антибиотическую активность соединений оценивали посредством турбидиметрического анализа,описанного в литературе (Keller R., Pedroso M.Z., et al. Occurrence of virulence-associated properties in Enterobacter cloacae. Infection and Immunity, p. 645-649, Feb. 1998), (Saiman L., Burns J.L. et al. Evaluation offrom patients with cystic fibrosis. Journal of Clinical Microbiology, p. 2987-2991, Sept., 1999). Турбидиметрическое определение бактериального роста дано по увеличению пропускания/поглощения, записанного спектрофотометрически в тестируемой культуральной среде. Антибактериальную активность оценивали как концентрацию соединения, способную ингибировать развитие культуральной среды бактериального штамма Escherichia coli (ATCC 25922), инкубируемой в 96-луночных планшетах. Антибиотики эритромицин и телитромицин использовали одновременно с тестируемыми соединениями в качестве контрольных стандартов для оценки ингибирования бактериального роста. Соединения и контрольные антибиотики тестировали в 8 концентрациях, полученных в инкубационном планшете посредством серийных разведений 1:2, начиная с концентрации 100 мкМ. Получение соединений. Для каждого тестируемого соединения получали концентрацию 200 мкМ (удвоенную относительно инкубационной концентрации), путем разведения 10 мкл основного 10 мМ раствора в ДМСО, в 0,5 мл среды Tryptic Soy (TSB). 200 мкл полученных растворов распределяли в 96-луночных планшетах и посредством серийных разведений 1:2 с помощью TSB получали последующие концентрации. Полученный планшет в конце разведений содержал в объеме 100 мкл/ячейку одно соединение в колонке в 8 концентрациях, соответствующих 100, 50, 25, 12,5, 6,25, 3,13, 1,56 и 0,78 мкМ на инкубацию. Для положительного контроля (бактериальный рост) и отрицательного контроля (контрольная проба/контроль стерильности) в ячейках с двумя колонками распределяли 100 мкл/ячейку TSB без соединений. Проведение исследования. Инкубацию начинали путем распределения в колонки, содержащие тестируемые соединения, контрольные макролиды и положительный контроль по 100 мкл/ячейку бактериальной суспензии с использованием многоканальной пипетки. 100 мкл TSB вносили в колонку контроля стерильности/контрольную пробу. Бактериальный рост измеряли путем считывания поглощения при 570 нм с использованием счетчика 96-луночных планшетов. Считывания получали в начале инкубации и через каждые 30 мин с 2 до 5 ч инкубации. Оценка данных. Значения поглощения для каждой ячейки, измеряемые в начале инкубации, вычитали из значений,полученных в последующие моменты инкубации. Из полученных значений рассчитывали ингибирование как процент уменьшения бактериального роста относительно 100% роста, измеряемого в неингибируемых контрольных ячейках в соответствующие моменты инкубации. Значения концентраций, которые ингибировали развитие бактерий на 20, 50 и 80% (IC 20, 50; 80%), рассчитывали с использованием по меньшей мере трех значений времени инкубации, для которых увеличение поглощения оказывалось наиболее линейным для концентраций (обычно между 150 и 240 мин инкубации). Для каждого выбранного времени с использованием парных серий концентрации и ингибирования рассчитывали ингибирующие концентрации посредством сигмоидального соответствия. Значения ингибирующих концентраций указаны как среднее значений, рассчитанных по меньшей мере для трех выбранных значений времени инкубации. Для неактивных соединений указана IC100, обозначающая, что для максимальной тестируемой концентрации (100 мкМ) не может быть рассчитано ингибирование. Результаты, полученные для контрольных антибиотиков макролидов и для соединений формулы (I),выраженные в нмоль/мл концентраций (IC), которые ингибируют рост бактериального штамма Escherichia coli (ATCC 25922) на 20, 50 и 80%, даны в табл. 2 ниже. Таблица 2 Данные, указанные в табл. 2, четко показывают, что соединения формулы (I), которые являются предметом настоящего изобретения, по существу, не имеют антибиотической активности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где R1 представляет собой группу -X-R3, гдеX представляет собой группу -С(=O)-, -C(=O)-NH- или -SO2- иR3 представляет собой атом водорода, (C1-C10)алкильную группу, фенил, гетероарил, выбранный из тиофена и пиридина;R2 представляет собой атом водорода или (C1-C6)алкильную группу,и его фармацевтически приемлемые соли. 2. Соединение по п.1, в котором R2 представляет собой (С 1-С 6)алкильную группу. 3. Соединение по п.2, в котором R2 представляет собой (C1-С 3)алкильную группу. 4. Соединение по п.3, в котором R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой (C1-C6)алкильную группу или фенил. 5. Соединение по п.4, в котором R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой (С 1-С 4)алкильную группу или фенил. 6. Соединение формулы (I) где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой метил. 7. Соединение формулы (I) где R2 представляет собой метил и R1 представляет собой группу -X-R3, где X представляет собой группу -С(=O)- и R3 представляет собой фенил. 8. Способ получения соединения формулы (I), который включает:a) деметилирование диметиламиногруппы телитромицина в положении 3';b) реакцию амидирования первичной или вторичной аминогруппы, полученной в результате реакции на стадии а). 9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1, смешанное с фармацевтически приемлемым носителем. 10. Фармацевтическая композиция по п.9 для лечения воспалительных заболеваний. 11. Фармацевтическая композиция по п.10 для лечения респираторных заболеваний. 12. Фармацевтическая композиция по п.10 для лечения желудочно-кишечных заболеваний.
МПК / Метки
МПК: A61K 31/7042, A61P 19/02, C07H 17/00
Метки: активностью, обладающие, противовоспалительной, соединения, макролидные
Код ссылки
<a href="https://eas.patents.su/9-17878-makrolidnye-soedineniya-obladayushhie-protivovospalitelnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Макролидные соединения, обладающие противовоспалительной активностью</a>
Предыдущий патент: Способ получения текстиля с десенсибилизированными компонентами серебра
Следующий патент: Улучшенное определение экспрессии mage-a
Случайный патент: Антагонисты рецептора cgrp