Композиция для лечения спидa и связанных со спидoм состояний
Номер патента: 13683
Опубликовано: 30.06.2010
Авторы: Асиеду Фредерик, Боатенг Дебра, Асиеду Вилльям, Аппиах-Куби Кваси, Боатенг Чарльз Антви, Доуду Майкл Нсиа, Овусу Вилльям, Варе Сет Опоку, Аджей Аквете Лекс, Эннин Менни, Ампим Кофи
Формула / Реферат
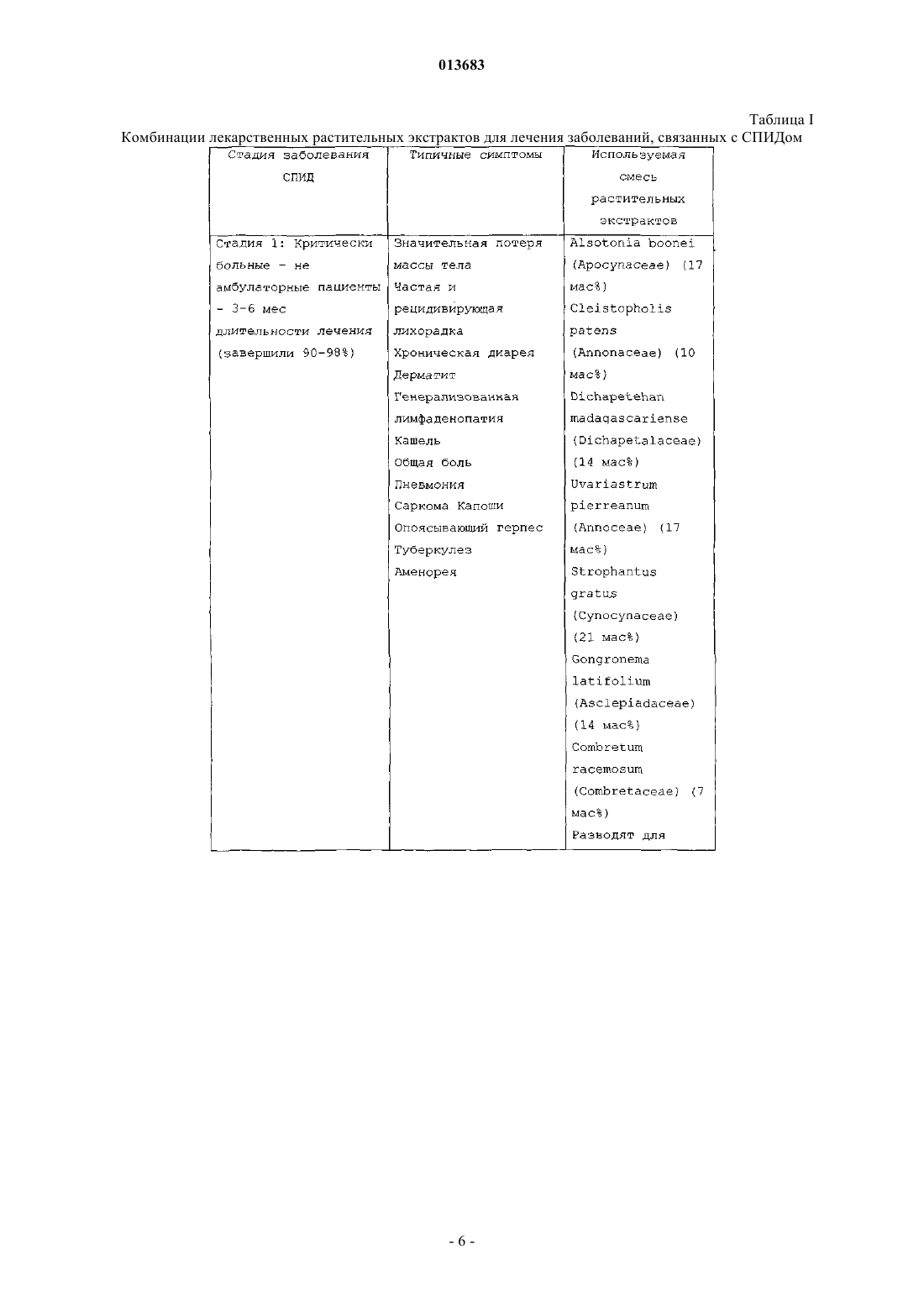
1. Композиция для лечения СПИДа и связанных со СПИДом состояний, включающая смесь водных травяных экстрактов, выбранную из экстрактов следующих трав:
(a) Alsotonia boonei или Pleioscarpa bicarpellata, Cleistopholis patens, Dichapetehan madagasca riense, Uvaristrum pierreanum, Strophanthus gratus, Gongronema latifolium и Combretum racemosum; или
(b) Alsotonia boonei или Pleioscarpa bicarpellata, Alternanthera pungens, Anchomanes differmis, Seleria Voivinil, Antrocaryon micraster или Lannea Acida или Spondias Mombin и Kigelia Africana;
(c) Uvaristrum pierreanum, Antrocaryon micraster или Lannea Acida или Spondias Mombin, Anchomanes differmis, Ceiba pentanota или Bombax bounopozense, Carica papaya и Combretum racemosum.
2. Способ лечения СПИДа и связанных со СПИДом состояний у пациента, включающий введение пациенту композиции по п.1.
3. Способ по п.2, где связанное со СПИДом состояние выбрано из группы, состоящей из рецидивирующей и персистирующей лихорадки, хронической диареи, дерматита, генерализованной лимфаденопатии, кашля, общей боли, туберкулеза, аменореи и комбинации любых из вышеуказанных состояний.
4. Способ по п.2, где указанную композицию вводят в организм пациента, например, перорально, назально, ректально, путем инъекции или путем комбинации указанных способов введения.
Текст
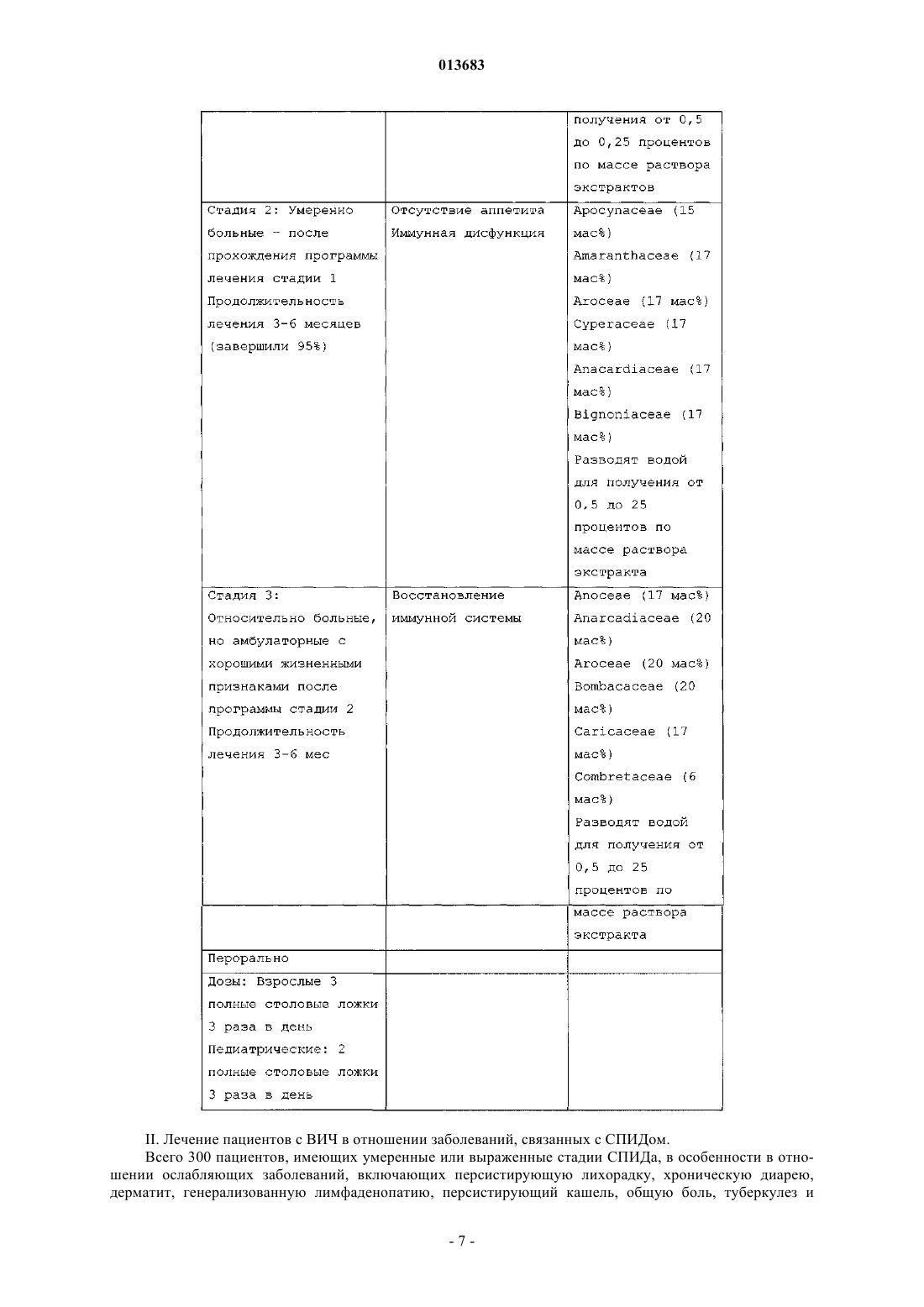
013683 Уровень техники изобретения Область изобретения Настоящее изобретение относится к композиции для лечения СПИДа и связанных состояний и, в частности, к композиции, включающей по меньшей мере один экстракт отобранного растения. Описание предшествующей области техники Пациенты с симптомами, которые ретроспективно оказались проявлениями синдрома приобретенного иммунодефицита (СПИД) первоначально были описаны летом 1981 г. [CDC - Pneumocystis pneumonia - Los Angeles, MMWR. 1981, 30:250-2; CDC - Kaposi's sarcoma and Pneumocystis pneumonia among homosexual men - New York City and California, MMWR 1981, 30: 305-8]. Определение случая СПИД для национального сообщения было впервые опубликовано в MMWR в сентябре 1982 г. [CDC - Hepatitis Вvirus vaccine safety: report of an inter-agency group MMWR 1982, 31:4 65-67; CDC - Update on acquired immune deficiency syndrome (AIDS) - United States. MMWR 1982, 31: 507-14]. С того времени определение подверглось минимальным исправлениям в перечне заболеваний, используемых как индикаторы лежащего в основе клеточного иммунодефицита [Jaffe H.W., Bregman D.J., Selik R.M. Acquired immune deficiency syndrome in the United States: the first 1000 cases. J Infect Dis 1983, 148: 339-45; Jaffe H.W., SelikR.M. Acquired immune deficiency syndrome: is disseminated aspergillosis predictive of underlying cellular immune deficiency (ответ на письмо) J Infect Dis 1984, 149:829; Selik R.M., Haverkos H.W., Curran J.W. Acquired immune deficiency syndrome (AIDS) trends in the United States, 1978-1982. Am J Med 1984, 76: 493500; CDC, Update: acquired immunodeficiency syndrome (AIDS) - United States. MMWR 1984, 32:688-91]. С тех пор, как было опубликовано определение 1982, вирус, лимфотропный к человеческим Тклеткам типа III/вирус, ассоциированный с лимфаденопатией (HTLV-III/LAV) был определен как причина СПИД. Клинические проявления инфекции (HTLV-III/LAV) могут относиться непосредственно к инфицированию таким вирусом или быть результатом вторичных состояний, возникающих в результате иммунной дисфункции, вызываемой лежащей в основе инфекцией (HTLV-III/LAV). Диапазон проявлений включает неопределенные, неспецифические признаки и симптомы заболевания, аутоиммунные и неврологические расстройства, множество оппортунистических инфекций и несколько типов злокачественных заболеваний. СПИД был определен для национального сообщения до того, как его этиология стала известной, и включал только определенные вторичные состояния, которые достоверно отражают наличие тяжелой иммунной дисфункции. Современные лабораторные тесты для определения антител к(HTLV-III/LAV) делают возможным включить дополнительные серьезные состояния в этот синдром, а также еще более улучшить специфичность определения, используемого для сообщения о случаях. Современное определение случая СПИДа обеспечивает применимые данные о течении заболевания, так как оно является точным, единообразно интерпретируемым и высокоспецифичным. Иные проявления инфекции HTLV-III/LAV, отличные от тех, о которых в настоящее время сообщается, являются менее специфическими и менее вероятно, что о них сообразно сообщать национально. Более мягкие заболевания, ассоциированные с инфекцией HTLV-III/LAV, и асимптоматические инфекции могут подлежать сообщению в некоторых штатах и городах, но не должны сообщаться на национальном уровне. Так как пациенты с менее специфическими или более мягкими проявлениями инфекции HTLV-III/LAV могут быть важным звеном в цепи передачи вируса, оценка количества таких пациентов является важной. Такие оценки могут быть получены посредством эпидемиологических исследований или специальных исследований в специфических популяциях. Проблемы, относящиеся к определению случая СПИДа, обсуждались на Конференции эпидемиологов штата и территорий (CSTE) на их ежегодной встрече в Мэдисоне, Висконсин, 2-5 июня 1985. CSTE приняли следующие решения. 1. Что определение случая СПИД, используемое для национального сообщения, по-прежнему будет включать только более тяжелые проявления инфекции HTLV-III/LAV. 2. Что Центр для контроля за заболеванием (CDC) будет разрабатывать более содержательные определения и классификацию инфекции HTLV-III/LAV для диагностики, лечения и предотвращения, а также для эпидемиологических исследований и специальных исследований. 3. Что следующие уточнения приняты в определении случая СПИД, используемом для национального сообщения:a) в отсутствие оппортунистических заболеваний, требуемых для современного определения случая, любое из следующих заболеваний рассматривается как указывающее на СПИД, если пациент имеет положительный серологический или вирусологический тест на HTLV-III/LAV: 1) рассеянный гистоплазмоз (не ограниченный легкими или лимфатическими узлами), диагностированный по культуре, гистологически или определением антигена; 2) изоспориаз, вызывающий хроническую диарею (более 1 месяца), диагностированный гистологически или микроскопией кала; 3) бронхиальный или легочный кандидоз, диагностированный микроскопией или по присутствию характерных белых бляшек избыточно на слизистой оболочке бронхов (не только в культуре); 4) неходжкинская лимфома высокого патологического типа (диффузная, недифференцированная) или В-клеточного неизвестного иммунологического фенотипа, диагностированная по биопсии;-1 013683 5) гистологически подтвержденная саркома Капоши у пациентов 60 лет и старше при диагностировании;b) в отсутствие оппортунистических инфекций, требуемых для современного определения случая,гистологически подтвержденный диагноз хронического лимфоидного интерстициального пневмонита у ребенка (до 13 лет) рассматривается как свидетельствующий о СПИДе, если только исследования наc) пациенты, которые имеют лимфоретикулярное злокачественное заболевание, диагностированное более чем через 3 месяца после диагностики оппортунистической инфекции, используемой в качестве маркера СПИД, больше не исключаются как случаи СПИД;d) для увеличения специфичности определения случая пациенты исключаются как случаи СПИД,если они имеют отрицательный результат исследования антител к HTLV-III/LAV в сыворотке, не имеют положительного результата исследования HTLV-III/LAV другого типа и не имеют низкого количества лимфоцитов Т-хелперов или низкого соотношения лимфоцитов Т-хелперов к Т-супрессорам. В отсутствие результатов исследования, пациенты, удовлетворяющие всем другим критериям в определении, продолжают оставаться включенными. CDC немедленно принимает вышеуказанные поправки к определению случая СПИДа для национального сообщения. Такая переработка определения случая приведет к реклассификации менее чем 1% случаев, о которых ранее сообщалось CDC. Ожидают что количество дополнительных новых случаев, подлежащих сообщению в результате пересмотра, будет небольшим. Случаи, включенные по пересмотренному определению, будут отличимы от случаев, включенных по старому определению для того, чтобы обеспечить унифицированную основу для интерпретации тенденций. CDC также разработает план классификации для проявлений заболевания инфекции HTLV-III/LAV, иных чем СПИД, широко их распространит для комментариев и опубликует результаты. Сообщено по Conference of State and Territorial Epidemiologists;Han. et al. описали способ получения экстрагированного вещества из смеси обезжиренного крахмала из Ricini Semen и корня Coptis sp. для терапевтического применения при СПИД [патент США 5928645]. Авторы утверждают, что экстрагированное вещество было эффективным в лечении СПИД, но не представляют клинических данных в отношении эффекта этого вещества у пациентов со СПИД. В продолжающейся работе Han et al. продемонстрировали значительную антиоксидантную способность их экстракта Ricini Semen с использованием анализа хемилюминесценции [Hong E.K., Kim Y.K., Lee W.C.,Shin H.K. и Kim J.В.; Measurement of antioxidation activity based on chemiluminescence reaction. In Bioluminescence and Chemiluminescence (Status Report), Eds. Szalay A.A., Kricka L.J., и Stanley P., John WileySons Ltd. London, England, pp. 244-246, 1993]. Антиоксидантная активность экстракта Ricini Semen была сравнима с т-бутилгидрокситолуолом (БГТ (ВНТ, сильным антиоксидантом, известным обычным специалистам в области техники изобретения. Таким образом, авторы предположили, что экстракт RiciniSemen обладает анти-ВИЧ действием, хотя не было представлено клинических данных. Изучение экстракта Ricini Semen на лабораторных животных путем подкожной инъекции выявило значительный некроз канальцев, гломерулонефрит и образование вакуолей в печени самцов и самок мышей, также у самок мышей был продемонстрирован интерстициальный нефрит. У крыс были показаны такие же симптомы и у самцов и у самок. Обычно обнаруживали митозы в печени и также часто обнаруживали экстрамедуллярный гематопоэз в печени и селезенке. Другие органы не изменялись по сравнению с контрольной группой [патент США 5928645].Chen et al. [патент США 6077512] описывает новый способ местного лечения для лечения болезни черных ног с использованием растительных экстрактов. Лекарственный препарат экстракта включает основную часть, состоящую из равных количеств измельченных, порошкообразных и смешанных гвоздики, ладана, мирры, fhizama arisaematis, пинеллии, аконита (корень) или аконита Кузнецова (корень) и клубня бамбуколистной орхидеи и дополнительной части, состоящей из равных количеств измельченных, порошкообразных и смешанных борнеолы, порошкообразных бобов сои, буры, coptis root и/илиphellodendron amureause и сепии ядовитой. Лекарственный препарат используют таким образом, что порошкообразную основную часть смешивают и перемешивают с теплой водой, пока она не станет гипсоподобной, и дополнительную часть сыпят в сухом виде на раневую или отечную поверхность, вызываемую болезнью черных ног перед тем, как гипсоподобную основную часть наносят на раневую или отечную поверхность около 0,5 см толщиной. Затем рану перевязывают и лекарственное средство меняют один или два раза в день, пока в ране не появится свежая ткань. После этого лекарственное средство постоянно наносят, но в сухой форме, пока рана полностью не заживет. Композиция лекарственного препарата экстракта, предлагаемая Chen et al., не имеет какого-либо влияния на СПИД как таковой, как системное заболевание. Сущность изобретения Настоящее изобретение относится к композиции для лечения СПИД и ассоциированных состояний,относящихся к СПИД, композиция включает лекарственное средство, которое является экстрактом по меньшей мере одного семейства растений.-2 013683 Подробное описание Настоящее изобретение относится к новому лекарственному средству в виде экстракта для использования в лечении СПИДа, иммунодефицита или заболеваний с нарушением иммунитета, а также множества заболеваний, связанных с СПИДом, включая рецидивирующую и персистирующую лихорадку,хроническую диарею, дерматит, генерализованную лимфаденопатию, персистирующий кашель, общую боль, туберкулез и аменорею. Экстракт получают из коры, листьев, корней и стеблей по меньшей мере одного растения из семейств растений apocynaceae, annonaceae, dichapetaceae, annoceae, cynocynaceae,asclepiadaceae, combretaceae, amaranthaceae, araceae, cyperaceae, anacardiaceae, bignoniaceae, bombacaceae и caricacea. Выбирают подходящее растение. Предпочтительно выбирают смесь по меньшей мере двух растений. Подходящие растения выбирают из семейств растений, включающих семейства растений (1) apocynaceae, (2) annonaceae, (3) dichapetalaceae, (4) annoceae, (5) cynocynaceae, (6) asclepiadaceae, (7) combretaceae, (8) amaranthaceae, (9) araceae, (10) cyperaceae, (11) anacardiaceae, (12) bignoniaceae, (13) bombacaceae,(14) anacardiaceae и caricaceae. Такие растения представляют собой тропические травы, которые растут в природе и, следовательно, могут быть культивированы в тропиках, саванне, на лугах или слегка лесистых лесах Западной Африки. Такие пустынные растения также могут быть обнаружены в других тропических областях мира,включая Азию, Малую Азию, Южную Америку и, возможно, Юго-Западные, Западные и равнинные области Соединенных Штатов. Активные лекарственные средства из таких растений включают, но не ограничиваются, сложные эфиры глицерина, сапонины и некоторые производные алкалоидов, гликозидов,белков, жиров и углеводов. Растения per se не используют в качестве требуемого лекарственного средства, а скорее экстракт такого избранного растения или растений. Процесс экстракции лекарственного средства из соответствующих растений включает следующее:(a) сбор коры, стеблей, листьев и корней каждого растения и нарезание этого материала, на ломтики и куски;(b) промывание и высушивание ломтиков и кусков в условиях регулируемой температуры, обычно от около 15 до 68 в течение около 3 дней;(c) пропорциональное смешивание промытых и высушенных веществ из каждого растения для создания смеси, необходимой для каждого типа клинического применения;(d) измельчение полученной смеси частей растений до порошкообразной композиции, имеющей размер частиц, обычно варьирующийся в размере от около 100 до около 10000 мкм;(e) экстрагирование около одной части полученной порошкообразной смеси в около двух частей очищенной воды при медленном процеживании в течение от около 1 до около 5 ч при температуре в диапазоне от около 76 до около 116 С и оставление смеси для остывания в соответствующих контейнерах при температурных условиях окружающей среды, т.е. от около 16 до около 33 С в течение приблизительно 1-2 дней;(f) реэкстрагирование полученной смеси во втором процессе процеживания с использованием приблизительно 2 частей очищенной воды при медленном процеживании в течение от около 1 до около 5 ч при температуре в диапазоне от около 76 до около 116 С и оставление смеси для остывания в соответствующих контейнерах при температурных условиях окружающей среды, т.е. от около 16 до около 33 С в течение приблизительно 1-2 дней;(g) повторение процесса экстракции третий раз с использованием двойной порции очищенной воды при медленном процеживании в течение от около 1 до около 5 ч при температуре в диапазоне от около 76 до около 116 С и оставление смеси для остывания в соответствующих контейнерах при температурных условиях окружающей среды, т.е. от около 16 до около 33 С в течение приблизительно 1-2 дней;(h) добавление обычной консервирующей системы, например крезолов, парабенов, пхлорметаксиленола, бензоатов, спиртов, для поддержания противомикробной консервирующей эффективности смешанного растительного экстракта;(i) смешивание экстрактов в подходящем контейнере и подвергание полученного элюата повторно фильтрованию при соответствующем давлении и температурных условиях для получения беспримесного, чистого, консервированного растительного экстракта для потребления человеком;(j) заполнение полученным экстрактом через фильтр из нержавеющей стали соответствующих контейнеров для распространения и(k) маркировка контейнеров и помещение их на хранение (полученный концентрат также может быть далее концентрирован до порошка в условиях пониженной температуры/давления, например, путем лотковой сушки, экстракции растворителя, исключения растворителя или распылительной сушки с получением желтовато-коричневого аморфного порошка для применения в качестве инъекционного или твердого продукта, такого как таблетка; или путем фильтрования полученного продукта через мембранный фильтр и затем лиофилизации для получения порошков; и затем упаковка полученных смешанных экстрактов в соответствующие закрытые системы для клинического применения. Как правило, полученный концентрированный экстракт содержит следующие соединения для каж-3 013683 дого полученного растительного концентрата [см. L. Watson and M.J. Dallwitz (1992) The Families ofFlowering Plants: Descriptions, Illustrations, Identification, and Information Retrieval. Version: 14th December 2000]. Перед введением пациенту экстракт или смесь экстрактов обычно разводят комбинацией с фармакологически совместимым растворителем, например этанолом или водой, для получения терапевтического раствора. Обычно количество или концентрация экстракта или смешанных экстрактов в терапевтическом растворе варьирует от 0,0001 до 10,0 мас.% от общей массы раствора. Конечно, экстракт или смесь экстрактов присутствует в терапевтически эффективном количестве, а именно в таком количестве,что экстракт или смесь экстрактов могут вводиться в терапевтически эффективном количестве посредством обычных пероральных, назальных, аэрозольных, местных, внутривенных, перитонеальных и др. средств. Термин количество, как используется в настоящем описании, относится к количеству или концентрации, как следует из контекста. Количество экстракта(ов), которое составляет терапевтически эффективное количество, варьирует в соответствии с такими факторами, как эффективность экстрата(ов),путь введения композиции и механическая система, используемая для введения композиции. Терапевтически эффективное количество определенного экстракта или смеси экстрактов может быть выбрано обычным специалистом в области техники посредством рассмотрения таких факторов. Обычно терапевтически эффективное количество составляет от около 0,005 до около 2 мас.ч. на 100 мас.ч. терапевтического раствора, или в случае твердых форм, таких как например, таблетки или капсулы, от 0,001 до 10 мас.ч. от массы таблетки или капсулы. Для перорального введения могут быть получены как твердые, так и жидкие стандартные лекарственные формы. Для получения твердых композиций, таких как таблетки, экстракт или смесь экстрактов смешивают в композиции с обычными ингредиентами, такими как тальк, стеарат магния, фосфат дикальция, алюмосиликат магния, сульфат кальция, крахмал, лактоза, акация, метилцеллюлоза и функционально подобные вещества, как фармацевтические разбавители или носители. Капсулы получают путем смешивания экстракта или смеси экстрактов с инертным фармацевтическим разбавителем и заполнения смесью твердых желатиновых капсул соответствующего размера. Мягкие желатиновые капсулы получают путем механического включения в капсулу взвеси экстракта или смеси экстрактов с приемлемым растительным маслом, светлым жидким вазелином или другим инертным маслом. Жидкие стандартные лекарственные формы для перорального введения, такие как сиропы, эликсиры и суспензии могут быть получены. Водорастворимые формы могут быть растворены в водном носителе вместе с сахаром, ароматическими отдушками и консервантами для образования сиропа. Эликсир получают с использованием водно-спиртового (например, этанол) растворителя с подходящими подсластителями, такими как сахар и сахарин, вместе с ароматической отдушкой. Суспензии могут быть получены с водным растворителем с помощью суспендирующего агента, такого как гуммиарабик, трагакант,метилцеллюлоза и подобное. Соответствующие композиции для парентерального применения являются очевидными для обычного практикующего врача. Обычно терапевтический экстракт или смесь экстрактов получают в водном растворе в концентрации от около 1 до около 100 мг/мл. Как правило, концентрация составляет от около 10 до около 20 мг/мл. Композиции, которые являются стерильными, подходят для различных парентеральных путей, включая интрадермальный, внутрисуставный, внутримышечный, внутрисосудистый и подкожный. В добавление к терапевтическому экстракту или смеси экстрактов композиции могут включать, в зависимости от желаемой композиции, фармацевтически приемлемые нетоксические носители или разбавители, которые включают носители, обычно используемые для создания фармацевтических композиций для введения животным или человеку. Разбавитель выбирают так, чтобы чрезмерно не воздействовать на биологическую активность комбинации. Примерами таких разбавителей, которые являются особенно применимыми для инъекционных композиций, являются вода, различные солевые растворы, раствор Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или рецептура может включать добавки, такие как другие носители; вспомогательные вещества; или нетоксические, нетерапевтические, неиммуногенные стабилизаторы и подобное. Кроме того, в композицию могут быть включены вспомогательные вещества. Примеры включают сорастворители, поверхностно-активные вещества, масла, увлажнители, смягчающие вещества, консерванты, стабилизаторы и антиоксиданты. Любой фармакологически приемлемый буфер может быть использован, например трис или фосфатный буфер. Эффективные количества разбавителей, добавок и вспомогательных веществ представляют собой такие количества, которые являются эффективными для получения фармацевтически приемлемой композиции в отношении растворимости, биологической активности и др. Термин стандартная лекарственная форма относится к физически отдельным единицам, подходящим в качестве единых дозировок для людей и животных, каждая единица содержит заранее определенное количество активного вещества, рассчитанное для получения желаемого фармацевтического эффекта в ассоциации с требуемым фармацевтическим разбавителем, носителем или растворителем. Спе-4 013683 цификации для стандартных лекарственных форм по настоящему изобретению зависят от (а) уникальных характеристик активного вещества и определенного достигаемого эффекта и (b) ограничений, свойственных в области техники рецептуры такого активного вещества, для использования у людей и животных. Примерами стандартных лекарственных форм являются таблетки, капсулы, пилюли, упаковки порошков, вафли, суппозитории, гранулы, облатки, мерные ложечки, капельницы, ампулы, флаконы, аэрозоли с дозирующим выбросом, отдельные составляющие любого из вышеперечисленного и другие формы, как описано в настоящем описании. Следовательно, композиция по изобретению включает терапевтический экстракт(ы), который может быть рецептирован с обычными фармацевтически приемлемыми носителями для местного, перорального или парентерального введения. Композиции также могут включать небольшие количества добавок, таких как буферы и консерванты для поддержания изотоничности, стабильности физиологической и рН. Средства получения, рецептуры и введения являются известными специалисту в области техники. См. в целом Remington's Pharmaceutical Science 15th., Mack Publising Co., Easton, Pa. (1980). Системы с медленной или продолжительной доставкой, включающие ряд биополимеров (биологические системы), системы, использующие липосомы и полимерные системы доставки, могут быть использованы с экстрактами, описанными в настоящем описании, для получения непрерывного или продолжительного источника терапевтического соединения. Подобные системы замедленного высвобождения являются применимыми для композиций для местного, офтальмологического, перорального и парентерального применения. Доставка изобретенного терапевтического экстракта или смеси экстрактов обычно происходит путем перорального введения в виде раствора. Однако при необходимости также может использоваться,например, интрадермальная, внутрисуставная, внутримышечная или внутривенная терапия. Как указано ранее, было обнаружено, что полученный лекарственный экстракт, например, из одного растения или смеси любых вышеупомянутых растений является эффективным в лечении СПИДа, а также в лечении связанных состояний, относящихся к СПИДу. Такие связанные состояния включают рецидивирующую или персистирующую лихорадку, хроническую диарею, дерматит, генерализованную лимфаденопатию, персистирующий кашель, общую боль, туберкулез и аменорею. ПримерыI. Около 105 пациентов, страдающих СПИДом, получали лечение смесями растительных экстрактов, полученных, как описано выше, в виде приблизительно 10 мас.% терапевтических растворов со следующими результатами, как показано в табл. I ниже.-5 013683 Таблица I Комбинации лекарственных растительных экстрактов для лечения заболеваний, связанных с СПИДомII. Лечение пациентов с ВИЧ в отношении заболеваний, связанных с СПИДом. Всего 300 пациентов, имеющих умеренные или выраженные стадии СПИДа, в особенности в отношении ослабляющих заболеваний, включающих персистирующую лихорадку, хроническую диарею,дерматит, генерализованную лимфаденопатию, персистирующий кашель, общую боль, туберкулез и-7 013683 аменорею, получали лечение раствором смеси экстрактов по изобретению. Смесь включала Anoceae (1020 мас.%), Anarcadiaceae (15-20 мас.%), Araceae (15-20 мас.%), Bombacaceae (20 мас.%), Caricaceae (15-20 мас.%) и Combretaceae (3-10 мас.%). Такую смесь затем разводили водой для получения около 10 мас.% раствора экстракта. Раствор вводили каждому пациенту в дозе 3 полные столовые ложки три раза в день. Все пациенты, получающие лечение в этой группе исследований, не имели ослабляющих симптомов во временные периоды, указанные в табл. II ниже. Таблица II ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для лечения СПИДа и связанных со СПИДом состояний, включающая смесь водных травяных экстрактов, выбранную из экстрактов следующих трав:differmis, Ceiba pentanota или Bombax bounopozense, Carica papaya и Combretum racemosum. 2. Способ лечения СПИДа и связанных со СПИДом состояний у пациента, включающий введение пациенту композиции по п.1. 3. Способ по п.2, где связанное со СПИДом состояние выбрано из группы, состоящей из рецидивирующей и персистирующей лихорадки, хронической диареи, дерматита, генерализованной лимфаденопатии, кашля, общей боли, туберкулеза, аменореи и комбинации любых из вышеуказанных состояний. 4. Способ по п.2, где указанную композицию вводят в организм пациента, например, перорально,назально, ректально, путем инъекции или путем комбинации указанных способов введения.
МПК / Метки
МПК: A61K 36/00, A61P 31/18
Метки: спидом, композиция, связанных, лечения, состояний, спида
Код ссылки
<a href="https://eas.patents.su/9-13683-kompoziciya-dlya-lecheniya-spida-i-svyazannyh-so-spidom-sostoyanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция для лечения спидa и связанных со спидoм состояний</a>
Предыдущий патент: Композиция, содержащая метафлумизон, для профилактики и лечения эктопаразитарной инфекции у животных
Следующий патент: Гетероциклические соединения бороновой кислоты
Случайный патент: Замещенные производные триазола и имидазола в качестве модуляторов гамма-секретазы