Способ получения (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила и его производных
Номер патента: 10100
Опубликовано: 30.06.2008
Авторы: Волберг Михель, Минк Даниэль, Серейниг Наташа, Бустен Вильхельмус Хюбертус Йозеф
Формула / Реферат
1. Способ получения соединения формулы (1) или его энантиомерно обогащенной формы
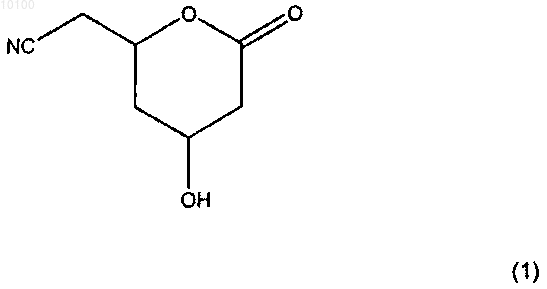
в котором соединение формулы (2) или его энантиомерно обогащенная форма
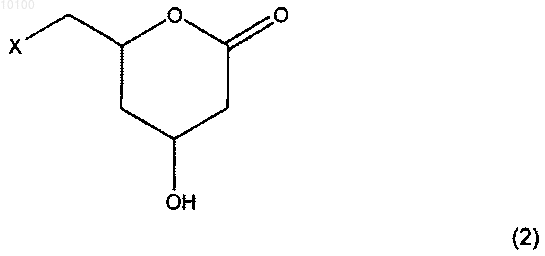
где X обозначает уходящую группу, реагирует с цианидом в воде и в котором затем pH понижают до значений 0-5.
2. Способ по п.1, в котором концентрация цианида составляет по крайней мере 1 моль на литр.
3. Способ по п.1 или 2, в котором мольное отношение между суммарным количеством цианида и общим количеством соединения формулы 2 равно 0,5-10.
4. Способ по любому из пп.1-3, в котором соединение формулы (1) перед взаимодействием с цианидом обрабатывают основанием.
5. Способ по п.4, в котором основание используют при мольном отношении от 0,3 до 3 по отношению к количеству соединения формулы (2).
6. Соединение, представляющее собой (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил.
7. Соединение по п.6, которое является энантиомерно обогащенным.
Текст
010100 Данное изобретение относится к способу получения соединения формулы 1 Вышеупомянутое соединение может быть соответственно использовано в качестве промежуточного продукта для получения различных активных ингредиентов фармацевтических препаратов, в частности,для получения ингибиторов HMG-CoA редуктазы, более конкретно для получения статинов, например,для получения аторвастатина, как описано у A. Kleemann, J. Engel; Pharmaceutical substances, synthesis,patents, applications 4th edition, 2001 Georg Thieme Verlag, p. 146-150. Соединение формулы 1 получают, согласно данному изобретению, путем взаимодействия соединения формулы 2 с цианид-ионом в воде с последующим понижением рН до значений в интервале от 0 до 5. где X обозначает уходящую группу. По сравнению с известными способами получения аторвастатина способ данного изобретения является более простым, но при этом эффективным и прибыльным. Преимуществами предлагаемого способа являются, например, то, что он хорошо масштабируется, не требует очень низких температур или опасных реагентов, таких как металлорганические соединения или алкилбораны. Уходящие группы X, которые могут быть использованы в этой реакции, включают, например, галогены, в частности, Cl, Br, I; функциональные группы эфиров сульфоновой кислоты, в частности, тозилат-,метилсульфонилат- или бензолсульфонатные группы, каждая из которых может быть необязательно замещена на галоген-или нитрогруппу; ацилоксигруппы, в частности, ацетокси- или бензоилоксигруппы. С точки зрения практического применения, под X подразумевается Cl. Для вышеприведенной реакции цианид-ион может быть добавлен, например, в виде солей синильной кислоты или в виде смеси синильной кислоты и основания. В принципе, могут быть использованы любые соли синильной кислоты, которые к настоящему времени известны специалистам. Это могут быть соли синильной кислоты со щелочным металлом в качестве катиона, например, цианистый натрий, цианистый калий или цианистый литий; соли синильной кислоты с объемным органическим катионом, например, цианид тетрабутиламмония или цианид тетрабутилфосфония. Для коммерческого использования предпочтительнее цианистый натрий или цианистый калий. Предпочтительно, чтобы концентрация цианид-иона составляла по крайней мере 1 моль на литр,более предпочтительно по крайней мере 5 молей на литр и наиболее предпочтительно по крайней мере 10 молей на литр. Предпочтительно выбирать как можно более высокую концентрацию цианид-иона. Значение температуры, при которой проводят реакцию, в принципе, не является важным определяющим показателем, например, она может быть выбрана в интервале 0-100 С, предпочтительнее в интервале 30-70 С, и наиболее предпочтительно в интервале 40-60 С. Понижение рН до значений в интервале 0-5, предпочтительнее в интервале 2-4, может быть осуществлено известным способом, например, в результате добавления кислоты, предпочтительно сильной кислоты, например, имеющей pKа 4, а предпочтительнее pKа 2. В случае необходимости, до понижения значения рН избыток цианид-иона может быть удален с помощью окислителя, например, хлора, гипохлорита или H2O2, как описано, например, в патенте США 3617567. В одном из вариантов осуществления данного изобретения соединение формулы 2 до проведения реакции с цианид-ионом может сначала быть обработано основанием. Обе стадии реакции могут быть исполнены в одном и том же реакторе. Выбор основания, используемого для превращения соединения формулы 2 в соединение формулы 1, а также в комбинации с HCN или перед реакцией с цианид-ионом, в принципе, не язляется важным определяющим показателем. К основаниям, которые соответственно могут быть использованы, относятся, например, гидроксиды щелочных (щелочно-земельных) металлов, например, гидроксид натрия или калия, карбонаты щелочных (щелочно-земельных) металлов, например карбонат натрия или карбонат магния, NH4OH или N(алкил)4OH, алкоголяты, NH3 или N(алкил)3 и карбоксилаты. Предпочтительно использовать основание при мольном отношении к количеству соединения формулы 2 в интервале от 0,3 до 3, более предпочтительно при мольном отношении от 0,5 до 1,5, наиболее предпочтительно при мольном отношении от 0,9 до 1,1. Если соединение формулы 2 сначала обрабатывается основанием, то мольное отношение общего количества цианид-иона к общему количеству соединения формулы 2 предпочтительно должно составлять от 0,5 до 10, более предпочтительно от 1 до 5, наиболее предпочтительно от 1,5 до 2,5. Если соединение формулы 2 сначала основанием не обрабатывают, то предпочтительно, чтобы-1 010100 мольное отношение общего количества цианид-иона к общему количеству соединения формулы 2 составляло от 1 до 11, более предпочтительно от 2 до 6, наиболее предпочтительно от 2,5 до 3,5 мольных эквивалентов. Соединение формулы 1 может быть восстановлено соответствующим восстановителем с образованием соответствующего соединения формулы 3 Восстановитель может быть выбран из группы восстановителей, которые обычно применяются для восстановления нитрилов в амины. Примером таких восстановителей являются восстанавливающие реагенты на основе гидридов, например, dibalH (гидрид диизобутилалюминия); на основе водорода, например, Н 2 на никеле Ренея, Rh/Al2O3/NH2 или Pd(OH)2 с Н 2. Соединения формулы 2, где X обозначает уходящую группу, может быть получено, например, альдольной конденсацией ацетальдегида с альдегидом, имеющим X в качестве заместителя в положении 2,где X уже был определен выше, в присутствии альдолазы, например, как описано в патенте США 5795749, и последующей реакцией образовавшегося соединения формулы 4 с окислителем где X уже был определен выше. Предпочтительно, чтобы в процессе альдольной конденсации при получении соединения формулы 4 концентрация карбонила, то есть сумма концентраций альдегида, альдегида, замещенного в 2 положение, и промежуточного продукта, образовавшегося по реакции между альдегидом и альдегидом, замещенным во 2 положение (промежуточное соединение 4-замещенный-3-гидроксибутаналь), составляла от 0,1 до 5 молей на литр реакционной смеси, более предпочтительно - от 0,6 до 4 молей на литр реакционной смеси. Температура и рН реакции не являются определяющими показателями и выбираются в зависимости от субстрата. Предпочтительно проводить реакцию в жидкой фазе. Реакция может осуществляться при температуре от -5 до 45 С, предпочтительно от 0 до 10 С и при рН от 5,5 до 9, предпочтительно 6-8. Реакцию предпочтительно проводить при более или менее постоянном значении рН, используя для этого, например, буфер или автоматическое титрование. В качестве буфера могут быть использованы,например, бикарбонаты натрия и калия, фосфаты натрия и калия, триэтаноламин/HCl, бис-триспропан/HCl и HEPES/KOH. Предпочтительно использовать буфер на основе бикарбонатов натрия и калия, например, при концентрации их в реакционной смеси от 20 до 400 ммоль/л. Мольное отношение общего количества альдегида к общему количеству альдегида с заместителем во 2 положении не является определяющим показателем и предпочтительно составляет от 1,5:1 до 4:1, в частности, от 1,8:1 до 2,2:1. Предпочтительно, чтобы в качестве альдолазы использовалась 2-дезоксирибоза-5-фосфатальдолаза(DERA, ЕС 4.1.2.4) или ее мутант, более предпочтительно - DERA из Escherichia coli или ее мутант. Необходимое для использования количество DERA не является определяющим показателем и выбирается в зависимости от, например, используемых реагентов, концентрации реагентов, требуемой скорости реакции, желаемой продолжительности реакции и других экономических факторов. Количество используемой DERA составляет от 50 до 5000 U на ммоль замещенного или незамещенного альдегидов. 1 U (единица) - это мера ферментной активности и соответствует превращению 1 моля 2-дезоксирибоза-5 фосфата в минуту при 37 С. Способ, описанный в данном изобретении, имеет особые преимущества, так как и получение соединения формулы 2 из простых альдегидов, и последующее превращение соединения формулы 2 в соединение формулы 1 может быть осуществлено в воде. Использование воды в качестве растворителя имеет много преимуществ, известных специалистам, например, вода является дешевым, доступным в широких масштабах и неопасным для окружающей среды растворителем. В качестве окислителя, используемого для окисления соединения формулы 4, могут быть использованы все известные специалистам окислители, применяемые для окисления спиртов в кетоны. Примерами таких окислителей являются Br2, Cl2, NaClO, NiO4, CrO3 и пероксиды, например, H2O2. Соединение формулы 1 или соединение формулы 3 может быть последовательно превращено в соединение формулы 6 где R1 обозначает CN или CH2NH2 и R2, R3 и R4, каждый независимо друг от друга, обозначает ал-2 010100 кил, например, с 1-12 атомами углерода, предпочтительно с 1-6 атомами углерода; алкенил, например, с 1-12 атомами углерода, предпочтительно 1-6 атомами углерода; циклоалкил, например, с 3-7 атомами углерода; циклоалкенил, например, с 3-7 атомами углерода; арил, например, с 6-10 атомами углерода или арилалкил, например, с 7-12 атомами углерода, каждый из R2, R3 и R4 может быть замещенным и где R2 иR3 могут образовывать кольцо с атомом углерода, с которым они связаны, используя приемлемый ацетальобразующий агент в присутствии кислотного катализатора, например, как описано в WO 02/06266. Заместителями в R2, R3 и R4 могут быть, например, галогены или углеводородные группы, содержащие, например, от 1 до 10 атомов углерода, необязательно содержащие один или более гетероатомов,например, Si, N, Р, О, S, F, Cl, Br или I. Под термином алкил подразумеваются как линейные, так и разветвленные углеводородные цепи. Например, к ним относятся метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, гексил и октил. Под термином алкенил подразумеваются линейные и разветвленные углеводородные цепи, такие как винил, аллил и изобутенил. Термин циклоалкил включает в себя насыщенные кольцеобразные углеводородные цепи. Примерами таких цепей являются циклопентил и циклогексил. Под термином циклоалкенил подразумеваются ненасыщенные кольцеобразные углеводородные цепи. Термин арил обозначает как ароматические и гетероароматические системы, так и их замещенные варианты. К ним относятся,например, фенил, параметилфенил и фуранил. Термин арилалкил означает комбинацию арила и алкила с остатком арила, соединенного через алкильную цепь, например, бензил. Предпочтительно, чтобы группы R2, R3 и R4, каждая независимо друг от друга, содержали 1-3 атома углерода, более предпочтительно - метил или этил. Предпочтительно, чтобы R4 являлся метилом. Для практических целей наиболее предпочтительным является вариант R2=R3=R4, и все они являются метилом. К примерам реагентов, подходящих для образования ацеталей, которые могут быть использованы в данном изобретении, относятся соединения на основе диалкоксипропана, причем каждая алкоксигруппа,предпочтительно, должна иметь 1-3 атома углерода, например, 2,2-диметоксипропан или 2,2-диэтоксипропан; на основе алкоксипропена с алкоксигруппой, содержащей, предпочтительно, от 1 до 3 атомов углерода, например, 2-метоксипропен или 2-этоксипропен. Наиболее предпочтительным является 2,2 диметоксипропан. Как один из вариантов он может быть получен in situ из ацетона и метанола, причем предпочтительно, чтобы при этом удалялась вода. В качестве кислотного катализатора могут использоваться кислотные катализаторы, известные для реакций образования ацеталей, предпочтительно сильные органические кислоты с pKa4 и ненуклеофильным анионом, например, сульфокислоты, в частности, п-толуолсульфокислота, метансульфокислота или камфорасульфокислота; или неорганические сильные кислоты с pKa4 и ненуклеофильным анионом,например, серная кислота HCl, фосфорная кислота, кислые иониты, например, DOWEX; или твердые кислоты, например, так называемые гетерополикислоты. Получение ацеталей может проводиться без использования специального растворителя, но если это желательно, то эта реакция также может осуществляться в органических растворителях. Примеры приемлемых органических растворителей включают кетоны, в частности, ацетон, углеводороды, в частности, ароматические углеводороды, например, толуол, хлорированные углеводороды, например, метиленхлорид. Температура, при которой проводят реакцию получения ацеталей, не является определяющим показателем и лежит в пределах предпочтительно от -20 С до 150 С, в частности от 0 С до 100 С. Мольное отношение реагента, образующего ацеталь, к соединению формулы 5 составляет предпочтительно от 1:1 до 20:1, в частности, от 3:1 до 5:1. При использовании органического растворителя мольное отношение составляет, в частности, от 1:1 до 2:1. Мольное отношение кислотного катализатора к соединению формулы 5 составляет предпочтительно от 1:1 до 0,001:1, в частности, от 0,05:1 до 0,1:1. Соединение формулы 6, где R1 обозначает CN или CH2NH2 и где R2, R3 и R4 уже были определены выше, может быть далее подвергнуто гидролизу в присутствии основания и воды с образованием соответствующей соли формулы 7 где Y обозначает щелочной металл, например, литий, натрий, калий, предпочтительно натрий; щелочно-земельный металл, например, магний или кальций, предпочтительно кальций; или замещенную или незамещенную аммониевую группу, предпочтительно тетраалкиламмониевую группу. Необязательно, гидролиз приводит к образованию соответствующего соединения формулы 7, где Y обозначает Н,например, как описано в WO 02/06266. Гидролиз соединения формулы 6 проводится предпочтительно по крайней мере с 1 эквивалентом основания, в частности, 1-1,5 эквивалентов основания, по отношению к соединению формулы 6. В принципе, может быть использован и больший избыток, но на практике это обычно не дает каких-либо пре-3010100 имуществ. Предпочтительно проводить реакцию при температуре от -20 до 60 С, в частности, от 0 до 30 С. Гидролиз может проводиться, например, в воде, органическом растворителе, например, спирте, в частности, метаноле или этаноле, ароматическом углеводороде, например, толуоле, или кетоне, в частности, ацетоне или метилизобутилкетоне (МИБК), или в смеси органического растворителя и воды, катализируемый необязательно межфазным катализатором, или добавлением сорастворителя. Соединение формулы 6, где R1, R2, R3 и R4 уже были определены выше, может быть превращено в соответствующую соль формулы 7, где R1, R2, R3 и Y уже были определены выше, с помощью ферментов, например, как это описано в WO 02/06266. К ферментам, которые могут быть использованы для превращения соединения формулы 6 в соответствующую соль формулы 7, относятся ферменты с активностью по липазе или эстеразе, например,ферменты из Pseudomonas, в частности, Pseudomonas fluorescens, Pseudomonas fragi; Burkholderia, например, Burkholderia cepacia; Chromobacterium, в частности, Chromobacterium viscosum; Bacillus, в частности,Bacillus thermocatenulatus, Bacillus licheniformis; Alcaligenes, в частности, Alcaligenes faecalis; Aspergillus,в частности, Aspergillus niger, Candida, в частности, Candida antarctica, Candida rugosa, Candida lipolytica,Candida cylindracea; Geotrichum, в частности, Geotrichum candidum; Humicola, в частности, Humicola lanuginosa; Penicillium, в частности, Penicillium cyclopium, Penicillium roquefortii, Penicillium camembertii;Rhizopus, в частности, Rhizopus oryzae, Rhizopus arhizus, Rhizopus delemar, Rhizopus niveus, Rhizopus japonicus, Rhizopus javanicus; липаза поджелудочной железы свиньи, липаза проростков пшеницы, липаза поджелудочной железы крупного рогатого скота, эстераза печени свиньи. Предпочтительно использование фермента, полученного из Pseudomonas cepacia, Pseudomonas sp., Burkholderia cepacia, свиной поджелудочной железы, Rhizomucor miehei, Humicola lanuginosa, Candida rugosa или Candida antarctica или сабтилизина. Такие ферменты могут быть получены по общеизвестным технологиям, и/или они выпускаются промышленностью. Соль формулы 7 может быть превращена в соответствующий сложный эфир формулы 8 где R1 обозначает CN или CH2NH2, где R2 и R3 уже были определены выше, и R5 может обозначать такие же группы, как выше уже было определено для R2, R3 и R4, по существу известным способом (например, как описано в WO 02/06266). Например, R5 может обозначать метил, этил, пропил, изобутил или трет-бутил. Важной группой сложных эфиров формулы 8, которые могут быть получены в соответствии с данным изобретением, являются трет-бутиловые эфиры (R5 обозначает трет-бутил). Отличительной особенностью данного изобретения является то, что соль формулы 7 превращают в соответствующий сложный эфир формулы 8 в результате контактирования соли формулы 7 в инертном растворителе, например, толуоле, с реагентом, образующим кислый хлорид, чтобы получить соответствующий кислый хлорид, и контактированием образовавшегося кислого хлорида со спиртом формулыR5OH, где R5 уже был определен выше, в присутствии N-метилморфолина (NMM). Реагент, образующий кислый хлорид, может быть выбран из соответствующей общеизвестной группы этих реагентов. Подходящими примерами реагентов, образующих кислые хлориды, являются оксалилхлорид, тионилхлорид, PCl3, PCl5 и POCl3. Предпочтительно использовать избыток реагента, образующего кислый хлорид, по отношению к количеству соли формулы 7, например, от 1 до 3 эквивалентов, наиболее предпочтительно - от 1,2 до 1,8 эквивалентов. В случае необходимости для образования кислого хлорида может также использоваться катализатор. Количество катализатора может быть различным, например, 0-1, предпочтительно 0-0,5 эквивалента, вычисленных по отношению к количеству соли формулы 6. Возможны и более высокие количества катализатора, но это обычно не дает дополнительных преимуществ. Предпочтительно, чтобы количество катализатора, если таковой используется, составляло 0,05-0,2 эквивалента, вычисленных по отношению к соли формулы 7. Подходящими катализаторами являются общеизвестные катализаторы, ускоряющие образование кислых хлоридов, например, диметилформамид (ДМФА) и N-метилпирролидон (NМП). Количество спирта формулы R5OH при превращении соли формулы 7 не является определяющим показателем и, предпочтительно, составляет 1-15 эквивалентов, вычисленных по отношению к количеству соли формулы 7, более предпочтительно от 2 до 13 и наиболее предпочтительно от 3 до 6. На практике, при конверсии соли формулы 7 отличительной особенностью данного изобретения является использование небольшого количества NMM, достаточного для улавливания остающейся в итоге свободной HCl, например, от 1,5 до 2,5, предпочтительно от 1,8 до 2,0 эквивалентов, вычисленных по отношению к количеству соли формулы 7. При большом избытке реагента, образующего кислый хлорид,предпочтительнее использование более высоких количеств NMM, а при более низком избытке реагента,образующего кислый хлорид, предпочтительнее использовать более низкие количества NMM.-4 010100 Предпочтительно, чтобы соль формулы 7 контактировала с реагентом, образующим кислый хлорид,при температуре от -30 до 60 С, более предпочтительно от 20 до 50 С. Превращение кислого хлорида в сложный эфир формулы 7 предпочтительно проводить при температуре от 20 до 80 С, более предпочтительно от 20 до 50 С. Превращение соли формулы 7 в соответствующий сложный эфир формулы 8, согласно отличительной особенности данного изобретения, может проводиться в одну стадию. Предпочтительно, чтобы сначала соль формулы 7 превращали в соответствующий кислый хлорид, а затем кислый хлорид контактировали со спиртом формулы R5OH и NMM. В частности, предпочтительным вариантом осуществления изобретения является гашение образовавшегося кислого хлорида NMM и спиртом формулы R5OH. Упоминавшиеся в описании соединения, в которых R1 обозначает CN, могут быть восстановлены подходящими восстановителями с образованием соответствующего соединения, в котором R1 обозначаетCH2NH2. Подходящими восстановителями являются общеизвестные специалистам восстановители, используемые для восстановления нитрилов в амины, примеры которых приводились выше. Также возможно начинать с обогащенного энантиомерами соединения формулы 2 для того, чтобы получить соответствующие обогащенные энантиомерами соединения. Обогащенное энантиомерами соединение формулы 2 может быть, например, получено альдольной конденсацией ацетальдегида с альдегидом, который имеет в положении 2 заместитель X, в присутствии DERA из Escherichia coli, как уже было описано выше. Исходя из (4R,6S)-6-хлорметилтетрагидропиран-2,4-диола, через цианирование его окисленной формы (4R,6S)-6-хлорметил-4-гидрокситетрагидропиран-2-она с образованием соответствующего 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила и последующей ацетализации 2R,4R)4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила в сложный эфир 4R,6R)-6-цианометил-2,2 диметил-[1,3]-диоксан-4-ил)уксусной кислоты, могут образовываться, например, его метиловый эфир,этиловый эфир или трет-бутиловый эфир. Предпочтительно, чтобы энантиомерный избыток (э.и.) полученных обогащенных энантиомерами соединений составлял 80% э.и., более предпочтительно 90% э.и.,еще более предпочтительно 95% э.и., еще более предпочтительно 98% э.и., наиболее предпочтительно 99% э.и. Если при превращении сложного эфира 4R,6R)-4-гидрокси-6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)-уксусной кислоты в соответствующую соль используется энантиоселективный фермент, то,кроме того, дальнейшее обогащение энантиомерами происходит во время гидролиза. Соединения, полученные с помощью процесса данного изобретения, особенно подходят для получения активного ингредиента фармацевтического препарата, например, статина. Особенно интересным примером такого препарата является кальциевая соль аторвастатина, как описано у A. Kleemann, J. Engel;Pharmaceutical substances, synthesis, patents, applications 4th edition, 2001 Georg Thieme Verlag, p. 146-150. Поэтому это изобретение также имеет отношение к новым промежуточным продуктам в таком процессе, например, к соединениям (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил, 6-(2-аминоэтил)4-гидрокситетрагидропиран-2-он,метиловый эфир(6-цианометил-2,2-диметил-[1,3]диоксан-4 ил)уксусной кислоты, этиловый эфир (6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты,изопропиловый эфир (6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты, н-пропиловый эфир (6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)уксусной кислоты, метиловый эфир [6-(2-аминоэтил)-2,2-диметил-[1,3]диоксан-4-ил]уксусной кислоты, этиловый эфир [6-(2-аминоэтил)-2,2-диметил[1,3]-диоксан-4-ил]уксусной кислоты, изопропиловый эфир [6-(2-аминоэтил)-2,2-диметил-[1,3]-диоксан 4-ил]уксусной кислоты, н-пропиловый эфир [6-(2-аминоэтил)-2,2-диметил-[1,3]диоксан-4-ил]уксусной кислоты. Кроме того, данное изобретение относится к способу, в котором полученное соединение, согласно данному изобретению, далее превращают в статин, предпочтительно в аторвастатин или его соль, например, кальциевую соль известным по существу методом. Такие процессы хорошо известны в технике. Примеры Пример 1. Получение 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил (соединение формулы 1, обогащенное энантиомерами). В трехгорлой круглодонной колбе емкостью 250 мл, снабженной капельной воронкой, механической мешалкой, и с водяным охлаждением суспендировали 42 г (4R,6S)-6-хлорметил-4-гидрокситетрагидропиран-2-она (соединение формулы 2, обогащенное энантиомерами, где Х=Cl) в 25 мл деминерализованной воды при перемешивании. Добавляли по каплям водный раствор гидроксида калия (28 г, 50 мас.%) в течение трех часов. Капельную воронку промывали водой (4 мл) и удаляли. Одной порцией добавляли твердый цианистый калий (26 г) и колбу нагревали до 45 С (температура водяной бани) в течение 5 ч и до 50 С еще в течение 30 мин. Водяную баню заменяли ледяной баней и удаляли избыток цианида путем добавления гидрата ацетата меди (II) (1 мг) и по каплям водного раствора перекиси водорода(8,1 мл, 50 мас.%) в течение 30 мин (Тмакс=60 оС). После перемешивания при 22 С в течение 1 ч смесь охлаждали на ледяной бане, добавляли противовспениватель (Sigma type 204, 0,02 мл) и по каплям водный раствор соляной кислоты (35 мл, 37 мас.%) в течение 2,5 ч. Подкисленную смесь фильтровали через фильтровальную бумагу и осадок на фильтре промывали четыре раза водой (по 10 мл каждый раз). Объ-5 010100 единенный фильтрат подвергали непрерывной экстракции этилацетатом в течение одного дня. Добавляли к водной фазе еще одну порцию водного раствора соляной кислоты (3 мл, 37 мас.%) и затем подвергали ее непрерывной экстракции этилацетатом в течение двух дней. Объединенные органические фазы обезвоживали над сульфатом натрия, фильтровали и упаривали под вакуумом, получая остаток в виде высоковязкого оранжевого масла, которое согласно данным тонкослойной хроматографии (ТСХ) и ЯМР анализов содержало целевое соединение 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил(соединение формулы 1, обогащенное энантиомерами). Выход: 29,6 г (76%). Образец неочищенного продукта (1,0 г) очищали колоночной хроматографией (100 мл силикагеля 60, 230-400 меш, диаметр колонны 3 см, элюирование смесью ацетонитрил/дихлометан, 3:7, об./об., размер фракции 20 мл). Самые чистые фракции объединяли и упаривали под вакуумом, получая 0,31 г целевого соединения 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила в виде твердого белого вещества после сушки при высоком вакууме. 1 Н-ЯМР (300 МГц, d6-ДМСО, остаточный недейтерированный растворитель в качестве внутреннего стандарта: 2,51 млн.д.), : 1,72-1,81 (м, 1 Н, Н-3), 1,88-1,97 (м, 1 Н, Н-3), 2,44 (дт, J=17,5, 2 Гц, 1 Н, Н-5),2,70 (дд, J=17,5, 4,7 Гц, 1 Н, Н-5), 2,95 (дд, J=17,1, 6,6 Гц, 1 Н, CH2CN), 3,05 (дд, J=17,1, 4,6 Гц, 1 Н,CH2CN), 4,15-4,21 (м, 1 Н, Н-4), 4,77-4,87 (м, 1 Н, Н-2), 5,37 (д, J=3,4 Гц, 1 Н, ОН). 13 С-ЯМР: (75,5 МГц, d6-ДМСО, дейтерированный растворитель в качестве внутреннего стандарта: 39,5 млн.д.), : 23,5 (CH2CN), 33,9, 38,2 (С-3/С-5), 60,9 (С-4), 71,05 (С-2), 117,2 (CN), 169,3 (С-6). Элементный анализ: вычислено, %, для C7H9NO3 (155,15): С 54,19, Н 5,85, N 9,03; найдено: С 54,4,Н 5,8, N 9,0. Результаты 1 Н-ЯМР и элементного анализа доказывают, что образовавшееся соединение является 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрилом. Пример 2. Получение метилового эфира 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил) уксусной кислоты (соединение формулы 6, обогащенное энантиомерами, где R1=CN и R2 = R3 = R4=Me). В круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой в тефлоновой оболочке, загружали 0,56 г неочищенного 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила, полученного в примере 1. Добавляли 2,2-диметоксипропан (3 мл) и гидрат п-толуолсульфокислоты (15 мг) и смесь нагревали с обратным холодильником в течение 5 ч. Добавляли еще одну порцию гидрата п-толуолсульфокислоты (15 мг) и продолжали нагревание в течение еще 5 ч. После охлаждения до температуры окружающей среды смесь разбавляли этилацетатом (30 мл) и промывали водным раствором бикарбоната натрия (5 мас.%). Фазы разделяли и водную фазу подвергали экстракции этилацетатом (30 мл). Объединенные органические фазы прюмывали водным насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали под вакуумом, с выходом желтого масла, которое содержало согласно данным тонкослойной хроматографии (ТСХ) и ЯМР анализов целевое соединение метиловый эфир 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты(соединение формулы 6, обогащенное энантиомерами, где R1=CN и R2=R3=R4=Me). Выход: 0,37 г (45%). 1 Н-ЯМР (300 МГц, CDCl3, остаточный недейтерированный растворитель в качестве внутреннего стандарта: 7,26 млн.д.), : 1,12-1,38 (м, 1 Н, Н-5), перекрывающий 1,36 (с, 3H, Me), 1,44 (с, 3H, Me), 1,75(дт, J=12,6, 2 Гц, 1 Н, Н-5), 2,39 (дд, J=15,7, 6,1 Гц, 1 Н, CH2CN), 2,49 (центр АВ-системы, 2 Н,СН 2 СООМе), перекрывающий 2,56 (дд, J=15,7, 6,9 Гц, 1 Н, CH2CN), 3,67 (с, 3H, СООСН 3), 4,13 (мс, 1 Н, Н 6), 4,31 (мс, 1 Н, Н-4). 13 С-ЯМР: (75,5 МГц, CDCl3, дейтерированный растворитель в качестве внутреннего стандарта: 77,2 млн.д.), : 19,6 (Me), 24,9 (CH2CN), 29,7 (Me), 35,3, 40,8 (С-5/СН 2 СООМе), 51,7 (COOCH3), 65,0, 65,4 (С 4/С-6), 99,5 (С-2), 116,8 (CN), 171,0 (СООМе). Результаты 1 Н-ЯМР и 13 С-ЯМР анализа доказывают, что образовавшееся соединение является метиловым эфиром 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты. Пример 3. Получение 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила в более крупном масштабе, чем в примере 1. В трехгорлой круглодонной колбе емкостью 250 мл, снабженной капельной воронкой, механической мешалкой и термометром, суспендировали 50 г 4R,6S)-6-хлорметил-4-гидрокситетрагидропиран 2-она) в деминерализованной воде (30 мл) при перемешивании. Добавляли по каплям водный раствор гидроксида калия (34 г, 50 мас.%) в течение двух часов. Капельную воронку промывали водой (4 мл) и удаляли. При добавлении температура реакционной смеси возрастала от 25 до 35 С. После перемешивания в течение дополнительных 45 мин одной порцией добавляли твердый цианистый калий (35,6 г). В течение двух часов температура реакционной смеси повышалась с 30 до 65 С (внешнее охлаждение или нагревание не использовалось). Далее в течение еще двух часов температура реакционной смеси поддерживалась от 50 до 55 С (при помощи масляной бани). Внешний подогрев прекращали и реакционную смесь перемешивали при комнатной температуре в течение ночи. Термометр заменяли газоотводящей трубкой, соединенной с промывной бутылью, заполненной раствором 50 мас.% KOH (чтобы отмыть избыток цианида). При помощи капельной воронки добавляли в-6 010100 течение двух часов водный раствор соляной кислоты (42 мл, 37 мас.%), используя при этом небольшое избыточное давление азота. По окончании добавления кислоты рН реакционной смеси достигало 3. После этого реакционную смесь в течение шести часов продували азотом для удаления избытка HCN. Подкисленную смесь фильтровали через фильтровальную бумагу и осадок на фильтре промывали четыре раза водой (по 10 мл каждый раз). Объединенный фильтрат подвергали непрерывной экстракции этилацетатом в течение одного дня. Добавляли к водной фазе еще одну порцию водного раствора соляной кислоты (1 мл, 37 мас.%) и затем подвергали водную фазу непрерывной экстракции этилацетатом в течение двух дней. Объединенные органические фазы сушили над сульфатом натрия, фильтровали и упаривали под вакуумом, получая остаток в виде высоковязкого масла, которое содержало целевое соединение 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил. Выход: 36 г (76%). Пример 4. Получение метилового эфира 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты в более крупном масштабе, чем в примере 2. В круглодонную колбу, снабженную обратным холодильником и магнитной мешалкой в тефлоновой оболочке, загружали 19 г неочищенного 2R,4R)-4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила, полученного в примере 1. Добавляли 2,2-диметоксипропан (133 мл) и смесь нагревали с обратным холодильником (растворимость субстрата при низких температурах была плохой). Добавляли гидрат п-толуолсульфокислоты (0,5 г) и продолжали нагревать в течение трех часов. После охлаждения до температуры окружающей среды смесь разбавляли этилацетатом и приливали к водному насыщенному раствору бикарбоната натрия. Фазы разделяли и водную фазу подвергали трижды экстракции этилацетатом. Объединенные органические фазы промывали водным насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и упаривали под вакуумом, получая остаток в виде оранжевого масла, которое очищали при помощи колоночной хроматографии на силикагеле (растворитель: петролейный эфир/метилтретбутиловый эфир градиент от 5+1 до 1+1). Образующееся желтое масло содержало целевое соединение метиловый эфир 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты. Выход: 12.7 г (46%). Пример 5. Получение натрий 4R,6R)-6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)ацетата (соединение формулы 7, обогащенное энантиомерами, где R1=CN и R2=R3=Me, Y=Na). В круглодонную колбу, снабженную магнитной мешалкой в тефлоновой оболочке, загружали 6,4 г метилового эфира 4R,6R)-6-цианометил-2,2-диметил-[1,3]диоксан-4-ил)уксусной кислоты, полученного в примере 4, толуол (10 мл), метанол (450 мг) и воду (6 мл). Добавляли в течение 10 мин по каплям раствор гидроксида натрия (32 мас.%, 3,9 г) при комнатной температуре. Образующуюся двухфазную смесь перемешивали при комнатной температуре в течение четырех часов. Толуольную фазу отделяли и отбрасывали, а большую часть водного слоя упаривали под вакуумом. Неочищенный остаток использовали для следующей реакции. Пример 6. Получение хлорида 4R,6R)-6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)уксусной кислоты. Неочищенный остаток (рН 9) из примера 5 переносили в круглодонную колбу, снабженную магнитной мешалкой в тефлоновой оболочке и насадкой Дина-Старка. Остаток сушили азеотропной дистилляцией с толуолом. В конце процесса сушки оставляли 100 мл толуола с твердой солью натрия. Насадку Дина-Старка удаляли. По каплям при помощи шприца вводили оксалилхлорид (3,5 мл) в течение 2,5 ч при комнатной температуре и постоянном токе через колбу азота. После того как добавление заканчивали, реакционную смесь перемешивали при комнатной температуре еще четыре часа. Образовавшуюся оранжевую суспензию использовали на следующей стадии. Пример 7. Получение 1,1-диметилэтил 4R,6R)-6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)ацетата (соединение формулы 8, обогащенное энантиомерами, где R1=CN, R2=R3=Me, R5=трет-бутил). В круглодонную колбу, снабженную магнитной мешалкой в тефлоновой оболочке, загружали третбутанол (10 мл) и N-метилморфолин (8 мл). К этому раствору при комнатной температуре добавляли в течение 30 мин толуольную суспензию. Образующийся темно-коричневый раствор перемешивали при комнатной температуре в течение 12 ч. После разбавления толуолом органический слой промывали три раза водным насыщенным раствором бикарбоната натрия, один раз водным насыщенным раствором хлорида аммония и один раз водным насыщенным раствором хлорида натрия. Органический слой сушили над сульфатом натрия, фильтровали и упаривали под вакуумом, получая остаток в виде темного вязкого масла (7 г), которое очищали колоночной хроматографией на силикагеле (растворитель:петролейный эфир/этилацетат 8+1). Образующееся твердое вещество содержало целевой продукт трет-бутиловый эфир 4R,6R)-6-цианометил-2,2-диметил-[1,3]-диоксан-4-ил)уксусной кислоты. Выход по трем стадиям: 3,3 г (43%). Полученные данные ЯМР для целевого соединения идентичны литературным данным, опубликованным по этому соединению (ЕР 1077212). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (1) или его энантиомерно обогащенной формы в котором соединение формулы (2) или его энантиомерно обогащенная форма где X обозначает уходящую группу, реагирует с цианидом в воде и в котором затем pH понижают до значений 0-5. 2. Способ по п.1, в котором концентрация цианида составляет по крайней мере 1 моль на литр. 3. Способ по п.1 или 2, в котором мольное отношение между суммарным количеством цианида и общим количеством соединения формулы 2 равно 0,5-10. 4. Способ по любому из пп.1-3, в котором соединение формулы (1) перед взаимодействием с цианидом обрабатывают основанием. 5. Способ по п.4, в котором основание используют при мольном отношении от 0,3 до 3 по отношению к количеству соединения формулы (2). 6. Соединение, представляющее собой (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрил. 7. Соединение по п.6, которое является энантиомерно обогащенным.
МПК / Метки
МПК: A61K 31/40, C07D 309/00, A61P 3/00, A61P 3/06
Метки: получения, производных, 4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила, способ
Код ссылки
<a href="https://eas.patents.su/9-10100-sposob-polucheniya-4-gidroksi-6-oksotetragidropiran-2-ilacetonitrila-i-ego-proizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (4-гидрокси-6-оксотетрагидропиран-2-ил)ацетонитрила и его производных</a>
Предыдущий патент: Пептиды, которые связываются с рецептором к эритропоэтину, и способы их применения
Следующий патент: Биокомплекс для производства парфюмерно-косметических средств
Случайный патент: Устройство доставки в кожу с изолирующим слоем in situ












