Устройство доставки в кожу с изолирующим слоем in situ
Номер патента: 20208
Опубликовано: 30.09.2014
Авторы: Кидоньеус Агис, Конвей Роберт Г., Росси Томас М.
Формула / Реферат
1. Устройство для трансдермальной доставки лекарственных средств, которое содержит:
a) слой активного ингредиента (AI), имеющий контактирующую с кожей поверхность и поверхность, не контактирующую с кожей, и содержащий летучий компонент;
b) слой антиадгезионного материала, непроницаемого для летучего компонента, примыкающий к контактирующей с кожей поверхности слоя AI, периметр которого простирается за пределы периметра слоя AI во всех направлениях; и
c) верхний слой, содержащий первый склеивающий при надавливании клей (PSA), примыкающий к поверхности слоя AI, не контактирующей с кожей, периметр которого простирается за пределы периметра слоя AI во всех направлениях,
где слой AI представляет собой матрицу, содержащую второй PSA, а летучий компонент является, по меньшей мере, частично солюбилизированным в указанном втором PSA; причём
растворимость летучего компонента в первом PSA верхнего слоя меньше, чем растворимость указанного компонента во втором PSA слоя AI;
слой антиадгезионного материала и первый PSA верхнего слоя находятся в контакте и приклеены друг к другу по периметру слоя AI для формирования изолирующего слоя, который уменьшает или предотвращает потерю летучего компонента из слоя AI.
2. Устройство по п.1, в котором летучий компонент представляет собой органический растворитель.
3. Устройство по п.2, в котором летучий компонент содержит диметилсульфоксид ДМСО и/или этиллактат;
матрица PSA слоя AI представляет собой полиакрилатный PSA;
антиадгезионный материал представляет собой фторсодержащую или силиконизированную полиэфирную пленку или фольгу, футурированную силиконизированным или фторсодержащим полимером; и
верхний слой содержит полиизобутиленовый, склеивающийся при надавливании клей (PIB PSA).
4. Устройство по пп.1, 2 или 3, которое дополнительно содержит покрытие верхнего слоя.
5. Устройство по п.4, в котором покрытие верхнего слоя содержит промежуточный слой с полиакрилатным PSA и слой без PSA.
6. Устройство по п.5, в котором не содержащий PSA слой в покрытии верхнего слоя представляет собой полиуретановую пленку, пенистую или фильерную структуру, полиолефиновую пену, PVC пену или тканый или нетканый материал.
7. Устройство по пп.1-5 или 6, которое дополнительно содержит внутренний покровный слой между слоем AI и верхним слоем.
8. Устройство по п.1, в котором верхний слой, примыкающий к поверхности слоя AI, не контактирующей с кожей, содержит PIB PSA.
9. Устройство по п.8, в котором летучий компонент содержит ДМСО и/или этиллактат.
10. Устройство по п.8 или 9, в котором PIB PSA содержит от приблизительно 5 до приблизительно 45 мас.% PVP с поперечными межмолекулярными связями; от приблизительно 10 до приблизительно 60 мас.% PIB низкой вязкости; от приблизительно 2 до приблизительно 20 мас.% PIB высокой вязкости; от приблизительно 10 до приблизительно 60 мас.% полибутена и от приблизительно 0 до приблизительно 20 мас.% минерального масла.
11. Устройство по п.10, в котором PIB PSA содержит от приблизительно 15 до приблизительно 30 мас.% кросповидона; от приблизительно 30 до приблизительно 50 мас.% PIB с низкой молекулярной массой; от приблизительно 5 до приблизительно 15 мас.% PIB с высокой молекулярной массой; от приблизительно 20 до приблизительно 40 мас.% полибутена, имеющего вязкость, равную от приблизительно 3900 до приблизительно 4200 сСт при 100°С и 0 мас.% минерального масла.
12. Устройство по п.11, в котором PIB PSA содержит приблизительно 20 мас.% кросповидона, приблизительно 40 мас.% PIB с низкой молекулярной массой, приблизительно 8 мас.% PIB с высокой молекулярной массой и приблизительно 32 мас.% полибутена.
13. Устройство по п.12, которое дополнительно содержит внутренний покровный слой между стороной слоя AI, не контактирующей с кожей, и верхним слоем.
14. Устройство по п.1, в котором
первый склеивающий при надавливании клей верхнего слоя представляет собой PIB PSA, и
верхний слой дополнительно содержит покрытие, которое, по существу, является непроницаемым для PIB PSA и которое является проницаемым для влаги.
15. Устройство по п.14, в котором покрытие верхнего слоя содержит слой PSA и пористый слой.
16. Устройство по п.15, в котором слой PSA в покрытии верхнего слоя представляет собой полиакрилатный PSA, а пористый слой представляет собой полиуретан.
17. Устройство по любому из пп.1-16, в котором активный ингредиент представляет собой по меньшей мере один гормон.
18. Устройство по любому из пп.1-16, в котором активный ингредиент представляет собой малую молекулу.
19. Устройство по п.17, в котором активный ингредиент представляет собой два гормона: прогестин и эстроген.
20. Устройство по п.19, в котором эстроген представляет собой этинилэстрадиол или 17 бета-эстрадиол, а прогестин представляет собой левоноргестрел, и оба находятся в полимерной матрице, которая содержит полиакрилатный PSA, гигроскопичное вещество/пластификатор и один или более усилителей проникновения в кожу.
21. Устройство по п.20, в котором один или более усилителей проникновения в кожу содержат ДМСО.
22. Устройство по п.21, в котором усилители проникновения в кожу содержат низший (С1-С4) алкиловый эфир гидроксикислоты.
23. Устройство по пп.20, 21 или 22, где усилители проникновения в кожу содержат ДМСО, эфир жирного (С8-С20) спирта и молочной кислоты; низший (С1-С4) алкиловый эфир молочной кислоты и С6-С18 жирную кислоту.
24. Устройство по пп.20-22 или 23, в котором полиакрилатный PSA представляет собой полиакрилатный сополимер.
25. Устройство по п.24, где полиакрилатный сополимер содержит от приблизительно 3 до приблизительно 60 мас.% винилацетата.
26. Устройство по пп.20-23 или 24, в котором гигроскопичное вещество/пластификатор содержит поливинилпирролидон (PVP).
27. Устройство по п.26, где гигроскопичное вещество/пластификатор представляет собой сополимер поливинилпирролидон/винилацетат (PVP/VA).
28. Устройство по п.27, где PVP составлен в количестве, равном приблизительно 60 мас.%, а винилацетат составлен в количестве, равном приблизительно 40 мас.% в сополимере PVP/VA.
29. Устройство по п.23 или по любому зависимому от него пункту, где эфир жирного спирта и молочной кислоты представляет собой лауриллактат.
30. Устройство по п.29, где низший алкиловый эфир молочной кислоты представляет собой этиллактат.
31. Устройство по п.23 или по любому зависимому от него пункту, где С6-С18 жирная кислота представляет собой капроновую кислоту.
32. Устройство по любому из пп.1-31, в котором верхний слой герметично прикреплен посредством PSA к антиадгезионному материалу и упакован в контейнер, который удерживает антиадгезионный материал в контакте с верхним слоем.
33. Устройство для трансдермальной доставки лекарственных средств, которое содержит:
a) слой активного ингредиента (AI), представляющего собой полимерную матрицу, имеющую контактирующую с кожей поверхность и поверхность, не контактирующую с кожей, который содержит летучий компонент;
b) слой антиадгезионного материала, непроницаемого для летучего компонента, примыкающий к контактирующей с кожей поверхности слоя AI, периметр которого простирается за пределы периметра слоя AI во всех направлениях; и
c) верхний слой, содержащий склеивающий при надавливании клей (PSA), примыкающий к поверхности слоя AI, не контактирующей с кожей, периметр которого простирается за пределы периметра слоя AI во всех направлениях,
где слой AI представляет собой полимерную матрицу, содержащую второй PSA, и летучий компонент, по меньшей мере, частично растворён в указанном втором PSA; причём
растворимость летучего компонента в первом PSA верхнего слоя меньше, чем во втором PSA слоя AI;
антиадгезионный слой находится в непосредственном контакте со слоем AI;
антиадгезионный слой и первый PSA верхнего слоя приклеены друг к другу по периметру слоя AI для формирования изолирующего слоя, который уменьшает или предотвращает потерю летучего компонента из слоя AI; при этом
антиадгезионный слой выполнен с возможностью удаления посредством отслаивания от слоя AI и верхнего слоя PSA непосредственно перед прикладыванием к коже, а слой AI приклеивается прямо на кожу, и первый PSA верхнего слоя дополнительно склеивает второй PSA со слоем AI;
летучий компонент содержит диметилсульфоксид ДМСО;
первый PSA представляет собой полиизобутиленовый PSA;
второй PSA представляет собой полиакрилатный PSA;
верхний слой дополнительно включает слой полиакрилатного PSA, примыкающий к поверхности слоя AI, не контакрирующей с кожей, и слой, не содержащий PSA, расположенный над поверхностью полиакрилатного слоя PSA; причём склеивание слоев достигается без нагрева.
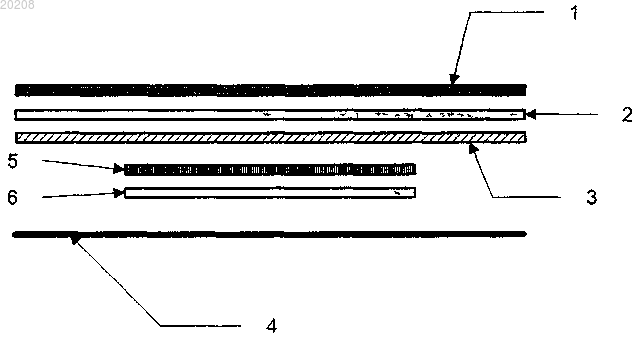
Текст
Изобретение относится к трансдермальному устройству доставки лекарственных средств, которое содержит слой активного ингредиента (AI), имеющий контактирующую с кожей поверхность и не контактирующую с кожей поверхность и содержащий летучий компонент, антиадгезионный материал, непроницаемый для летучего компонента, примыкающий к контактирующей с кожей поверхности слоя AI, имеющий периметр, который простирается за пределы периметра слояAI во всех направлениях, и верхний слой, содержащий склеивающий при надавливании клей(PSA), который не поглощает летучий компонент, примыкающий к не контактирующей с кожей поверхности слоя AI, периметр которого простирается за пределы периметра слоя AI во всех направлениях, где антиадгезионный материал и PSA верхнего слоя находятся в контакте и приклеены друг к другу по периметру слоя AI, чтобы образовать изолирующий слой, который уменьшает или предотвращает потерю летучего компонента. Перекрестная ссылка на родственную заявку Настоящая заявка испрашивает приоритет предварительной заявки США 60/948757, поданной 10 июля 2007 г. и озаглавленной "Dermal Delivery Device with In situ Seal", которая включена в данную заявку посредством ссылки во всей своей полноте для всех целей. Область изобретения Данное изобретение находится в области доставки в кожу фармакологически или косметически активных средств для системного, локального или местного применения. Уровень техники изобретения Устройство доставки в кожу представляет собой наклеиваемый "пластырь" для накладывания на кожу, который используют, чтобы доставлять большое разнообразие фармакологически и косметически активных средств. Такие пластыри могут быть использованы, чтобы доставлять средство трансдермально, т.е. через кожу и в кровоток для системной терапии или в или через кожу для локальной терапии. Такие пластыри могут также быть использованы для осуществления местного ухода, включая косметически активные средства. Такие пластыри в целом содержат в дополнение к активному ингредиенту, т.е. фармацевтически или косметически активному средству, клей, покрытие и антиадгезионный материал. В некоторых случаях устройство содержит один или более летучих компонентов. Такие летучие ингредиенты могут представлять собой активные лекарственные вещества, химические вещества для улучшения доставки лекарственных веществ или другие вспомогательные вещества, важные для получения соответствующего действия пластыря, такие как растворители, гигроскопичные вещества и пластификаторы. Такие летучие компоненты имеют тенденцию улетучиваться из устройства оказывая, тем самым,отрицательное влияние на срок годности устройства и, возможно, оказывая также отрицательное влияние на эффективность устройства в процессе использования. Сущность изобретения Данное изобретение относится к устройствам доставки в кожу или системам, которые задействуют один или более летучих компонентов и средство для замедления потери летучего компонента, для доставки лекарственных веществ или косметических средств в или через кожу. Частный аспект изобретения включает, среди других, объясняемых более полно в данной заявке ниже, прилипание верхнего слоя со склеивающим при надавливании клеем (PSA) на не контактирующей с кожей стороне содержащего активный ингредиент (AI) пластыря, причем такой пластырь содержит один или более летучих компонентов, и к антиадгезионному материалу на контактирующей с кожей стороне пластыря, посредством чегоPSA прилипает к антиадгезионному материалу и предотвращает потерю летучего компонента. Еще один аспект изобретения включает, например, использование верхнего слоя с полиизобутиленовым (PIB) PSA. Еще один связанный аспект изобретения включает, например, использование многослойного верхнего слоя, содержащего два или более слоев, как дополнительно описано в данной заявке ниже. Краткое описание фигур Чертеж иллюстрирует покомпонентное поперечное сечение иллюстративной системы доставки в кожу изобретения. Подробное описание изобретения Настоящее изобретение относится в целом к доставке в кожу композиции, содержащей какой-либоAI, который является активным при введении посредством трансдермальной доставки, пассивно или иным способом, и который содержит летучий компонент. Со ссылкой на чертеже, данное иллюстративное устройство изобретения содержит 4 слоя. Один представляет собой слой AI, или пластырь AI (6). Второй представляет собой антиадгезионный материал(4). Третий представляет собой внутренний покровный слой (5). Четвертый представляет собой верхний слой, который в данном иллюстративном устройстве сам содержит три составных слоя (1, 2, 3), упоминаемых в данной заявке ниже как, соответственно, слой PSA (3), промежуточный слой (2) и покрытие верхнего слоя или покровный материал верхнего слоя (1). Верхний слой может также быть описан, как содержащий, в данном иллюстративном варианте осуществления, слой PSA (3) и покрытие верхнего слоя(1 и 2). В любом случае, одним признаком данного аспекта изобретения является образование изолирующего слоя между слоем PSA (3) верхнего слоя (1, 2, 3) и антиадгезионным материалом (4). Признаком связанного аспекта изобретения является использование PIB PSA в слое PSA (3) верхнего слоя (1,2,3). Признаком еще одного связанного аспекта изобретения является использование верхнего слоя (1, 2,3), содержащего слой PIB PSA (3) и материал (1, 2), который покрывает слой PIB PSA, так чтобы PIBPSA не входил в контакт с пальцами или одеждой, но который обеспечивает возможность проницаемости для паров воды наружу из кожи. Как проиллюстрировано на чертеже, материал содержит слои 1 и 2,причем слой 2 представляет собой PSA, который предотвращает миграцию PIB PSA в покровный материал верхнего слоя (1). Признаком еще одного аспекта изобретения является использование промежуточного слоя (2) между слоем PIB PSA (3) и пористым покрытием верхнего слоя (1). В иллюстративных вариантах осуществления пластырь целиком является гибким, так что он будет эффективно и удобно прилипать к контурам участка наложения и так, что он будет выдерживать сгибания, связанные с нормальной жизнедеятельностью. Данные и другие аспекты изобретения более полно описаны в данной заявке ниже или другими словами будут очевидны рядовым специалистам в данной области на основании такого описания. Далее следует описание иллюстративного, неограничивающего варианта осуществления изобретения, которое содержит целиком трансдермальную систему доставки изобретения. Слой AI. Слой 6 содержит AI и летучий компонент, обычно в матрице PSA. Летучий компонент обычно, по меньшей мере, частично растворен в слое AI. Поэтому, например, в иллюстративном варианте осуществления изобретения, слой 6 содержит один или более гормонов в качестве AI, акриловый PSA, и летучий усилитель проникновения в кожу. Летучим компонентом, однако, может также быть, например, сам AI или растворитель или переносчик. Иллюстративные составы трансдермальных гормональных композиций, применимых в устройствах доставки настоящего изобретения, описаны, например, в патенте США 7045145 и в патенте США 20070065495. В иллюстративном варианте осуществления AI представляет собой активный фармацевтический ингредиент (API), который представляет собой один или более гормонов, таких как прогестин, например,левоноргестрел и эстроген, например этинилэстрадиол или 17- эстрадиол, диспергированных в клейкой полимерной матрице. В еще одном аспекте изобретения для доставки гормона, API ограничен только прогестином. В других подобных аспектах API содержит прогестин, эстроген и тестостерон или один тестостерон. Другие API, которые могут также быть доставляемы в соответствии с данным изобретением, включают "низкомолекулярные", т.е. синтетические органические соединения с низкой молекулярной массой(например, 2000 Дальтон), такие как, но не ограничивая, фентанил, никотин, скополамин, нитроглицерин, клонидин, метилфенидат, лидокаин, прилокаин, оксибутинин, нейролептические препараты, такие как флуфеназин, алпразолам, рисперидон и оланзапин, лекарственные вещества для лечения болезни Паркинсона, такие как ротиготин и селегилен, лекарственные вещества для лечения болезни Альцгеймера, такие как ривастигмин и донепезил, антигипертензивные средства, такие как эналаприл, ВРН лекарственные вещества, такие как тамсулозин и теразозин и противоастматические лекарственные вещества,такие как альбутерол и монтелукаст.AI может также представлять собой косметическое средство, такое как кератолитические средства,такие как альфа- и бета-гидроксикарбоновые кислоты и бета-кетокарбоновые кислоты; альфа-гидрокси кислоты, такие как гликолевая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, миндальная кислота и, в целом, фруктовые кислоты; бета-гидрокси кислоты, такие как салициловая кислота и ее производные; антибактериальные средства, такие как клиндамицина или эритромицина фосфат, или антибиотики тетрациклинового типа; аскорбиновая кислота и ее биологически совместимые соли и сложные эфиры; ферменты; стягивающие средства, такие как белковый, соевый и пшеничный порошки; гидроксилированные поликислоты; сахара и их производные; мочевина; аминокислоты; растительные и дрожжевые экстракты; белковые гидролизаты, такие как гидролизаты коллагена и эластина; гиалуроновая кислота; мукополисахариды; витамины; пантенол; фолиевая кислота; ацетилсалициловая кислота; аллантоин; койевая кислота; гидрохинон; ретиноевая кислота и ее производные; жирные кислоты; и т.д. Как описано в патенте США 20070065495, иллюстративный слой 6 получают, как описано в примере 1, ниже. Данный пример описывает составы, которые используют комбинацию усилителей проникновения в кожу, включая ДМСО и низший (С 1-С 4) алкиловый эфир молочной кислоты, такой как этиллактат, оба из которых являются летучими компонентами и являются примерами летучих компонентов, которые могут быть включены в трансдермальное устройство доставки лекарственных средств изобретения. Под "летучий", подразумевается, что средство имеет давление пара выше 0,1 мм ртутного столба при 20 С. Другие иллюстративные летучие компоненты, применимые в настоящем изобретении, известны квалифицированным специалистам в данной области и включают другие летучие органические растворители, например сульфоксиды, такие как децилметилсульфоксид; спирты, такие как этанол, пропанолы, гексанолы и бензиловый спирт, жирные кислоты, такие как валериановая кислота, изовалериановая кислота, изопропиловый бутират, этилацетат и бутилацетат; полиолы, такие как бутандиол и этиленгликоль; амиды, такие как диметилацетамид, диэтиловый толуамид, диметилформамид, пирролидон,и метилпирролидон; терпены, такие как лимонен, пинен, терпинон, ментон, эвкалипт и ментол; алканы,такие как гексан и гептан и органические кислоты, такие как лимонная кислота. Усилители проникновения в кожу и растворители, дополнительные к ДМСО, и аналогичные органические растворители включают, но не ограничиваются, растворителями, описанными в примере 1. Следующее описание относится к предпочтительному составу слоя 6 для доставки гормона, причем указанный слой или пластырь содержит один или более гормонов, усилителей проникновения в кожу и матрицу PSA, содержащую клеящий полимер и гигроскопичное вещество/пластификатор. Усилители проникновения в кожу: молекулы лекарственного вещества, высвобождаемые из трансдермальной системы доставки, должны быть способны проникать через каждый слой кожи. Для того чтобы увеличить скорость проникновения молекул лекарственных веществ, трансдермальная система доставки лекарственных веществ, желательно, должна быть способна увеличить проницаемость наружного слоя кожи, слоя ороговевших клеток, который обеспечивает наибольшее сопротивление проникновению молекул. В связи с этим, настоящее изобретение предусматривает трансдермальную систему доставки лекарственного вещества, которая задействует один или более усилителей проникновения в кожу в определенных количествах. Комбинация средств усиления проникновения в кожу предпочтительно используется в практике настоящего изобретения для доставки левоноргестрела и этинилэстрадиола (ЕЕ) или 17 бета-эстрадиола. Комбинация содержит смесь (1) фармацевтически приемлемого органического растворителя, такого как диметилсульфоксид (ДМСО), (2) жирного (С 8-С 20) спиртового эфира гидроксикислоты, такого как лауриллактат, (3) низшего (С 1-С 4) алкилового эфира гидроксикислоты, например этиллактата, и (4) С 6-С 18 жирной кислоты, такой как каприновая кислота. В определенных вариантах осуществления жирный спиртовой эфир молочной кислоты представляет собой лауриллактат, а низший алкиловый эфир молочной кислоты представляет собой этиллактат. В числе усилителей проникновения в кожу в составе усилителей проникновения в кожу могут быть задействованы жирные кислоты от средне- до длинноцепочечных. Каприновая кислота является предпочтительной для использования, но могут быть использованы другие С 6-С 18 растворимые или нерастворимые жирные кислоты, включая, но не ограничиваясь, капроновую кислоту, капритиковую кислоту, лауриновую кислоту и миристиновую кислоту и многие другие. Данные усилители проникновения в кожу могут присутствовать в количествах, как описано ниже. В определенных вариантах осуществления один или более усилителей проникновения в кожу могут быть исключены из полимерной матрицы. В таком частном варианте осуществления фармацевтически приемлемый органический растворитель представляет собой ДМСО. Другие органические растворители, подходящие для использования в настоящем изобретении, включают, но не ограничиваются, С 1-С 8 разветвленные или неразветвленные спирты, такие как этанол, пропанол, изопропанол, бутанол, изобутанол и т.п., а также азона (лаурокапрам: 1-додецилгексагидро-2 Н-азепин-2-она) и метилсульфонилметан, и многие другие. Жирный спиртовой эфир гидроксикислоты может представлять собой жирный спиртовой эфир молочной кислоты, такой как лауриллактат. Однако могут быть использованы другие гидрокси кислоты и жирные спирты. Альтернативные гидроксикислоты включают, но не ограничиваются, альфагидроксикислотами, такими как гликолевая кислота, винная кислота, лимонная кислота, яблочная кислота и миндальная кислота, а также бета-гидроксикислотой, салициловой кислотой. Альтернативные жирные спирты включают любые С 8-С 20 растворимые или нерастворимые жирные спирты, такие как миристиловый, пальмитиловый или олеиловый спирты и многие другие. Низший алкиловый эфир гидроксикислоты может также использовать молочную кислоту и может представлять собой, например, этиллактат. Однако могут также быть использованы другие гидроксикислоты, такие как гликолевая кислота, винная кислота, лимонная кислота, яблочная кислота, миндальная кислота и салициловая кислота. В дополнение, в качестве заменителя для низшего алкилового эфира гидроксикислоты может быть использована изопропилмиристиновая кислота (IPM). Упомянутая выше комбинация усилителей проникновения в кожу может быть использована для усиления трансдермальной доставки стероидных гормонов из любого типа трансдермального устройства доставки. Система клейких полимеров матричного типа, как описано подробно в данной заявке, является предпочтительной для использования; однако комбинация усилителей может также быть использована в неклейких полимерах, а также в трансдермальных системах доставки многослойного или емкостного типа и многих других. Гормоны: трансдермальное устройство доставки лекарственных средств, использующее упомянутые выше усилители проникновения в кожу, может быть использовано, чтобы доставлять различные типы API, включая гормоны, способные к трансдермальной доставке. В одном варианте осуществления комбинацию прогестина и эстрогена используют для одной или более следующих целей: (1) управления фертильностью, (2) регулирования состояния акне, (3) лечения эндометриоза, (4) лечения предменструального дисфорического расстройства (PMDD) и (5) индукции аменореи. В еще одном варианте осуществления один прогестин используют для одной или более следующих целей: (1) управления фертильностью, (2) сохранения беременности, (3) в качестве альтернативной гормональной терапии для индивидуумов, для которых эстроген противопоказан (например, лактирующих женщин) и (4) предотвращения галактореи. В еще одном другом варианте осуществления комбинацию прогестина, эстрогена и тестостерона используют в качестве гормональной заместительной терапии для лечения дефицита данных гормонов у женщин. Еще один другой вариант осуществления направлен на THDS, разработанную для доставки одного тестостерона, который применим для лечения пониженного либидо, являющегося следствием дефицита тестостерона как у мужчин, так и у женщин. Левоноргестрел представляет собой сильнодействующий прогестин, дозировка которого зависит от массы тела, что является важным фактором, поскольку прогестины зачастую демонстрируют намного меньший уровень чрезкожного поглощения, чем эстрогены. Другие прогестины, которые могли бы быть использованы частично или целиком, представляют собой норгестрел, норгестимат, дезогестрел, гесто-3 020208 ден, норетиндрон, норэтинодрел, гидрогестерон, этинодиолдицетат, гидроксипрогестеронкапроат, медроксипрогестеронацетат, норетиндронацетат, прогестерон, мегэстрола ацетат, гестоген и некоторые другие, которые являются биологически совместимыми и поглощаемыми трансдермально. Они включают биологически совместимые производные прогестинов, которые являются трансдермально поглощаемыми, некоторые из которых, преимущественно, являются биологически трансформируемыми после трансдермального поглощения в оригинальный прогестин. Прогестин и другие выбранные гормоны, предпочтительно, имеют высокую совместимость друг с другом. Для комбинаций прогестина с эстрогеном синтетический гормон этинилэстрадиол является особенно подходящим, хотя могут быть использованы природный эстроген или другие аналоги. Данный гормон может быть трансдермально доставляем в сочетании с особенно подходящими прогестином, левоноргестрелом, посредством TDHS настоящего изобретения с необходимыми суточными нормами для обоих гормонов. Этинилэстрадиол и левоноргестрел являются совместимыми и могут быть диспергированы в клейком полимерном составе. Обычно, трансдермальное устройство дозирования, разработанное для однонедельной терапии, должно доставлять по меньшей мере приблизительно 20 мкг/день левоноргестрела, например от приблизительно 50 до приблизительно 100 мкг/день (или эквивалентное эффективное количество другого прогестина) и 10-50 мкг/день этинилэстрадиола (или эквивалентное эффективное количество другого эстрогена). Полагают, что такие соответственные количества прогестина и эстрогена являются необходимыми,чтобы подавлять овуляцию и чтобы сохранять женскую физиологию и показатели нормальными. В настоящем изобретении количество трансдермально доставляемого левоноргестрела составляет предпочтительно 30 мкг в день с 15 см 2 трансдермальным устройством доставки в течение от более чем одного дня до приблизительно одной недели. Производные 17-эстрадиола, которые являются биологически совместимыми, способные трансдермально поглощаться и, предпочтительно, биологически трансформироваться в 17-эстрадиол, могут также быть использованы, если количество поглощения соответствует необходимой ежедневной дозе компонента эстрогена и если гормональные компоненты являются совместимыми. Такие производные эстрадиола включают сложные эфиры, либо моно- или ди-сложные эфиры. Сложные моноэфиры могут представлять собой либо 3-, либо 17-сложные эфиры. Сложные эфиры эстрадиола могут представлять собой, в качестве примера, эстрадиол-3,17-диацетат; эстрадиол-3-ацетат; эстрадиол 17-ацетат; эстрадиол 3,17-дивалерат; эстрадиол-3-валерат; эстрадиол-17-валерат; 3-моно-, 17-моно- и 3,17-дипивилат сложные эфиры; 3-моно-, 17-моно- и 3,17-дипропионат сложные эфиры; 3-моно-, 17-моно- и 3,17-дицикло пентилпропионат сложные эфиры; соответствующие ципионат, гептаноат, бензоат и т.п. сложные эфиры; этинилэстрадиол; эстрон; и другие эстрогенные стероиды и их производные, которые являются трансдермально поглощаемыми. Комбинации перечисленного выше с самим эстрадиолом (например, комбинация эстрадиола и эстрадиол-17-валерата или дополнительно комбинация эстрадиола-17-валерата и эстрадиол-3,17 дивалерата) могут быть использованы с благоприятными результатами. Например, 15-80% каждого соединения в расчете на общую массу эстрогенного стероидного компонента могут быть использованы,чтобы получить необходимый результат. Другие комбинации могут также быть использованы, чтобы получить необходимое поглощение и уровни 17-эстрадиола в организме объекта, подлежащего лечению. Составы, содержащие тестостерон, могут использовать природный тестостерон или синтетические тестостероны, которые поглощаются трансдермально. Например, метилтестостерон является подходящим для использования в настоящем изобретении. Рецептура для трансдермального устройства для доставки тестостерона у женщины в пременопаузе должна быть разработана для доставки до приблизительно 300 мкг ежедневно. Для лечения дефицита тестостерона у мужчин рецептура для трансдермальных систем доставки гормонов должна быть разработана, чтобы доставлять до приблизительно 3-6 мг ежедневно. Необходимо понимать, что гормоны могут быть задействованы не только в виде чистого химического соединения, но также в смеси с другими фармацевтическими веществами, которые могут применяться трансдермально или с другими ингредиентами, которые не являются несовместимыми с желательной целью, как перечислено выше. Таким образом, простые фармакологически приемлемые производные гормонов, такие как эфиры, сложные эфиры, амиды, ацетали, соли и т.п., могут быть использованы при необходимости. В некоторых случаях, такие производные могут быть предпочтительными. Соединение прогестина и эстрогенный стероид обычным путем диспергируют или растворяют одновременно в получаемой гормонсодержащей клейкой полимерной матрице, или они могут быть диспергированы или растворены по отдельности. Полимеры, используемые в качестве активных компонентов пластыря: AI-содержащий слой может представлять собой полимерную матрицу, содержащую фармацевтически или косметически активный ингредиент. Полимер может представлять собой PSA, чтобы сформировать биологически приемлемую клейкую полимерную матрицу, предпочтительно, способную образовывать тонкие пленки или покрытия,-4 020208 через которые может проходить AI с регулируемой скоростью. Подходящие полимеры являются биологически и фармацевтически совместимыми, неаллергенными, нерастворимыми в и совместимыми с текучими средами организма или тканей, с которыми устройство находится в контакте. Использование водорастворимых полимеров, в целом, менее предпочтительно, поскольку разложение или эрозия матрицы будет неблагоприятно влиять на скорость высвобождения AI, а также способность устройства дозирования оставаться на месте на коже. Поэтому в определенных вариантах осуществления полимер является водонерастворимым. Предпочтительно, полимеры, использованные, чтобы сформировать полимерную матрицу в AIсодержащем слое, имеют температуры стеклования ниже комнатной температуры. Полимеры, предпочтительно, являются некристаллическими, но могут обладать некоторой кристалличностью при необходимости для получения других желательных свойств. В такие полимеры могут быть включены мономерные звенья или участки с поперечными связями. Например, мономеры, образующие поперечные связи,которые могут быть включены в полиакрилатные полимеры, включают полиметакриловые сложные эфиры полиолов, такие как бутилендиакрилат и диметакрилат, триметилолпропантриметакрилат и т.п. Другие мономеры, которые предоставляют такие участки, включают аллилакрилат, аллилметакрилат,диаллилмалеат и т.п. Применимый клейкий полимерный состав содержит полиакрилатный клейкий полимер общей формулы (I): где X представляет количество повторяющихся звеньев, достаточное, чтобы обеспечить желаемые свойства клейкому полимеру, a R представляет собой Н или низший (С 1-С 10) алкил, такой как этил, бутил, 2-этилгексил, октил, децил и т.п. Более конкретно, является предпочтительным, чтобы клейкая полимерная матрица содержала полиакрилатный клейкий сополимер, имеющий 2-этилгексилакрилатный мономер и приблизительно 50-60% о/о винилацетата в качестве сомономера. Пример подходящего полиакрилатного клейкого сополимера для использования в настоящем изобретении включает, но не ограничивается, сополимером, продаваемым под маркой Duro Tak 87-4098 National Starch и Chemical Co.,Bridgewater, N.J., который содержит определенный процент винилацетатного сомономера. Гигроскопичное вещество/пластификатор. Предпочтительно, в составе клейкого полимера диспергирован пластификатор/гигроскопичное вещество. Включение гигроскопичного вещества в состав обеспечивает возможность устройству дозирования поглощать влагу с поверхности кожи, что в свою очередь помогает снизить раздражение кожи и предотвратить выход из строя клейкой полимерной матрицы системы доставки. Пластификатор/гигроскопичное вещество может представлять собой общепринятый пластификатор, используемый в фармацевтической промышленности, например, поливинилпирролидон(PVP). В частности, для использования в настоящем изобретении подходят сополимеры PVP/винилацетат (PVP/VA), такие как сополимеры, имеющие молекулярную массу равную от приблизительно 50000.PVP/VA действует как пластификатор, действующий для регулирования жесткости полимерной матрицы, а также гигроскопичное вещество, действующее для регулирования содержания влаги матрицы.PVP:VA, который имеет молекулярную массу равную 51000 и температуру стеклование равную 110 С. Количество гигроскопичного вещества/пластификатора непосредственно связано с продолжительностью приклеивания верхнего слоя. Предпочтительно PVP/винилацетат представляет собой PVP/VA S-630, поставляемый InternationalSpecialty Products, Inc. (ISP) из Wayne, New Jersey, где PVP и винилацетат каждый присутствуют приблизительно в равных массовых процентах. Форма устройства изобретения не имеет значения. Например, она может быть круглой, т.е. диском,или она может быть многоугольной, например, прямоугольной, или эллиптической. Площадь поверхности слоя AI в целом не должна превышать приблизительно 60 см 2 по площади. Предпочтительно, она будет составлять приблизительно от 5 до 50 см 2, более предпочтительно от приблизительно 8 до приблизительно 40 см 2. Наиболее предпочтительно, диски будут составлять от приблизительно 10 до приблизительно 20 см 2. Диск равный 15 см 2 является предпочтительным по причине его относительно маленького размера, сохраняя при этом способность диспергировать высокие уровни гормонов. Специфические варианты осуществления изобретения имеют отличительным признаком пластыри, обладающие слоем AI с площадью поверхности равной 10, 12,5, 15, 17,5 или 20 см 2. Однако могут быть использованы другие размеры. В иллюстративных вариантах осуществления слой AI помещен непосредственно между внутренним покровным слоем и антиадгезионным материалом. "Накопитель" или предварительно образованный карман отсутствует как таковой; точнее слой AI и внутренний покровный слой герметично изолированы между верхним слоем и антиадгезионным материалом. С такой полимерной матрицей нет необходимости заключать активный ингредиент, например, в микрокапсулы или другое средство локализации/высвобождения. Внутренний покровный слой Когда PSA содержит полиакрилатную матрицу, как описано выше, органический компонент может улетучиваться через кожу и не контактирующую с кожей поверхность системы. Для того чтобы минимизировать подобное улетучивание через не контактирующую с кожей поверхность, может быть задействован внутренний покровный слой. Данный слой, который подавляет поглощение компонентов слоя AI в верхнем слое, проиллюстрирован как слой 5 на чертеже. Такой внутренний покровный слой может быть изготовлен из любого подходящего материала, который является непроницаемым или, по существу, непроницаемым для AI и для вспомогательных веществ клейкой полимерной матрицы. Внутренний покровный слой служит в качестве защитного покрытия для слоя AI и обеспечивает опорную функцию. Покровный слой может быть сформирован таким образом, чтобы он был, по существу, того же размера, что и гормонсодержащая клейкая полимерная матрица, или он может быть большего размера так, чтобы он мог выходить наружу за пределы краев AIсодержащего пластыря. Покровный слой может быть любой соответствующей толщины, которая будет обеспечивать необходимые защитную и опорную функции. Подходящая толщина составляет от приблизительно 10 до приблизительно 300 мкм. Более конкретно, толщина составляет менее чем приблизительно 150 мкм, еще более конкретно она составляет менее, чем приблизительно 100 мкм, а наиболее конкретно, толщина составляет менее, чем приблизительно 50 мкм. Примерами материалов, подходящих для получения внутреннего покровного слоя, являются пленки из полипропилена, полиэфиров, таких как поли(этилентерефталат), разновидности металлической фольги, многослойные материалы из металлической фольги из таких подходящих полимерных пленок и т.п. Особенно подходящими для использования в настоящем изобретении являются полиэфирные пленки,такие как Mylar (DuPont Teijin) и Scotchpak 9732 (3 М Company). Внутренний покровный слой представляет собой, в целом, отдельный от верхнего слоя слой или любой составной слой верхнего слоя, например он не является соэкструдированным или совместно спрессованным с верхним слоем. В иллюстративных вариантах осуществления, внутренний покровный слой может быть покрыт на поверхности, прилегающей к слою AI, "связующим покрытием", например сополимером поливинилацетатполиэтиленвинилацетат или другим мягким полимером или сополимером. Антиадгезионный материал Площадь поверхности антиадгезионного материала является большей, чем площадь поверхности слоя AI. Это можно видеть на чертеже, где диаметр (в случае круглого устройства) или ширина и длина(в случае многостороннего устройства) слоя 4 больше, чем аналогичные параметры слоев 5 и 6, таким образом, чтобы он простирался за пределы слоя AI в некоторых или во всех направлениях. Антиадгезионный материал получают из любого материала (1), который является непроницаемым или, по существу, непроницаемым для компонентов слоя AI, (2), к которому в верхнем слое будет прилипать PSA, как обсуждается дополнительно в данной заявке ниже, и (3) который легко может быть удален посредством отслаивания от слоя AI и верхнего слоя PSA непосредственно перед прикладыванием к коже. Под "непроницаемый" и "по существу непроницаемый", следует понимать, что компоненты слояAI, в частности, летучие компоненты, не поглощаются или иным способом не проходят в или через антиадгезионный материал так, чтобы изменялась производительность устройства, в частности, проницаемость через кожу или эффективность активных ингредиентов. Антиадгезионный материал может иметь те же размеры, что и верхний слой, как обсуждается ниже,или он может выходить целиком или частично за пределы края пластыря. В одном иллюстративном варианте осуществления антиадгезионный материал простирается частично за пределы верхнего слоя таким образом, чтобы сформировать "ушки" антиадгезионного материала, которые выходят за пределы краев верхнего слоя для легкого отделения антиадгезионного материала от остальной системы. Предпочтительно, он содержит фторсодержащую или силиконизированную полиэфирную пленку или еще один фторсодержащий или силиконизированный полимер, такой как полиакрилонитриловый сополимер или фольга, футурированная силиконизированным или фторсодержащим полимером. Антиадгезионный материал предпочтительно не является полистиролом потому, что было показано, что полистирол будет поглощать ДМСО. Предпочтительным материалом для антиадгезионного материала, когда слой 4 верхнего слоя содержит PIB PSA, является материал Scotchpak (3M Company), такой какScotchpak 1022 или Scotchpak 9744 фторсодержащие полиэфирные антиадгезионные материалы. В данном иллюстративном варианте осуществления не требуются проницаемая для лекарственного вещества мембрана, регулирующая скорость мембрана, пористая мембрана, изолирующий слой, отслаиваемый диск или другой слой, покрытый или нанесенный между полимерной матрицей и антиадгезионным материалом. Вместо этого в иллюстративных вариантах осуществления благодаря вязкости полимерной матрицы антиадгезионный материал находится в непосредственном контакте со слоем AI, а за пределами периметра слоя AI, с верхним слоем. Верхний слой Верхний слой в данном иллюстративном варианте осуществления содержит три составных слоя,упоминаемых на чертеже, как слои 1, 2 и 3. Верхний слой содержит PSA, в котором растворимость летучих компонентов меньше, предпочтительно значительно меньше, чем растворимость тех же самых компонентов в матрице AI. Поэтому, например, когда летучий компонент представляет собой ДМСО или этиллактат, может быть выбран PIB PSA. Со ссылкой на чертеже слой PIB PSA является слоем 3. В целом, такой PIB PSA содержит смесь PIB с молекулярной массой от низкой до средней и высокой молекулярной массой, пластификатор, такой как полибутен, и гидроколлоид, такой как поливинилпирролидин с поперечными межмолекулярными связями. Используемые PIB включают, например, Oppanol PIB(BASF), которые имеют средние молекулярные массы между 40000 и 4000000. Используемый PIB PSA содержит кроссповидон, такой как кроссповидон Kollidon CLM (BASF)(например, 5-45 мас.%, предпочтительно 15-30 мас.%, и более предпочтительно 20-25 мас.%); PIB низкой вязкости, такой как Oppanol B12 (молекулярную масса: 51000, вязкость при 150 С: 150 Паскальсекунд) (например, 10-60 мас.%, предпочтительно 30-50 мас.%); PIB высокой вязкости, такой как Oppanol B100 (вязкость: приблизительно 1100 Паскаль-секунд) (например, 2-15 мас.%, предпочтительно 515 мас.%); полибутен, такой как Indopol 1900 (Innovene LLC) (молекулярная масса: 2500, вязкость при 100 С: 3900-4200 сантистокс) (например, 10-60 мас.%, предпочтительно 20-40 мас.%); и минеральное масло (0-20 мас.%). Например, иллюстративный состав содержит приблизительно 20 мас.% кросповидона, приблизительно 40 мас.% PIB низкой вязкости, приблизительно 8 мас.% PIB высокой вязкости и приблизительно 32 мас.% полибутена. (Термин "приблизительно", как использовано в данном описании,означает плюс или минус 10%. Под "низкой вязкостью" подразумевается менее чем приблизительно 300 Паскаль-секунд, а под "высокой вязкостью" подразумевается более чем приблизительно 800 Паскальсекунд, когда вязкость измеряют при 150 С). Поперечное сшивание PVP применимо потому, что такие полимеры с поперечными межмолекулярными связями имеют тенденцию быть водонабухаемыми, но водонерастворимыми. Такой PIB PSA может обеспечить хорошую износостойкость, например, фиксацию в нормальных условиях жизни в течение по меньшей мере 7 дней. Другие основанные на каучуке полимеры, которые могут быть использованы вместо PIB PSA в верхнем слое, включают основанные на силиконе PSA, такие как BIO-PSA (Dow Corning); сополимеры и терполимеры стирол/бутадиен/стирол, стирол/изопрен/стирол, и стирол-этилен/бутилены-стирол, такие как Kraton D стирол/бутадиен и Kraton G стирол-этилен/бутилен-стирол или стирол-этилен/пропиленстирол. Также могут быть использованы изопреновые каучуки, такие как линейные полиизопреновые гомополимеры Kraton IR. Как показано на чертеже и подобно антиадгезионному материалу, верхний слой может выходить за пределы периметра слоя AI во всех направлениях, обычно в пределах от приблизительно 0,1 до приблизительно 1,5 см, более конкретно от приблизительно 0,3 до приблизительно 1,2 см, а еще более конкретно от приблизительно 0,8 см за пределы периметра слоя AI. Верхний слой, если он содержит слой PSA, улучшает прилипаемость к коже посредством дополнения сцепления, обеспечиваемого PSA в слое AI, при наличии, или, в случае слоя AI, который не содержатPSA, он обеспечивает прилипаемость к коже. В дополнение, в одном иллюстративном варианте осуществления изобретения, верхний слой прилипает к антиадгезионному материалу по периметру обоих слоев, изолируя, тем самым, компоненты слоя AI. Посредством соответствующего выбора материалов, которые содержат верхний слой и антиадгезионный материал, данный изолирующий слой между ними предотвращает или, по существу, предотвращает, улетучивание летучего компонента в слое AI, но, тем не менее, обеспечивает возможность пользователю легко отделять антиадгезионный материал перед местным применением. Изолирующий слой образован in situ посредством сжатия механически вместе краев верхнего слоя,который выходит за пределы периметра слоя AI и краев антиадгезионного материала, который выходит за пределы периметра слоя AI. Когда первый верхний слой представляет собой PIB PSA, а антиадгезионный материал представляет собой пленку из фторсодержащего или силиконизированного полиэфира,подходящий изолирующий слой может быть получен посредством прикладывания давления. Количество давления, необходимого чтобы сформировать такой изолирующий слой, не имеет значения. Достаточно давления пальца. Конечно, в иллюстративном варианте осуществления изобретения желательно, чтобы изолирующий слой мог быть разрушен посредством отслаивания антиадгезионного материала от остальной системы руками непосредственно перед прикладыванием к коже. Изолирующий слой между верхним слоем PSA и антиадгезионным материалом предотвращает или,по существу, предотвращает потерю компонентов слоя AI через изолирующий слой между данными двумя слоями, как, например, в процессе хранения системы. Верхний слой может также содержать покрытие (1), которое не содержит PSA, т.е. которое содержит слой, не имеющий PSA, так, чтобы поверхность верхнего слоя, которая подвергается действию пальцев, одежды и наружной грязи или пыли была нелипкой, была гибкой или податливой так, чтобы изгибаться при кожных и мышечных движениях, была незаметного или привлекательного цвета и текстуры и обеспечивала возможность проходить влаге из кожи через устройство благодаря ее пористости или иному типу проницаемости для воды. Таким образом, может быть желательно использовать многослойный верхний слой, содержащий первый слой PSA, в котором летучий компонент является нерастворимым, покрытый промежуточным слоем, и покрытие верхнего слоя, имеющее свойства, описанные выше. Такой иллюстративный верхний слой проиллюстрирован на чертеже, как слои 1, 2 и 3. Несмотря на то что PIB PSA применим для включения ДМСО или этиллактата или и того и другого в слой AI, PIB PSA может проходить через большинство покрытий верхнего слоя, имеющих свойства,описанные выше. Такое прохождение PIB PSA может стать причиной того, что устройство станет липким и обесцвеченным. Вследствие этого, может быть желательно использовать покрытие верхнего слоя,которое само содержит два слоя, один из которых представляет собой полимерный слой, помещенный между PIB PSA (промежуточный слой), и покровный слой. Такой промежуточный слой может быть полиакрилатным PSA, как описано выше, потому что такой PSA будет, по существу, предотвращать прохождение PIB PSA в и через покрытие верхнего слоя, но не будет, по существу, сам мигрировать в или через покрытие верхнего слоя. Таким образом, в иллюстративном варианте осуществления изобретения слой AI содержит полиакрилатную матрицу, дополнительно содержащую гигроскопичное вещество, например PVP/VA, и усилители проникновения в кожу, включая ДМСО, этиллактат или и то и другое, или другой один или более летучих органических растворителей; верхний слой представляет собой слоистый материал, который содержит три слоя: слой PIB PSA (3, на черт.); промежуточный слой, который содержит материал, который не допускает прохождения PIB PSA, но который обеспечивает возможность прохождения влаги (2,на черт.); и покрытие верхнего слоя (или покровный слой), который является нелипким, привлекательным, гибким и влагопроницаемым (1, на черт.). Материалы, применимые в промежуточном слое, включают, например, полиакрилаты, полиуретаны, пластифицированные поливинилхлориды и сополимеры полиэтилена и этилвинилацетата. Также могут быть использованы каучуксодержащие полимеры с очень высокой молекулярной массой, например по меньшей мере приблизительно 150000 Да, а также каучуксодержащие полимеры, которые могут быть поперечно сшитыми. Примеры включают Kraton D стирол/бутадиен, Kraton G стиролэтилен/бутилен-стирол или стирол-этилен/пропилен-стирол и Kraton IR линейные полиизопреновые гомополимеры, а также могут быть использованы бутилкаучуки и силиконовые каучуки, которые являются сшиваемыми. Промежуточный слой может содержать PSA, который связывает первый слой верхнего слоя, а также покрытие верхнего слоя. Предпочтительными являются полимеры с большой молекулярной массой с поперечными межмолекулярными связями. Предпочтительно, такой PSA представляет собой полиакрилат, такой как описан выше со ссылкой на слой AI. Материалы, используемые в покрытии верхнего слоя представляют собой не PSA. Они включают,например, полиуретановую пленку, пенистую или фильерную структуру, полиолефиновую пену, PVC пену или тканый или нетканый материал. Иллюстративные ткани включают КОВ 051, 053 и 055 тканые полиэфиры (Karl Otto Braun). Иллюстративные нетканые материалы включают полиэфиры. Иллюстративным полиуретановым материалом является полученное из расплава полиуретановое нетканое покрытие CoTran 9700 (3 М), которое может быть раскрашено в тона кожи. Подходящие материалы описаны,например, в виде покровных слоев в патенте США 6660295. Если покрытие верхнего слоя не является пористым, то оно может быть использовано без промежуточного слоя. Однако, если покрытие верхнего слоя не является пористым, могут последовать проблемы сцепления от накапливания влаги на поверхности раздела кожа/PIB PSA. Может быть использовано применение сплошного материала, т.е. материала, который не является пористым, но который иным способом проницаем для воды, такого как тонкая, например, 1 мил (т.е. 0,001 дюйма), полиуретановая пленка. Однако пористый материал, такой как пена или материал, будет, в целом, лучше сохранять свою форму и предоставлять хорошее сцепление. Таким образом, основываясь на описании выше интегрированной трансдермальной системы доставки, можно видеть, что аспект изобретения имеет отношение к содержанию летучего компонента в слое AI посредством образования изолирующего слоя между верхним слоем и антиадгезионным материалом. Еще один аспект изобретения имеет отношение к использованию PIB PSA в верхнем слое для слояAI, который содержит летучий растворитель, особенно ДМСО, потому что ДМСО является слабо растворимым в PIB PSA. См. ниже табл. 1, в которой сравнивается растворимость ДМСО в полиакрилатномPSA (Duro Tak 87-4098, National Starch) и в PIB PSA, таком как описан выше. Таблица 1. Предельные растворимости (мг/г) Эти данные показывают, что ДМСО и этиллактат, которые оба являются летучими, не могут мигрировать в PIB PSA по причине факторов насыщения. Конечно, необходимо понимать, что некоторое количество поглощения в верхнем слое является приемлемым и, на самом деле, неизбежно, по меньшей мере, в определенных условиях. Важно, однако, что растворимость летучего компонента в AI содержащем слое выше, предпочтительно существенно выше, чем растворимость летучего компонента в верхнем слое PSA. Ссылки в данной заявке на PSA, который не поглощает летучие компоненты, необходимо понимать в данном контексте. В любом случае данные выше также указывают, что лауриллактат, который является относительно не летучим, может проходить в PIB PSA за счет контакта, вот почему внутренний покровный слой является предпочтительным в трансдермальной системе доставки лекарственных веществ изобретения. В соответствии с данными выше изучение изнашиваемости показало, что PIB PSA лучше сохраняет свою адгезионную способность, чем полиакрилатный PSA при хранении в присутствии усиливающих летучесть веществ, благодаря сниженной тенденции усиливающих летучесть веществ мигрировать в PIBPSA из акриловой клейкой матрицы AI, причем такая миграция оказывала бы отрицательное воздействие на адгезионную способность PIB PSA.PIB и полиакрилатные PSA верхнего слоя были протестированы для изучения изнашиваемости,чтобы определить их способность прилипать к коже в течение долгих периодов времени. Табл. 2 показывает, что когда поглощение вспомогательных веществ было минимизировано (воздействие при 25 С),акриловый клей показывал лучшие результаты, чем PIB. Когда была обеспечена возможность поглощению вспомогательных веществ происходить при более быстрой скорости (воздействие при 40 С), сцепление, обеспечиваемое PIB PSA, было лучше, чем сцепление акрилового PSA. Важно отметить, что адгезия PIB PSA была та же при воздействии в более высоких (40 С) или более низких (25 С) условиях для поглощения летучих вспомогательных веществ. Таблица 2. Адгезия единого верхнего слоя/активных пластырей(1) Примечание: это относительные значения, в которых более высокие числа означают лучшее сцепление. Еще один аспект изобретения имеет отношение к использованию покрытия верхнего слоя, чтобы покрывать PIB PSA, причем такой слой защищает от контакта с PIB PSA и обеспечивает возможность для проникновения паров воды. Еще один аспект изобретения имеет отношение к использованию пористого покрытия верхнего слоя и промежуточного слоя, который является проницаемым для влаги, но который подавляет или предотвращает прохождение PIB PSA в и через покрытие верхнего слоя. Данные в табл. 3 ниже иллюстрируют, что (1) использование уретанового верхнего слоя с или без слоя PIB PSA (PIB PSA защищает уретан только на одной стороне) приведет к поглощению и, вследствие этого, потере летучих компонентов, как те, что находятся в композиции усилителя проникновения в кожу, проиллюстрированной в примерах 1 и 2, и (2) пленка из сложного полиэфира не поглощает такие компоненты, даже когда покрыта PIB PSA, как, например, когда внутренний покровный слой представляет собой Mylar, а верхний слой содержит PIB PSA. Таблица 3. Поглощение усиливающих веществ компонентами пластыря (мас.%) Данные в табл. 3 были получены посредством помещения в металлический дессикатор четырех усиливающих веществ в том же соотношении, что и в пластыре, описанном в примерах ниже. Различные компоненты пластыря поместили в тот же дессикатор, удостоверившись, что жидкие усиливающие вещества (которые поместили в химический стакан на дне дессикатора) не находились в контакте с компонентами пластыря. Вследствие этого, какое-либо поглощение усиливающих веществ компонентами пластыря могло происходить только через передачу пара. Дессикатор поместили в 40 С печь, и поглощение компонентами пластыря измеряли посредством взвешивания образцов и определения увеличения массы спустя 3 месяца. Было также показано, что полиэфирные нетканые материалы, например КОВ 053 и КОВ 055, не поглощают летучие компоненты в значительном объеме. Примеры Следующие примеры изложены, чтобы описать изобретение более подробно. Они предназначены для иллюстрирования, а не для ограничения изобретения. Пример 1. Получение трансдермальной системы доставки лекарственных средств. Пример 1 представляет собой описание одного из способов получения системы доставки в кожу согласно изобретению. Необходимо понимать, что могут также быть использованы другие способы. В данном примере, часть А иллюстрирует получение многослойного материала внутреннее покрытие/слойAI/антиадгезионный материал. Часть В иллюстрирует получение структуры пена/акриловый PSA/верхний слой с PIB PSA. Часть С иллюстрирует получение единого устройства или системы изобретения,использующего многослойные материалы, полученные в частях А и В. Часть А. Получение многослойного материала внутреннее покрытие/слой AI/Антиадгезионный материал. После деаэрации клейкую полимерную композицию, содержащую AI и летучий компонент (компоненты) наносят на материал покровного слоя и впоследствии высушивают в течение установленного времени при установленной температуре. В альтернативном варианте осуществления вместо покровного слоя клейкую полимерную матрицу можно наносить на антиадгезионный материал. Соответственно,ссылку в данной заявке на нанесение клейкой полимерной матрицы на покровный слой следует понимать с учетом данного альтернативного варианта осуществления. Нанесение деаэрированной клейкой полимерной матрицы на покровный слой может быть выполнено с использованием имеющихся в продаже лабораторных устройств для покрытия/высушивания, обычно используемых для этой цели. Например, могут быть использованы устройство Werner Mathis Model LTSV/LTH, а также другие лабораторные устройства для покрытия, поставляемые Werner Mathis AG (Zurich, Switzerland). Другие подходящие устройства включают, но не ограничиваются, оборудованием, производимым Chemsultants, Inc. (Mentor,ОН). Толщина раствора клейкого полимера, наносимого на покровный слой, а также время и температура высушивания, все представляют собой технологические параметры, которые могут варьировать для получения итоговых концентраций и соотношений гормонов и средств, усиливающих проникновение внутрь пластыря. Например, было обнаружено, что изменение толщины клейкой полимерной матрицы,наносимой на покровный слой (например, с 300 до 800 мкм) может привести к суммарному большему удерживанию усилителей проникновения в кожу летучих веществ, когда другие два технологических параметра, время высушивания и температура высушивания, остаются постоянными. В противоположность этому изменение времени высушивания, например с 5 до 25 мин, или температуры высушивания,например с 40 до 100 С, может привести к суммарным потерям в удерживании усилителей проникновения в кожу летучих веществ, в большей или меньшей степени, в зависимости от усиливающего вещества. Таким образом, специалистам в данной области необходимо понимать, что в дополнение к выбору соответствующих количеств исходных материалов в исходном составе клейкого полимера, для получения в устройстве итоговой композиции усилителей проникновения в кожу и AI могут быть выбраны соответствующая комбинация (1) исходной толщины деаэрированного раствора клейкого полимера, наносимого на покровный слой, (2) времени высушивания и (3) температуры высушивания. Высушенную клейкую полимерную матрицу затем ламинируют куском антиадгезионного материала (таким как Scotchpak 1022 или 9744, 3 М Co., St. Paul Minn.) (или покровным слоем, если используют альтернативный вариант осуществления), предпочтительно того же размера, чтобы сформировать лист трансдермальной системы доставки гормонов. Часть В. Получение многослойного материала нетканый материал/акриловый PSA/верхний слой сPIB PSA: получение верхнего слоя выполняют в два этапа. На первом этапе разматывают покрытый РЕТ-силиконом антиадгезионный материал и раствор акрилового клейкого материала Duro-Tak 87-2852 наносят на силиконовую сторону антиадгезионного материала. Полотно продвигают через нагретые печи, где растворители продувают и формируют многослойный материал антиадгезионный материал/твердый акриловый PSA. Многослойный материал продвигают в направлении ламинаторного блока, где разматывают фильерный нетканый материал 3 М 9700,и акриловый PSA и 3 М 9700 проходят через нагретые валки ламинатора, где формируют три слоя многослойного материала (3m 9700/акриловый PSA/силиконовый антиадгезионный материал). На второй стадии разматывают покрытый РЕТ-силиконом антиадгезионный материал и раствор PIBPSA наносят на силиконовую сторону антиадгезионного материала. Полотно продвигают через нагретые валки, где растворители продувают и формируют многослойный материал антиадгезионный материал/твердый PIB PSA. Многослойный материал продвигают в направлении ламинаторного блока, где расположен многослойный материал 3M 9700/акриловый PSA/силиконовый антиадгезионный материал. 3M 9700 многослойный материал разматывают, удаляют и выкидывают его антиадгезионный материал, а остаток многослойного материала продвигают в направлении нагретых валков ламинатора, где он соединяет и привалльцовывает многослойный материал к антиадгезионному материалу/твердому PIB PSA,чтобы сформировать окончательный верхний слой, состоящий из 3M 9700 фильерного нетканого материала/акрилового PSA/PIB PSA/силиконового антиадгезионного материала. Часть С. Получение единого устройства изобретения (процесс преобразования двойного диска). Преобразование двойного диска, периферийное наклеиваемое трансдермальное устройство доставки получают на высекающе-ламинирующей части оборудования, обычного для данной промышленности. Оно имеет по меньшей мере две сматывающие секции, две высекающие секции, одну ламинирующую секцию и три перематывающие секции. Рулон верхнего слоя многослойного материала (полиуретановый, полиакрилатный PSA и PIB PSA) из части В и рулон многослойного материала антиадгезионный материал/активный пластырь/внутренний покровный слой из части А устанавливают на сматывающие стержни. Многослойный материал активного пластыря пропускают сквозь высекающую секцию, где выполняется неполная или легкая надсечка по форме активного пластыря сквозь внутреннее покрытие и слой AI, но не сквозь антиадгезионный материал. Ненужный материал вокруг пластырей отслаивают от защитного материала и наматывают на перематывающий стержень. Многослойный материал верхнего слоя пропускают через преобразующую машину, антиадгезионный материал удаляют, а обработанное клейкое-уретановое покрытие верхнего слоя наслаивают поверх пластыря и на антиадгезионный материал из многослойного материала активного пластыря. Полученный в результате многослойный материал с активным пластырем, размещенным между верхним слоем и антиадгезионным материалом, насекают по форме большей, чем активный пластырь, и накапливают для следующей технологической операции. Полученный в результате материал с отверстиями, вырезанными в форме верхнего слоя-пластыря, наматывают на перематывающий стержень. Пример 2. Регулирование потери летучих компонентов. Было получено трансдермальное устройство доставки гормонов, содержащее внутренний покровный слой, слой AI и антиадгезионный материал. Слой AI содержал в качестве полимерной матрицы PSA:Duro Tak 87-4098; в качестве гигроскопичного вещества: PVP/VA-S360; в качестве усилителей проникновения в кожу: диметилсульфоксид (ДМСО), лауриллактат (Ceraphyl 31), этиллактат и каприновую кислоту; в качестве AI: левоноргестрел и этинилэстрадиол. Устройство также содержало верхний слой, содержащий полиуретановое фильерное нетканое покрытие, которое способно поглощать большие количества летучих вспомогательных веществ, ДМСО и этиллактат, акриловый PSA, нанесенный на полиуретановую пену, и PIB PSA, нанесенный сверху акрилового PSA. Внутренний покровный слой состоял из полиэфирной покровной пленки Mylar, на которую был нанесен акриловый PSA, содержащий AI, а также летучие вспомогательные вещества, ДМСО и этиллактат при 8 мас.% и 1,7 мас.% номинальной концентрации соответственно, и нелетучее вспомогательное вещество, лауриллактат, при 8,4 мас.% номинальной концентрации. Антиадгезионный материал представлял собой полиэфирную пленку Mylar, покрытую фторполимерным антиадгезионным покрытием. Пластыри собирали так, чтобы антиадгезионный материал находился в непосредственном контакте сPIB PSA верхнего слоя, образуя изолирующий слой in situ вокруг активного пластыря. Устройства поместили в 25 С или 40 С печь. Спустя 6 недель и 12 недель, устройства извлекли из печи и активную часть каждого устройства отделили от верхнего слоя. В активном пластыре определили количества ДМСО, лауриллактата и этиллактата с использованием газовой хроматографии. (12 недельная обработка при 40 С предназначена имитировать 18-месячную обработку при комнатной температуре (25 С. Результаты показаны в табл. 4. Таблица 4. Количества ДМСО, этиллактата и лауриллактата в AI пластыря Данные результаты демонстрируют, что изолирующий слой между верхним слоем и антиадгезионным материалом и использование верхнего слоя, внутреннего покровного слоя и антиадгезионного мате- 11020208 риала являются достаточными для предотвращения потери летучих компонентов (ДМСО, этиллактат) и нелетучего компонента (лауриллактат). Устройства доставки в кожу изобретения необязательно могут быть упакованы для дистрибуции и продажи пользователям. Может быть использована стандартная упаковка или, если необходимо, может быть задействована упаковка, которая прикладывает давление на изолирующий слой in situ между антиадгезионным материалом и PSA верхнего слоя. Цель такой упаковки состоит в том, чтобы удерживать антиадгезионный материал и верхний слой в контакте друг с другом и чтобы минимизировать скольжение или отрыв друг от друга, что может произойти, например, в процессе транспортировки. Такая упаковка может содержать закрываемый пакет (например, створчатый пакет, который шарнирно откидывают для открывания, но который может быть зафиксирован закрытым), который в закрытом состоянии плотно входит по периметру устройства доставки, прикладывая, тем самым, небольшое количество давления на изолирующий слой in situ, но форма которого подобрана так, чтобы не сдавливать AIсодержащий пластырь. Настоящее изобретение не ограничено вариантами осуществления, описанными и приведенными в качестве примера выше, но может быть изменено и модифицировано в пределах объема правовых притязаний прилагаемой формулы изобретения. Опубликованные патентные заявки и патенты, упоминаемые в данном описании, включены в данную заявку посредством ссылки, как если бы были изложены полностью. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Устройство для трансдермальной доставки лекарственных средств, которое содержит:a) слой активного ингредиента (AI), имеющий контактирующую с кожей поверхность и поверхность, не контактирующую с кожей, и содержащий летучий компонент;b) слой антиадгезионного материала, непроницаемого для летучего компонента, примыкающий к контактирующей с кожей поверхности слоя AI, периметр которого простирается за пределы периметра слоя AI во всех направлениях; иc) верхний слой, содержащий первый склеивающий при надавливании клей (PSA), примыкающий к поверхности слоя AI, не контактирующей с кожей, периметр которого простирается за пределы периметра слоя AI во всех направлениях,где слой AI представляет собой матрицу, содержащую второй PSA, а летучий компонент является,по меньшей мере, частично солюбилизированным в указанном втором PSA; причм растворимость летучего компонента в первом PSA верхнего слоя меньше, чем растворимость указанного компонента во втором PSA слоя AI; слой антиадгезионного материала и первый PSA верхнего слоя находятся в контакте и приклеены друг к другу по периметру слоя AI для формирования изолирующего слоя, который уменьшает или предотвращает потерю летучего компонента из слоя AI. 2. Устройство по п.1, в котором летучий компонент представляет собой органический растворитель. 3. Устройство по п.2, в котором летучий компонент содержит диметилсульфоксид ДМСО и/или этиллактат; матрица PSA слоя AI представляет собой полиакрилатный PSA; антиадгезионный материал представляет собой фторсодержащую или силиконизированную полиэфирную пленку или фольгу, футурированную силиконизированным или фторсодержащим полимером; и верхний слой содержит полиизобутиленовый, склеивающийся при надавливании клей (PIB PSA). 4. Устройство по пп.1, 2 или 3, которое дополнительно содержит покрытие верхнего слоя. 5. Устройство по п.4, в котором покрытие верхнего слоя содержит промежуточный слой с полиакрилатным PSA и слой без PSA. 6. Устройство по п.5, в котором не содержащий PSA слой в покрытии верхнего слоя представляет собой полиуретановую пленку, пенистую или фильерную структуру, полиолефиновую пену, PVC пену или тканый или нетканый материал. 7. Устройство по пп.1-5 или 6, которое дополнительно содержит внутренний покровный слой между слоем AI и верхним слоем. 8. Устройство по п.1, в котором верхний слой, примыкающий к поверхности слоя AI, не контактирующей с кожей, содержит PIB PSA. 9. Устройство по п.8, в котором летучий компонент содержит ДМСО и/или этиллактат. 10. Устройство по п.8 или 9, в котором PIB PSA содержит от приблизительно 5 до приблизительно 45 мас.% PVP с поперечными межмолекулярными связями; от приблизительно 10 до приблизительно 60 мас.% PIB низкой вязкости; от приблизительно 2 до приблизительно 20 мас.% PIB высокой вязкости; от приблизительно 10 до приблизительно 60 мас.% полибутена и от приблизительно 0 до приблизительно 20 мас.% минерального масла. 11. Устройство по п.10, в котором PIB PSA содержит от приблизительно 15 до приблизительно 30 мас.% кросповидона; от приблизительно 30 до приблизительно 50 мас.% PIB с низкой молекулярной массой; от приблизительно 5 до приблизительно 15 мас.% PIB с высокой молекулярной массой; от приблизительно 20 до приблизительно 40 мас.% полибутена, имеющего вязкость, равную от приблизительно 3900 до приблизительно 4200 сСт при 100 С и 0 мас.% минерального масла. 12. Устройство по п.11, в котором PIB PSA содержит приблизительно 20 мас.% кросповидона, приблизительно 40 мас.% PIB с низкой молекулярной массой, приблизительно 8 мас.% PIB с высокой молекулярной массой и приблизительно 32 мас.% полибутена. 13. Устройство по п.12, которое дополнительно содержит внутренний покровный слой между стороной слоя AI, не контактирующей с кожей, и верхним слоем. 14. Устройство по п.1, в котором первый склеивающий при надавливании клей верхнего слоя представляет собой PIB PSA, и верхний слой дополнительно содержит покрытие, которое, по существу, является непроницаемым для PIB PSA и которое является проницаемым для влаги. 15. Устройство по п.14, в котором покрытие верхнего слоя содержит слой PSA и пористый слой. 16. Устройство по п.15, в котором слой PSA в покрытии верхнего слоя представляет собой полиакрилатный PSA, а пористый слой представляет собой полиуретан. 17. Устройство по любому из пп.1-16, в котором активный ингредиент представляет собой по меньшей мере один гормон. 18. Устройство по любому из пп.1-16, в котором активный ингредиент представляет собой малую молекулу. 19. Устройство по п.17, в котором активный ингредиент представляет собой два гормона: прогестин и эстроген. 20. Устройство по п.19, в котором эстроген представляет собой этинилэстрадиол или 17 бетаэстрадиол, а прогестин представляет собой левоноргестрел, и оба находятся в полимерной матрице, которая содержит полиакрилатный PSA, гигроскопичное вещество/пластификатор и один или более усилителей проникновения в кожу. 21. Устройство по п.20, в котором один или более усилителей проникновения в кожу содержат ДМСО. 22. Устройство по п.21, в котором усилители проникновения в кожу содержат низший (С 1-С 4) алкиловый эфир гидроксикислоты. 23. Устройство по пп.20, 21 или 22, где усилители проникновения в кожу содержат ДМСО, эфир жирного (С 8-С 20) спирта и молочной кислоты; низший (С 1-С 4) алкиловый эфир молочной кислоты и С 6-С 18 жирную кислоту. 24. Устройство по пп.20-22 или 23, в котором полиакрилатный PSA представляет собой полиакрилатный сополимер. 25. Устройство по п.24, где полиакрилатный сополимер содержит от приблизительно 3 до приблизительно 60 мас.% винилацетата. 26. Устройство по пп.20-23 или 24, в котором гигроскопичное вещество/пластификатор содержит поливинилпирролидон (PVP). 27. Устройство по п.26, где гигроскопичное вещество/пластификатор представляет собой сополимер поливинилпирролидон/винилацетат (PVP/VA). 28. Устройство по п.27, где PVP составлен в количестве, равном приблизительно 60 мас.%, а винилацетат составлен в количестве, равном приблизительно 40 мас.% в сополимере PVP/VA. 29. Устройство по п.23 или по любому зависимому от него пункту, где эфир жирного спирта и молочной кислоты представляет собой лауриллактат. 30. Устройство по п.29, где низший алкиловый эфир молочной кислоты представляет собой этиллактат. 31. Устройство по п.23 или по любому зависимому от него пункту, где С 6-С 18 жирная кислота представляет собой капроновую кислоту. 32. Устройство по любому из пп.1-31, в котором верхний слой герметично прикреплен посредствомPSA к антиадгезионному материалу и упакован в контейнер, который удерживает антиадгезионный материал в контакте с верхним слоем. 33. Устройство для трансдермальной доставки лекарственных средств, которое содержит:a) слой активного ингредиента (AI), представляющего собой полимерную матрицу, имеющую контактирующую с кожей поверхность и поверхность, не контактирующую с кожей, который содержит летучий компонент;b) слой антиадгезионного материала, непроницаемого для летучего компонента, примыкающий к контактирующей с кожей поверхности слоя AI, периметр которого простирается за пределы периметра слоя AI во всех направлениях; иc) верхний слой, содержащий склеивающий при надавливании клей (PSA), примыкающий к поверхности слоя AI, не контактирующей с кожей, периметр которого простирается за пределы периметра слоя AI во всех направлениях,где слой AI представляет собой полимерную матрицу, содержащую второй PSA, и летучий компо- 13020208 нент, по меньшей мере, частично растворн в указанном втором PSA; причм растворимость летучего компонента в первом PSA верхнего слоя меньше, чем во втором PSA слояAI; антиадгезионный слой находится в непосредственном контакте со слоем AI; антиадгезионный слой и первый PSA верхнего слоя приклеены друг к другу по периметру слоя AI для формирования изолирующего слоя, который уменьшает или предотвращает потерю летучего компонента из слоя AI; при этом антиадгезионный слой выполнен с возможностью удаления посредством отслаивания от слоя AI и верхнего слоя PSA непосредственно перед прикладыванием к коже, а слой AI приклеивается прямо на кожу, и первый PSA верхнего слоя дополнительно склеивает второй PSA со слоем AI; летучий компонент содержит диметилсульфоксид ДМСО; первый PSA представляет собой полиизобутиленовый PSA; второй PSA представляет собой полиакрилатный PSA; верхний слой дополнительно включает слой полиакрилатного PSA, примыкающий к поверхности слоя AI, не контакрирующей с кожей, и слой, не содержащий PSA, расположенный над поверхностью полиакрилатного слоя PSA; причм склеивание слоев достигается без нагрева.
МПК / Метки
МПК: A61F 13/00, A61K 9/70
Метки: устройство, кожу, слоем, изолирующим, доставки
Код ссылки
<a href="https://eas.patents.su/15-20208-ustrojjstvo-dostavki-v-kozhu-s-izoliruyushhim-sloem-in-situ.html" rel="bookmark" title="База патентов Евразийского Союза">Устройство доставки в кожу с изолирующим слоем in situ</a>
Предыдущий патент: Устройство для рефлексотерапии
Следующий патент: Способ получения соединений, применимых в качестве ингибиторов натрийзависимого переносчика глюкозы
Случайный патент: Способ развертывания в скважине электроприводной системы перекачки потока флюида












