Фармацевтический комплекс элетриптана и производного циклодекстрина
Формула / Реферат
1. Комплекс элетриптана и производного циклодекстрина формулы (I)
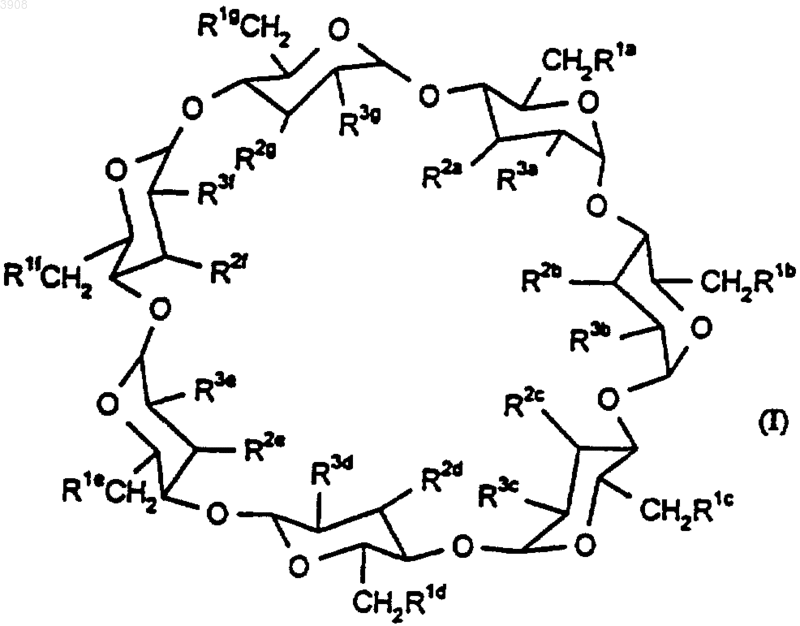
где R1a-g, R2a-g и R3a-g, каждый независимо, представляют собой -OH или -O(CH2)4SO3H;
при условии, что по меньшей мере один из R1a-g представляет собой -O(CH2)4SO3H;
или их фармацевтически приемлемой соли.
2. Комплекс по п.1, где среднее число групп -O(CH2)4SO3H на молекулу производного формулы (I) находится в диапазоне от 6,1 до 6,9.
3. Комплекс по п.1 или 2, где каждая группа -O(CH2)4SO3H, присутствующая в производном формулы (I), представлена в форме соли щелочного металла.
4. Комплекс по любому из пп.1-3, где молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 15:1.
5. Комплекс по п.4, где молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 10:1.
6. Комплекс по любому из пп.1-5, где элетриптан представлен в форме соли гемисульфата.
7. Фармацевтический препарат, включающий в себя комплекс по любому из пп.1-6 и фармацевтически приемлемый эксципиент, разбавитель или носитель.
8. Препарат по п.7, в котором присутствует от 50 до 120 мг/г гемисульфата элетриптана.
9. Препарат по п.7 или 8, в котором присутствует от 15 до 25 мас.% сульфобутилэфир-бета-циклодекстрина.
10. Препарат по пп.7, 8 или 9, включающий в себя один или более чем один антиоксидант, сорастворитель и органический полимер.
11. Препарат по п.10, где антиоксидантом является аскорбиновая кислота.
12. Препарат по п.11, в котором присутствует от 0,25 до 0,80 мас.% аскорбиновой кислоты.
13. Препарат по любому из пп.10-12, где сорастворителем является глицерин.
14. Препарат по п.13, в котором присутствует от 10,0 до 25,0 мас.% глицерина.
15. Препарат по любому из пп.10-14, где органическим полимером является карбоксиметилцеллюлоза или поливинилпирролидон.
16. Препарат по п.15, в котором присутствует от 0,05 до 0,20 мас.% карбоксиметилцеллюлозы или поливинилпирролидона.
17. Препарат по любому из пп.7-16, который представлен в форме водного раствора.
18. Водный препарат по п.17, который имеет pH от 4,0 до 5,0.
19. Препарат по любому из пп.7-18, который пригоден для парентерального введения.
20. Препарат по любому из пп.7-18, который пригоден для интраназального введения.
21. Препарат по любому из пп.7-18, который пригоден для введения путем ингаляции.
22. Препарат по п.7, который представляет собой водный раствор, содержащий
80 мг/г гемисульфата элетриптана;
20 мас.% сульфобутилэфир-бета-циклодекстрина, как он определен в п.1, имеющего среднее сульфобутилэфирное замещение, равное 6,5 на молекулу циклодекстрина, с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли;
20 мас.% глицерина; и
0,7 мас.% аскорбиновой кислоты;
причем pH препарата отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия.
23. Препарат по п.7, который представляет собой водный раствор, содержащий
80 мг/ г гемисульфата элетриптана;
20 мас.% сульфобутилэфир-бета-циклодекстрина, как он определен в п.1, имеющего среднее сульфобутилэфирное замещение, равное 6,5 на молекулу циклодекстрина, с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли;
0,10 мас.% поливинилпирролидона; и
0,7 мас.% аскорбиновой кислоты;
причем pH композиции отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия.
24. Применение комплекса по любому из пп.1-6 в качестве лекарства.
25. Применение комплекса по любому из пп.1-6 в качестве лекарства для лечения заболевания, для которого показан агонист 5HT1B/1D рецептора.
26. Применение комплекса по любому из пп.1-6 в качестве лекарства для лечения мигрени или предупреждения рецидива мигрени.
27. Способ лечения млекопитающего для лечения заболевания, для которого показан агонист 5HT1B/1D рецептора, при котором указанного млекопитающего лечат эффективным количеством комплекса по любому из пп.1-6 или его фармацевтически приемлемого препарата по любому из пп.7-23.
28. Способ лечения млекопитающего для лечения мигрени или предупреждения рецидива мигрени, при котором указанного млекопитающего лечат эффективным количеством комплекса по любому из пп.1-6 или его фармацевтически приемлемого препарата по любому из пп.7-23.
29. Способ приготовления комплекса, как он определен в п.1, при котором элетриптан или его фармацевтически приемлемую соль комбинируют с производным циклодекстрина или его фармацевтически приемлемой солью.
30. Способ приготовления препарата по п.7, при котором либо (1) комплекс, как он определен в п.1, либо (2) элетриптан или его фармацевтически приемлемую соль и производное циклодекстрина или его фармацевтически приемлемую соль комбинируют с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
Текст
1 Настоящее изобретение относится к комплексу элетриптана и сульфобутилэфир-бетациклодекстрина или их фармацевтически приемлемой соли, и к способам приготовления фармацевтических препаратов, включающих в себя такой комплекс, и к применению такого комплекса. Элетриптан, 3-([1-метилпирролидин-2(R)ил]метил)-5-(2-фенилсульфонилэтил)-1 Н-индол,раскрыт в WO-A-92/06973. Предпочтительная форма бромистоводородной соли элетриптана описана в WO-A-96/06842. В WO-A-99/01135 раскрыт фармацевтический препарат, содержащий гемисульфат элетриптана и кофеин. В WOA-00/06161 описано применение элетриптана для предупреждения рецидива мигрени. Элетриптан является агонистом 5 НТ 1B/1D рецептора и, как показано, обладает высокой эффективностью при лечении мигрени и предупреждении рецидива мигрени. Кроме того, описано применение элетриптана при лечении гипертензии, рвоты, депрессии, тревоги, пищевых расстройств, ожирения, злоупотребления лекарственными средствами, кластерной головной боли, боли, хронической пароксизмальной гемикрании и головной боли, связанной с сосудистыми нарушениями. Для введения элетриптана или его соли интраназальным путем желательно, чтобы препарат не создавал недопустимых уровней воздействия, такого как раздражения, на слизистую оболочку носа. Было обнаружено, что препараты, описанные в WO-A-99/01135, содержащие гемисульфат элетриптана и кофеин, обладают раздражающим действием на слизистую оболочку носа. Поэтому задача настоящего изобретения заключается в том, чтобы предложить хорошо переносимый комплекс элетриптана или его соли, который является пригодным для введения интраназальным путем. Другая задача настоящего изобретения состоит в том, чтобы предложить хорошо переносимый, стабильный водный фармацевтический препарат, содержащий элетриптан или его соль,который является пригодным для парентерального, предпочтительно интраназального введения и который обеспечивает хорошую биодоступность и быстрое начало действия лекарственного средства. В WO-A-91/11172 и WO-A-94/02518 раскрыты сульфоалкиловые эфирные производные циклодекстрина. В WO-A-98/02186 раскрыт комплекс включения (а) индольного селективного агониста серотонинового (5-НТ 1D) рецептора или его фармацевтически приемлемой соли и (б) незамещенного или замещенного бета- или гаммациклодекстрина вместе с его фармацевтическими композициями. В настоящее время обнаружено, что элетриптан или его соль могут образовывать ком 003908 2 плекс с некоторыми производными сульфобутилэфир-бета-циклодекстрина, подобно описанному в WO-A-91/11172. Хотя такое комплексообразование нежелательно и непредсказуемо уменьшает растворимость элетриптана или его соли в воде, оно неожиданно и наилучшим образом обеспечивает образование комплекса,который является хорошо переносимым при интраназальном введении, главным образом,вследствие того, что он обладает ничтожно малым раздражающим воздействием на слизистую оболочку носа по сравнению как с известными кофеиновыми препаратами элетриптана, описанными в WO-A-99/01135, так и с другими циклодекстриновыми комплексами элетриптана. В соответствии с этим в настоящем изобретении предложен комплекс элетриптана и производного циклодекстрина формулы (I) где R1a-g, R2a-g и R3a-g, каждый независимо, представляют собой -ОН или -O(СН 2)4SO3 Н; при условии, что по меньшей мере один из R1a-g представляет собой -O(СН 2)4SO3 Н; или их фармацевтически приемлемой соли. Предпочтительно, среднее число групп-O(СН 2)4SO3 Н на молекулу производного формулы (I) находится в диапазоне от 6,1 до 6,9. Предпочтительно, чтобы каждая группа-O(СН 2)4SO3 Н, присутствующая в производном формулы (I), была представлена в форме соли щелочного металла. Предпочтительно, молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 15:1. Наиболее предпочтительно, молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 10:1. Предпочтительно, элетриптан представлен в форме соли гемисульфата. Далее, согласно данному изобретению предложен фармацевтический препарат, включающий в себя комплекс, как он определен выше, и фармацевтически приемлемый эксципиент, разбавитель или носитель. Предпочтительно, когда в фармацевтическом препарате присутствует от 50 до 120 мг/г гемисульфата элетриптана. В фармацевтическом препарате может присутствовать от 15 до 25% по массе сульфобутилэфир-бета-циклодекстрина. 3 Фармацевтический препарат может включать в себя один или более чем один антиоксидант, сорастворитель и органический полимер. Предпочтительно, антиоксидантом является аскорбиновая кислота. В фармацевтическом препарате может присутствовать от 0,25 до 0,80% по массе аскорбиновой кислоты. Предпочтительно, сорастворителем является глицерин. В фармацевтическом препарате может присутствовать от 10,0 до 25,0% по массе глицерина. Целесообразно, если органическим полимером является карбоксиметилцеллюлоза или поливинилпирролидон. В фармацевтическом препарате может присутствовать от 0,05 до 0,20% по массе карбоксиметилцеллюлозы или поливинилпирролидона. Фармацевтический препарат может быть представлен в форме водного раствора. Предпочтительно, водный фармацевтический препарат имеет рН от 4,0 до 5,0. Фармацевтический препарат может быть пригоден для парентерального введения. Фармацевтический препарат может также быть пригоден для интраназального введения. Кроме того, фармацевтический препарат может быть пригоден для введения путем ингаляции. Предпочтительно, фармацевтический препарат представляет собой водный раствор, содержащий 80 мг/г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина, как он определен выше,имеющего среднее сульфобутилэфирное замещение, равное 6,5 на молекулу циклодекстрина,с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли; 20% по массе глицерина и 0,7% по массе аскорбиновой кислоты; причем рН препарата отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. Предпочтительно, фармацевтический препарат представляет собой водный раствор, содержащий 80 мг/г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина, как он определен выше,имеющего среднее сульфобутилэфирное замещение, равное 6,5 на молекулу циклодекстрина,с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли; 0,10% по массе поливинилпирролидона и 0,7% по массе аскорбиновой кислоты; причем рН композиции отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4 4,5, с помощью водного раствора гидроксида натрия. Далее, согласно данному изобретению предложено применение комплекса, как он определен выше, в качестве лекарства. Согласно данному изобретению также предложено применение комплекса, как он определен выше, в качестве лекарства для лечения заболевания, для которого показан агонист 5 НТ 1B/1D рецептора. Кроме того, согласно данному изобретению предложено применение комплекса, как он определен выше, в качестве лекарства для лечения мигрени или предупреждения рецидива мигрени. Настоящее изобретение также относится к способу лечения млекопитающего для лечения заболевания, для которого показан агонист 5HT1B/1D рецептора, при котором указанного млекопитающего лечат эффективным количеством комплекса, как он определен выше, или его фармацевтически приемлемого препарата, как он определен выше. Кроме того, настоящее изобретение относится к способу лечения млекопитающего для лечения мигрени или предупреждения рецидива мигрени, при котором указанного млекопитающего лечат эффективным количеством комплекса, как он определен выше, или его фармацевтически приемлемого препарата, как он определен выше. Далее, согласно настоящему изобретению предложен способ приготовления комплекса,как он определен выше, при котором элетриптан или его фармацевтически приемлемую соль комбинируют с производным циклодекстрина или его фармацевтически приемлемой солью. Кроме того, согласно данному изобретению предложен способ приготовления фармацевтического препарата, как он определен выше, при котором либо (1) комплекс, как он определен выше, либо (2) элетриптан или его фармацевтически приемлемую соль и производное циклодекстрина или его фармацевтически приемлемую соль комбинируют с фармацевтически приемлемым эксципиентом, разбавителем или носителем. Фармацевтически приемлемые соли, представляющие особый интерес, связанные с элетриптановым компонентом, представляют собой его соли присоединения кислот и оснований. Подходящие соли присоединения кислот получают из кислот, которые образуют нетоксичные соли, примерами являются соли гидрохлорид,гидробромид, гидроиодид, сульфат, бисульфат,нитрат, фосфат, кислый фосфат, ацетат, малеинат, фумарат, лактат, тартрат, цитрат, глюконат,сукцинат, сахарат, бензоат, метансульфонат,этансульфонат,бензолсульфонат,паратолуолсульфонат и памоат. Соли гидробромид и сульфат, включая гемисульфат, являются предпочтительными. Подходящие основные соли 5 получают из оснований, которые образуют нетоксичные соли, примерами являются соли натрия, калия, алюминия, кальция, магния, цинка и диэтаноламина. Фармацевтически приемлемые соли, представляющие особый интерес, связанные с компонентом циклодекстринового кольца, представляют собой основные соли групп-O(СН 2)4SO3 Н, например соли щелочного металла, такие как соли натрия. Обзор подходящих солей представленBerge et al. в J. Pharm. Sci., 66, 1-19,1977. Фармацевтически приемлемую соль можно легко получить путем совместного перемешивания растворов элетриптана, циклодекстрина или комплекса и желательной кислоты или основания, как подходит. Эту соль можно осаждать из раствора и собирать посредством фильтрования или можно выделять путем выпаривания растворителя. Когда соль элетриптана и/или циклодекстрина получают раздельно, их/ее можно затем использовать для получения комплекса. Полиморф элетриптана или его соль можно также использовать для этого назначения по настоящему изобретению. Предпочтительно среднее количество групп -O(СН 2)4SO3 Н на молекулу формулы (I) находится в диапазоне от 6,1 до 6,9, например 6,5 или около 6,5. Предпочтительно, чтобы каждая группа-O(СН 2)4SO3 Н была представлена в форме соли щелочного металла (такой как соль натрия). Данный комплекс может быть введен один, но обычно будет вводиться в смеси с фармацевтически приемлемым эксципиентом,разбавителем или носителем, выбранным в зависимости от предполагаемого пути введения и стандартной фармацевтической практики. Например, данный комплекс может быть введен перорально, буккально или сублингвально в форме таблеток, капсул, овулей, эликсиров,растворов или суспензий, которые могут содержать корригенты или красители для применения с немедленным, замедленным, отсроченным,импульсным или регулируемым высвобождением. Такие таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), крахмальный гликолят натрия, натриевая кроскармеллоза и некоторые комплексные силикаты и связующие для гранулирования,такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин и аравийская камедь. Кроме того, могут быть включены смазывающие агенты, такие как стеарат магния,стеариновая кислота, глицерилбегенат и тальк. 6 Твердые композиции аналогичного типа можно также использовать в качестве наполнителей желатиновых капсул. Предпочтительные в этом отношении эксципиенты включают в себя лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярный полиэтиленгликоль. В случае использования водных суспензий и/или эликсиров данный комплекс может быть объединен с различными подсластителями или корригентами, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин,и их комбинациями. Указанный комплекс можно также вводить парентерально, например внутривенно, внутриартериально, внутрибрюшинно, внутриоболочечно, интравентрикулярно, интрастернально,интракраниально, внутримышечно или подкожно или можно вводить с помощью инфузионных методов. Лучше всего его использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы для приготовления раствора, изотонического с кровью. Водные растворы должны быть соответствующим образом забуферены (предпочтительно до значений рН от 3 до 9), если необходимо. Приготовление подходящих парентеральных препаратов в стерильных условиях легко осуществимо с помощью стандартных фармацевтических методов, хорошо известных специалистам в этой области. Для перорального и парентерального введения пациенту - человеку уровень суточной дозировки элетриптана будет обычно составлять от 0,001 до 0,50 мг/кг (в однократной или разделенной дозах). Таким образом, таблетки или капсулы, содержащие этот комплекс, могут содержать от 5 до 240 мг элетриптана или его соли для введения однократно либо за два или более чем два раза, как подходит. Лечащий врач в любом случае определит фактическую дозировку, которая наиболее приемлема для любого индивидуального пациента и которая будет изменяться в зависимости от возраста, веса и ответной реакции конкретного пациента. Приведенные выше дозировки являются примером среднего случая. Конечно, могут быть индивидуальные требования, при которых более высокие или низкие дозировки являются необходимыми, и такие дозировки также входят в объем данного изобретения. Этот комплекс может быть также введен интраназально или путем ингаляции и подходящим образом доставлен в виде однократной дозы или многократной дозы в форме сухого порошкового ингалятора, либо аэрозольного спрея из находящегося под давлением контейнера, насоса, пульверизатора, спрея или распылителя, с использованием или без использова 7 ния подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [товарный знак]), или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA [товарный знак]), диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартную дозу можно определить путем обеспечения клапаном для доставки отмеренного количества. Находящийся под давлением контейнер, насос, пульверизатор, спрей или распылитель могут содержать раствор или суспензию данного комплекса,например, с использованием смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее вещество, например сорбитан триолеат. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть изготовлены таким образом, что они содержат порошковую смесь данного комплекса и подходящей порошковой основы, такой как лактоза или крахмал. Аэрозольные или сухие порошковые препараты составляют предпочтительно таким образом, чтобы каждая отмеренная доза или"пшик" содержали от 1 до 16 мг элетриптана для доставки пациенту. Альтернативно данный комплекс может быть введен в форме суппозитория или пессария, либо его можно применять местно в форме лосьона, раствора, крема, мази или порошка для присыпки. Данный комплекс может быть также введен трансдермально, например с помощью использования кожного пластыря. Для местного применения на кожу указанный комплекс может быть приготовлен в форме соответствующей мази, содержащей комплекс,суспендированный или растворенный, например, в смеси с одним или более следующих компонентов: вазелиновое масло, вазелин, медицинский вазелин, пропиленгликоль, соединение полиоксиэтилен-полиоксипропилен, эмульгирующий воск и вода. Альтернативно, он может быть приготовлен в форме подходящего лосьона или крема, суспедированного или растворенного, например, в смеси одного или более следующих компонентов: вазелиновое масло,сорбитан моностеарат, полиэтиленгликоль,жидкий парафин, полисорбат 60, цетиловоэфирные воска, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и вода. Комплекс по настоящему изобретению может быть приготовлен из водного раствора либо суспензии элетриптана или его соли и циклодекстрина или его соли с помощью обычных способов. В случаях, когда необходим твердый комплекс, раствор или суспензия могут быть высушены с помощью распылительной сушки или сублимационной сушки (лиофилизации). Альтерантивно, элетриптан или его соль и циклодекстрин или его соль могут быть смешаны, и 8 порошковая смесь увлажнена водой. Эту смесь можно затем интенсивно перемешать до образования пасты и высушить при повышенной температуре, предпочтительно при пониженном давлении, для удаления воды. Высушенный комплекс можно растолочь и просеять до требуемого размера частиц. Твердый комплекс может быть затем приготовлен в виде препарата для введения в качестве фармацевтического препарата с помощью стандартных способов, например, если необходим водный препарат, указанный комплекс может быть растворен при перемешивании в воде. Дополнительный подходящий эксципиент, разбавитель или носитель может быть введен в препарат на стадии приготовления смеси или перемешивания. Альтернативно, фармацевтический препарат, включающий в себя настоящий комплекс, может быть приготовлен непосредственно путем перемешивания элетриптана или его соли и циклодекстрина или его соли вместе с подходящим эксципиентом, разбавителем или носителем. Указанный комплекс может быть также введен вместе с прокинетическим (например,метоклопрамид) или противорвотным агентом. Следует отметить, что все приводимые здесь ссылки на лечение включают в себя целебное, паллиативное и профилактическое лечение. Предпочтительно, указанный комплекс вводят в виде фармацевтического препарата,наиболее предпочтительно, препарата, представляющего собой водный раствор. Предпочтительно, фармацевтический препарат готовят для парентерального введения,например интраназального введения. Предпочтительно, фармацевтический препарат, наиболее предпочтительно водный фармацевтический препарат, содержит один или более чем один из следующих эксципиентов,разбавителей или носителей:(а) антиоксидант, например лимонная кислота или аскорбиновая кислота;(б) сорастворитель, например этанол, глицерин или полиэтиленгликоль PEG200-400; и(в) органический полимер, например водорастворимый органический полимер, такой как карбоксиметилцеллюлоза, поливинилпирролидон или гидроксипропилметилцеллюлоза. Присутствие антиоксиданта повышает стабильность данного препарата. Присутствие органического полимера или сорастворителя оптимизирует биодоступность и увеличивает абсорбцию и начало действия элетриптана. Предпочтительно, в настоящем изобретении предложен фармацевтический препарат,предпочтительно водный фармацевтический препарат, включающий в себя от 10 до 150 мг/г элетриптана или его соли (предпочтительно гемисульфата) и от 10 до 30% по массе сульфобутилэфир-бета-циклодекстрина. 9 Предпочтительно, может присутствовать до 1% по массе включительно антиоксиданта,такого как лимонная кислота или аскорбиновая кислота. Предпочтительно, может присутствовать до 30% по массе включительно сорастворителя,такого как этанол, глицерин или PEG200-400,предпочтительно глицерин. Предпочтительно, может присутствовать до 0,5% по массе включительно органического полимера, такого как водорастворимый полимер, например карбоксиметилцеллюлоза, поливинилпирролидон или гидроксиметилцеллюлоза, предпочтительно карбоксиметилцеллюлоза или поливинилпирролидон. Предпочтительно, присутствует от 10 до 150 мг/г гемисульфата элетриптана. Предпочтительно, присутствует от 20 до 110 мг/г гемисульфата элетриптана. Предпочтительно, присутствует от 50 до 120 мг/г гемисульфата элетриптана. Предпочтительно, присутствует от 10 до 30% по массе сульфобутилэфир-бета-циклодекстрина. Предпочтительно, присутствует от 15 до 25% по массе сульфобутилэфир-бета-циклодекстрина. Предпочтительно, присутствует от 0,10 до 1,0% по массе аскорбиновой кислоты. Предпочтительно, присутствует от 0,25 до 0,80% по массе аскорбиновой кислоты. Предпочтительно, присутствует от 0,30 до 0,60% по массе аскорбиновой кислоты. Предпочтительно, присутствует от 5,0 до 30,0% по массе глицерина. Предпочтительно, присутствует от 10,0 до 25,0% по массе глицерина. Предпочтительно, присутствует от 10,0 до 20,0% по массе глицерина. Предпочтительно, присутствует от 0,05 до 0,5% по массе карбоксиметилцеллюлозы или поливинилпирролидона. Предпочтительно, присутствует от 0,05 до 0,2% по массе, наиболее предпочтительно от 0,1 до 0,2% по массе, карбоксиметилцеллюлозы или поливинилпирролидона. Предпочтительно, рН водного фармацевтического препарата отрегулировано в пределах от 4,0 до 9,0. Предпочтительно, рН водного фармацевтического препарата отрегулировано в пределах от 4,0 до 7,0. Предпочтительно, рН водного фармацевтического препарата отрегулировано в пределах от 4,0 до 5,0. Следующие примеры иллюстрируют приготовление водных фармацевтических препаратов, включающих в себя комплекс по настоящему изобретению. Указанные препараты готовили путем добавления гемисульфата элетриптана,сульфобутилэфир-бета-циклодекстрина,глицерина или поливинилпирролидона и аскор 003908 10 биновой кислоты к воде (достаточное количество для получения 80% конечного объема требуемого препарата). Смесь перемешивали до растворения твердых частиц, и рН полученного раствора доводили до требуемого значения рН,используя 1 М водный раствор гидроксида натрия. Затем добавляли воду до достижения конечного требуемого объема. Используемый сульфобутилэфир-бетациклодекстрин имел среднее сульфобутилэфирное замещение, равное 6,5 на молекулу циклодекстрина, и каждое сульфобутилэфирное звено было представлено в виде его натриевой соли. Пример 1. Препарат, пригодный для интраназального введения, представляет собой водный препарат,содержащий 100 мг/г гемисульфат элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина; 15% по массе глицерина и 0,5% по массе аскорбиновой кислоты: причем рН препарата отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. Пример 2. Препарат, пригодный для интраназального введения, представляет собой водный препарат,содержащий 80 мг/г гемисульфата элетрипана; 20% по массе сульфобутилэфир-бетациклодекстрина; 0,15% по массе глицерина и 0,5% по массе аскорбиновой кислоты; причем рН композиции отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. Пример 3. Препарат, пригодный для интраназального введения, представляет собой водный препарат,содержащий 80 мг/г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина; 20% по массе глицерина и 0,7% по массе аскорбиновой кислоты; причем рН препарата отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. Пример 4. Препарат, пригодный для интраназального введения, представляет собой водный препарат,содержащий 80 мг/г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина; 0,10% по массе поливинилпирролидона и 0,7% по массе аскорбиновой кислоты; 11 причем рН композиции отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. Биологическая активность Комплекс по настоящему изобретению может быть испытан на раздражающее воздействие на слизистую оболочку носа с помощью следующего метода. Растворы для испытаний были приготовлены следующим образом:(содержащего среднее число гидроксипропильных групп на молекулу циклодекстрина, равное 0,6);(содержащего среднее число гидроксипропильных групп на молекулу циклодекстрина, равное 0,6) и 50 мг/мл гемисульфата элетриптана, и(4) водный раствор, содержащий 17% по массе сульфобутилэфир-бета-циклодекстрина по настоящему изобретению и 50 мг/мл гемисульфата элетриптана. рН всех перечисленных выше растворов доводили до рН 4,2 +/- 0,2. Для этих испытаний использовали самок крыс Sprague-Dawley. Возраст животных составлял около 7 недель, и средняя масса тела 199 г. Каждое испытание проводили на группе из пяти крыс. 20 мкл раствора для испытания закапывали в левую ноздрю каждой крысы в исследуемой группе. Крыс в каждой группе обрабатывали 1 раз в день одним и тем же раствором для испытания в течение 7 дней. Крыс в каждой исследуемой группе наблюдали ежедневно на смертность и клинические показатели. Их взвешивали в дни испытаний - 2, 1 и 7. На 8 день испытания крыс умерщвляли и проводили макроскопические и гистопатологические исследования на тканях респираторного тракта каждой крысы. Смертных случаев зарегистрировано не было. Результаты показали, что растворы для испытания (1), (2) и (4) не вызывают никаких поражений. Раствор для испытания (3) вызывал гиперплазию от минимальной до средней и метаплазию респираторного эпителия и люминального экссудата. Эти полученные данные интерпретировали как признаки раздражения носовых раковин от минимального до среднего. Был сделан вывод, что раствор для испытания (4), содержащий комплекс гемисульфата элетриптана и сульфобутилэфир-бетациклодекстрина по настоящему изобретению,не вызывал раздражения слизистой оболочки носа при введении интраназальным путем. 12 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комплекс элетриптана и производного циклодекстрина формулы (I) где R1a-g, R2 а-g и R3a-g, каждый независимо, представляют собой -ОН или -O(СН 2)4SO3 Н; при условии, что по меньшей мере один изR1a-g представляет собой -O(СН 2)4SO3 Н; или их фармацевтически приемлемой соли. 2. Комплекс по п.1, где среднее число групп -O(СН 2)4SO3 Н на молекулу производного формулы (I) находится в диапазоне от 6,1 до 6,9. 3. Комплекс по п.1 или 2, где каждая группа -O(СН 2)4SO3 Н, присутствующая в производном формулы (I), представлена в форме соли щелочного металла. 4. Комплекс по любому из пп.1-3, где молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 15:1. 5. Комплекс по п.4, где молярное соотношение элетриптан:производное циклодекстрина формулы (I) находится в диапазоне от 1:1 до 10:1. 6. Комплекс по любому из пп.1-5, где элетриптан представлен в форме соли гемисульфата. 7. Фармацевтический препарат, включающий в себя комплекс по любому из пп.1-6 и фармацевтически приемлемый эксципиент, разбавитель или носитель. 8. Препарат по п.7, в котором присутствует от 50 до 120 мг/г гемисульфата элетриптана. 9. Препарат по п.7 или 8, в котором присутствует от 15 до 25% по массе сульфобутилэфир-бета-циклодекстрина. 10. Препарат по пп.7, 8 или 9, включающий в себя один или более чем один антиоксидант,сорастворитель и органический полимер. 11. Препарат по п.10, где антиоксидантом является аскорбиновая кислота. 12. Препарат по п.11, в котором присутствует от 0,25 до 0,80% по массе аскорбиновой кислоты. 13. Препарат по любому из пп.10-12, где сорастворителем является глицерин. 14. Препарат по п.13, в котором присутствует от 10,0 до 25,0% по массе глицерина. 15. Препарат по любому из пп.10-14, где органическим полимером является карбоксиметилцеллюлоза или поливинилпирролидон. 16. Препарат по п.15, в котором присутствует от 0,05 до 0,20% по массе карбоксиметилцеллюлозы или поливинилпирролидона. 17. Препарат по любому из пп.7-16, который представлен в форме водного раствора. 18. Водный препарат по п.17, который имеет рН от 4,0 до 5,0. 19. Препарат по любому из пп.7-18, который пригоден для парентерального введения. 20. Препарат по любому из пп.7-18, который пригоден для интраназального введения. 21. Препарат по любому из пп.7-18, который пригоден для введения путем ингаляции. 22. Препарат по п.7, который представляет собой водный раствор, содержащий 80 мг/г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина, как он определен в п.1, имеющего среднее сульфобутилэфирное замещение,равное 6,5 на молекулу циклодекстрина, с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли; 20% по массе глицерина и 0,7% по массе аскорбиновой кислоты; причем рН препарата отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 4,5, с помощью водного раствора гидроксида натрия. 23. Препарат по п.7, который представляет собой водный раствор, содержащий 80 мг/ г гемисульфата элетриптана; 20% по массе сульфобутилэфир-бетациклодекстрина, как он определен в п.1, имеющего среднее сульфобутилэфирное замещение,равное 6,5 на молекулу циклодекстрина, с каждым сульфобутилэфирным звеном, представленным в виде его натриевой соли; 0,10% по массе поливинилпирролидона и 0,7% по массе аскорбиновой кислоты; причем рН композиции отрегулировано в пределах от 4,0 до 5,0, предпочтительно около 14 4,5, с помощью водного раствора гидроксида натрия. 24. Применение комплекса по любому из пп.1-6 в качестве лекарства. 25. Применение комплекса по любому из пп.1-6 в качестве лекарства для лечения заболевания, для которого показан агонист 5HT1B/1D рецептора. 26. Применение комплекса по любому из пп.1-6 в качестве лекарства для лечения мигрени или предупреждения рецидива мигрени. 27. Способ лечения млекопитающего для лечения заболевания, для которого показан агонист 5HT1B/1D рецептора, при котором указанного млекопитающего лечат эффективным количеством комплекса по любому из пп.1-6 или его фармацевтически приемлемого препарата по любому из пп.7-23. 28. Способ лечения млекопитающего для лечения мигрени или предупреждения рецидива мигрени, при котором указанного млекопитающего лечат эффективным количеством комплекса по любому из пп.1-6 или его фармацевтически приемлемого препарата по любому из пп.723. 29. Способ приготовления комплекса, как он определен в п.1, при котором элетриптан или его фармацевтически приемлемую соль комбинируют с производным циклодекстрина или его фармацевтически приемлемой солью. 30. Способ приготовления препарата по п.7, при котором либо (1) комплекс, как он определен в п.1, либо (2) элетриптан или его фармацевтически приемлемую соль и производное циклодекстрина или его фармацевтически приемлемую соль комбинируют с фармацевтически приемлемым эксципиентом, разбавителем или носителем.
МПК / Метки
МПК: A61K 47/48
Метки: фармацевтический, циклодекстрина, производного, элетриптана, комплекс
Код ссылки
<a href="https://eas.patents.su/8-3908-farmacevticheskijj-kompleks-eletriptana-i-proizvodnogo-ciklodekstrina.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтический комплекс элетриптана и производного циклодекстрина</a>
Предыдущий патент: Композиция зипразидона в виде суспензии
Следующий патент: Абразив на основе церия, исходный материал для него и способы их получения
Случайный патент: Биологически активная добавка












