Разложение соединений пенициллина
Формула / Реферат
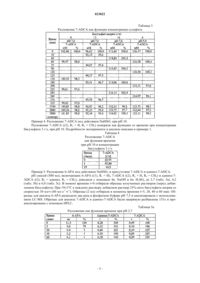
1. Способ разложения соединения, имеющего общую формулу (1), в смеси, включающей указанное соединение, имеющее общую формулу (1), и соединение, имеющее общую формулу (2):
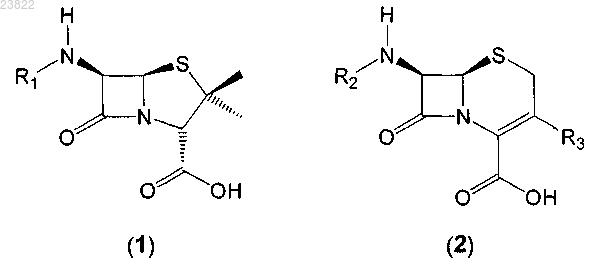
в которых R1 и R2 независимо выбирают из адипила и водорода;
R3 является метилом,
отличающийся тем, что указанное разложение осуществляют в присутствии сульфита, а также тем, что коэффициент скорости k(1) разложения указанного соединения общей формулы (1) по меньшей мере в 10 раз больше коэффициента скорости k(2) разложения указанного соединения общей формулы (2).
2. Способ по п.1, в котором R1 представляет собой то же, что и R2.
3. Способ по п.1, в котором R1 представляет собой водород, a R2 представляет собой адипил.
4. Способ по любому из пп.1-3, в котором указанный сульфит представляет собой бисульфит.
5. Способ по любому из пп.1-4, в котором указанное разложение осуществляют при pH от 3 до 9.
6. Применение сульфита для разложения соединения, имеющего формулу (1), в водной смеси, содержащей указанное соединение, имеющее общую формулу (1), и соединение, имеющее общую формулу (2):
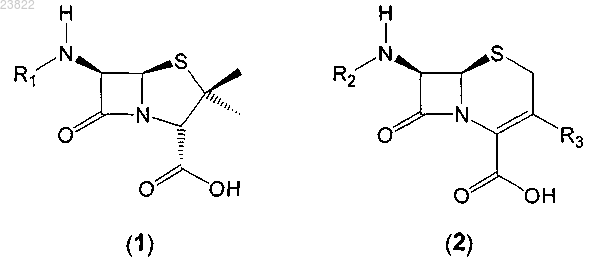
в которых R1 и R2 независимо выбраны из адипила и водорода;
R3 является метилом.
7. Применение по п.6, в котором указанная водная смесь представляет собой сток отходов.
Текст
Изобретение относится к разложению соединений -лактама, таких как пенициллины, в присутствии других соединений -лактама, таких как цефалоспорины. Кроме того, изобретение относится к применению сульфита для разложения пенициллинов, например, в промышленных стоках. Деккерс Рокус Маринус (NL) Фелицына С.Б. (RU)(71)(73) Заявитель и патентовладелец: ДСМ СИНОКЕМ ФАРМАСЬЮТИКАЛЗ НИДЕРЛАНДЗ Б.В. (NL) Область техники, к которой относится изобретение Настоящее изобретение относится к разложению -лактамных соединений, таких как пенициллины,в присутствии других -лактамных соединений, таких как цефалоспорины. Кроме того, настоящее изобретение относится к применению сульфита для разложения пенициллинов, например, в промышленных стоках. Уровень техники Уже в течение нескольких десятилетий -лактамные антибиотики с успехом применяют для лечения людей от самых разных инфекционных заболеваний. Тем не менее, при определенных обстоятельствах -лактамы могут быть вредны, и существуют строгие запреты в отношении присутствия-лактамов в определенных изделиях, таких как пищевые продукты, отходы, а также в определенных лекарственных препаратах и даже в самих антибиотиках. Например, -лактамные антибиотики цефалоспоринового типа предпочтительно не содержат -лактамные антибиотики пенициллинового типа, и наоборот. В "Pharmacopeia" указаны требования к чистоте цефалоспоринов относительно содержания пенициллинов. 7-Аминодезацетоксицефалоспорановая кислота (7-ADCA) представляет собой исходный материал для получения -лактамных антибиотиков цефалоспоринового типа, таких как цефалексин, цефадроксил и цефрадин. Традиционный путь к 7-ADCA начинается с пенициллина G, и, таким образом, есть естественный риск того, что в 7-ADCA сохранятся остатки соединений пенициллина, таких как пенициллин G и 6-аминопенициллановая кислота (6-АРА). Новые методы производства 7-ADCA с помощью ферментативных методик с применением штамма Penicillium, трансформированного геном экспандазы, как раскрыто в WO 93/05158, WO 95/04148, WO 95/04149, WO 98/48036, WO 98/48034 и/или в WO 98/48035, по своей природе на различных стадиях характеризуются присутствием примесных количеств соединений пенициллина, таких как 6-АРА. Существует, таким образом, потребность в способах селективного разложения -лактамных соединений, например для селективного разложения 6-АРА. Подробное описание изобретения В целом, -лактамы представляют собой нестабильные соединения, и существует несколько способов разложения -лактамов. Однако в существующих способах или используются жесткие реакционные условия, и/или в них отсутствует селективность, и/или они представляют собой дорогостоящие и/или трудоемкие способы. Например, 6-АРА можно селективно разлагать путем инкубации в определенных диапазонах температуры и pH или в присутствии СО 2 и других источников СО 2. Кроме того, для селективного разложения могут быть использованы -лактамазы. Об инактивации 2-пентенилпенициллина и пенициллина G с помощью бисульфита натрия сообщали Florey et al. ("Antibiotics", vol. II (1949), OxfordUniversity Press, London, 802) и Clarke et al. ("The Chemistry of Penicillin" (1949) Princeton University Press,Princeton, 207-242), хотя в этих исследованиях нет намеков на селективность, связанную с бисульфитом натрия. Наконец, известно несколько способов очистки, в которых 6-АРА или другие пенициллины отделяют от цефалоспориновых продуктов. В первом аспекте изобретения было неожиданно обнаружено, что селективное разложение соединений пенициллина можно осуществить путем осуществления процесса разложения в присутствии сульфита. Таким образом, настоящее изобретение раскрывает способ разложения соединения пенициллина,имеющего общую формулу (1), в смеси, включающей указанное соединение, имеющее общую формулу(1), и соединение цефалоспорина, имеющее общую формулу (2): В соединениях, имеющих общую формулу (1) и (2), R1 и R2 представляют собой водород или ацильные группы, такие как, например, адипил, 2-аминоадипил, 2-амино-4-тиазолилацетил, 2-амино-4 тиазолил(метоксиимино)ацетил, 2,5-дигидрофенилглицил, 2-фуранил(метоксиимино)ацетил, глутарил,гидроксифенилацетил,4-гидроксифенилглицил,феноксиацетил,фенилацетил,фенилглицил,4-пиридинилтиоацетил, 1H-тетразол-1-илацетил или 2-тиенилацетил. Вышеперечисленные группы широко представлены в большинстве -лактамов, имеющих терапевтическое применение. Для аналогичных целей группа R3 в соединении, имеющем общую формулу (2), может представлять собой водород или такие группировки, как ацетамидометил, ацетоксиметил, хлор, этенил, водород, гидроксиметил, метоксигруппу, метоксиметил, метил, метилпиридиний, (1-метил-1H-тетразол-5-илтио)метил, пропенил,1,2,5,6-тетрагидро-2-метил-5,6-диоксо-1,2,4-триазин-3-илтио)метил или (1,3,4-тиадиазол-2-илтио)метил. Примеры соединений, имеющих общую формулу (2), из которых соединения пенициллина могут быть удалены в соответствии с настоящим изобретением, представляют собой 7-аминоцефалоспорановую ки-1 023822 слоту (7-АСА), 7-ADCA, адипил-7-ADCA, цефаклор, цефадроксил, цефамандол, цефатризин, цефазедон,цефазолин, цефдинир, цефиксим, цефменоксим, цефодизим, цефоницид, цефоперазон, цефоранид, цефотаксим, цефотиам, цефпимизол, цефпирамид, цефпрозил, цефподоксим, цефроксадин, цефсулодин, цефтазидим, цефтерам, цефтезол, цефтибутен, цефтизоксим, цефтриаксон, цефуроксим, цефузонам, цефалексин, цефалоглицин, цефалоридин, цефалоспорин С, цефалотин, цефапирин и цефрадин. В одном из воплощений настоящего изобретения соединение пенициллина, имеющее общую формулу (1), предпочтительно выбирают из группы, состоящей из 6-АРА и любого 6-N-ацил производного,такого как адипил-6-АРА, пенициллин G, пенициллин V, амоксициллин, ампициллин или те, которые были раскрыты в описанном выше уровне техники. В предпочтительном воплощении изобретения соединение пенициллина, имеющее общую формулу (1), представляет собой 6-АРА или адипил-6-АРА. В другом предпочтительном воплощении соединение цефалоспорина, имеющее общую формулу (2), представляет собой 7-ADCA или любое 7-N-ацил производное 7-ADCA, такое как адипил-7-ADCA. Наиболее предпочтительно разложение 6-АРА и/или адипил-6-АРА в смеси, включающей 7-ADCA и/или адипил 7-ADCA. Способ по изобретению может осуществляться при любой подходящей температуре, такой как температура от 0 до 60 С, предпочтительно от 10 до 40 С. Специалист вполне способен подобрать подходящую температуру для разложения соединения пенициллина способом по настоящему изобретению. В контексте настоящего изобретения термин "сульфит" означает любое соединение, включающее серу в окисленном состоянии (которое также называют степенью окисления или валентностью) 4+. Предпочтительные примеры представляют собой SO2, (HSO3)- и (SO3)2-, которые соседствуют друг с другом в водных растворах в соотношениях, зависящих от величины рН. Например, при pH 1 водный раствор содержит приблизительно 90% SO2 и приблизительно 10% (HSO3)-, при pH 7 водный раствор содержит приблизительно 50% (HSO3)- и приблизительно 50% (SO3)2-, а при pH 8 водный раствор содержит приблизительно 10% (HSO3)- и приблизительно 90% (SO3)2-. Сульфит может быть добавлен в любой форме. Подходящий источник представляет собой NaHSO3, но и другие источники, такие как соли металлов и (HSO3)-, (SO3)2- или (S2O3)2- (метабисульфит), также могут быть использованы. Кроме того, в реакционную смесь можно вводить газообразный SO2. Специалист вполне способен подобрать подходящий источник сульфита, который может быть использован в способе по настоящему изобретению. Предпочтительно способ по изобретению осуществляют при pH от 3 до 9, более предпочтительно от 4 до 8, более предпочтительно от 5 до 7, наиболее предпочтительно от 5,5 до 6,5. Предпочтительно,чтобы величина pH была такой, чтобы по меньшей мере 10% сульфита присутствовало в виде (HSO3)-,что обычно имеет место при pH от 1 до 8; более предпочтительно, чтобы величина pH была такой, чтобы по меньшей мере 40% сульфита присутствовало в виде (HSO3)-, что обычно имеет место при pH от 1,6 до 7,2, наиболее предпочтительно, чтобы величина pH была такой, чтобы по меньшей мере 80% сульфита присутствовало в виде (HSO3)-, что обычно имеет место при pH от 2,5 до 6,3. В контексте настоящего изобретения термин "разложение соединения пенициллина" определяют как то, что в соединении пенициллина предпочтительно расщепляется 4-членное -лактамное кольцо,что приводит к разложению продукта, представляющего собой соединение пенициллина. Предпочтительно константа скорости k(1) (в ч-1(г/л)-1), характеризующая разложение соединения общей формулы(1), в 10 раз выше константы скорости k(2) (в ч-1(г/л)-1), характеризующей разложение соединения общей формулы (2). Более предпочтительно, чтобы k(1) была в 10-100 раз больше константы скорости k(2), и наиболее предпочтительно, чтобы k(1) была в 50-1000 раз больше константы скорости k(2). В другом аспекте настоящее изобретение раскрывает применение сульфита для разложения соединения пенициллина, более предпочтительно, чтобы соединение пенициллина выбирали из группы, состоящей из 6-АРА и любого 6-N-ацил производного, такого как адипил-6-АРА, пенициллин G, пенициллин V, амоксициллин, ампициллин или те соединения, которые были раскрыты в описанном выше уровне техники. В одном из воплощений изобретения раскрывается применение сульфита для разложения соединения пенициллина, в ходе которого соединение пенициллина селективно разлагается в присутствии соединения цефалоспорина. Предпочтительное воплощение настоящего изобретения относится к применению сульфита для разложения соединения пенициллина, присутствующего в виде примеси, в способе получения соединения цефалоспорина. В другом воплощении изобретения раскрывается применение сульфита для разложения пенициллина в стоках отходов, таких как мицелий организмапродуцента, применяемого для получения соединений -лактамных антибиотиков, такого как продуцирующие пенициллин микроорганизмы из рода Penicillium. Указанное применение имеет существенное практическое значение, поскольку следовые количества пенициллинов в стоках отходов опасны для здоровья населения с точки зрения нежелательного и/или неконтролируемого развития резистентности бактерий к пенициллинам. Примеры Материалы и методы. Концентрацию 6-АРА определяли с помощью HPLC, применяя "Dionex Ultimate 3000 RS", оборудованный колонкой "Lichrospher RP-18" (5 мкм, 2504,6 мм ("Merck", которая работала со скоростью тока 1,3 мл/мин. Прочие условия: Элюенты (изократические): 6,62 г K2HPO4 + 17,76 г KH2PO4 растворяли в очищенной воде. Добавляли 100 мл ацетонитрила (чистота для HPLC). Общий объем доводили до 2 л добавлением очищенной воды. Время хроматографирования: 12 мин. Объем впрыска: 10 мкл. Длина волны для детекции: 214 нм. Температура: 20-25 С. В этих условиях 6-АРА элюировался за 2,9 мин, a pHPG - за 1,5 мин. Сульфит определяли с помощью теста на сульфит "Reflectoquant" (номер по каталогу продуктов"Merck" 1.16970.0001). Пример 1. Разложение 6-АРА под действием NaHSO3. Разложение 6-АРА 1), R1 = Н) измеряли как функцию от времени, концентрации бисульфита(0-8 г/л) и при нескольких значениях pH (4, 6 и 9). pH растворов, содержащих 1 г/л 6-АРА в воде, доводили до желаемого значения с помощью 1 н. NaOH и/или 1 н. H2SO4. Затем добавляли указанные количества NaHSO3. Различные смеси инкубировали при 20 С и образцы отбирали в различные моменты времени для измерения остаточной концентрации 6-АРА, а также остаточной концентрации сульфита. Сульфит может присутствовать в растворе в виде H2SO3, HSO3- или SO32-, в зависимости от величины рН.H2SO3 имеет два значения pKa, одно при 1,8 и второе при 7,0. При pH 4 и 6 практически весь сульфит присутствовал в виде HSO3", тогда как при pH 9 практически весь сульфит присутствовал в виде SO32-. В табл. 1 а-1 с показано зависящее от времени разложение 6-АРА под действием сульфита при pH 4, 6 и 9 соответственно. Таблица 1 а Разложение 6-АРА как функция концентрации сульфита при pH 4 Таблица 1b Разложение 6-АР А как функция концентрации сульфита при pH 6 Таблица 1 с Разложение 6-АРА как функция концентрации сульфита при pH 9 Результаты показали, что скорость разложения зависит как от концентрации 6-АРА [6-АРА], так и от концентрации (би)сульфита [SO32-] и, следовательно, имеет, по меньшей мере, второй порядок. Реакция может быть смоделирована с помощью уравнения скорости реакции второго порядка: в котором k представляет собой коэффициент скорости или константу скорости реакции(в ч-1(г/л)-1). Измерение концентраций SO32- в ходе реакций показало, что эта концентрация остается достаточно постоянной в ходе разложения (не показано). Сульфит присутствовал в избытке. Следовательно, уравнение скорости реакции можно упростить до уравнения реакции псевдопервого порядка: в котором k'=k[SO32-] (в ч-1). При pH 4, 6 и 9 для каждой концентрации сульфита рассчитывают k' и впоследствии k (см. табл. 1 а 1 с). Самая высокая скорость разложения 6-АРА была обнаружена при pH 6. Из рассчитанных величин k можно заключить, что разложение при pH 9 приблизительно в 30 раз медленнее, чем при pH 6. При pH 4 скорость разложения в 2,5 раза ниже, однако по-прежнему значительная. Пример 2. Разложение адипил-7-ADCA под действием NaHSO3 при pH 7. Разложение адипил-7-ADCA 2), R2 = адипил, R3 = СН 3) измеряли как функцию от времени, концентрации бисульфита (0-12 г/л) при pH 7. Подробности эксперимента и анализа описаны в примере 1. Таблица 2 Разложение адипил-7-ADCA как функция концентрации сульфита при pH 7 Данные в табл.2 показывают, что адипил-7-ADCA значительно более устойчив к разложению под действием сульфита. Едва ли вообще происходит какое-нибудь разложение. Это проиллюстрировано сравнением константы скорости второго порядка для 6-АРА при pH 6 (0,097) с константой скорости второго порядка для адипил-7-ADCA при pH 7 (0,00020), которое показывает, что 6-АРА разлагается в 485 раз быстрее, чем адипил-7-ADCA. Пример 3. Разложение 7-ADCA под действием различных концентраций NaHSO3. Разложение 7-ADCA 2), R2 = Н, R3, = СН 3) измеряли как функцию от времени при концентрациях бисульфита 0, 4, 13 или 16 г/л. Четыре раствора 7-ADCA (50 мл) перемешивали при 20 С в течение 2 дней. Концентрацию 7-ADCA измеряли с помощью HPLC, точность 2%. Величину pH доводили до 7,6 с помощью 1 М NaOH или до pH 9,4, как указано в табл. 3. Таблица 3 Разложение 7-ADCA как функция концентрации сульфита Пример 4. Разложение 7-ADCA под действием NaHSO3 при pH 10. Разложение 7-ADCA 2), R2 = Н, R3 = СН 3) измеряли как функцию от времени при концентрации бисульфита 3 г/л, при pH 10. Подробности эксперимента и анализа описаны в примере 1. Таблица 4 Разложение 7-ADCA как функция времени при pH 10 и концентрации бисульфита 3 г/л(табл. 5b) и 6,0 (табл. 5 с). В момент времени t=0 отбирали образцы полученных растворов (перед добавлением бисульфита). При 193 С к каждому раствору добавляли раствор 25%-ного бисульфита натрия со скоростью 30 мл/ч (60 млл-1 ч-1). Образцы (2 мл) отбирали в моменты времени t=5, 20, 40 и 60 мин. Образцы для анализа 6-АРА разводили два раза в фосфатном буфере pH 7,5 и анализировали с использованием LC-MS. Образцы для анализа 7-ADCA и адипил-7-ADCA были напрямую разбавлены 151 х и проанализированы с помощью HPLC. Таблица 5 а Разложение как функция времени при pH 2,7 Таблица 5b Разложение как функция времени при pH 4,2 Таблица 5 с Разложение как функция времени при pH 6,0 Пример 6. Разложение адипил-6-АРА по сравнению с адипил-7-ADCA под действием NaHSO3 при 462 С. Адипил-7-ADCA 2), R2 = адипил, R3 = СН 3; 95% чистота, 7,06 мг, 1 экв.) и адипил-6-АРА 1),R1 = адипил; 44% чистота, 14,65 мг, 1 экв.) растворяли в 4 мл фосфатного буфера, pH 6-7. Для получения прозрачного раствора образец помещали на 2-3 мин в ультразвуковую баню. 550 мкл переносили в ампулу для ЯМР-спектроскопии и помещали в спектрофотометр (700 МГц, предварительно нагретый до 462 С). Образец выдерживали в спектрофотометре, и регистрировали спектры в моменты времени, указанные в табл. 6. В следующем эксперименте адипил-7-ADCA 2), R2 = адипил, R3 = СН 3; 95% чистота, 6,66 мг,1 экв.), адипил-6-АРА 1), R1 = адипил; 44% чистота, 14,57 мг, 1 экв.) и NaHSO3 (9,43 мг, 4,7 экв.) растворяли в 4 мл фосфатного буфера, pH 6-7. Для получения прозрачного раствора образец помещали на 23 мин в ультразвуковую баню. 550 мкл переносили в ампулу для ЯМР-спектроскопии и помещали в спектрофотометр (700 МГц, предварительно нагретый до 462 С). Образец выдерживали в спектрофотометре и регистрировали спектры в моменты времени, указанные в табл. 6. Разложение вынесенного в подзаголовок соединения определяли путем измерения интеграла дублета при 5,4 ppm (-лактамное кольцо адипил-6-АРА) и дублета при 5,05 ppm (-лактамное кольцо адипил 7-ADCA). Начальное увеличение сигналов как адипил-6-АРА, так и адипил-7-ADCA, вероятно, представляет собой следствие измерения, которое проводили до того, как образец достигал желаемой температуры, равной 462 С. Результаты, приведенные в табл. 6, показывают, что в присутствии сульфита предпочтительно разлагается адипил-6-АРА по сравнению с адипил-7-ADCA. Таблица 6 Разложение адипил-6-АРА в сравнении с адипил-7-ADCA под действием NaHSO3 при 462 С и pH 6 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ разложения соединения, имеющего общую формулу (1), в смеси, включающей указанное соединение, имеющее общую формулу (1), и соединение, имеющее общую формулу (2): в которых R1 и R2 независимо выбирают из адипила и водорода;R3 является метилом,отличающийся тем, что указанное разложение осуществляют в присутствии сульфита, а также тем, что коэффициент скорости k(1) разложения указанного соединения общей формулы (1) по меньшей мере в 10 раз больше коэффициента скорости k(2) разложения указанного соединения общей формулы (2). 2. Способ по п.1, в котором R1 представляет собой то же, что и R2. 3. Способ по п.1, в котором R1 представляет собой водород, a R2 представляет собой адипил. 4. Способ по любому из пп.1-3, в котором указанный сульфит представляет собой бисульфит. 5. Способ по любому из пп.1-4, в котором указанное разложение осуществляют при pH от 3 до 9. 6. Применение сульфита для разложения соединения, имеющего формулу (1), в водной смеси, содержащей указанное соединение, имеющее общую формулу (1), и соединение, имеющее общую формулу (2): в которых R1 и R2 независимо выбраны из адипила и водорода;R3 является метилом. 7. Применение по п.6, в котором указанная водная смесь представляет собой сток отходов.
МПК / Метки
МПК: C07D 501/12
Метки: разложение, соединений, пенициллина
Код ссылки
<a href="https://eas.patents.su/8-23822-razlozhenie-soedinenijj-penicillina.html" rel="bookmark" title="База патентов Евразийского Союза">Разложение соединений пенициллина</a>
Предыдущий патент: Хиназолинкарбоксамидазетидины, их применение в лечении гиперпролиферативных заболеваний и содержащие их композиции
Следующий патент: Способ изготовления продуктов с покрытием
Случайный патент: Оптическое устройство и способ его регулировки