Замещенное производное тиазолидиндиона, способ его получения и его фармацевтическое применение
Номер патента: 2833
Опубликовано: 31.10.2002
Авторы: Линч Ян Роберт, Сэсс Майкл Джон, Чаудари Бернадетт Мари
Формула / Реферат
1. Гидрат соли малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона, отличающийся тем, что он
(i) включает воду в интервале от 0,3 до 0,6 мольных эквивалента; и
(ii) имеет инфракрасный спектр, содержащий пики при 1757, 1331, 1290, 1211 и 767 см-1; и/или
(iii) имеет спектр Рамана, содержащий пики при 1758, 1610, 1394, 1316 и 1289 см-1; и/или
(iv) в твердом состоянии имеет спектр ядерно-магнитного резонанса, содержащий, в основном, химические сдвиги, которые приведены в табл. 1, и/или
(v) имеет картину дифракции рентгеновских лучей в порошке (РЛПД), в основном, соответствующую фиг. 4.
2. Гидрат по п.1, в котором содержание воды находится в интервале от 0,3 до 0,5 мольных эквивалента.
3. Гидрат по п.1 или 2, который имеет инфракрасный спектр, соответствующий, в основном, фиг. 1.
4. Гидрат по любому из пп.1-3, который имеет спектр Рамана, соответствующий, в основном, фиг. 2.
5. Гидрат по любому из пп.1-4, который имеет в твердом состоянии спектр ядерно-магнитного резонанса, соответствующий, в основном, фиг. 3.
6. Гидрат по любому из пп.1-5, который имеет картину дифракции рентгеновских лучей в порошке (РЛПД), в основном, соответствующую фиг. 4.
7. Гидрат по любому из пп.1-6 в выделенной форме.
8. Гидрат по любому из пп.1-7 в чистом виде.
9. Гидрат по любому из пп.1-8 в кристаллической форме.
10. Соединение в виде регидратируемой формы гидрата по любому из пп.1-9.
11. Способ получения гидрата по п.1, отличающийся тем, что соль малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]-бензил]тиазолидин-2,4-диона кристаллизуют из водного этанола.
12. Способ по п.11, в котором водный этанол содержит от 2 до 15% воды по объему.
13. Фармацевтическая композиция, включающая эффективное нетоксичное количество гидрата по п.1 и его фармацевтически приемлемый носитель.
14. Гидрат по п.1 для применения в качестве терапевтически активного вещества.
15. Гидрат по п.1 для применения при лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений.
16. Применение гидрата для производства медикамента для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений.
17. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений у млекопитающих, как человека, так и животных, который включает введение эффективного нетоксичного количества гидрата нуждающемуся в этом млекопитающему, человеку или животному.
Текст
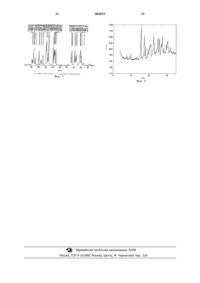
1 Данное изобретение относится к новому фармацевтическому препарату, способу получения фармацевтического препарата и к использованию фармацевтического препарата в медицине. В опубликованной международной патентной заявке WO 94/05659 описаны некоторые производные тиазолидиндиона, имеющие гипогликемическую и гиполипидемическую активность, включая соль малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси] бензил]тиазолидин-2,4-диона (называемую также ниже "Соединение (I)"). Соединение (I) описано только как безводная форма. Сейчас установлено, что соединение(I) существует в новой гидратированной форме,которая особенно удобна для получения и обращения с ней. Оно может быть получено эффективным, экономичным и воспроизводимым способом, особенно подходящим для крупномасштабного производства. Новый гидрат также имеет полезные фармацевтические свойства, и, в частности, показано, что он является полезным при лечении и/или профилактике сахарного диабета (diabetes mellitus), состояний, связанных с сахарным диабетом, и некоторых их осложнений. Соответственно настоящее изобретение предлагает гидрат соли малеиновой кислоты 5[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона ("Гидрат"), характеризуемый тем, что гидрат(ii) имеет инфракрасный спектр, содержащий пики при 1757, 1331, 1290, 1211 и 767 см-1; и/или(iii) имеет спектр Рамана, содержащий пики при 1758, 1610, 1394, 1316 и 1289 см-1; и/или(iv) в твердом состоянии имеет спектр ядерно-магнитного резонанса, содержащий, в основном, химические сдвиги, которые приведены в табл. 1; и/или(v) имеет картину дифракции рентгеновских лучей в порошке (РЛПД), в основном, соответствующую фиг. 4. Предпочтительно содержание воды в гидрате находится в интервале от 0,3 до 0,5 мольных эквивалента, например 0,4 мольных эквивалента. В одном предпочтительном аспекте гидрат имеет инфракрасный спектр, соответствующий,в основном, фиг. 1. В другом предпочтительном аспекте гидрат имеет спектр Рамана, соответствующий, в основном, фиг. 2. В одном предпочтительном аспекте гидрат в твердом состоянии имеет спектр ядерномагнитного резонанса, соответствующий, в основном, фиг. 3. Гидрат может существовать в определенных дегидратированных формах, которые обра 002833 2 тимо превращаются в гидрат при контакте с водой, или в жидкой или парообразной форме. Настоящее изобретение охватывает все такие обратимо регидратируемые формы гидрата. Настоящее изобретение охватывает гидрат,выделенный в чистой форме или в смеси с другими веществами, например с известной безводной формой соединения (I), вышеупомянутыми обратимо регидратируемыми формами или с любым другим веществом. Таким образом, в одном аспекте предлагается гидрат в выделенной форме. В другом аспекте предлагается гидрат в чистом виде. Еще в одном аспекте предлагается гидрат в кристаллической форме. Изобретение также предлагает способ получения гидрата, отличающийся тем, что соль малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона кристаллизуют из водного этанола, обычно из водного денатурированного этанола. Обычно водный этанол содержит от 2 до 15 об.% воды, например от 5 до 15 об.%, лучше от 7 до 12 об.%, предпочтительно от 10 до 12 об.%, например 10 об.%. Для получения гидрата могут быть также использованы другие водные растворители, например изопропанол, ацетонитрил, тетрагидрофуран, метилэтилкетон, этилацетат или уксусная кислота или их смеси. Точное количество воды, используемое в каждом из альтернативных растворителей, зависит от конкретно выбранного растворителя, но обычно находится в интервале от 2 до 15 об.% воды, например около 3 об.%. Для некоторых растворителей, таких как этилацетат, гидрат может быть получен при таких низких концентрациях воды, как 1 об.% (что укладывается в рекомендуемый интервал от 1 до 15 об.% воды в подходящем растворителе). Альтернативно гидрат может быть получен путем кристаллизации из воды, содержащей небольшое количество (например, от 2 до 5% по объему) органической кислоты, такой как уксусная кислота. Кристаллизацию и любую перекристаллизацию обычно проводят при температуре от низкой до комнатной, такой как в интервале от 0 до 30 С, например при 25 С; иначе кристаллизацию можно начать при повышенной температуре, такой как в интервале между 30 и 60 С,например при 50 С, и затем завершить, дав температуре растворителя снизиться до комнатной или низкой температуры, такой как в интервале между 0 и 30 С, например до 20 С. Кристаллизация может быть инициирована путем затравки кристаллами гидрата, но это не является обязательным. Соединение (I) получают по известным методикам, таким как описанные в WO 94/05659. Описание WO 94/05659 включено сюда в качестве ссылки. 3 Термин "профилактика состояний, связанных с сахарным диабетом", когда он используется здесь, включает лечение таких состояний,как устойчивость к инсулину, нарушение переносимости к глюкозе, гиперинсулиновая анемия и диабет беременности. Сахарный диабет предпочтительно означает сахарный диабет типа II. Состояния, связанные с диабетом, включают гипергликемию и устойчивость к инсулину, в особенности приобретенную устойчивость к инсулину и ожирение. Другие состояния, связанные с диабетом, включают гипертонию, сердечно-сосудистые заболевания, особенно атеросклероз, некоторые расстройства питания, в частности ограничение аппетита и приема пищи у субъектов, страдающих от расстройств, связанных с недоеданием, таких как нервная потеря аппетита (anorexia nervosa), и перееданием, таких как ожирение и чрезмерный аппетит (bulimia). Дополнительно состояния, связанные с диабетом, включают синдром поликистоза яичника и вызванную стероидами устойчивость к инсулину. Осложнения состояний, связанных с сахарным диабетом, охваченные здесь, включают заболевания почек, особенно заболевания почек,связанные с развитием диабета типа II, включающие экссудативный нефрит, нефрит почечных клубочков, склероз почечных клубочков,нефрозный синдром, гипертензивный нефросклероз и конечную стадию заболевания почек. Термин "водный", как он использован здесь по отношению к данному растворителю или смеси растворителей, относится к растворителю, который содержит достаточно воды для образования гидрата, т.е. к имеющему от 0,3 до 0,6 мольных эквивалента воды. Как указано выше, соединение по изобретению имеет полезные терапевтические свойства; соответственно настоящее изобретение предлагает гидрат для применения в качестве активного терапевтического вещества. Более конкретно, настоящее изобретение предлагает гидрат для применения при лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений. Гидрат может вводиться per se или предпочтительно в виде фармацевтической композиции, содержащей также фармацевтически приемлемый носитель. Композиции гидрата и его дозировка обычно таковы, как описано для соединения (I) в опубликованной международной патентной заявке WO 94/05659. Соответственно настоящее изобретение предлагает также фармацевтическую композицию, включающую гидрат и его фармацевтически приемлемый носитель. Гидрат обычно вводят в форме единичных доз. 4 Активное соединение можно вводить любым подходящим способом, но обычно перорально или парентерально. Для такого использования соединение обычно применяют в форме фармацевтической композиции в сочетании с фармацевтическим носителем, разбавителем и/или инертным наполнителем, хотя точная форма композиции будет, естественно, зависеть от способа введения. Композиции готовятся путем смешения и соответствующим образом адаптируются для перорального, парентерального или топического введения, и, как таковые, могут быть в форме таблеток, капсул, жидких препаратов для перорального введения, порошков, гранул, лепешек,пастилок, реконституируемых (способных восстанавливаться) порошков, растворов или суспензий для инъекций и инфузии, свечей и устройств для трансдермального введения. Предпочтительными являются композиции для перорального введения, в особенности формованные композиции для перорального введения, поскольку они более удобны для общего использования. Таблетки и капсулы для перорального введения обычно предоставляются в единичных дозах и содержат обычные вспомогательные вещества, такие как связующие агенты, наполнители, разбавители, агенты для таблетирования, смазки, разрыхлители, красители, вкусовые и увлажняющие агенты. На таблетки могут быть нанесены покрытия хорошо известными в практике способами. Подходящие для использования наполнители включают целлюлозу, маннитол, лактозу и другие подобные агенты. Подходящие разрыхлители включают крахмал, поливинилпирролидон и производные крахмала, такие как натрийгликоллат крахмала. Подходящие смазывающие вещества включают, например, стеарат магния. Подходящие фармацевтически приемлемые увлажняющие агенты включают лаурилсульфат натрия. Твердые композиции для перорального введения могут быть приготовлены обычными методами смешения, наполнения, таблетирования или подобными методами. Для того чтобы распределить активный агент по композициям, в которых применены большие количества наполнителей, можно использовать повторяющиеся операции смешения. Такие операции, конечно, являются обычными в практике. Жидкие композиции для перорального введения могут быть, например, в форме водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для реконституирования с водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты,например сорбитол, сироп, метилцеллюлозу, 5 желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры, эмульгирующие агенты, например лецитин, моноолеат сорбитана или аравийскую камедь, неводные носители(которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры,такие как сложные эфиры глицерина, пропиленгликоля или этилового спирта, консерванты,например метил- или пропил-п-гидроксибензоат или сорбиновую кислоту, и, если требуется,обычные вкусовые или окрашивающие агенты. Для парентерального введения готовят формы жидких единичных доз, содержащие соединение по настоящему изобретению и стерильный носитель. В зависимости от носителя и концентрации соединение может быть суспендированным или растворенным. Парентеральные растворы обычно готовят путем растворения активного соединения в носителе и фильтрационной стерилизации перед заполнением подходящего сосуда или ампулы и их запаиванием. Преимущественно в носителе растворяют также вспомогательные вещества, такие как местная анестезия, консерванты и буферные агенты. Для улучшения стабильности композиции могут быть заморожены после помещения в сосуд и удаления воды под вакуумом. Парентеральные суспензии готовят обычно таким же образом, за исключением того, что активное соединение суспендируют в носителе вместо растворения и стерилизуют путем выдержки в окиси этилена перед суспендированием в стерильном носителе. В композицию преимущественно включают поверхностно-активное вещество или смачивающий агент для того,чтобы обеспечить равномерное распределение активного соединения. Кроме того, такие композиции могут содержать дополнительные активные агенты, такие как антигипертензивные агенты и диуретики. Как практикуется обычно, композиции должны сопровождаться письменной инструкцией по использованию в медицинских целях. Термин "фармацевтически приемлемый",как он используется здесь, включает соединения, композиции и ингредиенты как для медицинского, так и ветеринарного применения, например, термин "фармацевтически приемлемая соль" охватывает ветеринарно приемлемую соль. Настоящее изобретение, кроме того, предлагает способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений у млекопитающих, как человека, так и животных,который включает введение эффективного нетоксичного количества гидрата нуждающемуся 6 в этом млекопитающему, человеку или животному. Удобно назначать активный ингредиент в виде фармацевтической композиции, как это определено здесь ранее, и это составляет особый аспект настоящего изобретения. При лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений гидрат можно принимать в таких дозах, которые описаны выше. Подобные режимы дозировки являются пригодными для лечения и/или профилактики животных. В дополнительном аспекте настоящее изобретение предлагает применение гидрата для производства медикамента для лечения и/или профилактики сахарного диабета, состояний,связанных с сахарным диабетом, и некоторых их осложнений. При вышеупомянутом лечении соединениями по изобретению не обнаружены вредные токсикологические эффекты. Нижеследующие примеры поясняют изобретение, но никоим образом не ограничивают его. Пример 1. Получение гидрата соли малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил) амино)этокси]бензил]тиазолидин-2,4-диона. Свободное основание 5-[4-[2-(N-метил-N(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (6,0 г) и малеиновую кислоту (2,1 г) нагревают до 60 С в денатурированном этаноле(60 мл), содержащем добавленную воду (6,1 мл,т.е. общее содержание воды приблизительно 10% об./об.), и перемешивают при этой температуре в течение 30 мин, во время чего получают раствор. Раствор фильтруют, снова нагревают до 55 С и затем охлаждают до 20-25 С и перемешивают в течение 18 ч. Продукт отфильтровывают и сушат при 50 С под вакуумом, получая указанное в заголовке соединение (4,62 г,58%). Характеристические показатели. Для гидрата были получены следующие характеристические показатели. А. Содержание воды. Содержание воды было определено как 1,55 мас.% (0,41 мольных эквивалента), при использовании аппарата Карла Фишера. В. Инфракрасный спектр. ИК-спектр поглощения дисперсии гидрата в минеральном масле получали, используя спектрометр Nicolet 710 FT-IR при разрешении 2 см-1. Результаты выводились в цифровом виде с интервалом 1 см-1. Полученный спектр показан на фиг. 1. Положение пиков было следующим: 3574, 3458, 3377, 3129, 2776, 1757, 1743, 1708,1691, 1640, 1620, 1585, 1542, 1512, 1414, 1350,1331, 1306, 1290, 1249, 1238, 1211, 1183, 1163,1143, 1107, 1078, 1063, 1031, 1002, 974, 954, 927, 7 902, 865, 836, 830, 817, 809, 767, 735, 717, 663,616, 585, 558, 520 и 508 см-1. С. Спектр Рамана. Спектр Рамана гидрата записан через стеклянные сосуды с использованием спектрометраPerkin-Elmer 2000R при разрешении 4 см-1 и показан на фиг. 2 (1800-2000 см-1). Возбуждение получали, используя лазер Nd:YAG (1064 нм) с мощностью выхода 500 мВт). Результаты выводились в цифровом виде с интервалом 1 см-1. Положение пиков было следующим: 1758, 1743,1703, 1610, 1586, 1544, 1468, 1435, 1394, 1330,1316, 1289, 1265, 1238, 1206, 1185, 1148, 1095,1032, 1003, 976, 923, 903, 843, 825, 780, 741, 722,664, 637, 606, 526, 471, 331 и 293 см-1.D. ЯМР-спектр. 13 С CP-MAS ЯМР-спектр 90,55 мГц гидрата показан ниже на фиг. 3. Химические сдвиги табулированы в табл. 1. Данные регистрировались при комнатной температуре и вращающей частоте 10 кГц без предварительного размола образца на спектрометре Bruker AMX360WB с перекрестной поляризацией 1,6 мс и скоростью повтора 20 с. Химические сдвиги относили к резонансу твердого адамантана (38,4 ppm относительно к тетраметилсилану) в поле высокого напряжения и оценивали с точностью 0,5 ppm. Пики не определялись. Таблица 1 Химические сдвиги гидрата (13 С) Химические сдвиги (ррm) 32,4 38,8 42,1 42,9 43,8 53,0 54,7 57,2 Е. Дифракция рентгеновских лучей порошка (ДРЛП). Картина ДРЛП гидрата показана ниже на фиг. 4, и итоговые данные по углам ДРЛП и рассчитанным пространственным характеристикам решетки гидрата даны в табл. 2. Для получения спектра использовали порошковый рентгеновский дифрактометр PW1710(Сu источник рентгеновских лучей) при следующих условиях. Анодная трубка Напряжение генератора Ток генератора Начальный угол Конечный угол Величина шага Время на шаг 8 Таблица 2 Углы дифракции рентгеновских лучей порошка и рассчитанные характеристики постоянных решетки гидрата Постоянная решетки,Угол дифракции,ангстремы 2 7,5 11,74 9,8 9,04 15,2 5,81 17,2 5,15 17,9 4,95 19,3 4,60 20,4 4,35 20,7 4,29 22,3 3,98 24,8 3,59 25,6 3,47 26,6 3,35 27,1 3,29 28,1 3,17 29,3 3,05 30,2 2,96 31,6 2,83 Пример 2. Безводную малеатную соль 5-[4-[2-N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона (3,0 г) перемешивают и нагревают при 55-60 С в ацетонитриле (30 мл), содержащем воду (1,0 мл), до достижения полного растворения. Полученный раствор перемешивают и охлаждают до 20-25 С, продукт отфильтровывают, промывают ацетонитрилом (5,0 мл) и сушат при 50 С под вакуумом, получая указанное в заголовке соединение (1,8 г, 60%). Содержание воды в продукте составляет 1,77%. Пример 3. Процедуру примера 2 повторяют, используя в качестве растворителя тетрагидрофуран(60%), содержание воды 1,60%. Пример 4. Процедуру примера 2 повторяют, используя в качестве растворителя метилэтилкетон (30 мл),содержащий воду (1,0 мл). Выход 2,05 г (68%),содержание воды 1,58%. Пример 5. Процедуру примера 2 повторяют, используя 2,0 г малеатной соли при нагреве до 65 С и в качестве растворителя этилацетат (150 мл), содержащий воду (1,5 мл). Выход 1,34 г (67%),содержание воды 1,61%. Пример 6. Процедуру примера 2 повторяют при нагревании до 65-70 С в изопропаноле (33 мл),содержащем воду (1 мл) в качестве растворителя. Выход 2,4 г (80%), содержание воды 1,58%. Пример 7. Процедуру примера 2 повторяют, используя в качестве растворителя смесь воды (20 мл) 9 и уксусной кислоты (1,0 г). Выход 0,76 г (38%),содержание воды 1,78%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрат соли малеиновой кислоты 5-[4[2-(N-метил-N-(2-пиридил)амино)этокси]бензил] тиазолидин-2,4-диона, отличающийся тем, что он(ii) имеет инфракрасный спектр, содержащий пики при 1757, 1331, 1290, 1211 и 767 см-1; и/или(iii) имеет спектр Рамана, содержащий пики при 1758, 1610, 1394, 1316 и 1289 см-1; и/или(iv) в твердом состоянии имеет спектр ядерно-магнитного резонанса, содержащий, в основном, химические сдвиги, которые приведены в табл. 1; и/или(v) имеет картину дифракции рентгеновских лучей в порошке (РЛПД), в основном, соответствующую фиг. 4. 2. Гидрат по п.1, в котором содержание воды находится в интервале от 0,3 до 0,5 мольных эквивалента. 3. Гидрат по п.1 или 2, который имеет инфракрасный спектр, соответствующий, в основном, фиг. 1. 4. Гидрат по любому из пп.1-3, который имеет спектр Рамана, соответствующий, в основном, фиг. 2. 5. Гидрат по любому из пп.1-4, который имеет в твердом состоянии спектр ядерномагнитного резонанса, соответствующий, в основном, фиг. 3. 6. Гидрат по любому из пп.1-5, который имеет картину дифракции рентгеновских лучей в порошке (РЛПД), в основном, соответствующую фиг. 4. 10 7. Гидрат по любому из пп.1-6 в выделенной форме. 8. Гидрат по любому из пп.1-7 в чистом виде. 9. Гидрат по любому из пп.1-8 в кристаллической форме. 10. Соединение в виде регидратируемой формы гидрата по любому из пп.1-9. 11. Способ получения гидрата по п.1, отличающийся тем, что соль малеиновой кислоты 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона кристаллизуют из водного этанола. 12. Способ по п.11, в котором водный этанол содержит от 2 до 15 об.% воды. 13. Фармацевтическая композиция, включающая эффективное нетоксичное количество гидрата по п.1 и его фармацевтически приемлемый носитель. 14. Гидрат по п.1 для применения в качестве терапевтически активного вещества. 15. Гидрат по п.1 для применения при лечении и/или профилактике сахарного диабета,состояний, связанных с сахарным диабетом, и некоторых их осложнений. 16. Применение гидрата для производства медикамента для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений. 17. Способ лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и некоторых их осложнений у млекопитающих, как человека, так и животных, который включает введение эффективного нетоксичного количества гидрата нуждающемуся в этом млекопитающему, человеку или животному.
МПК / Метки
МПК: C07D 417/12, A61K 31/427
Метки: фармацевтическое, тиазолидиндиона, замещенное, применение, способ, получения, производное
Код ссылки
<a href="https://eas.patents.su/7-2833-zameshhennoe-proizvodnoe-tiazolidindiona-sposob-ego-polucheniya-i-ego-farmacevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенное производное тиазолидиндиона, способ его получения и его фармацевтическое применение</a>
Предыдущий патент: Способ и раствор для бурения или эксплуатации скважины, способ предотвращения поглощения раствора
Следующий патент: Способ удаления волос и устройство для его осуществления
Случайный патент: Пестицидные композиции