Циклопропильное соединение, фармацевтическая композиция и способ лечения диабета
Номер патента: 19055
Опубликовано: 30.12.2013
Авторы: Ахехас-Чичарро Франсиско Хавьер, Буэно Мелендо Ана Белен
Формула / Реферат
1. Соединение формулы
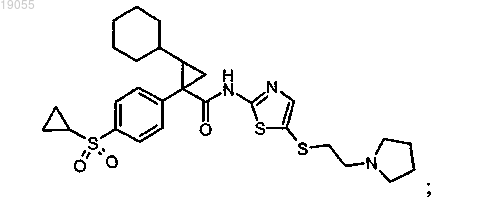
или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы
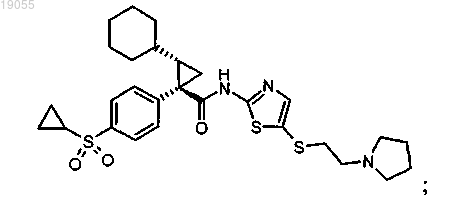
или его фармацевтически приемлемая соль.
3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый разбавитель или носитель.
4. Применение соединения по п.1 или 2 или фармацевтически приемлемой соли указанного соединения для лечения диабета.
5. Применение по п.4 для лечения диабета II типа.
Текст
Буэно Мелендо Ана Белен, АхехасЧичарро Франсиско Хавьер (ES) Медведев В.Н. (RU) и фармацевтические композиции для лечения диабета.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Диабет является прогрессирующим заболеванием, которое негативно сказывается как на продолжительности, так и на качестве жизни. Имеющиеся на сегодняшний день терапевтические средства для перорального приема как по отдельности, так и в комбинации, не проявляют надлежащей или продолжительной эффективности в отношении снижения уровня глюкозы у пациентов, страдающих диабетом. Таким образом, по-прежнему существует потребность в усовершенствованных способах лечения пациентов, страдающих диабетом. Активаторы глюкокиназы (GKA) представляют собой класс агентов, понижающих уровень глюкозы, действие которых, главным образом, заключается в снижении концентрации глюкозы в крови за счет модулирующего действия в -клетках поджелудочной железы и печени. Был описан ряд синтетическихGKA для лечения диабета, например GKA, предложенные в WO 04/063179. По-прежнему существует потребность в альтернативных GKA в качестве терапевтического средства для лечения пациентов, страдающих диабетом. Было показано, что глюкокиназа (GK) имеет важное значение для опосредования чувствительности к глюкозе в нервных клетках. Активация GK в гипоталамусе ослабляет контррегуляторный ответ на вызываемую инсулином гипогликемию. Таким образом, активация GK в мозге с помощью GKA может приводить к повышению риска развития гипогликемии за счет снижения секреции адреналина, норадреналина и снижения уровня глюкагона при низких уровнях глюкозы. Соединения GKA с ограниченной способностью проникать через гематоэнцефалический барьер могли бы обладать меньшей потенциальной способностью вызывать тяжелую гипогликемию. Было обнаружено, что соединения согласно настоящему изобретению активируют глюкокиназу какin vitro, так и in vivo. Соединения согласно настоящему изобретению, как было показано, проявляют повышенную эффективность по сравнению с существующими GKA. Было обнаружено, что соединения согласно настоящему изобретению проявляют ограниченную способность проникать через гематоэнцефалический барьер. Настоящее изобретение относится к соединениям, активирующим глюкокиназу, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, способам лечения расстройств, связанных с нарушением функции глюкокиназы, и их применению для лечения диабета, в частности диабета II типа. Согласно настоящему изобретению предложено соединение формулы или его фармацевтически приемлемая соль. Соединение согласно настоящему изобретению имеет два стереоцентраи, таким образом, четыре возможных стереоизомера. Предполагается, что каждый стереоизомер и рацемические или диастереомерные смеси, чистые или частично чистые, находятся в рамках настоящего изобретения. Предпочтительный стереоизомер соединения согласно настоящему изобретению имеет структурную формулу Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый разбавитель или носитель. Согласно настоящему изобретению предложены соединение формулы I или фармацевтически приемлемая соль указанного соединения для применения в терапии. Согласно настоящему изобретению также предложено соединение формулы I или фармацевтически приемлемая соль указанного соединения для применения при лечении диабета, в частности диабета II типа. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы I или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства для лечения диабета, в частности диабетаII типа. Согласно настоящему изобретению предложен способ лечения диабета, включающий введение эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения нуждающемуся в этом человеку или животному. Согласно настоящему изобретению также предложен способ лечения диабета II типа, включающий введение эффективного количества соединения формулы I или фармацевтически приемлемой соли указанного соединения нуждающемуся в этом человеку или животному. Согласно настоящему изобретению предложена фармацевтическая композиция для применения в терапии, содержащая соединение согласно настоящему изобретению или фармацевтически приемлемую соль указанного соединения. Согласно настоящему изобретению предложена фармацевтическая композиция для применения при диабете, в частности диабете II типа, содержащая соединение согласно настоящему изобретению или фармацевтически приемлемую соль указанного соединения. В настоящем описании термин "фармацевтически приемлемая соль" относится к солям соединения согласно настоящему изобретению, которые, по существу, не токсичны для живых организмов. Указанные соли и общепринятая методология их получения хорошо известны в данной области техники; см.,например, P. Stahl, et al., Handbook of Pharmaceutical Salts: Properties Selection and Use (VCHA/WileyVCH, 2002) и J. Pharm. Sci., 66, 2-19 (1977). Предпочтительная фармацевтически приемлемая соль представляет собой гидрохлорид. Соединения согласно настоящему изобретению предпочтительно приготовлены в виде фармацевтических композиций, вводимых различными способами. Наиболее предпочтительно указанные композиции представляют собой композиции для перорального введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области техники; см., например, Remington: TheScience and Practice of Pharmacy (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Согласно другому аспекту изобретения настоящие соединения вводят в комбинации с одним или более активными веществами. Такие активные вещества включают, например, метформин. Введение в комбинации включает одновременное, последовательное или раздельное введение. Названия соединений для следующих примеров получены при помощи программы AutoNom 2000. Общие методики. Все чувствительные к влаге или воздуху реакции проводили в обезвоженных растворителях в инертной атмосфере. Масс-спектры (МС) были получены на спектрометре Agilent серии 1100 MSD при ионизации электрораспылением. Значения оптического вращения в хлороформе получали на цифровом поляриметре JASCO DIP-370 при температуре 20C с использованием D-линии натрия. Пример 1. [5-(2-Пирролидин-1-илэтилсульфанил)тиазол-2-ил]амид (1R,2S)-2-циклогексил-1-(4 циклопропансульфонилфенил)циклопропанкарбоновой кислоты Смесь этилового эфира (4-циклопропансульфонилфенил)оксоуксусной кислоты (250 г, 806 ммоль) и п-толуолсульфонилгидразида (187 г, 984 ммоль) в 1,5 л этанола перемешивали при комнатной температуре до получения раствора светло-желтого цвета. Затем добавляли концентрированную соляную кислоту (20 мл, 233 ммоль) и полученную в результате смесь нагревали с обратным холодильником в течение 3,5 ч. Освобождали от летучих компонентов с получением чистого масла светло-желтого цвета, которое растворяли в 1,5 л этилацетата. Полученный раствор затем промывали 1 л насыщенного водного раствора бикарбоната натрия, а затем 1 л насыщенного водного раствора хлорида натрия. Водные фазы заново экстрагировали этилацетатом (2500 мл), а органические слои объединяли, сушили над сульфатом магния и фильтровали. Полученный неочищенный раствор гидразона (2,1 л, предположительно содержащий 363 г промежуточного соединения гидразона) интенсивно перемешивали, при этом медленно добавляли триэтиламин (100 мл, 890 ммоль). Полученный в результате раствор оставляли стоять в течение ночи, за это время некоторое количество твердого вещества выпадало в осадок. Смесь разбавляли этилацетатом до объема 3 л с получением раствора, который промывали 1 л воды, а затем двумя порциями воды по 500 мл, смешанными с насыщенным водным раствором хлорида натрия, что необходимо для разрушения каких-либо эмульсий. Полученную в результате органическую фазу затем сушили над сульфатом магния, фильтровали и концентрировали с получением влажного твердого вещества, которое растирали с метил-трет-бутиловым эфиром. Полученную в результате суспензию фильтровали с получением твердого вещества светло-желтого цвета, которое сушили в вакууме для получения 155 г указанного в заголовке соединения. Фильтрат концентрировали до получения масла, которое растирали, как указано выше, до тех пор, пока не получали свободнотекучее твердое вещество. Указанное твердое вещество отделяли с помощью фильтрования и сушили с получением дополнительных 10 г указанного в заголовке соединения. ЖХ-МС (m/e): 295 (М+Н). К раствору винилциклогексана (300 мл, 2,72 моль) в 150 мл безводного дихлорметана при температуре 25-30C в инертной атмосфере по каплям добавляли раствор аддукта бис-(этилацетата) тетракис[Nфталоил-(R)-трет-лейцинат]диродия (120 мг, 84 мкмоль) в винилциклогексане (40 мл), тогда как этиловый эфир (4-циклопропансульфонилфенил)диазоуксусной кислоты (169,40 г, 575,5 ммоль) добавляли порциями. Скорости добавления регулировали для поддержания внутренней температуры 40C. Добавление завершали примерно через 1,5 ч и реакционную смесь перемешивали в течение дополнительных 2 ч при 30C. Затем освобождали от летучих компонентов в вакууме для получения неочищенного этилового эфира (1R,2S)-2-циклогексил-1-(4-циклопропансульфонилфенил)циклопропанкарбоновой кислоты в виде вязкого коричневого масла (218 г, 579 ммоль), которое растворяли в 1,1 л метанола для получения раствора желто-коричневого цвета, к которому медленно добавляли 5 н. раствор водного гидроксида натрия (500 мл, 2,5 ммоль). Полученную в результате суспензию затем перемешивали при температуре 50C 1 ч, в течение которого формировался раствор. Метанол удаляли в вакууме и добавляли 1 л этилацетата. Полученную в результате смесь подкисляли путем добавления примерно 550 мл 5% водной соляной кислоты и разделяли на два слоя. Водный слой затем экстрагировали двумя порциями по 500 мл этилацетата. Органические фазы объединяли, промывали 500 мл насыщенного водного раствора хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали с получением влажного твердого вещества бледно-желтого цвета. Полученный материал затем растворяли в 1 л метанола. Воду (1 л) добавляли к перемешиваемому раствору в течение 1,5 ч. Полученную в результате суспензию перемешивали при комнатной температуре в течение 30 мин и затем фильтровали. Фильтровальную подушку промывали смесью метанол/вода (1:1) и сушили с получением указанного в заголовке соединения в виде кристаллов бледно-желтого цвета (166 г). Точная масса по результатам МС: рассчитано 349,14735; обнаружено 349,14679 (времяпролетный масс-спектрометр для ЖХ Agilent 1100 с ионизацией электрораспылением); []D20=-31. Энантиомерный избыток кислоты был определен посредством сравнения интегралов для двух пиков, соответствующих энантиомерам, разделенным с помощью хиральной хроматографии на колонке с фазой AD-H (150 мм) при элюировании при 35C 10% этанолом в гексанах с содержанием 0,05% трифторуксусной кислоты, и составлял 97,7%. С) 5-(2-Пирролидин-1-илэтилсульфанил)тиазол-2-иламин Тииран (550 мл, 9,2 моль) добавляли к смеси пирролидина (543 мл, 6,57 моль) в 2,5 л безводного диоксана в инертной атмосфере. Температура медленно повышалась, и когда внутренняя температура достигала 54C, реакционную смесь охлаждали на ледяной бане. Как только температура падала до 45C,охлаждающую баню убирали и реакционную смесь нагревали до 60C. Через 3 ч смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток затем перегоняли при давлении 6 мм рт. ст. и фракцию, испаряющуюся при 50C, отбирали для получения 2-пирролидин-1-илэтантиола в виде бесцветного масла (643 г). МС (m/e): 132 (М+Н). К смеси 5-бромтиазол-2-иламингидробромида (1,53 кг, 5,87 моль) в 7,5 л изопропанола медленно добавляли бикарбонат натрия (1,232 кг, 14,7 моль) порциями. Затем добавляли 2-пирролидин-1-илэтантиол (1,060 кг, 8,07 моль) в течение 15 мин и полученную в результате смесь перемешивали при 60C в течение 96 ч. Температуру повышали до 70C в течение 1 ч, а затем смесь охлаждали до комнатной температуры. Большую часть изопропанола удаляли в вакууме и полученный остаток помещали в 4 л раствора изопропанол/хлороформ (1:9). Добавляли насыщенный водный бикарбонат натрия (4 л) и полученную в результате смесь перемешивали в течение 30 мин Слои разделяли и водную фазу экстрагировали тремя порциями по 4 л раствора изопропанол/хлороформ (1:9). Органические слои объединяли,сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный в результате остаток растирали с 3 л диэтилового эфира и отфильтровывали с получением первой порции указанного в заголовке соединения в виде твердого вещества бледно-желтого цвета (410 г). Фильтрат концентрировали с получением твердого вещества оранжевого цвета, которое растирали с 2 л диэтилового эфира и выделяли в виде твердого вещества бежевого цвета путем фильтрации. Полученное твердое вещество затем растворяли в 2 л метанола и раствор нагревали при 45C в течение 30 мин. При охлаждении до комнатной температуры образовывалось твердое вещество. Данное вещество выделяли путем фильтрования, растирали с диэтиловым эфиром, как указано выше, и сушили под вакуумом с получением дополнительных 310 г указанного в заголовке соединения. МС (m/e): 230 [М+Н].(1R,2S)-2-циклогексил-1-(4-циклопропансульфонилфенил)циклопропанкарбоновой кислоты (295,00 г,0,847 моль) в 10 л безводного дихлорметана в инертной атмосфере. Затем одной порцией добавляли диметилформамид (654,61 мкл, 8,5 ммоль) и полученный в результате раствор перемешивали в течение ночи. Затем освобождали от летучих компонентов в вакууме при 40C с получением масла, которое растворяли в 3 л безводного дихлорметана. Инертная атмосфера восстанавливалась, и раствор охлаждали до 5C. Затем добавляли по каплям триэтиламин (177 мл, 1,27 моль) в течение 20 мин с получением темного раствора. Добавляли сульфат натрия (120,25 г, 0,847 моль) с последующим добавлением 5-(2 пирролидин-1-илэтилсульфанил)тиазол-2-иламина (213,60 г, 0,931 моль). Внутренняя температура повышалась до 20C. Реакционную смесь перемешивали в течение 10 мин на холоде, а затем позволяли ей нагреться до комнатной температуры. После перемешивания в течение ночи реакционную смесь выливали в 3 л воды. Полученную в результате смесь перемешивали в течение нескольких минут, а затем разделяли два слоя. Водный слой экстрагировали 1 л дихлорметана и растворы дихлорметана объединяли, сушили над MgSO4, фильтровали и концентрировали под вакуумом при температуре 40C. Полученное в результате масло (556 г) переносили на пластинки с силикагелем в виде раствора дихлорметана. Элюирование пластинок смесью 2 М аммиак в метаноле/метил-трет-бутиловый эфир/гептан (1:12:7) с последующим элюированием смесью 2 М аммиак (в метаноле)/этилацетат (1:19) приводило к получению коричневой пены (351 г). Кристаллизация 320 г указанного материала из метилтрет-бутилового эфира и гептана после сушки в течение 2 дней при 45C приводила к получению указанного в заголовке соединения (279,4 г) в виде твердого вещества грязно-белого цвета. ЖХ-МС (m/e): 560 (М+Н); []D20=-44. Исследование глюкокиназы. Изоформу человеческой GK островков поджелудочной железы экспрессировали в E. coli в виде(His)6-меченного гибридного белка и очищали с помощью металлохелатной аффинной хроматографии,см., например, Tiedge et al., Biochem. Biophys. Acta, 1337, 175-190, 1997. Фермент после очистки хранили в аликвотированном виде в концентрации 0,8 мг/мл в растворе, содержащем 25 мМ фосфат натрия, 150 мМ хлорид натрия, 100 мМ имидазол, 1 мМ дитиотреитол и 50% глицерин при -80C. Анализ проводили в 96-луночных планшетах с плоским дном в конечном инкубационном объеме 100 мкл. Инкубационная смесь содержала 25 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (HEPES) (рН 7,4), 50 мМ хлорид калия, 2,5 мМ хлорид магния, 2 мМ дитиотреитол, 4 ед/мл глюкозо-6-фосфатдегидрогеназы из Leuconostoc mesenteroides, 5 мМ АТФ, 1 мМ НАД и определенную концентрацию глюкозы. Тестируемые соединения растворяли в диметилсульфоксиде и затем добавляли в реакционную смесь, получая конечную концентрацию диметилсульфоксида 10%. Реакцию инициировали путем добавления 20 мклGK и проводили в течение 20 мин при 37C. Количество полученного НАДН оценивали по увеличению абсорбции на длине волны 340 нм с использованием прибора для считывания микропланшетов. Значения абсорбции использовали для расчета EC50. Соединение согласно примеру 1 активировало GK с EC50=4242 нМ (n=5) при концентрации глюкозы 10 мМ. Указанное соединение также повышало активность фермента дозозависимым образом при более низких концентрациях глюкозы. Исследование гликолиза. Клетки INS-1E инсулиномы крыс выдерживали при 37C, 5% CO2, 95% влажности в среде 1640 с добавлением 11 мМ глюкозы, 5% эмбриональной бычьей сыворотки, 50 мкМ 2-меркаптоэтанола, 1 мМ пирувата, 10 мМ HEPES и антибиотиков. До проведения исследования клетки обрабатывали трипсином,осаждали центрифугированием и высевали в 96-луночные аналитические планшеты для тканевых культур при плотности 30000 клеток на лунку. Клеткам давали прикрепиться и инкубировали их в течение 48 ч при 37C, 5% CO2. В день проведения анализа клетки промывали и инкубировали в 200 мкл сбалансированного солевого раствора Эрла (EBSS) с добавлением 0,1% бычьего сывороточного альбумина (БСА). Через 30 мин инкубации буфер удаляли и к клеткам добавляли 100 мкл буфера EBSS, содержащего 0,1% БСА, 8 мМ глюкозу и соединение. Затем сразу добавляли к клеткам 20 мкл реагента CellTiter 96 AQueous One Solution и клетки инкубировали при 37C в течение еще 1 ч. По окончании инкубации измеряли абсорбцию при длине волны 490 нм. Значения абсорбции использовали для расчета EC50. Соединение согласно примеру 1 стимулировало метаболизм глюкозы в клетках INS1-E инсулиномы крыс (средняя EC50=579139 нМ, n=4). Таким образом, было показано, что соединения согласно настоящему изобретению активируют GKin vitro. Пероральный тест на толерантность к глюкозе (ПТТГ). Самцов крыс породы Wistar массой 225-250 г содержали на обычной диете при нормальном цикле свет/темнота и нормальных условиях. Для проведения исследования крысам не давали пищу в течение ночи до момента измерения их точной массы и случайным образом распределяли по группам животных с одинаковой массой (n=4 на группу). Соединение суспендировали в смеси солютол/этанол (1:1) в ультразвуковой ванне (10% от общего объема). Полученную суспензию затем разводили 9 об. 10% водного раствора солютола и соединение вводили перорально в дозах 1, 3, 6, 10, 20 и 30 мг/кг. Крысам давали глюкозу в виде болюсов для перорального приема (2 г/кг) через 2 ч после введения соединения. Кровь забирали из хвоста через 0, 15, 30, 60, 90 и 120 мин после введения глюкозы. Собранную кровь помещали в пробирки с этилендиаминтетрауксусной кислотой (ЭДТА) в объеме 400 мкл на образец и образцы хранили во льду. Плазму отделяли и хранили при -20C до момента исследования образцов на предмет содержание глюкозы и соединения. Площадь под кривой содержания глюкозы в плазме (ППК глюкозы) рассчитывали для каждой группы и процентное снижение ППК глюкозы по сравнению с контрольной группой использовали как меру эффективности соединения в отношении снижения уровня глюкозы в плазме. Соединение согласно примеру 1 снижало уровень глюкозы в плазме дозозависимым образом как натощак, так и после приема пищи. Максимальное снижение ППК глюкозы по сравнению с контрольной группой, не получавшей лечение, наблюдалось при высокой дозе (30 мг/кг) и представляло собой снижение на 42%. В результате интерполяции было выявлено, что снижение ППК глюкозы на 20% происходит при средней концентрации соединения в плазме, равной 99 нг/мл (179 нМ), что соответствует дозе соединения 6,9 мг/кг. Таким образом, было показано, что соединения согласно настоящему изобретению активируют GKin vivo. Способность проникать через гематоэнцефалический барьер. Исходный раствор соединения готовили в диметилсульфоксиде в концентрации 10 мМ. Затем готовили дозированный раствор в концентрации 1 мМ путем разбавления 100 мкл исходного раствора 900 мкл пропиленгликоля. Дозу вводили путем внутривенного болюсного введения (2,2 мл/кг) через хвостовую вену шести самцам мышей линии CF-1 (весом примерно 23 г) в дозе из расчета 2,17 мкмоль/кг. Мышей умерщвляли с использованием CO2 и метода смещения шейных позвонков. Троих мышей усыпляли через 5 мин после введения дозы и троих - через 60 мин после введения дозы. Кровь от каждого животного забирали посредством пункции сердца, получали плазму с использованием ЭДТА натрия,переносили в полипропиленовую пробирку и сразу замораживали с помощью сухого льда. У каждого животного извлекали мозг целиком и рассекали посередине, каждую половину переносили в полипропиленовую пробирку и сразу замораживали с помощью сухого льда. Образцы плазмы готовили для анализа путем преципитации белка с использованием двух частей раствора для экстракции (10% тетрагидрофурана в ацетонитриле) и одной части плазмы и перемешивания с помощью вихревой мешалки. Предполагали, что 1 мг ткани мозгапо объему 1 мкл, и добавляли две части раствора для экстракции к одной части ткани. Образцы сразу гомогенизировали с использованием ультразвукового клеточного дезинтегратора. Калибровочные стандарты готовили путем добавления известных концентраций соединения в контрольный образец плазмы крови мыши, а затем обрабатывали так же, как тестируемые образцы плазмы. Все образцы центрифугировали при относительной центробежной силе, равной 6000, в течение 5 мин. Аликвоту супернатанта из каждого образца переносили в полипропиленовый 96-луночный планшет и запечатывали для анализа с помощью ЖХ/МС/МС. МС/МС проводили с использованием тройного квадрупольного масс-спектрометра Sciex API 4000,снабженного высокоэффективным распылительным источником ионов. Высокоэффективную жидкостную хроматографию проводили с использованием аналитической колонки Phenomenex Hyrdro RP(1002,0 мм, 4 мк), нагретой до 50C, при постоянной скорости потока 0,6 мл/мин. Использовали градиент подвижной фазы при изначальном составе подвижной фазы: 5 мМ водный формиат аммония:5 мМ формиат аммония в метаноле (60:40) с конечным временем выдержки, равным 1 мин, с последующим использованием линейного градиента в течение 2 мин до 5 мМ водный формиат аммония:5 мМ формиат аммония в метаноле, 10:90, с конечным временем выдержки, равным 1 мин. Элюат из колонки отводили в течение 0-2,8 мин, а затем направляли в масс-спектрометр в течение 2,8-4,0 мин. Наблюдали переходы МС/МС 560/84. Количественную оценку соединения в тестируемых образцах проводили путем сравнения полученных значений площади пика со значениями площади пика, рассчитанными согласно квадратному уравнению 1/x2 для заданных концентраций калибровочных стандартов. Верхний и нижний пределы количественного определения получали путем обратного пересчета восстановленных значений калибровочных стандартов, превышающих +/-20% от теоретических значений. Значения концентраций в ткани мозга корректировали с учетом плазматической составляющей при использовании известного из литературы фактора, составляющего 16 мкл плазмы на 1 г ткани мозга мыши. По результатам исследования in vivo способности соединения согласно примеру 1 проникать через гематоэнцефалический барьер было показано, что среднее отношение "концентрация в ткани мозга/концентрация в плазме" через 5 мин после введения дозы составляет 0,17, а средняя общая концентрация в мозге через 5 мин после введения дозы составляет 0,539 нмоль/г. Было показано, что соединения согласно настоящему изобретению имеют ограниченную способность проникать через гематоэнцефалический барьер и, таким образом, обеспечивают ограниченную потенциальную возможность вызывать тяжелую гипогликемию. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль. 2. Соединение по п.1 формулы или его фармацевтически приемлемая соль. 3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый разбавитель или носитель. 4. Применение соединения по п.1 или 2 или фармацевтически приемлемой соли указанного соединения для лечения диабета. 5. Применение по п.4 для лечения диабета II типа.
МПК / Метки
МПК: A61K 31/427, A61P 3/10, C07D 277/46
Метки: фармацевтическая, циклопропильное, способ, соединение, диабета, лечения, композиция
Код ссылки
<a href="https://eas.patents.su/7-19055-ciklopropilnoe-soedinenie-farmacevticheskaya-kompoziciya-i-sposob-lecheniya-diabeta.html" rel="bookmark" title="База патентов Евразийского Союза">Циклопропильное соединение, фармацевтическая композиция и способ лечения диабета</a>