Способ получения 2′-дезокси-5-азацитидина (децитабина)
Формула / Реферат
1. Способ получения 2'-дезокси-5-азацитидина, включающий стадии взаимодействия соединения формулы (I)
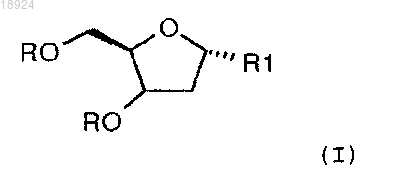
в которой
R представляет собой удаляемый заместитель, выбранный из группы, состоящей из (C1-C8)алкилкарбонила, фенилкарбонила и бензилкарбонила; и
R1 представляет собой удаляемый заместитель, выбранный из группы, состоящей из галогена, трихлорметилимидата и тиометила;
с силилированным основанием формулы (II)
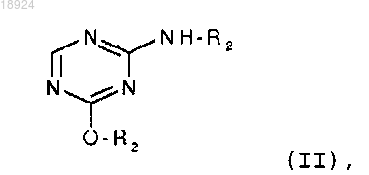
в которой R2 представляет собой триметилсилильный (TMS) остаток;
в безводном растворителе и в присутствии катализатора, который представляет собой соль алифатической сульфокислоты, выбранной из метансульфокислоты или этансульфокислоты, или соль фторированной алифатической сульфокислоты, выбранной из трифторметансульфокислоты, пентафторэтансульфокислоты или гептафторпропансульфокислоты;
с получением соединения формулы (III)
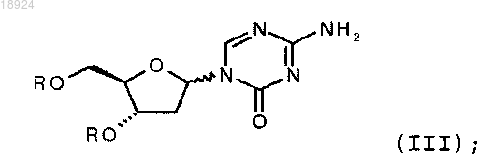
и удаления заместителей R с получением 2'-дезокси-5-азацитидина.
2. Способ по п.1, в котором R1 выбран из группы, состоящей из хлора, брома, фтора, трихлорметилимидата и тиометила.
3. Способ по п.1, в котором R представляет собой фенилкарбонил или бензилкарбонил.
4. Способ по п.1, в котором катализатор представляет собой соль метансульфокислоты или соль этансульфокислоты.
5. Способ по п.1, в котором катализатор представляет собой соль трифторметансульфокислоты, соль пентафторэтансульфокислоты или соль гептафторпропансульфокислоты.
6. Способ по п.1, в котором катализатор представляет собой соль щелочного металла или соль щелочно-земельного металла.
7. Способ по п.6, в котором катализатор представляет собой соль лития, натрия, калия или магния.
8. Способ по п.7, в котором катализатор представляет собой метансульфонат лития или трифторметансульфонат лития.
9. Способ по п.1, в котором катализатор представляет собой Sc(OTf)3, Zn(OTf)2 или Cu(OTf)2.
10. Способ по п.1, в котором растворитель выбирают из группы, состоящей из органических растворителей или хлорированных растворителей.
11. Способ по п.10, в котором растворитель представляет собой бензол, толуол, ксилол, ацетонитрил или пропиленкарбонат.
12. Способ по п.10, в котором растворитель представляет собой дихлорметан, дихлорэтан, хлороформ или хлорбензол.
13. Способ по п.1, в котором катализатор представляет собой трифторметансульфонат лития и растворитель выбирают из группы, состоящей из толуола, ксилола, дихлорметана, дихлорэтана, хлороформа и хлорбензола.
Текст
Раскрыт способ получения 2'-дезокси-5-азацитидина (Децитабина) путем взаимодействия соединения формулы (I) где R и R1 представляют собой удаляемый заместитель, с силилированным основанием формулы (II) где R2 представляет собой триметилсилильный (TMS) остаток; в безводном растворителе, в присутствии катализатора, который представляет собой соль алифатической сульфокислоты или соль фторированной алифатической сульфокислоты; с получением соединения формулы (III) Настоящее изобретение относится к способу получения 2'-дезокси-5-азацитидина (Децитабина) путем приведения во взаимодействие гликозильного донора, предпочтительно 1-галоген-производного, или имидата, предпочтительно трихлорметилпроизводного, или тиоалкилпроизводного защищенного моносахарида с выбранным силилированным основанием в присутствии выбранного катализатора. Уровень техники Децитабин представляет собой нуклеозид и является известным фармацевтически активным соединением. В US 3817980 описан способ синтеза нуклеозидов путем силилирования соответствующего нуклеинового основания и взаимодействия силилированного основания с гликозильным донором, предпочтительно с 1-галоген-производным защищенного моносахарида в присутствии выбранного катализатора. Применяемые катализаторы могут быть выбраны, например, из SnCl4, TiCl4, ZnCl2, BF3-эфирата, AlCl3 иSbCl5. Основным недостатком является то, что эти катализаторы склонны к гидролизу, в результате которого образуются продукты гидролиза, которые оказывают раздражающее действие, такие как HCl,и/или образуют нерастворимые оксиды (TiO2, SnO2), которые сложно отделить от продукта реакции. С этими катализаторами сложно работать, особенно при крупномасштабном производстве. В US-A-4082911 описан аналогичный способ взаимодействия силилированного основания нуклеозида с защищенным производным сахара и предложено применение в качестве катализатора триалкилсилилового эфира сильной органической кислоты, такого как триметилсилилтрифторметансульфонат. ВUS-A-4209613 предложен способ, усовершенствованный по сравнению со способом, описанным в US-A4082911, благодаря проведению в одну стадию процесса, согласно которому триалкилсилиловый эфир указанной сильной органической кислоты, такой как триметилсилилтрифторметансульфонат, образуетсяin situ из свободной кислоты путем реакции свободной кислоты с силилирующим агентом, например,триалкилхлорсиланом, который присутствует в подходящем молярном количестве. Силилирующие агенты, такие как триалкилхлорсилан, обладают высокой реакционной способностью и быстро взаимодействуют с образованием триалкилсилилового эфира свободной кислоты, присутствующей в реакционной смеси. Описание изобретения В настоящее время обнаружено, что 1-галоген-производное моносахарида можно привести во взаимодействие с силилированным 5-азацитозином в присутствии соли в качестве катализатора, при этом указанный катализатор выбирают из группы, включающей соль алифатической сульфокислоты, например трифторметансульфонат. При этом отсутствует необходимость использования сложноэфирного соединения в качестве катализатора, в результате чего сильно упрощается получение 2'-дезокси-5 азацитидина (Децитабина), как описано в настоящем изобретении. Более того, применение катализатора согласно настоящему изобретению обеспечивает достижение повышенной избирательности по отношению к бета-изомеру (-изомеру), например избирательности, составляющей по меньшей мере 1:2. Реакцию согласно настоящему изобретению можно вести таким образом, что приблизительно три четверти выхода реакции будет составлять бета-изомер, и, в зависимости от конкретных условий реакции, отношение альфа-изомера к бета-изомеру будет составлять 12:88. Дополнительно, согласно настоящему изобретению, можно достичь выхода реакции выше 95%, и обычно достигается выход 97-99%, из расчета на суммарное количество аномеров, присутствующих в конечной неочищенной реакционной смеси. Катализатор, используемый согласно настоящему изобретению, характеризуется стабильностью в водной среде, удобен в использовании, не вызывает образования раздражающих продуктов гидролиза и может быть легко отделен от продуктов реакции. Дополнительно, избирательность реакции для получения желательного аномера, т.е. соотношения альфа/бета-аномеров, и конечный выход значительно улучшены. Настоящее изобретение определено в формуле изобретения. Настоящее изобретение относится к способу получения 2'-дезокси-5-азацитидина (Децитабина), который включает стадии взаимодействия соединения формулы (I)R представляет собой удаляемый заместитель, выбранный из группы, состоящей из (C1C8)алкилкарбонила, фенилкарбонила и бензилкарбонила; иR1 представляет собой удаляемый заместитель, выбранный из группы, состоящей из галогена, трихлорметилимидата и тиометила; с силилированным основанием формулы (II) в которой R2 представляет собой триметилсилильный (TMS) остаток; в безводном растворителе и в присутствии катализатора, который представляет собой соль алифатической сульфокислоты, выбранной из метансульфокислоты или этансульфокислоты, или соль фторированной алифатической сульфокислоты, выбранной из трифторметансульфокислоты, пентафторэтансульфокислоты или гептафторпропансульфокислоты; с получением соединения формулы (III) и удаления заместителей R с получением 2'-дезокси-5-азацитидина. Применение катализатора согласно настоящему изобретению обеспечивает желательную избирательность, предпочтительно по отношению к бета-изомеру (-изомеру), предпочтительно при соотношении по меньшей мере 1:2, и так, чтобы при этом предпочтительно приблизительно три четверти выхода реакции составлял бета-изомер. Предпочтительным является бета-гликозид формулы (III). Если катализатор, используемый в указанной реакции, представляет собой соль алифатической сульфокислоты, указанный катализатор представляет собой соль метансульфокислоты (мезилата) или этансульфокислоты, или представляет собой соль фторсодержащей алифатической сульфокислоты, такую как соль трифторметансульфокислоты, пентафторэтансульфокислоты или гептафторпропансульфокислоты. Предпочтительными из этих солей является соль метансульфокислоты (мезилата) или соль этилсульфокислоты. Предпочтительным катализатором является соль трифторметансульфокислоты, соль пентафторэтансульфокислоты или соль гептафторпропансульфокислоты. Предпочтительными алифатическими солями сульфокислоты, фторсодержащими алифатическими солями сульфокислоты и солями сильной неорганической кислоты являются соли щелочных металлов и соли щелочно-земельных металлов, предпочтительно соли лития, натрия, калия или магния. Предпочтительными являются соли лития, предпочтительно метансульфонат лития (мезилат лития), трифторметансульфонат лития (LiOTf, трифлат лития). Также можно применять другие соли, например соли скандия,такие как Sc(OTf)3, цинка, такие как Zn(OTf)2, или меди, такие как Cu(OTf)2. Тем не менее, соль лития, в частности LiOTf, является предпочтительной. Предпочтительными растворителями для проведения реакции согласно настоящему изобретению являются органические растворители, такие как бензол, толуол, ксилол, или хлорированные растворители, например, дихлорметан, дихлорэтан, хлороформ, хлорбензол или ацетонитрил, и/или пропиленкарбонат и/или аналогичные растворители. Предпочтительными являются толуол и хлорированные растворители. Предпочтительным является применение трифторметансульфоната лития (LiOTf) в хлорированном растворителе, предпочтительно в дихлорметане, дихлорэтане, хлороформе, хлорбензоле и/или в ароматическом растворителе, таком как толуол или ксилол. Каждый растворитель или смесь растворителей может привести к различной избирательности по отношению к бета-изомеру (-изомеру). Для специалиста в данной области не составит труда оптимизировать катализатор и/или растворитель или смесь растворителей для получения желательной избирательности по отношению к бета-изомеру. Соединение формулы (I) представляет собой соединение гликозильного донора. Получение соединения формулы (I) известно per se. Удаляемый заместитель R представляет собой (C1-С 4)алкилкарбонил, фенилкарбонил, или бензилкарбонил; предпочтительно ацетил, фенилкарбонил или бензилкарбонил. Удаляемый заместитель R1 представляет собой галоген, предпочтительно хлор, бром, фтор, предпочтительно хлор, или имидат, предпочтительно трихлорметилимидат [-NH-(O)C-CCl3], или тиоалкильное производное, предпочтительно -S-метил. Соединение формулы (II) и его получение известны. Соединение получают с помощью взаимодействия свободного основания с триметилхлорсиланом. При осуществлении взаимодействия соединений формул (I) и (II) температура реакции, как правило, лежит в диапазоне от 0 до приблизительно 90C, предпочтительно приблизительно соответствует комнатной температуре, в результате чего компоненты вступают в реакцию в приблизительно эквимолярных количествах или с избытком соединения формулы (II). Катализатор предпочтительно используют в концентрации, равной приблизительно от 10 до 100 мол.%, рассчитанной по отношению к суммарному молярному присутствию двух взаимодействующих компонентов. Для специалиста в данной области не составляет труда оптимизироватьмолярные соотношения компонентов. Для удаления заместителей R из соединения формулы (III), с целью получения указанного соединения 2'-дезокси-5-азацитидина (Децитабина), содержащего свободные гидроксильные группы, используют известные способы. Предпочтительный способ удаления заместителей R включает, например, обработку спиртовым раствором аммиака или алкоголятами; но можно также применять другие известные способы. Следующий пример иллюстрирует настоящее изобретение. Пример 1.(А) Смесь 5-азацитозина (20 г, 178,4 ммоль), сульфата аммония (2,4 г, 18,16 ммоль) и гексаметилдисилазана (160 г, 991,3 ммоль) кипятили с обратным холодильником до получения прозрачного раствора. Избыток гексаметилдисилазана удаляли в вакууме при 60C.(B) К остатку, полученному на стадии (А), добавляли 264 г дихлорметана, а затем трифторметансульфонат лития (27,84 г, 178,4 ммоль) и "хлор-сахар" C-137: 1-хлор-3,5-ди-O-п-хлорбензоил-2-дезокси-D-рибофуранозу [76,67 г, 178,4 ммоль, соответствующую соединению формулы (I)].(C) Полученную смесь перемешивали в течение 4 ч при температуре окружающей среды (20-25C). Реакция позволяла получить 99,2% объединенных аномеров, избирательность альфа/бета - 27/73.(D) Затем растворитель удаляли при 40C в вакууме, и полученный остаток растворяли в 60 г этилацетата. Раствор добавляли по каплям к смеси 220 г водного бикарбоната натрия (2,5% раствор по весу),174 г этилацетата, 36 г циклогексана и 70 г ацетонитрила при 30C, и полученную реакционную смесь охлаждали до 0C и перемешивали в течение 3 ч (ч). Осадок блокированного (защищенного) аминотриазина отфильтровывали, промывали водой и, наконец, смесью ацетонитрила и этилацетата (1:1). Общий выход составлял 79,2 г (87,8%) объединенных аномеров; отношение альфа/бета - 31:69. На схеме 1 показана описанная химическая реакция. Пример 2. Соединение, соответствующее формуле (III), полученное в примере 1, дополнительно обрабатывали спиртовым раствором аммиака известным способом, с получением 2'-дезокси-5-аза-цитидина (Децитабина) практически с количественным выходом. Схема 1 Пример 3. Пример 1 воспроизводили с использованием 1,0 эквивалента мезилата лития вместо трифторметансульфоната лития. Выход реакции после стадии (С): объединенных аномеров 95,2%, избирательность альфа/бета 60:40. Суммарный выход после заключительной стадии (D): 85,2% объединенных аномеров; отношение альфа/бета - 63:37. Пример 4. Пример 1 воспроизводили с использованием 1,0 эквивалента перхлората лития вместо трифторметансульфоната лития. Выход реакции после стадии (С): 99,4% объединенных аномеров, избирательность альфа/бета 37:63. Суммарный выход после заключительной стадии (D): 85,2% объединенных аномеров; отношение альфа/бета - 36:64. Пример 5. Пример 1 воспроизводили с использованием 1,0 эквивалента тетрафторбората лития вместо трифторметансульфоната лития. Выход реакции после стадии (С): 94,5% объединенных аномеров, избирательность альфа/бета 59:41. Суммарный выход после заключительной стадии (D): 47,9% объединенных аномеров; отношение альфа/бета - 70:30. Пример 6. Пример 1 воспроизводили с использованием 1,0 эквивалента трифторметансульфоната натрия вместо трифторметансульфоната лития. Выход реакции после стадии (С): 99,2% объединенных аномеров, избирательность альфа/бета 40:60. Суммарный выход после заключительной стадии (D): 80,7% объединенных аномеров; отношение альфа/бета - 40:60. Пример 7. Пример 1 воспроизводили с использованием 1,0 эквивалента трифторметансульфоната калия вместо трифторметансульфоната лития. Выход реакции после стадии (С): 99,0% объединенных аномеров, избирательность альфа/бета 44:56. Суммарный выход после заключительной стадии (D): 79,9% объединенных аномеров; отношение альфа/бета - 46:54. Пример 8. Пример 1 воспроизводили [за исключением стадии (D)] с использованием 1,0 эквивалента трифторметансульфоната цинка вместо трифторметансульфоната лития. Выход реакции после стадии (С): 96,0% объединенных аномеров, избирательность альфа/бета 54:46. Пример 9. Пример 1 воспроизводили с использованием равного объема толуола вместо дихлорметана в качестве растворителя. Выход реакции после стадии (С): объединенных аномеров 99,4%, избирательность альфа/бета 27:73. Суммарный выход после заключительной стадии (D): 88,7% объединенных аномеров; отношение альфа/бета - 31:69. Пример 10. Пример 1 воспроизводили с использованием равного объема ацетонитрила вместо дихлорметана в качестве растворителя. Выход реакции после стадии (С): 99,2% объединенных аномеров, избирательность альфа/бета 50:50. Суммарный выход после заключительной стадии (D): 82,5% объединенных аномеров; отношение альфа/бета - 52:48. Пример 11.(А) Смесь 5-азацитозина (0,5 г, 4,46 ммоль, 1 экв.), сульфата аммония (40 мг, 0,3 ммоль, 0,07 экв.) и гексаметилдисилазана (4 г, 24,8 ммоль, 5,6 экв.) кипятили с обратным холодильником до получения прозрачного раствора. Избыток гексаметилдисилазана удаляли в вакууме при 60C.(В) После этого к остатку, полученному на стадии (А), добавляли 10 мл дихлорметана, трифторметансульфоната лития (0,33 г, 2,11 ммоль; 0,47 экв.) и "хлор-сахар" С-137: 1-хлор-3,5-ди-O-п-хлорбензоил 2-дезокси-альфа-D-рибофуранозу [0,73 г, 1,70 ммоль, 0,38 экв.; соответствующую соединению формулы(I)]. Смесь перемешивали в течение 4 ч при температуре окружающей среды (20-25C). В результате реакции получали 99,1% объединенных аномеров; альфа/бета - 16/84. Пример 12. Пример 11 воспроизводили с использованием 0,47 эквивалента трифторметансульфоната меди вместо трифторметансульфоната лития. Выход реакции после стадии (В): 98,0% объединенных аномеров, избирательность альфа/бета 42:58. Пример 13. Пример 11 воспроизводили с использованием 0,47 эквивалента трифторметансульфоната скандия вместо трифторметансульфоната лития. Выход реакции после стадии (В): 88,0% объединенных аномеров, избирательность альфа/бета 43:57. Пример 14. Пример 11 воспроизводили с использованием 0,47 эквивалента трифторметансульфоната магния вместо трифторметансульфоната лития. Выход реакции после стадии (В): 89,0% объединенных аномеров, избирательность альфа/бета 58:42. Пример 15. Пример 11 воспроизводили с использованием равного объема ацетонитрила вместо дихлорметана в качестве растворителя. Выход реакции после стадии (В): 97,6% объединенных аномеров, избирательность альфа/бета 39:61. Пример 16. Пример 11 воспроизводили с использованием равного объема хлорбензола вместо дихлорметана в качестве растворителя. Выход реакции после стадии (В): 96,2% объединенных аномеров, избирательность альфа/бета 26:74. Пример 17. Пример 11 воспроизводили с использованием равного объема пропиленкарбоната вместо дихлорметана в качестве растворителя. Выход реакции после стадии (В): 96,8% объединенных аномеров, избирательность альфа/бета 42:58. Пример 18. Пример 11 воспроизводили с использованием смеси 10 мл дихлорметана и 3,5 мл ксилола вместо 10 мл чистого дихлорметана в качестве растворителя. Выход реакции после стадии (В): 93,3% объединенных аномеров, избирательность альфа/бета 27:73. Пример 19.(A) Смесь 5-азацитозина (0,5 г, 4,46 ммоль, 1 экв.), сульфата аммония (40 мг, 0,3 ммоль, 0,07 экв.) и гексаметилдисилазана (4 г, 24,8 ммоль, 5,6 экв.) кипятили с обратным холодильником до получения прозрачного раствора.(B) После этого к остатку, полученному на стадии (А), добавляли 10 мл 1,2-дихлорбензола, трифторметансульфоната лития (0,33 г, 2,11 ммоль; 0,47 экв.) и "хлор-сахар" С-137: 1-хлор-3,5-ди-O-пхлорбензоил-2-дезокси-альфа-D-рибофуранозу [1,15 г, 2,68 ммоль, 0,60 экв.; соответствующую соединению формулы (I)]. Смесь перемешивали в течение 4 ч при температуре окружающей среды (20-25C). В результате реакции получали 91,2% объединенных аномеров; альфа/бета - 27/73. Пример 20. Пример 19 воспроизводили с использованием равного объем 1,2-дихлорэтана вместо 1,2-дихлорбензола в качестве растворителя. Выход реакции после стадии (В): 93,4% объединенных аномеров, избирательность альфа/бета 27:73. Пример 21.(А) Смесь 5-азацитозина (0,5 г, 4,46 ммоль, 1 экв.), сульфата аммония (40 мг, 0,3 ммоль, 0,07 экв.) и гексаметилдисилазана (4 г, 24,8 ммоль, 5,6 экв.) кипятили с обратным холодильником до получения прозрачного раствора. Избыток гексаметилдисилазана удаляли в вакууме при 60C.(В) После этого к остатку, полученному на стадии (А), добавляли 10 мл дихлорметана, трифторметансульфонат лития (0,33 г, 2,11 ммоль; 0,47 экв.) и "хлор-сахар" С-137: 1-хлор-3,5-ди-O-п-хлорбензоил 2-дезокси-альфа-D-рибофуранозу [0,38 г, 0,88 ммоль, 0,20 экв.; соответствующую соединению формулы(I)]). Смесь перемешивали в течение 4 ч при температуре окружающей среды (20-25C). В результате реакции получали 99,3% объединенных аномеров; альфа/бета - 12/88. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 2'-дезокси-5-азацитидина, включающий стадии взаимодействия соединения формулы (I)R представляет собой удаляемый заместитель, выбранный из группы, состоящей из (C1C8)алкилкарбонила, фенилкарбонила и бензилкарбонила; иR1 представляет собой удаляемый заместитель, выбранный из группы, состоящей из галогена, трихлорметилимидата и тиометила; с силилированным основанием формулы (II) в которой R2 представляет собой триметилсилильный (TMS) остаток; в безводном растворителе и в присутствии катализатора, который представляет собой соль алифатической сульфокислоты, выбранной из метансульфокислоты или этансульфокислоты, или соль фторированной алифатической сульфокислоты, выбранной из трифторметансульфокислоты, пентафторэтансульфокислоты или гептафторпропансульфокислоты; с получением соединения формулы (III) и удаления заместителей R с получением 2'-дезокси-5-азацитидина. 2. Способ по п.1, в котором R1 выбран из группы, состоящей из хлора, брома, фтора, трихлорметилимидата и тиометила. 3. Способ по п.1, в котором R представляет собой фенилкарбонил или бензилкарбонил. 4. Способ по п.1, в котором катализатор представляет собой соль метансульфокислоты или соль этансульфокислоты. 5. Способ по п.1, в котором катализатор представляет собой соль трифторметансульфокислоты,соль пентафторэтансульфокислоты или соль гептафторпропансульфокислоты. 6. Способ по п.1, в котором катализатор представляет собой соль щелочного металла или соль щелочно-земельного металла. 7. Способ по п.6, в котором катализатор представляет собой соль лития, натрия, калия или магния. 8. Способ по п.7, в котором катализатор представляет собой метансульфонат лития или трифторметансульфонат лития. 9. Способ по п.1, в котором катализатор представляет собой Sc(OTf)3, Zn(OTf)2 или Cu(OTf)2. 10. Способ по п.1, в котором растворитель выбирают из группы, состоящей из органических растворителей или хлорированных растворителей. 11. Способ по п.10, в котором растворитель представляет собой бензол, толуол, ксилол, ацетонитрил или пропиленкарбонат. 12. Способ по п.10, в котором растворитель представляет собой дихлорметан, дихлорэтан, хлороформ или хлорбензол. 13. Способ по п.1, в котором катализатор представляет собой трифторметансульфонат лития и растворитель выбирают из группы, состоящей из толуола, ксилола, дихлорметана, дихлорэтана, хлороформа и хлорбензола.
МПК / Метки
МПК: C07H 19/056, C07H 1/00
Метки: децитабина, способ, получения, 2'-дезокси-5-азацитидина
Код ссылки
<a href="https://eas.patents.su/7-18924-sposob-polucheniya-2-dezoksi-5-azacitidina-decitabina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 2′-дезокси-5-азацитидина (децитабина)</a>
Предыдущий патент: Собирательный транспортер
Следующий патент: Постметаллоценовые комплексы на основе бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов для полимеризации этилена и альфа-олефинов
Случайный патент: Полиамидная композиция, содержащая полиамид 4,10