Постметаллоценовые комплексы на основе бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов для полимеризации этилена и альфа-олефинов
Номер патента: 18925
Опубликовано: 29.11.2013
Авторы: Разави Аббас, Карпантье Жан-Франсуа, Кириллов Евгений
Формула / Реферат
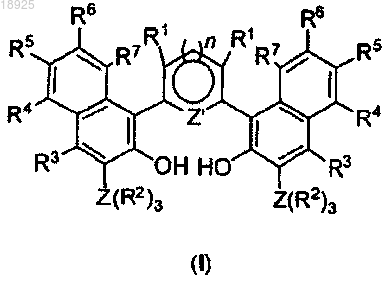
1. Лиганд общей формулы (I)
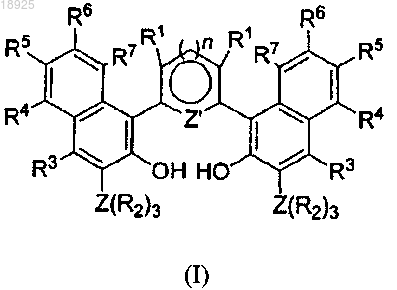
где R1, R3, R4, R5, R6 и R7 представляют собой водород;
Z' представляет собой атом N при n=1 или Z' представляет собой атом S при n=0;
Z представляет собой Si;
R2 представляет собой фенильную группу.
2. Способ получения лиганда по п.1, который включает следующие стадии:
а) взаимодействие β-нафтола формулы
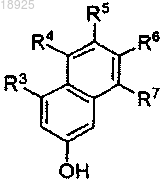
с алкоксиалкилгалогенидом формулы XROR', где X представляет собой галоген, и R и R', каждый независимо, выбраны из алкила, имеющего от 1 до 6 атомов углерода, в присутствии диметилформамида (ДМФ) и щелочного металл-алкила или щелочного металл-гидрида для получения соединения формулы
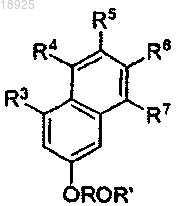
которое
b) подвергают реакции с (R2)3ZX', где X' представляет собой галоген, в присутствии sec-BuLi в растворителе для получения соединения формулы
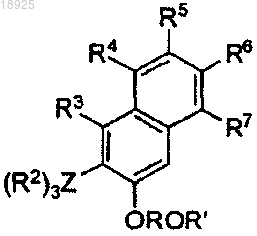
которое
с) подвергают реакции с дигалогетероарилом формулы
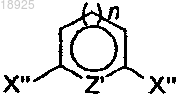
где Z' представляет собой S и n представляет собой 0 или Z' представляет собой N и n=1, X" представляет собой галоген (Cl, Br, I), в присутствии палладиевого или никелевого катализатора перекрестного сшивания для получения соединения формулы
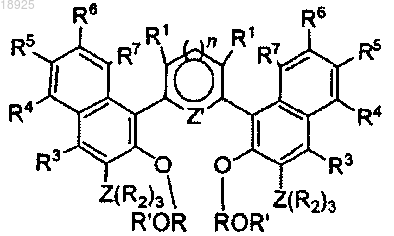
d) снимают защитные группы с соединения, полученного на этапе с), например, реакцией кислоты (например, HCl в CHCl3/EtOH), для получения лиганда общей формулы (I)
3. Способ по п.2, где щелочной металл-гидрид представляет собой NaH.
4. Металлический комплекс общей формулы
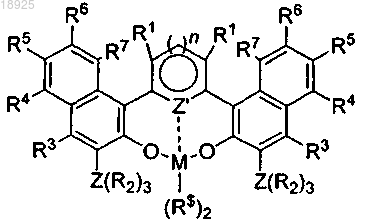
получаемый реакцией металлирования лиганда по п.1 солью металла формулы MR$n, где М представляет собой металл 4 группы Периодической таблицы, R$ представляет собой бензил или NMe2.
5. Металлический комплекс по п.4, где М представляет собой Zr, Ti, Hf.
6. Способ получения металлического комплекса по любому из пп.4, 5 реакцией соли металла MR$n с лигандом по п.1 в растворителе.
7. Активная каталитическая система металла 4 группы, включающая металлический комплекс по любому одному из пп.4, 5 и активирующее средство с ионизирующим действием.
8. Способ гомо- или сополимеризации этилена и альфа-олефинов, который включает стадии, на которых:
а) впускают активную каталитическую систему по п.7 в реактор;
b) впускают мономер и необязательно сомономер в реактор одновременно с или после каталитической системы;
c) поддерживают при условиях полимеризации;
d) выделяют гомо- или сополимер этилена или альфа-олефина.
9. Способ по п.8, где мономером является этилен и сомономером, если присутствует, является 1-гексен.
Текст
ПОСТМЕТАЛЛОЦЕНОВЫЕ КОМПЛЕКСЫ НА ОСНОВЕ БИС(НАФТОКСИ)ПИРИДИНОВЫХ И БИС-(НАФТОКСИ)ТИОФЕНОВЫХ ЛИГАНДОВ ДЛЯ ПОЛИМЕРИЗАЦИИ ЭТИЛЕНА И АЛЬФА-ОЛЕФИНОВ Изобретение относится к области группы 4 постметаллоценовых комплексов на основе пространственно затрудненных бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов. Оно также относится к применению таких постметаллоценовых комплексов в полимеризации этилена и альфа-олефинов.(71)(73) Заявитель и патентовладелец: ТОТАЛ ПЕТРОКЕМИКАЛЗ РЕСЕРЧ ФЕЛЮИ (BE); САНТР НАСИОНАЛЬ ДЕ ЛЯ РЕШЕРШ СЬЯНТИФИК Изобретение относится к области постметаллоценовых комплексов на основе пространственно затрудненных бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов. Оно также относится к применению таких постметаллоценовых комплексов в полимеризации этилена и альфа-олефинов. Существует потребность в новых высокоактивных каталитических системах полимеризации алкена на основе постметаллоценов и было проведено большое количество исследований в этой области, таких как рассмотренных, например, в Gibson и Sptizmesser (Gibson, V.С.; Spitzmesser, S.K. в Chem. Rev. 2003,103, 283), или в Ittel et al. (Ittel, S.D.; Johnson, L.K.; Brookhart, M. в Chem. Rev. 2000, 100, 1169), или в Britovsek et al. (Britovsek, G.J.P.; Gibson, V.C.; Wass, D.F. в Angew. Chem., Int. Ed. 1999, 38, 429). Среди изобилия недавно раскрытых каталитических систем металлические комплексы отдельной группы 4, несущие различные хелатирующие на основе арилоксида лиганды, продемонстрировали удивительные характеристики при полимеризации этилена и -олефинов. В частности, подходящие в промышленности высокоэффективные феноксииминовые системы впервые были введены Fujita et al. at Mitsui, такие как раскрыты, например, в Makio и Fujita (Makio, H.; Fujita, Т. в Macromol. Rapid Commun. 2007, 28, 698), или в Terao et al. (Terao, H.; Ishii, S.; Saito, J.; Matsuura, S.; Mitani, M.; Nagai, N.; Tanaka, H.;Fujita, Т. в Macromolecules 2006, 39, 4023), или в Nakayama et al. (Nakayama, Y.; Saito, J.; Bando, H.; Fujita,Т. в Macromol. Chem. Phys. 2005, 206, 1847), или в Furuyama et al. (Furuyama, R.; Saito, J.; Ishii, S.; Makio,H.; Mitani, M.; Tanaka, H.; Fujita, Т. в J. Organomet. Chem. 2005, 690, 4398), или в Saito et al. (Saito, J.; Tohi,Y.; Matsukawa, N.; Mitani, M.; Fujita, T. в Macromolecules 2005, 38, 4955). Типичные металлические комплексы этой группы представлены на фиг. 1, комплекс А. Другие группы также представляют очень активные высокоизоспецифические предшественники полимеризации 1-гексена, несущие тетрадентатные вспомогательные средства ONXO и ONNO, такие как описаны, например, в Mason и Coates (Mason, A.F.; Coates, G.W. в J. Am. Chem. Soc. 2004, 126,10798), или в DeRosa et al. (DeRosa, C.; Circelli, Т.; Auriemma, F.; Mathers, R.T.; Coates, G.W. в Macromolecules 2004, 37, 9034), или в Mason и Coates (Mason, A.F.; Coates, G.W. в J. Am. Chem. Soc. 2004, 726,16326), или в Reinartz et al. (Reinartz, S.; Mason, A.F.; Lobkovsky, E.B.; Coates, G.W. в Organometallics 2003, 22, 2542), или в Hustad et al. (Hustad, P.D.; Tian, J.; Coates, G.W. в J. Am. Chem. Soc. 2002, 124, 3614),или в Yeori et al. (Yeori, A.; Goldberg, I.; Shuster, M.; Kol, M. в J. Am. Chem. Soc. 2006, 128, 13062). Дополнительные структуры были описаны в Groysman et al. (Groysman, S.; Sergeeva, E.; Goldberg, I.; Kol, M. в Inorg. Chem. 2005, 44, 8188), или в Yeori et al. (Yeori, A.; Groysman, S.; Goldberg, I.; Kol, M. в Inorg.Chem. 2005, 44, 4466), или в Segal et al. (Segal, S.; Goldberg, I.; Kol, M. в Organometallics 2005, 24, 200),или в (Yeori, A.; Gendler, S.; Groysman, S.; Goldberg, I.; Kol, M. в Inorg. Chem. Commun. 2004, 7, 280), или в Tshuva et al. (Tshuva, E.Y.; Groysman, S.; Goldberg, I.; Kol, M.; Goldschmidt, Z. в Organometallics 2002,21, 662). Типичные структуры этой группы представлены на фиг. 1, комплексы В и С. Пространственно жесткие комплексы, включающие тетрадентатные OSSO лиганды, показали эффективное производство изотактического полистирола, такого как описан, например, в Lian et al. (Lian, В.; Beckerle, K.; Spaniol,T.P.; Okuda, J. в Angew. Chem., Int. Ed. 2007, 46, 8507), или в Beckerle et al. (Beckerle, K.; Manivannan, R.;Okuda, J. в Organometallics 2006, 25, 3019), или в Capacchione et al. (Capacchione, C.; Manivannan, R.; Barone, M.; Beckerle, K.; Centore, R.; Oliva, L.; Proto, A.; Tuzi, A.; Spaniol, T. P.; Okuda, J. в Organometallics 2005, 24, 2971). Типичные структуры этой группы представлены на фиг. 1, комплекс D. В последнее время ввели жесткие тридентатные системы лиганда и родственные системы полимеризации: они способны к образованию ПЭВП (полиэтилен высокой плотности) с активностями порядка 10-15106 кгмоль-1 ч-1, а также сополимеризации этилен/1-октен. Они были описаны, например, в Chan et al. (Chan, M.C.W.; Kui,S.C.F.; Cole, J.M.; Mclntyre, G.J.; Matsui, S.; Zhu, N.; Tarn, K.-H. в Chem. Eur. J. 2006, 12, 2607), или в Chanet al. (Chan, M.C.W.; Tarn, K.-H.; Pui, Y.-L.; Zhu, Z. в J. Chem. Soc, Dalton Trans. 2002, 3085). Типичные структуры этой группы представлены на фиг. 1, комплексы Е и F. Список фигур Фиг. 1 представляет различные металлорганические соединения, раскрытые в литературе, которые пригодны для олигомеризации или полимеризации этилена и альфа-олефинов. Фиг. 2 представляет схему, применяемую для получения ONOH2. Фиг. 3 представляет некопланарную ориентацию перекрывания гетероциклических и прилежащих нафтильных групп, возникающую в результате пространственного отталкивания между протонами в мета и 8 положениях. Фиг. 4 представляет спектр 1 Н ЯМР (ядерно-магнитный резонанс) ONOH2. Фиг. 5 представляет спектр 1 Н ЯМР OSOH2. Фиг. 6 представляет молекулярную структуру OSOH2 лиганда. Фиг. 7 представляет молекулярную структуру титанового металлического комплексаrac-ONOTi(CH2Ph)2. Фиг. 8 представляет 1 Н ЯМР спектр титанового металлического комплекса rac-ONOTi(CH2Ph)2. Фиг. 9 представляет молекулярную структуру гафниевого металлического комплексаONOHf(NMe2)2(NHMe2). Тем не менее, все еще остается потребность в развитии новых очень активных каталитических систем, имеющих специфические функциональности для адаптации полимера к желаемым свойствам. Целью данного изобретения является получение пространственно затрудненных лигандов на основе феноксигрупп. Другой целью данного изобретения является образование комплекса этих лигандов с металлами с устойчивой стереоселективной координацией. Также целью данного изобретения является получение очень активных каталитических систем для полимеризации этилена и альфа-олефинов. Любая из этих целей, по меньшей мере частично, выполнена данным изобретением. Соответственно, данное изобретение раскрывает лиганд формулы (I)Z' представляет собой атом N при n=1 или Z' представляет собой атом S при n=0;R2 представляет собой фенильную группу;Z(R2)3 также может быть замещенной арильной группой. Предпочтительно R1, R3, R4, R5, R6 и R7, каждый независимо, выбраны из водорода или алкильных групп, имеющих не более 6 атомов углерода, более предпочтительно они все представляют собой водород. Предпочтительно Z' представляет собой S, или N, или N=N. Предпочтительно Z представляет собой С или Si, более предпочтительно это Si. Предпочтительно R2 представляет собой замещенную или незамещенную фенильную группу или более высокую ароматическую группу (например, нафтил) или алкил. Более предпочтительно это незамещенная фенильная группа или трет-бутиловая группа. Пробовали несколько процедур для получения лигандов по данному изобретению, большинство из них не имели успеха. Их можно получить с хорошим выходом, начиная с -нафтола способом, который включает следующие стадии: а) взаимодействие -нафтола формулы с алкоксиалкилгалогенидом формулы XROR', где X представляет собой галоген и R и R', каждый независимо, выбраны из алкила, имеющего от 1 до 6 атомов углерода, в присутствии диметилформамида(ДМФ) и щелочного металл-алкила или щелочного металл-гидрида, предпочтительно NaH, для получения соединения формулыb) подвергают реакции с (R2)3ZX', где X' представляет собой галоген, в присутствии sec-BuLi в растворителе для получения соединения формулы где Z' представляет собой S и n представляет собой 0 или Z' представляет собой N и n=1, X" представляет собой галоген (Cl, Br, I; предпочтительно X"=Br), в присутствии палладиевого или никелевого катализатора перекрестного сшивания для получения соединения формулы IId) снимают защитные группы с соединения, полученного на этапе с), например, реакцией кислоты(например, HCl в CHCl3/EtOH), для получения лиганда общей формулы (I) Способ получения можно подытожить схемой, представленной на иллюстративной фиг. 2, для соответствующего получения данного ONOH2 лиганда. Ключевым признаком лигандов по данному изобретению является возможность образовывать устойчивую стереоселективную комбинацию к металлическому центру, обеспеченную некомпланарной ориентацией соединенных мостиковой связью гетероциклических и прилегающих нафтильных групп изза пространственного отталкивания между протонами в мета и 8 положениях этих частей, как можно увидеть на иллюстративной фиг. 3. Изобретение также раскрывает металлический комплекс формулы (II) Металлические комплексы II получают в результате комплексообразования лиганда I с металлическими солями MRn в растворителе, где М представляет собой металл 4 группы Периодической таблицы,где каждый R одинаковый или отличается и представляет собой алкил, бензил, арил, амидо, алкоксид и/или галогенид (Cl, Br, I). Предпочтительно все R являются одинаковыми и являются или CH2Ph, OiPr, или NMe2. Предпочтительно на соединенный мостиковой связью биснафтоловый комплекс применяют один эквивалент металлической соли. Реакцию металлирования проводят при температуре от -80 С до температуры 25 С и в течение времени от 1 до 18 ч. Данное изобретение также раскрывает активную каталитическую систему, включающую компонент односайтового катализатора на металле 4 группы формулы (II) и активирующее средство с алкилирующим/ионизирующим действием. Подходящие активирующие средства хорошо известны в технике. Активирующим средством может быть алкил алюминия, представленный формулой AlR+nX3-n, где R+ представляет собой алкил, имеющий от 1 до 20 атомов углерода, X представляет собой галоген, в комбинации с [Ph3C][B(C6F5)4]. Предпочтительными алкилами алюминия являются триизобутил алюминия (TIBAL) или триэтил алюминия (TEAL). Алкилы алюминия применяют в комбинации с тритилом. Альтернативно, им может быть алюмоксан, включающий олигомерные линейные и/или циклические алкильные алюмоксаны, представленные формулой для олигомерных, циклических алюмоксанов,где n представляет собой 1-40, предпочтительно 1-20, m представляет собой 3-40, предпочтительно 3-20 и R представляет собой C1-C8-алкильную группу, предпочтительно метил или изобутил. Предпочтительно активирующим средством является метилалюмоксан (МАО). Количество активирующего средства выбрано для получения соотношения А 1/М от 500 до 10000,предпочтительно от 1000 до 5000. Количество активирующего средства зависит от его природы. Подходящие борсодержащие средства могут также применяться для активации компонента односайтового катализатора на металле 4 группы формулы II, где R представляет собой алкильную или бензильную группу. Они включают, например, трифенилкарбенийборонат, такой как тетракиспентафторфенил-борат-трифенилкарбений, как описано в патентом документе ЕР-А-0427696, или представленные общей формулой [L'-H]+[BAr1Ar2XX4]-, как описано в патентом документе ЕР-А-0277004 (с. 6, строка 30 до с. 7, строка V). Количество борсодержащего активирующего средства выбрали для получения соотношения В/М от 0,5 до 5, предпочтительно приблизительно 1. В другом варианте осуществления по данному изобретению компонент односайтового катализатора формулы II может размещаться на обычной подложке. Предпочтительно обычной подложкой является диоксид кремния, пропитанный МАО (моноаминоксидаза). Альтернативно подложка также может быть активирующей подложкой, такой как фторированный алюмосиликат. Каталитическая система может включать необязательно поглотитель, который может быть выбран из триэтилалюминия, триизобутилалюминия, трис-п-октилалюминия, тетраизобутилдиалюминоксана или диэтилцинка. Активную каталитическую систему металла 4 группы применяют в олигомеризации и в полимеризации этилена и альфа-олефинов. Данное изобретение раскрывает способ олигомеризации или гомо- или со-полимеризации этилена и альфа-олефинов, который включает стадии, на которых:a) впускают активную каталитическую систему в реактор;b) впускают мономер и необязательно сомономер или до, или после, или одновременно с этапом а);c) поддерживают при условиях полимеризации;d) выделяют гомо- или сополимер этилена или альфа-олефина. Давление в реакторе может изменяться от 0,5 до 50 бар, предпочтительно от 5 до 25 бар. Температура полимеризации может изменяться от 10 до 100 С, предпочтительно от 50 до 85 С. Предпочтительный мономер и необязательно сомономер можно выбрать из этилена, пропилена, 1 гексена или стирола. Предпочтительным мономером является этилен с 1-гексеном как сомономером. Примеры Все эксперименты выполнены в атмосфере чистого аргона с применением стандартных технологийSchlenk, или в перчаточной камере. Растворители дистиллировали под азотом, от Na/бензофенон дляTHF (тетрагидрофуран) и Et2O, и от сплава Na/K для толуола и пентана. Их тщательно дегазировали и хранили под азотом перед применением. Дейтерированные растворители (бензол-d6, толуол-d8, THF-d8; 99,5% D, Eurisotop) переместили под вакуумом от сплава Na/K в запоминающие трубки. ТетрабензилM(CH2Ph)4, где М=Ti, Zr, Hf, и предшественники тетракис-(диметиламидо) Hf(NMe2)4 и Sфос(дициклогексил(2',6-диметокси-1,1'-бифенил-2-ил)фосфин) получали с применением сообщенных методик. Другие исходные материалы закупили у Acros, Strem и Aldrich. Спектры ЯМР комплексов записали на спектрофотометрах Bruker АС-200, АС-300 и АМ-500 в снабженных тефлоном ЯМР трубках при 25 С, если не указано иное. Химические сдвиги 1 Н и 13 С сообщали в ppm (число частей на миллион) против SiMe4 и определяли относительно пиков остаточного растворителя. Установку резонансов металлоорганических комплексов сделали из 1 Н-13 С HMQC (гетероядерная многоквантовая корреляция) и НМВС (гетероядерная многополосная корреляция) ЯМР экспериментов. Константы взаимодействия представлены в Герцах. Элементарные анализы выполнили при помощи Микроаналитической лаборатории при Институте химии Rennes, и они являлись средним из двух независимых определений. Получение лигандов. Получение ONOH2(2-NH2). А. Получение 2-(метоксиметокси)нафталина. К суспензии 5,0 г NaH (208,33 ммоль) в 150 мл DMF (диметилформамид) под подачей аргона добавили 20,0 г твердого 2-гидроксинафталина (138,7 ммоль) при температуре 0 С небольшими порциями. Суспензию держали при перемешивании в течение 4 ч при комнатной температуре, медленно добавили 17,8 г метоксиметилхлорида (221,2 ммоль) и реакционную смесь перемешивали в течение 10 дополнительных часов. Реакционную смесь осторожно разбавили 1 л воды и органическую часть экстрагировали 3 раза 50 мл CH2Cl2. Объединенные органические экстракты дважды промыли 500 мл воды, солевым раствором и высушили над MgSO4. Раствор выпарили, высушили в вакууме при температуре 80 С для получения 25,1 г бесцветного масляного продукта (133,3 ммоль), который применяли без дополнительной очистки. Результаты ЯМР следующие: 1 Н ЯМР (200 МГц, CDCl3, 25 С):7,80 (m, 3H), 7,55-7,37 (m, 3H),7,26 (m, 1 Н), 5,34 (s, 2H, ОСН 2 О), 3,57 (s, 3H, ОСН 3). Анализ рассчитан для C12H12O2: С, 76,57; Н, 6,43. Обнаружено: С, 76,59; Н, 6,55.B. Получение [3-(метоксиметокси)-2-нафтил](трифенил)силана. Раствор 19,1 м sec-BuLi 1,3 М в гексане/циклогексане (24,70 ммоль) добавили по каплям к перемешанному раствору 4,64 г [3-(метоксиметокси)-2-нафтил](трифенил)силана (24,65 ммоль) в 150 мл THF при температуре -78 С за период времени 15 мин. После перемешивания всю ночь при комнатной температуре к полученному в результате окрашенному раствору добавили раствор 7,27 г Ph3SiCI (24,65 ммоль) и 4,3 мл НМРА (гексаметилфосфортриамид) (24,72 ммоль) в 100 мл THF. Реакционную смесь нагревали обратным холодильником в течение 40 ч, охладили и разбавили 1000 мл воды. Органическую часть экстрагировали 3 раза 100 мл Et2O. Объединенные органические экстракты сушили над MgSO4 и выпарили. Неочищенный остаток перекристаллизовали из гептана и сушили под вакуумом для получения 8,25 г [3-(метоксиметокси)-2-нафтил](трифенил)силана (18,47 ммоль) с выходом 75%. Результаты ЯМР следующие: 1 Н ЯМР (200 МГц, CDCl3, 25C):7,83-7,75 (m, 2H), 7,72-7,58 (m, 7 Н), 7,55-7,25 (m, 12 Н), 4,96 (s,2H, ОСН 2 О), 3,00 (s, 3 Н, ОСН 3). Анализ рассчитан для C29H24OSi: С, 83,61; Н, 5,81. Обнаружено: С, 82,15; Н, 5,23. Это является однореакторным способом, включающим следующие этапы.sec-BuLi 1,3 М в гексане/циклогексане (5,46 ммоль) при температуре -78 С. Реакционную смесь перемешивали при комнатной температуре всю ночь, затем все летучие вещества выпарили и остаток сушили 1 ч под вакуумом.(ii) 0,70 г безводного ZnCl2 (5,15 ммоль) добавили в перчаточную камеру, 30 мл THF переместили под вакуумом и полученный раствор перемешивали 30 мин при комнатной температуре.Pd2dba3 (102,6 мкмоль), 0,168 г S-Phos (409,3 мкмоль) и 0,61 г 2,6-дибромпиридина (2,57 ммоль). Реакционную смесь перемешивали 40 ч при температуре 105 С, охладили, разбавили 200 мл воды и экстрагировали 3 раза 20 мл CH2Cl2. Объединенные органические экстракты сушили над MgSO4 и выпарили. Неочищенный материал включал приблизительно 50% продукта 2,6-бис-[2-(метоксиметокси)-3(трифенилсилил)-1-нафтил]пиридина, как оценивали при помощи 1 Н ЯМР спектроскопии. Этот материал очистили колоночной хроматографией (диоксид кремния, гептан:ЕЮАс (15:1), Rf=0,12) и применяли без полной характеристики.(iv) Полученное в результате твердое вещество растворили в смести 20 мл концентрированной HCl,30 мл CHCl3 и 40 мл EtOH, и раствор кипятили с обратным холодильником в течение 24 ч. Реакционную смесь охладили до 0 С и затем осторожно разбавили концентрированным раствором NaOH. Затем добавили концентрированный раствор NH4Cl для поддержания значения рН 7-8. Продукт экстрагировали 3 раза 20 мл CH2Cl2. Объединенные органические экстракты сушили над MgSO4 и выпарили для обеспечения 1,11 г ONOH2 в виде грязно-белого твердого вещества (1,26 ммоль) с выходом 98%. Спектры ЯМР следующие:H ЯМР спектр ONOH2 можно видеть на фиг. 4. MS-FAB (м/з): 880,3 (М+). Анализ рассчитан для C61H44NO2Si2: С, 83,24; Н, 5,15. Обнаружено: С, 82,76; Н, 5,01. Получение OSOH2(2-SН 2). Применяя подобный подход к синтезу, что описан выше для ONOH2, лиганда OSOH2 получили из 3,48 г [3-(метоксиметокси)-2-нафтил](трифенил)силана (7,79 ммоль), 1,18 мл TMEDA (7,82 ммоль),6,3 мл sec-BuLi 1,3 М в гексане/циклогексане (8,18 ммоль), 1,06 г ZnCI2 (7,78 ммоль), 0,142 г Pd2dba3(155,0 мкмоль), 0,255 г S-Phos (621,2 мкмоль) и 0,94 г 2,5-дибромтиофена (3,89 ммоль). Выход (3(метоксиметокси)-4-5-[2-(метоксиметокси)-3-(трифенилсилил)-1-нафтил]тиен-2-ил-2 нафтил)(трифенил)силана после Pd-катализированного объединения был приблизительно 30% за 100 ч. После этапа снятия защитных групп и дополнительной обработки неочищенный OSOH2 восстановили в виде темно-синего порошка, который очистили пропусканием через небольшую подушку диоксида кремния (гептан :CH2Cl2 (1:1 для обеспечения 1,01 г бесцветного твердого вещества (1,14 ммоль) с выходом 98%. Спектры ЯМР были следующие: 1 Н ЯМР (500 МГц, CDCl3, 25C) (фиг. 6):7,89 (s, 2 Н), 7,76 (d, J=8,6 Hz, 2 Н), 7,73-7,69 (m, 14 Н),7,54-7,46 (m, 8H), 7,46-7,41 (m, 12H), 7,38-7,33 (m, 4H), 5,85 (s, 2H, OH). 13C ЯМР (125 МГц, CDCl3, 25C):155,7, 141,9, 137,6, 136,4, 135,4, 134,3, 130,9, 129,6, 128,7, 128,6,128,0, 127,9, 124,2, 123,6, 122,9, 112,1. Спектр 1 Н ЯМР OSOH2 представлен на фиг. 5, и молекулярная структура представлена на фиг. 6. Анализ рассчитан для C60H44O2SSi2: С, 81,41; Н, 5,01. Обнаружено: С, 80,56; Н, 4,87. Получение металлических комплексов. Синтез rac-ONOTi(CH2Ph)2. Трубку Schlenk загрузили 0,20 г ONOH2 (0,23 ммоль) и 0,094 г Ti(CH2Ph)4 (0,23 ммоль), затем в вакууме переместили 5 мл толуола. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали, выпарили и высушили в вакууме для получения 0,24 г rac-ONOTi(CH2Ph)2 в виде коричневато-красного микрокристаллического материала (0,22 ммоль) с выходом 95%. Молекулярную структуру титанового металлического комплекса можно увидеть на фиг. 7. Спектр ЯМР следующий: 1 Н ЯМР (500 МГц, толуол-d8, 70 С) (Фиг. 7):8,29 (s, 2 Н), 8,02 (m, 12 Н), 7,48 (d, J=8,2 Hz, 2H),7,34 (d, J=8,2 Hz, 2H), 7,32 (d, J=8,2 Hz, 2H), 7,23 (m, 12H), 7,13 (t, J=6,8 Hz, 2H), 7,06 (m, 2H), 6,99 (m,6H), 6,81 (t, J=8,2 Hz, 1H), 6,05 (t, J=7,5 Hz, 2H, CH2Ph), 5,94 (t, J=7,5 Hz, 4H, CH2Ph), 5,75 (d, J=7,5 Hz,4H, CH2Ph), 2,36 (brs, 4H, CH2Ph). 13C ЯМР (75 МГц, бензол-d6, 25 С):161,3, 151,0, 144,1, 142,3, 137,1, 137,0, 134,6, 133,1, 129,6,128,3, 128,1, 125,7, 125,2, 123,0, 122,9, 122,0, 121,9, 116,9 (три сигнала от четвертичных ароматических углеродов и один от СН 2 бензильных групп не наблюдали). Спектр 1 Н ЯМР титанового металлического комплекса можно увидеть на фиг. 8. Анализ рассчитан для C75H57NO2Ti: С, 81,28; Н, 5,18. Обнаружено: С, 80,89; Н, 4,97. Синтез ONOZr(CH2Ph)2. Применяя процедуру, подобную описанной выше, получили 0,12 г циркониевого комплекса (0,10 ммоль) с выходом 90%. Его получили из 0,10 г ONOH2 (0,11 ммоль) и 0,052 г Zr(CH2Ph)4 (0,11 ммоль). Синтез мезо-ONOHf(NMe2)2(NHMe2). Трубку Schlenk загрузили 0,11 г ONOH2 (0,12 ммоль) и 0,044 г Hf(NMe2)4 (0,12 ммоль), и 5 мл бензола переместили под вакуумом. Реакционную смесь перемешивали всю ночь при комнатной температуре, фильтровали, выпарили и высушили под вакуумом для получения 0,12 г комплексов гафния в виде желтого микрокристаллического материала (0,10 ммоль) с выходом 84%. Молекулярную структуру комплекса можно увидеть на фиг. 9. Результат ЯМР был следующим: 1 Н ЯМР (500 МГц, толуол-d8, 70 С):8,40-8,20 (br m, 2 Н), 7,98 (br m, 9 Н), 7,84 (brm, 2 Н), 7,55-7,30(br m, 7H), 7,28 (br m, 20H), 7,13 (br m, 3H), 3,13 (s, 12H, N/Me2), 2,27 (br s, 12H, NH/Me2) (сигнал от протонов NHMe2 не наблюдался). Анализ рассчитан для C67H62HfN4O2Si2: С, 67,63; Н, 5,25. Обнаружено: С, 66,01; Н, 4,99. Гомо- или сополимеризация этилена. Полимеризацию выполняли следующим образом. 300-мл стеклянный реактор высокого давления загрузили 80 мл только что дистиллированного толуола и необязательно сомономером под вспышкой аргона. Запустили механическое перемешивание(турбина Пельтона, 1000 rpm), затем реактор продули этиленом и загрузили раствором поглотителя, выбранного из МАО (моноаминоксидаза) или TIBAL (триизобутилалюминий), при атмосферном давлении,и затем сохраняли при желаемой температуре циркулированием воды в двойной стенке. Раствор тритила(если применяли) в 2 мл толуола ввели через шприц с последующим введением раствора предварительного катализатора в 2 мл толуола. Газовое давление в реакторе поддерживали непосредственно и сохраняли постоянным с обратным регулятором в течение эксперимента. Потребление этилена наблюдали через водомер Aalborg. После данного периода времени в реакторе снизили давление и реакцию погасили добавлением приблизительно 5 мл 10% раствора HCl в метаноле. Полимер дополнительно осадили добавлением 500 мл метанола, промыли и сушили под вакуумом всю ночь при комнатной температуре. Условия полимеризации представили в табл. I и результаты полимеризации представили в табл. II. Кат. 1 представляет собой rac-ONOTi(CH2Ph)2. Кат. 2 представляет собой ONOZr(CH2Ph)2. Мономером является этилен. Таблица I ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Лиганд общей формулы (I)Z' представляет собой атом N при n=1 или Z' представляет собой атом S при n=0;R2 представляет собой фенильную группу. 2. Способ получения лиганда по п.1, который включает следующие стадии: а) взаимодействие -нафтола формулы(ДМФ) и щелочного металл-алкила или щелочного металл-гидрида для получения соединения формулыb) подвергают реакции с (R2)3ZX', где X' представляет собой галоген, в присутствии sec-BuLi в растворителе для получения соединения формулы где Z' представляет собой S и n представляет собой 0 или Z' представляет собой N и n=1, X" представляет собой галоген (Cl, Br, I), в присутствии палладиевого или никелевого катализатора перекрестного сшивания для получения соединения формулыd) снимают защитные группы с соединения, полученного на этапе с), например, реакцией кислоты(например, HCl в CHCl3/EtOH), для получения лиганда общей формулы (I) 3. Способ по п.2, где щелочной металл-гидрид представляет собой NaH. 4. Металлический комплекс общей формулы-8 018925 получаемый реакцией металлирования лиганда по п.1 солью металла формулы MRn, где М представляет собой металл 4 группы Периодической таблицы, R представляет собой бензил или NMe2. 5. Металлический комплекс по п.4, где М представляет собой Zr, Ti, Hf. 6. Способ получения металлического комплекса по любому из пп.4, 5 реакцией соли металла MRn с лигандом по п.1 в растворителе. 7. Активная каталитическая система металла 4 группы, включающая металлический комплекс по любому одному из пп.4, 5 и активирующее средство с ионизирующим действием. 8. Способ гомо- или сополимеризации этилена и альфа-олефинов, который включает стадии, на которых: а) впускают активную каталитическую систему по п.7 в реактор;b) впускают мономер и необязательно сомономер в реактор одновременно с или после каталитической системы;c) поддерживают при условиях полимеризации;d) выделяют гомо- или сополимер этилена или альфа-олефина. 9. Способ по п.8, где мономером является этилен и сомономером, если присутствует, является 1 гексен.
МПК / Метки
МПК: C07F 7/08, C07F 7/00, C07F 7/28, C08F 10/00
Метки: бис-(нафтокси)тиофеновых, бис-(нафтокси)пиридиновых, альфа-олефинов, комплексы, лигандов, полимеризации, этилена, постметаллоценовые, основе
Код ссылки
<a href="https://eas.patents.su/13-18925-postmetallocenovye-kompleksy-na-osnove-bis-naftoksipiridinovyh-i-bis-naftoksitiofenovyh-ligandov-dlya-polimerizacii-etilena-i-alfa-olefinov.html" rel="bookmark" title="База патентов Евразийского Союза">Постметаллоценовые комплексы на основе бис-(нафтокси)пиридиновых и бис-(нафтокси)тиофеновых лигандов для полимеризации этилена и альфа-олефинов</a>
Предыдущий патент: Способ получения 2′-дезокси-5-азацитидина (децитабина)
Следующий патент: Циклические гуанидиновые производные, способ их получения и применения
Случайный патент: Безопасный шприц












