Высокочистый 17α-цианометил-17β-гидроксиэстра-4,9-диен-3-он и способ его синтеза
Номер патента: 14558
Опубликовано: 30.12.2010
Авторы: Махо Шандор, Хорват Янош, Данчи Лайошне, Араньи Антал
Формула / Реферат
1. Способ синтеза 17a-цианометил-17b-гидроксиэстра-4,9-диен-3-она (диеногест) формулы (I)
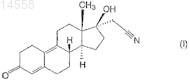
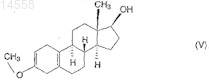
из 3-метокси-17-гидроксиэстра-2,5(10)-диена формулы (V)
характеризующийся:
i) взаимодействием 3-метокси-17-гидроксиэстра-2,5(10)-диена формулы (V) с изопропилатом алюминия в присутствии циклогексанона в инертном органическом растворителе при нагревании,
ii) последующим взаимодействием полученного таким образом 3-метоксиэстра-2,5(10)-диен-17-она формулы (IV)
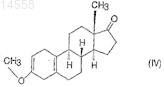
с цианометиллитием при температуре между 0 и -30°С,
iii) последующим взаимодействием полученного 3-метокси-17a-цианометил-17b-гидроксиэстра-2,5(10)-диена формулы (III)
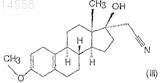
с сильной органической кислотой в тетрагидрофурановом растворе,
iv) взаимодействием полученного 17a-цианометил-17b-гидроксиэстр-5(10)-ен-3-она формулы (II)
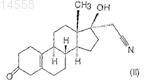
с 1-1,5 экв. пиридиний трибромида в пиридиновом растворе при температуре между 0 и 60°С,
последующей очисткой полученного сырого диеногеста формулы (I) перекристаллизацией и препаративной ВЭЖХ.
2. Способ по п.1, характеризующийся выполнением окисления на стадии i) в толуоле в присутствии 20-25 экв. циклогексанона при температуре между 100 и 120°С.
3. Способ по любому из предшествующих пунктов, характеризующийся получением цианометиллитиевого реагента на стадии ii) in situ из гексиллития и ацетонитрила.
4. Способ по любому из пп.1-3, характеризующийся выполнением реакции цианометилирования на стадии ii) при температуре между 0 и -30°С.
5. Способ по любому из пп.1-4, характеризующийся выполнением реакции цианометилирования на стадии ii) при температуре между -10 и -20°С.
6. Способ по любому из пп.1-5, характеризующийся использованием 2 экв. цианометиллитиевого реагента на стадии ii).
7. Способ по любому из пп.1-6, характеризующийся выполнением кислотной обработки на стадии iii) двух- или трехосновной органической кислотой в тетрагидрофуране.
8. Способ по любому из пп.1-7, характеризующийся выполнением кислотной обработки на стадии iii) 2 экв. дигидрата щавелевой кислоты.
9. Способ по любому из пп.1-8, характеризующийся взаимодействием соединения формулы (II) с 1,05 экв. пиридиний трибромида на стадии iv).
10. Способ по любому из пп.1-9, характеризующийся взаимодействием соединения формулы (II) с пиридиний трибромидом при температуре между 0 и 60°С на стадии iv).
11. Способ по любому из пп.1-10, характеризующийся взаимодействием соединения формулы (II) с пиридиний трибромидом при температуре между 25 и 50°С на стадии iv).
12. Способ по любому из пп.1-11, характеризующийся очисткой диеногеста формулы (I) методом ВЭЖХ с использованием силикагеля в качестве адсорбента.
13. Способ по любому из пп.1-12, характеризующийся очисткой диеногеста формулы (I) методом ВЭЖХ с использованием следующих смесей растворителей в качестве элюентов: 70:30 дихлорметан/этилацетат, или 80:20 дихлорметан/трет-бутилметиловый эфир, или 90:10 дихлорметан/ацетон.
14. Способ по любому из пп.1-13, характеризующийся перекристаллизацией диеногеста формулы (I), полученного с помощью препаративной ВЭЖХ, из этилацетата, ацетона, трет-бутилметилового эфира, диизопропилового эфира, ацетонитрила, метанола, этанола или смесей этих растворителей с водой в различных соотношениях.
Текст
Настоящее изобретение относится к новому способу синтеза высокочистого 17-цианометил 17-гидроксиэстра-4,9-диен-3-она (далее по тексту диеногест) формулы (I) из 3-метокси-17 гидроксиэстра-2,5(10)-диена формулы (V). Настоящее изобретение относится также к высокочистому 17-цианометил-17-гидроксиэстра-4,9-диен-3-ону и фармацевтическим композициям,содержащим его в качестве активного ингредиента. Фармацевтические композиции по настоящему изобретению содержат высокочистый диеногест формулы (I), в котором общее количество примесей составляет менее 0,1%, в то время как количество 4-бром-диеногеста находится ниже предела обнаружения (0,02%), в качестве активного ингредиента или по меньшей мере одного из активных ингредиентов и дополнительные вещества, обычно используемые на практике, такие как носители, наполнители или разбавители. Согласно настоящему изобретению диеногест формулы (I) синтезируют следующим образом: i) 3-метокси-17-гидроксиэстра-2,5(10)-диен формулы(V) подвергают взаимодействию с изопропилатом алюминия в присутствии циклогексанона в инертном органическом растворителе при нагревании; ii) полученный таким образом 3 метоксиэстра-2,5(10)-диен-17-он формулы (IV) подвергают взаимодействию с цианометиллитием при температуре между 0 и -30 С; iii) полученный 3-метокси-17-цианометил-17 гидроксиэстра-2,5(10)-диен формулы (III) подвергают взаимодействию с 1-1,5 экв. сильной органической кислоты в тетрагидрофурановом растворе; iv) полученный 17-цианометил-17 гидроксиэстр-5(10)-ен-3-он формулы (II) подвергают взаимодействию с 1-1,5 экв. пиридиний трибромида в пиридиновом растворе при температуре между 0 и 60 С, затем полученный сырой диеногест формулы (I) очищают перекристаллизацией и препаративной ВЭЖХ. 014558 Область техники, к которой относится изобретение Настоящее изобретение относится к новому способу синтеза высокочистого 17-цианометил-17 гидроксиэстра-4,9-диен-3-она (далее по тексту диеногест) формулы (I) Данное соединение используется в качестве активного ингредиента в контрацептивных фармацевтических композициях как прогестогенный компонент, в гормон-заместительной терапии, а также в композициях против эндометриоза. Настоящее изобретение относится также к высокочистому 17 цианометил-17-гидроксиэстра-4,9-диен-3-ону и фармацевтическим композициям, содержащим его в качестве активного ингредиента. Фармацевтические композиции по настоящему изобретению содержат высокочистый диеногест согласно настоящему изобретению в качестве активного ингредиента или по меньшей мере одного из активных ингредиентов и дополнительные вещества, обычно используемые на практике, такие как носители, наполнители или разбавители. В данном описании высокочистый диеногест означает, что общее количество примесей составляет менее 0,1%, в то время как количество 4-бром-диеногеста находится ниже предела обнаружения (0,02%). Уровень техники Известная методика синтеза диеногеста формулы (I) использует в качестве исходного материала интермедиаты общего синтеза эстрона. Главное различие между известными методиками состоит в том,что две двойные связи, характеристичные для целевого соединения, уже присутствуют в исходном веществе или нет, и в последнем случае они образуются на последней стадии синтеза. В соответствии с патентной заявкой Германии DD 132497 3-метокси-17-спиро-1',2'-оксиран-эстра 2,5(10)-диен подвергают взаимодействию с цианидом щелочного металла с получением производного 17-цианометил-17-гидрокси-3-енолэфира. Затем полученное таким образом соединение гидролизуют,бромируют и дегидробромируют, получая диеногест формулы (I) с выходом 32%. Чистоту полученного диеногеста характеризуют температурой плавления (204-214 С) и оптическим вращением ([]D25=-290,пиридин, с=0,5%). Согласно способу, описанному в патентной заявке DD 80023, 3-метокси-17-спиро 1',2'-оксиран-эстра-2,5(10)-диен, использующийся как исходное вещество, можно синтезировать реакцией диметилсульфоний метилида и 17-оксо производного, полученного окислением по Оппенауэру 17 гидроксигруппы 3-метокси-17-гидроксиэстра-2,5(10)-диена формулы (V), при этом последний синтезируют известными способами. Способ, описанный в патентной заявке Германии DD 160418, является модификацией вышеописанного способа, в котором сначала соединение формулы (V) превращают в 3,3-диметокси-17-гидроксиэстр 5(10)-ен, 17 гидроксигруппу окисляют пиридиний хлорхроматом - вместо окисления по Оппенауэру затем формируют 17-спиро-1',2'-оксиран взаимодействием с диметилсульфоний метилидом, и последний подвергают взаимодействию с цианидом щелочного металла, получая 3,3-диметокси-17 цианометил-17-гидроксиэстр-5(10)-ен. Полученное вещество гидролизуют с помощью серной кислоты с получением 17-цианометил-17-гидроксиэстр-5(10)-ена, из которого после бромирования и последующего дегидробромирования получают диеногест с выходом 48%. Общий выход по данному способу составляет 24%. Патентная заявка Германии DD 296495 описывает синтез в одном реакционном сосуде, в соответствии с которым сначала исходный кето-стероид - положение 3 которого содержит гидрокси или оксо группу, защищенную одной или более алкоксигруппой - подвергают взаимодействию с цианометил литием, образующимся in situ в реакции литийалкилов или литийдиалкиламидов с ацетонитрилом в органическом растворителе при низкой температуре. Таким образом, из 17 оксо группы формируют 17 гидрокси и 17-цианометил группу, полученную реакционную смесь обрабатывают водой, полученное 17 гидрокси-17-цианометильное производное выделяют или превращают в диеногест непосредственным гидролизом в кислой среде. Выход конечного продукта составляет 82% исходя из 3,3-диметоксиэстра 5(10),9(11)-диен-17-она, в то время как при использовании в качестве исходного вещества 3,3-(1,3 пропилендиокси)эстра-5(10),9(11)-диенового производного выход составляет 80%. Чистоту полученного продукта характеризовали по температуре плавления: 208-211,5 С. Данный синтез состоит из 6 стадий,включая получение 17-оксо производного, используемого в качестве исходного вещества.-1 014558 В соответствии с патентной заявкой ЕР 0776904 3,3-(2,2-диметилпропилен-1,3-диокси)-4,5 секоэстр-9-ен-5,17-дион сначала переводят в эстра-4,9-диен-3,17-дион, а последний - в 3,3 этилендиоксиэстра-5(10),9(1)-диен-17-он. После взаимодействия с диметилсульфоний иодидом получают 17-спиро-1',2'-оксирановое производное, которое реагирует с цианидом калия с образованием 17 цианометил-17-гидроксиэстра-5(10),9(11)-диен-3-этиленкеталя. Кетальную группу данного соединения гидролизуют с помощью соляной кислоты с получением конечного продукта диеногеста с чистотой 98%. Согласно данным способам, исходя из упомянутого выше 3-метокси-17-гидроксиэстра-2,5(10)диена формулы (V) сначала образуется 3,3-диалкоксикетал-5(10)-еновое производное, затем последнее окисляют в кето-соединение, которое подвергают взаимодействию с диметилсульфоний-метилидом, получая 17-спиро-1',2'-оксирановое производное, и его превращают в 17-цианометил-17-гидрокси производное. Полученное соединение гидролизуют с помощью кислоты, затем бромируют и дегидробромируют, получая диеногест формулы (I) в 6 стадий. Согласно другому способу, также исходя из соединения формулы (V), после окисления по Оппенауэру гидроксильной группы в положении 17 синтезируют 17-спиро-1',2'-оксирановое производное,которое подвергают взаимодействию с цианидом щелочного металла, полученный 3-енолэфир гидролизуют, бромируют и дегидробромируют, получая диеногест в 5 стадий. Согласно другому упомянутому выше способу 3,3-этилендиоксиэстра-5(10),9(11)-диен-17-он либо непосредственно подвергают взаимодействию с цианометиллитием, либо сначала формируют спирооксиран и раскрывают оксирановый цикл цианидом щелочного металла с получением 17-цианометил 17-гидрокси производного, которое гидролизуют с получением конечного продукта формулы (I). Синтезы 17-спиро-1',2'-оксирановых производных исходя из 17-кето соединений и диметилсульфониевых производных согласно способам, описанным в патентных заявках DD 132497 и ЕР 0776904,дороги и опасны для окружающей среды. Использование цианидов щелочных металлов для раскрытия оксиранового цикла требует строгого соблюдения инструкций техники безопасности и приводит к проблемам для окружающей среды после обработки реакционных смесей. В указанных выше заявках на патенты качество продукта характеризовали только по температуре плавления или, в лучшем случае, по содержанию вещества. Последние требования фармакопеи устанавливают несколько других способов определения количества вещества и примесей, такие как тонкослойная или жидкостная хроматография, а также определяют и ограничивают количество и число примесей. Сущность изобретения Задачей авторов было устранить упомянутые выше недостатки известных методик и разработать более короткий, экономичный и благоприятный для окружающей среды синтез, который может проводиться в промышленном масштабе, предпочтительно с использованием интермедиата общего синтеза эстрона, 3-метокси-17-гидроксиэстра-2,5(10)-диена формулы (V) как исходного вещества. Другой задачей авторов было синтезировать высокочистый продукт, в котором общее количество примесей составляет менее 0,1%, в то время как количество 4-бром-диеногеста находится ниже предела обнаружения (0,02%), таким образом данный продукт подходит для производства различных готовых лекарственных форм. Неожиданно было обнаружено, что при использовании соединения формулы (V) в качестве исходного вещества для синтеза соединения формулы (III) не является необходимым образование 17 оксиранового производного с последующим раскрытием эпоксидного цикла цианидом щелочного металла, а также не требуется синтезировать 3,3-диалкоксикеталь из енолэфирной группы соединения формулы (V) и окислять гидроксильную группу в положении 17 пиридиний хлорхроматом. При использовании условий реакции по настоящему изобретению соединение формулы (V) можно окислить по Оппенауэру с хорошим выходом (90%), не затрагивая кольцо А (ароматизация). Таким образом, авторам удалось разработать 4-стадийный синтез, который короче известных методик. По настоящему изобретению диеногест формулы (I) синтезируют следующим образом:i) 3-метокси-17-гидроксиэстра-2,5(10)-диен формулы (V) подвергают взаимодействию с изопропилатом алюминия в присутствии циклогексанона в инертном органическом растворителе при нагревании,ii) полученный таким образом 3-метоксиэстра-2,5(10)-диен-17-он формулы (IV) подвергают взаимодействию с цианометиллитием при температуре между 0 и -30 С,iii) полученный 3-метокси-17-цианометил-17-гидроксиэстра-2,5(10)-диен формулы (III) подвергают взаимодействию с сильной органической кислотой в тетрагидрофурановом растворе,iv) полученный 17-цианометил-17-гидроксиэстр-5(10)-ен-3-он формулы (II) подвергают взаимодействию с 1-1,5 эквивалентами пиридиний трибромида в пиридиновом растворе при температуре между 0 и 60 С,затем полученный сырой диеногест формулы (I) очищают перекристаллизацией и препаративной ВЭЖХ. Стадию ii) предпочтительно выполняют при температуре между -10 и 20 С, в то время как стадиюiv) - между 25 и 50 С, используя 1,05 эквивалента пиридиний трибромида. Перекристаллизацию предпочтительно проводят с использованием ацетона, этилацетата, ацетонитрила, метанола, этанола или смесей этих растворителей с водой в различных соотношениях, а также смесей дихлорметана и диизопропилового эфира или изопропанола или трет-бутилметилового эфира в различных соотношениях. Для достижения высокой чистоты полученный таким образом перекристаллизованный продукт дополнительно очищают препаративной ВЭЖХ с использованием силикагеля как адсорбента и различных систем растворителей в качестве элюентов, таких как дихлорметан/этилацетат, дихлорметан/третбутилметиловый эфир или дихлорметан/ацетон. Из элюата упаривают дихлорметан и полученный высокочистый диеногест выделяют из другого компонента используемой системы растворителей, например этилацетата, трет-бутилметилового эфира, ацетона или диизопропилового эфира, метанола, этанола или смесей этих растворителей с водой в различных соотношениях. Настоящий процесс имеет следующие преимущества: синтез может выполняться в промышленном масштабе; увеличение масштаба загрузки по сравнению с масштабом, описанным в примерах, не вызывает технических проблем и не влияет на чистоту конечного продукта,исходное вещество для синтеза, 3-метокси-17-гидроксиэстра-2,5(10)-диен формулы (V), является легкодоступным промышленным продуктом,синтез состоит из меньшего количества стадий (всего 4), чем процессы, известные в литературе (56-8 стадий),при использовании условий реакций по настоящему изобретению выходы в реакционных стадиях указанного синтеза намного выше, чем известные в предшествующем уровне техники. Выход на каждой стадии превышает 80%, поэтому общий выход составляет более 50%,качество получаемого высокочистого диеногеста выше, чем требования к качеству согласно фармакопеи. Количество примесей определено методом ВЭЖХ. Согласно данным измерений, общее количество примесей в данном продукте составляет менее 0,1%, и количество 4-бром-диеногеста, который является примесью, детектируемой в продажных фармацевтических композициях в количествах выше 0,1%,находится ниже предела обнаружения (0,2%). В реакции цианометилирования не используются цианиды щелочных металлов и диметилсульфониевые производные, что соответствует требованиям охраны окружающей среды и экономическим соображениям, а также не используется дорогой и опасный бутиллитий - вместо них используется гексановый раствор гексиллития. Способ по настоящему изобретению проиллюстрирован следующими неограничивающими примерами. Пример 1. 3-Метоксиэстра-2,5(10)-диен-17-он. К перемешиваемому раствору 106,3 г (0,52 моль) изопропоксида алюминия в 2000 мл сухого толуола добавили 720 мл циклогексанона, 0,35 г 2,6-дитрет-бутил-4-метилфенола и 100 г (0,307 моль) 3 метокси-17-гидроксиэстра-2,5(10)-диена, затем реакционную смесь перемешивали при 108-110 С в течение 1 ч. Контроль за реакцией осуществляли методом ТСХ. По окончании реакции смесь охладили до 2025 С, добавили 200 мл воды и полученную таким образом смесь перемешивали в течение 1 ч. Выпавший осадок гидроксида алюминия отфильтровали и фильтрат упарили при пониженном давлении до объема 250 мл. Смесь 200 мл метанола и 100 мл воды добавили к данному концентрированному теплому (около 60 С) раствору, полученную суспензию охладили до 20-25 С и перемешивали в течение 1 ч. Выпавший в-3 014558 осадок кристаллический продукт отфильтровали и высушили в вакууме при температуре не выше 40 С,получив 76,4 г (87%) указанного в заголовке продукта. Чистота: мин. 98% (ВЭЖХ). Температура плавления: 106-110 С. Пример 2. 3-Метокси-17-цианометил-17-гидроксиэстра-2,5(10)-диен. 410 мл (1,012 моль) 2,5 М раствора гексиллития разбавили 300 мл сухого тетрагидрофурана, раствор охладили до -20 С и добавили 58 мл (1,112 моль) ацетонитрила. К полученной таким образом суспензии цианометиллития добавили раствор 144,8 г (0,506 моль) 3-метоксиэстра-2,5(10)-диен-17-она в 1450 мл тетрагидрофурана при температуре между -20 и -10 С и перемешивали полученную реакционную смесь при температуре между -20 и -10 С до завершения реакции - контроль по ТСХ. По окончании реакции добавили 640 мл воды, отделили органическую фазу, промыли дважды 60 мл воды и упарили при пониженном давлении до объема 720 мл. Концентрированный раствор охладили до 20-25 С, добавили 720 мл воды, выпавший в осадок кристаллический продукт отфильтровали и высушили в вакууме при температуре не выше 40 С. Полученный сырой продукт перекристаллизовали из этанола, получив 143,4 г(86,5%) указанного в заголовке продукта. Чистота: мин. 98% (ВЭЖХ). Температура плавления: 145-150 С. Пример 3. 17-Цианометил-17-гидроксиэстр-5(10)-ен-3-он. К перемешиваемому раствору 100,8 г (0,8 моль) дигидрата щавелевой кислоты в 560 мл воды добавили при охлаждении раствор 131 г (0,4 моль) 17-цианометил-17-гидрокси-3-метоксиэстра-2,5(10)диена в 1050 мл тетрагидрофурана. После перемешивания при 20-25 С в течение 1 ч выпавший в осадок продукт отфильтровали и высушили в вакууме при температуре не выше 50 С. Полученный сырой продукт перекристаллизовали из этилацетата, получив 107 г (85,6%) указанного в заголовке продукта. Чистота: мин. 98% (ВЭЖХ). Температура плавления: 170-175 С. Пример 4. 17-Цианометил-17-гидроксиэстра-4,9-диен-3-он (сырой диеногест). Перемешиваемый раствор 142 г (0,45 моль) 17-цианометил-17-гидроксиэстр-5(10)-ен-3-она в 850 мл пиридина охладили до 20-25 С и добавили раствор 150 г (0,47 моль) пиридиний трибромида в 640 мл пиридина, постепенно повышая температуру реакционного раствора до 50 С. После перемешивания в течение 1 ч реакционную смесь добавили при перемешивании к смеси 320 мл концентрированной серной кислоты и 5600 мл воды. Выпавшие в осадок кристаллы отфильтровали и высушили в вакууме при температуре не выше 60 С. Полученный сырой продукт перекристаллизовали из ацетона, получив 116 г (83%) указанного в заголовке продукта. Количество активного компонента: мин. 97% (ВЭЖХ). Примесь 4-бром-диеногеста: мкс. 1% (ВЭЖХ). Температура плавления: 210-213 С.[]20D=-318 (с=1%, дихлорметан). Пример 5. Очистка диеногеста препаративной ВЭЖХ. Металлическую колонку динамического аксиального сжатия (диаметр: 5 см; длина: 60 см) заполняли 510 г силикагеля (Uetikon C-gel С-490, размер частиц: 15-35 мкм), суспендированного в 1400 мл дихлорметана, и колонку кондиционировали со смесью 70:30 дихлорметан/этилацетат (2500 мл). В колонку вводили шприцом раствор 8,5 г сырого диеногеста в 210 мл дихлорметана и элюировали указанной выше системой растворителей при скорости потока 85 мл/мин. Для детектирования использовали УФдетектор. Фракции, содержащие чистое вещество (3600 мл), концентрировали, из остатка упаривали этилацетат и полученный диеногест перекристаллизовывали из этилацетата, получая после сушки в вакууме при температуре не выше 60 С 7,53 г (90,6%) чистого диеногеста. Общее количество примесей: максимально 0,1% (ВЭЖХ). Индивидуальные примеси: максимально 0,02% (ВЭЖХ). Температура плавления: 211-214 С.[]20D=-322 (с=1%, дихлорметан). Пример 6. Очистка диеногеста препаративной ВЭЖХ. Стеклянную колонку (диаметр: 2,6 см; длина: 46 см) заполняли 120 г силикагеля (Uetikon C-gel С 490, размер частиц: 15-35 мкм) и колонку кондиционировали с элюентом, представляющим собой смесь 90:10 дихлорметан/ацетон. В колонку вводили шприцом раствор 2 г сырого диеногеста в 50 мл дихлорметана и элюировали указанной выше системой растворителей при скорости потока 10 мл/мин. Для детектирования использовали УФ-детектор. Фракции, содержащие чистое вещество (700 мл), концентрировали, из остатка упаривали ацетон и полученный диеногест перекристаллизовывали из ацетона, получая после сушки в вакууме при температуре не выше 60 С 1,77 г (88,5%) чистого диеногеста. Общее количество примесей: максимально 0,1% (ВЭЖХ). Индивидуальные примеси: максимально 0,02% (ВЭЖХ). Температура плавления: 211-214 С.[]20D=-322 (с=1%, дихлорметан). Пример 7. Очистка диеногеста препаративной ВЭЖХ. Стеклянную колонку (диаметр: 2,6 см; длина: 46 см) заполняли 120 г силикагеля (Uetikon C-gel С 490, размер частиц: 15-35 мкм), колонку кондиционировали с элюентом, представляющим собой смесь 90:10 дихлорметан/ацетон. В колонку вводили шприцом раствор 2 г сырого диеногеста в 50 мл дихлорметана и элюировали указанной выше системой растворителей при скорости потока 10 мл/мин. Для детектирования использовали УФ-детектор. Фракции, содержащие чистое вещество (700 мл), концентрировали, из остатка упаривали ацетон и полученный диеногест перекристаллизовывали из ацетона, получая после сушки в вакууме при температуре не выше 60 С 1,77 г (88,5%) чистого диеногеста. Общее количество примесей: максимально 0,1% (ВЭЖХ). Индивидуальные примеси: максимально 0,02% (ВЭЖХ). Температура плавления: 211-214 С.i) взаимодействием 3-метокси-17-гидроксиэстра-2,5(10)-диена формулы (V) с изопропилатом алюминия в присутствии циклогексанона в инертном органическом растворителе при нагревании,ii) последующим взаимодействием полученного таким образом 3-метоксиэстра-2,5(10)-диен-17-она формулы (IV) с цианометиллитием при температуре между 0 и -30 С,iii) последующим взаимодействием полученного 3-метокси-17-цианометил-17-гидроксиэстра 2,5(10)-диена формулы (III) с сильной органической кислотой в тетрагидрофурановом растворе,iv) взаимодействием полученного 17-цианометил-17-гидроксиэстр-5(10)-ен-3-она формулы (II) с 1-1,5 экв. пиридиний трибромида в пиридиновом растворе при температуре между 0 и 60 С,последующей очисткой полученного сырого диеногеста формулы (I) перекристаллизацией и препаративной ВЭЖХ. 2. Способ по п.1, характеризующийся выполнением окисления на стадии i) в толуоле в присутствии 20-25 экв. циклогексанона при температуре между 100 и 120 С. 3. Способ по любому из предшествующих пунктов, характеризующийся получением цианометиллитиевого реагента на стадии ii) in situ из гексиллития и ацетонитрила.-5 014558 4. Способ по любому из пп.1-3, характеризующийся выполнением реакции цианометилирования на стадии ii) при температуре между 0 и -30 С. 5. Способ по любому из пп.1-4, характеризующийся выполнением реакции цианометилирования на стадии ii) при температуре между -10 и -20 С. 6. Способ по любому из пп.1-5, характеризующийся использованием 2 экв. цианометиллитиевого реагента на стадии ii). 7. Способ по любому из пп.1-6, характеризующийся выполнением кислотной обработки на стадииiii) двух- или трехосновной органической кислотой в тетрагидрофуране. 8. Способ по любому из пп.1-7, характеризующийся выполнением кислотной обработки на стадииiii) 2 экв. дигидрата щавелевой кислоты. 9. Способ по любому из пп.1-8, характеризующийся взаимодействием соединения формулы (II) с 1,05 экв. пиридиний трибромида на стадии iv). 10. Способ по любому из пп.1-9, характеризующийся взаимодействием соединения формулы (II) с пиридиний трибромидом при температуре между 0 и 60 С на стадии iv). 11. Способ по любому из пп.1-10, характеризующийся взаимодействием соединения формулы (II) с пиридиний трибромидом при температуре между 25 и 50 С на стадии iv). 12. Способ по любому из пп.1-11, характеризующийся очисткой диеногеста формулы (I) методом ВЭЖХ с использованием силикагеля в качестве адсорбента. 13. Способ по любому из пп.1-12, характеризующийся очисткой диеногеста формулы (I) методом ВЭЖХ с использованием следующих смесей растворителей в качестве элюентов: 70:30 дихлорметан/этилацетат, или 80:20 дихлорметан/трет-бутилметиловый эфир, или 90:10 дихлорметан/ацетон. 14. Способ по любому из пп.1-13, характеризующийся перекристаллизацией диеногеста формулы(I), полученного с помощью препаративной ВЭЖХ, из этилацетата, ацетона, трет-бутилметилового эфира, диизопропилового эфира, ацетонитрила, метанола, этанола или смесей этих растворителей с водой в различных соотношениях.
МПК / Метки
МПК: C07J 41/00
Метки: синтеза, 17α-цианометил-17β-гидроксиэстра-4,9-диен-3-он, высокочистый, способ
Код ссылки
<a href="https://eas.patents.su/7-14558-vysokochistyjj-17alpha-cianometil-17beta-gidroksiestra-49-dien-3-on-i-sposob-ego-sinteza.html" rel="bookmark" title="База патентов Евразийского Союза">Высокочистый 17α-цианометил-17β-гидроксиэстра-4,9-диен-3-он и способ его синтеза</a>
Предыдущий патент: Связующее, способное свариваться антикоррозионное средство и деталь
Следующий патент: Способ получения (s)-n-метил-3-(1-нафтилокси)-3-(2-тиенил)пропиламина гидрохлорида (дулоксетина)
Случайный патент: Замещенные производные азоантрацена, фармацевтические композиции и способы их применения











