Способ синтеза производных (1h)-бензо[c]хинолизин-3-онов
Номер патента: 3997
Опубликовано: 25.12.2003
Авторы: Гуарна Антонио, Оккьято Эрнесто Джованни, Серио Марио
Формула / Реферат
1. Способ получения соединений формулы (I)

в которой R1, R2, R3, R4, R5, одинаковые или различные, выбраны из группы, включающей H, C1-8алкил, C2-8алкенил, C2-8алкинил, C3-9циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, галоген, CN, азид, NRR', C1-8алкиламино, ариламино, C1-8алкилокси, арилокси, COOR, CONRR', где R и R', одинаковые или различные, выбраны из группы, включающей H, C1-8алкил, C3-9циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, арилC1-8алкил;
Q выбран из группы, включающей простую связь, C1-8алкил, C2-8алкенил, C2-8алкинил, C3-9циклоалкил, CO, CONR, NR, где R имеет вышеуказанные значения;
W выбран из группы, включающей H, C1-8алкил, C2-8алкенил, C2-8алкинил, C3-9циклоалкил, трифторметил, C1-8алкокси, C1-8алкоксиC1-8алкил, арилC1-8алкил, арил, арилокси, ариламино, C1-8алкилкарбонил, арилкарбонил, арилкарбоксил, арилкарбоксиамид, галоген, CN, NRR', C1-8алкиламино, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, где группы алкил, алкенил, алкинил, C3-9циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, могут быть замещёнными галогеном, OR, фенилом, NRR', CN, COOR, CONRR', C1-8алкилом (где R и R' имеют указанные выше значения); причем арил представляет собой фенил и нафтил,
n представляет целое число от 1 до 4;
и их фармацевтически приемлемых солей или сложных эфиров,
по которому тиоамид 3

(в котором R3 и R4 имеют вышеуказанные значения) N-алкилируют винилкетоном формулы 2

(в котором R1, R2 и R5 имеют вышеуказанные значения), получая соответствующее соединение 4
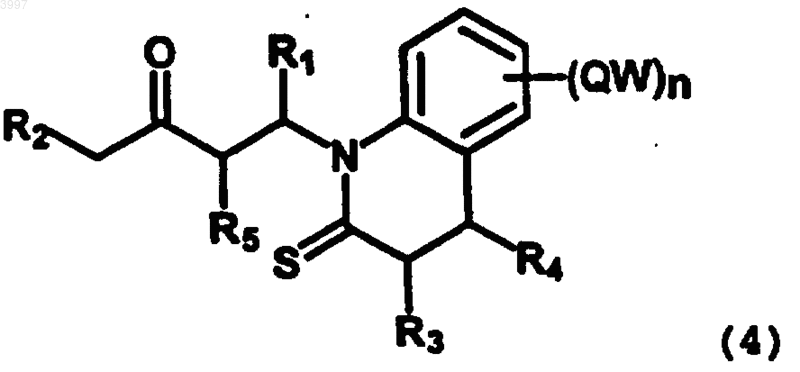
(в котором все заместители имеют вышеуказанные значения), которое метилируют по атому серы, получая соль 5
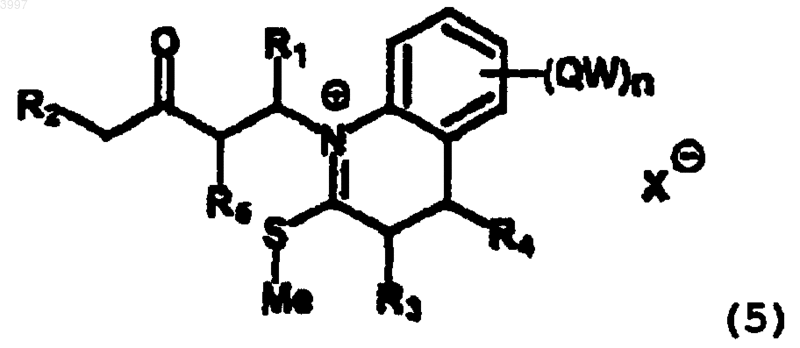
(в которой все заместители имеют вышеуказанные значения), которую непосредственно подвергают реакции с основанием с получением желаемого соединения I.
2. Способ по п.1, в котором реакцию между соединениями 2 и 3 проводят в органическом растворителе в присутствии сильного, но ненуклеофильного основания.
3. Способ по п.1 или 2, в котором конечную стадию циклизации проводят в органическом растворителе в присутствии сильного, но ненуклеофильного основания.
4. Способ по п.2, в котором основанием является K2CO3/18-краун-6 или диазабициклоундецен (ДБУ).
5. Способ по п.3, в котором основанием является диазабициклоундецен (ДБУ).
6. Способ по п.2, в котором растворителем является ТГФ.
7. Способ по пп.1 и 3, в котором метилирующим агентом является диметилсульфат, а растворителем - толуол и процесс проводят при температуре дефлегмации.
8. Способ по п.7, в котором общее время реакции составляет в пределах 1/2-1 ч.
9. Способ по пп.1-8, в котором соединением формулы (I) является
2,3,5,6-тетрагидро-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-8-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1-метил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-4-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,8-диметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-1-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,4-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-6-метил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-6-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-6,8-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,6-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,6-диметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-4,6-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,6,8-триметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-1,6-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,4,6-триметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-5-метил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-5-метил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-5,8-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,5-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,5-диметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-4,5-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,5,8-триметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-1,5-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,4,5-триметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-5,6-диметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-5,6-диметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-5,6,8-триметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,5,6-триметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-4,5,6-триметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-1,5,6-триметил-(1H)-бензо[c]хинолизин-3-он;
8-хлор-2,3,5,6-тетрагидро-1,5,6-триметил-(1H)-бензо[c]хинолизин-3-он;
2,3,5,6-тетрагидро-4,5,6,8-тетраметил-(1H)-бензо[c]хинолизин-3-он.
Текст
1 Краткое описание изобретения Настоящее изобретение относится к способу получения производных (1 Н)-бензо[с]хинолизин-3-онов общей формулы (I), включающего всего три стадии, и к применению в качестве исходных продуктов промышленно доступных или легко синтезируемых соединений. Соединения формулы (I) полезны в качестве ингибиторов 5-редуктаз. Область изобретения Настоящее изобретение относится к способу получения производных (1 Н)-бензо[с]хинолизин-3-онов общей формулы (I)n представляет целое число от 1 до 4; и их фармацевтически приемлемым солям или сложным эфирам, исходя из промышленно доступных или легко синтезируемых соединений, и включающему всего три стадии. Уровень техники Соединения общей формулы (I), определенные выше, известны как ингибиторы 5 редуктаз, полезные для лечения опосредуемых ферментами патологических состояний (например, угрей, алопеции (облысения), рака и гипертрофии предстательной железы у мужчин и гирсутизма у женщин) (см. международную патентную заявкуРСТ/ЕР 97/00552). Они также активны в качестве регуляторов роста растений. Как описано в вышеуказанной патентной заявке, до сих пор соединения формулы (I) получают способом, включающим различные стадии, исходя из соединения формулы II 2 Согласно этому способу, соединение (II) с амидной группой защищают в виде N-Bocпроизводного, полученное соединение восстанавливают по реакции с силилоксидиеном, получаемым "на месте", и гидролизуют, получая соединение формулы III Наконец, введение двойной связи в положение b осуществляют по реакции с дихлордицианохиноном и соответствующими силиленолэфирами или окислением ацетатом ртути. Можно заметить, что вышеуказанный способ включает много стадий, что тем самым оказывает отрицательное воздействие на конечные выходы целевых соединений. Ввиду важности этих соединений в качестве ингибиторов 5-редуктаз, очевиден интерес к разработке новых доступных способов получения желаемых соединений более эффективным путм. Подробное описание изобретения Данное изобретение позволяет преодолеть вышеуказанные проблемы с помощью способа синтеза, включающего всего три стадии, и, кроме того, использования в качестве исходных продуктов соединений, которые могут быть легко синтезированы или промышленно доступны. Согласно данному изобретению в соединениях формулы (I) группы С 1-8 алкил, С 2-8 алкенил и С 2-8 алкинил представляют линейные или разветвлнные алкильные радикалы, как например: метил, этил, пропил, изопропил, бутил,пентил, гексил, гептил, октил, этилен, пропен,бутен, изобутен, ацетилен, пропин, бутин и т.д. Термин циклоалкил обозначает: циклопропан, циклобутан, циклопентан, циклогексан,циклогептан, циклооктан, норборнан, камфан,адамантан. Термин арил обозначает: фенил и нафтил. Термин гетероцикл обозначает, в частности: насыщенные или ароматические гетероциклы, содержащие один или более атомов N,более конкретно: пиридин, имидазол, пиррол,индол, триазолы, пирролидин, пиперидин. Галоген обозначает: фтор, хлор, бром, иод. Заместителями вышеуказанной группы W предпочтительно являются: галоген, OR, фенил,NRR', CN, COOR, CONRR', C1-8 алкил (где R и R' имеют вышеуказанные значения). В частности,способ согласно данному изобретению позволяет получить соединения формулы (I), в которой:R1, R2, R3, R4, R5 = Н, Me, CN, фенил,COOR, CONRR' (где R и R' имеют вышеуказанные значения). Из числа фармацевтически приемлемых сложных эфиров и солей согласно данному изобретению могут быть упомянуты следующие: гидрохлорид, сульфат, цитрат, формиат, фосфат. Конкретными соединениями, получаемыми согласно процессу изобретения, являются: 2,3,5,6-тетрагидро-(1 Н)-бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-8-метил-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-4-метил-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-1-метил-(1 Н)-бензо[с] хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-4-метил-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-4,8-диметил-(1 Н)-бензо 4 8-хлор-2,3,5,6-тетрагидро-1,5-диметил(1H)-бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-1,4,5-триметил-(1H)бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-5,6-диметил-(1H)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-5,6-диметил(1H)-бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-5,6,8-триметил-(1H)бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-4,5,6-триметил-(1H)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-4,5,6-триметил(1H)-бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-1,5,6-триметил-(1H)бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-1,5,6-триметил(1H)-бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-4,5,6,8-тетраметил-(1H)бензо[с]хинолизин-3-он. Согласно изобретению вышеуказанные соединения формулы (I) могут быть получены,исходя из соединений общей формулы 2 и 3 в которых R1, R2, R3, R4, R5, W, Q и n имеют вышеуказанные значения. Соединения 2 и 3 являются промышленно доступными или могут быть получены по известным методикам. Указанные соединения являются производными тиокарбостирила, которые хорошо известны специалисту в данной области по меньшей мере с 1970 г. и раскрыты в документе DE 2166396 ( стр. 4, 13, 14, 24). Как видно из схемы 1, получение соединений I согласно изобретению включает Nалкилирование тиоамида 3 винилкетоном 2, давая N-алкилированный тиоамид 4, в присутствии сильного, но ненуклеофильного, основания. Предпочтительно, реакцию проводят в органическом растворителе (например, ТГФ), при температуре в интервале 0-30 С, в течение периода времени два - четыре часа. Более предпочтительно добавлять винилкетон к тиоамиду периодически. Характеристики основания оказывают решающее влияние на эффективность реакции. Действительно, сильные нуклеофильные основания вызывают полимеризацию винилкетона, тогда как с мягкими основаниями реакция не происходит. Предпочтительными основаниями, имеющими вышеуказанные характеристики, являются: K2 СО 3/18-краун-6 или диаза 5 бициклоундецен (ДБУ). Затем, N-алкилированный тиоамид 4 метилируется по атому серы,давая соль 5, которую обычно не отделяют, а оставляют реагировать с основанием, получая конечное соединение I. Для данной стадии важны также реакционные условия (температура и время) и тип основания. Наилучшие результаты получаются при использовании диметилсульфата в качестве метилирующего агента, сильного, но ненуклеофильного, основания (например, ДБУ) и при проведении реакции при температуре дефлегмации в органическом растворителе (например,толуоле) в течение времени 1/2-1 ч. С целью лучшей иллюстрации изобретения в нижеследующих примерах приведен синтез двух соединений формулы (I). Пример 1. Получение 6-хлор-1-(3-оксо-1 пентил)-(1 Н)-3,4-дигидрохинолин-2-тиона [соединения 4, в котором (QW)n = Cl, R1 = R3 = R4 == Cl, R3 = R4= H) (450 мг, 2,28 ммоль), безводного К 2 СО 3 (692 мг, 5,01 ммоль) и 18-краун-6 (60 мг, 0,23 ммоль) в безводном ТГФ (41 мл), при охлаждении при 0 С. Затем суспензии дают подогреться до комнатной температуры и после 30-минутного перемешивания суспензию охлаждают до 0 С и добавляют дополнительное количество этилвинилкетона (3,42 ммоль). Спустя 1 ч при комнатной температуре суспензию охлаждают снова до 0 С и добавляют оставшееся количество этилвинилкетона (3,42 ммоль). Таким образом после 1 ч при комнатной температуре реакция завершается. Реакционную смесь фильтруют через небольшой слой безводногоNa2SO4 и растворитель упаривают. Оставшееся масло хроматографируют (этилацетат: петролейный эфир, 1:9, Rt=0,29), получая чистый 6 хлор-1-(3-оксо-1-пентил)-(1 Н)-3,4-дигидрохинолин-2-тион [соединение 4, в котором (QW)n =Cl, R1 = R3 = R4 = R5 = H, R2 = Me] (277 мг, 45%) в виде бледно-жлтого тврдого вещества (т.пл. 68-70 С). В качестве альтернативы, тиоамид 3 (450 мг, 2,28 ммоль) растворяют в 5 мл безводного ТГФ, добавляют ДБУ (69 мл, 0,46 ммоль) и при охлаждении при 0 С, добавляют по каплям при перемешивании и в атмосфере азота этилвинилкетон 2 (275 мл, 2,76 ммоль). Через 2,5 ч при 0 С добавляют дополнительное количество этилвинилкетона (113 мл, 1,38 ммоль), реакционную смесь оставляют ещ на час при 0 С и затем упаривают растворитель, оставшееся масло разбавляют CH2Cl2 (30 мл), промывают 5% лимонной кислотой, NаНСО 3 (насыщ.) и водой. Органический слой сушат над Na2SO4, фильтруют и упаривают, получая сырое масло, кото 003997 6 рое хроматографируют как указано выше. Таким образом получают соединение 4 в виде смеси 1,6:1 с непрореагировавшим тиоамидом 3. Вычисленный выход по 4: 35%. Пример 2. Получение 8-хлор-2,3,5,6-тетрагидро-4-метил-(1 Н)-бензо[с]хинолизин-3-онаR4 = R5 = H, R2 = Me]. К раствору 6-хлор-1-(3-оксо-1-пентил)(1 Н)-3,4-дигидрохинолин-2-тиона [соединения 4, в котором (QW)n = Cl, R1 = R3 = R4 = R5 = H,R2 = Me], (250 мг, 0,93 ммоль) в безводном толуоле (3 мл) добавляют Ме 2SO4 (149 мл, 1,57 ммоль) при перемешивании и в атмосфере азота. Раствор нагревают при температуре кипения с обратным холодильником и через 5 мин начинает отделяться красное масло. Спустя ещ 10 мин к нагреваемой с обратным холодильником двухфазной реакционной смеси добавляется по каплям ДБУ (235 мл, 1,57 ммоль), вызывая через несколько минут потемнение смеси. Нагревание с обратным холодильником поддерживают в течение 20 мин, затем раствор охлаждают до комнатной температуры, разбавляют дихлорметаном (50 мл), промывают водой (50 мл) и сушат над Na2SO4. После фильтрования и упаривания растворителя оставшееся тмное масло хроматографируют (этилацетат: петролейный эфир, 1:1, Rt=0,28), получая чистый 8-хлор 2,3,5,6-тетрагидро-4-метил-(1 Н)-бензо[с]хинолизин-3-он [соединение 1, в котором (QW)n =(47 мл), при охлаждении при 0 С. Затем суспензии дают подогреться до комнатной температуры, и после 60-минутного перемешивания суспензию охлаждают снова до 0 С и добавляют дополнительное количество этилвинилкетона 2(3,81 ммоль). После 2 ч при комнатной температуре реакция завершается. Реакционную смесь фильтруют через небольшой слой безводногоNa2SO4 и растворитель упаривают. Оставшееся масло хроматографируют (этилацетат: петролейный эфир, 1:9, Rt=0,23), получая чистый 6 метил-1-(3-оксо-1-пентил)-(1 Н)-3,4-дигидрохинолин-2-тион [соединение 4, в котором (QW)n =Me, R1 = R3 = R4 = R5 = H, R2 = Me] (500 мг,68%) в виде белого тврдого вещества (т.пл. 7071 С).R3 = R4 = R5 = H, R2 = Me]. К раствору 6-метил-1-(3-оксо-1-пентил)(1 Н)-3,4-дигидрохинолин-2-тиона [соединения 4, в котором (QW)n = Me, R1 = R3 = R4 = R5 = H,R2 = Me], (350 мг, 1,40 ммоль) в безводном толуоле (4 мл) добавляют Me2SO4 (227 мл, 2,40 ммоль) при перемешивании и в атмосфере азота. Раствор нагревают при температуре кипения с обратным холодильником и через 5 мин начинает отделяться красное масло. Спустя ещ 15 мин к нагреваемой с обратным холодильником двухфазной реакционной смеси добавляется по каплям ДБУ (365 мл, 2,40 ммоль), вызывая через несколько минут потемнение смеси. Нагревание с обратным холодильником поддерживают в течение 20 мин, затем раствор охлаждают при комнатной температуре, разбавляют дихлорметаном (50 мл), промывают водой (50 мл) и сушат над Na2SO4. После фильтрования и упаривания растворителя оставшееся тмное масло хроматографируют (этилацетат: петролейный эфир, 1:1, Rt=0,29), получая чистый 8-метил 2,3,5,6-тетрагидро-4-метил-(1 Н)-бензо[с]хинолизин-3-он [соединение I, в котором (QW)n =Me, R1 = R3 = R4 = R5 = Н и R2 = Me] (152 мг,50%) в виде масла, затвердевающего при стоянии (т.пл. 143-145 С).W выбран из группы, включающей Н, C1-8 алкил, С 2-8 алкенил, С 2-8 алкинил, С 3-9 циклоалкил,трифторметил, С 1-8 алкокси, C1-8 алкоксиС 1-8 алкил, арилС 1-8 алкил, арил, арилокси, ариламино,C1-8 алкилкарбонил, арилкарбонил, арилкарбоксил, арилкарбоксиамид, галоген, CN, NRR', C1-8 алкиламино, насыщенный или ароматический гетероцикл, содержащий один или более атомовN, где группы алкил, алкенил, алкинил, С 3-9 циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, могут быть замещнными галогеном,OR, фенилом, NRR', CN, COOR, CONRR', C1-8 алкилом (где R и R' имеют указанные выше значения); причем арил представляет собой фенил и нафтил,n представляет целое число от 1 до 4; и их фармацевтически приемлемых солей или сложных эфиров,по которому тиоамид 3(в котором R1, R2 и R5 имеют вышеуказанные значения), получая соответствующее соединение 4 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений формулы (I) в которой R1, R2, R3, R4, R5, одинаковые или различные, выбраны из группы, включающей Н,C1-8 алкил, С 2-8 алкенил, С 2-8 алкинил, С 3-9 циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомовN, галоген, CN, азид, NRR', C1-8 алкиламино,ариламино, C1-8 алкилокси, арилокси, COOR,CONRR', где R и R', одинаковые или различные,выбраны из группы, включающей Н, С 1-8 алкил,С 3-9 циклоалкил, арил, насыщенный или ароматический гетероцикл, содержащий один или более атомов N, арилС 1-8 алкил;(в котором все заместители имеют вышеуказанные значения), которое метилируют по атому серы, получая соль 5(в которой все заместители имеют вышеуказанные значения), которую непосредственно подвергают реакции с основанием с получением желаемого соединения I. 2. Способ по п.1, в котором реакцию между соединениями 2 и 3 проводят в органическом растворителе в присутствии сильного, но ненуклеофильного основания. 3. Способ по п.1 или 2, в котором конечную стадию циклизации проводят в органическом растворителе в присутствии сильного, но ненуклеофильного основания. 4. Способ по п.2, в котором основанием является K2 СО 3/18-краун-6 или диазабициклоундецен (ДБУ). 5. Способ по п.3, в котором основанием является диазабициклоундецен (ДБУ). 6. Способ по п.2, в котором растворителем является ТГФ. 7. Способ по пп.1 и 3, в котором метилирующим агентом является диметилсульфат, а растворителем - толуол и процесс проводят при температуре дефлегмации. 8. Способ по п.7, в котором общее время реакции составляет в пределах 1/2-1 ч. 9. Способ по пп.1-8, в котором соединением формулы (I) является 2,3,5,6-тетрагидро-(1 Н)-бензо[с]хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-8-метил-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-4-метил-(1 Н)-бензо[с] хинолизин-3-он; 2,3,5,6-тетрагидро-1-метил-(1 Н)-бензо[с] хинолизин-3-он; 8-хлор-2,3,5,6-тетрагидро-4-метил-(1 Н)бензо[с]хинолизин-3-он; 2,3,5,6-тетрагидро-4,8-диметил-(1 Н)-бензо
МПК / Метки
МПК: C07D 455/04
Метки: синтеза, 1h)-бензо[c]хинолизин-3-онов, способ, производных
Код ссылки
<a href="https://eas.patents.su/6-3997-sposob-sinteza-proizvodnyh-1h-benzochinolizin-3-onov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза производных (1h)-бензо[c]хинолизин-3-онов</a>
Предыдущий патент: Новые дигидрофуро[3, 4-b]хинолин-1-оны, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Димерные тромбопоэтиновые пептидные миметики, связывающие мpl рецептор и имеющие тромбопоэтичеcкую активность
Случайный патент: Устройство для избирательного фототермолиза кожи










