Способ синтеза промежуточных соединений хлорпурина
Формула / Реферат
1. Способ получения соединения формулы (I)
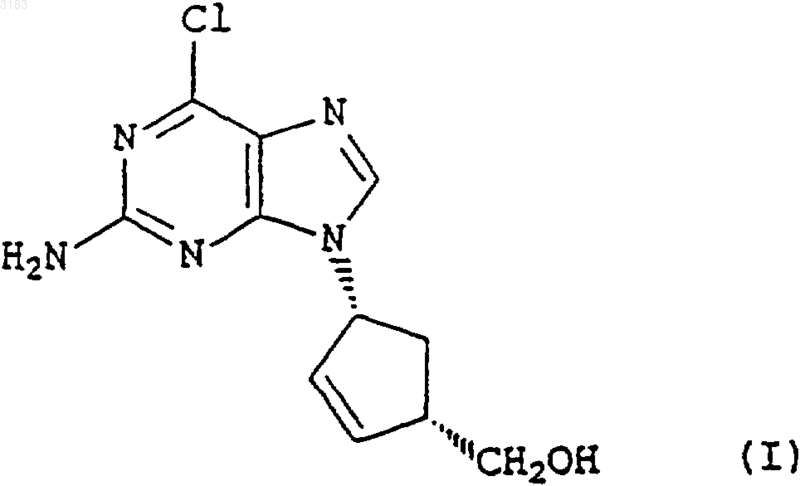
возможно в форме его соли или комплекса, включающий гидролиз в присутствии кислоты соединения формулы (IV)
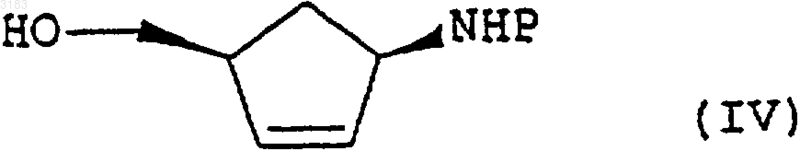
где Р - защитная группа, конденсацию образующегося продукта формулы (V)
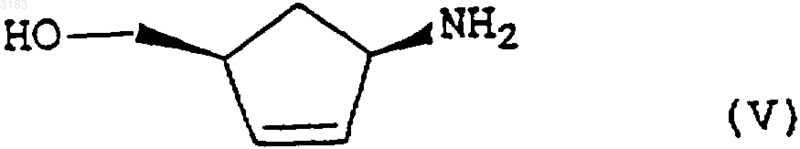
in situ в полярном растворителе в присутствии основания с соединением формулы (VI)
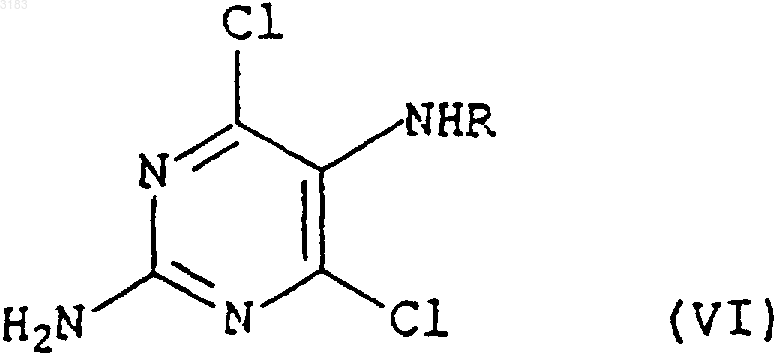
где R представляет собой CHO или H, с последующим in situ замыканием кольца образующегося промежуточного продукта формулы (VII)
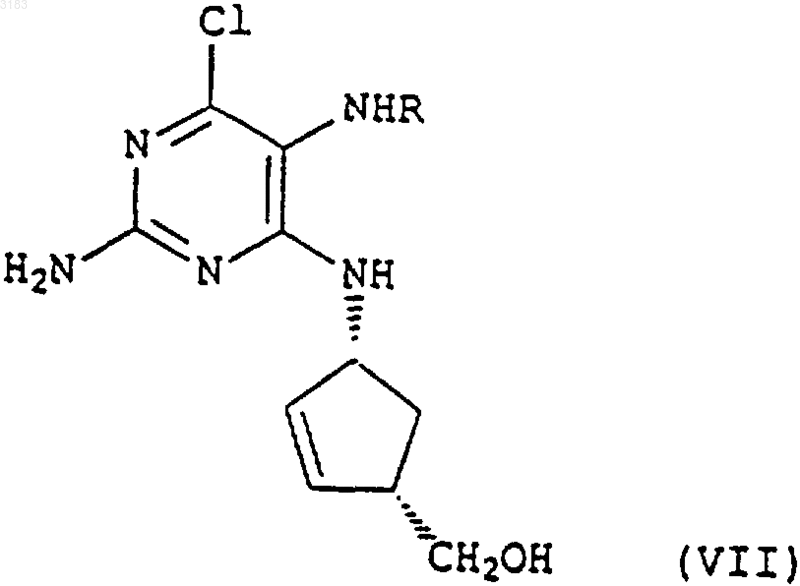
где R представляет собой CHO или H, причем реакцию замыкания кольца проводят с использованием триалкилортоформиата в присутствии минеральной кислоты и возможно одного или более неводных растворителей, для получения соединения формулы (I), которое затем, возможно, вводят в реакцию с кислотой или комплексообразующим реагентом с образованием соли или комплекса.
2. Способ по п.1, в котором R представляет собой CHO.
3. Способ по п.1 или 2, в котором P представляет собой ацильную или замещенную оксикарбонильную группу.
4. Способ по п.3, в котором P представляет собой формильную, C1-4 алканоильную группу или оксикарбонильную группу формулы R'OC(O), где R' - алкил или аралкил.
5. Способ по п.4, в котором P представляет собой ацетильную группу или R' является третичным бутилом или бензилом.
6. Способ по любому из пп.1-5, в котором операцию гидролиза выполняют в спирте, в простом циклическом эфире или хлорированном углеводороде в присутствии органической или минеральной кислоты.
7. Способ по п.6, в котором операцию гидролиза выполняют в промышленном метилированном спирте (ПМС), а кислота представляет собой трифторуксусную или соляную кислоту.
8. Способ по любому из пп.1-7, в котором реакцию конденсации проводят при нагревании с обратным холодильником.
9. Способ по п.8, в котором полярный растворитель представляет собой спирт, воду или ацетонитрил, а основанием является триалкиламин или карбонат или бикарбонат щелочного металла.
10. Способ по п.9, в котором основание представляет собой карбонат калия или натрия или бикарбонат натрия.
11. Способ по любому из пп.1-10, в котором реакцию замыкания кольца проводят с использованием триэтилортоформиата в присутствии соляной кислоты.
12. Способ по любому из пп.1-11, в котором неводный растворитель является тетрагидрофураном, этилацетатом или ПМС.
Текст
1 Настоящее изобретение относится к способу получения аналога нуклеозида карбоциклического пурина формулы (I), его солей и фармацевтически приемлемых производных. Энантиомерно чистое соединение формулы (I) описано в патенте GB-A-2217320 и может быть использовано в качестве промежуточного продукта при производстве абакавира, аналога нуклеозида 2-аминопурина, со следующей структурой (II) Это вещество описано в патенте ЕР 0434450 как средство, потенциально активное против вируса иммунодефицита человека (ВИЧ) и вируса гепатита Б (ВГБ). Таким образом, существует потребность синтезировать абакавир в больших количествах для клинических испытаний, и, поскольку абакавир одобрен национальными управлениями здравоохранения, большие количества абакавира потребуются также для продажи в качестве медикамента, отпускаемого по рецепту, для лечения инфекций ВИЧ. Способы получения абакавира с использованием энантиомерно чистых соединений формулы (III) через промежуточное соединение 2-аминопурина формулы (I) в целом описаны в патентных заявках РСТ WO 91/15490, WO 95/21161, в патенте ЕР 0434450 и в Tetrahedron: AsymmetryVol. 4, р. 1117 (1993). Однако описанные способы не обеспечивают удовлетворительный путь получения производного 2-аминопурина формулы (I), поскольку они требуют выделения и очистки ряда промежуточных соединений, что приводит к относительно высоким затратам и низкому выходу синтеза. Мы разработали способ получения промежуточного соединения формулы (I) из Nзащищенных-4-аминоциклопентенов формулы(IV) где Р - защитная группа, при этом способ обеспечивает высокий выход и большую экономичность. Защитная группа Р предпочтительно является ацилом или замещенной оксикарбонильной группой. 2 Один из аспектов настоящего изобретения включает простую и удобную конверсию in situ циклопентенов формулы (IV) в производные 2 аминопурина формулы (I) без необходимости выделения каких-либо промежуточных соединений. Согласно нашей технологии, снятие защиты с исходного материала формулы (IV) insitu обеспечивает получение желаемого аминоспирта без каких-либо неэкономных операций и,благодаря прямому сочетанию и циклизации,также без каких-либо дополнительных операций или выделения промежуточных соединений,общий выход процесса увеличивается. При этом согласно другому аспекту данного изобретения мы обеспечиваем способ получения соединения формулы (I) возможно, в виде его соли или комплекса, который включает гидролиз соединения формулы(IV), как определено выше, в присутствии кислоты, конденсацию образующегося продукта формулы (V) где R представляет собой СНО или Н, с последующим in situ замыканием кольца у образующегося промежуточного соединения формулы(VII), где R представляет собой СНО или Н для получения соединения формулы (I), которое затем,возможно, вводят в реакцию с кислотой или комплексообразующим реагентом с образованием его соли или комплекса. Как указано выше, предпочтительными защитными группами в соединении формулы(IV) являются ацильная или замещенная оксикарбонильная группы. Предпочтительные ацильные группы включают формил или низший алканоил (имеющий, например, от 1 до 4 атомов углерода в алкильной части), в частности, ацетильную группу. Предпочтительные замещенные оксикарбонильные группы имеют формулу R'OC(O)-, где R' может представлять собой алкильную группу или аралкильную группу. Предпочтительной алкильной группой 3 является третичный бутил, а предпочтительной аралкильной группой - бензил. Операцию гидролиза предпочтительно проводить путем мягкого гидролиза с кислым катализатором в органическом растворителе,таком как спирт, циклический простой эфир или хлорированный углеводород. Предпочтительно использовать органическую или минеральную кислоту, такую как трифторуксусная кислота или соляная кислота, в спиртовом растворителе,таком как промышленный метилированный спирт (ПМС), возможно, в присутствии воды. Операцию конденсации затем проводят без какого-либо выделения продукта гидролиза формулы (V). Эту реакцию конденсации предпочтительно выполнять при нагревании в колбе с обратным холодильником в полярном растворителе, таком как спирт, например этанол или бутанол, или в воде, или в ацетонитриле, или в их смеси, в присутствии, по меньшей мере, достаточного количества основания для нейтрализации кислоты, как используемой для гидролиза, так и образующейся в процессе конденсации. В общем случае это будет, по меньшей мере,два эквивалента, исходя из количества соединения формулы (IV). Предпочтительным основанием является триалкиламин, карбонат или бикарбонат щелочного металла, например, карбонат калия или натрия, и более предпочтительно- бикарбонат натрия. Предпочтительными сочетаниями являются триэтиламин или бикарбонат натрия в ПМС. Группа R в соединении формулы(VI) предпочтительно представляет собой СНО. Затем проводят реакцию замыкания кольца также без какого-либо выделения предшествующего промежуточного соединения формулы(VII). Ее удобно проводить при использовании триалкилортоформиатов в присутствии концентрированной водной или безводной минеральной кислоты, возможно, в присутствии одного или более неводных растворителей, например тетрагидрофурана, этилацетата или ПМС. Возможно добавление невыделенного продукта формулы (VII) к смеси кислоты и триалкилортоформиата. Предпочтительное сочетание включает применение примерно от 1,5 до 3,предпочтительно около 2 молярных эквивалентов соляной кислоты в триалкилортоформиате,что приводит к осаждению хлористо-водородной соли 9-замещенного 2-аминопурина формулы (I). При желании можно выделить свободное основание путем обработки основанием. Способ согласно изобретению, как обнаружено, обеспечивает выходы соединений формулы (I) из исходного соединения формулы (IV) свыше 80%. Это очень выгодно отличается от выходов соединений формулы (I), получаемых с использованием известных поэтапных технологий с выделением промежуточных соединений,где выходы обычно составляют около 56% при использовании в качестве исходного материала соединения формулы (III), или где выходы со 003183 4 ставляют около 75% при использовании способа, описанного в публикации WO 95/21161, и исходного соединения формулы (V). Соединения формулы (VI) можно синтезировать способом, описанным в WO 95/21161. Такое соединение можно синтезировать из легко доступного 2,5-диамино-4,6-дигидроксипиримидина в результате его реакции с реактивом Вильсмайера формулы (VIII) для образования соединения формулы (IX),(при этом в обеих формулах (VIII) и (IX) R1 и R2 соответствуют определению в WO 95/21161, а именно: R1 и R2, которые могут быть одинаковыми или различными, выбраны из ряда, включающего нормальный алкил C1-8, разветвленный алкил С 1-8, циклоалкил С 3-8 и арильные группы(такие как фенильная или нафтильная), которые могут быть произвольно замещенными, например, алкилом C1-4 или галогеном (например,хлором), в предпочтительном варианте реализации изобретения R1 и R2 являются метилом), с последующим гидролизом. Соединения формулы (VIII) можно получить из разнообразных формамидов вторичных аминов в результате реакции с различными галогенангидридами, такими как оксихлорид фосфора, пентахлорид фосфора, тионилхлорид,фосген и оксалилхлорид, как подробно описано,например, в обзоре С. М. Marson, Tetrahedon 1992, 48:3660-3720, и приведенных в нем ссылках. Соединение формулы (VI), где R представляет собой Н, можно получить из соединения формулы (IX) путем гидролиза в кислотном растворе, например, при рН 30,5 путем добавления совместного смешивающегося с водой растворителя, такого как этанол. Соединение формулы (VI), где R представляет собой СНО,можно также получить гидролизом соединения формулы (IX) при минимальном содержании воды и регулировании рН в пределах, указанных выше. При таких условиях соединение формулы (VI), где R представляет собой СНО,осаждается по мере образования и может быть отфильтровано. Соединение формулы (IV) можно получить способами, аналогичными описанным вTetrahedron: Asymmetry Vol. 4, р. 1117 (1993). Следующие примеры приведены только в качестве иллюстрации, а не с целью ограничения объема изобретения каким-либо образом. Пример А. Получение хлористо-водородной соли (1S,4R)-цис-4-[2-амино-6-хлор-9 Нпурин-9-ил]-2-циклопентен-1-метанола.(ПМС) (600 мл) обработали концентрированной соляной кислотой (48 мл, 1,2 молярных эквивалента), и полученный раствор нагревали до кипения в течение более чем примерно 0,5 ч. В течение примерно 2,5 ч поддерживали нагревание с обратным холодильником. Раствор охладили до 20-25 С и разбавили ПМС (600 мл). Добавили вначале триэтиламин (170 мл), а затемN-(2-амино-4,6-дихлор-5-пиримидинил)формамид (WO 95/21161) (97 г). Суспензию нагревали с обратным холодильником в течение примерно 17 ч с получением прозрачного раствора, который охладили до 25-30 С и добавили тонкоизмельченный карбонат калия (169 г). Поддерживая указанный диапазон температур, перемешивали суспензию в течение примерно 0, 5 ч, затем охладили до 0-5 С и отфильтровали твердую фазу. Указанную твердую фазу промыли ПМС(3 х 180 мл и 1 х 140 мл) и фильтрат, объединенный с промывной жидкостью, концентрировали при пониженном давлении до получения смолы красного цвета. Эту смолу повторно растворили в ПМС (1000 мл) и снова концентрировали раствор при пониженном давлении до получения смолы. Разбавление и концентрирование повторили еще два раза и растворили конечную смолу в ПМС (350 мл). Тем временем приготовили смесь триэтилортоформиата (900 мл) и тетрагидрофурана(ТГФ) (400 мл) и охладили ее до 0-5 С. Добавили концентрированную соляную кислоту (80 мл), поддерживая температуру от 0 до 10 С, а затем добавили еще ТГФ (100 мл). В эту смесь добавили полученный выше концентрат ПМС,промыв его ПМС (100 мл). Смесь нагрели до 2025 С, ввели затравочные кристаллы аутентичной хлористо-водородной соли (1S,4R)-цис-4[2-амино-6-хлор-9 Н-пурин-9-ил]-2-циклопентен-1-метанола и непрерывно перемешивали в течение примерно 20 ч. Суспензию отфильтровали, твердый осадок промыли смесью простого трет-бутилметилового эфира и ПМС (9/1, 3 х 300 мл) и высушили в вакууме при 40-45 С для получения указанного в заглавии соединения(117 г, 82%) в виде твердой фазы желтоватокоричневого цвета. ПМР (ДМСО-d6), : (s, 1, пуриновый СН),7,50 (br m, примерно 5, NН 3+, ОН, HOD), 6,20(ПМС) (600 мл) обработали концентрированной соляной кислотой (48 мл, 1,2 молярных эквивалента) и полученный раствор нагревали до кипения в течение более чем примерно 0,5 ч. Затем в течение примерно 3 ч поддерживали нагревание с обратным холодильником. Охладили раствор до 20-25 С и добавили бикарбонат натрия (103,4 г), а затем N-(2-амино-4,6-дихлор-5 пиримидинил)формамид (WO 95/21161) (97 г) и ПМС (600 мл). Суспензию нагревали с обратным холодильником в течение примерно 4 ч, а затем охладили примерно до -5 С. После перемешивания при данной температуре в течение примерно 1 ч отфильтровали твердую фазу и промыли ПМС (2 х 100 мл). Фильтрат, объединенный с промывной жидкостью, концентрировали при пониженном давлении до получения массы с остаточным объемом около 400 мл. Эту массу повторно растворили в ПМС (1000 мл) и снова концентрировали раствор при пониженном давлении до получения смолы. Разбавление и повторное концентрирование повторили еще два раза, и растворили конечную смолу в ПМС(350 мл). Между тем, триэтилортоформиат (900 мл) охладили до 0-5 С и добавили концентрированную соляную кислоту (80 мл), поддерживая температуру от 0 до 10 С. В эту смесь добавили приготовленный ранее концентрат ПМС, промыв его ПМС (600 мл). Смесь нагрели до 2025 С, ввели затравочные кристаллы аутентичной хлористо-водородной соли (1S,4R)-цис-4[2-амино-6-хлор-9 Н-пурин-9-ил]-2-циклопентен-1-метанола и непрерывно перемешивали в течение примерно 7 ч. Суспензию отфильтровали, твердый осадок промыли ПМС (2 х 150 мл) и высушили в вакууме при 40-45 С с получением указанного в заглавии соединения (114 г,81%) в виде твердой фазы желтоватокоричневого цвета со спектроскопическими характеристиками, идентичными продукту в примере А. Пример С. Получение хлористо-водородной соли (1S,4R)-цис-4-[2-амино-6-хлор-9 Нпурин-9-ил]-2-циклопентен-1-метанола. Суспензию сложного 1,1-диметилэтилового эфира (1R,4S)-цис-[4-(гидроксиметил)-2 циклопентен-1-ил]карбаминовой кислоты (72,5 кг) в промышленном метилированном спирте(ПМС) (435 л) и воде (около 200 л) обработали концентрированной соляной кислотой (36,5 л,1,2 молярных эквивалента), и полученный раствор нагревали до кипения в течение примерно свыше 1,5 ч. Затем в течение примерно 2 ч поддерживали нагревание с обратным холодильником. Охладили раствор до 20-25 С и добавили бикарбонат натрия (75 кг), а затем N-(2-амино 4,6-дихлор-5-пиримидинил)формамид 7 примерно 4 ч, а затем охладили примерно до-5 С. После перемешивания при данной температуре в течение примерно 1 ч твердую фазу отфильтровали и промыли ПМС (2 х 144 л). Фильтрат, объединенный с промывной жидкостью, концентрировали при пониженном давлении до получения массы с остаточным объемом около 290 л. Эту массу растворили в ПМС (около 300 л) и снова концентрировали раствор при пониженном давлении до получения массы с остаточным объемом около 290 л. Разбавление и концентрирование повторили еще два раза, разбавили конечный концентрат ПМС (610 л) и нагрели примерно до 35-40 С. Полученную смесь профильтровали и твердую фазу промыли ПМС (2 х 144 л). Фильтрат, объединенный с промывной жидкостью, концентрировали при пониженном давлении до получения массы с остаточным объемом около 290 мл и затем разбавили ПМС (217 л). Тем временем приготовили смесь из триэтилортоформиата (660 л), концентрированной соляной кислоты (58 л) и ПМС (72 л) при температуре 0-8 С. В эту смесь добавили полученный ранее концентрат ПМС, промыв его ПМС(2 х 72 л). Смесь нагрели до 20-25 С, ввели затравочные кристаллы аутентичной хлористо-водородной соли (1S,4R)-цис-4-[2-амино-6-хлор 9 Н-пурин-9-ил]-2-циклопентен-1-метанола и непрерывно перемешивали в течение примерно 7 ч. Суспензию охладили до 18-21 С, отфильтровали, твердый осадок промыли ПМС(72 л и 217 л) и высушили в вакууме при 4045 С для получения указанного в заглавии соединения (81,7 кг, 79,5%) в виде твердой фазы желтовато-коричневого цвета со спектроскопическими параметрами, идентичными продукту в примере А. Пример D. Получение хлористо-водородной соли (1S,4R)-цис-4-[2-амино-6-хлор-9 Нпурин-9-ил]-2-циклопентен-1-метанола. Суспензию сложного 1,1-диметилэтилового эфира (1R,4S)-цис-[4-(гидроксиметил)-2 циклопентен-1-ил]карбаминовой кислоты (10 г) в промышленном метилированном спирте(ПМС) (60 мл) обработали концентрированной соляной кислотой (5 мл, 1,2 молярных эквивалента) и полученный раствор нагревали до кипения в течение примерно более 0,5 ч. В течение примерно 3 ч поддерживали нагревание с обратным холодильником. Раствор охладили до 20-25 С и взвесили (45,7 г). Часть раствора (14 г) разбавили ПМС и добавили к нему бикарбонат натрия (3,1 г), а затем 2,5-диамино-4,6 дихлорпиримидин (WO 95/21161) (2,0 г). Суспензию нагревали с обратным холодильником в течение примерно 7 ч, а затем охладили примерно до -5 С. Отфильтровали твердую фазу, и фильтрат, объединенный с промывной жидкостью, концентрировали при пониженном давле 003183 8 нии до получения смолы, которую повторно растворили в ПМС (17 мл). Тем временем триэтилортоформиат (21,4 мл) охладили до 0-5 С и добавили концентрированную соляную кислоту (1,9 мл), поддерживая температуру от 0 до 10 С. В эту смесь добавили приготовленный ранее раствор в ПМС,промыв его ПМС (2 х 2,5 мл). Смесь нагрели до 20-25 С, ввели затравочные кристаллы аутентичной хлористо-водородной соли (1S,4R)-цис 4-[2-амино-6-хлор-9 Н-пурин-9-ил]-2-циклопентен-1-метанола и непрерывно перемешивали в течение примерно 19 ч. Суспензию отфильтровали, твердый осадок промыли ПМС (2 х 4,5 мл) и высушили в вакууме при 40-45 С для получения указанного в заглавии соединения (2,06 г,61%) в виде твердой фазы светло-желтого цвета со спектроскопическими параметрами, идентичными продукту в примере А. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы возможно в форме его соли или комплекса,включающий гидролиз в присутствии кислоты соединения формулы (IV) где Р - защитная группа, конденсацию образующегося продукта формулы (V) где R представляет собой СНО или Н, с последующим in situ замыканием кольца образующегося промежуточного продукта формулы (VII) где R представляет собой СНО или Н, причем реакцию замыкания кольца проводят с использованием триалкилортоформиата в присутствии минеральной кислоты и возможно одного или более неводных растворителей, для получения соединения формулы (I), которое затем, возможно, вводят в реакцию с кислотой или комплексообразующим реагентом с образованием соли или комплекса. 2. Способ по п.1, в котором R представляет собой СНО. 3. Способ по п.1 или 2, в котором Р представляет собой ацильную или замещенную оксикарбонильную группу. 4. Способ по п.3, в котором Р представляет собой формильную, C1-4 алканоильную группу или оксикарбонильную группу формулыR'OC(O), где R' - алкил или аралкил. 5. Способ по п.4, в котором Р представляет собой ацетильную группу или R' является третичным бутилом или бензилом. 6. Способ по любому из пп.1-5, в котором операцию гидролиза выполняют в спирте, в простом циклическом эфире или хлорированном углеводороде в присутствии органической или минеральной кислоты. 7. Способ по п.6, в котором операцию гидролиза выполняют в промышленном метилированном спирте (ПМС), а кислота представляет собой трифторуксусную или соляную кислоту. 10 8. Способ по любому из пп.1-7, в котором реакцию конденсации проводят при нагревании с обратным холодильником. 9. Способ по п.8, в котором полярный растворитель представляет собой спирт, воду или ацетонитрил, а основанием является триалкиламин или карбонат или бикарбонат щелочного металла. 10. Способ по п.9, в котором основание представляет собой карбонат калия или натрия или бикарбонат натрия. 11. Способ по любому из пп.1-10, в котором реакцию замыкания кольца проводят с использованием триэтилортоформиата в присутствии соляной кислоты. 12. Способ по любому из пп.1-11, в котором неводный растворитель является тетрагидрофураном, этилацетатом или ПМС.
МПК / Метки
МПК: C07D 473/00
Метки: синтеза, промежуточных, способ, хлорпурина, соединений
Код ссылки
<a href="https://eas.patents.su/6-3183-sposob-sinteza-promezhutochnyh-soedinenijj-hlorpurina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза промежуточных соединений хлорпурина</a>
Предыдущий патент: Универсальная плазма крови
Следующий патент: Способ лечения синдрома раздражения толстой кишки
Случайный патент: Замещенные трициклические соединения










