Способ получения производных дифенила
Номер патента: 622
Опубликовано: 29.12.1999
Авторы: Канната Винченцо, Иера Сильвио, Берначез Мишель, Баррека Джузеппе, Кастальди Грациано, Гигьер Пьер
Формула / Реферат
1. Способ получения производных дифенила формулы I:
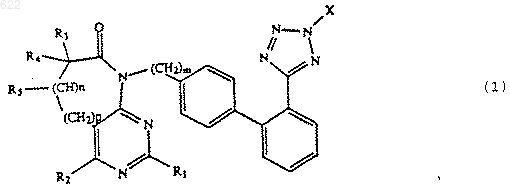
или его соли;
где Х -защитная группа и R1, R2, R3 и R4, каждый независимо, представляет собой водород, C1-6 алкил или C1-6 перфторалкил; R5 -водород или, когда n равно 1, R5 вместе с R3 образует двойную связь; m равно 1, 2 или 3; n равно 0 или 1; р равно 0, 1 или 2;
отличающийся тем, что проводят взаимодействие соединения формулы II
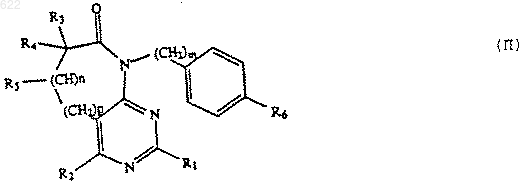
или его соли;
где R1-R5, m, n и р принимают указанные выше значения, R6 -хлор, бром или йод;
с соединением формулы III
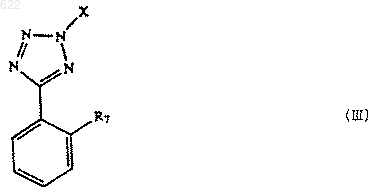
или его солью;
где Х - защитная группа и R7 - галогенид цинка в присутствии палладиевого или никелевого катализатора.
2. Способ по п.1, отличающийся тем, что R7 представляет собой ZnCl-, ZnBr-.
3. Способ по п.1, отличающийся тем, что катализатор получают из Pd(OAc)2 или PdCl2(РРh3)2, NiCl2(dppe), NiCl2(РРh3)2, Ni(acac) или Pd2 dba3 и одного или более реагентов, обладающих двойной функцией восстановитель/лиганд, выбранных из группы, включающей РРh3, Р(о-толил)3, Р(2-фурил)3, Р(трет-бутил)3, Р(OiРr)3, СuJ, СuВг, АsРh3 и алюмогидрид диизобутила (DIBAL), 1,3-бис-дифенилфосфинопропан (DPPP) или 1,3-бис-дифенил-фосфин-бутан (DPPB).
4. Способ по любому из пп.1-3, отличающийся тем, что катализатор получают непосредственно в реакционной емкости, в которой проводят реакцию соединений формул II и III.
5. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию соединений формулы II и III проводят в присутствии растворителя, который является по существу не смешивающимся с водой.
6. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию соединений формул II и III проводят в присутствии смеси растворителей, включающей растворитель, по существу не смешивающийся с водой, и растворитель эфирного типа.
7. Способ по любому из предыдущих пунктов, отличающийся тем, что используемое в нем соединение формулы III получают переметаллированием соединений формулы IV
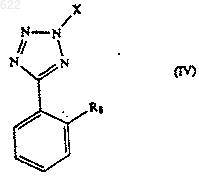
или его соли;
где Х - защитная группа и R8 - MgBr или MgI;
с реагентом реакции переметаллирования, выбранным из группы, включающей хлорид цинка, бромид цинка, хлорид тpи (C1-6 алкил) олова или бромид три (С1-6 алкил) олова.
8. Способ по п.7, отличающийся тем, что в качестве реагента реакции переметаллирования используется хлорид цинка.
9. Способ по п.7 или 8, отличающийся тем, что реакцию соединения формулы IV с реагентом реакции переметаллирования проводят в присутствии растворителя, который является по существу не смешивающимся с водой.
10. Способ по п.9, отличающийся тем, что реакцию соединения IV с реагентом реакции переметаллирования проводят в присутствии смеси растворителей, включающей растворитель, который является по существу не смешивающимся с водой, и растворитель эфирного типа.
11. Способ по любому из пп.1-10, отличающийся тем, что используемое в нем соединение формулы IV получают взаимодействием соединения формулы V

или его соли;
где Х - защитная группа и R9 - Вr или I;
с магнием.
12. Способ по п.11, отличающийся тем, что взаимодействие соединения формулы V с магнием проводят в присутствии растворителя эфирного типа.
13. Способ по п.12, отличающийся тем, что, по меньшей мере, часть растворителя эфирного типа, присутствующего во время реакции соединения формулы V с магнием, остается в процессе взаимодействия соединения формулы IV с реагентом реакции переметаллирования.
14. Способ по п.13, отличающийся тем, что, по меньшей мере, часть растворителя эфирного типа, присутствующего при проведении реакции соединения формулы V с магнием, остается во время реакции соединения формулы II с соединениями формулы III.
15. Способ по любому из пп.11-14, отличающийся тем, что взаимодействие соединений формулы IV и V и in situ получение палладиевого или никелевого катализатора проводят по существу в одной реакционной емкости.
16. Способ по п.15, отличающийся тем, что взаимодействие соединений формул II, III, IV и V и in situ получение палладиевого или никелевого катализатора проводят по существу в одной реакционной емкости.
17. Способ по любому из предыдущих пунктов, отличающийся тем, что m равно 1, n равно 0, р равно 1, R1 и R2 каждый представляет собой метил и R3 и R4 каждый представляет собой водород.
18. Способ по любому из предыдущих пунктов, отличающийся тем, что Х представляет собой C1-6 алкил, фенил или бензил, в каждом случае необязательно замещенный и содержащий один или большее количество заместителей, выбранных из группы, включающей C1-6 алкил, C1-6 алкоксигруппу, нитро-, аминогруппу, (C1-6) алкиламино-, ди(С1-6) алкиламино-, тио (C1-6) алкил или фенил.
19. Способ по п.18, отличающийся тем, что Х - C1-6 алкил, необязательно замещенный и содержащий один или большее количество заместителей, выбранных из группы, включающей C1-6 алкоксигруппу, нитро-; аминогруппы, (C1-6) алкиламино-, ди(С1-6) алкиламино- или тио (C1-6) алкил.
20. Способ по пп.18, 19, отличающийся тем, что C1-6 алкоксигруппу выбирают из метокси-, этокси, пропокси-, бутоксигрупп.
21. Способ по п.20, отличающийся тем, что Х представляет собой трет-бутил.
22. Способ по любому из предыдущих пунктов, отличающийся тем, что R6 представляет собой бром.
23. Способ по любому из предыдущих пунктов, отличающийся тем, что R8 представляет собой MgBr.
24. Способ по любому из предыдущих пунктов, отличающийся тем, что R9 представляет собой бром.
25. Способ получения 8-[2'-(2(1)-трет-бутил-2Н-тетразол-5-ил)-дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6Н-пиридо[2,3-d]пиримидин-7-она (или такого соединения, где бензильная или n-метоксибензильная группа присутствует вместо трет-бутильной группы) или его соли, отличающийся тем, что он включает следующие стадии:
A) взаимодействие 2-трет-бутил-5-(2-бром- или йодфенил)-2Н-тетразола с магнием с получением бром- или йод[2-[2-(трет-бутил)-2Н-тетразол-5-ил]фенил]магниевого реактива Гриньяра,
B) переметаллирование указанного реактива Гриньяра с хлоридом цинка, бромидом цинка или хлоридом трибутилолова и
C) взаимодействие продукта реакции переметаллирования с 8[(4-бром-, йодфенил)метил]-5,8-дигидро-2,4-диметилпиридо[2,3-d]-пиримидин-7(6Н)-оном в присутствии палладиевого или никелевого катализатора для получения продукта; причем на протяжении способа бензильная или n-метоксибензильная группа может присутствовать вместо трет-бутильной группы.
26. Способ по п.25, отличающийся тем, что на стадии С используют 2-трет-бутил-5-(2-бромфенил)-2Н-тетразол.
27. Способ по п.25, отличающийся тем, что в нем используют трет-бутильную группу.
28. Способ по п.25, отличающийся тем, что хлорид цинка представляет собой реагент реакции металлирования на стадии С.
29. Способ по п.25, отличающийся тем, что 8[(4-бромфенил)метил]-5,8-дигидро-2,4-диметилпиридо[2,3-d]-пиримидин-7(6Н)-он реагирует с хлор- или бром[2-[2-(трет-бутил)-2Н-тетразол-5-ил]фенил]цинком на стадии С.
30. Способ по п.25, отличающийся тем, что палладиевый катализатор используют на стадии С.
31. Способ по п.25, отличающийся тем, что палладиевый катализатор получают из Pd(OAc)2 или РdСl2(РРh3)2 и добавки, выбранной из группы, включающей РРh3, Р(о-толил)3, Р(2-фурил)3, Р(трет-бутил)3, Р(OiРr)3, CuJ, CuBr, АsРh3 DIBAL.
32. Способ по п.29, отличающийся тем, что фосфинированный палладиевый катализатор получают в реакционной емкости, содержащей хлор- или бром[2-[2-(трет-бутил)-2Н-тетразол-5-ил]фенил]цинк.
33. Способ по п.25, отличающийся тем, что реакцию стадий В и С и получение палладиевого или никелевого катализатора с или без добавки проводят в одной реакционной емкости.
34. Способ по п.25, отличающийся тем, что проводят
B) переметаллирование бром[[2-[2-(трет-бутил)-2Н-тетразол-5-ил]фенил]магния, который представляет собой реактив Гриньяра, с хлоридом цинка; и
C) взаимодействие продукта реакции переметаллирования с 8[(4-бромфенил)метил]-5,8-дигидро-2,4-диметилпиридо[2,3-d]-пиримидин-7(6Н)-оном в присутствии палладиевого катализатора для получения продукта.
35. Способ по любому из пп.25-34, отличающийся тем, что он включает дополнительную стадию удаления защитной группы из продукта для получения 8-[2'-(1Н-тетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6Н-пиридо[2,3-d] пиримидин-7-она или его соли.
Текст
1 Данное изобретение относится к усовершенствованному способу получения промежуточного продукта -8-[2'-(2(1)-трет-бутил-2 Нтетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7 она, который является исходным продуктом для лекарственного средства-5,8-дигидро-2,4 диметил-8-[(2'-(1 Н-тетразол-5-ил)-[1,1'-дифенил]-4-ил]метил]пиридо[2,3-d]пиримидин 7(6 Н)-она. Указанное лекарственное средство представляет собой антагонист ангиотензина II,особенно полезно в качестве гипотензивного средства, которое впервые описывается в патенте США 5149699 (American Home ProductsCorporation). В данном описании используются следующие аббревиатуры: Аббревиатура Полное название асас ацетонилацетонChem. 42, 1821 (1977 впервые обнаружили, что поперечное связывание арил- и бензилцинкпроизводных с арилбромидами или йодидами в присутствии каталитических количеств Ni илиPd катализатора обеспечивает общий и высокоселективный синтез хемо- и региоизомеров для несимметричных диарилов и диарилметанов,причем количества гомосвязанных диарилов составляет менее пяти процентов. J.W. Tilley,J.W. Clader, S. Zawoiski, М. Wirkus, R.A. LeMahieu, M. O'Donnell, H. CrowleyA. F. Welton; (J.Med. Chem. 32, 1814 (1989 продемонстрировали пример поперечного связывания по методикеNegishi в соответствии со схемой II на странице 1816 и в Экспериментальной части (столбец 2 страница 1818, второй пример), в котором получают метиловый эфир 2-бром-3',4'-диметокси 1,1'-дифенил-4-карбоновой кислоты. В этом примере 3,4-диметоксифенилцинк получают взаимодействием бутиллития с 3,4 диметоксибромбензолом с последующим переметаллированием хлоридом цинка. Катализатором сшивания является дихлорид бис(трифенилфосфин)палладия. В публикацииA.S. Bell, D.A. RobertsК. S. Ruddock; Synthesis 843 (1987) описывается прямой синтез 6 пиридинил-2(1H)-хинолинонов посредством связывания хлоридов пиридилцинка с галогенхинолинонами с использованием палладиевого катализатора. Хлориды пиридилцинка получают реакцией переметаллирования галогенидов пи 000622 2 ридиниллития или пиридинилмагния с хлоридом цинка. В приведенных выше ссылках описываются способы получения арилцинкпроизводного и его связывание с арилгалогенидами в присутствии палладиевого катализатора, которое приводит к образованию производных дифенила. Однако ни в одной из этих ссылок нет описания использования арилтетразолов в реакции связывания или получения дифенилтетразолов. В патенте США 5039814 (MerkCo.) описывается получение арилтетразола представленной ниже структуры, у которого в ортоположении фенильного кольца находится литийсодержащий фрагмент ("орто-литинированный арилтетразол").R2=Н или trityl. Такие орто-литинированные тетразолы обрабатывают либо электрофилом, либо галогенидом металла М(L)n с получением металлорганического соединения с замещенным металлсодержащим остатком (М=Zn, Мg, Сu, В,Al или Cd). Это соединение затем обрабатывают арилгалогенидами в присутствии катализатора(палладиевого или никелевого) с получением дифенилпроизводных соединений структуры.R3=алкил, СН 2OН. В отличие от указанного процесса в способе данного изобретения используют реакцию Гриньяра,например,с 1-(трет-бутил)-3(бромфенил)тетразолом для получения третбутилфенилтетразол-2-магнийбромида - реактива Гриньяра, а не такого реагента А, включающего литийсодержащий фрагмент в ортоположении, который затем подвергают реакции переметаллирования с хлоридом цинка. Таким образом, в способе данного изобретения исключается использование бутиллития, который представляет собой самовоспламеняющееся вещество. На стадиях 3, 4 и 5 примера 3 указанного патента США 5149699 (American Home Product 3 промежуточного продукта известного также как 2,4-диметил-5,6,8-тригидро-8-2'-(1-третбутил-1 Н-тетразол-5-ил)[1,1-дифенил]-4-ил]метил]-7 Н-пиридо[2,3-d]пиримидин-7-он представленной ниже последовательностью реакций 4 тетразола (108) с 3-[4-(R40-фенил)метил]хиназолиноном (109); где М выбирают из группы,включающей -МgВг, -Sn(С 1-4 низший алкил или фенил), Li или -Zn комплекс, и R40 выбирают из группы, включающей I, Вr и ОSO2 СF3. Единственным конкретным примером данной реакции является пример 90, где М - МgВr и R40 - бром,т.е. тетразолпроизводным реагентом является 5(2-бромфенил)-1-(трифенилметил)-1 Н-тетразол и производным хиназолинона является 3-[4 бромфенил)метил]-2-бутил-6-(1-метокси-1 метилэтил)-4(3 Н)-хиназолинон]. Из приведенной схемы видно, что 2-третбутил-5-бромфенил-2H-тетразол (1), который далее в описании называется"третбутилбромтетразол", взаимодействует с магнием с получением соответствующего реактива Гриньяра, который далее реагирует с получением бороновой кислоты (2). Общий выход на этой стадии составляет 48%. Каталитическое поперечное связывание (с использованием палладиевого катализатора) бороновой кислоты (2) и 8-[(4-бромфенил)метил]5,8-дигидро-2,4 диметилпиридо[2,3-d]пиридин-7(6 Н)-она, который далее в описании называется "бромбензиллактам", приводит к получению промежуточного продукта (3) с выходом 66%. Способ, описанный в данном изобретении, неожиданно обеспечивает лучшие выходы и позволяет исключить стадию выделения бороновой кислоты(2). В примере 5 Европейского патента ЕР 0550313 А 1 (Synthelabo) описывается получение дифенильного продукта (5) посредством следующей последовательности превращений. Подробное описание изобретения Данное изобретение относится к способу получения соединения формулы IR1=трет-бутил, triryl. Арилбромид (4) превращают в цинкорганическое соединение, которое используется в реакции поперечного связывания с получением дифенильного производного (5) с выходом в интервале от 60 до 80%. В описанном в данной заявке способе реактив Гриньяра получают из арилтетразола. Это является преимуществом,поскольку арилгалогенид, который не содержит тетразольного цикла, может быть полностью функционализирован. На схеме IX в ЕР 0497150 А 1 (AmericanCyanamid Company), представленной ниже, показано каталитическое связывание с использованием палладиевого или никелевого катализатора 5-(2-М-фенил)-1-(трифенилметил)-1 Н или его соли; где Х - защитная группа и R1, R2, R3 и R4 каждый независимо представляет собой водород, C1-6 алкил или C1-6 перфторалкил, R5 - водород или, когда n равно 1, R5 вместе с R3 образует двойную связь; m равно 1, 2 или 3; n равно 0 или 1, и р равно 0, 1 или 2,взаимодействием соединения формулы II или его солью; где Х - защитная группа и R7 - фрагмент,содержащий цинк или олово (такой как ZnCl,ZnBr или Sn (C1-6 алкил)3); в присутствии палладиевого или никелевого катализатора. Термин "защитная группа" в данном описании используется для обозначения группы,которая остается в данном положении в процессе проведения реакции (такой, как получение реактива Гриньяра, переметаллирование и/или связывание), но может легко удаляться поcле завершения реакции, например, с помощью кислотного или основного гидролиза. Примерами обычных защитных групп являются трет-бутил,C1-4 алкоксиметил,метилтиометил,фенилC1-4 алкоксиметил,п-метоксибензил,2,4,6 триметилбензил,бензилоксиметил,2(триметилсилил)этил, тетрагидропиранил и пиперанил. Дополнительные примеры защитных групп приводятся в публикации GreeneWutzC1-6 алкил, фенил или бензил, в каждом случае необязательно замещенный и содержащий один или большее количество заместителей, выбранных из группы, включающей C1-6 алкил (например, метил, этил, пропил, изопропил, бутил,изобутил, пентил и гексил), C1-6 алкокси-группу(например, метокси-, этокси-, пропокси-, бутокси-группу), нитро-, амино-группу, (C1-6) алкиламино, ди (C1-6) алкиламино, тио (C1-6) алкил или фенил; или бензилоксиметил, необязательно содержащий в фенильном кольце один или большее количество заместителей, выбранных из группы, включающей C1-6 алкил (например,метил, этил, пропил, изопропил, бутил, изобу 000622(например, метокси-, этокси-, пропокси-, бутокси-группу). Предпочтительно Х представляет собой C1-6 алкил, необязательно содержащий один или большее количество заместителей,выбранных из группы, включающей C1-6 алкокси(например, метокси-, этокси-, пропокси-, бутокси-группу), нитро-, аминогруппу, (C1-6) алкиламино, ди (C1-6) алкиламино-группу или тио (C1-6) алкил. Предпочтительно Х представляет собой алкильную группу с разветвленной углеродной цепью, такую как трет-бутил. Предпочтительно в способе данного изобретения m равно 1, n равно 0, р равно 1, R1 и R2 каждый представляет собой метил и R3 и R4 каждый представляет собой водород. Предпочтительно R6 представляет собой бром. Предпочтительно R8 представляет собой МgВr. Предпочтительно R9 представляет собой бром. Предпочтительно палладиевый, никелевый катализатор получают из соли палладия или никеля, восстановителя и лиганда или из соли палладия или никеля и вещества, обладающего двойной функцией "восстановитель/лиганд" или из комплекса палладия или никеля и лиганда. Предпочтительно катализатор получают из(РРh3)2, Ni(асас)2 или Рd2(dba)3 и одного или более реагентов, обладающих двойной функцией восстановитель/лиганд, выбранных из группы, включающей РРh3, Р(о-толил)3, Р(третбутил)3, Р(2-фурил)3, Р(OiPr)3, CuJ, CuBr, АsРh3,N2H2 и алюмогидрид диизобутила (DIBAL), 1,3(дифенилфосфино)пропан (DPPP) или бис(1,4 дифенилфосфино)бутан (DPPB). Подходящим образом катализатор получают в реакционной емкости, где проходит реакция соединения формулы II и соединения формулы III. Предпочтительно взаимодействие соединения формулы II и соединения формулы III проводят в присутствии растворителей, которые относятся к растворителям, по существу не смешивающимся с водой, подходящим является углеводородный растворитель и предпочтительно ароматический углеводородный растворитель, такой как толуол или ксилол. Предпочтительно взаимодействие соединения формулы II и соединения формулы III проводят в присутствии смеси растворителей,которая включает растворитель, не смешивающийся с водой, и растворитель эфирного типа. Предпочтительно соотношение растворителя, не смешивающегося с водой, и растворителя эфирного типа находится в интервале от 5:1 до 1:5. Предпочтительно растворителем эфирного типа является тетрагидрофуран (ТГФ). 7 Предпочтительно соединение формулы III получают реакцией переметаллирования соединения формулы IV(C1-6 алкил) олова. Предпочтительно в качестве реагента реакции переметаллирования используют хлорид цинка. Предпочтительно взаимодействие соединения формулы IV с реагентом реакции переметаллирования проводят в присутствии растворителей, не смешивающихся с водой, таких как углеводородный растворитель, предпочтительно ароматический углеводородный растворитель,такой как толуол или ксилол. Обычно растворитель, который является по существу не смешивающимся с водой, будет обладать низкой полярностью и может быть по существу неполярным. Предпочтительно реакцию соединения IV с реагентом реакции переметаллирования проводят в смеси растворителей, которая включает растворитель, не смешивающиqся с водой и растворитель эфирного типа, такой как тетрагидрофуран (ТГФ). Предпочтительно объемное отношение растворителя, не смешивающегося с водой, к растворителю эфирного типа находится в интервале от 5:1 до 1:5, предпочтительно от 5:1 до 1:1. Предпочтительно взаимодействие соединения формулы IV и in situ получение палладиевого или никелевого катализатора проводят по существу в одной реакционной емкости. Предпочтительно взаимодействие соединений формул II, III и IV и in situ получение палладиевого или никелевого катализатора проводят в одной реакционной емкости. Предпочтительно соединение формулы IV получают взаимодействием соединения формулы V 8 где Х - защитная группа и R9 - Вг или I; с магнием. Предпочтительно взаимодействие соединения формулы V с магнием проводят в растворителе эфирного типа, таком как ТГФ, диметоксиэтан (ДМЭ), диэтиловый эфир или 1,4 диоксан, из которых предпочтительным является ТГФ. Приемлемо, если, по меньшей мере, часть эфирного растворителя, присутствующего в процессе взаимодействия соединения формулыV, остается в процессе проведения реакции соединения формулы IV с реагентом реакции переметаллирования, и приемлемо, если, по меньшей мере, часть эфирного растворителя,присутствующего в процессе взаимодействия соединения формулы V, остается на время проведения реакции соединения формулы II с соединением формулы III). Подходящим является наличие в способе дополнительной стадии удаления защитной группы соединения формулы I для получения соединения формулы VI или его соли; где R1, R2, R3 и R4 каждый независимо представляет собой водород, C1-6 алкил или C1-6 перфторалкил, R5 представляет собой водород или, когда n равно 1, R5 вместе с R3 образует двойную связь; m равно 1, 2 или 3; n равно 0 или 1, и р равно 0, 1 или 2. В предпочтительном воплощении изобретение включает способ получения 8-[2'(2(1)трет-бутил-2 Н-тетразол-5-ил)-дифенил-4-илметил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3d]пиримидин-7-она (или такого соединения, в котором трет-бутильная группа заменена бензильной или п-метоксибензильной группой) или его соли. Указанный способ имеет следующие отличительные признаки: А) взаимодействие 2-трет-бутил-5-(2-бромили йодфенил)-2 Н-тетразола с магнием для получения бром- или йод[2-[2-(трет-бутил)-2 Нтетразол-5-ил]фенил]магния, который представляет собой реактив Гриньяра; В) переметаллирование указанного реактива Гриньяра хлоридом цинка, бромидом цинка или хлоридом трибутилолова; и С) взаимодействие продукта реакции переметаллирования с 8[(4-бром- или йодфенил)метил]-5,8-дигидро-2,4-диметилпиридо[2,3d]пиримидин-7(6 Н)-оном в присутствии палладиевого или никелевого катализатора с получением продукта; (где на всем протяжении процесса вместо трет-бутильной группы может 9 присутствовать бензильная или р-метоксибензильная группа). Предпочтительно на стадии А используют 2-трет-бутил-5-(2-бромфенил)-2 Н-тетразол. Предпочтительно на стадии С реагентом реакции переметаллирования является хлорид цинка. Предпочтительно 8[(4-бромфенил)метил]5,8-дигидро-2,4-диметилпиридо[2,3-d]пиримидин-7(6 Н)-он взаимодействует с хлорили бром[2-[2-(трет-бутил)-2 Н-тетразол-5 ил]фенил]цинком на стадии С. Предпочтительно реактив Гриньяра получают взаимодействием 2-трет-бутил-5-(2-бромфенил)-2 Н-тетразола с магнием. Предпочтительно на стадии С используют палладиевый катализатор. Предпочтительно палладиевый катализатор получают из PdCl2, Pd(ОАс)2, Pd2(dba)3 илиPdCl2(РРh3)2 и добавки, выбранной из группы,включающей РРh3, Р(о-толил)3, Р(2-фурил)3,Р(трет-бутил)3, Р(OiPr)3, CuJ, CuBr, AsPh3,DPPP, DPPB и DIBAL. Предпочтительно палладиевый катализатор получают в реакционной емкости, содержащей хлор- или бром[2-[2-(трет-бутил)-2 Нтетразол-5-ил]фенил]цинк. Предпочтительно взаимодействия на стадиях В и С и получение палладиевого или никелевого катализатора проводят в одной реакционной смеси. Другим предпочтительным воплощением данного изобретения является способ получения 8-[2(2(1)-трет-бутил-2 Н-тетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Нпиридо[2,3-d]пиримидин-7-она (или такого соединения, в котором вместо трет-бутильной группы присутствует бензильная или п-метоксибензильная группа) или его соли, указанный способ характеризуется В) переметаллированием бром-[2-[2-(третбутил)-2 Н-тетразол-5-ил]фенил]магния,который представляет собой реактив Гриньяра, хлоридом цинка; и С) взаимодействием продукта реакции переметаллирования с 8[(4-бромфенил)метил]-5,8 дигидро-2,4-диметилпиридо[2,3-d]-пиримидин 7(6 Н)-оном в присутствии палладиевого катализатора с получением продукта (где на всем протяжении процесса вместо трет-бутильной группы может присутствовать бензильная или пметоксибензильная группа). Предпочтительно способ включает дополнительную стадию удаления защитной группы из продукта для получения 8-[2'-(1 Н-тетразол-5 ил)дифенил-4-ил-метил]-2,4-диметил-5,8 дигидро-6 Н-пиридо[2,3-d]пиримидин-7-она или его соли. В дополнительном аспекте изобретение относится к соединению формулы VIIR11 - цинксодержащий фрагмент, такой как ZnCl или ZnBr. Предпочтительно R10 представляет собой алкильную группу с разветвленной углеродной цепью, такую как трет-бутил. Предпочтительный способ получения промежуточного продукта 8-[2'(2(1)-трет-бутил-2 Нтетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7 она показан на следующей схеме: Трет-бутилбромтетразол (1) взаимодействует с магнием с получением соответствующего реактива Гриньяра (1 а), который обрабатывают хлоридом цинка, в результате чего образуется цинкорганический продукт (2). Последний не выделяют и обрабатывают бромбензиллактамом(3) в присутствии каталитического количества палладиевого или никелевого катализатора для получения нужного промежуточного продукта(4). Удаление защитной группы известными способами (например, гидролизом с использованием в качестве катализатора кислоты, например, 2 N HCl) и дополнительная перекристаллизация, если это необходимо, приводят к получению продукта (5), который является лекарственным средством. Подходящие способы удаления защитной группы описываются в публикациях: патент США 5149699 (Ellingboe etal.), который введен в список ссылок данного изобретения, (см., например, пример 3, стадия 6), и J. W. Ellingboe et al., J. Med. Chem. 1994, 37,542-550. Например, соединение, содержащее защитную группу, можно смешать с приблизительно 10 молярным избытком метансульфоновой кислоты в толуоле и кипятить с обратным холодильником в течение приблизительно 18 ч. После этого смесь можно упарить и добавить воду и 1 N КОН для получения раствора с рН 8. Полученную смесь можно экстрагировать этилацетатом для удаления непрореагировавшего 11 исходного материала, и водную фракцию подкислить 1 N HCl до рН 5. Затем продукт можно экстрагировать этилацетатом, этилацетатную фракцию высушить над MgS04 и упарить и, если потребуется, растереть в порошок (например, со смесью ацетон/эфир) с получением продукта, не содержащего защитной группы, в виде твердого вещества. Особенно предпочтительным является способ получения 8-[2'-(2(1)-трет-бутил-2 Нтетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7 она или его соли, характеризующийся А) взаимодействием 2-трет-бутил-5-(2 бромфенил)-2 Н-тетразола с магнием с получением бром[2-[2-(трет-бутил)-2 Н-тетразол-5 ил]фенилмагния, который представляет собой реактив Гриньяра; В) реакцией переметаллирования указанного реактива Гриньяpa с хлоридом цинка для получения бром[2-[2-(трет-бутил)-2 Н-тетразол 5-ил]фенил]цинка; и С) взаимодействием указанного хлор[2-[2(трет-бутил)-2 Н-тетразол-5-ил]фенил]цинка с 8[(4-бромфенил)метил]5,8-дигидро-2,4-диметилпиридо[2,3-d]пиримидин-7(6 Н)-оном в присутствии палладиевого катализатора с получением продукта -8-[2'-(2(1)-трет-бутил-2 Н-тетразол-5 ил)дифенил-4-ил-метил]-2,4-диметил-5,8 дигидро-6 Н-пиридо[2,3-d]пиримидин-7-она или его соли. В указанных выше реакциях третбутилбромтетразол (1) [или другое соединение формулы III] предпочтительно получают и используют в молярном избытке бромбензиллактама (3) [или другого соединения формулы II] при соотношении этих реагентов 1-2:1, предпочтительно 1,1-1,4:1 и наиболее предпочтительно 1,2-1,3:1. Реагент реакции переметаллирования предпочтительно используется в молярном соотношении к количеству третбутилбромтетразола (1) [или другого соединения формулы III], равном 1-3:1, предпочтительно 1,5-3:1, наиболее предпочтительно 2-2,5:1. Палладиевый или никелевый катализатор предпочтительно используется в молярном отношении к количеству бромбензиллактама (3) [или другого соединения формулы II], равном 0,0050,05:1, предпочтительно 0,01-0,03:1, наиболее предпочтительно 0,015-0,03:1. Растворитель, используемый на стадии А(или, в более общем случае, в реакции соединений формулы V) представляет собой простой эфир, такой как тетрагидрофуран (ТГФ), диметоксиэтан (ДМЭ), диэтиловый эфир или диоксан, который может использоваться на стадиях В или С (или, в более общем случае, в реакции соединений формул II, III и IV). Предпочтительным растворителем на стадии А (или, в более общем случае, в реакции соединений формулы V) является ТГФ. Предпочтительно дополнительный растворитель (помимо основного 12 растворителя) добавляют на стадии В (или, в более общем случае в реакции соединений формулы IV), дополнительный растворитель предпочтительно представляет собой не смешивающийся с водой растворитель. Дополнительный растворитель предпочтительно присутствует в объемном соотношении к основному растворителю, равном 0,1-5:1, предпочтительно 0,3-4:1,наиболее предпочтительно 1-2:1. Предпочтительно дополнительный растворитель смешивается с основным растворителем, но является не смешивающимся с водой. Дополнительный растворитель предпочтительно представляет собой углеводород, более предпочтительно ароматический углеводород. Особенно предпочтительными являются замещенный фенил или бензил,такие как толуол или ксилол. Предпочтительно на стадии переметаллирования В (или, в более общем случае, в реакции соединений формулы IV) температуру реакции поддерживают невысокой во избежание реакции между растворителем и реагентом реакции переметаллирования, но достаточно высокой для того, чтобы реагенты оставались в растворе. Подходящим является интервал температур от 30 до 50 С, предпочтительно от 30 до 40 С. Предпочтительными температурами на стадии поперечного связывания С являются температуры 50-70 С, более предпочтительно приблизительно 60-65 С. Стадии В и С (или, в более общем случае,реакцию соединений формул II, III и IV) предпочтительно проводят в одной реакционной емкости без выделения продукта реакции переметаллирования на стадии В (или, в более общем случае, соединение формулы III). Предпочтительно получение катализатора также проводят в той же реакционной емкости, которая используется на стадиях В и С (или, в более общем случае, для реакции соединений формул II,III и IV). Предпочтительно в палладиевом или никелевом катализаторах палладий или никель имеет степень окисления 0. Палладиевый или никелевый катализатор может добавляться либо в готовом виде, либо получаться непосредственно в процессе синтеза. Подходящими готовыми палладиевыми или никелевыми катализаторами для стадии С являются Pd2(dba)3, Ni(РРh3) иPd(РРh3)4. В соответствии с другим способом катализатор может быть получен непосредственно смешением Pd(ОАс)2, PdCl2, PdCl2 (РРh3)2,NiCl2 (dppe), NiCl2(PPh)2, Ni(acac)2 или Pd2(dba)3 с одним или более реагентами, имеющими двойную функциональность лиганд/восстановитель и использующимися в качестве добавок,такими как РРh3, Р(о-толил)3, Р(трет-бутил)3,Р(2-фурил)3, Р(OiPr)3, CuJ, CuBr, AsPh, DIBAL,dppp или dppb. Особенно предпочтительно получение катализатора in situ добавлением= 1,3-(дифенилфосфино)пропан; dppb = бис(1,4-дифенилфосфино)бутан]. Приведенные далее примеры иллюстрируют практическое использование данного изобретения. Пример 1. Получение 8-[2'(2(1)-трет-бутил-2 Нтетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7 она.(i) Получение цинкорганического соединения хлор[2-[2-(трет-бутил)-2 Н-тетразол-5 ил]фенил]цинка. 640 г Трет-бутилбромтетразола (1) растворяют в 1080 г тетрагидрофурана. 10% Этого раствора добавляют при перемешивании к суспензии 75,6 г магния (1,37 экв.) в 1080 г тетрагидрофурана при 40C. Добавляют 10,9 г 1,2 дибромэтана и реакционную смесь перемешивают в течение часа при температуре 40 С. Остаток раствора трет-бутилбромтетразола добавляют к суспензии магния с постоянной скоростью в течение 5 ч при добавлении 10 порций 10,9 г 1,2-дибромэтана каждый час. Реакционную смесь перемешивают в течение 20 ч при 40 С. К полученному реактиву Гриньяра добавляют 424 г хлорида цинка (1,37 экв.) в 2020 г тетрагидрофурана, поддерживая температуру в интервале 25-35 С. Полученную суспензию перемешивают в течение 1 ч при 30 С.(ii) Получение катализатора. 54,1 г 25%ного раствора DIBAL в толуоле добавляют в суспензию 30,6 г хлорида бис(трифенилфосфин) палладия (II) в 620 г тетрагидрофурана при 30 С. Полученный черный раствор перемешивают в течение 1 ч при 30 С.(iii) Реакция поперечного связывания 8[2'(2(1)-трет-бутил-2 Н-тетразол-5-ил)дифенил 4-ил-метил]-2,4-диметил-5,8-дигидро-6 Нпиридо[2,3-d]пиримидин-7-она. 603,4 г Бромбензиллактама (3) (0,77 экв.(1 добавляют к суспензии цинкорганического соединения с последующим добавлением каталитического раствора. Полученную реакционную смесь в виде суспензии нагревают до 64 С и выдерживают при этой температуре в течение 20 ч. После этого реакционную смесь охлаждают до 0 С и добавляют 2,1 л HCl и 1214 г толуола, поддерживая температуру в интервале 010 С. Полученную смесь перемешивают в течение 30 мин и делят на фракции. Органическую фракцию промывают 350 мл 1 N HCl. Фракции разделяют и добавляют 765 г концентрированного гидроксида аммония, поддерживая температуру в интервале 0-10 С. Полученную смесь делят на фракции, и к органической фракции добавляют 1821 г толуола, а затем 2,1 л 2 N HCl. Полученную смесь перемешивают в течение 30 мин при 5 С. Снова смесь делят на фракции, и органическую фракцию промывают 30,7 л 2 N 14 вают с 303 г толуола. Фракции разделяют и к водной фракции добавляют 2428 г толуола, а к органической фракции добавляют 2,8 л концентрированного гидроксида аммония, поддерживая температуру в интервале 0-10 С. Фракции разделяют и водную фракцию промывают 607 г толуола. Две органические фракции соединяют и промывают 2350 мл воды. Органическую фракцию сушат над сульфатом натрия и упаривают до масла. Получают 637 г продукта, выход(i) Получение цинкорганического соединения хлор[2-[2-(трет-бутил)-2 Н-тетразол-5 ил]фенил]цинка. 40 г Трет-бутилбромтетразола (1) растворяют в 35,6 г тетрагидрофурана. 10% Этого раствора добавляют при перемешивании к суспензии 4,8 г магния в 35,6 г тетрагидрофурана при 50 С. 2,4 г 1,2-дибромэтана добавляют в этот раствор и перемешивают его в течение 30 мин при 50 С. Остаток раствора третбутилбромтетразола с постоянной скоростью в течение 4 ч добавляют к суспензии магния и перемешивают в течение 2 ч при 50 С. После этого добавляют 0,4 г 1,2-дибромэтана и перемешивают при 50 С в течение дополнительных 5 ч. Половину полученного реактива Гриньяра переносят в колбу, содержащую раствор 10,2 г хлорида цинка в 43 г тетрагидрофурана, и раствор перемешивают в течение 1,5 ч при 35 С.(iii) Реакция связывания - получение 8[2'(2(1)-трет-бутил-2 Н-тетразол-5-ил)дифенил 4-ил-метил]-2,4-диметил-5,8-дигидро-6 Нпиридо[2,3-d]пиримидин-7-она. В суспензию цинкорганического соединения добавляют 20,9 г бромбензиллактама (3), а затем катализатор. Реакционную смесь нагревают до 70 С и выдерживают при этой температуре 2,5 ч, затем охлаждают до 0-5 С, добавляют 60 мл 13% водной уксусной кислоты и 28 г толуола. Полученную смесь перемешивают и фракции разделяют. 34,7 г Толуола и 10 мл 13% водной уксусной кислоты добавляют к органической фракции и смесь перемешивают. Фракции разделяют, органическую фракцию промывают 10 мл 13% водной уксусной кислоты. Фракции снова разделяют и добавляют 36 мл концентрированного гидроксида аммония. Фракции перемешивают и снова разделяют. 17 г Толуола и 60 мл 2 N HCl добавляют в органическую фракцию. Полученную смесь перемешивают в течение 30 мин при температуре 10 С, 15 затем фракции разделяют и органическую фракцию промывают 220 мл 2 N HCl. Фракции 2 N HCl соединяют и промывают 9 г толуола. Фракции разделяют и в водную фракцию добавляют 69,4 г толуола, а затем 30 мл NH40H,поддерживая температуру в интервале 0-10 С. Фракции разделяют и водную фракцию промывают 17 г толуола. Две органические фракции соединяют и промывают 210 мл воды, сушат над сульфатом натрия и упаривают. Добавляют 10 г изопропанола и полученную смесь нагревают до 50 С, добавляют 17,8 г гептана и полученную смесь охлаждают до 25 С, затем перемешивают 16 ч при 25 С, а затем 2 ч при 0 С. Полученную смесь фильтруют, кристаллический продукт промывают 215 мл смеси 2/1 гептан/изопропанол, в результате получают 19,9 г продукта, выход [из расчета на (3)] = 70%. Пример 3. Получение 8-[2'(2(1)-трет-бутил-2 Нтетразол-5-ил)дифенил-4-ил-метил]-2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3-d]пиримидин-7 она.(i) Получение реактива Гриньяра - бром[2[2-(трет-бутил)-2 Н-тетразол-5-ил]фенил]магния. 600 г Трет-бутилбромтетразола (1) растворяют в 640 г тетрагидрофурана. 10% Этого раствора добавляют при перемешивании в суспензию 72,6 г магния в 320 г тетрагидрофурана при 50 С. В этот раствор добавляют дополнительно 3,27 г 1,2-дибромэтана, затем перемешивают его еще 30 мин при 50 С. Остаток раствора третбутилбромтетразола добавляют к суспензии магния с постоянной скоростью в течение 6 ч,затем полученную смесь перемешивают в течение 2 ч при 50 С. В этот раствор добавляют дополнительно 3,27 г 1,2-дибромэтана и полученную смесь перемешивают при 50 С еще 5 ч и охлаждают до 25 С.(ii) Получение катализатора - 38,61 г триэтилфосфина растворяют в 291 г тетрагидрофурана. 11,01 г Ацетата палладия добавляют в этот раствор, полученную суспензию нагревают до 60 С и выдерживают при этой температуре в течение 3 ч, а затем охлаждают до 25 С.(iii) Получение цинкорганического соединения и реакция связывания - получение 8[2'(2(1)-трет-бутил-2 Н-тетразол-5-ил)-дифенил 4-ил-метил]-2,4-диметил-5,8-дигидро-6 Нпиридо[2,3-d]пиримидин-7-она. 565,2 г Хлорида цинка (2) и 567,3 г бромбензиллактама (3) растворяют в 1640 г тетрагидрофурана. Добавляют катализатор и полученную смесь нагревают до 60 С. К смеси в течение 8 ч добавляют реактив Гриньяра, поддерживая температуру на уровне 60 С. После завершения добавления реакционную смесь выдерживают при 60 С в течение дополнительных 4 ч и затем охлаждают до 25 С. Охлажденную реакционную смесь выливают в 1800 г 10% водной уксусной кислоты и 520 г толуола. 16 Фракции разделяют и 1040 г толуола и 300 г воды добавляют в органическую фракцию. Фракции разделяют и органическую фракцию последовательно промывают 300 г воды, 675 г гидроксида аммония и 300 г воды. Затем в органическую фракцию добавляют 520 г толуола и 1800 мл 2 N водной соляной кислоты, полученную смесь перемешивают при 10 С в течение 1 ч. Фракции разделяют и органическую фракцию экстрагируют 2600 мл 2 N водной соляной кислоты. Экстракты 2 N соляной кислоты соединяют и промывают 260 г толуола. 2081 г Толуола добавляют в кислотную водную смесь, а затем 648 г гидроксида аммония. Полученные фракции разделяют и органическую фракцию промывают 2300 г воды. Полученную органическую фракцию упаривают до масла, в которое добавляют 312 г изопропанола и полученную смесь нагревают до 50 С. К этой смеси добавляют 543 г гептана, смесь охлаждают до 0 С и фильтруют. Получают 581 г кристаллизованного продукта, выход [из расчета на (3)] = 76%. Пример 4. Получение 8-[2'(2(1)-трет-бутил-2 Н-тетразол-5-ил]дифенил-4-ил-метил]-2,4-диметил-5,8 дигидро-6 Н-пиридо[2,3-d]пиримидин-7-она. 600 г Трет-бутилбромтетразола (1) растворяют в 640 г тетрагидрофурана. 10% Этого раствора добавляют при перемешивании в суспензию 72,6 г магния в 320 г тетрагидрофурана при 50 С. К полученной смеси добавляют 3,27 г 1,2 дибромэтана и смесь перемешивают в течение 30 мин при 50 С. Остаток раствора трет-бутилбромтетразола добавляют к суспензии магния с постоянной скоростью добавления в течение 6 ч. Полученную смесь перемешивают дополнительно в течение 2 ч при 50 С, добавляют 3,27 г 1,2-дибромэтана и перемешивание продолжают при 50 С в течение еще 5 ч. Полученную смесь,содержащую реактив Гриньяра, охлаждают до 25 С. 527,2 г Хлорида цинка растворяют в смеси 844 г толуола и 844 г тетрагидрофурана. Реактив Гриньяра добавляют к раствору хлорида цинка и полученную суспензию перемешивают в течение 15 мин при 25 С для получения цинкорганической смеси. 527,2 г Бромбензиллактама (3), 10,13 г ацетата палладия и 23,7 г трифенилфосфина последовательно добавляют к цинкорганической смеси. Полученную смесь выдерживают при 60 С в течение 12 ч. После этого смесь охлаждают до 25 С, добавляют 733 г воды и фракции разделяют. Водную фракцию промывают 200 г толуола, а полученную органическую фракцию соединяют с первой органической фракцией. Полученную смесь промывают 3733 г воды,232 г гидроксида аммония и 533 г воды. Органическую фракцию упаривают до масла, добавляют 1433 г изопропанола и полученную смесь нагревают до 50 С. Смесь охлаждают до 10 С(5,5 г; 0,23 моля) и ТГФ (26 мл), позволяя температуре возрастать до приблизительно 55 С,смесь перемешивают в течение 30 мин при 55 С, затем добавляют ТГФ (40 мл). Вторую часть трет-бутилбромтетразола (30,4 г; 0,1 моля) добавляют по каплям в течение 4,5 ч. После завершения добавления смесь выдерживают при 55 С в течение 17 ч.(ii) Переметаллирование. Раствор реактива Гриньяра переносят в капельную воронку и добавляют при перемешивании в течение приблизительно 15 мин к смеси ZnCl2 (30 г; 0,22 моля) и толуола (117 мл) при 25 С, охлаждая реакционную смесь для сохранения температуры ниже 45 С. После завершения добавления смесь перемешивают в течение 30 мин.Примера Фосфин 5(i) Получение реактива Гриньяра. Раствор трет-бутилбромтетразола (1) (3,4 г; 0,011 молей) и 1,2-дибромэтана (0,4 г; 0,002 моля) при температуре 25C добавляют при перемешивании к смеси магния (3,9 г; 0,16 моля) и ТГФ (26 мл),позволяя температуре возрастать до приблизительно 55 С; смесь перемешивают при 55 С в течение 30 мин, затем добавляют ТГФ (40 мл). Вторую часть трет-бутилбромтетразола (1) (30,4 г; 0,1 моля) добавляют по каплям в течение 4,5 ч. По завершении добавления смесь выдерживают при 55 С в течение 17 ч.(ii) Переметаллирование. Раствор реактива Гриньяра переносят в капельную воронку и добавляют при перемешивании в течение приблизительно 15 мин к смеси ZnCl2 (30 г, 0,22 моля) и толуола (117 мл) при 25 С, охлаждая реакционную смесь для сохранения температуры ниже 45 С. После завершения добавления реакционную смесь нагревают до 45-50 С и перемешивают в течение 1 ч.(iii) Прямое получение катализатора и реакция сочетания. К смеси цинкорганического соединения последовательно добавляют бромбензиллактам (30 г; 0,086 моля) и Pd(OAc)2 (0,29 г; 0,0013 моля). Реакционную массу нагревают до 60 С и добавляют Рh3 Р (0,34 г; 0,0013 моля). Спустя 5 мин добавляют фосфин (см. таблицу). Смесь выдерживают при 60 С в течение 21 ч. Смесь охлаждают до 25-30 С и добавляют воду (40 г) и уксусную кислоту (4,1 г). Органическую фазу отделяют и промывают водой (40 г). Органическую фазу смешивают с водой (10 г) и 30% гидроксидом аммония (9,3 г); после разделения фаз органическую фазу смешивают с водой (30 г) и уксусной кислотой (приблизительно 1,66 г) до получения рН 5. Органическую фазу отделяют и анализируют методом ВЭЖХ относительно внутреннего стандарта (см. таблицу). Следующие примеры проводят в соответствии со способом, описанным в примере 5, заменяя фосфин добавками (например, dppp и т.д.), указанными в таблице. Выходы вычисляют из расчета на прореагировавший бромбензиллактам.(iii) Прямое получение катализатора и реакция поперечного связывания. К смеси, содержащей цинкорганическое соединение, последовательно добавляют бромбензиллактам (3) (30 г; 0,086 моля) и Pd(ОАс)2 (0,29 г; 0,0013 моля). Реакционная смесь нагревается до 60 С, и добавляют Рh3 Р (1,02 г, 0,039 моля). Смесь выдерживают при 60 С в течение 20 ч. Смесь охлаждают до 25-30 С и добавляют воду (40 г) и уксусную кислоту (4,2 г). Органическую фазу отделяют и промывают водой (40 г). В органическую фазу добавляют воду (10 г) и 30% гидроксид аммония (9,3 г), разделяют и снова добавляют воду (30 г) и уксусную кислоту(1,7 г) до доведения рН до 5. Органическую фазу отделяют и упаривают при 60 С под вакуумом, в результате получают остаток, который растворяют в изопропиловом спирте (85 г) при 50 С. Раствору дают кристаллизоваться при медленном охлаждении до 10 С и оставляют при этой температуре на ночь. Продукт выделяют фильтрованием. Промывают изопропиловым спиртом и сушат при 60 С под вакуумом, в результате получают 30 г чистого продукта (выход 74,6% из расчета на соединение 3). 19 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производных дифенила формулы I или его соли; где Х - защитная группа и R1, R2, R3 и R4 каждый независимо представляет собой водород, C1-6 алкил или C1-6 перфторалкил; R5 водород или, когда n равно 1, R5 вместе с R3 образует двойную связь; m равно 1, 2 или 3; n равно 0 или 1; р равно 0, 1 или 2; отличающийся тем, что проводят взаимодействие соединения формулы II или его соли; где R1-R5, m, n и р принимают указанные выше значения, R6 -хлор, бром или йод; с соединением формулы III или его солью; где Х - защитная группа и R7 - галогенид цинка в присутствии палладиевого или никелевого катализатора. 2. Способ по п.1, отличающийся тем, чтоR7 представляет собой ZnCl-, ZnBr-. 3. Способ по п.1, отличающийся тем, что катализатор получают из Pd(OAc)2 илиPdCl2(РРh3)2, NiCl2(dppe), NiCl2(РРh3)2, Ni(acac) или Pd2 dba3 и одного или более реагентов, обладающих двойной функцией восстановитель/лиганд, выбранных из группы, включающей РРh3, Р(о-толил)3, Р(2-фурил)3, Р(третбутил)3, Р(OiРr)3, СuJ, СuВг, АsРh3 и алюмогидрид диизобутила(DIBAL),1,3-бисдифенилфосфинопропан (DPPP) или 1,3-бисдифенил-фосфин-бутан (DPPB). 4. Способ по любому из пп.1-3, отличающийся тем, что катализатор получают непосредственно в реакционной емкости, в которой проводят реакцию соединений формул II и III. 5. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию соединений формулы II и Ш проводят в присутст 000622 20 вии растворителя, который является по существу не смешивающимся с водой. 6. Способ по любому из предыдущих пунктов, отличающийся тем, что реакцию соединений формул II и III проводят в присутствии смеси растворителей, включающей растворитель, по существу не смешивающийся с водой, и растворитель эфирного типа. 7. Способ по любому из предыдущих пунктов, отличающийся тем, что используемое в нем соединение формулы Ш получают переметаллированием соединений формулы IVMgI; с реагентом реакции переметаллирования,выбранным из группы, включающей хлорид цинка, бромид цинка, хлорид тpи (C1-6 алкил) олова или бромид три (С 1-6 алкил) олова. 8. Способ по п.7, отличающийся тем, что в качестве реагента реакции переметаллирования используется хлорид цинка. 9. Способ по п.7 или 8, отличающийся тем,что реакцию соединения формулы IV с реагентом реакции переметаллирования проводят в присутствии растворителя, который является по существу не смешивающимся с водой. 10. Способ по п.9, отличающийся тем, что реакцию соединения IV с реагентом реакции переметаллирования проводят в присутствии смеси растворителей, включающей растворитель, который является по существу не смешивающимся с водой, и растворитель эфирного типа. 11. Способ по любому из пп.1-10, отличающийся тем, что используемое в нем соединение формулы IV получают взаимодействием соединения формулы V или его соли; где Х - защитная группа и R9 - Вr или I; с магнием. 12. Способ по п.11, отличающийся тем, что взаимодействие соединения формулы V с магнием проводят в присутствии растворителя эфирного типа. 13. Способ по п.12, отличающийся тем,что, по меньшей мере, часть растворителя 21 эфирного типа, присутствующего во время реакции соединения формулы V с магнием, остается в процессе взаимодействия соединения формулы IV с реагентом реакции переметаллирования. 14. Способ по п.13, отличающийся тем,что, по меньшей мере, часть растворителя эфирного типа, присутствующего при проведении реакции соединения формулы V с магнием,остается во время реакции соединения формулыII с соединениями формулы III. 15. Способ по любому из пп.11-14, отличающийся тем, что взаимодействие соединений формулы IV и V и in situ получение палладиевого или никелевого катализатора проводят по существу в одной реакционной емкости. 16. Способ по п.15, отличающийся тем, что взаимодействие соединений формул II, III, IV иV и in situ получение палладиевого или никелевого катализатора проводят по существу в одной реакционной емкости. 17. Способ по любому из предыдущих пунктов, отличающийся тем, что m равно 1, n равно 0, р равно 1, R1 и R2 каждый представляет собой метил и R3 и R4 каждый представляет собой водород. 18. Способ по любому из предыдущих пунктов, отличающийся тем, что Х представляет собой C1-6 алкил, фенил или бензил, в каждом случае необязательно замещенный и содержащий один или большее количество заместителей, выбранных из группы, включающей C1-6 алкил, C1-6 алкоксигруппу, нитро-, аминогруппу,(C1-6) алкиламино-, ди(С 1-6) алкиламино-, тио(C1-6) алкил или фенил. 19. Способ по п.18, отличающийся тем, что Х - C1-6 алкил, необязательно замещенный и содержащий один или большее количество заместителей, выбранных из группы, включающей C1-6 алкоксигруппу, нитро-; аминогруппы,(C1-6) алкиламино-, ди(С 1-6) алкиламино- или тио(C1-6) алкил. 20. Способ по пп.18, 19, отличающийся тем, что C1-6 алкоксигруппу выбирают из метокси-, этокси-, пропокси-, бутоксигрупп. 21. Способ по п.20, отличающийся тем, что Х представляет собой трет-бутил. 22. Способ по любому из предыдущих пунктов, отличающийся тем, что R6 представляет собой бром. 23. Способ по любому из предыдущих пунктов, отличающийся тем, что R8 представляет собой MgBr. 24. Способ по любому из предыдущих пунктов, отличающийся тем, что R9 представляет собой бром. 25. Способ получения 8-[2'-(2(1)-третбутил-2 Н-тетразол-5-ил)-дифенил-4-ил-метил]2,4-диметил-5,8-дигидро-6 Н-пиридо[2,3d]пиримидин-7-она (или такого соединения, где бензильная или n-метоксибензильная группа присутствует вместо трет-бутильной группы) 22 или его соли, отличающийся тем, что он включает следующие стадии:A) взаимодействие 2-трет-бутил-5-(2-бромили йодфенил)-2 Н-тетразола с магнием с получением бром- или йод[2-[2-(трет-бутил)-2 Нтетразол-5-ил]фенил]магниевого реактива Гриньяра,B) переметаллирование указанного реактива Гриньяра с хлоридом цинка, бромидом цинка или хлоридом трибутилолова иC) взаимодействие продукта реакции переметаллирования с 8[(4-бром-,йодфенил)метил]-5,8-дигидро-2,4-диметилпиридо[2,3d]-пиримидин-7(6 Н)-оном в присутствии палладиевого или никелевого катализатора для получения продукта; причем на протяжении способа бензильная или n-метоксибензильная группа может присутствовать вместо трет-бутильной группы. 26. Способ по п.25, отличающийся тем, что на стадии С используют 2-трет-бутил-5-(2 бромфенил)-2 Н-тетразол. 27. Способ по п.25, отличающийся тем, что в нем используют трет-бутильную группу. 28. Способ по п.25, отличающийся тем, что хлорид цинка представляет собой реагент реакции металлирования на стадии С. 29. Способ по п.25, отличающийся тем, что 8[(4-бромфенил)метил]-5,8-дигидро-2,4 диметилпиридо[2,3-d]-пиримидин-7(6 Н)-он реагирует с хлор- или бром[2-[2-(трет-бутил)-2 Нтетразол-5-ил]фенил]цинком на стадии С. 30. Способ по п.25, отличающийся тем, что палладиевый катализатор используют на стадии С. 31. Способ по п.25, отличающийся тем, что палладиевый катализатор получают из Pd(OAc)2 или РdСl2(РРh3)2 и добавки, выбранной из группы, включающей РРh3, Р(о-толил)3, Р(2-фурил)3,Р(трет-бутил)3, Р(OiРr)3, CuJ, CuBr, АsРh3DIBAL. 32. Способ по п.29, отличающийся тем, что фосфинированный палладиевый катализатор получают в реакционной емкости, содержащей хлор- или бром[2-[2-(трет-бутил)-2 Н-тетразол-5 ил]фенил]цинк. 33. Способ по п.25, отличающийся тем, что реакцию стадий В и С и получение палладиевого или никелевого катализатора с или без добавки проводят в одной реакционной емкости. 34. Способ по п.25, отличающийся тем, что проводятB) переметаллирование бром 2-[2-(третбутил)-2 Н-тетразол-5-ил]фенил]магния,который представляет собой реактив Гриньяра, с хлоридом цинка; иC) взаимодействие продукта реакции переметаллирования с 8[(4-бромфенил)метил]-5,8 дигидро-2,4-диметилпиридо[2,3-d]-пиримидин 7(6 Н)-оном в присутствии палладиевого катализатора для получения продукта. 35. Способ по любому из пп.25-34, отличающийся тем, что он включает дополнительную стадию удаления защитной группы из продукта для получения 8-[2'-(1 Н-тетразол-5 24 ил)дифенил-4-ил-метил]-2,4-диметил-5,8 дигидро-6 Н-пиридо[2,3-d] пиримидин-7-она или его соли.
МПК / Метки
МПК: C07D 471/04, C07F 3/06
Метки: дифенила, производных, получения, способ
Код ссылки
<a href="https://eas.patents.su/13-622-sposob-polucheniya-proizvodnyh-difenila.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения производных дифенила</a>
Предыдущий патент: Полиамид, способ его получения и композиция, его содержащая.
Следующий патент: Замещенные бензотиазолы в качестве средств защиты растений.
Случайный патент: Способ увеличения проницаемости древесины












