Способ получения оланзапина
Номер патента: 14934
Опубликовано: 29.04.2011
Авторы: Сент-Кирайи Жужанна, Кованьине Лакс Дьёрдь, Краснаи Дьёрдь, Верецкенэ Донат Дьёрдь, Немет Габор, Мештерхази Норберт, Надь Калман
Формула / Реферат
1. Способ получения 2-метил-4-(4-метилпиперазин-1-ил)-10Н-тиено[2,3-b][1,5]бензодиазепина (оланзапина) формулы (IA)
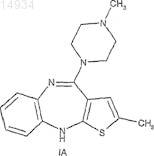
путем реакции 4-амино-2-метил-10Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорида формулы (II)

с N-метилпиперазином в органическом растворителе, который включает проведение реакции в смеси толуола и 1,3-диметил-2-имидазолидинона.
2. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 3:1.
3. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 1:1.
4. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 2:1.
5. Способ по любому из пп.1-4, который включает проведение реакции при температуре от 100 до 130°С.
6. Способ по любому из пп.1-5, который включает проведение реакции в течение 8-11 ч.
7. Способ по п.6, который включает проведение реакции в течение 9 ч.
Текст
Изобретение относится к способу получения 2-метил-4-(4-метилпиперазин-1-ил)-10 Н-тиено[2,3b][1,5]бензодиазепина (оланзапина) формулы (I) путем реакции 4-амино-2-метил-10 Н-тиено[2,3b][1,5]бензодиазепина гидрохлорида формулы (II) с N-метилпиперазином в органическом растворителе, который включает проведение реакции в смеси толуола и 1,3-диметил-2 имидазолидинона.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ 014934 Область техники Настоящее изобретение относится к улучшенному способу получения оланзапина. Известно, что 2-метил-4-(4-метилпиперазин-1-ил)-10 Н-тиено[2,3-b][1,5]бензодиазепин формулы(далее оланзапин) представляет собой ценное антипсихотическое лекарственное средство. Впервые оланзапин был описан в публикации ЕР 454436. На конечной стадии синтеза предложенного в описании изобретения к указанному патенту 4-амино-2-метил-10 Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорид формулы (II) подвергают реакции с избытком N-метилпиперазина в течение 20 ч в атмосфере азота в смеси толуола и диметилсульфоксида 1:1 при температуре кипения смеси и охлаждают реакционную смесь до 50 С. Оланзапин кристаллизуется при добавлении к смеси небольшого количества воды, и полученный таким образом сырой продукт перекристаллизовывают из ацетонитрила. Желаемый оланзапин получают с выходом 48%. Эта реакция изображена на реакционной схеме 1. В международной заявке на патент WO 2004/094433 А 1 предложены две новые полиморфные формы оланзапина дигидрохлорида и, кроме того, новый полиморфный оланзапина моногидрохлорид. В описании изобретения к европейскому патенту 733635 раскрывается получение оланзапина так называемого "технического качества". Этот способ также осуществляют согласно реакционной схеме 1 с тем отличием, что используют шестикратное количество диметилсульфоксида при температуре 120 С. Прохождение реакции определяют с помощью ВЭЖХ. Реакцию проводят до тех пор, пока в смеси не останется 5% остаточного исходного вещества формулы (II). Затем ее охлаждают до 20 С, и оланзапин кристаллизуют при 5 С с последующим добавлением к смеси десятикратного количества метанола и трехкратного количества воды. Выход полученного таким образом неочищенного основания оланзапина составляет 76,7%. Авторы настоящего изобретения воспроизвели вышеупомянутую реакцию, проводя ее в диметилсульфоксиде или в смеси толуола и диметилсульфоксида 1:1, как описано в уровне техники. При воспроизведении выяснилось, что образуется нежелательное количество N-оксида оланзапина формулы (III) даже если реакцию проводят в атмосфере инертного газа (например, азота или аргона). Это является особенно неожиданным, потому что согласно экспериментам авторов настоящего изобретения диметилсульфоксид не окисляет оланзапин, при том, что согласно многим имеющимся публикациям, диметилсульфоксид действует как окислитель. Несмотря на этот факт, если в качестве растворителя для реакции,изображенной на реакционной схеме 1, применяют диметилсульфоксид, образуется большее количество-1 014934 нежелательного N-оксида формулы (III). Все более строгие аналитические требования, предъявляемые к фармакологическим веществам, предписывают уменьшать количество примесей, например N-оксида формулы (III), насколько это возможно. Согласно опыту авторов настоящего изобретения количество примеси формулы (III), присутствующей в фармацевтической композиции, содержащей оланзапин в качестве активного ингредиента, увеличивается при хранении. Из-за структурного сходства между оланзапином и его N-оксидом формулы (III) разделение двух соединений, т.е. удаление примеси формулы (III),с одной стороны, является трудным и, с другой стороны, неизбежно приводит к потерям. Краткое описание изобретения Целью настоящего изобретения является разработка промышленно применимого способа получения оланзапина, который позволяет свести к минимуму образование N-оксида формулы (III). Вышеупомянутая цель достигается настоящим изобретением. Настоящее изобретение основано на открытии, что если проводить реакцию, в смеси не диметилсульфоксида, а другого диполярного апротонного растворителя - 1,3-диметил-2-имидазолидинона - и толуола, N-оксид оланзапина формулы (III) образуется в значительно меньшем количестве, которое не создает проблем, связанных со стабильностью композиции, потому что даже при длительном хранении оно не увеличивается выше предела, разрешенного в фармацевтических композициях. Подробное описание изобретения Согласно одному аспекту настоящего изобретения, предложен способ получения 2-метил-4-(4 метилпиперазин-1-ил)-10 Н-тиено[2,3-b][1,5]бензодиазепина (оланзапина) формулы (IA) путем реакции 4-амино-2-метил-10 Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорида формулы (II) с N-метилпиперазином в органическом растворителе, который включает проведение реакции в смеси толуола и 1,3 диметил-2-имидазолидинона. 1,3-Диметил-2-имидазолидинон обладает благоприятными фармацевтическими свойствами. Он представляет собой сильно полярный апротонный растворитель, который является устойчивым в присутствии кислот и щелочей даже при высоких температурах и не вызывает коррозию. Температуры кипения и воспламенения 1,3-диметил-2-имидазолидинона являются высокими (225 и 120 С соответственно),LD50 (средняя смертельная доза) составляет 2840 мг/кг. Благодаря своей высокой диэлектрической проницаемости и эффектам сольватации 1,3-диметил-2-имидазолидинон активирует реагенты. Дополнительное преимущество применения 1,3-диметил-2-имидазолидинона заключается в том, что он лишен окислительных свойств, вредных как для окружающей среды, так и с точки зрения безопасности труда,которые характерны для диметилсульфоксида. В ходе реакции N-метилпиперазин предпочтительно применяют в избытке. Реакцию предпочтительно проводят в смеси 3:1, особенно предпочтительно в смеси 1:1, более предпочтительно в смеси 2:1 толуола и 1,3-диметил-2-имидазолидинона. Реакцию проводят при температуре от 100 до 130 С. Реакцию проводят в атмосфере инертного газа (предпочтительно азота или аргона). Дополнительное преимущество способа по изобретению заключается в том, что реакцию можно выполнить в течение значительно более короткого промежутка времени (в течение 8-11 ч, предпочтительно в течение 9 ч) по сравнению с реакцией, предложенной в уровне техники, которую проводят в среде диметилсульфоксида и которая занимает 20 ч. Основание оланзапина, полученное после упаривания реакционной смеси, имеет высокую чистоту. Если требуется, продукт можно перекристаллизовать из ацетонитрила. Изобретение предоставляет следующие преимущества. При получении основания оланзапина образуется меньшее количество нежелательной примеси Nоксида формулы (III). Способ обеспечивает получение оланзапина высокой чистоты с превосходным выходом. При получении оланзапина применяют растворитель, имеющий хорошие физические характеристики и пригодный с точки зрения экологических требований и требований охраны труда. Оланзапин может быть получен за значительно более короткий промежуток времени. Дополнительные характеристики настоящего изобретения представлены в следующих примерах,однако объем охраны не ограничивается указанными примерами. Пример 1. Основание оланзапина: (IA). К смеси 53,77 г (0,2 моль) 4-амино-2-метил-10 Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорида, 538 см 3 толуола и 269 см 3 ДМИ (1,3-диметил-2-имидазолидинона) добавляют при перемешивании 186 см 3(167,4 г, 1,67 моль) N-метилпиперазина, создают поток аргона и реакционную смесь нагревают до температуры кипения (126 С) при помощи масляной бани. Смесь нагревают при кипении в течение 9 ч до тех пор, пока с помощью ВЭЖХ не будет обнаруживаться 1%-ное количество стартового вещества. Затем ее упаривают при температуре 50-55 С и давлении 5-10 мбар. Полученный таким образом остаток охлаждают с помощью ледяной воды до температуры приблизительно 3-5 С, к нему по каплям добавляют 320 см 3 воды, при этом продукт непрерывно выделяется из реакционной смеси. Далее его перемешивают при температуре 5 С в течение 1 ч, отфильтровывают, промывают 120 см 3 воды и сушат при помощи инфракрасной лампы. Таким образом получают 56 г(89,6%) основания (Т.пл.: 189-193 С, ВЭЖХ: 98%), которое перекристаллизовают из 14-кратного количества ацетонитрила с образованием 42,6 г (76%) желаемого соединения. Т.пл.: 194-196 С, ВЭЖХ: 99,87%. 1 Н ЯМР (ДМСО, рабочая частота 500 МГц): : 7,59 (с, 1 Н), 6,84 (м, 1 Н), 6,81 (м, 1 Н), 6,79 (дд, 1 Н),6,69 (дд, 1 Н), 6,33 (д, 1 Н, J = 1,1 Гц), 3,33 (м, 4 Н), 2,37 (т, 4 Н), 2,27 (д, 3 Н, J = 1,1 Гц), 2,20 (с,3 Н). Пример 2. Основание оланзапина: (IA). К смеси 5 г (0,019 моль) 4-амино-2-метил-10 Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорида, 50 см 3 толуола и 50 см 3 ДМИ добавляют при перемешивании 17,5 см 3 N-метилпиперазина, создают поток аргона и реакционную смесь нагревают при кипении в течение 11 ч при температуре 130 С при помощи масляной бани. Затем ее упаривают при температуре от 50 до 55 С и давлении 5-10 мбар. Полученный в результате коричневый остаток охлаждают при перемешивании до температуры приблизительно 3-5 С при помощи ледяной воды. Затем к нему добавляют по каплям 30 см 3 воды при той же температуре. Далее его перемешивают в течение 1 ч, промывают водой и сушат. Таким образом получают 4,5 г (77,1%) желаемого соединения. Т.пл.: 193-196 С, ВЭЖХ: 98,8%. Пример 3. Основание оланзапина: (IA). К смеси 26,58 г (0,1 моль) 4-амино-2-метил-10 Н-тиено[2,3-b][1,5]бензодиазепина гидрохлорида, 266 см 3 толуола и 83 см 3 ДМИ добавляют при перемешивании 93 см 3 N-метилпиперазина, создают поток аргона и смесь нагревают при кипении на масляной бане при температуре 120 С в течение 9 ч. Затем реакционную смесь упаривают при температуре 50-55 С при давлении 5-10 мбар. Полученный таким образом остаток при перемешивании охлаждают до температуры приблизительно 3-5 С при помощи ледяной воды и к нему при той же температуре добавляют по каплям 160 см 3 воды. Далее смесь перемешивают в течение 1 ч при температуре приблизительно 5 С, отфильтровывают,промывают 60 см 3 воды и сушат. Таким образом получают 23,7 г (76%) желаемого соединения. Т.пл.: 194-196 С, ВЭЖХ: 99,18%. Пример 4. 4-2-Метил-10 Н-тиено[2,3-b][1,5]бензодиазепин-4-ил-1-метилпиперазин 1-оксид (III)[оланзапин N-оксид]. 5,0 г (0,016 моль) основания оланзапина суспендируют в 50 см 3 дихлорметана, суспензию охлаждают до 0-5 С, и к ней добавляют 4,05 г 75%-ной (3,03 г, 0,016 моль) м-хлорпербензойной кислоты. Далее смесь перемешивают сначала в течение 2 ч при температуре 0-5 С, затем в течение 10 ч при 10-12 С и обрабатывают следующим образом: ее выливают при перемешивании в 100 см 3 воды и экстрагируют 3 раза по 150 см 3 дихлорметана. Органическую фазу промывают последовательно раствором хлористого натрия и водой. В ходе экстракции "N-оксид" выделяется из водной фазы в виде белого осадка. Затем смесь фильтруют. Таким образом получают 4,1 г (79,1%) желаемого вещества. Т.пл.: 204-206 С, ВЭЖХ: 99,6%. При упаривании органической фазы, которая содержит также основание оланзапина, получают 2,78 г вещества. Путем очистки с использованием колоночной хроматографии в смеси толуола и метанола 6:4 получают дополнительно 1,6 г вещества, которое суспендируют в эфире и перекристаллизовывают из этанола. Таким образом получают дополнительно 0,8 г продукта, ВЭЖХ: 99,7%. Элементный анализ для формулы C37H20N4OS1,5 Н 2 О = 355,44 Рассчитано: С% 57,39, Н% 6,47, N% 15,76 Найдено: C% 57,25, H% 6,5, N% 15,8 ИК (KBr): 3213, 3051, 2945, 2915, 1588, 1563, 1466, 1416, 1283, 1220, 1136 1 Н ЯМР (ДМСО, рабочая частота 500 МГц): : 7,97 (с, 1 Н), 6,85 (т, 1 Н), 6,83 (т, 1 Н), 6,81 (дд, 1 Н),6,73 (дд, 1 Н), 6,39 (с, 1 Н), 3,78 (д, 2 Н), 3,6 (т, 2 Н), 3,42 (т, 2 Н),3,11 (с,3 Н), 2,96 (д,2 Н), 2,27 (с, 3 Н) 13 С ЯМР (ДМСО, рабочая частота 500 МГц): : 157,04, 154,2, 144,27, 140,6, 128,33, 127,72, 123,86,123,66, 122,66, 119,20, 117,78, 64,75, 60,37, 41,47, 15,27. Согласно данным масс-спектрометрии, М+Н находится при 329, осколочные ионы обнаруживаются при значениях масса/заряд 311, 285, 229. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения с N-метилпиперазином в органическом растворителе, который включает проведение реакции в смеси толуола и 1,3-диметил-2-имидазолидинона. 2. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 3:1. 3. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 1:1. 4. Способ по п.1, который включает применение смеси толуола и 1,3-диметил-2-имидазолидинона в объемном соотношении 2:1. 5. Способ по любому из пп.1-4, который включает проведение реакции при температуре от 100 до 130 С. 6. Способ по любому из пп.1-5, который включает проведение реакции в течение 8-11 ч. 7. Способ по п.6, который включает проведение реакции в течение 9 ч.
МПК / Метки
МПК: C07D 495/04, A61K 31/5513
Метки: получения, способ, оланзапина
Код ссылки
<a href="https://eas.patents.su/5-14934-sposob-polucheniya-olanzapina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения оланзапина</a>
Предыдущий патент: Пестицидные композиции
Следующий патент: Способы получения производных циклопропиламида
Случайный патент: Устройство для очистки плазмы дугового испарителя от незаряженных микро- и макрочастиц









