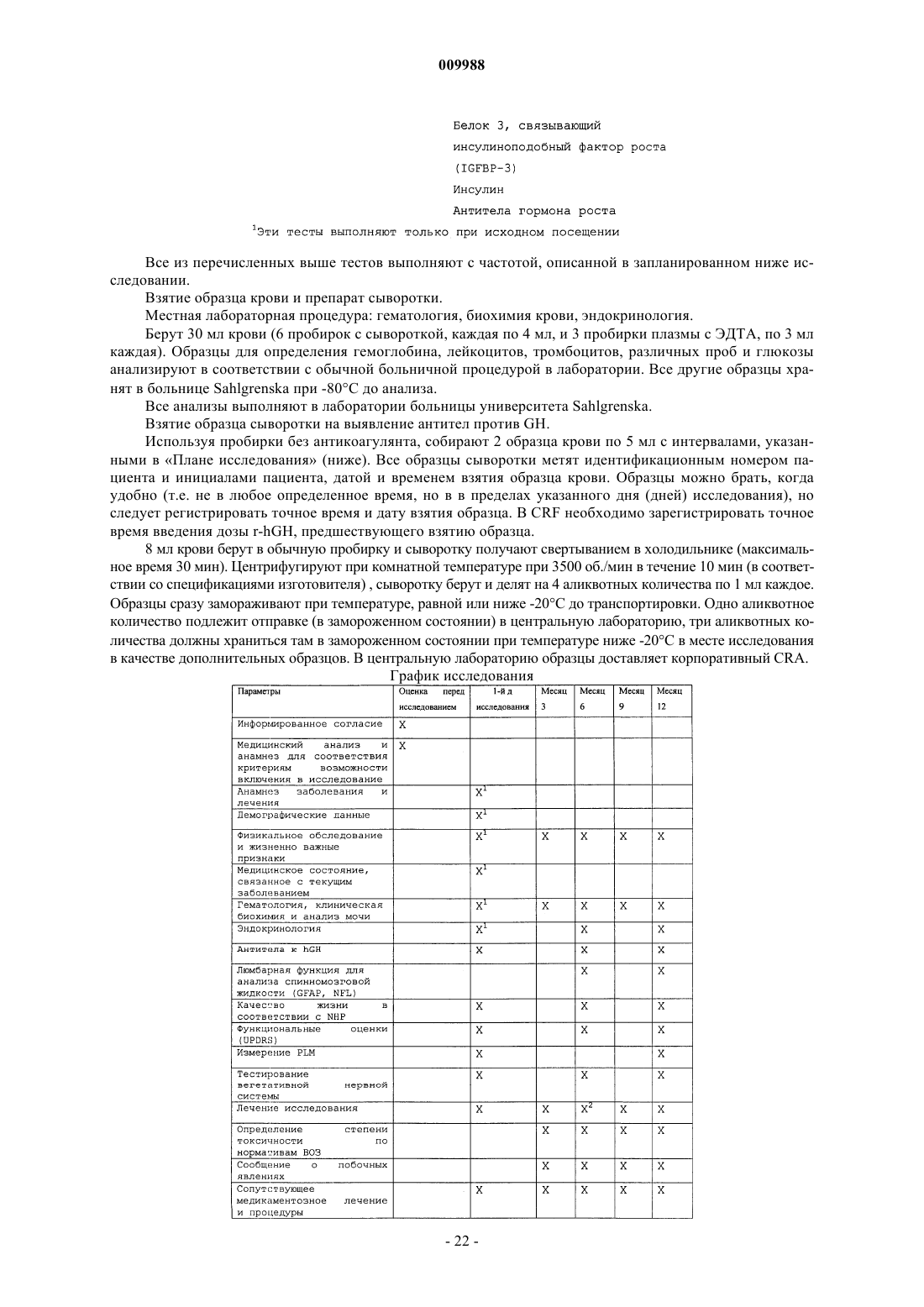
Применение человеческого гормона роста при множественной системной атрофии
Формула / Реферат
1. Применение вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для изготовления лекарственного средства для лечения и/или предотвращения синдрома "паркинсонизма-плюс", где вещество выбрано из:
a) человеческого гормона роста;
b) фрагмента (а), который обладает агонистической активностью в отношении рецептора hGH;
c) варианта (а) или (b), который имеет, по меньшей мере, идентичность последовательности 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGH;
d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент нативной последовательности ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGH;
e) соли или функционального производного (а), (b), (с) или (d), которое обладает агонистической активностью в отношении рецептора hGH;
f) гормона, высвобождающего человеческий гормон роста (hGHRH);
g) фрагмента (g), который обладает агонистической активностью в отношении рецептора hGHRH;
h) варианта (f) или (g), который имеет идентичность последовательности по меньшей мере 70% с (f) или (g) и который обладает агонистической активностью в отношении рецептора hGHRH;
i) варианта (f) или (g), который кодируется последовательностью ДНК, которая гибридизируется в комплемент последовательности нативной ДНК, кодирующей (f) или (g) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGHRH;
j) соли или функционального производного (f), (g), (h) или (i), которое обладает агонистической активностью в отношении рецептора hGHRH; или
k) их комбинации.
2. Применение по п.1, где синдром "паркинсонизма-плюс" выбран из группы, состоящей из прогрессирующего супрануклеарного паралича (PSP), множественной системной атрофии (MSA), бокового амиотрофического склероза Паркинсона-деменции Гуама, генерализованной болезни Леви организма, кортикобазилярной ганглионарной дегенерации, синдрома перекрытия Альцгеймера/Паркинсона, болезни Хантингтона: ригидного варианта, болезни Hallervorden-Spatz и синдрома Gerstmann-Strausler.
3. Применение по п.2, где синдром "паркинсонизма-плюс" представляет собой множественную системную атрофию.
4. Применение по любому из предыдущих пунктов, где вещество представляет собой естественно встречающийся человеческий гормон роста.
5. Применение по любому из пп.1-3, где человеческий гормон роста представляет собой рекомбинантный человеческий гормон роста.
6. Применение по п.1 или 5, где фрагмент человеческого гормона роста или рекомбинантного человеческого гормона роста представляет собой C-концевой фрагмент hGH.
7. Применение по п.6, где С-концевой фрагмент включает аминокислоты от 177 до 191 hGH.
8. Применение по п.1 или 5, где вариант человеческого гормона роста или рекомбинантного человеческого гормона роста представляет собой гормон роста, который имеет дополнительный остаток метионина на N-конце.
9. Применение по п.1 или 5, где фрагмент человеческого гормона роста или рекомбинантного человеческого гормона роста представляет собой гормон роста, лишенный 15 аминокислотных остатков с Glu32 по Glu46.
10. Применение по п.1, где фрагмент человеческого гормона роста представляет собой усеченный человеческий гормон роста, лишенный первых 8 аминокислотных остатков на N-конце.
11. Применение по п.1, где фрагмент человеческого гормона роста представляет собой усеченный человеческий гормон роста, лишенный первых 13 аминокислотных остатков на N-конце.
12. Применение по п.1, где функциональное производное включает димер человеческого гормона роста, выбранный из группы, состоящей из дисульфидного димера, соединенного посредством межцепочечных дисульфидных связей, ковалентного необратимого недисульфидного димера, нековалентного димера и их смесей.
13. Применение по п.1, где функциональное производное представляет собой химическое производное человеческого гормона роста.
14. Применение по п.13, где человеческий гормон роста ацетилирован на N-конце.
15. Применение по п.13 или 14, где человеческий гормон роста деаминирован.
16. Применение по любому из пп.13-15, где человеческий гормон роста сульфоксидирован у одного или нескольких метиониновых остатков.
17. Применение по п.1, где функциональное производное включает по меньшей мере одну составляющую часть, присоединенную к одной или нескольким функциональным группам, которые встречаются в виде одной или нескольких боковых цепей на аминокислотных остатках.
18. Применение по п.17, где составляющая часть представляет собой составляющую часть полиэтиленгликоль (PEG).
19. Применение по любому из пп.1-18, где лекарственное средство дополнительно включает IGF (инсулиноподобный фактор роста (IGF)).
20. Применение по п.19, где IGF выбран из IGF-I или IGF-II.
21. Применение по п.19 или 20, где лекарственное средство дополнительно включает IGFBP (белок, связывающий инсулиноподобный фактор роста) для одновременного, последовательного или отдельного применения.
22. Применение по п.21, где IGFBP представляет собой IGFBP3.
23. Применение молекулы нуклеиновой кислоты, включающей последовательность, кодирующую вещество, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома "паркинсонизма-плюс", в частности множественной системной атрофии, где вещество выбрано из:
a) человеческого гормона роста;
b) фрагмента (а), который обладает агонистической активностью в отношении рецептора hGH;
c) варианта (а) или (b), который имеет, по меньшей мере, идентичность последовательности 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGH;
d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент нативной последовательности ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGH;
e) гормона, высвобождающего человеческий гормон роста (hGHRH);
f) фрагмента (е), который обладает агонистической активностью в отношении рецептора hGHRH;
g) варианта (е) или (f), который имеет идентичность последовательности по меньшей мере 70% с (е) или (f) и который обладает агонистической активностью в отношении рецептора hGHRH;
h) варианта (е) или (f), который кодируется последовательностью ДНК, которая гибридизируется в комплемент последовательности нативной ДНК, кодирующей (е) или (f) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGHRH; или
i) их комбинации.
24. Применение вектора для индукции и/или усиления эндогенной продукции вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома "паркинсонизма-плюс", в частности множественной системной атрофии, где вектор включает молекулу нуклеиновой кислоты по п.23.
25. Применение клетки, которая была генетически модифицирована для продукции вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома "паркинсонизма-плюс", в частности множественной системной атрофии, где вещество выбрано из:
a) человеческого гормона роста;
b) фрагмента (а), который обладает агонистической активностью т отношении рецептора hGH;
c) варианта (а) или (b), который имеет, по меньшей мере, идентичность последовательности 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGH;
d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент нативной последовательности ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGH;
e) гормона, высвобождающего человеческий гормон роста (hGHRH);
f) фрагмента (е), который обладает агонистической активностью в отношении рецептора hGHRH;
g) варианта (е) или (f), который имеет идентичность последовательности по меньшей мере 70% с (е) или (f) и который обладает агонистической активностью в отношении рецептора hGHRH;
h) варианта (е) или (f), который кодируется последовательностью ДНК, которая гибридизируется в комплемент последовательности нативной ДНК, кодирующей (е) или (f) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGHRH; или
i) их комбинации.
26. Способ лечения синдрома "паркинсонизма-плюс", в частности множественной системной атрофии, включающий введение нуждающемуся в нем пациенту эффективного количества вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, где вещество выбрано из:
a) человеческого гормона роста;
b) фрагмента (а), который обладает агонистической активностью в отношении рецептора hGH;
c) варианта (а) или (b), который имеет, по меньшей мере, идентичность последовательности 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGH;
d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент нативной последовательности ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGH;
e) соли или функционального производного (а), (b), (с) или (d), которое обладает агонистической активностью в отношении рецептора hGH;
f) гормона, высвобождающего человеческий гормон роста (hGHRH);
g) фрагмента (g), который обладает агонистической активностью в отношении рецептора hGHRH;
h) варианта (f) или (g), который имеет идентичность последовательности по меньшей мере 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGHRH;
i) варианта (f) или (g), который кодируется последовательностью ДНК, которая гибридизируется в комплемент последовательности нативной ДНК, кодирующей (f) или (g) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGHRH;
j) соли или функционального производного (f), (g), (h) или (i), которое обладает агонистической активностью в отношении рецептора hGHRH; или
k) их комбинации.
27. Способ по п.26, где указанное вещество вводится в дозировке примерно от 0,1 до 10 мг в день на человека или примерно от 0,5 до 6 мг в день на человека.
28. Способ по п.26, где указанное вещество вводится в дозировке примерно 1 мг в день на человека.
29. Способ по любому из пп.26-28, где указанное вещество вводится ежедневно или через день.
30. Способ по любому из пп.26-28, где указанное вещество вводится в чередующихся суточных дозировках, причем первая дозировка выше, чем вторая дозировка.
31. Способ по п.30, где первая дозировка составляет примерно 1 мг на человека, а вторая дозировка составляет примерно 0,5 мг на человека.
32. Способ по любому из пп.26-31, где недельная дозировка указанного вещества составляет примерно 6, или примерно 5, или примерно 4,5 мг на человека.
33. Способ по любому из пп.26-31, где указанное вещество вводится подкожно.
34. Способ по любому из пп.26-31, где указанное вещество вводится внутримышечно.
35. Способ по любому из пп.26-31, где указанное вещество вводится автоинжектором.
Текст
009988 Область изобретения Настоящее изобретение относится к области неврологических заболеваний. Конкретнее, оно относится к применению человеческого гормона роста для изготовления лекарственного средства для лечения и/или предотвращения синдромов паркинсонизма-плюс, и в частности множественной системной атрофии (MSA). Уровень техники Человеческий гормон роста (hGH), также известный как соматропин (INN) или соматотропин,представляет собой белковый гормон, продуцируемый и секретируемый соматотропными клетками переднего гипофиза. Человеческий гормон роста играет ключевую роль в соматическом росте в детском возрасте и в метаболизме во взрослом возрасте посредством его воздействий на метаболизм белков, углеводов и липидов. Человеческий гормон роста представляет собой одиночную полипептидную цепь из 191 аминокислоты (Bewly et al., 1972), имеющую 2 дисульфидных связи, одну между Cys-54 и Cys-165, формирующими большую петлю в молекуле, и другую между Cys-182 и Cys-189, формирующими небольшую петлю около С-конца. О последовательности ДНК, которая подтверждала аминокислотную последовательность, сообщали Martial et al. (1979). Очищенный hGH представляет собой белый аморфный порошок в его лиофилизированной форме. Он легко растворим (концентрации 10 мг/л) в водных буферах при рН в диапазоне от 6,5 до 8,5. В растворе hGH существует преимущественно в виде мономера при небольшой фракции в виде димеров и олигомеров более высокой молекулярной массы. В определенных условиях может быть индуцировано формирование hGH больших количеств димеров, триммеров и высших олигомеров. Известны несколько производных hGH, включая естественно встречающиеся производные, варианты и метаболические продукты, продукты распада преимущественно биосинтетического hGH и созданные методами генной инженерии производные hGH, полученные генетическими способами. Один пример естественно встречающихся производных hGH представляет собой GH-V, вариант гормона роста,обнаруживаемый в плаценте. Другие члены генного локуса описаны в публикации Chen et al. (1989). Метионил hGH представлял собой первую форму hGH, полученную посредством технологии рекомбинантной ДНК. Это соединение, в действительности, представляет собой производное hGH, имеющее один дополнительный остаток метионина на ее N-конце (Goeddel et al., 1979). Сообщалось о наличии в гипофизе, а также в системе кровотока естественно встречающегося варианта hGH, называемого 20-K-hGH (Lewis et al., 1978; Lewis et al., 1980). Это соединение, которое не имеет 15 аминокислотных остатков от Glu-32 до Gln-46, возникает в результате альтернативного сплайсинга матричной рибонуклеиновой кислоты (DeNoto et al., 1981). Это соединение разделяет многие, но не все биологические свойства hGH. 20-K-hGH вырабатывается в гипофизе и секретируется в кровь. Он составляет примерно 5% выхода гормона роста взрослых людей и примерно 20% выхода гормона роста детей. Он обладает такой же стимулирующей рост активностью, как и гормон роста 22 кДа, и, по имеющимся данным, имеет такое же или большее количество липолитической активности, чем форма 22 кДа. Он связывается с рецепторами гормона роста с таким же аффинитетом, что и гормон роста 22 кДа, и обладает 1/10 лактогенной биологической активности (подобной пролактину) гормона 22 кДа. В отличие от гормона 22 кДа, 20-K-hGH обладает слабой антиинсулиновой активностью. Ряд производных hGH возникает в результате протеолитических модификаций молекулы. Первичный путь метаболизма hGH включает протеолиз. Область hGH вокруг остатков 130-150 крайне восприимчива к протеолизу, и были описаны несколько производных hGH, имеющих однонитевые разрывы или делеции в этой области (Thorlacius-Ussing, 1987). Эта область находится в большой петле hGH, и расщепление пептидной связи в ней приводит к генерированию двух цепей, которые соединяются посредством дисульфидной связи у Cys-53 и Cys-165. Сообщается, что многие из этих двухцепочечных форм имеют повышенную биологическую активность (Singh et al., 1974). Различные производные человеческого гормона роста были созданы искусственно посредством использования ферментов. Ферменты трипсин и субтилизин, а также другие, использовались для модификации hGH в различных точках по всей молекуле (Lewis et al., 1977; Graff et al., 1982). Одно такое производное, называемое двухцепочечным анаболическим белком (2-CAP), было сформировано посредством регулируемого протеолиза hGH с использованием трипсина (Becker et al., 1989). Было обнаружено, что 2-CAP имеет биологические свойства, очень отличающиеся от свойств интактной молекулы hGH тем, что способствующая росту активность hGH в значительной степени сохранялась, а большинство воздействий на углеводный обмен отсутствовало. Остатки аспарагина и глутамина в белках восприимчивы к реакциям деамидирования в соответствующих условиях. Было показано, что гипофизарный hGH подвергается этому типу реакции, приводящему к превращению Asn-152 в аспарагиновую кислоту, а также, в меньшей степени, к превращению Gln-137 в глутаминовую кислоту (Lewis et al., 1981). Было показано, что деамидированный hGH имеет измененную восприимчивость к протеолизу фермента субтилизина, свидетельствуя о том, что деамидирование может иметь физиологическое значение в направлении протеолитического расщепления hGH. Известно, что биосинтетический hGH разрушается в определенных условиях хранения, приводя к деамидированию у другого аспарагина (Asn-149). Это первичный сайт деамидирования, но также наблюдается деамидирование уAsn-152 (Becker et al., 1988). Не было сообщений о деамидировании Gln-137 в биосинтетическом hGH. Остатки метионина в белках восприимчивы к окислению, в первую очередь к сульфоксиду. И происходящий из гипофиза, и биосинтетический hGH подвергаются сульфоксидированию у Met-14 и Met125 (Becker et al., 1988). Сообщалось также об окислении у Met-170 в гипофизарном, но не в биосинтетическом hGH. Было обнаружено, что и дезамидный hGH, Met-14 сульфоксидный hGH проявляют полную биологическую активность (Becker et al., 1988). Были получены усеченные формы hGH или посредством действий ферментов, или генетическими методами. 2-САР, генерированный контролируемыми воздействиями трипсина, имеет удаленные первые 8 остатков на N-конце hGH. Другие усеченные варианты hGH были получены модификацией гена перед экспрессией у подходящего хозяина. Были удалены первые 13 остатков для получения производного, имеющего отличительные биологические свойства (Gertler et al., 1986), у которого полипептидная цепь не расщеплена. Хотя человеческий гормон роста был первоначально получен из гипофизов трупов, эти препараты не были электрофоретически однородными, и антитела появлялись в сыворотке пациентов, получавших препараты, имеющие чистоту порядка 50%, причем иммуногенность приписывали неактивным компонентам. Технология рекомбинантной РНК обеспечила возможность получения неограниченной поставкиhGH в ряде различных систем. Очистке hGH из культуральной среды способствует присутствие лишь небольших количеств загрязняющих белков. Действительно, было показано, что hGH можно очистить в лабораторном масштабе одной стадией очистки на колонке ВЭЖХ с обращенной фазой (Hsiung et al., 1989). Рекомбинантный человеческий гормон роста, rhGH, производится Serono International S.А. в виде продукта SEROSTIM, причем этот продукт получил ускоренное одобрение FDA (Администрации США по пищевым продуктам и лекарственным средствам) на применение для лечения потери массы тела и гипотрофии у пациентов со СПИДом. SAIZEN представляет собой рекомбинантный человеческий гормон роста, показанный для лечения недостаточности GH у детей, синдрома Тернера у девочек, а также хронической почечной недостаточности у детей. PROTROPIN, производимый Genetech, Inc. (South SanFrancisco, CA), слегка отличается по структуре от естественной последовательности hGH, имеющей дополнительный остаток метионина на N-конце. Рекомбинантный hGH, в целом, поступает в продажу в виде ампул, содержащих hGH плюс дополнительные эксципиенты, например глицин и манит, в лиофилизированной форме. Предоставляется сопутствующая ампула с разбавителем, позволяющая пациенту растворить продукт до желательной концентрации перед введением дозы. Рекомбинантный hGH может также поступать в продажу в других хорошо известных формах, таких как предварительно заполненные шприцы и т.д. В целом, не наблюдались существенные различия фармакокинетики или видах биологической активности hGH с рекомбинантной, естественной последовательностью, рекомбинантного N-метионилhGH, или полученного из материала гипофиза людей (Moore et al., 1988; Jorgensson et al., 1988). В течение развития эндогенный гормон роста стимулирует многочисленные ключевые явления и функции и действует прямо или косвенно, по существу, на каждую ткань в организме. Поэтому многочисленные рецепторы гормона роста в зрелой центральной нервной системе (ЦНС) могут предоставить новые стратегии лечения. Кроме того, GH оказывает метаболические воздействия, которые важны у многих видов после завершения основного роста тела. Хотя в течение длительного времени считалось, что воздействия GH полностью опосредуются через генерирование печеночного инсулиноподобного фактора роста-1 (IGF-1), в настоящее время ясно, что GH также оказывает прямые воздействия во многих тканях, действуя в содружестве с местно генерируемым IGF-1 (и, возможно, многими другими факторами роста), в дополнение к IGF-1 из циркулирующей крови. Хотя гормон роста, главным образом, синтезируется в гипофизе, имеется также широко распространенная эктопическая продукция в различных областях мозга (Johansson et al., 2000). Кроме того, в изобилии встречаются рецепторы гормона роста, IGF-1 и рецепторы IGF-1. Во время лечения ЦНС гормоном роста имеются также изменения уровней в CSF (спинно-мозговой жидкости) GH, зависимых отGH факторов и нейромедиаторов. Это может указызать на то, что нейроэндокринные механизмы участвуют в улучшении физического, а также психологического благополучия, наблюдаемого во время лечения гормоном роста у взрослых с недостаточностью гормона роста. Ранние экспериментальные данные показали, что GH увеличивает пластичность мозга. Например,исследования с GH, меченным радиоактивной меткой, свидетельствовали о присутствии специфических участков связывания в ЦНС, но они были немногочисленны и, в основном, идентифицировались в гипоталамических областях и в сосудистом сплетении, хотя предполагалось гораздо более широкое распределение (Harvey et al., 1993). Физиологический эффект GH в ЦНС представляет собой ингибирование его собственного высвобождения как часть цепи аутообратной связи (Tannenbaum, 1980). У пациентов с недостаточностью гормона роста (GHD) имеется более высокий уровень ощущаемых проблем, связанных с состоянием здоровья. Эти пациенты как группа менее энергичны, менее физически подвижны и более социально изолированы (Johansson et al., 2000). Кроме того, они хуже спят и имеют функцию памяти, которая ниже нормы. Эти пациенты жаловались, главным образом, на усталость, низкую энергию и отсутствие инициативы, отсутствие концентрации, трудности запоминания и раздражительность. Во время лечения GH энергия и настроение, а также память улучшились. Наблюдаемые изменения-2 009988 указывают на нормализацию, поскольку у здоровой популяции наблюдаются одинаковые уровни энергии, настроение и память. Недостаточность GH, а конкретнее лечение GH, связаны с разнообразными изменениями основных центральных нейромедиаторов, их биосинтетических ферментов или их рецепторов (Andersson et al., 1983),но физиологическая роль эндогенного GH, действующего непосредственно на эти системы, еще не была установлена. GH оказывает ряд нейротропных видов действия, хотя они в значительной степени упускаются из вида (стимуляция пролиферации нейронов и глии, увеличение миелинизации и увеличение размера мозга), в то время как недостаточность GH связана с недостаточностью развития мозга (Elias Eriksson, 1985). В одномесячном, двойном слепом, плацебо контролируемом исследовании ранее было показано,что лечение GH у взрослых с недостаточностью GH вызывает, в среднем, десятикратное увеличение уровня GH в CSF. Кроме того, во время лечения GH среднее увеличение концентрации IGF-1 в CSF составило примерно 50%, концентрация гомованилиновой кислоты (HVA), метаболита допамина, в CSFHVA в ЦНС указывает на то, что GH воздействует на оборот допамина в ЦНС, что согласуется с предыдущими исследованиями на животных и с исследованием Burman et al. (Burman et al., 1995). Представляется вероятным, что эти нейроэндокринные изменения могут участвовать в улучшении психологического благополучия во время лечения GH взрослых с недостаточностью GH. Синдромы паркисонизма-плюс, также называемые паркинсонными-плюс синдромами или просто синдромами паркинсон-плюс, формируют группу заболеваний, которые отличаются от классической болезни Паркинсона. Синдромы паркисонизма-плюс включают следующие заболевания: прогрессирующий супрануклеарный паралич (PSP), множественную системную атрофию (MSA), боковой амиотрофический склероз Паркинсона-деменцию Гуама, генерализованную болезнь телец Леви, кортикобазилярную ганглионарную дегенерацию (CGD), синдром перекрытия Альцгеймера/Паркинсона, болезнь Хантингтона: ригидный вариант, болезнь Hallevorden-Spatz, синдром Gerstmann-Strausler. При прогрессирующем PSP начало симптомов обычно происходит в возрасте от 55 до 70 лет, тогда как начало до 50 лет наблюдается редко. Со времени первого описания заболевания были предложены различные наборы клинических критериев. Двумя наиболее специфичными симптомами, на которых основывается клинический диагноз, являются супрануклеарный паралич взгляда, включающий неспособность поворачивать глаза в сторону тактильного стимула, и постуральная неустойчивость с ранним падением. Важные критерии исключения, такие как хороший и стойкий эффект, достигаемый лечением леводопа, синдром чужой руки, галлюцинаторный синдром, корковая деменция и ранние симптомы дисфункции вегетативной нервной системы были далее установлены в критериях, предложенных Litvanet al. в 1996 г. Сообщалось о характерной микроскопической патоморфологии в виде сплетений нервных волокон, нейропильных нитях и потере нейронов в бледном шаре, черной субстанции, верхнем мозолистом теле, сером веществе около водопровода, околопокровных областях, стволе мозга и продолговатом мозге. Патогенез PSP может быть связан с нарушением метаболизма компонентов клеточного каркаса(нервных волокон) с накоплением тау белка в нейронах и клетках глии. Считается, что PSP представляет собой спорадическое расстройство, но оно вызвано наследственной причиной, такой как генетическая изменчивость, связанная с геном тау. Ранними признаками являются двухсторонняя брадикинезия с ригидностью осевого типа, которая может даже отсутствовать в конечностях. Течение заболевания является всегда прогрессирующим и, как оказывается, менее вариабельно, чем болезни Паркинсона и MSA. Мужчины больше поражаются заболеванием и имеют тенденцию к худшему прогнозу, тогда как у женщин и пациентов с более ранним началом заболевания прогноз может быть несколько лучше. После нескольких лет заболевания клиническая картина часто становится более очевидной. Движения глаз становятся медленнее, сначала в горизонтальном направлении, затем в вертикальном направлении. Пациент испытывает затруднение при фокусировке и попытке смотреть в глаза клиницисту и имеет пристальный взгляд вследствие непроизвольной стойкой фиксации глаз. Позднее в ходе заболевания при PSP обнаруживается супрануклеарный офтальмопарез с параличом взгляда вниз и прямоугольноволновыми судорожными подергиваниями. Походка становится неуклюжей с отведением верхних конечностей, вращением при повороте и выпрямленным положением тела. Описано типичное удивленное выражение на лице, и пациент часто отрицает тяжелые проблемы вследствие дисфункции лобной доли. Тяжелая постуральная неустойчивость возникает наиболее выражено в середине течения заболевания, и она может быть доминирующей проблемой. Могут возникать множественные травмы с переломами верхних и нижних конечностей, даже летальная травма вследствие падения. Кортикобазилярная дегенерация (CBD) была впервые описана в 1968 г. и рассматривается многими как самый трудный случай для диагностики на ранней стадии заболевания. CBD представляет собой редкое состояние, и достоверные данные о ее распространенности отсутствуют. Средний возраст клинического начала составляет 60-65 лет. Клиническая картина относительно болезни Паркинсона часто отличается постепенно с течением времени. Патоморфология отличается от болезни Паркинсона присутствием крупных, набухших ахроматических нейронов в качестве основного признака. Обнаруживается атрофия и корковых, и базальных структур, т.е. базальных ганглиев, черной субстанции и ствола мозга. Начало симптомов обычно обнаруживается в одной из верхних конечностей. Нижняя конечность на той же-3 009988 стороне поражается перед вовлечением противоположной стороны. Проявления могут быть разделены на 3 категории: симптомы, указывающие на поражение 1) коры, 2) базальных ганглиев или 3) поражение других структур. Часто наблюдается дистония. Когда присутствует односторонний тремор, связанный с действиями, картину можно спутать с картиной эссенциального тремора. Со временем тремор становится миоклоническим. Иногда ранним проявлением может быть апраксия, дающая ключи к диагностике,но сосудистое поражение может создать аналогичную картину. Через несколько лет наблюдается характерный феномен чужой конечности. Поздним признаком является корковая потеря чувствительности,которую можно использовать при дифференциальной диагностике данного синдрома и болезни Паркинсона. Поздними проявлениями заболевания являются другие симптомы, такие как супрануклеарный паралич взгляда, дизартрия, дисфагия, пирамидальные симптомы. Однако асимметрия симптомов является стойкой, и поэтому риск спутать синдром с PSP мал. Болезнь диффузных телец Леви (DLBD) возникла как вторая по частоте причина дегенеративной деменции у пожилых лиц после болезни Альцгеймера (AD). Однако клиническая дифференциальная диагностика этих расстройств трудна. В случае DLBD сообщалось о о нарушении походки, ригидности,треморе в покое на ранней стадии заболевания, а также психозе и деменции. Сложные зрительные галлюцинации на ранней стадии заболевания являются особенно характерными для DLBD. В дополнение к прогрессирующему когнитивному снижению, для диагностики вероятной DLBD требуются 2 из следующих критериев и 1 для возможного диагноза: 1. колеблющаяся когнитивная функция с выраженными изменениями внимания и активности; 2. рецидивирующие, обычно хорошо сформированные, зрительные галлюцинации и 3. двигательные признаки паркинсонизма. Подтверждающие признаки, не требующиеся для диагностики, включают повторные падения, обмороки, преходящую потерю сознания, нейролептическую чувствительность, систематизированные иллюзии и галлюцинации при других модальностях. Множественная системная атрофия (MSA) представляет собой нейродегенеративное расстройство,при котором дегенерация в областях мозга ведет к нарушенному контролю движения, равновесия, артериального давления и функции мочеполовой системы.MSA представляет собой отчетливую клинико-патоморфологическую сущность (Gilman et al.,1998). Пациенты обозначаются MSA-P, если преобладают паркинсоновские признаки, или MSA-C, если преобладают мозжечковые признаки. MSA-M представляет собой смешанный подтип, который включает пациентов с пирамидальными или мозжечковыми признаками.MSA обычно проявляется в пятом-седьмом десятилетии жизни при несколько более высокой частоте встречаемости у мужчин. У пациентов обычно сначала имеется дисфункция вегетативной нервной системы. Дисфункция мочеполовой системы представляет собой самую частую первоначальную жалобу у женщин, тогда как импотенция представляет собой самую частую первоначальную жалобу у мужчин. Часто встречается ортостатическая гипотензия, которая может вызвать головокружение, затуманивание зрения, боль в голове и шее, зевоту, временную спутанность сознания, неразборчивую речь, и, если имеется тяжелая гипотензия, пациент может упасть в обморок после подъема из положения лежа на спине.MSA отличается от классической болезни Паркинсона по некоторым важным аспектам: раннее начало (на 5-10 лет раньше, чем у пациентов с болезнью Паркинсона), пограничная реакция на лечение Lдопа, быстрое прогрессирование, и выживание после диагностики редко составляет более 7 лет. Хотя при болезни Паркинсона главный удар поражения приходится преимущественно на одну систему, путь от черного вещества к полосатому телу, при MSA поражаются множественные нейронные системы. Частота встречаемости MSA составляет 5-15:100000, и она может быть причиной заболевания у 10% с клинически идиопатическим паркинсонизмом. Ее причина неизвестна, и нет известных случаев излечения. Высказывается гипотеза, что симптомы при MSA связаны с прогрессирующей дегенерацией нейронов (Holmber et al., 1998). Было показано, что у пациентов с MSA имеются повышенные уровни маркеров нейродегенерации в спинно-мозговой жидкости. Множественная системная атрофия (MSA) представляет собой, вероятно, самый частый дифференциальный диагноз с болезнью Паркинсона в отделении расстройств движений, и она может включать до 10% всех пациентов с симптомами паркинсонизма (Quinn, 1989). MSA состоит из 3 частей: синдром ShyDrager, дегенерации полосатого тела и черного вещества и атрофии оливы мозжечка-варолиева моста. Как указано выше, множественная системная атрофия (MSA) представляет собой нейродегенеративное расстройство, при котором дегенерация в областях мозга ведет к нарушенному контролю движения, равновесия, артериального давления и функции мочеполовой системы. Начало заболевания вариабельно. Самые ранние случаи проявляются в четвертом десятилетии жизни, тогда как в исследовании, подтвержденном данными вскрытия (Wenning, 1996), средний возраст начала заболевания составил 50 лет. Наблюдается небольшое преобладание мужчин. Термин MSA включает хроническое дегенеративное расстройство, создающее различные комбинации симптомов, связанных с базальными ганглиями, пирамидальными путями, мозжечком, стволом мозга и вегетативной нервной системой. Номенклатура различных проявлений MSA была вариабельной и,вероятно, отсрочила осознание существования этого заболевания. Для пациентов с преобладающими симптомами паркинсонизма был предложен термин MSA-SND, тогда как MSA-OPCA может использоваться, когда обнаруживается мозжечковое преобладание (Quinn, 1989). В течение 1990-х гг. эта номенк-4 009988 латура дополнительно обсуждалась. MSA-P и MSA-C также представляют собой термины, которые были предложены в качестве описания различных проявлений заболевания, соответственно, с преобладанием паркинсонизма и мозжечковых симптомов. Были предложены различные наборы диагностических критериев (Quinn, 1989). Пока не проводилась систематическая оценка этих критериев, хотя среди неврологов точность клинического диагноза MSA оценивалась ретроспективно (Litvan et al., 1997). Специфичность идентификации MSA, превышающая 90%, была уже обнаружена при первой клинической оценке,хотя чувствительность оставалась низкой, несмотря на повторные оценки. Невропатологические данные включают специфические глиоцитоплазматические тельца включений, глиоз и потерю нервных клеток в скорлупе, черной субстанции, основании варолиева моста, нижних оливах, извилинах мозжечка, интермедиолатеральном столбе спинного мозга и ядре Onuf (Daniel, 1999). Другими областями, пораженными заболеванием, являются locus ceruleus, дорзальное вагусное ядро, пирамидальный путь и клетки переднего рога (Wenning, 1996, Wenning, 1997, Van der Ecken et al., 1960).MSA обычно представляет собой спорадическое заболевание (Bandmann et al., 1997). Течение заболевания неоднородное, что дополнительно отражает различные обозначения его появления. Дисфункция вегетативной нервной системы представляет собой обычно обнаруживаемое явление при MSA, и она может присутствовать в виде предобморочных эпизодов, недержания мочи или нарушения половой функции (Wenning, 1994). Другими менее специфичными признаками вегетативной недостаточности являются головокружение, мышечная боль, запор и усталость. Холодные, смуглые кисти рук также должны вызвать подозрение на MSA (Klein et al., 1997). Прогноз становится неблагоприятным,когда развиваются явления падения артериального давления с повторными обмороками. Более 40% пациентов становятся прикованными к инвалидной коляске в пределах 5 лет вследствие нарушения движений. Индивидуальный прогноз может существенно варьироваться. Сообщалось о пациентах с MSA с длительностью заболевания более 20 лет (Wenning, 1997), в то время как, по сообщениям, среднее время выживания в случаях, подтвержденных данными вскрытия, где вероятна склонность к более агрессивным случаям, составляет от 6 до 9 лет от начала заболевания (Wenning, 1997, Wenning, 1994). Депрессия и тревога обычно наблюдаются и на ранних, и на поздних стадиях течения всех синдромов паркинсонизма-плюс, часто с хорошей реакцией на антидепрессанты. Помощь лабораторных методов в диагностике до настоящего времени оценивалась лишь у относительно небольших исследуемых популяций клинически диагностированных или доказанных данными вскрытия случаях. Методы с высокой чувствительностью (количество действительно положительно прогнозированных диагнозов с помощью теста, деленное на общее количество пациентов с заболеванием) и специфичностью (количество действительно отрицательно прогнозированных диагнозов с помощью теста, деленное на общее количество пациентов без заболевания), а также методы, которые дают объективную количественную характеристику данных, являются перспективными и могут помочь клинической диагностике. Данные ЯМР обычно приводятся у пациентов с MSA, где эта методика иногда полезна для дифференцировки MSA-P от болезни Паркинсона и супрануклеарного паралича (PSP). В частности, комбинация гипо- и гиперинтенсивных изменений сигналов скорлупы на Т 2-взвешенных ЯМР последовательностях рассматривалась как высокоспецифичная для диагностики, хотя ее чувствительность низка (Schrag,1998; Kraft et al., 1999). Эти данные можно было использовать в дифференцировке некоторых пациентов с MSA-P с положительной реакцией на леводопа от пациентов с болезнью Паркинсона. Отдельные гипоинтенсивные изменения в скорлупе также часто встречаются при MSA, но они менее специфичны, поскольку они также отмечаются при болезни Паркинсона и PSP (Schrag et al., 1998). Сообщалось также об аномалиях под наметом мозжечка; наблюдаются поперечные волокна в варолиевом мосту, повышенная интенсивность сигналов от варолиевого моста, напоминающая крест, и диффузная повышенная интенсивность сигналов от средних ножек мозжечка с сопутствующей атрофией (Schrag et al., 1998). Эти изменения под наметом мозжечка могут только служить в качестве подтверждения клинического диагноза,поскольку они имеют тенденцию следовать за типичной комбинацией симптомов, связанных с мозжечком и стволом мозга, которые уже дифференцируют MSA от болезни Паркинсона и PSP. Клиническая реакция на леводопа представляет собой важный признак в каждом наборе диагностических критериев для расстройств при паркинсонизме. Несколько авторов предложили тестирование одной дозой апоморфина (Hughes, 1990) или леводопа (Hughes et al., 1991; Rossi et al., 2000) в качестве инструментов для дифференциальной диагностики и прогноза отдаленных эффектов лечения. Тест с леводопа при регистрации в соответствии с Руководством по положению тела - двигательным функциям может предоставить дополнительную диагностическую информацию. Этот тест представляет собой сложную двигательную задачу для всего тела, которая требует способности пациента ходить без посторонней помощи. Недавно появились маркеры дегенерации нейронов и глиоза в качестве потенциальных способов диагностики, прогноза и оценки лечения (Rosengren et al., 1994; Rosengren et al., 1996). Дегенерацию нейронов и реактивность глии при различных состояниях с острым или хроническим поражением центральной нервной системы (ЦНС) можно идентифицировать по высоким концентрациям различных специфичных для мозга белков в спинно-мозговой жидкости (CSF) (Rosengren et al., 1999). Более того, они предоставляют данные, которые, по существу, не связаны с клиническими диагностическими критерия-5 009988 ми для различных расстройств при паркинсонизме. Нервное волокно представляет собой основной структурный элемент нейронов, где оно поддерживает калибр аксона, размер и форму нейрона. Высокие уровни нервных волокон были выявлены в CSF пациентов с боковым амиотрофическим склерозом и болезнью Альцгеймера, а также при других нейродегенеративных расстройствах, и предполагалось, что NFL в CSF можно использовать в качестве маркера дегенерации аксонов (Rosengren, 1996). Белок GFA представляет собой основной астроглиальный белок, экспрессированный, главным образом, в фибриллярных астроцитах. На концентрацию белка GFA в CSF влияют различные патологические состояния мозга. Наблюдались высокие уровни белка GFA как последствие острого повреждения ЦНС и разрушения астроглиальных клеток (Rosengren et al., 1994). При хронических расстройствах мозга с глиозом, таких как деменция, рассеянный склероз и хронические энцефалопатии, уровни белка GFA были повышены (Rosengren et al., 1994, Rosengren et al., 1995). Поэтому предполагалось, что белок GFA можно использовать в качестве маркера CSF, и разрушения ткани ЦНС, и астроглиоза (Rosengren et al., 1994).Kimber et al. (1997) сообщили о том, что диагностический тест с клонидином был полезным для идентификации белков MSA. Проводились повторные измерения гормона роста (GH) после внутривенной инъекции клонидина. Было обнаружено, что группа белков MSA имеет значительно сниженную реакцию на клонидин по сравнению с пациентами с болезнью Паркинсона, и предполагалось, что тест является показателем центральной вегетативной недостаточности, указывая на потерю катехоламинергических нейронов продолговатого мозга, иннервирующих гипоталамус. В дальнейшем исследовании (Kimber etal., 2000) было обнаружено, что концентрации GH после инъекции клонидина значительно ниже у группы пациентов с MSA по сравнению и с контролями, и с группой пациентов с PSP, предоставляя, таким образом, диагностический тест для дифференцировки MSA от других нейродегенеративных заболеваний. Краткая сущность изобретения Настоящее изобретение основано на данных о том, что человеческий гормон роста оказывает благоприятный эффект на пациентов, страдающих заболеванием, относящимся к синдромам паркинсонизма-плюс, а именно множественной системной атрофией. Поэтому изобретение относится к применению вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенногоhGH, для лечения и/или предотвращения синдрома паркинсонизма-плюс. Указанное вещество особенно подходит для лечения и/или предотвращения множественной системной атрофии (MSA), которая представляет собой пока неизлечимое заболевание, четко отграниченное от классической болезни Паркинсона. Изобретение, кроме того, относится к применению молекулы нуклеиновой кислоты, включающей кодирующую последовательность вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности MSA. Применение вектора, индуцирующего и/или усиливающего эндогенную продукцию вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH,для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности MSA, также находится в пределах настоящего изобретения. Изобретение, кроме того, относится к клетке, которая была генетически модифицирована для продукции вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или вещества, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности MSA. Подробное описание изобретения Настоящее изобретение основано на данных о том, что множественную системную атрофию(MSA), представляющую собой расстройство, относящееся к синдрому паркинсонизма-плюс, можно лечить введением эффективного количества человеческого гормона роста. Поэтому изобретение относится к применению вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или к веществу, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизма-плюс. В предпочтительном варианте осуществления изобретения синдром паркинсонизма-плюс выбран из группы, состоящей из прогрессирующего супрануклеарного паралича (PSP), множественной системной атрофии (MSA), бокового амиотрофического склероза Паркинсона-деменции Гуама, генерализованной болезни Леви организма, кортикобазилярной ганглионарной дегенерации, синдрома перекрытия Альцгеймера/Паркинсона, болезни Хантингтона: ригидного варианта, болезни Hallervorden-Spatz и синдрома Gerstmann-Strausler. Эти заболевания, наряду с возможностями диагностировать их и дифференцировать их от друг друга и от других неврологических расстройств, были подробно описаны выше в разделе Описание предшествующего уровня техники.-6 009988 В особенно предпочтительном варианте осуществления синдром паркинсонизма-плюс представляет собой множественную системную атрофию. MSA представляет собой отчетливую клинико-патоморфологическую сущность (Gilman et al., 1998), которая, например, характеризуется тем, что, в отличие от пациентов, страдающих болезнью Паркинсона, пациенты с MSA, в целом, проявляют только пограничную реакцию на лечение леводопа (L-допа). Тесты для оценки клинической реакции на леводопа были описаны выше в разделе Описание предшествующего уровня техники. Изобретение может относиться к любому типу MSA, включая MSA-P, MSA-C и MSA-M, MSA-SND или MSA-OPCA, как описано выше в разделе Описание предшествующего уровня техники. Термины лечение и предотвращение, используемые в настоящем описании, следует понимать как частичное или полное предотвращение, ингибирование, ослабление, облегчение или обратное развитие одного или нескольких симптомов или причины (причин) синдрома паркинсонизма-плюс, а также симптомов, заболеваний или осложнений, сопровождающих синдром паркинсонизма-плюс. При лечении синдрома паркинсонизма-плюс вещества в соответствии с изобретением часто вводятся после начала заболевания, предотвращение относится к введению веществ перед диагностикой или проявлением признаков заболевания у пациента. В предпочтительном варианте осуществления изобретения указанное вещество выбрано из:b) фрагмента (а), который обладает агонистической активностью в отношении рецептора hGH;c) варианта (а) или (b), который имеет по меньшей мере идентичность последовательности 70% с (а) или (b) и который обладает агонистической активностью в отношении рецептора hGH;d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент нативной последовательности ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и который обладает агонистической активностью в отношении рецептора hGH; илиe) соли функционального производного (а), (b), (с) или (d), которая обладает агонистической активностью в отношении рецептора hGH. Термин человеческий гормон роста или hGH, используемый в настоящем изобретении, предназначен для включения естественно встречающихся и синтетических производных, как указано выше,включая, без ограничения, человеческий гормон роста и 20 кДа, и 22 кДа, GH-V и других членов локуса гена гормона роста, как подробно описано в разделе Уровень техники.hGH может представлять собой естественно встречающийся человеческий гормон роста, или он может предпочтительно представлять собой рекомбинантный hGH. Рекомбинантный GH может быть экспрессирован в любом подходящем хозяине, или в прокариотическом, или в эукариотическом хозяине. Например, E. coli. представляет собой хозяина, особенно подходящего для экспрессии hGH. Клетки дрожжей, насекомых или млекопитающих представляют собой еще одних хозяев, подходящих для экспрессии рекомбинантного гормона роста. Предпочтительно hGH экспрессирован в клетках человека или животных, например в клетках яичников китайских хомячков (CHO). Используемый в настоящем описании термин hGH или гормон роста также включает функциональные производные, фрагменты, варианты, аналоги или соли, которые сохраняют биологическую активность гормона роста, т.е. которые действуют в качестве агонистов на рецепторы гормона роста. Другими словами, они способны связываться с рецептором гормона роста для инициации активности передачи сигналов рецептора. Используемый в настоящем описании термин функциональные производные или химические производные охватывает производные, которые можно получить из функциональных групп, которые встречаются в виде боковых цепей на остатках N- или C-концевых групп, средствами, известными в данной области, и включены в изобретение, пока они остаются фармацевтически приемлемыми, и не разрушают биологическую активность hGH, как описано в настоящем описании, т.е. способность связывать рецептор hGH и инициировать передачу сигналов рецептора, и не придают токсические свойства композициям, содержащим их. Производные могут иметь химические составляющие части, такие как углеводородные или фосфатные остатки, при условии, если такое производное сохраняет биологическую активность hGH и остается фармацевтически приемлемым. Например, производные могут включать сложные алифатические эфиры карбоксильных групп,амиды карбоксильных групп взаимодействием с аммиаком или с первичными или вторичными аминами,N-ацильные производные или свободные аминогруппы аминокислотных остатков, образованные с ацильными частями (например, алканоильные или карбоциклические ароильные группы), или О-ацильные производные свободной гидроксильной группы (например, производные серильных или треонильных остатков), образованные с ацильными частями. Такие производные могут также включать, например, боковые цепи полиэтиленгликоля, которые могут маскировать антигенные участки и продлевать пребывание молекулы в биологических жидкостях. Особое значение имеет гормон роста, который был дериватизирован или комбинирован с комплексообразующим агентом для длительного существования. Поэтому предпочтительный вариант осуществления изобретения относится к комбинированным с полиэтиленгликолем вариантам человеческого гормона роста. Гормоны роста, созданные методами генной инженерии, для проявления длительно сохраняющейся активности также являются примерами производных hGH в пределах объема настоящего изобретения.-7 009988 Был выделен и идентифицирован hGH, который ацетилирован на N-конце (Lewis et al., 1979). Неясно, играет ли ацетилирование регуляторную роль или просто является артефактом очистки. Однако ожидается, что эта молекула проявляет активность против MSA образом, аналогичным другим производнымhGH. Поэтому в предпочтительном варианте осуществления изобретение относится к человеческому гормону роста, который ацетилирован на его N-конце. Другие предпочтительные химические производные настоящего изобретения включают деаминированный hGH, который сульфоксидирован у одного или нескольких остатков метионина. Предпочтительно лекарственное средство в соответствии с изобретением включает димер человеческого гормона роста, выбранный из группы, состоящей из дисульфидного димера, соединенного через межцепочечные дисульфидные связи, ковалентный необратимый недисульфидный димер, нековалентный димер и их смеси. Термин соли в настоящем описании относится и к солям карборксильных групп, и к кислотно-аддитивным солям аминогрупп молекулы hGH или их аналогам. Соли карбоксильной группы могут быть образованы средствами, известными в данной области, и включают неорганические соли, например соли натрия, кальция, аммония, трехвалентного железа или цинка и им подобные и соли с органическими основаниями, как соли, образованные, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и им подобные. Кислотно-аддитивные соли включают, например, соли с минеральными кислотами, такими как, например, хлористо-водородная кислота или серная кислота, и соли с органическими кислотами, такими как, например, уксусная кислота или щавелевая кислота. Конечно,любые такие соли должны сохранять биологическую активность hGH, релевантного для настоящего изобретения, т.е. способность связываться с рецептором hGH и инициировать передачу сигналов рецептора. Еще в одном предпочтительном варианте осуществления изобретение относится к фрагменту человеческого гормона роста. Фрагмент гормона роста в соответствии с настоящим изобретением относится к любой части молекулы, т.е. к более короткому пептиду, который сохраняет желательную биологическую активность. Фрагменты можно легко получить удалением аминокислот из любого конца молекулы hGH и тестированием полученного фрагмента для выявления его свойств в качестве агониста рецепторов hGH. Известны протеазы для удаления каждый раз по одной аминокислоте или с N-конца, или с С-конца полипептида, и,таким образом, определение фрагментов, которые сохраняют желательную биологическую активность,включает лишь обычное экспериментирование. Предпочтительно фрагменты hGH в соответствии с настоящим изобретением могут иметь внутренние делеции, пока делеция не воздействует на биологическую активность hGH, т.е. связывание с рецептором hGH и инициацию передачи сигналов через него. Фрагмент, который предпочтителен в соответствии с изобретением, лишен 15 аминокислотных остатков от глутаминовой кислоты (Glu) 32 до глутаминовой кислоты 46. Фрагменты hGH могут, кроме того, быть усечены на С- или N-конце. Усеченный hGH, лишенный первых 8 N-концевых остатков или первых 13 N-концевых остатков человеческого гормона роста, также предпочтителен в соответствии с настоящим изобретением. Было описано, что короткий С-концевой фрагмент сохраняет биологическую активность hGH (см. патент США 5869452). Поэтому применение С-концевого фрагмента hGH предпочтительно в соответствии с изобретением. Фрагмент hGH177-191, включающий, по меньшей мере, аминокислотные остатки со 177 до 191 hGH (LRIVQCRSVEGSCGF), особенно предпочтителен в соответствии с настоящим изобретением. Кроме того, предпочтительными являются производные этого пептида, такие как варианты пептидов, описанные в патенте США 6335319 или WO 99/12969, например циклические пептиды. Кроме того, полипептид, который обладает такой активностью агониста рецептора hGH, является ли он hGH, его аналогом или вариантом, солью, функциональным производным или фрагментом, может также содержать дополнительные аминокислотные остатки, фланкирующие полипептид hGH. Пока полученная молекула сохраняет агонистическую способность сердцевинного полипептида в отношении рецептора hGH,обычным экспериментированием можно определить, воздействуют ли любые такие фланкирующие остатки на основные и новые характеристики сердцевинного пептида, т.е. его характеристики агониста рецептора. Примером такого варианта GH, который предпочтителен в соответствии с настоящим изобретением, является метионил-человеческий гормон роста (Met-hGH), который имеет дополнительный остаток метионина на N-конце человеческого гормона роста. Варианты hGH, которые предпочтительны в соответствии с изобретением, включают метионилhGH, который представляет собой человеческий гормон роста, имеющий дополнительный остаток метионина на его N-конце. Другим предпочтительным вариантом является человеческий гормон роста, лишенный 15 аминокислотных остатков от Glu32 до Glu46. Вариант человеческого гормона роста в соответствии с настоящим изобретением относится к молекуле, которая, по существу, аналогична или всему белку, или его фрагменту. Вариант можно также назвать мутеином. Вариант может, например, представлять собой изоформу hGH, такую как вариант,генерированный альтернативным сплайсингом. Вариантные (поли)пептиды можно также подходяще получить прямым химическим синтезом вариантного пептида, используя способы, хорошо известные в данной области. Конечно, вариантный человеческий гормон роста должен иметь, по меньшей мере, та-8 009988 кую же активность связывания с рецептором hGH и инициирования передачи его сигналов, как hGH, и который поэтому, как следует ожидать, должен обладать активностью против MSA, аналогичной hGH. Варианты аминокислотной последовательности человеческого гормона роста можно получить мутациями в ДНК, которые кодируют синтезированные производные человеческого гормона роста. Такие варианты включают, например, делеции из остатков или инсерции или замещения остатков в пределах аминокислотной последовательности. Можно также произвести любую комбинацию делеции, инсерции и замещения для получения конечного конструкта при условии, что конечный конструкт обладает желательной активностью. Очевидно, что мутации, которые будут произведены в ДНК, кодирующей вариантный пептид, не должны изменить рамку считывания. На генетическом уровне эти варианты могут быть получены направленным на сайт мутагенезом(как проиллюстрировано Adelman et al., 1983) нуклеотидов в ДНК, кодирующей пептидную молекулу,продуцируя посредством этого ДНК, кодирующую вариант, а затем экспрессируя ДНК в рекомбинантной клеточной культуре. Варианты обычно проявляют, по меньшей мере, такую же качественную биологическую активность, как и невариантный пептид. Аналог человеческого гормона роста в соответствии с настоящим изобретением относится к ненатуральной молекуле, которая, по существу, аналогична или всей молекуле, или ее активному фрагменту. Аналог человеческого гормона роста, который можно применять в настоящем изобретении, должен проявлять активность против MSA. Типы замещений, которые могут быть внесены в человеческий гормон роста в соответствии с настоящим изобретением, могут быть основаны на анализе частот аминокислотных изменений между гомологичным белком различных видов. На основании такого анализа, консервативные замещения могут быть определены в настоящем описании как обмены в пределах одной из следующих пяти групп:I. Небольшие, алифатические, неполярные или слегка полярные остатки: Ala, Ser, Thr, Pro, GlyII. Полярные, отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, GlnV. Крупные ароматические остатки: Phe, Try, Trp В пределах указанных выше групп следующие замещения считаются высококонсервативными:Ket/Leu/Ile/Val Полуконсервативные замещения определяются как обмены между указанными выше двумя группами (I)-(IV), которые ограничены супергруппой (А), включающей указанные выше (I), (II) и (IIII), или супергруппой (В), включающей указанные выше (IV) и (V). Замещения не ограничиваются генетически кодированными или даже натурально встречающимися аминокислотами. Когда эпитоп получен пептидным синтезом, желательную аминокислоту можно использовать непосредственно. Альтернативно, генетически кодированная аминокислота может быть модифицирована взаимодействием ее с органическим дериватизирующим агентом, который способен взаимодействовать с выбранными боковыми цепями и концевыми остатками. Цистеиниловые остатки чаще всего взаимодействуют с альфа-галоидацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, для получения карбоксиметильных или карбоксиамидометильных производных. Цистеиниловые остатки также дериватизируются взаимодействием с бромтрифторацетоном, альфа-бром-бета-(5-имидазол)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, дисульфидом 3-нитро-2-пиридила, дисульфидом метил-2-пиридила,парахлорртутьбензоатом, 2-хлорртуть-4-нитрофенолом или хлор-7-нитробензо-2-окса-1,3-диазолом. Гистидиловые остатки дериватизируются взаимодействием с диэтилпрокарбонатом при рН 5,5-7,0, потому что это вещество относительно специфично для боковой цепи гистидила. Можно также использовать парабромфенацилбромид; взаимодействие предпочтительно выполняется в 0,1 М какодилата натрия при рН 6,0. Лизинил и аминоконцевые остатки взаимодействуют с ангидридами янтарной или другой карбоновой кислоты. Дериватизация этими веществами оказывает эффект обращения заряда лизинильных остатков. Другие подходящие реагенты для дериватизации остатков, содержащих альфа-аминокислоту, включают сложные имидоэфиры, такие как метилпиколинимидат; пиридоксалфосфат; пиридоксал; хлорборгидрид; тринитробензолсульфоновая кислота; О-метилтиомочевина; 2,4-пентандион; и катализируемое трансаминазой взаимодействие с глиоксилатом. Аргиниловые остатки модифицируются взаимодействием с одним или несколькими обычными реагентами, среди них фенилглиоксалом; 2,3-бутандионом и нингидрином. Дериватизация аргининовых остатков требует, чтобы взаимодействие выполнялось в щелочных условиях ввиду высокого pKa гуанидиновой функциональной группы. Кроме того, эти реагенты могут взаимодействовать с группами лизина, а также с эпсилон-аминогруппой аргинина. Специфическая модификация тирозиловых остатков как таковая интенсивно исследовалась с особым интересом к внесению спектральных меток в тирозильные остатки взаимодействием с ароматическими-9 009988 соединениями диазония или тетранитрометаном. Чаще всего N-ацетилимидазол и тетранитрометан используются для образования, соответственно, соединения О-ацетилтирозила и -нитропроизводных. Карбоксильные боковые группы (аспартил или глутамил) селективно модифицируются взаимодействием с карбодиимидами (R'N-C-N-R'), такими как 1-циклогексил-3-[2-морфолинил-(4-этил)карбодиимид или 1-этил-3-(4-азониа-4,4-диметилпентил)карбодиимид. Кроме того, аспартильные и глутамильные остатки превращаются в аспарагинильные и глутаминильные остатки взаимодействием с ионами аммония. Глутаминильные и аспарагинильные остатки часто деамидируются в соответствующие глутамильные и аспартильные остатки. Альтернативно, эти остатки деамидируются в слегка кислотных условиях. Любая форма этих остатков подпадает под объем настоящего изобретения. Примеры получения аминокислотных замещений в белках, которые можно использовать для получения аналогов hGH для применения в настоящем изобретении, включают стадии любых известных способов, таких, которые представлены в патентах США RE 33653; 4959314; 4588585 и 4737462, выданныхal., и белки с замещенным лизином, представленные в патенте США 4904584 (Shaw et al.). Другие варианты гормона роста были описаны, например, в патенте США 6143523 (Cunningham et al.). Среди веществ, которые связываются с рецептором человеческого гормона роста и инициируют передачу его сигналов и которые можно использовать в соответствии с настоящим изобретением, находятся все из тех аналогов и миметиков гормона роста, которые уже известны в литературе, такие как, например, вещества, раскрытые в патентах США 5851992, 5849704, 5849700, 5849535, 5843453,5834598, 5688666, 5654010, 5635604, 5633352, 5597709 и 5534617. Предпочтительно вариант или аналог hGH должен иметь сердцевинную последовательность, которая является такой же, как последовательность нативной последовательности или биологически активного фрагмента, который имеет аминокислотную последовательность, имеющую идентичность по меньшей мере 70% с нативной аминокислотной последовательностью, и сохраняет его биологическую активность. Предпочтительнее такая последовательность имеет идентичность по меньшей мере 80%, по меньшей мере 90% или наиболее предпочтительно идентичность по меньшей мере 95% с нативной последовательностью. Идентичность отражает связь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определяемую сравнением последовательностей. В целом, идентичность относится к точному соответствию нуклеотида нуклеотиду или аминокислоты аминокислоте двух полинуклеотидных или двух полипептидных последовательностей по всей длине сравниваемых последовательностей. Для последовательностей, где нет точного соответствия, можно определить % идентичности. В целом, 2 последовательности, подлежащие сравнению, совмещаются для получения максимальной корреляции между последовательностями. Это может включать инсерцию гэпов или в одну, или в обе последовательности, для усиления степени совмещения. % идентичности можно определить по всей длине каждой из сравниваемых последовательностей (так называемое глобальное совмещение), что особенно подходит для последовательностей одинаковой или очень похожей длины, или по более коротким, определенным отрезкам(так называемое локальное совмещение), что больше подходит для последовательностей неравной длины. Способы сравнения идентичности и гомологии двух или более последовательностей хорошо известны в данной области. Так, например, программы, имеющиеся в пакете программ Wisconsin SequenceAnalysis Package, версия 9.1 (Devereux J. et al., 1984), например программы BESTFIT и GAP, можно использовать для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии между двумя полипептидными последовательностями. BESTFIT использует алгоритм локальной гомологии Smith и Waterman (1981), и он находит наилучшую одиночную область аналогии между двумя последовательностями. В данной области также известны другие программы для определения идентичности и/или аналогии между последовательностями, например семейство программ BLAST(Altschul S.F. et al., 1990; Altschul S.F. et al., 1997, доступных через домашнюю страницу NCBI на сайтеwww.ncbi.nlm.nih.gov) и FASTA (Pearson W.R., 1990; Pearson, 1988). Предпочтительные изменения для вариантов или мутеинов в соответствии с настоящим изобретением представляют собой те, которые известны как консервативные замещения. Консервативные аминокислотные замещения полипептидов гормона роста или белков могут включать синонимические аминокислоты в пределах группы, которые имеют достаточно одинаковые физико-химические свойства, так что замещение между членами группы сохранит биологическую функцию молекулы (Grantham, 1974). Ясно, что инсерции и делеции аминокислот могут осуществляться в определенных выше последовательностях без изменения их функции, в частности, если инсерции или делеции вовлекают только несколько аминокислот, например менее 30, а предпочтительно менее 10, и не удаляют или смещают аминокислоты,которые играют решающую роль для функциональной конформации, например цистеиновые остатки. Белки и мутеины, полученные такими делециями и/или инсерциями, входят в объем настоящего изобретения. Аналоги или варианты в соответствии с настоящим изобретением могут также быть определены в соответствии со следующей процедурой. ДНК нативной последовательности известна в предшествующем уровне техники, и ее можно найти в литературе (Martial et al., 1979). Полипептиды, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которая гибридизируется в комплемент нативной ДНК или РНК в- 10009988 очень строгих или умеренно строгих условиях, пока этот полипептид сохраняет биологическую активность нативной последовательности, также считаются находящимися в пределах объема настоящего изобретения. Условия строгости представляют собой функцию температуры, используемой в эксперименте гибридизации, молярность одновалентных катионов и процентную долю формамида в гибридизационном растворе. Для определения степени строгости, связанной с каждым данным набором условий, сначала используется уравнение Meinkoth et al. (1984) для определения устойчивости гибридов 100% идентичности, выраженной в виде температуры плавления Tm гибрида ДНК-ДНК:Tm=81,5C+16,6 (LogM)+0,41 (% GC)-0,61 (% form)-500/L где М представляет собой молярность одновалентных катионов, % GC представляет собой процентную долю G и C нуклеотидов в ДНК, % form представляет собой процентную долю формамида в гибридизационном растворе и L представляет собой длину гибрида в паре нуклеотидов. Для каждого 1 С, на который Tm снижается от расчетной для гибрида со 100% идентичностью, количество допустимого несоответствия увеличивается примерно на 1%. Таким образом, если Tm, используемая для любого данного эксперимента гибридизации при определенных концентрациях соли и формамида, составляет на 10C ниже Tm, рассчитанной для 100% гибрида в соответствии с уравнением Meinkoth, то гибридизация произойдет, даже если имеется несоответствие примерно до 10%. Используемые в настоящем описании очень строгие условия представляют собой те условия, которые допустимы при дивергенции последовательности примерно до 15%, в то время как умеренно строгие условия представляют собой те, которые допустимы при дивергенции последовательности примерно до 20%. Без ограничения в примерах очень строгих (на 12-15C ниже расчетной Tm гибрида) и умеренно строгих (на 15-20C ниже расчетной Tm гибрида) условиях используется промывной раствор 2 хSSC (стандартный солевой цитрат) и 0,5% SDS (додецилсульфат натрия) при соответствующей температуре ниже расчетной Tm гибрида. Окончательная строгость условий, в первую очередь, связана с условиями промывания, в частности, если используемые условия гибридизации такие, которые обеспечивают возможность формирования менее устойчивых гибридов наряду с устойчивыми гибридами. Затем промывание в условиях более высокой строгости удаляет менее устойчивые гибриды. Обычное условие гибридизации, которое можно использовать при описанных выше от очень строгих до умеренно строгих условиях промывания, представляет собой гибридизацию в растворе 6 хSSC (или 6 хSSPE), 5 х реагентDenhardt, 0,5% SDS, 100 мкг/мл денатурированной, фрагментированной ДНК спермы лосося при температуре приблизительно на 20-25C ниже Tm. Если используются смешанные зонды, предпочтительно использовать хлорид тетраметиламмония (TMAC), вместо SSC (Ausubel, 1987-1998). Хотя настоящее изобретение предоставляет рекомбинантные способы получения производных человеческого гормона роста, эти производные могут быть также получены обычными способами белкового синтеза, которые хорошо известны специалистам в данной области. Человеческий гормон роста или его фрагменты, варианты, аналоги или функциональные производные или соли можно вводить в различных дозировках. В предпочтительном варианте осуществления гормон роста вводится в дозировке примерно от 0,1 до 10 мг/человека/день или от 0,5 до 6 мг/человека/день. В другом предпочтительном варианте осуществления гормон роста вводится в дозировке примерно 1 мг/человека/день. Еще в одном предпочтительном варианте осуществления гормон роста вводится ежедневно или через день. В соответствии с настоящим изобретением гормон роста можно также вводить в чередующихся суточных дозировках, причем первая дозировка выше, чем вторая дозировка. Предпочтительно первая дозировка составляет примерно 1 мг на человека, а вторая дозировка составляет примерно 0,5 мг на человека. В другом предпочтительном варианте осуществления изобретения недельная дозировка гормона роста составляет примерно 6, или примерно 5, или примерно 4,5 мг на человека. Лечение гормоном роста в соответствии с настоящим изобретением можно осуществить или введением экзогенного гормона роста, или введением вещества, которое стимулирует продукцию эндогенного гормона роста или прямо, или косвенно подавлением секреции эндогенного соматостатина. Поэтому еще в одном предпочтительном варианте осуществления настоящего изобретения вещество, которое связывается с рецептором человеческого гормона роста (hGH) или инициирует передачу его сигналов, или вещество, которое стимулирует высвобождение или потенцирует активность эндогенногоhGH, которое используется для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности множественной системной атрофии, выбрано из:(a) гормона, высвобождающего человеческий гормон роста (hGHRH);(b) фрагмента (а), который обладает агонистической активностью в отношении рецептора hGHRH;(c) варианта (а) или (b), который имеет идентичность последовательности по меньшей мере 70% с(а) или (b) и который обладает агонистической активностью в отношении рецептора hGHRH;(d) варианта (а) или (b), который кодируется последовательностью ДНК, которая гибридизируется в комплемент последовательности нативной ДНК, кодирующей (а) или (b) в умеренно строгих условиях, и- 11009988 который обладает агонистической активностью в отношении рецептора hGHRH; или(e) соли или функционального производного (а), (b), (с) или (d), которая обладает агонистической активностью в отношении рецептора hGHRH. Известно, что гормон, высвобождающий человеческий гормон роста (hGHRH), стимулирует высвобождение hGH. Таким образом, биологическую активность hGH можно косвенно получить введениемGHRH или его функционального производного, соли, варианта, аналога или фрагмента, который сохраняет биологическую активность GHRH, т.е. способность стимулировать высвобождение гормона роста. Так, например, кроме GHRH, можно использовать его функциональные производные в соответствии с указанным выше определением, их аналоги или варианты, которые имеют идентичность последовательности с ним по меньшей мере 70%, предпочтительнее 80 или 90% или наиболее предпочтительно идентичность последовательности с ним 95% и при этом сохраняют биологическую активность GHRH, или вариант, или аналог, который представляет собой полипептид, кодируемый ДНК, которая гибридизируется в нативную ДНК, кодирующую GHRH, в умеренно строгих условиях, или предпочтительно в очень строгих условиях, все в соответствии с представленными здесь выше определениями. В предпочтительном варианте осуществления настоящего изобретения функциональное производное hGH или GHRH или любой его активный фрагмент, вариант или аналог включает по меньшей мере одну составляющую часть, прикрепленную к одной или нескольким функциональным группам, которые встречаются в виде одной или нескольких боковых цепей на аминокислотных остатках. Предпочтительным является присоединение полиэтиленгликоля (PEG). Предпочтительные молекулы GHRH, связанные с PEG (также именуемые GRF), которые можно использовать в связи с настоящим изобретением, были,например, описаны в документе WO99/27897. Вещества настоящего изобретения могут быть также алкилированы для удлинения периода полувыведения внутри организма человека. Длительно действующие композиции, такие как композиции, в которых период полувыведения (Тн) активных веществ составляет более 30 ч, являются особенно предпочтительными в соответствии с настоящим изобретением. Любые из GHRH или аналогов или агонистов GHRH, известные в литературе и описанные как стимулирующие высвобождение гормона роста, можно также использовать в настоящем изобретении, такие как вещества, раскрытые в патентах США 5792747, 5776901, 5696089, 5137872, 5767085, 5612470, 5846936 и 5847066. См. также Thorner et al. (1997), Felix et al. (1995), Alba-Roth et al. (1988), Friend et al. (1997). Другие вещества, способные стимулировать высвобождение гормона роста in vivo, которые можно использовать в соответствии с настоящим изобретением, включают вещества, раскрытые в патентах США 5807985, 5804578, 5795957, 5777112, 5767118, 5731317, 5726319, 5726307, 5721251, 5721250 и т.д. Любую другую молекулу, которая связывается с рецептором hGH и инициирует передачу сигналов этого рецептора, можно также использовать в соответствии с настоящим изобретением. Известно, например, что были разработаны небольшие молекулы, иногда называемые стимуляторами секреции, которые связывают рецепторы hGH, и вызывают их агрегацию, и инициируют передачу сигналов, причем инициация сигналов такая же, как стимуляция, получаемая связыванием натурального hGH с рецептором. Такие молекулы известны, например, из патентов США 5773441, 5798337, 5830433, 5767124 и 5723616. См. также Bowers et al. (1991), Thorner et al. (1997), Camanni et al. (1998), Smith et al. (1993) иGhigo et al. (1998). Таким образом, настоящее изобретение предназначено для включения любого вещества, которое связывается с рецептором hGH и инициирует передачу его сигналов с тем, чтобы получить такой же конечный качественный эффект, как и после введения натурального hGH, в отношении лечения синдрома паркинсонизма-плюс, в частности MSA. В данной области хорошо известно, что инсулиноподобные факторы роста (IGF) относятся к каскаду передачи сигналов гормона роста. Пока были описаны 2 IGF, именуемые IGF-I и IGF-II. IGF-I опосредует большинство видов действия GH, стимулирующих рост IGF-I, мощного митогенного фактора роста,имеющего поразительную гомологию с проинсулином. Он связывается со специфическими рецепторами,которые также связывают инсулин при более низком аффинитете. Преобладающим участком продукцииIGF-I, стимулируемой GH, является печень, в то время как несколько внепеченочных тканей также синтезируют IGF-I. IGF-I регулирует экспрессию и секрецию гена GH регуляцией отрицательной обратной связью, аналогичной ингибированию гормонами щитовидной железы и надпочечников их соответствующих гипофизарных трофических гормонов. Поэтому изобретение, кроме того, относится к применению IGF (инсулиноподобного фактора роста) для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизмаплюс, в частности множественной системной атрофии. Предпочтительно IGF выбран из IGF-I или IGF-II. Известно также, что IGF формируют комплексы со специфическими связывающими белками, именуемыми белками, связывающими IGF (IGFBP). Предполагалось, что эти связывающие белки выполняют 4 функции, включая транспортировку IGF в сосудистой системе и через интактные капиллярные мембраны, локализацию IGF в специфических тканях и клеточных типов, регуляцию взаимодействияIGF с рецепторами клеточной поверхности и модуляцию биологических видов действия IGF (Clemmonset al., 1993). В частности, белок-3, связывающий инсулиноподобный фактор роста (IGF) (IGFBP-3), пред- 12009988 ставляет собой основную детерминанту уровней IGF в циркулирующей крови и может найти клиническое применение для оценки недостаточности GH и для прогноза реакции на лечение GH. Поэтому в предпочтительном варианте осуществления изобретения лекарственное средство, кроме того, включает IGFBP. Предпочтительно IGFBP представляет собой IGFBP3. Комбинации IGF-I, IGF-II, IGFBP с человеческим гормоном роста или GHRH или любых их фрагментов, вариантов, функциональных производных или солей для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности MSA, находятся, кроме того, в пределах настоящего изобретения. Вещества можно применять последовательно, отдельно или одновременно. Изобретение, кроме того, относится к применению молекулы нуклеиновой кислоты, включающей кодирующую последовательность вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или к веществу, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности множественной системной атрофии. Молекула нуклеиновой кислоты может, кроме того, включать последовательность вектора экспрессии, например, для применения генной терапии для введения hGH в соответствии с изобретением. Предпочтительно лекарственное средство изобретения вводится подкожно. Также предпочтительно вводить лекарственное средство внутримышечно. Еще в одном предпочтительном варианте осуществления вещество вводится автоинжектором. Автоинжекторы представляют собой устройства, облегчающие подкожное введение лекарственных средств. Автоинжекторы известны в данной области, такие как устройство, называемое Easyject, которое особенно полезно для введения hGH. Безыгольное введение можно также использовать в связи с настоящим изобретением, используя специальные устройства, которые известны в данной области. Изобретение, кроме того, относится к применению вектора для индукции и/или усиления эндогенной продукции вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или к веществу, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности множественной системной атрофии. Вектор может включать регуляторные элементы, функциональные в клетках, которые желательно должны экспрессировать вещество изобретения. Такие регуляторные последовательности или элементы могут,например, представлять собой промотеры или усилители. Затем регуляторную последовательность можно внести в правый локус генома гомологичной рекомбинацией, таким образом, функционально связывая регуляторную последовательность с геном, экспрессию которого необходимо вызвать или усилить. Технология обычно именуется Эндогенной активацией гена (EGA) и описана, например, в документе WO 91/09955. Изобретение, кроме того, относится к применению клетки, которая была генетически модифицирована для продукции вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или к веществу, которое стимулирует высвобождение или потенцирует активность эндогенного hGH, для получения лекарственного средства для лечения и/или предотвращения синдрома паркинсонизма-плюс, в частности множественной системной атрофии. Изобретение, кроме того, относится к способу лечения синдрома паркинсонизма-плюс, в частности множественной системной атрофии, включающему введение нуждающемуся в нем пациенту эффективного количества вещества, которое связывается с рецептором человеческого гормона роста (hGH) и инициирует передачу его сигналов, или к веществу, которое стимулирует высвобождение или потенцирует активность эндогенного hGH. Фармацевтические композиции для введения в соответствии с настоящим изобретением могут включать по меньшей мере один человеческий гормон роста в соответствии с настоящим изобретением в фармацевтически приемлемой форме, необязательно в комбинации с фармацевтически приемлемым носителем, эксципиентом, стабилизатором или вспомогательным агентом. Эти композиции можно вводить любыми средствами, которые достигают их предполагаемых назначений. Количества и схемы введения композиции в соответствии с настоящим изобретением могут легко определить средние специалисты в области лечения синдромов паркинсонизма-плюс, в частности MSA. Композиции в пределах объема настоящего изобретения включают все композиции, включающие по меньшей мере один гормон роста или его производное, аналог или вариант в соответствии с настоящим изобретением в количестве, эффективном для достижения их предполагаемого назначения. Хотя индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств каждого компонента известно в данной области. Типичные дозировки включают от примерно 0,001 до примерно 0,1 мг/кг массы тела/день. При введении пациентам с MSA лечение hGH против MSA можно назначать одновременно с другими способами лечения, которые могут быть показаны при этом заболевании. В предпочтительном варианте осуществления изобретения hGH вводят в суточной дозировке примерно от 0,1 до 10 мг или примерно от 0,5 до 6 мг. Кроме того, предпочтительна дозировка примерно 1 мг человеческого гормона роста на человека/день. Еще в одном предпочтительном варианте осуществления hGH вводится в чередующихся дозировках, причем первая дозировка выше, чем вторая дозировка. Предпочтительно первая дозировка составля- 13009988 ет примерно 1 мг, а вторая дозировка составляет примерно 0,5 мг. Еженедельные дозировки предпочтительно составляют примерно 6, или примерно 5, или примерно 4,5 мг, в зависимости от потребностей пациента. Например, введение может быть парентеральным, например подкожным, внутривенным, внутримышечным, оральным, внутрибрюшинным, аэрозольным, трансдермальным, подоболочечным или ректальным путем. Введенная дозировка зависит от возраста, состояния здоровья и массы реципиента, типа предварительного или сопутствующего лечения, если оно проводится, частоты лечения и природы желательного эффекта. В соответствии с настоящим изобретением предпочтительными путями введения являются подкожный и внутримышечный пути. Особенно предпочтительным путем введения является оральный путь. Следует также понимать, что для того, чтобы быть полезным, обеспечиваемое лечение не должно быть абсолютным, при условии, что оно достаточно для обеспечения клинически значимого эффекта. Средство, которое обеспечивает лечение в меньшей степени, чем конкурирующие средства, все же может иметь значение, если другие средства являются неэффективными для конкретного индивидуума,если его можно применять в комбинации с другими средствами, для усиления общего уровня защиты,или если оно безопаснее, чем конкурирующие средства. Понятно, что подходящая доза композиции в соответствии с настоящим изобретением будет зависеть от возраста, состояния здоровья и массы реципиента, вида сопутствующего лечения, если оно имеет место, частоты лечения и природы желательного эффекта. Однако наиболее предпочтительную дозировку можно подобрать для отдельного индивидуума, как понятно и может быть определено специалистом в данной области без ненужного экспериментирования. Это обычно включает подбор стандартной дозы,например снижение дозы, если у пациента имеется низкая масса тела. Общую дозу, требуемую для каждого лечения, можно ввести множественными дозами или 1 дозой. Композиции можно ввести отдельно или в сочетании с другими терапевтическими средствами против заболевания или против других его симптомов. В дополнение к соединениям изобретения, фармацевтическая композиция может содержать подходящие фармацевтически приемлемые носители, такие как эксципиенты, носители и/или вспомогательные вещества, которые облегчают обработку активных соединений для препаратов, которые можно использовать фармацевтически. Теперь после полного описания настоящего изобретения специалистам в данной области должно быть понятно, что его можно выполнить в пределах широкого диапазона эквивалентных показателей, концентраций и условий без отхода от сущности и объема изобретения и без ненужного экспериментирования. Хотя настоящее изобретение было описано в связи с определенными вариантами его осуществления, следует понимать, что оно может быть подвержено дальнейшим модификациям. Настоящая заявка предназначена для охвата любых изменений, способов применения или адаптаций изобретения, в целом,в соответствии с принципами изобретения, и включая такие отходы от настоящего описания, как входящие в пределы известной или обычной практики в пределах области, к которой относится изобретение, и что может быть приложено к указанным выше в настоящем описании изложенным существенным признакам, как следует ниже в объеме прилагаемой формулы изобретения. Все приведенные здесь ссылки, включая журнальные статьи или рефераты, опубликованные или неопубликованные патентные заявки США или других стран, или любые другие ссылки полностью включены в настоящее описание в качестве ссылки, включая все данные, таблицы, чертежи и текст,представленные в приведенных ссылках. Кроме того, полное содержание ссылок, приведенных в пределах имеющихся в настоящем описании ссылок, также полностью включено в качестве ссылки. Ссылка на этапы известного способа, этапы обычных способов, известные способы или обычные способы ни в коей мере не является допущением того, что любой аспект, описание или вариант осуществления настоящего изобретения раскрыт, указан или предположен в релевантной области. Предшествующее описание конкретных вариантов осуществления, таким образом, полностью выявит общую природу изобретения, которое другие специалисты, применяя знания в пределах данной области (включая содержание приведенные здесь ссылок), могут легко модифицировать и/или адаптировать для различного применения таких специфических вариантов осуществления без ненужного экспериментирования, без отхода от общей концепции настоящего изобретения. Поэтому такие приспособления и модификации предназначены находиться в пределах диапазона значений, эквивалентных раскрытым вариантам осуществления, на основании представленных в настоящем описании положений и руководства. Следует понимать, что используемая в настоящем описании фразеология или терминология предназначена для цели описания, а не ограничения, так что терминологию или фразеологию настоящего описания следует интерпретировать опытному специалисту в свете представленных здесь положений и руководства, в комбинации со знаниями среднего специалиста в даной области. Теперь, после описания изобретения, оно будет легче понятно при ссылке на следующий пример иллюстративного описания клинического исследования, который представлен в качестве иллюстрации и не предназначен для ограничения настоящего изобретения. Краткое описание исследования Название: одноцентровое, двойное слепое, рандомизированное, исследование с плацебо контролемII фазы подкожно введенного рекомбинантного человеческого гормона роста (r-hGH) при лечении множественной системной атрофии (MSA). Фаза проекта: II фаза. Показание: множественная системная атрофия. Первичные цели:- 15009988 1) лабораторные: определить эффект лечения r-hGH анализом фибриллярного кислого белка глии(GFAP) и белка нервных волокон (NFL), маркеров нейродегенерации, в спинно-мозговой жидкости(a) стабилизация, по сравнению с группой плацебо, при функциональных оценках, измеренных по Унифицированной рейтинговой шкале Паркинсона (см. ниже),(b) стабилизация, по сравнению с группой плацебо, результатов тестирования функций вегетативной нервной системы. Вторичные цели:(a) оценить безопасность и переносимость r-hGH у этой популяции пациентов,(b) выявить любое различие между группами в прогрессировании заболевания, используя постурально-двигательный ручной тест (PLM),(c) улучшение качества жизни, по данным измерения с использованием Ноттингемского профиля состояния здоровья (NHP) (см. ниже). Размер выборки: 40 пациентов с возможностью оценки состояния. Исследуемое лекарственное средство: Saizen [рекомбинантный человеческий гормон роста (r-hGH)]. Схема лечения: 1 мг 3 раза/неделю в течение 12 месяцев (с возможным повышением дозы через 6 месяцев к чередующимся ежедневным инъекциям по 1 и 0,5 мг, если состояние пациента значительно ухудшается). Путь введения: подкожный. Процедуры: перед включением пациенты должны соответствовать критериям клинически вероятного диагноза MSA. Должно быть 6 посещений, оценка перед исследованием, в 1-й день, 3-й, 6-й, 9-й и 12-й месяцы исследования. Анализы GFAP и NFL в спинно-мозговой жидкости производят при оценке состояния перед исследованием, в 6-й и 12-й месяцы. В 1-й день, 6-й и 12-й месяцы исследования пациента просят заполнить анкету NHP, их состояние оценивается в отношении функциональности с помощью UPDRS и при выполнении тестирования вегетативной нервной системы. Данные по безопасности и эффективности получают посредством обычного клинического наблюдения, обычного гематологического исследования, клинической биохимии и анализа мочи, в дополнение к указанным выше специфическим процедурам. Цели. Целями исследования являются следующие. Первичные цели: лабораторные: определить эффект лечения r-hGH анализом GFAP и NFL (маркеров для выявления нейродегенерации) в спинно-мозговой жидкости (Holmberg et al., 1998), т.е. стабилизацию GFAP и NFL у пациентов,получающих r-hGH, и увеличения этих маркеров как признака продолжающегося разрушения в группе плацебо; клинические:стабилизация, по сравнению с группой плацебо, функциональных оценок, по данным измерения по Унифицированной рейтинговой шкале болезни Паркинсона (приложение F),стабилизация, по сравнению с плацебо, результатов тестирования вегетативной нервной системы(a) оценить безопасность и переносимость r-hGH у этой популяции пациентов,(b) выявить любое различие между группами в прогрессировании заболевания, используя постурально-двигательный ручной тест (PLM) (см. ниже)(с) улучшение качества жизни, по данным измерения с использованием Ноттингемского профиля состояния здоровья (NHP) (см. ниже). Популяция исследования. В исследование включают 40 пациентов. Каждый пациент должен соответствовать критериям включения и исключения, определенным в следующих разделах в пределах определенных временных рамок,получать назначенную схему лечения и выполнять требуемые виды деятельности, определенные в протоколе, и заполнить свою форму истории болезни (CRF), получить и ответить на все вопросы в соответствии со стандартом, требуемым спонсором. Критерии включения. Для включения в настоящее исследование каждый пациент должен соответствовать следующим критериям в пределах 28 дней перед 1-м днем исследования: 1) соответствовать критериям клинически вероятного диагноза MSA (см. ниже); 2) иметь ожидаемую продолжительность жизни по меньшей мере 1 год; 3) его возраст должен составлять от 30 до 75 лет; 4) желание и способность выполнять протокол исследования в течение всего исследования; 5) письменное информированное согласие, данное перед любой связанной с исследованием процедурой, не являющейся частью обычного медицинского обслуживания пациента, при понимании того, что- 16009988 пациент может отозвать согласие в любое время без ущерба будущему медицинскому обслуживанию; 6) пациентки должны: или (а) находиться в периоде постменопаузы, или быть хирургически стерилизованными,или (b) применять гормональное контрацептивное средство, внутриматочную спираль, диафрагму со спермицидным средством или презерватив со спермицидным средством в течение исследования и (с) не должны быть ни беременными, на кормящими грудью. Подтверждение того, что пациентка не беременна, устанавливается отрицательным тестом беременности, по данным исследования hCG в сыворотке/моче в течение 28-дневного периода скрининга перед 1-м днем исследования. Тест беременности не требуется, если пациентка находится в периоде постменопаузы или является хирургически стерилизованной. Критерии исключения. Пациенты, соответствующие любому из следующих критериев, исключаются из исследования: 1. клиническое доказательство сопутствующего инфекционного или воспалительного заболевания в крови или спинно-мозговой жидкости; 2. креатинин, AST или ALT2,5 х верхнюю величину нормального диапазона (величины не должны быть старше 1 месяца до 1-го дня исследования); 3. наличие анамнеза сахарного диабета (типа I или II); 4. наличие анамнеза любого активного злокачественного поражения; 5. гипотиреоз (пока не будет проведено адекватное лечение заместительной терапией гормонами щитовидной железы); 6. доброкачественная внутричерепная гипертензия; 7. предшествующий анамнез синдрома запястного туннеля, не подвергнутого хирургическому освобождению; 8. не подлежат включению пациенты, у которых имеются высокие медицинские риски, ввиду не злокачественного заболевания органов или систем или значительных вторичных эффектов рака. Не подлежат включению пациенты с клинически значимым сердечным заболеванием (т.е. наличием определенных кардиологических симптомов с выраженными ограничениями и потребностью в дополнительном отдыхе для устранения симптомов); 9. если пациенты принимали другое исследуемое лекарственное средство или принимали участие в любой экспериментальной процедуре в течение 3 месяцев, предшествовавших включению в исследование; 10. анамнез предыдущей аллергии к r-hGH; 11. предыдущее лечение r-hGH. Распределение количества пациентов и групп лечения. 40 пациентов включают в исследование, и после включения они методом случайной выборки распределяются двойным слепым методом в группы, получающие подкожные инъекции, или Saizen, или плацебо 1 мг, в течение 12 месяцев (с возможным повышением дозы через 6 месяцев до чередующихся ежедневных инъекций по 1 и 0,5 мг, если состояние пациента значительно ухудшается). Лечение, назначенное каждому пациенту, определяется в соответствии с генерированным компьютером списком рандомизации. Предназначенные для пациентов упаковки и содержащиеся в них ампулы маркируют индивидуальным идентификационным номером пациента. Когда обнаружено, что пациент подлежит включению в исследование и он выполнил все процедуры перед исследованием, ему/ей в 1-й день исследования присваивают индивидуальный идентификационный номер пациента в последовательном, хронологическом порядке после завершения всех исходных оценок. Перед присвоением номера пациента всех пациентов следует идентифицировать их инициалами и датой рождения. Если пациент исключается из исследования после рандомизации, его или ее идентификационный номер не должен присваиваться повторно. Медикаментозная терапия исследования. Форма представления, препарат, хранение и маркировка. Исследуемый препарат, (Saizen или плацебо) поставляется Serono в виде многодозового препарата в стеклянных флакончиках, содержащих 24 Ед (8,8 мг) r-hGH плюс эксципиенты (сахароза, фосфорная кислота 85% и фосфорная кислота, разбавленная из фосфорной кислоты 85%, или гидроокись натрия),или соответствующих стеклянных флакончиках с плацебо, содержащих только эксципиенты. Растворитель для растворения поставляют в кассетах, содержащих 0,3% Meta cresol (мас./об.) в воде для инъекций. Содержимое одного флакончика исследуемого препарата растворяют 1,51 мл разбавителя. Для настоящего исследования используют автоинжектор Easyject и его поставляют пациентам вместе с наборами для растворения и иглами. Лиофилизированный продукт должен храниться при 25C или ниже и защищенным от света. Все исследуемые препараты должны храниться в безопасном месте, предпочтительно в закрытом холодильнике с регулируемой температурой или в холодной комнате. В соответствии с целесообразностью исследуемые препараты могут отпускаться только исследователем, фармацевтом или членом персонала, специально уполномоченного исследователем. О любых отклонениях от рекомендуемых условий хранения- 17009988 следует немедленно сообщать спонсору и применение исследуемого препарата следует прервать до тех пор, пока спонсор не утвердит его продолжающееся применение. После растворения бактериостатическим разбавителем препарат должен храниться при температуре от 2 до 8C (от 36 до 46F) и использоваться для инъекции в пределах 21 дня. Маркировку и упаковку производят в соответствии с требованиями местных нормативов. Доза, путь и схема введения исследуемого препарата. Каждый пациент получает подкожную инъекцию, предпочтительно перед отходом ко сну, 3 раза/неделю (предпочтительно в понедельник, среду и пятницу) в дозе 1 мг в течение 12 месяцев. Однако,если при посещении на 6-м месяце состояние пациента значительно хуже по любому из следующих клинических симптомов или данных, дозу увеличивают до чередующихся ежедневных инъекций по 1 и 0,5 мг: ухудшение дизартрии, дисфагии, пареза, координации, ригидности, равновесия, способности ходить, недержания мочи или половой функции; повышенные уровни NFL в спинно-мозговой жидкости; дальнейшее нарушение результатов тестов сердечно-сосудистых рефлексов. Следует проводить ротацию участков инъекции на животе, плечевых областях и нижних конечностях. На усмотрение исследователя, пациента или члена семьи можно научить делать инъекции. Пациента просят регистрировать в карточке дневника время инъекции, инъецированное количество и любые местные или системные побочные явления. Сопутствующее лечение. Применение во время исследования антикоагулянтных лекарственных средств (за исключением,аспирина) не разрешается. За указанным исключением, любые лекарственные средства, которые считаются необходимыми для благополучия пациента и которые не помешают исследуемому лекарственному средству, можно вводить на усмотрение исследователя. О введении сопутствующих препаратов необходимо сообщать в соответствующем разделе CRF наряду с информацией о дозировке, пути введения, датах введения и причинах применения. Кроме того, любые не планировавшиеся диагностические, терапевтические или хирургические процедуры, выполненные в течение периода исследования, необходимо зарегистрировать в разделе сопутствующих процедур CRF, включая дату, показание и описание процедур и их исходов. Применение травяных/натуральных продуктов или других народных лекарств, витаминов, питательных добавок и всех других сопутствующих лекарственных средств необходимо регистрировать в форме истории болезни таким же образом, как обычные лекарственные средства. Поскольку это исследование является амбулаторным, пациентов просят регистрировать подробности любого самостоятельного медикаментозного лечения в карточке дневника. Информированное согласие. Каждого потенциально подлежащего включению в исследование пациента информируют о целях и общих требованиях исследования. Перед проведением перед включением каких-либо тестов, обычно не проводимых при лечении пациента, исследователь полностью объясняет пациенту исследование, используя информационный листок для пациента/форму информированного согласия. Если пациент желает принимать участие в исследовании, потребуется получение письменного информированного согласия после того,как пациенту было предоставлено достаточное время для рассмотрения участия и возможность спросить о дополнительных деталях. Бланк информированного согласия должен быть подписан и лично датирован и пациентом, и исследователем/ассистентом исследователя. Копия подписанного бланка предоставляется пациенту, а оригинал остается с исходными документами. Хотя в описании испытания пациенту может участвовать персонал, обеспечивающий уход, исследователь/ассистент исследователя должен участвовать в обсуждениях с пациентом и должен подписать и лично датировать бланк информированного согласия. Краткую CRF заполняют для всех пациентов, которые подписывают бланк информированного согласия,но которые в последующем не включаются в исследование. Этих пациентов идентифицируют по их инициалам и датам рождения; кроме того, регистрируют их расу, пол и причины исключения из исследования. Оценка перед исследованием. В пределах 28 дней от 1-го дня исследования (дня первой инъекции r-hGH) необходимо провести оценку состояния пациентов для определения того, подлежат ли они включению в исследование. Эта оценка должна включать медицинский анализ и анамнез, достаточные для соответствия критериям включения и исключения (результат лабораторного исследования должен быть доступен для соответствия критерию 2 исключения, т.е. уровню креатинина, AST/ALT). Выполняют люмбарную пункцию и берут образец спинно-мозговой жидкости. Образец посылают в местную лабораторию для анализа уровней GFAP и NFL. 1-й день исследования. Следующие исходные данные и оценки следует собрать/выполнить и зарегистрировать в 1-й день перед первой инъекцией r-hGH. Они включают полный медицинский анамнез, не связанный с MSA; анамнез исследуемого состояния, включая дату диагностики, подтип, если он известен, и предшествующее лечение;- 18009988 сбор демографических данных, включая даты рождения, этничность и пол; физикальное обследование, включая массу тела и показатели жизненно важных функций; текущие медицинские состояния, связанные с заболеванием, сопутствующая медикаментозная терапия и процедуры; обычное гематологическое исследование, клиническое биохимическое исследование, эндокринология, анализ мочи и антитела к hGH. Пациента просят заполнить Ноттингемский профиль состояния здоровья анкеты качества жизни(см. ниже). Исследователь или медсестра, участвующая в исследовании, объясняет это пациенту. Исследователь оценивает функциональную способность пациента заполнением Унифицированной рейтинговой шкалы болезни Паркинсона (UPDRS) (см. ниже). Постурально-двигательный ручной (PLM) тест выполняет исследователь, как описано ниже. Тестирование вегетативной нервной системы выполняет исследователь (вариабельность частоты сердечных сокращений при регулируемом форсированном дыхании, реакции артериального давления и частоты сердечных сокращений на наклон). 3-й месяц. Следующие процедуры выполняют в конце 3-го месяца (не более чем на 1 неделю раньше или на 1 неделю позже, чем посещение, запланированное графиком): физикальное обследование, включая показатели жизненно важных функций; оценка побочных явлений, сопутствующих лекарственных средств и процедур; обычная гематология, клиническая биохимия и анализ мочи. 6-й месяц. Следующие процедуры выполняют в конце 6-го месяца (не более чем на 1 неделю раньше или на 1 неделю позже, чем посещение, запланированное графиком): физикальное обследование, включая показатели жизненно важных функций; обычная гематология, клиническая биохимия, эндокринология, анализ мочи и антитела к r-hGH; оценка побочных явлений, сопутствующих лекарственных средств и процедур. Выполняют люмбарную пункцию и берут образец спинно-мозговой жидкости. Образец посылают в местную лабораторию для анализа уровней GFAP и NFL. Пациента просят заполнить Ноттингемский профиль состояния здорсвья анкеты качества жизни. Исследователь или медсестра, участвующая в исследовании, объясняет это пациенту. Исследователь оценивает функциональную способность пациента заполнением Унифицированной рейтинговой шкалы болезни Паркинсона (UPDRS). Тестирование вегетативной нервной системы выполняет исследователь (вариабельность частоты сердечных сокращений при регулируемом форсированном дыхании, реакции артериального давления и частоты сердечных сокращений на наклон). Если состояние пациента значительно ухудшается по любым из следующих клинических симптомов или данным, дозу повышает до чередующихся ежедневных инъекций 1,0 и 0,5 мг: ухудшение дизартрии, дисфагии, пареза, координации, ригидности, равновесия, способности ходить, недержания мочи или половой функции; повышенные уровни NFL в спинно-мозговой жидкости; дальнейшее нарушение результатов тестов сердечно-сосудистых рефлексов. 9-й месяц. Следующие процедуры выполняют в конце 9-го месяца (не более чем на 1 неделю раньше или на 1 неделю позже, чем посещение, запланированное графиком): физикальное обследование, включая показатели жизненно важных функций; оценка побочных явлений, сопутствующих лекарственных средств и процедур; обычная гематология, клиническая биохимия и анализ мочи. 12-й месяц (или после выхода из исследования). Следующие процедуры выполняют в конце 12-го месяца (не более чем на 1 неделю раньше или на 1 неделю позже, чем посещение, запланированное графиком), т.е. в конце лечения r-hGH или после раннего выхода пациента из исследования: физикальное обследование, включая показатели жизненно важных функций; обычная гематология, клиническая биохимия, эндокринология, анализ мочи и антитела к hGH; оценка побочных явлений, сопутствующих лекарственных средств и процедур. Выполняют люмбарную пункцию и берут образец спинно-мозговой жидкости. Образец посылают в местную лабораторию для анализа уровней GFAP и NFL. Пациента просят заполнить Ноттингемский профиль состояния здоровья анкеты качества жизни. Исследователь или медсестра, участвующая в исследовании, объясняет это пациенту. Исследователь оценивает функциональную способность пациента заполнением Унифицированной рейтинговой шкалы болезни Паркинсона (UPDRS). Выполняют постурально-двигательный ручной (PLM) тест. Выполняют тестирование вегетативной нервной системы (вариабельность частоты сердечных со- 19009988 кращений при регулируемом форсированном дыхании, реакции артериального давления и частоты сердечных сокращений на наклон). В случае продолжающегося побочного явления, такого как клинически значимая лабораторная аномалия, соответствующие оценки безопасности следует повторять чаще и/или при клинических показаниях выполнять дополнительные тесты (или по усмотрению исследователя) до разрешения или до окончания периода 30 дней, прошедшего после введения последней дозы исследуемого препарата, в зависимости от того, какой период из них короче. Преждевременное прекращение исследования и политика замещения. Критерии прекращения. Пациентов информируют о том, что они имеют право выйти из исследования в любое время без ущерба их лечению и что они не обязаны сообщать о своих причинах выхода. Любой выход из исследования должен быть полностью документирован в CRF и контролироваться исследователем. Кроме того, исследователь может исключить пациента из исследования в любое время, если считается, что это больше всего отвечает интересам пациента. В течение хода исследования участие в нем пациента можно прекратить по следующим причинам: токсичность 3 или 4 степени по критериям ВОЗ (модифицированным), которая считается исследователем связанной с исследуемым препаратом. Участие пациентов в исследовании может быть прекращено по следующим причинам: поступление в отделение интенсивной терапии; нарушения протокола, включая несоблюдение предписанной схемы лечения и утраченный контроль; серьезное интеркуррентное заболевание или значительное ухудшение интеркуррентного заболевания; побочные явления или административные причины. Если пациент не возвращается для наблюдения, следует предпринимать попытки вступить в контакт с пациентом для того, чтобы убедиться в том, что причиной для невозвращения не являемся побочное явление. Аналогичным образом, если пациент принимает решение прекратить участие в исследовании, например, по личным причинам, то следует предпринять попытку установления того, что истинная причина не является побочным явлением (имея в виду то, что пациенты не обязаны указывать их причины). Если медикаментозная терапия исследования преждевременно прекращается, причину прекращения необходимо зарегистрировать в соответствующем разделе CRF и необходимо предпринять усилия для того,чтобы как можно тщательнее внести в форму и описать наблюдения. Полную окончательную оценку следует произвести после выхода пациента из исследования, как описано в разделе 6.7. Любые побочные явления следует наблюдать до их разрешения или до тех пор, пока не пройдет период 30 дней после введения последней дозы исследуемого лекарственного средства, в зависимости от того, какой из этих периодов короче. Политика замещения. Если пациент выпадает или выходит из исследования, его или ее номер повторно не присуждается. Все не подлежащие включению пациенты (ошибочно включенные пациенты, которые не соответствуют критериям пригодности для включения) должны быть заменены, поскольку для оценки исследования необходимы 40 пациентов, состояние которых можно оценить. Сообщение о побочных явлениях. Определение. Побочное явление (AE) определяется как любая неблагоприятная медицинская ситуация у пациента или объекта клинического исследования, которому введен фармацевтический продукт, необязательно имеющая причинную связь с этим лечением. Поэтому побочное явление может представлять собой любой неблагоприятный и непреднамеренный признак (включая аномальные лабораторные данные), симптом или заболевание, по времени связанное с применением медикаментозного (исследуемого) продукта,связанное или не связанное с медикаментозным (исследуемым) продуктом. Составление отчета. Все AE, как определено выше, встречающиеся во время клинического исследования, а также любые побочные явления должны описываться в соответствующем разделе CRF. Важно, чтобы это включало продолжительность AE (даты начала/разрешения), тяжесть, связь с лекарственным средством (возможная, вероятная, маловероятная - см. ниже), частоту и любое проводимое сопутствующее лечение (или другое предпринятое действие). Возможная: клиническое явление, включая аномалию лабораторного исследования, с целесообразной временной последовательностью относительно введения лекарственного средства, которое навряд ли может быть отнесено к сопутствующему заболеванию, или другому лекарственному средству, или химическим соединениям и которое следует клинически целесообразной реакции после отмены (прекращение введения). Для соответствия этому определению повторное введение не требуется. Вероятная: клиническое явление, включая аномалию лабораторного теста, с целесообразной последовательностью во времени с введением лекарственного средства, но которое можно также объяснить сопутствующим заболеванием, или другими лекарственными средствами, или химическими соединениями. Сведения об отмене лекарственного средства могут отсутствовать или быть нечеткими.- 20009988 Маловероятная: клиническое явление, включая аномалию лабораторного теста, со связью по времени с введением лекарственного средства, которая делает причинную связь невероятной и при которой другие лекарственные средства, химические соединения или лежащее в основе заболевание обеспечивают вероятные объяснения. Тяжесть побочных явлений распределяют в соответствии с модифицированной шкалой ВОЗ градуированной токсичности. Если происходит AE, которое не перечислено среди этих критериев, то исследователь оценивает его тяжесть, используя следующие определения. Легкая: пациент осознает наличие явления или симптома, но явление или симптом легко переносимы. Умеренная: пациент испытывает значительный дискомфорт, который мешает обычному уровню его или ее активности; тяжелая: значительное нарушение функционирования: пациент неспособен осуществлять обычные виды активности. Угрожающая жизни: побочное явление угрожает риском жизни пациента. Данные побочного явления получают по любой информации, добровольно предоставленной пациентом, или посредством опроса пациента. Кроме того, данные побочного явления также собирают посредством использования карточки дневника. Тяжелые побочные явления. Тяжелое побочное явление (SAE) определяется как нежелательный медицинский случай, который при любой дозе приводит к смерти,угрожает жизни (т.е. пациенту угрожал риск смерти во время явления). Оно не относится к явлению, которое гипотетически может вызвать смерть, если бы оно было более тяжелым: требует госпитализации в стационар или продления существующей госпитализации,приводит к стойкой или значительной инвалидности или нетрудоспособности,представляет собой врожденную аномалию или врожденный дефект или представляет собой важное с медицинской точки зрения состояние (т.е. состояние, которое может не быть непосредственно угрожающим жизни или привести к смерти или госпитализации, но отчетливо имеет существенное клиническое значение. Оно может ухудшить состояние пациента или может потребовать вмешательства для предотвращения того или другого тяжелого исхода. Примерами таких явлений являются интенсивное лечение в палате неотложной помощи или на дому по поводу аллергического бронхоспазма, патологических изменений крови или судорог, которые не приводят к госпитализации в стационар, или развитие лекарственной зависимости или наркомании). Клинические лабораторные параметры Все из перечисленных выше тестов выполняют с частотой, описанной в запланированном ниже исследовании. Взятие образца крови и препарат сыворотки. Местная лабораторная процедура: гематология, биохимия крови, эндокринология. Берут 30 мл крови (6 пробирок с сывороткой, каждая по 4 мл, и 3 пробирки плазмы с ЭДТА, по 3 мл каждая). Образцы для определения гемоглобина, лейкоцитов, тромбоцитов, различных проб и глюкозы анализируют в соответствии с обычной больничной процедурой в лаборатории. Все другие образцы хранят в больнице Sahlgrenska при -80C до анализа. Все анализы выполняют в лаборатории больницы университета Sahlgrenska. Взятие образца сыворотки на выявление антител против GH. Используя пробирки без антикоагулянта, собирают 2 образца крови по 5 мл с интервалами, указанными в Плане исследования (ниже). Все образцы сыворотки метят идентификационным номером пациента и инициалами пациента, датой и временем взятия образца крови. Образцы можно брать, когда удобно (т.е. не в любое определенное время, но в в пределах указанного дня (дней) исследования), но следует регистрировать точное время и дату взятия образца. В CRF необходимо зарегистрировать точное время введения дозы r-hGH, предшествующего взятию образца. 8 мл крови берут в обычную пробирку и сыворотку получают свертыванием в холодильнике (максимальное время 30 мин). Центрифугируют при комнатной температуре при 3500 об./мин в течение 10 мин (в соответствии со спецификациями изготовителя) , сыворотку берут и делят на 4 аликвотных количества по 1 мл каждое. Образцы сразу замораживают при температуре, равной или ниже -20C до транспортировки. Одно аликвотное количество подлежит отправке (в замороженном состоянии) в центральную лабораторию, три аликвотных количества должны храниться там в замороженном состоянии при температуре ниже -20C в месте исследования в качестве дополнительных образцов. В центральную лабораторию образцы доставляет корпоративный CRA. График исследования Если оно проводится в пределах 14 дней после 1-го дня исследования, то нет необходимости повторять эту процедуру. 2 Если состояние пациента значительно ухудшается, то дозу повышают до чередующихся ежедневных инъекций по 1 и 0,5 мг. Унифицированная рейтинговая шкала болезни Паркинсона (UPDRS). Использование UPDRS в качестве рейтингового инструмента для контроля динамики болезни Паркинсона представляет собой общепринятый способ. Она состоит из разделов 1) мышление, поведение и настроение, 2) ADL (повседневная активность) и 3) двигательная активность. Они оцениваются по интервью. Некоторые разделы требуют присвоения каждой конечности множественных степеней. Возможно применение общего количества до 199 баллов. 199 представляет самую выраженную (общую) потерю трудоспособности, 0 - отсутствие потери трудоспособности. 1. Мышление, поведение, настроение. Нарушение интеллекта: 0 - отсутствие нарушений 1 - легкое нарушение (стойкая забывчивость с частичным воспоминанием событий без других затруднений) 2 - умеренная потеря памяти с дезориентацией и умеренным затруднением при разрешении сложных проблем 3 - тяжелая потеря памяти с дезориентацией во времени и часто пространстве, выраженное затруднение при разрешении проблем 4 - тяжелая потеря памяти с ориентацией только на личность, неспособность суждений или разрешения проблем Нарушение мышления: 0 - отсутствие нарушения 1 - выраженное воображение 2 - доброкачественные галлюцинации с сохраненной адекватной самооценкой 3 - галлюцинации от редких до частых или бред без адекватной самооценки, способные помешать повседневной деятельности 4 - стойкие галлюцинации, бред или выраженный психоз Депрессия: 0 - отсутствует 1 - периоды грусти или вины, превышающие нормальные, никогда не продолжающиеся больше нескольких дней или 1 недели 2 - длительная депрессия в течение 1 недели 3 - симптомы со стороны вегетативной нервной системы (бессонница, анорексия, абулия, потеря массы тела) 4 - симптомы со стороны вегетативной нервной системы со склонностью к суицидальным попыткам Мотивация/инициатива: 0 - нормальная 1 - менее напористая, более пассивная 2 - потеря инициативы или отсутствие интереса к выбранным видам деятельности 3 - потеря инициативы или отсутствие интереса к повседневным (обычным) видам деятельности 4 - отстранение, полная потеря мотивации 2. Виды активности повседневной жизни. Речь: 0 - нормальная 1 - слегка нарушенная, без трудности понимания 2 - умеренно нарушенная, могут попросить повторить 3 - тяжело нарушенная, часто просят повторить 4 - чаще всего, непонятная Слюноотделение: 0 - нормальное 1 - незначительное, но заметное увеличение, может происходить слюнотечение в ночное время 2 - умеренно избыточное выделение слюны, может происходить минимальное слюнотечение 3 - выраженное слюнотечение- 23009988 Глотание: 0 - нормальное 1 - редкое попадание пищи в дыхательное горло 2 - периодическое попадание пищи в дыхательное горло 3 - требует мягкой пищи 4 - требует назогастральной трубки или гастральной трубки Почерк: 0 - нормальный 1 - слегка маленький или медленный 2 - все слова маленькие, но разборчивые 3 - резко измененный, не все слова разборчивы 4 - главным образом, неразборчивый Резка пищевых продуктов/обращение с кухонными принадлежностями: 0 - нормальная 1 - несколько замедленная и неуклюжая, но не требует помощи 2 - может разрезать большинство пищевых продуктов, требуется некоторая помощь 3 - пищевые продукты необходимо нарезать, но может самостоятельно есть 4 - требует кормления Одевание: 0 - нормальное 1 - несколько замедленное, помощь не требуется 2 - периодически требуется помощь при застегивании пуговиц или вдевании рук в рукава 3 - требуется значительная помощь, но кое-что может делать самостоятельно 4 - беспомощность Гигиена: 0 - нормальная 1 - несколько замедленные действия, но помощь не требуется 2 - необходима помощь при приеме душа или ванны или очень медленные действия при гигиеническом уходе 3 - требуется помощь при умывании, чистке зубов, посещении ванной 4 - беспомощность Вращение в постели/приведение в порядок постельного белья: 0 - нормальное 1 - несколько замедленные действия, но помощь не требуется 2 - может поворачиваться самостоятельно или привести в порядок простыни, но с большим затруднением 3 - может начать движение, но не может самостоятельно повернуться или привести в порядок постельное белье 4 - беспомощность Падение, не связанное с фиксацией положения тела: 0 - нет 1 - редкие падения 2 - редкие падения, менее одного в день 3 - в среднем, 1 раз/день 4 - 1 раза/день Фиксация положения тела при ходьбе: 0 - нормальная 1 - редкая, может начаться колебание 2 - периодические падения в результате фиксации положения тела 3 - частая фиксация положения тела, периодические падения 4 - частые падения в результате фиксации положения тела Ходьба: 0 - нормальная 1 - небольшое затруднение, медленное движение ног или уменьшение раскачивания рук при ходьбе- 24009988 в течение дня 2 - умеренное затруднение, не требующее помощи 3 - тяжелое расстройство, требует помощи 4 - пациент вообще не может ходить, даже с помощью Тремор: 0 - отсутствует 1 - незначительный и нечастый тремор, не тревожащий пациента 2 - умеренный тремор, тревожащий пациента 3 - тяжелый тремор, мешающий многим видам деятельности 4 - выраженный тремор, мешающий многим видам деятельности Сенсорные жалобы, связанные с паркинсонизмом: 0 - отсутствуют 1 - пациент изредка имеет онемение, покалывание и незначительную боль 2 - частые, но не вызывающие тяжелых расстройств 3 - частое болезненное ощущение 4 - мучительная боль 3. Обследование двигательной функции. Речь: 0 - нормальная 1 - небольшая потеря выразительности, дикции, красноречия 2 - монотонная, смазанная, но понятная, умеренно нарушенная 3 - выраженное нарушение речи, которую трудно понимать 4 - неразборчивая речь Выражение лица: 0 - нормальное 1 - легкая гипомимия, может быть ничего не выражающее лицо 2 - незначительное, но определенное аномальное уменьшение выражения 3 - умеренная гипомимия, губы некоторое время отделены друг от друга 4 - маскообразное или фиксированное выражение лица, губы отделены на 1/4 дюйма или более с полной потерей выражения лица Тремор в покое. Лицо: 0 - отсутствует 1 - незначительный и нечастый 2 - легкий и присутствует большую часть времени 3 - умеренный и присутствует большую часть времени 4 - выраженный и присутствует большую часть времени Правая верхняя конечность (RUE): 0 - отсутствует 1 - легкий и нечастый 2 - легкий и присутствует большую часть времени 3 - умеренный и присутствует большую часть времени 4 - выраженный и присутствует большую часть времениLUE (левая верхняя конечность): 0 - отсутствует 1 - легкий и нечастый 2 - легкий и присутствует большую часть времени 3 - умеренный и присутствует большую часть времени 4 - выраженный и присутствует большую часть времениRLE (правая нижняя конечность): 0 - отсутствует 1 - легкий и нечастый 2 - легкий и присутствует большую часть времени 3 - умеренный и присутствует большую часть времени- 25009988 4 - выраженный и присутствует большую часть времениLLE (левая нижняя конечность): 0 - отсутствует 1 - легкий и нечастый 2 - легкий и присутствует большую часть времени 3 - умеренный и присутствует большую часть времени 4 - выраженный и присутствует большую часть времени Динамический или постуральный тремор ILUE: 0 - отсутствует 1 - легкий, присутствует при действии 2 - умеренный, присутствует при действии 3 - умеренный, присутствует при действии и удерживании положения 4 - выраженный, мешает приему пищиLUE: 0 - отсутствует 1 - легкий, присутствует при действии 2 - умеренный, присутствует при действии 3 - умеренный, присутствует при действии и удерживании положения 4 - выраженный, мешает приему пищи Ригидность. Шея: 0 - отсутствует 1 - небольшая или только при активации 2 - легкая/умеренная 3 - выраженная, полный диапазон движения 4 - тяжелаяRUE: 0 - отсутствует 1 - небольшая или только при активации 2 - легкая/умеренная 3 - выраженная, полный диапазон движения 4 - тяжелаяLUE: 0 - отсутствует 1 - небольшая или только при активации 2 - легкая/умеренная 3 - выраженная, полный диапазон движения 4 - тяжелаяRLE: 0 - отсутствует 1 - небольшая или только при активации 2 - легкая/умеренная 3 - выраженная, полный диапазон движения 4 - тяжелаяLLE: 0 - отсутствует 1 - небольшая или только при активации 2 - легкая/умеренная 3 - выраженная, полный диапазон движения 4 - тяжелая Легкие постукивания пальцами. Правая кисть: 0 - нормальные- 26009988 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Левая кисть: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Движения кистей (разжимание и сжатие кистей с быстрой последовательностью). Правая кисть: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Левая кисть: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Быстрые чередующиеся движения (пронация и супинация кистей). Правая кисть: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Левая кисть: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Быстрота движений ног (постукивание пяткой о землю, амплитуда должна быть 3 дюйма). Правая стопа: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Левая стопа: 0 - нормальные 1 - легкое замедление и/или уменьшение амплитуды 2 - умеренное нарушение; определенная и ранняя усталость, могут наступать периодические остановки- 27009988 3 - резко нарушенные; частые колебания и остановки 4 - едва имеющаяся способность выполнения Вставание со стула (пациент встает с руками, сложенными перед грудной клеткой): 0 - нормальное 1 - медленное, может потребовать нескольких попыток 2 - пациент отталкивается от подлокотников или сидения 3 - тенденция к падению назад, могут потребоваться множественные попытки, но пациент может встать без помощи 4 - пациент неспособен встать без помощи Поза: 0 - нормальная выпрямленная 1 - слегка сутулая, может быть нормальной для более старшего лица 2 - определенно аномальная, умеренно сутулая, может наклоняться в одну сторону 3 - резко сутулая с кифозом 4 - выраженное сгибание с крайней аномалией позы Походка: 0 - нормальная 1 - ходит медленно, может ходить шаркающей походкой короткими шажками без семенящей походки или пропульсии 2 - ходит с трудом, с небольшой помощью или без нее, несколько семенящая походка, короткие шаги или пропульсия 3 - тяжелое нарушение, частая помощь 4 - неспособность ходить Постуральная устойчивость (тест ретропульсии): 0 - нормальная 1 - восстанавливает положение тела без помощи 2 - может упасть, если его не поймают 3 - спонтанно падает 4 - не может стоять Брадикинезия/гипокинезия тела: 0 - отсутствует 1 - минимальное замедление, может быть нормальным, преднамеренный характер 2 - легкое замедление и бедность движения, определенно аномальная или уменьшенная амплитуда движений 3 - умеренное замедление, бедность или маленькая амплитуда 4 - выраженное замедление, бедность или амплитуда Ноттингемский профиль состояния здоровья. Использование этой анкеты представляет собой общепринятый способ измерения качества жизни. Ниже перечислены некоторые проблемы, с которыми люди могут столкнуться в их повседневной жизни. Необходимо внимательно прочитать список и поставить галочки в отсеке к под обозначением ДА для любой проблемы, которая относится к пациенту в данный момент. Поставить галочки под обозначением НЕТ для любой проблемы, которая не относится к пациенту. Просьба ответить на каждый вопрос. Если пациент не уверен в том, следует ли ему ответить утвердительно или отрицательно, то он должен поставить галочку на том ответе, который он считает самым правдивым в этот момент.- 29009988 Теперь просьба вернуться к началу и удостовериться в том, что ответы ДА или НЕТ даны на каждый вопрос анкеты. Описание постурально-двигательного ручного тестаassessment in Parkinson's disease. Acta Neurol. Scand., 1989: 79: 227-238. Постурально-двигательный ручной (PLM) тест представляет собой новый способ, предназначенный для измерения степени инвалидизации при болезни Паркинсона. В нем используется оптикоэлектрическая камера для регистрации движений тела свободно движущихся пациентов. Автоматическая компьютерная методика количественно характеризует двигательную функцию для обеспечения объективной оценки. Процедура теста. Тест PLM требует, чтобы индивидуум поднял предмет с пола и прошел вперед для доставки его на полку, помещенную на высоте его подбородка, принуждая, таким образом, тело к преодолению постуральных изменений и к движению вперед и требуя направленного к цели движения предплечья-кисти руки. Путем сравнения с выполнением здоровыми индивидуумами такого же возраста тест можно использовать для измерения степени нарушения постуральных, двигательных и ручных двигательных актов - всех элементарных двигательных функций, необходимых для независимой жизни и часто нарушенных у пациентов с паркинсонизмом. Выдвинутая идея состоит в том, что пациенты с болезнью Паркинсона отличаются друг от друга степенью и типом дегенерации допаминовых нервных клеток в мозгу и тем, что это в каждом случае вызывает варьирующиеся степени постуральных, двигательных и ручных нарушений, профиль инвалидности и вызывает необходимость индивидуализированного лечения. Если это так, то тест PLM должен служить для регистрации и количественной характеристики этого профиля для каждого пациента как основания для рационального лечения. Описание тестирования вегетативной нервной системыEvaluation and Differential Diagnosis of Parkinsonian Syndromes. Все тесты вегетативной нервной системы выполняют в отделении клинической нейрофизиологии,где клинические обычные тесты вегетативной функции основаны на анализе изменений частоты сердечных сокращений и артериального давления в динамике. Индивидуумов помещают и фиксируют на наклоняющемся столе и начинают записи частоты сердечных сокращений и артериального давления. Используют и непрерывное, неинвазивное измерение АД в пальце в соответствии с принципом фиксации объема (Finapres, Ohmeda Monitoring Systems, Englewood, Colorado, USA), и автоматический сфигмоманометрический способ (Sphygmomanometer BP-203Y, Colin Co. Muranaka, Komaki-City, Japan) манжетой,помещенной на левую верхнюю конечность. Частоту сердечных сокращений (ЧСС) рассчитывают компьютерной программой, запускаемой пульсовым сигналом от Finapres. Синусовую аритмию оценивают в течение 60-секундного периода в покое и во время регулируемого глубокого дыхания (6 циклов дыхания на 1 период) и рассчитывают в соответствии с формулой 100(ЧССмакс.-ЧССмин.)/ЧССсредн. В последующем выполняют ортостатические тесты при времени, используемом для подъема наклоняемого стола от горизонтального положения до наклона с подъемом головного конца на 75, ограниченном 2 с. Количественные изменения ЧСС и АД в течение 8 мин наклона основаны на сфигмоманометрических данных, поскольку было отмечено, что трудно избежать гидростатических ошибок при использовании оборудования Finapres, даже если принимается предосторожность с размещением манжеты на уровне сердца. У нескольких пациентов по сигналу Finapres было качественно документировано быстрое и выраженное ортостатическое падение артериального давления, в то время как нельзя было получить достоверные данные о давлении в манжете перед тем, как пациентов нужно было возвратить в горизонтальное положение вследствие предобморочных симптомов. Диагностические критерии MSA Множественная системная атрофияAuton. Nerv. Syst. 1998; 74: 189-192. Таблица 1. Клинические домены, признаки и критерии, используемые при диагностике MSA.I. Дисфункция вегетативной нервной системы и мочевыводящей системы.A. Признаки со стороны вегетативной нервной системы и мочевыводящей системы. 1. Ортостатическая гипотензия на (20 мм рт.ст. систолическое или 10 мм рт.ст. диастолическое). 2. Недержание мочи или неполное опорожнение мочевого пузыря.B. Критерий недостаточного вегетативной нервной системы или мочевыводящей системы при MSA. Ортостатическое падение артериального давления на (30 мм рт.ст. систолическое или 15 мм рт.ст. диастолическое), или недержание мочи (стойкое, непроизвольное, частичное или полное опорожнение мочевого пузыря, сопровождающееся эректильной дисфункцией у мужчин), или оба симптома.
МПК / Метки
МПК: A61K 38/30, A61K 38/25, A61P 25/16, A61K 48/00, A61K 38/27
Метки: роста, множественной, применение, гормона, системной, атрофии, человеческого
Код ссылки
<a href="https://eas.patents.su/30-9988-primenenie-chelovecheskogo-gormona-rosta-pri-mnozhestvennojj-sistemnojj-atrofii.html" rel="bookmark" title="База патентов Евразийского Союза">Применение человеческого гормона роста при множественной системной атрофии</a>