Ингибиторы гликогенфосфорилазы, представляющие собой амиды пирролопиридин-2-карбоновых кислот
Номер патента: 9215
Опубликовано: 28.12.2007
Авторы: Роули Роберт Джон, Шофильд Карен Лесли, Брэдли Стюарт Эдуард, Проктер Мартин Джеймс, Крулле Томас Мартин, Томас Джерард Хью, Мюррей Питер Джон, Сэмбрук Смит Колин Питер
Формула / Реферат
1. Соединение формулы (I)
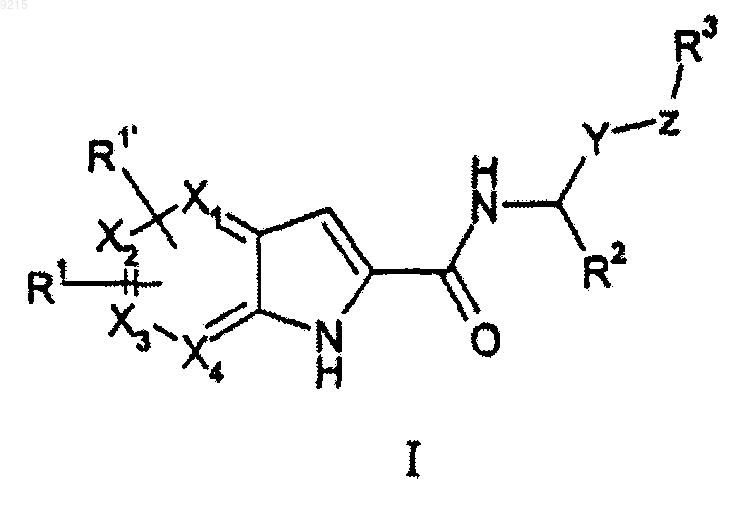
или его стереоизомер или фармацевтически приемлемая соль,
где один из X1, X2, X3 и X4 должен представлять собой N, а другие должны представлять собой С;
R1 и R1', каждый независимо, представляют собой галоген, гидрокси, циано, С0-4алкил, С1-4алкокси, фторметил, дифторметил, трифторметил, этенил или этинил;
R2 представляет собой С0-4алкил, COOR6, COR6, С1-4алкоксиС1-4алкил-, гидроксиС1-4алкил-, циклоалкилС0-4алкил-, арилС0-4алкил-, гетероарилС0-4алкил-, где любое из арильных или гетероарильных колец, возможно, независимо замещено 1-2 заместителями, представляющими собой галоген, циано,
С1-4алкил, С1-4алкокси, -N(С0-4алкил)(С0-4алкил), -SO2С1-4алкил, -SO2N(С0-4aлкил)(С0-4алкил), гидрокси, фторметил, дифторметил или трифторметил;
Y представляет собой С0-2алкил или -CH(OH)-;
Z представляет собой CH2, -C(O)-, -О-, >N(С0-4алкил), >N(С3-6циклоалкил) или отсутствует; но, когда Y представляет собой -CH(OH)-, Z или R3 должны быть связаны с Y через углерод-углеродную связь;
R3 представляет собой водород, -СООС0-4алкил, С1-4алкокси, С1-4алкил, арилС1-4алкилтио-,
-С0-4алкиларил, -С0-4алкилгетероарил, -С0-4алкилциклоалкил или -С0-4алкилгетероциклил, где любое из колец, возможно, независимо замещено 1-3 заместителями, представляющими собой галоген, циано,
С1-4алкил, фторметил, дифторметил, трифторметил, -С0-4алкилNHC(O)O(C1-4алкил), -C0-4алкилNR7R8,
-C(O)R9, С1-4алкоксиС0-4алкил-, -СOOC0-4алкил, -C0-4алкилNHC(O)R9, -С0-4алкилС(О)N(R10)2,
-С1-4алкоксиС1-4алкокси, гидроксиС0-4алкил-, -NHSO2R10, -SO2(С1-4алкил), -SO2NR11R12, 5-6-членный гетероциклил, фенилС0-2алкокси или фенилС0-2алкил, где фенил, возможно, независимо замещен 1-2 заместителями, представляющими собой галоген, циано, С1-4алкил, С1-4алкокси, -N(С0-4алкил)(С0-4алкил),
-SO2С1-4алкил, -SO2N(С0-4алкил)(С0-4алкил), гидрокси, фторметил, дифторметил или трифторметил, либо две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо (=O);
либо R3 представляет собой -NR4(-C0-4алкилR5);
R4 представляет собой С0-3алкил, -С2-3алкил-NR7R8, С3-6циклоалкил, возможно, замещенный группой гидроксиС0-4алкил-, дополнительно, возможно, замещенной группой гидрокси, С1-2алкоксиС2-4алкил- или С1-2алкил-S(O)n-С2-3алкил-;
n равно 0, 1 или 2;
R5 представляет собой водород, гидроксиС2-3алкил-, С1-2алкоксиС0-4алкил-, или арил, гетероарил, или гетероциклил;
где гетероциклическое азотсодержащее кольцо R5, возможно, является монозамещенным по
кольцевому атому азота группой С1-4алкил, бензил, бензоил, С1-4алкил-С(O)-, -SO2С1-4алкил,
-SO2N(С0-4алкил)(С0-4алкил), С1-4алкоксикарбонил или арил(С1-4алкокси)карбонил и где кольца R5,
возможно, являются монозамещенными по кольцевому атому углерода галогеном, группой циано,
С1-4алкил-С(O)-, С1-4алкил-SO2-, С1-4алкил, С1-4алкокси, гидрокси, -N(С0-4алкил)(С0-4алкил),
гидроксиС0-4алкил- или С0-4алкилкарбамоил- при условии, что не включен ни один кватернизированный атом азота; или две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо (=O);
R6 представляет собой С1-4алкил, арил или гетероарил;
R7 и R8 независимо представляют собой С0-4алкил, С3-6циклоалкил или CO(С1-4алкил);
R9 представляет собой С1-4алкил или С3-6циклоалкил;
R10 представляет собой С0-4алкил или С3-6циклоалкил;
R11 и R12 независимо представляют собой С0-4алкил или вместе с атомом азота, к которому они присоединены, могут образовывать 4-6-членный гетероцикл;
где отсутствуют связи азот-кислород, азот-азот или азот-галоген в соединении трех компонентов
-Y-Z-R3 друг с другом.
2. Соединение по п.1, или его стереоизомер, или фармацевтически приемлемая соль, где X3 представляет собой N.
3. Соединение по п.1 или 2, или его стереоизомер, или фармацевтически приемлемая соль, где R1 и R1', каждый независимо, представляют собой галоген, циано или водород.
4. Соединение по любому из пп.1-3, или его стереоизомер, или фармацевтически приемлемая соль, где один из R1 и R1' представляет собой водород, а другой представляет собой группу 5-галогено или
5-циано.
5. Соединение по любому из пп.1-4, или его стереоизомер, или фармацевтически приемлемая соль, где Y представляет собой С0-2алкил.
6. Соединение по любому из пп.1-5, где Z представляет собой -C(O)-.
7. Соединение по любому из пп.1-6, или его стереоизомер, или фармацевтически приемлемая соль, где Y представляет собой прямую связь.
8. Соединение по любому из пп.1-7, или его стереоизомер, или фармацевтически приемлемая соль, где R2 представляет собой С0-4алкил или арилС0-4алкил-, где арильное кольцо, возможно, независимо замещено 1-2 заместителями, представляющими собой галоген, циано, С1-4алкил, С1-4алкокси,
-N(С0-4алкил)(С0-4алкил), -SO2С1-4алкил, -SO2N(С0-4алкил)(С0-4алкил), гидрокси, фторметил, дифторметил или трифторметил.
9. Соединение по п.8, или его стереоизомер, или фармацевтически приемлемая соль, где R2 представляет собой бензил, возможно, замещенный 1-2 заместителями галогено.
10. Соединение по любому из пп.1-9, или его стереоизомер, или фармацевтически приемлемая соль, где R3 представляет собой -С0-4алкилгетероциклил, возможно, независимо замещенный 1-3 заместителями, представляющими собой галоген, циано, С1-4алкил, фторметил, дифторметил, трифторметил,
-С0-4алкилNHC(O)O(С1-4алкил), -С0-4алкилNR7R8, -C(O)R9, С1-4алкоксиС0-4алкил-, -СООС0-4алкил,
-С0-4алкилNHC(O)R9, -С0-4алкилС(О)N(R10)2, -С1-4алкоксиC1-4алкокси, гидроксиС0-4алкил, -NHSO2R10,
-SO2(С1-4алкил), -SO2NR11R12, 5-6-членный гетероциклил, фенилС0-2алкокси или фенилС0-2алкил, где фенил, возможно, независимо замещен 1-2 заместителями, представляющими собой галоген, циано,
С1-4алкил, С1-4алкокси, -N(С0-4алкил)(С0-4алкил), -SO2С1-4алкил, -SO2N(С0-4алкил)(С0-4алкил), гидрокёш, фторметил, дифторметил или трифторметил, либо две связи на кольцевом атоме углерода группы
гетероциклил, возможно, могут образовать заместитель оксо (=O); либо R3 представляет собой
-NR4(-C0-4алкилR5).
11. Соединение по п.10, где R3 представляет собой, возможно, замещенную азотсодержащую гетероциклильную группу, присоединенную к Z через кольцевой атом азота; либо R3 представляет собой -NR4(-C0-4алкилR5).
12. Соединение по п.11, где R3 представляет собой, возможно, замещенную 4-8-членную азотсодержащую гетероциклильную группу.
13. Соединение по п.12, или его стереоизомер, или фармацевтически приемлемая соль, где R3 представляет собой пирролидин-1-ил или пиперидин-1-ил, возможно, замещенный гидрокси.
14. Соединение по п.1, выбранное из следующих:
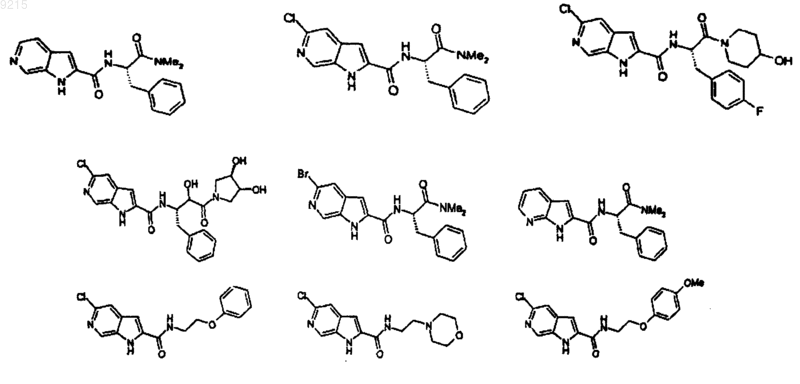

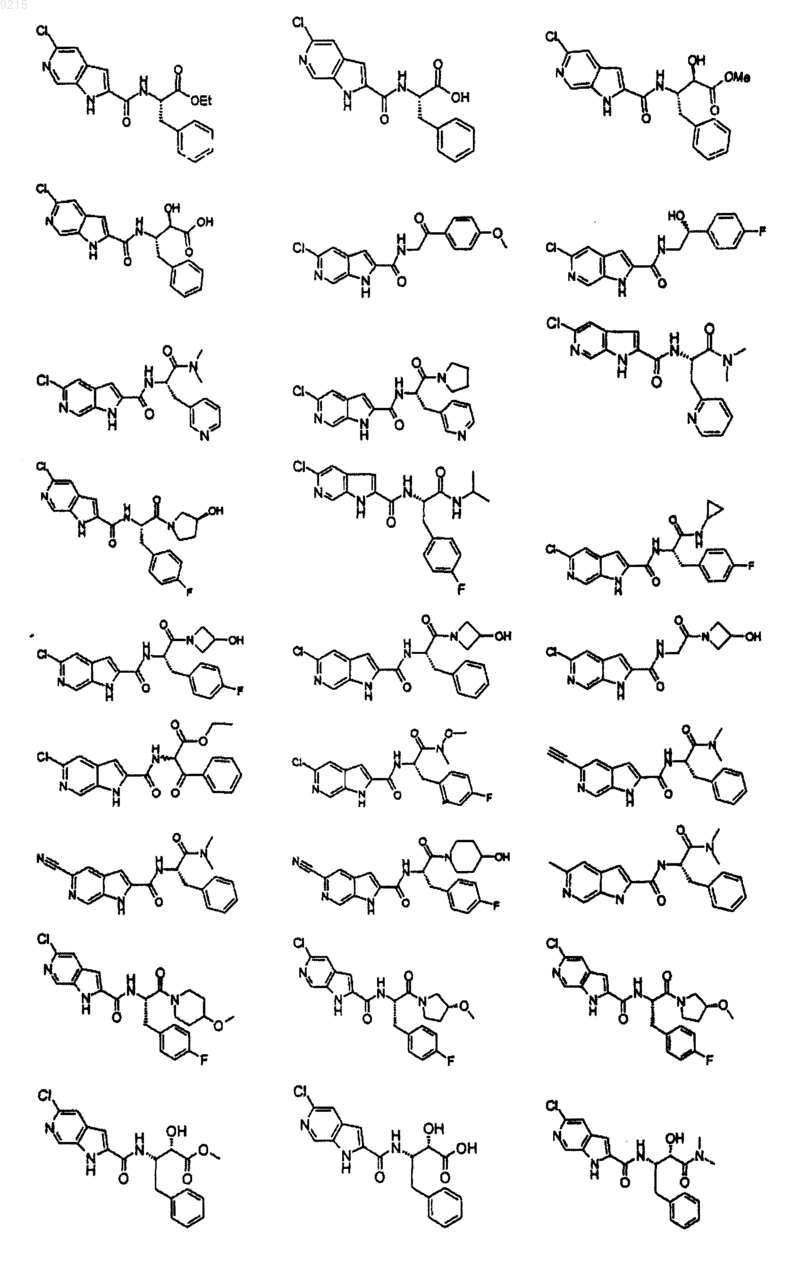
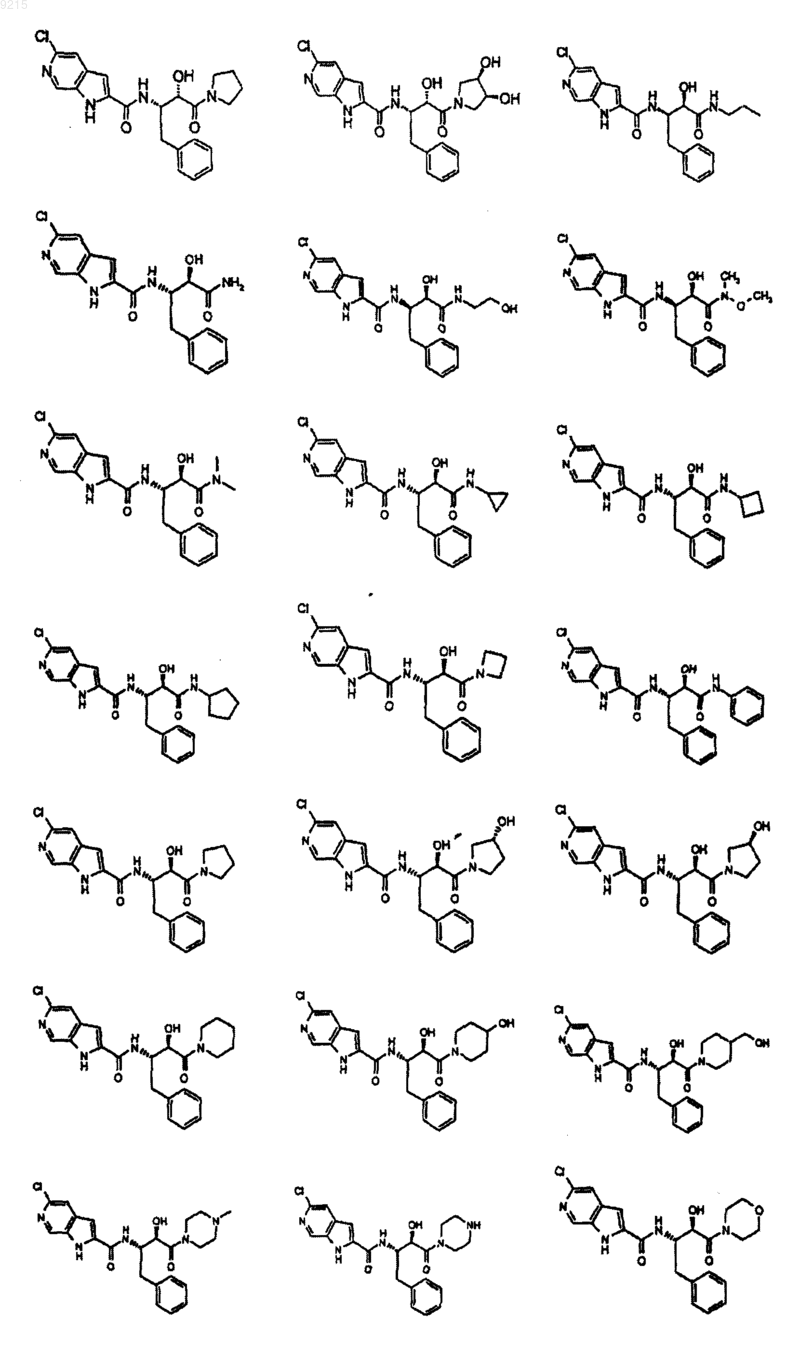
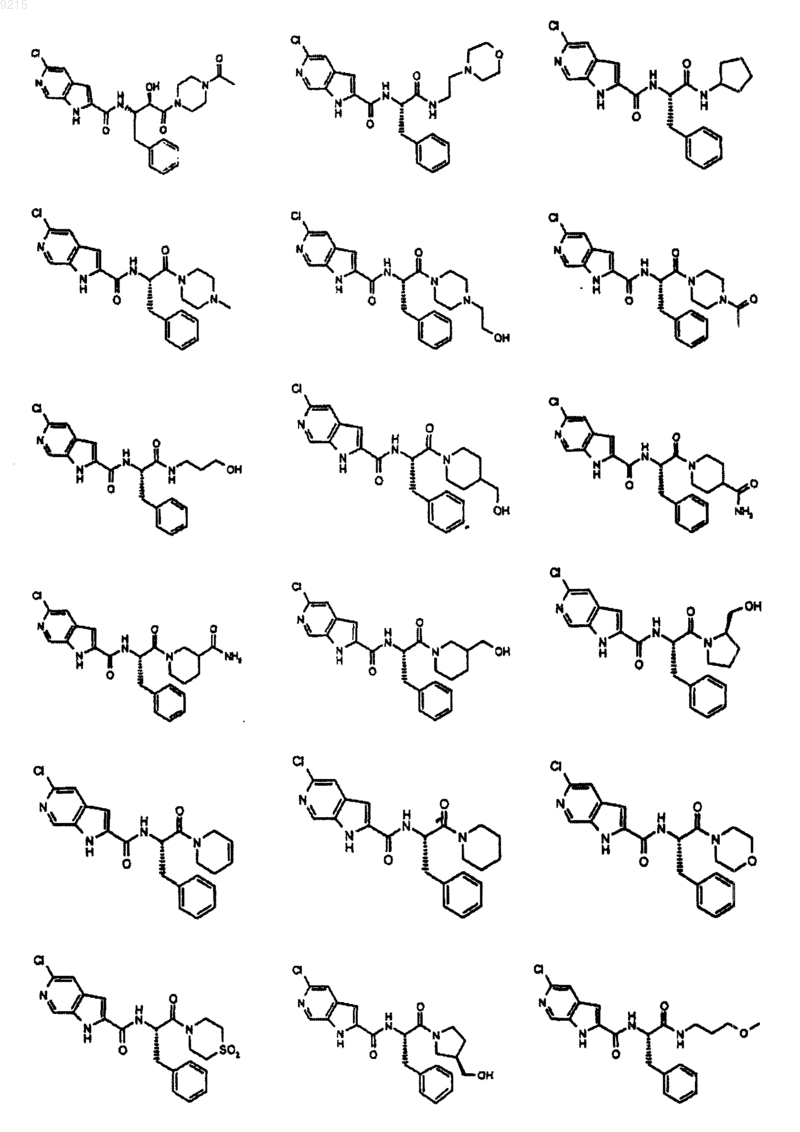
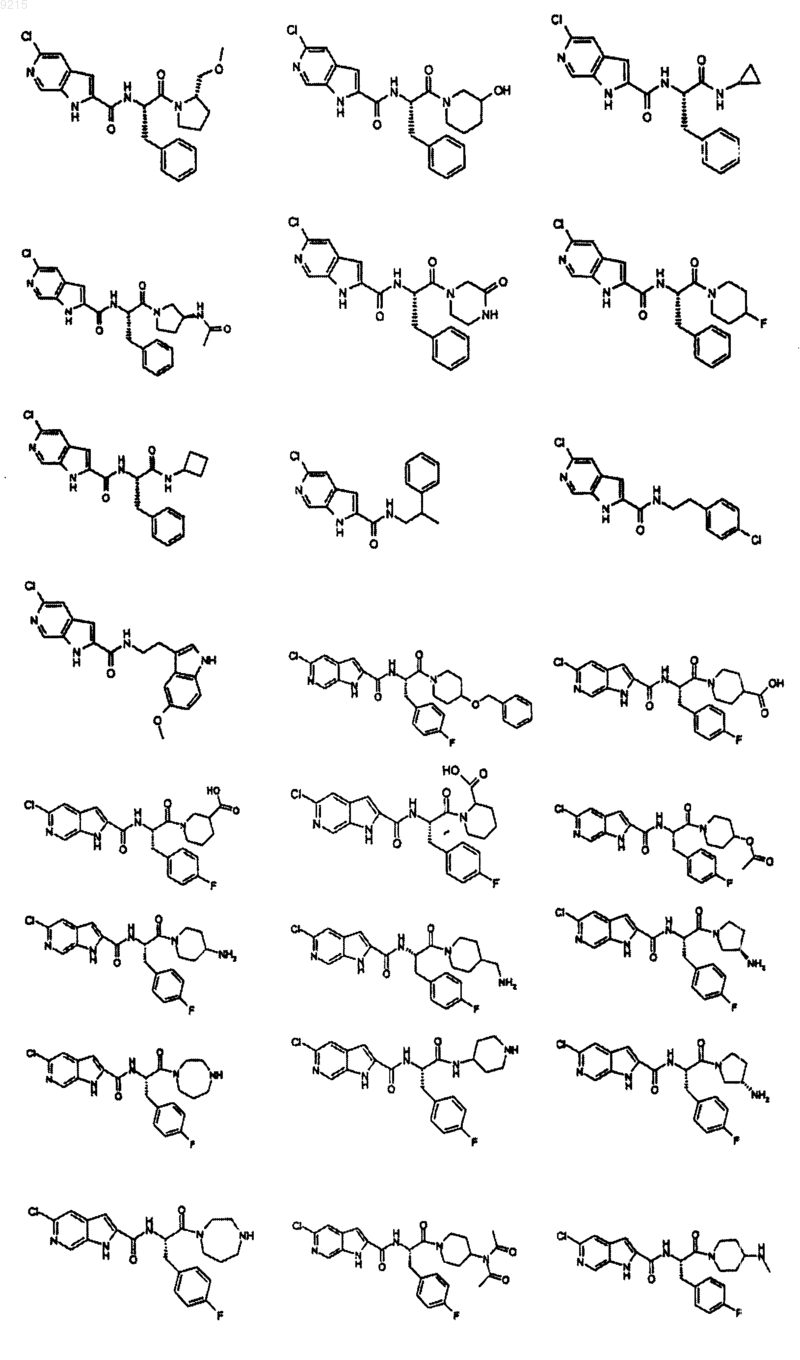
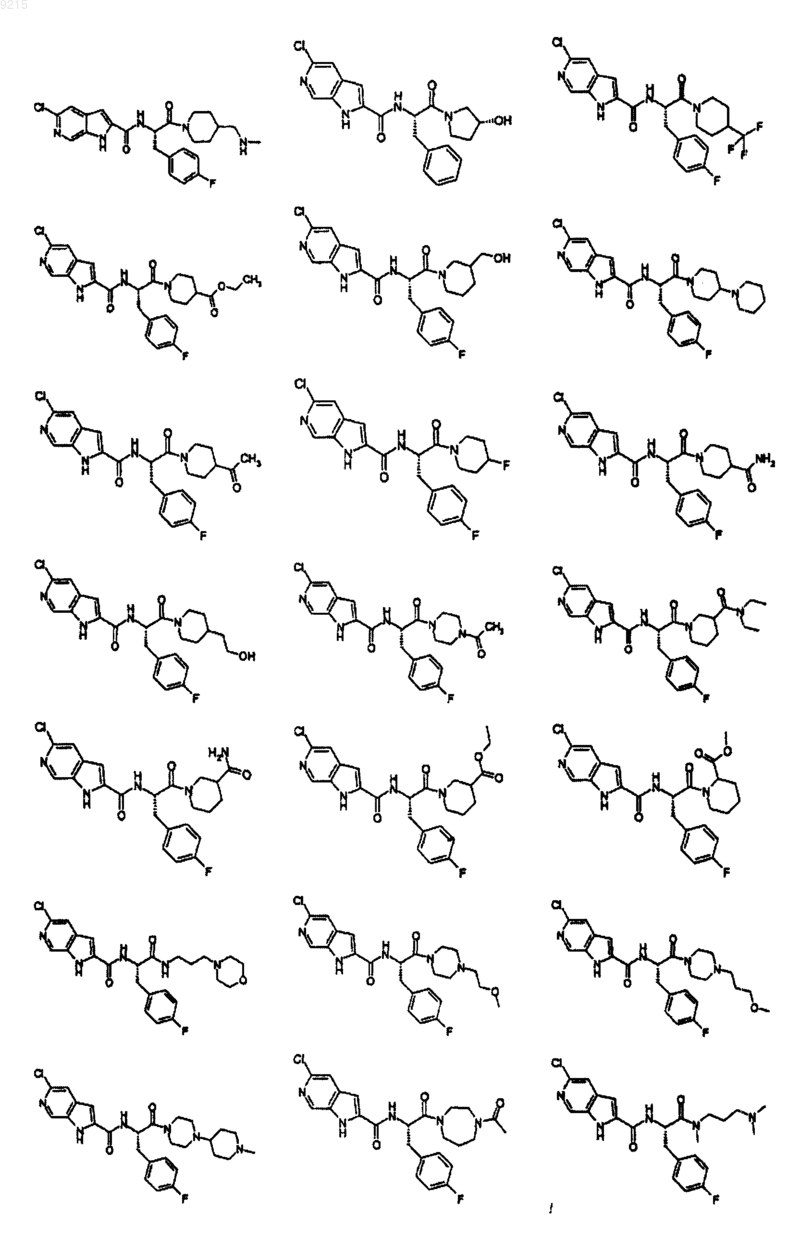
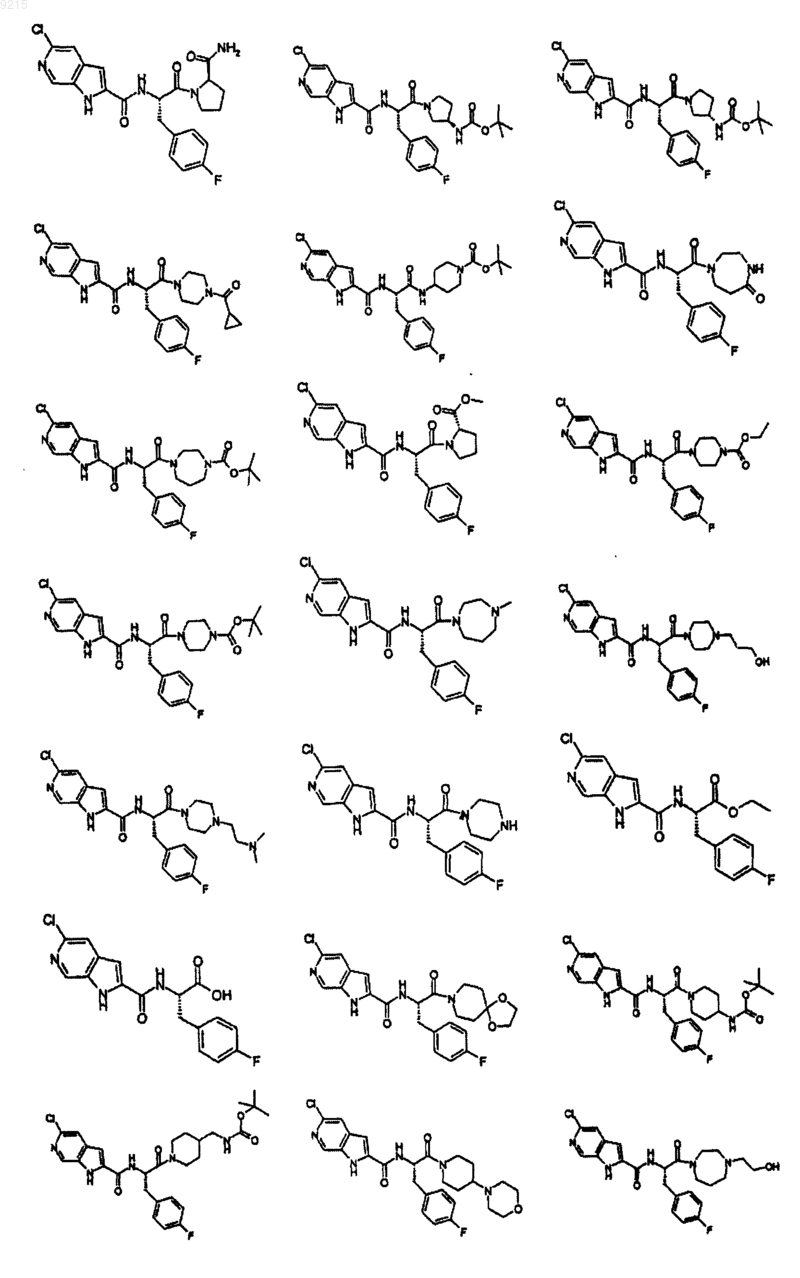
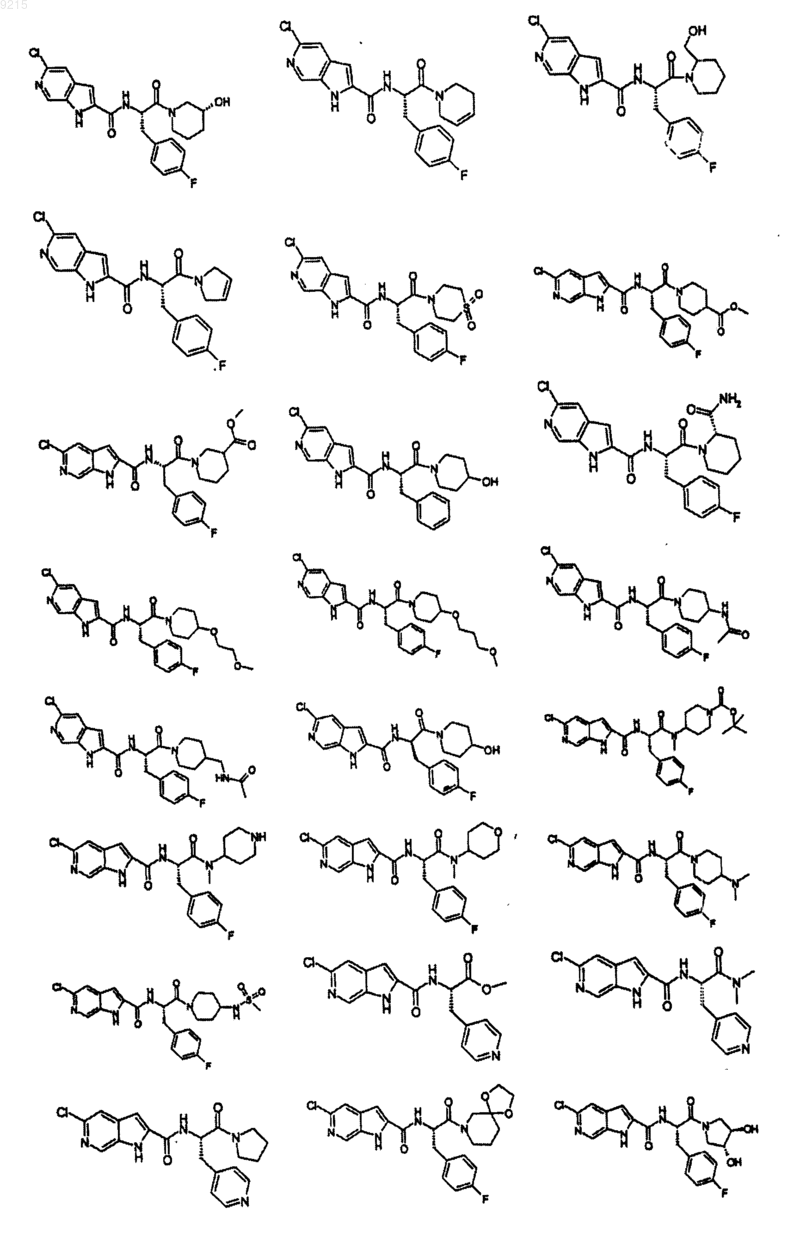
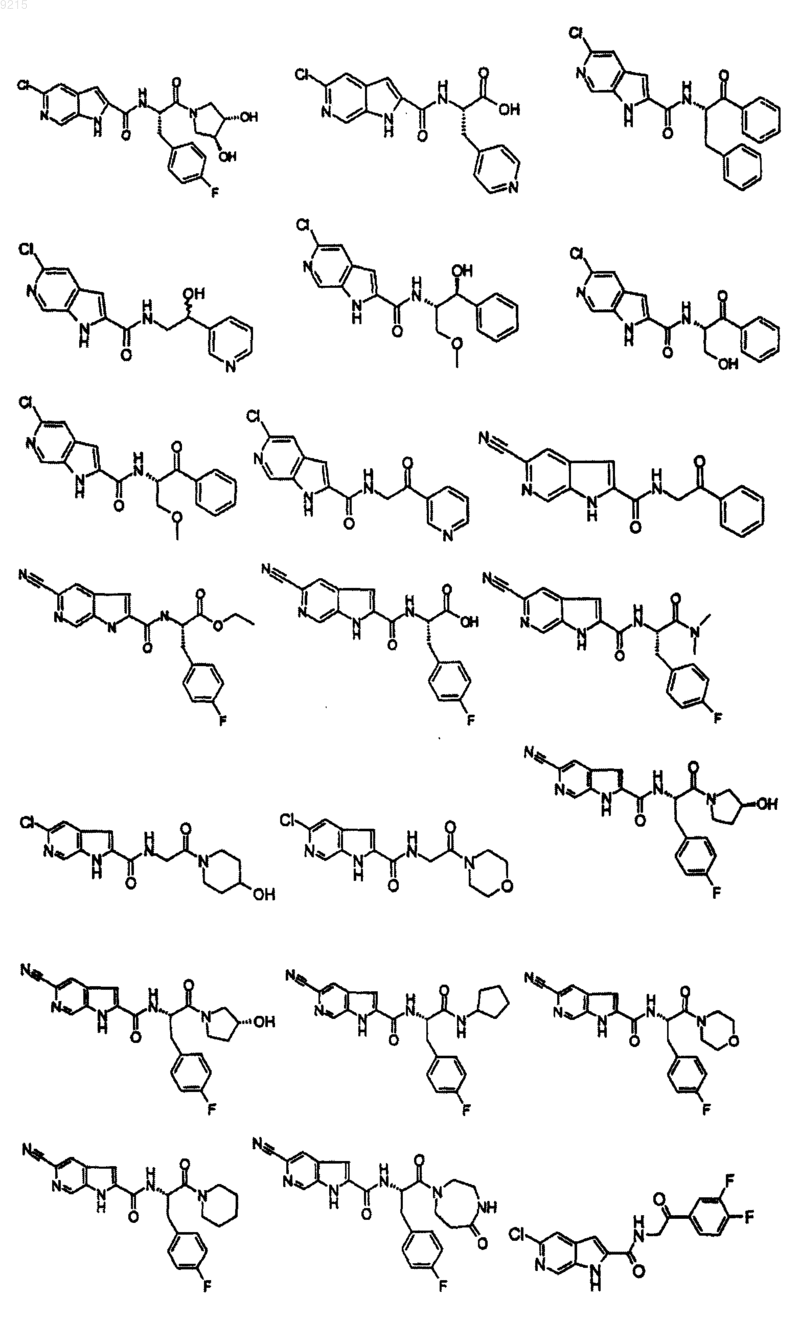
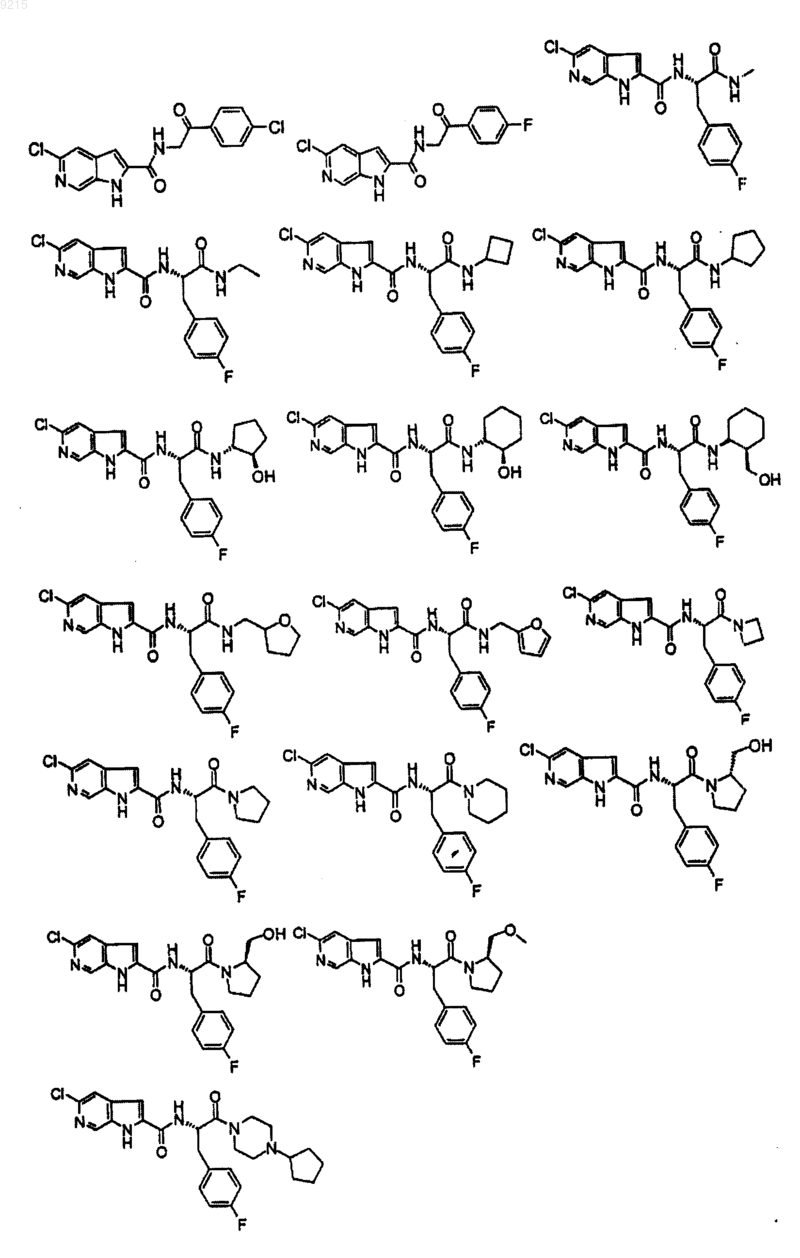
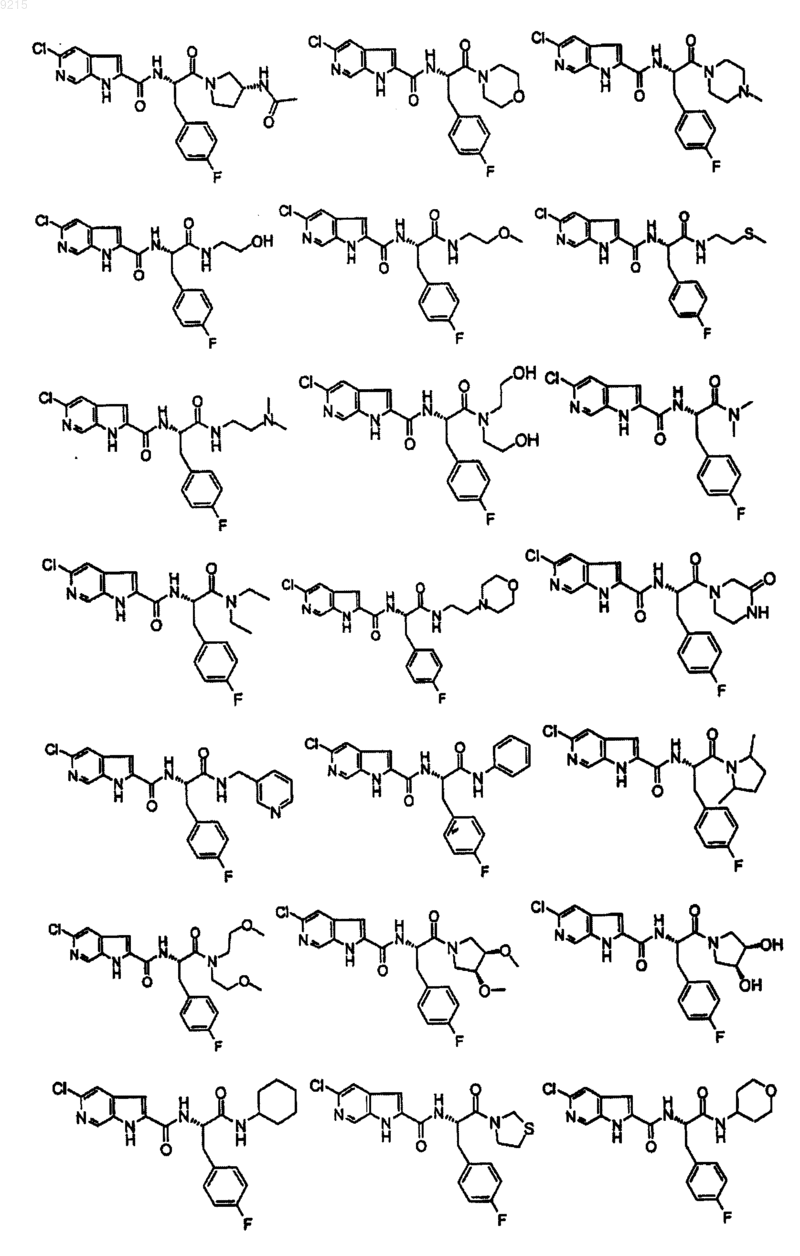
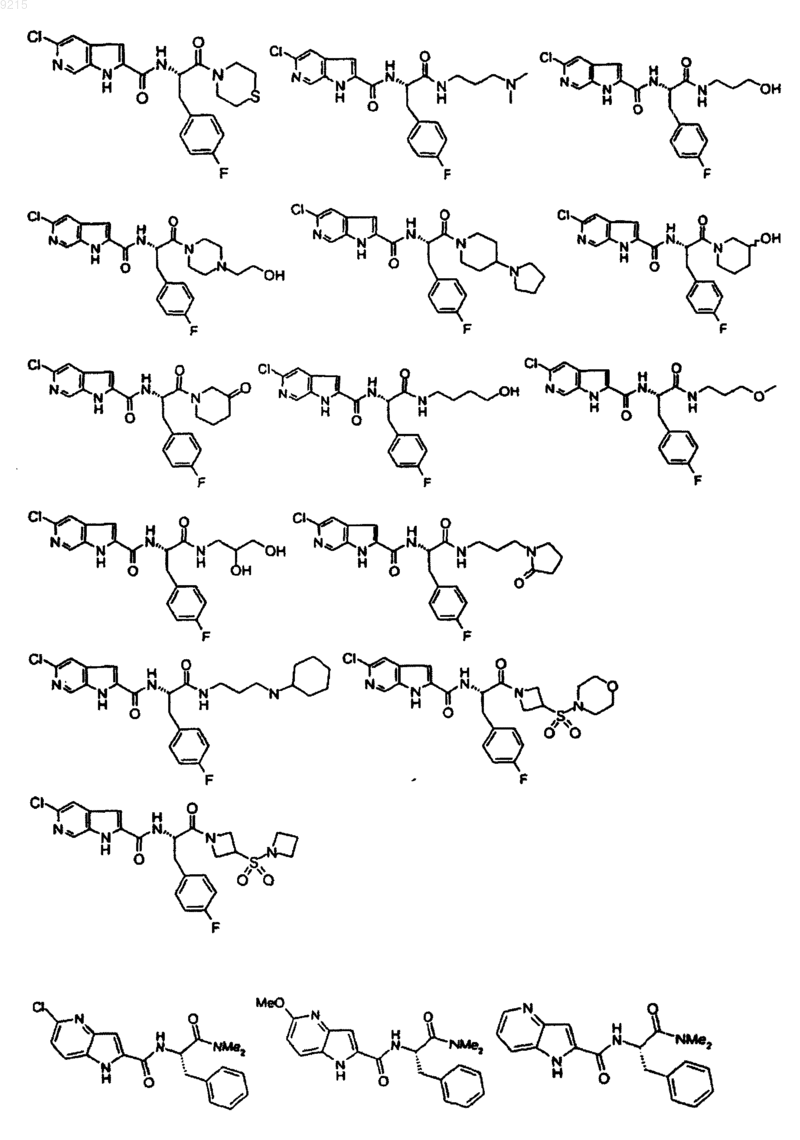
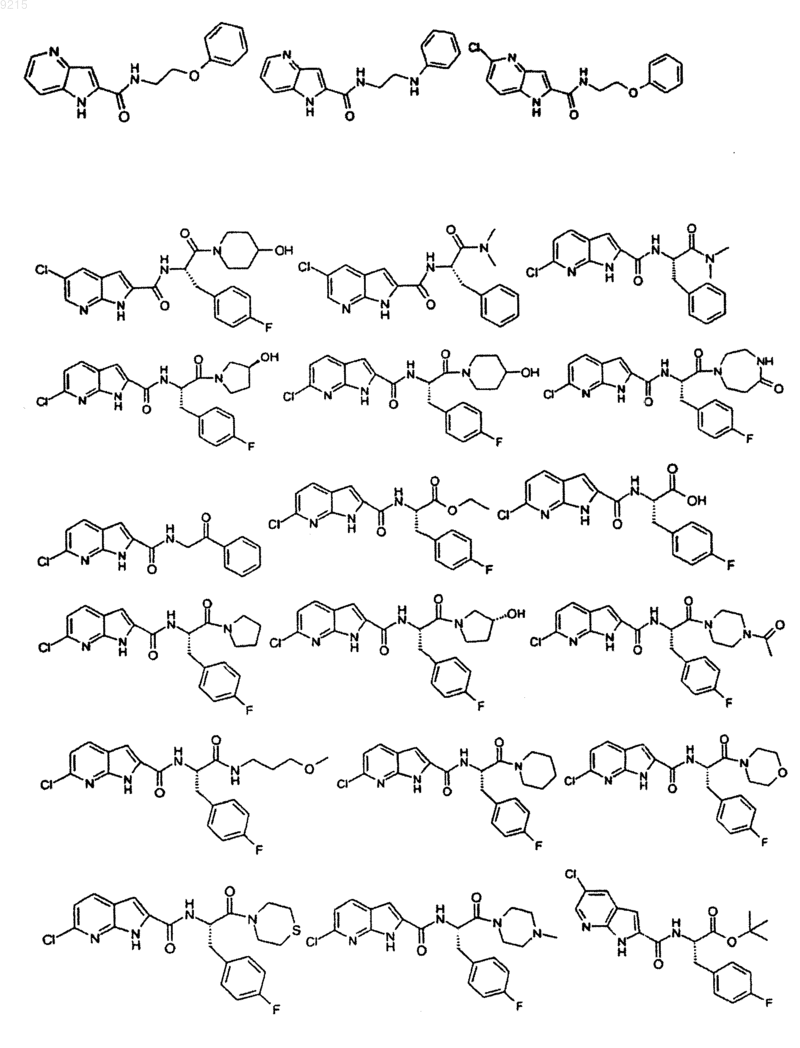
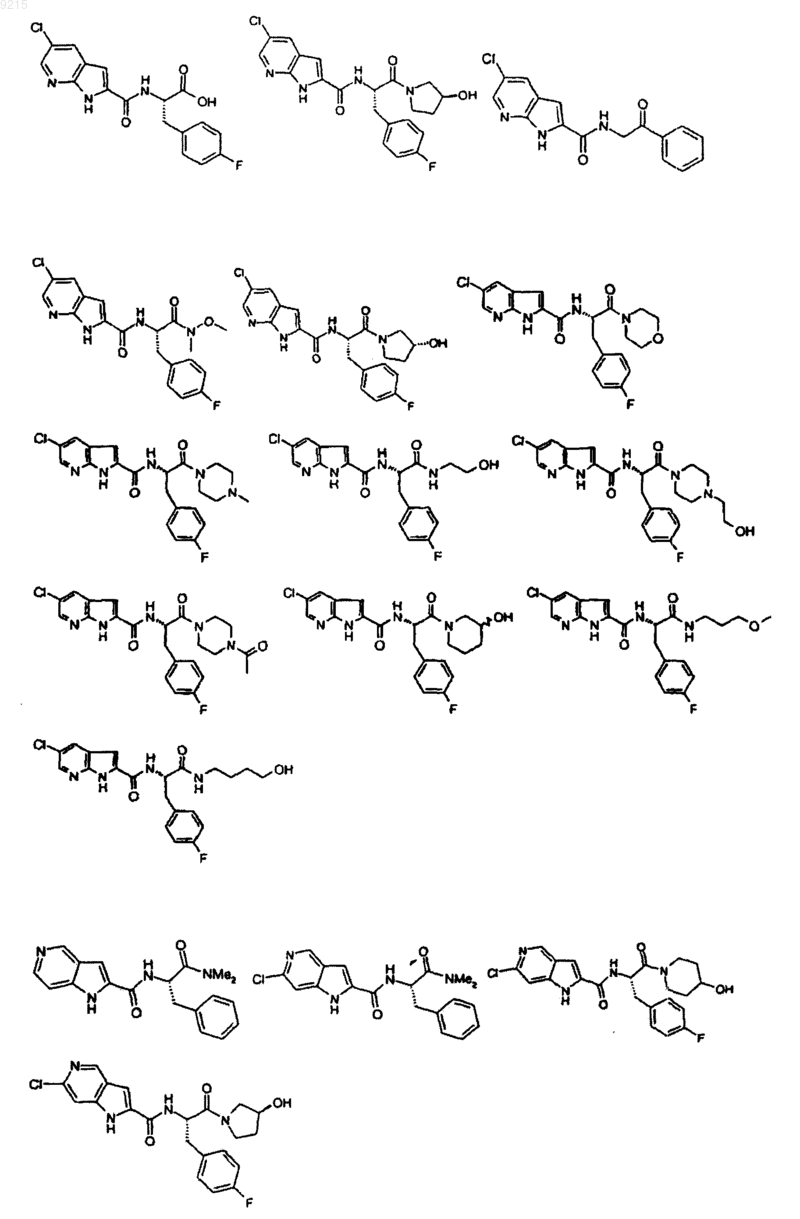
или его фармацевтически приемлемая соль.
15. Композиция, содержащая соединение по любому из пп.1-14, или его стереоизомер, или фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
16. Способ профилактического или терапевтического лечения гипергликемии или диабета, включающий стадию введения эффективного количества соединения по любому из пп.1-14, или его стереоизомера, или фармацевтически приемлемой соли.
17. Способ предупреждения диабета у человека, проявляющего преддиабетическую гипергликемию или нарушенную толерантность к глюкозе, включающий стадию введения эффективного профилактического количества соединения по любому из пп.1-14, или его стереоизомера, или фармацевтически приемлемой соли.
18. Способ профилактического или терапевтического лечения гиперхолестеринемии, гиперинсулинемии, гиперлипидемии, атеросклероза или ишемии миокарда, включающий стадию введения эффективного количества соединения по любому из пп.1-14, или его стереоизомера. или фармацевтически приемлемой соли.
19. Способ кардиозащиты, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения по любому из пп.1-14 или его стереоизомера или фармацевтически приемлемой соли.
20. Способ получения соединения формулы (I) по п.1, включающий
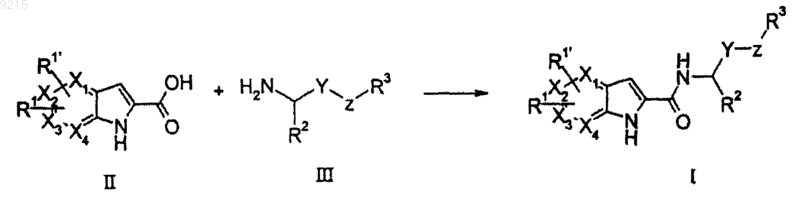
сочетание пирролопиридин-2-карбоновой кислоты формулы (II) или ее защищенного или активированного производного с амином формулы (III).
21. Способ получения соединения формулы (I) по п.1, где Z представляет собой C=O и R3 представляет собой -NR4(-С0-4алкилR5), включающий
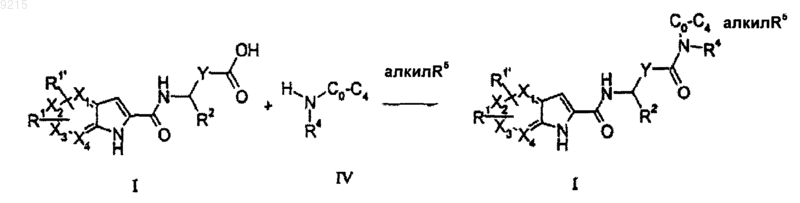
сочетание карбоновой кислоты формулы (I) или ее защищенного или активированного производного, в которых Z отсутствует и R3 представляет собой -СО2Н, с амином формулы (IV).
22. Способ получения соединения формулы (I) по п.1, где R2 представляет собой H, Y представляет собой С0алкил, Z представляет собой -C(O)- и R3 представляет собой -С0алкиларил или
-С0алкилгетероарил, включающий
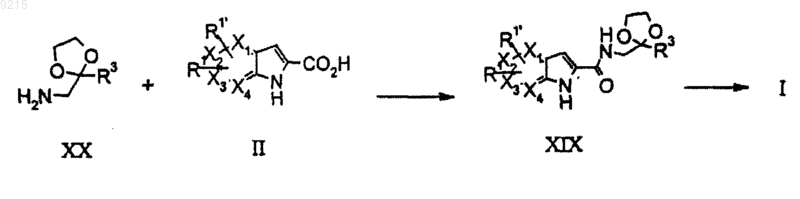
сочетание соединения формулы (XX) с соединением формулы (II) в стандартных условиях сочетания с получением соединения формулы (XIX), с последующим удалением кетальной группы в присутствии кислоты.
23. Соединение формулы (IIA)

либо его С1-4алкиловый эфир или защищенное производное,
где один из X1, Х2, X3 и X4 должен представлять собой N, а другие должны представлять собой С;
R1 и R1, каждый независимо, представляют собой галоген, гидроксил, циано, С0-4алкил, С1-4алкокси, фторметил, дифторметил, трифторметил, этенил или этинил либо отсутствуют;
при условии что когда X1, X3 или X4 представляет собой N, тогда R1 и R1' оба не являются водородом,
при условии что, когда X1, X2 и X3 представляют собой С, X4 представляет собой N, R1 находится в положении 4 и выбран из галогена, циано, С0-4алкила, С1-4алкокси, фторметила, дифторметила, трифторметила и этенила и R1' представляет собой водород, тогда это соединение не является С1-4алкиловым эфиром,
при условии что это соединение не является: этиловым эфиром 6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты, этиловым эфиром 4-метокси-1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты, этиловым эфиром 4-метокси-1-(2-триметилсиланилэтоксиметил)-1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты, 5-этокси-1H-пирроло[3,2-b]пиридин-2-карбоновой кислотой, этиловым эфиром
5-этокси-1Н-пирроло[3,2-b]пиридин-2-карбоновой кислоты, этиловым эфиром 5-метокси-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты или этиловым эфиром 6-циано-1Н-пирроло[3,2-b]пиридин-2-карбоновой кислоты, этиловым эфиром 5-метокси-1Н-пирроло[3,2-b]пиридин-2-карбоновой кислоты, 5-метокси-1Н-пирроло[3,2-b]пиридин-2-карбоновой кислотой или 5-метокси-1H-пирроло[2,3-с]пиридин-2-карбоновой кислотой.
24. Соединение по п.23, выбранное из
5-хлор-1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты,
5-бром-1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты,
5-циано-1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты,
5-метокси-1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты,
1H-пирроло[3,2-с]пиридин-2-карбоновой кислоты,
6-хлор-1Н-пирроло[3,2-с]пиридин-2-карбоновой кислоты,
6-циано-1Н-пирроло[3,2-с]пиридин-2-карбоновой кислоты,
5-хлор-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты,
5-бром-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты,
6-этинил-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты,
5-циано-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты,
5-метил-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты,
5-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновой кислоты,
6-хлор-1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты,
6-циано-1Н-пирроло[2,3-b]пиридин-2-карбоновой кислоты
или С1-4алкиловых эфиров любого из них.
25. Соединение формулы (XIX)

где R1, Rr, X1, Х2, X3 и X4 такие, как определено в п.1;
R3 представляет собой -С0алкиларил или -С0алкилгетероарил.
26. 4(S)-(4-Фторбензил)оксазолидин-2,5-дион.
Текст
009215 Предшествующий уровень техники Настоящее изобретение направлено на амиды пирролопиридин-2-карбоновых кислот. В частности,настоящее изобретение направлено на амиды пирролопиридин-2-карбоновых кислот, являющиеся ингибиторами гликогенфосфорилазы. Инсулинозависимый диабет типа I и инсулиннезависимый диабет типа II продолжают оставаться трудными для лечения, даже несмотря на то, что в распоряжении имеются допущенные к клиническому применению режимы, включающие в себя диету, физическую нагрузку, гипогликемические агенты и инсулин. Лечение является зависимым от пациента, поэтому остается необходимость в новых гипогликемических агентах, в частности таких, которые пациент может лучше переносить с незначительными побочными эффектами. Печень и некоторые другие органы продуцируют глюкозу, расщепляя гликоген или синтезируя глюкозу из небольших молекул-предшественников и повышая таким образом уровень сахара в крови. Расщепление гликогена катализирует фермент гликогенфосфорилаза. Соответственно, ингибирование гликогенфосфорилазы ("GP") может снижать повышенный уровень сахара в крови у пациентов с диабетом. Аналогично, гипертензия и ассоциированные с ней патологии, такие как, например, атеросклероз,липидемия, гиперлипидемия и гиперхолестеринемия, ассоциируются с повышенными уровнями инсулина (гиперинсулинемией), что может приводить к аномальным уровням сахара в крови. Более того, в результате может иметь место ишемия миокарда. Такие заболевания можно лечить гипогликемическими агентами, включая соединения, которые ингибируют гликогенфосфорилазу. Также описаны кардиопротекторные эффекты ингибиторов гликогенфосфорилазы, например, после реперфузионного повреждения(см., например, Ross et al., American Journal of Physiology, Heart and Circulary Physiology, Mar. 2004,286(3), H1177-84). Соответственно, принято считать, что соединения, которые ингибируют гликогенфосфорилазу (см., например, патент США 6297269) полезны в лечении диабета, гипергликемии, гиперхолестеринемии, гиперинсулинемии, гиперлипидемии, атеросклероза или ишемии миокарда. Тем не менее, было бы желательно получить новые соединения, которые ингибируют гликогенфосфорилазу. В R. Kurukulasuriya, J.T. Link, et al., Current Medicinal Chem., 10: 99-121 (2003) описаны "ProspectsInhibition of Hepatic Glucose Production". В патенте США 6297269 и в европейской патентной заявкеЕР 0832066 описаны замещенныеN-(индол-2-карбонил)амиды и их производные в качестве ингибиторов гликогенфосфорилазы. В патентах США 6107329 и 6277877 описаны замещенные N-(индол-2-карбонил)глицинамиды и их производные в качестве ингибиторов гликогенфосфорилазы. В патенте США 6399601 описаны бициклические пирролиламиды в качестве ингибиторов гликогенфосфорилазы. В европейских патентных заявкахEP 0978276 и EP 1136071 описаны ингибиторы гликогенфосфорилазы человека и их применение. В международной патентной публикацииWO 01/68055 описаны ингибиторы гликогенфосфорилазы. В патенте США 5952322 описан способ уменьшения некардиального ишемического повреждения тканей с использованием ингибиторов гликогенфосфорилазы. В международной патентной публикацииWO 01/55146 описаны ариламидины. В международной патентной публикацииWO 01/62775 описаны противоаритмические пептиды. В международной патентной публикацииWO 01/96346 описаны трициклические соединения. В международной патентной публикацииWO 02/16314 описаны замещенные полиаминные соединения. В международной патентной публикацииWO 02/20475 описаны ингибиторы активности сериновых протеаз. В международной патентной публикацииWO 02/40469 описаны ингибиторы бомбезиновых рецепторов. В международной патентной публикацииWO 02/46159 описаны производные гуанидина и амидина. В международной патентной публикацииWO 00/69815 описаны производные уреидозамещенных циклических аминов. В международной патентной публикацииWO 00/43384 описаны ароматические гетероциклические соединения. В международных патентных публикацияхWO 02/26697 и WO 00/76970 описаны ароматические производные. В международной патентной публикацииWO 01/32622 описаны индолы. В европейской патентной заявкеEP 1101759 описаны фенилазольные соединения. В европейской патентной заявкеEP 1179341 описаны циклические аминосоединения.-1 009215 В патенте США 6037325 описаны замещенные гетероциклические соединения. В патенте США 5672582 описаны 4-замещенные производные циклогексиламина. В европейской патентной заявкеEP 1201239 описаны CCR3-антагонисты, представляющие собой циклические амины. В международной патентной публикацииWO 98/25617 описаны замещенные арилпиперазины. В патенте США 5756810 описано получение 3-нитробензоатных соединений. В патенте США 5710153 описаны тетразольные соединения. В патентах США 6174887 и 6420561 описаны амидные соединения. В S.P. Hiremath et al., Acta Ciencia lndica, XVIII: 397 (1992) описан синтез и биологические активности индолилтиосемикарбазидов и семикарбазидов. В международной патентной публикацииWO 96/36595 описаны 3,4-дизамещенные фенилсульфонамиды. В патенте США 5618825 описаны комбинаторные библиотеки сульфонамидов. В европейской патентной заявкеEP 0810221 описаны кислородсодержащие гетероциклические производные. В европейской патентной заявкеEP 0345990 описаны полипептидные соединения. В европейской патентной заявкеEP 0254545 описаны диаминосоединения. В международной патентной публикацииWO 97/31016 описаны ингибиторы SH2 опосредованных процессов. В патенте США 6034067 описаны ингибиторы сериновых протеаз. В международной патентной публикацииWO 97/17985 и в патенте США 6107309 описаны геморегуляторные соединения. В патенте США 6432921 описаны ингибиторы тромбина. В патентной заявке ВеликобританииGB 2292149 описаны пептидные ингибиторы проинтерлейкин 1-превращающего фермента. В патенте США 5821241 описаны антагонисты фибриногеновых рецепторов. В международной патентной публикацииWO 01/02424 описаны пептидные бороновокислые соединения. В патентах США 6001811, 5869455 и 5618792 описаны оксадиазольные, тиадиазольные и триазольные пептоиды. В патентах США 5885967, 6090787 и 6124277 описаны тромбинингибирующие пептидные производные. В патенте США 6455529 описаны антагонисты адгезионных рецепторов. В патенте США 6410684 описаны ингибиторы сериновых протеаз. В международной патентной публикацииWO 01/94310 описаны бис-гетероциклические алкалоиды. В патентной публикации США 20030004162 А 1, европейской патентной заявкеEP 0846464 и в международной патентной публикацииWO 96/39384 описаны ингибиторы гликогенфосфорилазы. В международной патентной публикацииWO 97/28798 описаны производные пирролидина. В патенте США 5346907 описаны аминокислотные аналоги. Краткое изложение сущности изобретения Соединения, представленные формулой (I) или их стереоизомеры, или фармацевтически приемлемые соли являются ингибиторами гликогенфосфорилазы и полезны в профилактическом или терапевтическом лечении диабета, гипергликемии, гиперхолестеринемии, гиперинсулинемии, гиперлипидемии, гипертензии, атеросклероза или ишемии тканей,например ишемии миокарда, а также в качестве кардиопротекторов.-2 009215 Подробное описание изобретения Настоящее изобретение направлено на соединение формулы (I) или его стереоизомер или фармацевтически приемлемую соль,где один из X1, X2, X3 и X4 должен представлять собой N, а другие должны представлять собой C; каждый из R1 и R1' независимо представляет собой галоген, гидрокси, циано, C0-4 алкил, C1-4 алкокси,фторметил, дифторметил, трифторметил, этенил или этинил;R2 представляет собой C0-4 алкил, COOR6, COR6, C1-4 алкоксиC1-4 алкил-, гидроксиC1-4 лкил-, циклоалкилC0-4 алкил-, арилC0-4 алкил-, гетероарилC0-4 алкил-, где любое из арильных или гетероарильных колец,возможно, замещено 1-2 независимыми заместителями, представляющими собой галоген, циано,C1-4 алкил, C1-4 алкокси, -N(C0-4 алкил)(C0-4 алкил), -SO2C1-4 алкил, -SO2N(C0-4 алкил)(C0-4 алкил), гидрокси,фторметил, дифторметил или трифторметил;Z представляет собой CH2, -C(O)-, -O-, N(C0-4 алкил), N(C3-6 циклоалкил) или отсутствует; но, когда Y представляет собой -CH(OH)-, Z или R3 должны быть связаны с Y через углерод-углеродную связь;R3 представляет собой водород, -COOC0-4 алкил, C1-4 алкокси, C1-4 алкил, арилС 1-4 алкилтио-,-C0-4 алкиларил, -C0-4 алкилгетероарил, -C0-4 алкилциклоалкил или -C0-4 алкилгетероциклил, где любое из колец, возможно, замещено 1-3 независимыми заместителями, представляющими собой галоген, циано,C1-4 алкил, фторметил, дифторметил, трифторметил, -C0-4 алкилNHC(O)О(С 1-4 алкил), -С 0-4 алкилNR7R8,-C(O)R9,C1-4 алкоксиC0-4 алкил-,-COOC0-4 алкил,-C0-4 алкилNHC(O)R9,-C0-4 алкилC(O)N(R10)2,10-C1-4 алкоксиC1-4 алкокси, гидроксиC0-4 алкил-, -NHSO2R , -SO2(C1-4 алкил), -SO2NR11R12, 5-6-членный гетероциклил, фенилC0-2 алкокси или фенилC0-2 алкил, где фенил, возможно, замещен 1-2 независимыми заместителями, представляющими собой галоген, циано, C1-4 алкил, C1-4 алкокси, -N(C0-4 алкил)(C0-4 алкил),-SO2C1-4 алкил, -SO2N(C0-4 алкил)(C0-4 алкил), гидрокси, фторметил, дифторметил или трифторметил, либо две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо(=O); либо R3 представляет собой -NR4(-C0-4 алкилR5);R5 представляет собой водород, гидроксиC2-3 алкил-, C1-2 алкоксиC0-4 алкил- либо арил, гетероарил или гетероциклил; где гетероциклическое азотсодержащее кольцо R5, возможно, является монозамещенным по кольцевому атому азота C1-4 алкилом, бензилом, бензоилом, группой C1-4 алкил-C(O)-, -SO2C1-4 алкил,-SO2N(C0-4 алкил)(C0-4 алкил), C1-4 алкоксикарбонилом или арил(C1-4 алкокси)карбонилом и где кольца R5,возможно, являются монозамещенными по кольцевому атому углерода галогеном, циано, группойC1-4 алкил-C(O)-, C1-4 алкил-SO2-, C1-4 алкилом, группой C1-4 алкокси, гидрокси, -N(C0-4 алкил)(C0-4 алкил),гидроксиC0-4 алкил- или C0-4 алкилкарбамоил- при условии, что не включен ни один кватернизированный атом азота или две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо(=O);R7 и R8 независимо представляют собой C0-4 алкил, C3-6 циклоалкил или CO(С 1-4 алкил);R11 и R12 независимо представляют собой С 0-4 алкил или вместе с атомом азота, к которому они присоединены, могут образовать 4-6-членный гетероцикл, и где отсутствуют связи азот-кислород, азот-азот или азот-галоген в соединении трех компонентов Y-Z-R3 друг с другом. Молекулярная масса соединений формулы (I) предпочтительно составляет менее 800, более предпочтительно менее 600. В первом аспекте настоящее изобретение направлено на соединение, представленное формулой (I),или его стереоизомер, или фармацевтически приемлемую соль, где X1 представляет собой N, а другие переменные такие, как определено выше для формулы (I).-3 009215 В одном воплощении первого аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X1 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой -C(O)-, а другие переменные такие, как определено выше для формулы (I). В другом воплощении первого аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X1 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой -О-, а другие переменные такие,как определено выше для формулы (I). Еще в одном воплощении первого аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X1 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой N(С 0-4 алкил), а другие переменные такие, как определено выше для формулы (I). Во втором аспекте настоящее изобретение направлено на соединение, представленное формулой (I),или его стереоизомер, или фармацевтически приемлемую соль, где X2 представляет собой N, а другие переменные такие, как определено выше для формулы (I). В одном воплощении второго аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X2 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой -C(O)-, а другие переменные такие, как определено выше для формулы (I). В третьем аспекте настоящее изобретение направлено на соединение, представленное формулой (I),или его стереоизомер, или фармацевтически приемлемую соль, где Х 3 представляет собой N, а другие переменные такие, как определено выше для формулы (I). В одном воплощении третьего аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер или фармацевтически приемлемую соль, где X3 представляет собой N, Y представляет собой С 0-2 алкил, Z представляет собой -C(O)-, а другие переменные такие, как определено выше для формулы (1). В другом воплощении третьего аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X3 представляет собой N; Y представляет собой -CH(OH)-; Z представляет собой -C(O)-, а другие переменные такие, как определено выше для формулы (I). Еще в одном воплощении третьего аспекта настоящее изобретение направлено на соединение,представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X3 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой -O-, а другие переменные такие, как определено выше для формулы (I). Еще в одном воплощении третьего аспекта настоящее изобретение направлено на соединение,представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X3 представляет собой N; Y представляет собой С 0-2 алкил; Z отсутствует, а другие переменные такие, как определено выше для формулы (I). Еще в одном воплощении третьего аспекта настоящее изобретение направлено на соединение,представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X3 представляет собой N; Y представляет собой С 0-2 алкил; Z представляет собой N(С 0-4 алкил), а другие переменные такие, как определено выше для формулы (I). В четвертом аспекте настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X4 представляет собойN, а другие переменные такие, как определено выше для формулы (I). В одном воплощении четвертого аспекта настоящее изобретение направлено на соединение, представленное формулой (I), или его стереоизомер, или фармацевтически приемлемую соль, где X4 представляет собой N; Y представляет собой -CH(OH)-; Z представляет собой -C(O)-, а другие переменные являются такими, как определено выше для формулы (I). Когда Y представляет собой прямую связь, тогда Z предпочтительно является отличным от группы-O-, N(С 0-4 алкил) или N(С 3-6 циклоалкил). Предпочтительно X3 представляет собой N. Предпочтительно каждый из R1 и R1' независимо представляют собой галоген, циано, водород, метил, метокси или этинил. Более предпочтительно каждый из R1 и R1' независимо представляют собой галоген, циано или водород. Предпочтительно по меньшей мере один из R1 и R1' представляет собой водород. Более предпочтительно один из R1 и R1' представляет собой водород. Предпочтительную группу составляют соединения, в которых X3 представляет собой N; один из R1 1' и R представляет собой водород, а другой представляет собой группу 5-галогено или 5-циано. Предпочтительно Y представляет собой С 0-2 алкил, более предпочтительно Y представляет собой прямую связь. Предпочтительно Z представляет собой -C(O)-.-4 009215 Предпочтительную группу составляют соединения, в которыхZ представляет собой -C(O)-. Предпочтительно R2 представляет собой С 0-4 алкил или арилС 0-4 алкил-, где арильное кольцо, возможно, замещено 1-2 независимыми заместителями, представляющими собой галоген, циано,С 1-4 алкил, С 1-4 алкокси, -N(C0-4 алкил)(С 0-4 алкил), -SO2C1-4 алкил, -SO2N(С 0-4 алкил)(C0-4 алкил), гидрокси,фторметил, дифторметил или трифторметил. Более предпочтительно R2 представляет собой бензил, возможно, замещенный 1-2 галогеновыми заместителями. Конкретный заместитель R2, который можно упомянуть, представляет собой -(S)-(4-фторбензил). Предпочтительно R3 представляет собой -С 0-4 алкилгетероциклил, возможно, замещенный 1-3 независимыми заместителями, представляющими собой галоген, циано, С 1-4 алкил, фторметил,дифторметил,трифторметил,-С 0-4 алкилNHC(O)O(C1-4 алкил),-C0-4 алкилNR7R8,-C(O)R9,9 С 1-4 алкоксиС 0-4 алкил-,-СООС 0-4 алкил,-С 0-4 алкилNHC(O)R ,-C0-4 алкилC(O)N(R10)2,10-С 1-4 алкоксиС 1-4 алкокси, гидроксиC0-4 алкил-, -NHSO2R , -SO2(C1-4 алкил), -SO2NR11R12, 5-6-членный гетероциклил, фенилC0-2 алкокси или фенилC0-2 алкил, где фенил, возможно, замещен 1-2 независимыми заместителями, представляющими собой галоген, циано, С 1-4 алкил, С 1-4 алкокси, -N(C0-4 алкил)(C0-4 алкил),-SO2C1-4 алкил, -SO2N(C0-4 алкил)(C0-4 алкил), гидрокси, фторметил, дифторметил или трифторметил, либо две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо(=O); или R3 представляет собой -NR4(-C0-4 алкилR5). Более предпочтительно R3 представляет собой азотсодержащую гетероциклическую группу, особенно 4-8-членную азотсодержащую гетероциклическую группу, соединенную с Z через кольцевой атом азота, возможно, замещенную 1-3 независимыми заместителями, представляющими собой галоген, циано, C1-4 алкил, фторметил, дифторметил, трифторметил, -C0-4 алкилNHC(O)O(C1-4 алкил), -C0-4 алкилN7R8,-C(O)R9,C1-4 алкоксиC0-4 алкил-,-COOC0-4 алкил,-C0-4 алкилNHC(O)R9,-C0-4 алкилC(O)N(R10)2,10-C1-4 алкоксиC1-4 алкокси, гидроксиC0-4 алкил-, -NHSO2R , -SO2(C1-4 алкил), -SO2NR11R12, 5-6-членный гетероциклил, фенилC0-2 алкокси или фенилC0-2 алкил, где фенил, возможно, замещен 1-2 независимыми заместителями, представляющими собой галоген, циано, C1-4 алкил, C1-4 алкокси, -N(C0-4 алкил)(C0-4 алкил),-SO2C1-4 алкил, -SO2N(C0-4 алкил)(C0-4 алкил), гидрокси, фторметил, дифторметил или трифторметил, либо две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо (=O); или R3 представляет собой -NR4(-C0-4 алкилR5). Примеры азотсодержащих гетероциклических групп, которыми может являться R3, включают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, 1,4-диазапан-1-ил, пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1,1-диоксо-тиоморфолин-4-ил или тиазолидин-3-ил; где эти группы могут быть, возможно, замещены, как описано выше. Предпочтительные группы-заместители для R3 включают -C1-4 алкокси, гидрокси и оксо. Еще более предпочтительно R3 представляет собой пирролидин-1-ил или пиперидин-1-ил, возможно, замещенный гидроксилом, например 4-гидроксипиперидин-1-ил и 3-(S)-гидроксипирролидин-1-ил. Конкретными соединениями по изобретению, которые можно упомянуть, являются соединения,включенные в примеры, в частности 5-хлор-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты [1-(S)-(4 фторбензил)-2-(4-гидроксипиперидин-1-ил)-2-оксоэтил]амид и 5-хлор-1H-пирроло[2,3-с]пиридин-2 карбоновой кислоты [1-(S)-(4-фторбензил)-2-(3-(S)-гидроксипирролидин-1-ил)-2-оксоэтил]амид. Конкретную группу соединений, которую можно упомянуть, составляют соединения, представленные формулой (IA) или их стереоизомер, или фармацевтически приемлемая соль,где один из X1, X2, X3 и X4 должен представлять собой N, а другие должны представлять собой C; каждый из R1 и R1' независимо представляет собой галоген, гидрокси, циано, C0-4 алкил, C1-4 алкокси,фторметил, дифторметил, трифторметил, этенил или этинил;R2 представляет собой C0-4 алкил, арилC0-4 алкил-, гетероарилC0-4 алкил-, где любое из арильных или гетероарильных колец, возможно, замещено 1-2 независимыми заместителями, представляющими собой галоген,циано,C1-4 алкил,C1-4 алкокси,-N(C0-4 алкил)(C0-4 алкил),-SO2C1-4 алкил,-SO2N(C0-4 алкил)(C0-4 алкил), гидрокси, фторметил, дифторметил или трифторметил;Z представляет собой CH2, -C(O)-, -O-, N(C0-4 алкил), N(C3-6 циклоалкил) или отсутствует; но, ко-5 009215 гда Y представляет собой -CH(OH)-, Z или R3 должны быть связаны с Y через углерод-углеродную связь;R3 представляет собой водород, -COOC0-4 алкил, C1-4 алкокси, арилC1-4 алкилтио-, -C0-4 алкиларил,-C0-4 алкилгетероарил или -C0-4 алкилгетероциклил, где любое из колец, возможно, замещено 1-3 независимыми заместителями, представляющими собой галоген, циано, C1-4 алкил, фторметил, дифторметил,трифторметил,-C0-4 алкилN(C0-4 алкил)(C0-4 алкил),-C(O)(C0-4 алкил),C1-4 алкоксиC0-4 алкил-,-СООC0-4 алкил, C0-4 алкилкарбамоил-, -C1-4 алкоксиметокси, гидроксиC0-4 алкил-, -SO2(C1-4 алкил) или фенилC0-2 алкил, либо две связи на кольцевом атоме углерода гетероциклильной группы, возможно, могут образовать заместитель оксо(=O); либо R3 представляет собой -NR4(-C0-4 алкилR5);R5 представляет собой водород, гидроксиC2-3 алкил-, C1-2 алкоксиC2-4 алкил- либо арил, гетероарил или гетероциклил; где гетероциклическое азотсодержащее кольцо R5, возможно, является монозамещенным по кольцевому атому азота C1-4 алкилом, бензилом, бензоилом, группой C1-4 алкил-C(O)-, -SO2C1-4 алкил,-SO2N(C0-4 алкил)(C0-4 алкил), C1-4 алкоксикарбонилом или арил(C1-4 алкокси)карбонилом; и где кольца R5,возможно, являются монозамещенными по кольцевому атому углерода галогеном, циано, группойC1-4 алкил-C(О)-, C1-4 алкил-SO2-, C1-4 алкилом, группой C1-4 алкокси, -N(C0-4 алкил)(C0-4 алкил),гидроксиC0-4 алкил- или C0-4 алкилкарбамоил-, при условии что не включен ни один кватернизированный атома азота; и где отсутствуют связи азот-кислород, азот-азот или азот-галоген в соединении трех компонентов Y-Z-R3 друг с другом. Хотя предпочтительные группы для каждой переменной в целом перечислены выше отдельно для каждой переменной, предпочтительные соединения по данному изобретению включают соединения, в которых некоторые переменные или каждая переменная в формуле (I) выбраны из предпочтительных,более предпочтительных, наиболее предпочтительных, особенно или конкретно перечисленных групп для каждой переменной. Следовательно, в данное изобретение следует включать все комбинации предпочтительных, более предпочтительных, наиболее предпочтительных, особенно или конкретно перечисленных групп. В данном описании, если не указано иное, "алкил", также как другие группы, имеющие префикс"алк", такие как, например, алкокси, алканил, алкенил, алкинил и подобные, означает углеродные цепи,которые могут быть линейными или разветвленными, либо их комбинации. Примеры алкильных групп включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил и подобные."Алкенил", "алкинил" и другие подобные термины включают углеродные цепи, имеющие по меньшей мере одну ненасыщенную углерод-углеродную связь. В данном описании, например, "C0-4 алкил" используют для обозначения алкила, имеющего от 0 до 4 атомов углерода, т.е. 0, 1, 2, 3 или 4 атома углерода в прямой или разветвленной конфигурации. Алкил,не имеющий атомов углерода, представляет собой водород, когда алкил является концевой группой. Алкил, не имеющий атомов углерода, представляет собой прямую связь, когда алкил является мостиковой(связующей) группой. Термины "циклоалкил" и "карбоциклическое кольцо" означают карбоциклы, не содержащие гетероатомов, и включают моно-, би- и трициклические насыщенные карбоциклы, а также конденсированные и мостиковые системы. Такие конденсированные кольцевые системы могут включать одно кольцо,которое является частично или полностью ненасыщенным, такое как бензольное кольцо, с образованием конденсированных кольцевых систем, таких как бензоконденсированные карбоциклы. Циклоалкил включает такие конденсированные кольцевые системы, как спироконденсированные кольцевые системы. Примеры циклоалкильных и карбоциклических колец включают C3-10 циклоалкильные группы, в частности C3-8 циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил и декагидронафталин, адамантан, инданил, 1,2,3,4-тетрагидронафталин и подобные. Термин "галоген" включает атомы фтора, хлора, брома и йода. Термин "карбамоил", если конкретно не указано иное, означает -C(O)-NH- или -NH-C(O)-. Термин "арил" хорошо известен химикам. Предпочтительными арильными группами являются фенил и нафтил, более предпочтительно фенил. Термин "гетероарил" хорошо известен химикам. Этот термин включает 5- или 6-членные гетероарильные кольца, содержащие 1-4 гетероатома, выбранные из кислорода, серы и азота, в которых атомы кислорода и серы не являются соседними. Примерами таких гетероарильных колец являются фурил, тиенил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридинил, пиридазинил, пиримидинил, пиразинил и триазинил. Термин "гетероарил" включает гетероарильные кольца с конденсированными карбоциклическими кольцевыми системами, которые являются частично или полностью ненасыщенными, такими как бензольное кольцо, с образованием бензоконденсированного гетероарила, например бензимидазола, бензоксазола,-6 009215 бензотиазола, бензофурана, хинолина, изохинолина, хиноксалина и т.п Если не указано иное, термины "гетероциклическое кольцо", "гетероциклил" и "гетероцикл" эквивалентны и включают 4-10-членные, например 4-8-членные, насыщенные или частично насыщенные кольца, содержащие один или два гетероатома, выбранные из кислорода, серы и азота. Гетероатомы серы и кислорода непосредственно не присоединены друг к другу. Любые гетероатомы азота в кольце могут быть, возможно, замещены C1-4 алкилом. Примеры гетероциклических колец включают азетидин, оксетан, тетрагидрофуран, тетрагидропиран, оксепан, оксокан, тиетан, тиазолидин, оксазолидин, оксазетидин, пиразолидин, изоксазолидин, изотиазолидин, тетрагидротиофен, тетрагидротиопиран, тиепан,тиокан, азетидин, пирролидин, пиперидин, N-метилпиперидин, азепан, 1,4-диазапан, азокан,[1,3]диоксан,оксазолидин,пиперазин,гомопиперазин,морфолин,тиоморфолин,1,2,3,6-тетрагидропиридин и т.п. Другие примеры гетероциклических колец включают окисленные формы серосодержащих колец. Так, тетрагидротиофен-1-оксид, тетрагидротиофен-1,1-диоксид,тиоморфолин-1-оксид, тиоморфолин-1,1-диоксид, тетрагидротиопиран-1-оксид, тетрагидротиопиран-1,1 диоксид, тиазолидин-1-оксид и тиазолидин-1,1-диоксид также рассматриваются как гетероциклические кольца. Термин "гетероциклический" также включает конденсированные кольцевые системы и может включать карбоциклическое кольцо, которое является частично или полностью ненасыщенным,такое как бензольное кольцо, с образованием бензоконденсированных гетероциклов, например 3,4-дигидро-1,4-бензодиоксина, тетрагидрохинолина, тетрагидроизохинолина и т.п. Соединения, описанные здесь, могут содержать один или более чем один асимметрический центр и могут, таким образом, образовывать диастереоизомеры и оптические изомеры. Настоящее изобретение включает все такие возможные диастереомеры, а также их рацемические смеси, их, по существу, чистые разделенные энантиомеры, все возможные геометрические изомеры и их фармацевтически приемлемые соли. Формула (I) приведена выше без указания какой-либо определенной стереохимии по некоторым положениям. Настоящее изобретение включает все стереоизомеры формулы (I) и их фармацевтически приемлемые соли. Кроме того, включены также как смеси стереоизомеров, так и выделенные конкретные стереоизомеры. В процессах синтеза, используемых для получения таких соединений, либо при использовании процессов рацемизации или эпимеризации, известных специалистам в данной области техники,продукты таких процессов могут представлять собой смесь стереоизомеров. Если существует таутомер соединения формулы (I), в настоящее изобретение включены все возможные таутомеры и их фармацевтически приемлемые соли, а также их смеси, за исключением случаев,когда конкретно изображено или указано иное. Если соединение формулы (I) и его фармацевтически приемлемые соли существуют в форме сольватов или полиморфных форм, в настоящее изобретение включены все возможные сольваты и полиморфные формы. Тип растворителя, который образует сольват, конкретно не ограничен, при условии,что этот растворитель является фармацевтически приемлемым. Например, можно использовать воду,этанол, пропанол, ацетон или т.п. Данное изобретение также охватывает фармацевтическую композицию, состоящую из соединения формулы (I) или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым носителем. Предпочтительно эта композиция состоит из фармацевтически приемлемого носителя и нетоксичного терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Кроме того, в рамках данного предпочтительного воплощения изобретение охватывает фармацевтическую композицию для лечения заболевания посредством ингибирования гликогенфосфорилазы, результатом чего является профилактическое или терапевтическое лечение диабета, гипергликемии, гиперхолестеринемии, гиперинсулинемии, гиперлипидемии, гипертензии, атеросклероза или ишемии ткани,например ишемии миокарда, содержащую фармацевтически приемлемый носитель и нетоксичное терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных оснований или кислот. Когда соединение по настоящему изобретению является кислым, его соответствующую соль можно легко получить из фармацевтически приемлемых нетоксичных оснований, включая неорганические основания и органические основания. Соли, полученные из таких неорганических оснований, включают соли алюминия, аммония, кальция, меди (двухвалентной и одновалентной), трехвыалентного и двухвалентного железа, лития, магния, калия, натрия, цинка и подобные. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли,полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, а также циклических аминов и замещенных аминов, таких как природные или синтетические замещенные амины. Другие фармацевтически приемлемые органические нетоксичные основания, из которых можно образовать соли, включают аргинин, бетаин, кофеин,холин, N',N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидраба-7 009215 мин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы,прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Если соединение по настоящему изобретению является основным, его соответствующую соль можно легко получить из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Такие кислоты включают, например, уксусную, бензолсульфоновую, бензойную,камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, бромистоводородную, соляную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую, азотную, памовую, пантотеновую, фосфорную, янтарную, серную, винную, паратолуолсульфоновую кислоты и подобные. Особенно предпочтительными являются лимонная, бромистоводородная, соляная, малеиновая, фосфорная, серная и винная кислоты. Так как соединения формулы (I) предназначены для фармацевтического применения, их предпочтительно представляют, по существу, в чистой форме, например по меньшей мере 60% чистоты, более пригодно по меньшей мере 75% чистоты и особенно по меньшей мере 98% чистоты (% представляет собой массовый процент). Фармацевтические композиции по настоящему изобретению содержат соединение, представленное формулой (I), или его фармацевтически приемлемую соль в качестве активного ингредиента, фармацевтически приемлемый носитель и, возможно, другие терапевтические ингредиенты или адъюванты. Эти композиции включают композиции, пригодные для перорального, ректального, местного и парентерального (включая подкожное, внутримышечное и внутривенное) введения, хотя наиболее подходящий путь в любом конкретном случае будет зависеть от конкретного хозяина, а также от природы и тяжести состояний, при которых вводят активный ингредиент. Композиции предпочтительно пригодны для перорального введения. Фармацевтические композиции могут быть удобно представлены в стандартной лекарственной форме и изготовлены любым из способов, хорошо известных в фармацевтической области. На практике соединения формулы (I) или их фармацевтически приемлемые соли можно объединять в качестве активного ингредиента в тесной смеси с фармацевтическим носителем в соответствии с общепринятыми фармацевтическими методиками смешивания. Носитель может иметь большое множество форм в зависимости от желательной для введения формы препарата, например пероральной или парентеральной (включая внутривенную). Таким образом, фармацевтические композиции по настоящему изобретению могут быть представлены в виде дискретных единиц, пригодных для перорального введения,таких как капсулы, саше или таблетки, каждая из которых содержит предопределенное количество активного ингредиента. Кроме того, эти композиции могут быть представлены в виде порошка, в виде гранул, в виде раствора, в виде суспензии в водной жидкости, в виде неводной жидкости, в виде эмульсии масло-в-воде или в виде жидкой эмульсии вода-в-масле. В дополнение к обычным лекарственным формам, указанным выше, соединения формулы (I) или их фармацевтически приемлемые соли можно также вводить посредством регулируемого высвобождения и/или устройств доставки. Эти композиции можно изготовить любыми фармацевтическими способами. В общем случае такие способы включают стадию объединения активного ингредиента с носителем, который состоит из одного или более необходимых ингредиентов. В общем случае композиции готовят, равномерно и тесно смешивая активный ингредиент с жидкими носителями или тонкоизмельченными твердыми носителями либо с обоими. Затем продукт можно подходящим образом отформовать в нужном виде. Таким образом, фармацевтические композиции по данному изобретению могут включать фармацевтически приемлемый носитель и соединение формулы (I) или его фармацевтически приемлемую соль. Соединения формулы (I) или их фармацевтически приемлемые соли могут быть также включены в фармацевтические композиции в комбинации с одним или более другими терапевтически активными соединениями. Используемый фармацевтический носитель может представлять собой, например, твердое вещество, жидкость или газ. Примеры твердых носителей включают лактозу, каолин, сахарозу, тальк, желатин,агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Примерами жидких носителей являются сахарный сироп, арахисовое масло, оливковое масло и вода. Примеры газообразных носителей включают диоксид углерода и азот. В изготовлении композиций для пероральной лекарственной формы можно использовать любые удобные фармацевтические среды. Например, воду, гликоли, масла, спирты, корригирующие агенты,консерванты, красящие агенты и т.п. можно использовать для образования пероральных жидких препаратов, таких как суспензии, эликсиры и растворы; тогда как такие носители, как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, гранулирующие агенты, смазывающие агенты, связующие агенты, разрыхляющие агенты и т.п. можно использовать для изготовления пероральных твердых препаратов, таких как порошки, капсулы и таблетки. Благодаря легкости их введения таблетки и капсулы являются предпочтительными пероральными лекарственными формами, в силу чего используют твердые фармацевтические носители. Таблетки, возможно, могут быть покрыты оболочкой стандартными водными или неводными способами. Таблетка, содержащая композицию по данному изобретению, может быть получена путем прессования или формования, возможно, с одним или более вспомогательными ингредиентами или адъюванта-8 009215 ми. Прессованные таблетки могут быть получены путем прессования активного ингредиента в сыпучей форме, такой как порошок или гранулы, возможно, смешанного со связующим агентом, смазывающим агентом, инертным разбавителем, поверхностно-активным или диспергирующим агентом в подходящем аппарате. Формованные таблетки могут быть получены путем формования в подходящем аппарате смеси порошкообразного соединения, увлажненной инертным жидким разбавителем. Каждая таблетка предпочтительно содержит от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента, и каждое саше или каждая капсула предпочтительносодержат от приблизительно 0,05 мг до приблизительно 5 г активного ингредиента. Например, препарат, предназначенный для перорального введения людям, может содержать от приблизительно 0,5 мг до приблизительно 5 г активного агента, смешанного с подходящим и удобным количеством вещества-носителя, которое может варьироваться от приблизительно 5 до приблизительно 95% от всей композиции. Стандартные лекарственные формы будут, как правило, содержать от приблизительно 1 мг до приблизительно 2 г активного ингредиента, обычно 25, 50, 100, 200, 300, 400, 500, 600,800 или 1000 мг. Фармацевтические композиции по настоящему изобретению, пригодные для парентерального введения, можно готовить в виде растворов или суспензий активных соединений в воде. Можно включать подходящее поверхностно-активное вещество, такое как, например, гидроксипропилцеллюлоза. Дисперсии можно также готовить в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Кроме того,можно включать консервант для предотвращения нежелательного роста микроорганизмов. Фармацевтические композиции по настоящему изобретению, пригодные для инъекционного применения, включают стерильные водные растворы или дисперсии. Кроме того, эти композиции могут находиться в форме стерильных порошков для приготовления таких стерильных инъекционных растворов или дисперсий непосредственно перед применением. Во всех случаях конечная инъекционная форма должна быть стерильной и должна быть хорошо текучей для легкого введения шприцем. Эти фармацевтические композиции должны быть стабильными в условиях изготовления и хранения; так, они предпочтительно должны быть предохранены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель должен представлять собой раствор или дисперсионную среду, содержащие, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), растительные масла и их подходящие смеси. Фармацевтические композиции по настоящему изобретению могут находиться в форме, пригодной для местного применения, такой как, например, аэрозоль, крем, мазь, лосьон, порошок для опудривания или т.п. Кроме того, композиции могут находиться в форме, пригодной для применения в чрескожных устройствах. Эти препараты можно изготовить, используя соединение формулы (I) или его фармацевтически приемлемую соль, общепринятыми способами обработки. Например, крем или мазь готовят путем смешивания гидрофильного вещества и воды вместе с соединением в количестве от приблизительно 5 до приблизительно 10 мас.% с получением крема или мази с нужной консистенцией. Фармацевтические композиции по данному изобретению могут находиться в форме, пригодной для ректального введения, когда носитель представляет собой твердое вещество. Предпочтительно, чтобы смесь образовала суппозиторий со стандартной дозой. Пригодные носители включают какао-масло и другие вещества, обычно используемые в данной области техники. Суппозитории можно легко сформировать, сначала смешивая композицию с размягченным(и) или расплавленным(и) носителем(ями), а затем охлаждая и формуя ее в формах. В дополнение к вышеуказанным ингредиентам-носителям фармацевтические композиции, описанные выше, могут включать, когда это приемлемо, один или более чем один дополнительный ингредиентноситель, такой как разбавители, буферы, корригенты, связующие агенты, поверхностно-активные агенты, загустители, смазывающие агенты, консерванты (включая антиоксиданты) и т.п. Кроме того, можно включать другие адъюванты, чтобы сделать препарат изотоничным крови предполагаемого реципиента. Композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль, можно также приготовить в порошкообразной или жидкой концентрированной форме. Как правило, уровни дозировки порядка от 0,01 мг/кг до приблизительно 150 мг на 1 кг массы тела в сутки либо альтернативно от приблизительно 0,5 мг до приблизительно 7 г на пациента в сутки полезны в лечении вышеуказанных состояний. Например, диабет и гипергликемию можно эффективно лечить путем введения от приблизительно 0,01 до 50 мг соединения на 1 кг массы тела в сутки или альтернативно от приблизительно 0,5 мг до приблизительно 3,5 г на пациента в сутки. Аналогично, гиперхолестеринемию, гиперинсулинемию, гиперлипидемию, гипертензию, атеросклероз или ишемию ткани, например ишемию миокарда, можно эффективно лечить путем введения от приблизительно 0,01 до 50 мг соединения на 1 кг массы тела в сутки или альтернативно от приблизительно 0,5 мг до приблизительно 3,5 г на пациента в сутки. Очевидно, однако, что конкретный уровень дозировки для любого конкретного пациента будет зависеть от ряда факторов, включая возраст, массу тела, общее состояние здоровья, пол, режим питания,время введения, путь введения, скорость выведения, комбинацию лекарственных средств и тяжесть конкретного заболевания, подлежащего лечению.-9 009215 Соединения формулы (I) и их фармацевтически приемлемые можно применять в лечении заболеваний или состояний, при которых какую-либо роль играет гликогенфосфорилаза. Таким образом, в изобретении также предложен способ лечения заболевания или состояния, при котором какую-либо роль играет гликогенфосфорилаза, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Заболевания или состояния, при которых играет роль гликогенфосфорилаза, включают диабет(включая тип I и тип II, нарушенную толерантность к глюкозе, резистентность к инсулину и диабетические осложнения, такие как невропатия, нефропатия, ретинопатия и катаракта), гипергликемию, гиперхолестеринемию, гиперинсулинемию, гиперлипидемию, гипертензию, атеросклероз, ишемию ткани, например ишемию миокарда. В изобретении также предложен способ лечения гипергликемии или диабета, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ предупреждения диабета у человека, у которого проявляется предиабетическая гипергликемия или нарушенная толерантность к глюкозе, включающий стадию введения субъекту, нуждающемуся в этом, эффективного профилактического количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ лечения гиперхолестеринемии, гиперинсулинемии, гиперлипидемии, гипертензии, атеросклероза или ишемии ткани, например ишемии миокарда, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложен способ кардиозащиты, например после реперфузионного повреждения, включающий стадию введения субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в лечении состояния, как определено выше. В изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарства для лечения состояния, как определено выше. В способах по изобретению термин "лечение" включает как терапевтическое, так и профилактическое лечение. Соединения формулы (I) или их фармацевтически приемлемые соли можно вводить сами по себе или в комбинации с одним или более другими терапевтически активными соединениями. Другие терапевтически активные соединения могут быть предназначены для лечения того же заболевания или состояния, что и соединения формулы (I), или другого заболевания или состояния. Терапевтически активные соединения можно вводить одновременно, последовательно или отдельно. Соединения формулы (I) можно вводить с другими активными соединениями для лечения диабета,например, инсулином и аналогами инсулина, сульфонилмочевинами и их аналогами, бигуанидами,2-агонистами, ингибиторами окисления жирных кислот, ингибиторами -глюкозидазы, -агонистами,ингибиторами фосфодиэстеразы, агентами, снижающими уровень липидов, агентами против ожирения,антагонистами амилина, ингибиторами липоксигеназы, аналогами сомостатина, активаторами глюкокиназы, антагонистами глюкагона, агонистами инсулиновой передачи сигнала, РТР 1 В-ингибиторами, ингибиторами глюконеогенеза, антилиполитическими агентами, ингибиторами GSK, агонистами рецептора Галанина, аноректическими агентами, агонистами CCK-рецепторов, лептином, CRF-антагонистами илиCRF-связывающими белками. Соединения формулы (I) можно также вводить в комбинации с тиреомиметическими соединениями, ингибиторами альдозоредуктазы, антагонистами глюкокортикоидных рецепторов, ингибиторамиNHE-1 или ингибиторами сорбитолдегидрогеназы. Соединения формулы (I) могут обладать более полезными свойствами по сравнению с известными ингибиторами гликогенфосфорилазы, например, эти соединения могут обладать улучшенной растворимостью, таким образом улучшая всасываемость и биодоступность. Кроме того, соединения формулы (I) могут обладать дополнительными полезными свойствами, такими как уменьшенное ингибирование ферментов цитохрома Р 450, что означает, что они с меньшей вероятностью вызывают побочные взаимодействия лекарство-лекарство, чем известные ингибиторы гликогенфосфорилазы. Все публикации, включая патенты и патентные заявки, цитируемые в данном описании, но не ограничиваясь ими, включены в данное описание посредством ссылки, как если бы каждая отдельная публикация конкретно и индивидуально была указана как включенная в описание посредством ссылки в полном изложении. В соответствии с данным изобретением соединения формулы (I) могут быть получены, как изображено ниже на схеме 1, где R1, R1', R2, R3, X1, X2, X3, X4, Y и Z являются такими, как определено выше для формулы (I). Согласно схеме 1 соединения формулы (I) могут быть получены путем сочетания соответствующей пирролопиридин-2-карбоновой кислоты формулы (II) или ее защищенного или активированного производного с соответствующим амином формулы (III). Соединения формулы (II) могут быть получены посредством синтезов, изображенных ниже на схемах 3 и 5. Соединения формулы (III), как правило, имеются в продаже или могут быть получены посредством синтезов, изображенных ниже на схемах 8 и 9. Обычно соединение формулы (II) или его защищенное или активированное производное объединяют с соединением формулы (III) в присутствии подходящего агента сочетания. Примерами подходящих реагентов сочетания являются 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид/гидроксибензотриазол (EDCl/HOBt), 1,1-карбонилдиимидазол (CDI), дициклогексилкарбодиимид/гидроксибензотриазол (DCC/HOBt), O-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония тетрафторборат (R. Knorr et al., Tetrahedron Lett., 1989, 30, 1927-1930) и карбодиимид-1-гидроксибензотриазол на полимерном носителе (типичные методики, см., например в Argonaut Technical Note 501, доступный от Argonaut Technologies, Inc., Foster City, California). Сочетания проводят в инертном растворителе,предпочтительно в апротонном растворителе, при температуре от приблизительно 0 до приблизительно 45 С в течение от приблизительно 1 до 72 ч в присутствии третичного аминного основания, такого как диизопропилэтиламин (DIPEA) или триэтиламин. Примеры растворителей включают ацетонитрил, хлороформ, дихлорметан, N,N-диметилформамид (DMF) или их смеси. Использование этих агентов сочетания и подходящий выбор растворителей и температур известны специалистам в данной области техники или могут быть легко определены из литературы. Эти, а также другие примеры условий, полезных для сочетания карбоновых кислот, описаны в Houben-Weyl, vol. XV, part II, E. Wunch, Ed., G. Nhiene Verlag,1974, Stuttgart, и в M. Bodansky, Principles of Peptide Synthesis, Springer-Verlag, Berlin, 1984, и в The Peptides, Analysis, Synthesis and Biology (ed. E. Gross and J. Meienhofer), vol. 1-5, Academic Press NY, 19791983. Схема 2 Во втором способе соединения формулы (I), где Z представляет собой C=O, a R3 представляет собой-NR (-C0-4 алкилR5), могут быть получены согласно схеме 2 путем сочетания соответствующей карбоновой кислоты формулы (I) или ее защищенного или активированного производного (где Z отсутствует иR3 представляет собой -CO2H) с соответствующим амином формулы (IV). Примеры подходящих реагентов сочетания и условий тикие, как описано выше. Соединения формулы (IV) имеются в продаже или могут быть легко получены с помощью известных способов. Соединения формулы (II) могут быть получены, как показано на схеме 3. Схема 3 4- 11009215 Соединения формулы (VI) могут быть получены путем конденсации орто-метилнитросоединений формулы (V) с оксалатным эфиром в растворителе, таком как диэтиловый эфир, в присутствии основания, такого как этилат калия или DBU (1,8-диазабицикло[5.4.0]ундек-7-ен). Соединения формулы (VlI) получают из соединений формулы (Vl) в восстанавливающих условиях, таких как порошок железа и хлорид аммония, либо путем гидрирования в этаноле с использованием палладиевого катализа. Соединения формулы (VII) подвергают гидролизу эфира, используя водную щелочь, с получением пирролопиридин-2-карбоновых кислот формулы (II). Дополнительная информация по превращению соединений формулы (V) в соединения формулы (II) описана в литературе (Kermack et al., J. Chem. Soc., 1921, 119, 1602;Cannon et al., J. Med. Chem., 1981, 24, 238; Julian et al., в Heterocyclic Compounds, vol. 3 (Wiley, New York,NY, 1962, R.C. Elderfield, Ed., p. 18). Альтернативно соединение формулы (VII), где Х 2 представляет собой азот, может быть получено,как показано на схеме 4 Схема 4 В результате депротонирования соединений формулы (VIII) литийорганическим реагентом, таким как н-бутиллитий, в подходящем растворителе, таком как THF (тетрагидрофуран), и затем гашения метилйодидом получают соединения формулы (IX). Такие соединения можно подвергнуть дальнейшему депротонированию трет-бутиллитием в подходящем растворителе, таком как THF, с последующим гашением диэтилоксалатом и последующим нагреванием промежуточного соединения с обратным холодильником в соляной кислоте с получением соединений формулы (VII). Соединения формулы (II) могут быть также получены согласно схеме 5 путем сочетания Хека ортойодаминопиридина (XIV) с последующей циклизацией при температуре между 100 и 150 С в присутствии катализатора, такого как ацетат палладия, и основания, такого как DABCO (бицикло(2,2,2)-1,4 диазаоктан), в растворителе, таком как DMF (см. Chen et al., J. Org. Chem. 1997, 62, 2676). Ортойодаминопиридины (XIV) могут быть получены путем непосредственного йодирования соответствующего аминопиридина (XIII), используя йод в присутствии сульфата серебра в растворителе, таком как этанол, при температуре окружающей среды (см. Sy, W., Synth. Commun., 1992, 22,3215). Схема 5 Альтернативно соединения формулы (XIV) могут быть получены согласно схеме 6 путем удаления защиты N-пивалоильных соединений (XV) при нагревании с обратным холодильником с использованием соляной кислоты. N-пивалоильные соединения (XV), в свою очередь, получают путем депротонирования соединений формулы (XVI) литийорганическим реагентом, таким как трет-бутиллитий, в подходящем растворителе, таком как THF, с последующим гашением йодом при низкой температуре. Соединения формулы (XVI) могут быть получены путем защиты имеющихся в продаже аминопиридинов (XIII) триметилацетилхлоридом и основанием, таким как триэтиламин, в растворителе, таком как дихлорметан. Схема 6- 12009215 Альтернативно соединения формулы (XIV) могут быть получены в соответствии со схемой 7 путем удаления защиты N-Boc-защищенных соединений (XVII) с использованием кислоты, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, при температуре окружающей среды.N-Boc-соединения (XVII), в свою очередь, получают путем депротонирования соединений формулы (XVIII) литийорганическим реагентом, таким как н-бутиллитий, в присутствииN,N,N',N'-тетраметилэтилендиамина (TMEDA) в подходящем растворителе, таком как эфир, при температурах около -70C с последующим добавлением йода при температурах около -10C.N-Boc-аминопиридины (XVIII) обычно получают из имеющихся в продаже аминопиридинов (XIII), используя ди-трет-бутилдикарбонат, путем нагревания в растворителе, таком как 1,4-диоксан. Схема 7 Защищенные или активированные производные соединений формулы (II) могут быть получены способами, известными специалистам в данной области техники. Соединения формулы (III) могут быть получены, как показано на схеме 8. Соединения формулы (X), как правило, имеются в продаже или могут быть легко получены известными способами. PG представляет собой защитную группу, такую как, например, трет-бутоксикарбонил(Boc). Соединения формулы (XI) получают из карбоновых кислот формулы (X), используя стандартные условия сочетания, как описано выше для схемы 1. Схема 8 Соединения формулы (III) могут быть получены из соединений формулы (XI) путем удаления защитной группы, где PG=Boc, в кислых условиях, используя, например, трифторуксусную кислоту в дихлорметане при температуре около 25C. Соединения формулы (III), где R2 представляет собой H, Y представляет собой C0 алкил, Z представляет собой -C(O)- и R3 представляет собой -C0 алкиларил или -C0 алкилгетероарил, могут быть получены в соответствии со схемой 9 Схема 9 Соединения формулы (XXIII) подвергают взаимодействию с фталимидом калия в растворителе, таком как DMF, с получением соединений формулы (XXII), которые затем можно подвергнуть взаимодействию с этиленгликолем в присутствии каталитического количества кислоты, такой как паратолуолсульфоновая кислота, в растворителе, таком как толуол, удаляя воду, с получением соедине- 13009215 ний формулы (XXI). Затем фталимидную защитную группу можно удалить, используя гидрат гидразина,путем нагревания в виде неразбавленного раствора или путем нагревания в растворителе, таком как этанол, с получением соединений формулы (XX). Затем эти амины подвергают сочетанию с соединениями формулы (II) в стандартных условиях сочетания, как описано на схеме 1, после чего кетальную группу удаляют в присутствии кислоты, такой как соляная кислота, в растворителе, таком как ацетон, при температуре образования флегмы с получением соединений формулы (I). Схема 10 Соединения формулы (I), где Z представляет собой C=O, a R3 представляет собой C1-4 алкокси, могут быть получены, как показано на схеме 10, путем объединения соединений формулы (II) и соединений формулы (XII) в стандартных условиях сочетания, как описано для схемы 1. Соединения формулы (XII),как правило, имеются в продаже или могут быть легко получены известными способами. Соединения формулы (I), где Z отсутствует, a R3 представляет собой -CO2H, могут быть получены путем гидролиза эфира соединений формулы (I), где Z представляет собой C=O, a R3 представляет собойC1-4 алкокси, с использованием водной щелочи обычно при температуре около 25C в течение промежутка времени от 30 мин до 20 ч. Соединения формулы (I) можно получать по отдельности или в виде библиотек соединений, содержащих по меньшей мере 2, например от 5 до 1000 соединений и более предпочтительно от 10 до 100 соединений формулы (I). Библиотеки соединений могут быть получены с помощью комбинаторного подхода "разделения и смешивания" или путем множественного параллельного синтеза с использованием либо химии растворов, либо твердофазной химии и методик, известных специалистам в данной области техники. В процессе синтеза соединений формулы (I) лабильные функциональные группы в промежуточных соединениях, например гидрокси, карбокси и аминогруппы, могут быть защищены. Соединения формулы (II) могут быть защищены по положению 1, например, группой арилметил, ацил, алкоксикарбонил,сульфонил или силил. Защитные группы могут быть удалены на любой стадии синтеза соединений формулы (I) или могут присутствовать на конечном соединении формулы (I). Всестороннее обсуждение способов, которыми могут быть защищены различные лабильные функциональные группы, и способов расщепления, полученных в результате защищенных производных, приведено, например, в Protective Groupsin Organic Chemistry, T.W. Greene and P.G.M. Wuts (1991), Wiley-Interscience, New York, 2nd edition. Любые новые промежуточные соединения, как определено выше, также включены в объем данного изобретения. В изобретении также предложено соединение формулы (IIA) либо его C1-4 алкиловый эфир или защищенное производное,где один из X1, X2, X3 и X4 должен представлять собой N, а другие должны представлять собой C; каждый из R1 и R1' независимо представляет собой галоген, гидроксил, циано, C0-4 алкил,C1-4 алкокси, фторметил, дифторметил, трифторметил, этенил или этинил, либо отсутствует; при условии, что, когда X1, X3 или X4 представляют собой N, тогда R1 и R1' оба не являются водородом. Предпочтительные соединения формулы (IIA) включают соединения, в которых X3 представляет собой N. Предпочтительно один из R1 и R1' представляет собой водород, а другой представляет собой галоген или циано, в частности, если X1, X3 или X4 представляют собой N, то 5-галогено, например 5-хлоро, или 5-циано.- 14009215 Конкретные соединения формулы (IIA) включают в себя 5-хлор-1H-пирроло[3,2-b]пиридин-2-карбоновую кислоту,5-бром-1H-пирроло[3,2-b]пиридин-2-карбоновую кислоту,5-циано-1H-пирроло[3,2-b]пиридин-2-карбоновую кислоту,5-метокси-1H-пирроло[3,2-b]пиридин-2-карбоновую кислоту,1H-пирроло[3,2-с]пиридин-2-карбоновую кислоту,6-хлор-1H-пирроло[3,2-с]пиридин-2-карбоновую кислоту,6-циано-1H-пирроло[3,2-с]пиридин-2-карбоновую кислоту,5-хлор-1H-пирроло[2,3-с]пиридин-2-карбоновую кислоту,5-бром-1H-пирроло[2,3-с]пиридин-2-карбоновую кислоту,5-этинил-1H-пирроло[2,3-с]пиридин-2-карбоновую кислоту,5-циано-1H-пирроло[2,3-с]пиридин-2-карбоновую кислоту,5-метил-1H-пирроло[2,3-с]пиридин-2-карбоновую кислоту,5-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновую кислоту,6-хлор-1H-пирроло[2,3-b]пиридин-2-карбоновую кислоту,6-циано-1H-пирроло[2,3-b]пиридин-2-карбоновую кислоту. В изобретении также предложено соединение формулы (XIX) где R1, R1', X1, Х 2, Х 3 и X4 являются такими, как определено выше для формулы (I), a R3 представляет собой -C0 алкиларил или -C0 алкилгетероарил. В изобретении также предложено новое соединение 4(S)-(4-фторбензил)оксазолидин-2,5-дион, которое может быть получено, как описано в экспериментальном разделе. Экспериментальный раздел Материалы и методы. Колоночную хроматографию проводили на SiO2 (40-63 меш.). Данные LCMS (жидкостной хроматографии - масс-спектрометрии) получали, используя колонку Waters Symmetry C18 3,5 мкм (2,130,0 мм,скорость потока 0,8 мл/мин) с элюированным раствором (5% MeCN в H2O)-MeCN, содержащим 0,1%HCO2H, в течение 6 мин и УФ-обнаружение при 220 нм. Информация о градиенте: 0-1,2 мин: (5% MeCN в H2O) - 100%; 1,2-3,8 мин: повышали до 10% (5% MeCN в Н 2 О) - 90% MeCN; 3,8-4,4 мин: выдержавали при 10% (5% MeCN в Н 2 О) - 90% MeCN; 4,4-5,5 мин: повышали до 100% MeCN; 5,5-6,0 мин: возвращались к 100% (5% MeCN в H2O). Масс-спектры получали, используя источник ионизации в электроспрее в режиме положительной ионизации (ES+). Спектры ЯМР получали при 27C на спектрометре Varian Mercury 400, оперируя на частоте 400 МГц, или на спектрометре Bruker АМХ 2 500, оперируя на частоте 500 МГц. Управляемую массой очистку проводили на Micromass Platform LC при конусном напряжении 30 В, используя источник ионизации в электроспрее в режиме положительной ионизации (ES+), Waters 996 Photodiode Array Указанное в заголовке соединение получали в соответствии со способом Parker and Shive (J. Am. Указанное в заголовке соединение получали в соответствии со способом Baumgarten and Su (J. Am. Суспензию 6-метил-5-нитро-1 Н-пиридин-2-она (подготовительный пример 2, 3,53 г, 22,9 ммоль) в оксихлориде фосфора (20 мл) нагревали до 115C (температура масляной бани) в течение 3 ч, затем оставляли охлаждаться до комнатной температуры. Оксихлорид фосфора удаляли в вакууме и остаток вливали в ледяную воду (100 мл). Смесь гасили добавлением насыщенного раствора бикарбоната натрия,затем водную смесь экстрагировали этилацетатом (3100 мл). Объединенные органические фазы промывали рассолом, сушили (MgSO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества. Н (CDCl3): 2,86 (3 Н, s), 7,36 (1H, d, 8,59 Гц), 8,27 (1 Н, d, 8,32 ГЦ). Подготовительный пример 4. Этиловый эфир 3-(2-хлор-5-нитропиридин-6-ил)-2-оксопропионовой кислоты К раствору этилата калия (134 мг, 1,59 ммоль) в диэтиловом эфире (5 мл) и этаноле (1 мл) добавляли диэтилоксалат (218 мкл, 1,59 ммоль) одной порцией и полученный раствор перемешивали в течение 30 мин при комнатной температуре. Добавляли 2-хлор-6-метил-5-нитропиридин (подготовительный пример 3, 250 мг, 1,45 ммоль) в виде суспензии в диэтиловом эфире (2 мл, безводный) и перемешивание продолжали в течение 17 ч при комнатной температуре. Смесь фильтровали на агломерате, промывая холодным диэтиловым эфиром. Собранный осадок растворяли в ледяной уксусной кислоте, затем упаривали до сухости в вакууме с получением указанного в заголовке соединения в виде коричневого порошка. К раствору этилового эфира 3-(2-хлор-5-нитропиридин-6-ил)-2-оксопропионовой кислоты (подготовительный пример 4, 1,53 г, 5,6 ммоль) в THF (65 мл) и этаноле (30 мл) добавляли насыщенный раствор хлорида аммония (30 мл) и суспензию энергично перемешивали при комнатной температуре. Добавляли порциями порошок железа (1,95 г, 34,8 ммоль) и смесь нагревали с обратным холодильником в- 16009215 течение 2 ч, затем оставляли охлаждаться, после чего фильтровали через пробку целита и промывали теплым THF. Смесь концентрировали при пониженном давлении с получением водной суспензии, которую фильтровали через агломерат, промывая водой. Влажное твердое вещество промывали метанолом и сушили. Остаток адсорбировали на силикагеле и очищали флэш-хроматографией, элюируя смесью этилацетат/гексан (1:19), с получением указанного в заголовке соединения в виде белого твердого вещества. К перемешанному раствору этилового эфира 5-хлор-1 Н-пирроло[3,2-b]пиридин-2-карбоновой кислоты (подготовительный пример 5, 151 мг, 0,67 ммоль) в этаноле (10 мл) добавляли гидроксид натрия(0,35 мл, 2 M) и перемешанный раствор нагревали при 70C в течение 2 ч. Затем реакционную смесь оставляли охлаждаться до комнатной температуры и оставляли стоять в течение 16 ч. Доводили рН до 4 добавлением ледяной уксусной кислоты, растворители удаляли в вакууме с получением белого твердого вещества, которое суспендировали в дихлорметане и фильтровали через агломерат, промывая дополнительным количеством дихлорметана. Фильтровальный кек промывали этилацетатом (330 мл) и сушили с получением указанного в заголовке соединения в виде белого твердого вещества. Раствор диметиламина гидрохлорида (1,45 г, 17,8 ммоль) в DMF (46 мл) охлаждали до -10C и добавляли триэтиламин (2,7 мл, 19,4 ммоль). Затем добавляли N-Вос-L-фенилаланин (4,59 г, 17,3 ммоль,Aldrich) и HOBt (3,49 г, 26 ммоль) и реакционную смесь перемешивали в течение 5 мин, после чего добавляли EDCl (3,33 г, 17,4 ммоль). Реакционную смесь оставляли перемешиваться на 16 ч, затем разбавляли этилацетатом (400 мл), последовательно промывали водным раствором гидроксида натрия (2 M,2100 мл), соляной кислотой (2 н., 2100 мл), рассолом (250 мл), а затем сушили (MgSO4). В результате выпаривания в вакууме получали указанное в заголовке соединение в виде бледно-желтого масла. К раствору диметиламида N-трет-бутоксикарбонил-(S)-фенилаланина (подготовительный пример 7,24,8 г, 84 ммоль) в метаноле (50 мл) добавляли раствор соляной кислоты (4 н., в диоксане, 40 мл) и эту смесь перемешивали при комнатной температуре в течение 3 ч. Полученный в результате раствор концентрировали в вакууме, затем растворяли в воде (300 мл). Водный раствор промывали этилацетатом(3100 мл) и снова концентрировали. В результате последовательной перекристаллизации из метанолаSpirey et al. (J. Org. Chem., 1999, 64, 9430) с получением указанного в заголовке соединения в виде белого кристаллического твердого вещества. трет-Бутиловый эфир (3-метилпиридин-4-ил)карбаминовой кислоты получали в соответствии со способом Hands et al. (Synthesis, 1996, 7, 877) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. Раствор трет-бутилового эфира (3-метилпиридин-4-ил)карбаминовой кислоты (подготовительный пример 10, 1,0 г, 4,8 ммоль) в безводном THF (10 мл) охлаждали до -40C и добавляли по каплям третбутиллитий (5,9 мл, 10,1 ммоль). Температуру поддерживали при -40C в течение 1 ч, а затем к этой смеси добавляли раствор диэтилоксалата (0,72 мл, 5,3 ммоль) в THF (20 мл). Реакционную смесь нагревали до 0C, поддерживали при этой температуре в течение 2 ч, нагревали до комнатной температуры и перемешивали в течение 16 ч. Добавляли соляную кислоту (2 н., 40 мл) и реакционную смесь нагревали с обратным холодильником в течение 90 мин, концентрировали в вакууме и доводили до рН 8 насыщенным водным раствором гидрокарбоната натрия. Смесь экстрагировали этилацетатом (3100 мл) и органический раствор сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения. Водный раствор гидроксида натрия (2,4 мл, 2 M, 4,8 ммоль) добавляли к раствору этилового эфира 1 Н-пирроло[3,2-с]пиридин-2-карбоновой кислоты (подготовительный пример 11, 0,76 г, 4,0 ммоль) в этаноле (40 мл) и смесь нагревали с обратным холодильником в течение 2 ч, после чего охлаждали и концентрировали в вакууме. Остаток растворяли в минимальном количестве воды, добавляли ледяную уксусную кислоту (1 мл) и этот раствор охлаждали в холодильнике в течение 3 суток. Полученный в результате осадок собирали фильтрацией, промывали эфиром и сушили в вакууме с получением указанного в заголовке соединения в виде твердого вещества кремового цвета. К раствору этилата калия (3,1 г, 36,2 ммоль) в диэтиловом эфире (70 мл) и этаноле (10 мл) в атмосфере аргона добавляли диэтилоксалат (4,9 мл, 36,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли раствор 4-метил-3-нитропиридина (5,0 г,36,2 ммоль) в диэтиловом эфире (20 мл) с немедленным образованием темно-красного осадка. Реакционную смесь перемешивали при комнатной температуре в течение 72 ч, затем охлаждали до 0C и фильтровали. Твердое вещество растворяли в воде (500 мл), подкисляли до рН 4 уксусной кислотой и осадок собирали и сушили с получением указанного в заголовке соединения в виде красного твердого вещества. К раствору этилового эфира 3-(3-нитропиридин-4-ил)-2-оксопропионовой кислоты (подготовительный пример 13, 500 мг, 2,1 ммоль) в этаноле (20 мл) и THF (10 мл) добавляли насыщенный раствор хлорида аммония (10 мл) и порошок железа (700 мг, 12,6 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 1 ч, затем фильтровали через целит и промывали горячим этилацетатом(330 мл). Объединенные органические фракции промывали рассолом (20 мл), сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества. К раствору этилового эфира 1 Н-пирроло[2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 14, 310 мг, 1,6 ммоль) в этаноле (20 мл) добавляли 2 н. раствор гидроксида натрия (1 мл,2,0 ммоль), реакционную смесь нагревали с обратным холодильником в течение 1,5 ч, затем концентрировали в вакууме. Остаток растворяли в воде (10 мл) и подкисляли уксусной кислотой с немедленным образованием коричневого осадка. Твердое вещество фильтровали и сушили с получением указанного в заголовке соединения в виде бежевого твердого вещества. Способ А. К раствору этилата калия (1,46 г, 17,4 ммоль) в диэтиловом эфире (80 мл) и этаноле (10 мл) в атмосфере аргона добавляли диэтилоксалат (2,4 мл, 17,4 ммоль), эту смесь перемешивали при комнатной температуре в течение 0,5 ч. Добавляли раствор 2-хлор-4-метил-5-нитропиридина (3,0 г, 17,4 ммоль) в диэтиловом эфире (20 мл), в результате чего образовался темно-зеленый осадок. Реакционную смесь перемешивали при комнатной температуре в течение 15 ч, охлаждали до 0C, фильтровали и промывали холодным диэтиловым эфиром с получением темно-зеленого твердого вещества. Твердое вещество растворяли в воде (200 мл) и подкисляли до рН 4 уксусной кислотой с получением оранжевого осадка. Это твердое вещество собирали и сушили с получением указанного в заголовке соединения.m/z (ES+)=273 [M+H]+. Способ Б. К раствору 2-хлор-4-метил-5-нитропиридина (1,0 г, 5,8 ммоль) в диэтилоксалате (4,23 г, 29 ммоль) в атмосфере аргона добавляли 1,8-диазабицикло[5.4.0]ундек-7-ен (0,95 мл, 6,4 ммоль). Эту смесь перемешивали при комнатной температуре в течение 1,5 ч, затем разбавляли трет-бутилметиловым эфиром(40 мл), водой (30 мл) и уксусной кислотой (1 мл). Органический слой отделяли, промывали водой, сушили (MgSO4) и упаривали до сухости. Полученный в результате темно-красный твердый остаток окончательно сушили в глубоком вакууме при 40-50C с получением указанного в заголовке соединения. Подготовительный пример 17. Этиловый эфир 5-хлор-1 Н-пирроло[2,3-с]пиридин-2-карбоновой кислоты(3,7 г, 66,0 ммоль) и насыщенный раствор хлорида аммония (50 мл), смесь нагревали с обратным холодильником в течение 2 ч. Смесь охлаждали, фильтровали через целит и промывали несколько раз этилацетатом. Органические слои объединяли, промывали рассолом (100 мл), сушили (MgSO4) и концентри- 19009215 ровали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества. Способ А. К раствору этилового эфира 5-хлор-1H-пирроло[2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 17, 1,78 г, 7,9 ммоль) в этаноле (70 мл) добавляли раствор гидроксида натрия (5,2 мл,2 M, 10,3 ммоль), эту смесь нагревали с обратным холодильником в течение 2 ч. Растворитель удаляли в вакууме и твердое вещество растворяли в воде (150 мл) и подкисляли до рН 4 уксусной кислотой с получением указанного в заголовке соединения в виде коричневого твердого вещества, которое выделяли фильтрацией.m/z (ES+)=197 [M+H]+. Способ Б. Смесь 6-хлор-4-йодпиридин-3-иламина (подготовительный пример 106, 0,33 г, 1,30 ммоль), пировиноградной кислоты (0,27 мл, 3,89 ммоль), DABCO (0,44 г, 3,89 ммоль) и ацетата палладия (0,015 г,0,07 ммоль) в сухом DMF энергично перемешивали и дегазировали аргоном в течение 15 мин. Реакционную смесь нагревали до 107C в течение 5 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и перемешивали в течение 16 ч. Летучие вещества удаляли при пониженном давлении, а остаток распределяли между этилацетатом (100 мл) и водой (50 мл). Слои разделяли и водный слой экстрагировали этилацетатом (250 мл). Объединенные органические фазы экстрагировали водным NaOH(2 M, 370 мл). Объединенные водные экстракты подкисляли до рН 4 ледяной уксусной кислотой, затем экстрагировали этилацетатом (360 мл). Объединенные органические фазы промывали рассолом (50 мл),сушили (MgSO4), фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества.(12,3 мл, 70 ммоль) и через 5 мин EDCl (7,4 г, 38,8 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме и остаток распределяли между водой (150 мл) и этилацетатом (2150 мл). Объединенные органические фракции промывали раствором гидроксида натрия (2 M, 50 мл), соляной кислотой (2 н., 50 мл), сушили (MgSO4) и концентрировали в вакууме. Продукт хроматографировали на силикагеле, элюируя этилацетатом, с получением указанного в заголовке соединения в виде белого твердого вещества. Способ А. К раствору трет-бутилового эфира [1-(S)-(4-фторбензил)-2-(4-гидроксипиперидин-1-ил)-2 оксоэтил]карбаминовой кислоты (подготовительный пример 19, 11,6 г, 31,7 ммоль) в метаноле (40 мл) добавляли соляную кислоту в диоксане (24 мл, 4 н., 95,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 6 ч. Растворитель удаляли в вакууме и остаток растворяли в воде (100- 20009215 мл) и экстрагировали в этилацетат (250 мл). Водную фазу упаривали до сухости с получением указанного в заголовке соединения в виде белого твердого вещества.(0,5 Н, m), 1,72-1,82 (1 Н, m), 2,61-2,71 (0,5 Н, m), 2,91-3,15 (4 Н, m), 3,33-3,47 (1 Н, m), 3,69-3,78 (1 Н, m),3,88-3,96 (1 Н, m), 4,60-4,72 (1 Н, m), 7,02-7,11 (2 Н, m), 7,14-7,26 (2 Н, m). Способ Б. К раствору 4-гидроксипиперидина (40 мг, 0,4 ммоль) в безводном THF (3 мл) в атмосфере аргона добавляли раствор 4-(S)-(4-фторбензил)оксазолидин-2,5-диона (подготовительный пример 117, 100 мг,0,48 ммоль) в THF (2 мл) по каплям в течение 15 мин. Полученную в результате смесь перемешивали в течение 40 ч при комнатной температуре, после чего растворитель удаляли в вакууме. Неочищенное вещество очищали колоночной хроматографией (SiO2, 9:1 дихлорметан/метанол) с получением масла. Свободный амин растворяли в метаноле (2 мл) и добавляли 4 M раствор HCl в диоксане (0,3 мл), перемешивание продолжали в течение 15 мин. Растворитель удаляли в вакууме и вещество распределяли между этилацетатом (5 мл) и водой (5 мл). Водный слой концентрировали в вакууме с получением указанного в заголовке соединения. Метиловый эфир (3S,2R)-3-амино-2-гидрокси-4-фенилмасляной кислоты синтезировали согласно способу A. Fassler et al. (Tetrahedron Lett., 1998, 39, 4925) в три стадии из имеющегося в продаже Метиловый эфир (3S,2S)-3-амино-2-гидрокси-4-фенилмасляной кислоты получали как побочный продукт в подготовительном примере 21. Раствор бензил-2,5-дигидро-1H-пиррол-1-карбоксилата (10,0 г, 49,3 ммоль) в THF (200 мл) обрабатывали раствором тетроксида осмия (2,5% в трет-бутаноле, 5 мл) и N-метилморфолином (6,90 г,59,0 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Добавляли водный раствор тиосульфата натрия (10%, 200 мл) и смесь перемешивали в течение еще 1 ч, а затем концентрировали в вакууме. Полученный в результате водный слой экстрагировали этилацетатом(3200 мл) и объединенные органические слои промывали водным раствором тиосульфата натрия (10%,300 мл) и соляной кислотой (1 н., 300 мл). Органическую фракцию сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. Палладий на угле (144 мг, 10 мас.%) добавляли к раствору бензилового эфира цис-3,4-дигидроксипирролидин-1-карбоновой кислоты (подготовительный пример 22, 403 мг,1,70 ммоль) в этаноле (20 мл) и циклогексене (2 мл) и эту смесь перемешивали и нагревали с обратным холодильником в течение 6 ч. После фильтрации через целит и повторной промывки катализатора метанолом (ОСТОРОЖНО) фильтрат и промывки объединяли и концентрировали в вакууме с получением указанного в заголовке соединения в виде бесцветного масла. К суспензии 2-гидрокси-4-метил-5-нитропиридина (1 г, 6,5 ммоль) в дихлорэтане (10 мл) добавляли раствор оксихлорида фосфора (2,8 г, 9,7 ммоль) в дихлорэтане (10 мл). Реакционную смесь нагревали с обратным холодильником в течение 4 ч, затем охлаждали до комнатной температуры и гасили водой(40 мл). Слои разделяли и водный слой экстрагировали в дихлорметан (230 мл). Объединенные органические фазы сушили (MgSO4), концентрировали в вакууме и хроматографировали на силикагеле, элюируя дихлорметаном, с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества. К раствору этилата калия (2,105 г, 24,3 ммоль) в диэтиловом эфире (70 мл) и этаноле (10 мл) в атмосфере аргона добавляли диэтилоксалат (3,3 мл, 24,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 15 мин. К реакционной смеси добавляли раствор 2-бром-4-метил-3-нитропиридина (подготовительный пример 24, 4,8 г, 22,1 ммоль) в диэтиловом эфире(20 мл) с немедленным образованием черного осадка. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 6 ч, затем охлаждали до 0C и фильтровали с получением черного твердого вещества. Это твердое вещество растворяли в воде (250 мл) и подкисляли до рН 4 уксусной кислотой, в результате чего образовался красный осадок. Твердое вещество собирали и сушили с получением указанного в заголовке соединения в виде красного твердого вещества. Способ А. К раствору этилового эфира 3-(2-бром-5-нитропиридин-4-ил)-2-оксопропионовой кислоты (подготовительный пример 25, 3,38 г, 10,7 ммоль) в THF (50 мл) и этаноле (100 мл) добавляли насыщенный раствор хлорида аммония (50 мл) и порошок железа (3,57 г, 64,0 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 2 ч. Реакционную смесь фильтровали через целит и промывали несколько раз этилацетатом. Растворитель удаляли в вакууме и остаток распределяли между насыщенным раствором гидрокарбоната натрия (100 мл) и этилацетатом (3150 мл). Объединенные органические фракции сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневого твердого вещества.m/z (ES+)=269 [M+H]+. Способ Б. К раствору 2-бром-4-метил-5-нитропиридина (подготовительный пример 24, 5,7 г, 26,3 ммоль) в диэтилоксалате (17,9 мл) в атмосфере аргона добавляли 1,8-диазабицикло[5.4.0]ундек-7-ен (4,5 мл,30,2 ммоль) с образованием темно-красного осадка. Реакционную смесь перемешивали при комнатной- 22009215 температуре в течение 4,5 ч и концентрировали в вакууме. К остатку добавляли уксусную кислоту(140 мл) в атмосфере аргона и нагревали до 60C. Добавляли железо (2,94 г, 52,6 ммоль) небольшими порциями за промежуток времени 1 ч. Реакционную смесь нагревали при 80C в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в воду (300 мл) с получением бежевого осадка. Этот осадок отделяли и промывали водой. Полученное твердое вещество растворяли в этилацетате (700 мл) и фильтровали. Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения. Раствор гидроксида натрия (1,1 мл, 2 M, 2,23 ммоль) добавляли к раствору этилового эфира 5-бром-1 Н-пирроло[2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 26, 500 мг,1,86 ммоль) в этаноле (20 мл) и эту смесь нагревали с обратным холодильником в течение 1,5 ч, а затем концентрировали в вакууме. Остаток растворяли в воде (15 мл) и подкисляли уксусной кислотой, в результате чего образовался коричневый осадок. Твердое вещество собирали фильтрацией и сушили с получением указанного в заголовке соединения в виде коричневого твердого вещества. Указанное в заголовке соединение получали в соответствии со способом Romero and Mitchell Смесь 2-хлор-3-нитропиридина (1,00 г, 6,30 ммоль), карбоната калия (2,62 г, 18,90 ммоль), тетракис(трифенилфосфин)палладия (0,73 г, 0,63 ммоль) и триметилбороксина (0,88 мл, 6,30 ммоль) в 1,4-диоксане (2 мл) и воде (8 мл) нагревали до 110C (температура масляной бани) в течение 6 ч, а затем перемешивали в течение 16 ч при комнатной температуре. Затем смесь фильтровали через слой целита,промывая THF. Фильтрат адсорбировали на силикагеле и очищали колоночной флэш-хроматографией,элюируя смесью этилацетат/гексаны (3:7), с получением указанного в заголовке соединения в виде желтого твердого вещества. К раствору этилата калия (2,44 г, 27,7 ммоль) в диэтиловом эфире (90 мл) и этаноле (8 мл) добавляли диэтилоксалат (3,79 мл, 27,7 ммоль) с получением желтой суспензии. Реакционную смесь перемешивали в течение 15 мин, после чего добавляли 2-метил-3-нитропиридин (подготовительный пример 29,3,40 г, 24,6 ммоль) одной порцией. Полученную в результате красную суспензию перемешивали при комнатной температуре в атмосфере аргона в течение 20 ч. Смесь фильтровали, тщательно промывали диэтиловым эфиром и сушили. Красное твердое вещество растворяли в воде (250 мл) и смесь доводили до рН 4 добавлением ледяной уксусной кислоты. Полученный в результате осадок собирали фильтрацией, растворяли в дихлорметане, промывали рассолом, сушили (MgSO4), а затем фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде оранжевого твердого вещества. К суспензии этилового эфира 3-(3-нитропиридин-2-ил)-2-оксопропионовой кислоты (подготови- 23009215 тельный пример 30, 1,00 г, 4,20 ммоль) в этаноле (30 мл, абсолютный) добавляли палладий (10% на активированном угле, 447 мг, 0,42 ммоль) и реакционную смесь помещали в атмосферу водорода при давлении 20-30 фунт/кв.дюйм (137,89-206,84 кПа) в течение 12 ч при энергичном перемешивании. Реакционную смесь фильтровали через целит, промывая этилацетатом и фильтрат концентрировали в вакууме приблизительно до 20 мл. Добавляли воду (150 мл) и смесь охлаждали до температуры 0-5C. Образовавшийся осадок собирали фильтрацией и сушили с получением указанного в заголовке соединения в виде бежевого твердого вещества. Суспензию этилового эфира 1H-пирроло[3,2-b]пиридин-2-карбоновой кислоты (подготовительный пример 31, 0,34 г, 1,77 ммоль) в водном растворе гидроксида натрия (2 M, 10 мл) нагревали с обратным холодильником в течение 3 ч, полученный в результате раствор оставляли охлаждаться до комнатной температуры. Доводили рН до 4 добавлением ледяной уксусной кислоты. Избыток уксусной кислоты удаляли в вакууме и полученную в результате суспензию охлаждали до 0C, а затем оставляли стоять при комнатной температуре на 16 ч. Полученный в результате бежевый осадок собирали фильтрацией и сушили с получением указанного в заголовке соединения в виде бежевого твердого вещества. К перемешанной суспензии 2-хлор-6-метокси-3-нитропиридина (2,44 г, 12,9 ммоль) в 10% об./об. водном диоксане (25 мл) добавляли тетракис(трифенилфосфин)палладий (1,50 г, 1,3 ммоль), эту смесь перемешивали в течение 15 мин, после чего добавляли триметилбороксин (1,81 мл, 12,9 ммоль) и карбонат калия (5,36 г, 38,8 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 6 ч,затем оставляли охлаждаться до комнатной температуры в течение 16 ч. Добавляли этилацетат (100 мл) и смесь энергично перемешивали в течение 1 ч. Смесь фильтровали через целит, промывая этилацетатом. Водную фазу отделяли и экстрагировали этилацетатом (330 мл) и объединенные органические фазы промывали рассолом (50 мл), сушили (MgSO4), фильтровали и адсорбировали на силикагеле. В результате очистки колоночной флэш-хроматографией (SiO2, этилацетат/изогексан, 1:20) получали указанное в заголовке соединение в виде бледно-желтого твердого вещества. К перемешанной суспензии этилата калия (0,55 г, 6,55 ммоль) в диэтиловом эфире (20 мл, безводный) и этаноле (4 мл) добавляли диэтилоксалат (894 мкл, 6,55 ммоль), реакционную смесь перемешивали в течение 30 мин, после чего добавляли 6-метокси-2-метил-3-нитропиридин (подготовительный пример 33, 1,0 г, 5,95 ммоль) в диэтиловом эфире (8 мл). Полученную в результате красную суспензию перемешивали при комнатной температуре в атмосфере аргона в течение 20 ч. Смесь фильтровали, твердое вещество тщательно промывали диэтиловым эфиром, затем сушили. Затем красное твердое вещество растворяли в горячей воде и раствор охлаждали до 0C. Осадок фильтровали, промывали холодной водой и сушили с получением указанного в заголовке соединения в виде бежевого твердого вещества. К суспензии этилового эфира 3-(6-метокси-3-нитропиридин-2-ил)-2-оксопропионовой кислоты(подготовительный пример 34, 276 мг, 1,03 ммоль) в THF (12 мл) и этаноле (5 мл) добавляли насыщен- 24009215 ный водный раствор хлорида аммония (5 мл) и порошок железа (346 мг, 6,18 ммоль) одной порцией. Реакционную смесь нагревали с обратным холодильником в течение 1 ч, затем горячим фильтровали через слой целита, промывая горячим этилацетатом. Фильтрат охлаждали и промывали рассолом (20 мл), сушили (MgSO4), фильтровали и адсорбировали на силикагеле в вакууме. В результате очистки колоночной флэш-хроматографией (SiO2, этилацетат/гексаны, 1:9) получали указанное в заголовке соединение в виде бежевого твердого вещества. К раствору этилового эфира 5-метокси-1 Н-пирроло[3,2-b]пиридин-2-карбоновой кислоты (подготовительный пример 35, 128 мг, 0,58 ммоль) в этаноле (10 мл, абсолютный) добавляли водный гидроксид натрия (0,35 мл, 2 M), смесь нагревали до 70C в течение 3 ч, затем охлаждали до комнатной температуры. Раствор доводили до рН 4 добавлением ледяной уксусной кислоты и растворители удаляли при пониженном давлении. К полученному в результате маслу добавляли этилацетат (20 мл) и смесь обрабатывали ультразвуком до образования мелкодисперсной суспензии. Маточную жидкость декантировали и оставшееся твердое вещество промывали этилацетатом и сушили в вакууме с получением указанного в заголовке соединения в виде бледно-оранжевого порошка. К раствору 4-метоксифенацилбромида (5,78 г, 25,23 ммоль) в DMF (20 мл) добавляли фталимид калия (5,00 г, 25,99 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь распределяли между дихлорметаном (200 мл) и водой (100 мл). Слои разделяли и водный слой экстрагировали дихлорметаном (350 мл). Объединенные органические фазы промывали гидроксидом натрия (2 M, 50 мл), водой (50 мл) и рассолом (50 мл) и сушили (MgSO4). В результате фильтрации с последующим концентрированием в вакууме получали не совсем белое твердое вещество. В результате растирания с диэтиловым эфиром с последующим сбором фильтрацией получали указанное в заголовке соединение в виде белого твердого вещества.H (CDCl3): 3,86 (3H, s), 5,15 (2 Н, s), 7,09 (2H, d), 7,81-8,01 (4H, m), 8,05 (2H, d). Приведенные ниже соединения синтезировали в соответствии с подготовительным примером 37 из фталимида калия и соответствующего -бромкетона. 2-[2-(4-Метоксифенил)-2-оксоэтил]изоиндол-1,3-дион (подготовительный пример 37, 6,35 г,21,5 ммоль) суспендировали в толуоле (50 мл) и добавляли этиленгликоль. Добавляли паратолуолсульфоновую кислоту (300 мг, 1,58 ммоль) и полученную в результате смесь нагревали с обратным холодильником в течение 40 ч, удаляя воду ловушкой Дина-Старка. Реакционную смесь оставляли- 25009215 охлаждаться до комнатной температуры, затем распределяли между этилацетатом (200 мл) и насыщенным водным раствором бикарбоната натрия (100 мл). Органический слой промывали рассолом (50 мл),сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде не совсем белого твердого вещества.H (d6 ДМСО): 3,66 (2 Н, t), 3,72 (3 Н, s), 3,87 (4 Н, m), 6,88 (2 Н, d), 7,32 (2 Н, d), 7,83 (4 Н, m). Приведенные ниже соединения синтезировали в соответствии с подготовительным примером 41 из этиленгликоля и соответствующего кетона. Объединяли 2-[2-(4-метоксифенил)-[1,3]диоксолан-2-илметил]изоиндол-1,3-дион (подготовительный пример 41, 2,0 г, 5,90 ммоль) и гидрат гидразина (5 мл). Перемешанную реакционную смесь нагревали с обратным холодильником в течение 48 ч, затем оставляли охлаждаться до комнатной температуры. Добавляли водный раствор гидроксида натрия (2 M, 10-15 мл) и воду (20 мл), смесь перемешивали до образования раствора. Добавляли диэтиловый эфир (20 мл) и двухфазную смесь энергично перемешивали в течение 16 ч. Слои разделяли и водный слой экстрагировали диэтиловым эфиром (320 мл), затем объединенные органические экстракты промывали рассолом (20 мл). Эфирный раствор пропускали через фильтровальную бумагу, затем упаривали до сухости в вакууме с получением указанного в заголовке соединения в виде желтого масла, которое затвердевало при стоянии.H (CDCl3): 1,42 (2 Н, br s), 3,06 (2 Н, s), 3,97 (3 Н, s), 4,00 (2 Н, t), 4,21 (2 Н, t), 7,04 (2 Н, d), 7,53 (2 Н, d). Приведенные ниже соединения синтезировали в соответствии с подготовительным примером 45 из гидрата гидразина и соответствующего фталимида.HOBt (0,076 г, 0,56 ммоль). Полученный в результате раствор перемешивали в течение 2 мин, затем добавляли EDCl (0,117 г, 0,61 ммоль), перемешивание продолжали в течение 18 ч при комнатной температуре. Реакционную смесь распределяли между дихлорметаном (30 мл) и водой (20 мл) и слои разделяли. Водную фазу экстрагировали дихлорметаном (320 мл), затем объединенные органические фазы промывали рассолом (20 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. В результате перекристаллизации из смеси метанол/дихлорметан получали указанное в заголовке соединение в виде оранжевого твердого вещества.(2H, d), 7,57 (1 Н, s), 8,68 (1 Н, s), 9,94 (1 Н, br s). Приведенные ниже соединения синтезировали в соответствии с подготовительным примером 49 из 5-хлор-1 Н-пирроло[2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 18) и соответствующего амина.(S)-2-амино-N,N-диметил-3-пиридин-3 К раствору (S)-2-трет-бутоксикарбониламино-3-пиридин-3-илпропионовой кислоты (500 мг,1,88 ммоль) в DMF (10 мл) добавляли гидрохлорид диметиламина (153 мг, 1,88 ммоль), DIPEA (1,2 мл,6,57 ммоль) и TBTU (602 мг, 1,88 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме и остаток растворяли в метаноле (20 мл). К этому раствору добавляли 4 M соляную кислоту в диоксане (20 мл) и реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Растворитель удаляли в вакууме и остаток распределяли между водой(100 мл) и этилацетатом (2100 мл). Водный слой упаривали до сухости и остаток перекристаллизовали из смеси этанол/этоксиэтанол (9:1) с получением указанного в заголовке соединения в виде белого твердого вещества. К раствору пирролидина (157 мкл, 1,88 ммоль) в DMF (10 мл) добавляли DIPEA (817 мкл,ммоль), (S)-2-трет-бутоксикарбониламино-3-пиридин-3-илпропионовую кислоту (500 мг,- 27009215 1,88 ммоль) и TBTU (663 мг, 2,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Растворитель удаляли в вакууме и остаток растворяли в метаноле (15 мл). К этому раствору добавляли 4 M соляную кислоту в диоксане (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме и остаток распределяли между водой (100 мл) и этилацетатом (2100 мл). Водный слой упаривали до сухости с получением указанного в заголовке соединения в виде зеленого масла. К перемешанному раствору гидрохлорида диметиламина (0,153 г, 1,87 ммоль) в DMF (8 мл) добавляли DIPEA (2 мл, 6,55 ммоль), (S)-2-трет-бутоксикарбониламино-3-пиридин-2-илпропионовую кислоту(0,50 г, 1,87 ммоль, Acros) и TBTU (0,60 г, 1,87 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме и остаток растворяли в метаноле(15 мл). К этому раствору добавляли 4 M соляную кислоту в диоксане (20 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли в вакууме и остаток распределяли между водой (100 мл) и этилацетатом (2100 мл). Водный слой упаривали до сухости с получением твердого вещества, которое перекристаллизовали из этанола с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества. Сульфат серебра (3,40 г, 10,9 ммоль) и 2-амино-5-хлорпиридин (1 г, 7,8 ммоль) добавляли к раствору йода (2,76 г, 10,9 ммоль) в этаноле (50 мл) и реакционную смесь перемешивали при комнатной температуре в течение 72 ч. Смесь фильтровали, промывали метанолом и фильтрат концентрировали в вакууме. Остаток распределяли между насыщенным раствором Na2S2O3(50 мл) и DCM (250 мл). Объединенные органические фазы сушили (MgSO4), концентрировали в вакууме и очищали хроматографией на силикагеле, элюируя DCM, с получением указанного в заголовке соединения в виде бежевого твердого вещества.DABCO (700 мг, 6,24 ммоль) в безводном DMF (20 мл). Реакционную смесь дегазировали аргоном в течение 20 мин, затем нагревали до 110C в течение 16 ч. Растворитель удаляли в вакууме и остаток суспендировали в воде (10 мл) и уксусной кислоте (5 мл), а затем фильтровали. Твердое вещество растворяли в EtOAc (50 мл), экстрагировали в 2 н. раствор NaOH (50 мл) и органический слой отбрасывали. Водный раствор подкисляли концентрированной HCl и экстрагировали в EtOAc (240 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения в виде бежевого твердого вещества.PdCl3(PPh3)2 (0,026 г, 0,037 ммоль) и Cu(I)I (0,007 г, 0,037 ммоль) последовательно добавляли к этиловому эфиру 5-бром-1 Н-пирроло(2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 26,0,100 г, 0,370 ммоль) в атмосфере аргона. Добавляли 1,4-диоксан (7 мл, безводный) и затем диизопропи- 28009215 ламин (0,063 мл, 0,45 ммоль), эту перемешанную смесь продували аргоном в течение 5 мин. Добавляли по каплям триметилсилилацетилен (0,064 мл, 0,45 ммоль) и полученную в результате смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь распределяли между водой (50 мл) и этилацетатом (100 мл) и слои разделяли. Водную фазу экстрагировали этилацетатом (330 мл). Объединенные органические фазы промывали рассолом (50 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в минимальном количестве дихлорметана и наносили на колонку силикагеля. В результате очистки колоночной флэш-хроматографией (SiO2, дихлорметан, затем 25% смесь этилацетат/изогексан) получали бледно-желтое твердое вещество. К перемешанному раствору эфира (подготовительный пример 58, 0,123 г) добавляли фторид тетран-бутиламмония (1,0 M в THF, 5 мас.% H2O, 0,47 мл, 0,47 ммоль), и цвет раствора немедленно становился темно-розовым. Через 5 мин реакционную смесь распределяли между этилацетатом (60 мл) и водой(40 мл). Слои разделяли и водный слой экстрагировали этилацетатом (220 мл). К объединенным органическим фазам добавляли ледяную уксусную кислоту до тех пор, пока цвет не изменился с розового на желтый. Раствор промывали водой (20 мл), рассолом (20 мл), затем сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в метаноле и адсорбировали на силикагеле. В результате очистки колоночной флэш-хроматографией (SiO2, этилацетат:изогексан, 1:1, об./об.) получали указанное в заголовке соединение в виде бледно-желтого порошка. К суспензии эфира (подготовительный пример 59, 0,065 г, 0,30 ммоль) в этаноле (6 мл) добавляли гидроксид натрия (2 M водный, 1,5 мл, 3,0 ммоль) и реакционную смесь перемешивали при 50C в течение 3 ч. Смесь оставляли охлаждаться до комнатной температуры и добавляли ледяную уксусную кислоту, что вызвало выпадение в осадок белого твердого вещества. Это твердое вещество собирали фильтрацией, промывали водой (20 мл), а затем диэтиловым эфиром (20 мл). Твердое вещество сушили на воздухе с получением указанного в заголовке соединения в виде белого порошка. К раствору этилового эфира 5-бром-1 Н-пирроло[2,3-с]пиридин-2-карбоновой кислоты (подготовительный пример 26, 0,160 г, 0,590 ммоль) в DMF (безводный, 5 мл) добавляли цианид цинка (II) (0,041 г,0,35 ммоль), затем тетракис(трифенилфосфин)палладий(0). Реакционную смесь дегазировали барботированием через нее аргона в течение 10 мин. Реакционную смесь нагревали до температуры образования флегмы в течение 4,5 ч, затем оставляли охлаждаться до комнатной температуры. Добавляли воду(30 мл) и смесь экстрагировали этилацетатом (250 мл). Объединенные органические фазы промывали рассолом (30 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток растворяли в этилацетате, затем адсорбировали на силикагеле. В результате очистки колоночной флэшхроматографией (SiO2, этилацетат:изогексан, 1:3, об./об.) получали указанное в заголовке соединение в виде белого твердого вещества. К перемешанной суспензии эфира (подготовительный пример 61, 0,266 г, 1,24 ммоль) в этаноле(6 мл) и воде (0,6 мл) добавляли гидроксид натрия (0,108 г, 2,72 ммоль). Реакционную смесь нагревали до 50C в течение 24 ч, затем оставляли охлаждаться до комнатной температуры. Реакционную смесь разбавляли диэтиловым эфиром (30 мл), собирали фильтрацией и промывали диэтиловым эфиром. Твердое вещество промывали водной уксусной кислотой (250 мл), затем диэтиловым эфиром. Твердое вещество сушили на воздухе с получением указанного в заголовке соединения в виде белого твердого вещества.(110 мл) добавляли тетракис(трифенилфосфин)палладий (6,330 г, 5,46 ммоль) и эту смесь перемешивали в течение 15 мин, после чего добавляли триметилбороксин (7,68 мл, 54,6 ммоль) и карбонат калия(22,64 г, 164,0 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 6 ч, затем оставляли охлаждаться до комнатной температуры в течение 16 ч. Добавляли этилацетат (200 мл) и смесь энергично перемешивали в течение 1 ч. Смесь фильтровали через целит, промывая смесью этилацетат/THF (1:1, об./об.). Добавляли рассол (100 мл) и попытались разделить слои, в результате чего образовывалась густая эмульсия. После удаления всех летучих веществ добавляли этилацетат (300 мл) и смесь фильтровали с получением двухфазной смеси. Слои разделяли и водную фазу экстрагировали этилацетатом (3100 мл). Объединенные органические фазы промывали рассолом (100 мл), сушили(MgSO4), фильтровали и концентрировали в вакууме. Полученное в результате масло растворяли в дихлорметане, затем очищали колоночной флэш-хроматографией (SiO2, этилацетат/изогексан, 3:7, об./об.) с получением указанного в заголовке соединения в виде оранжевого масла. К раствору этилата калия (0,262 г, 2,96 ммоль) в диэтиловом эфире (10 мл) и этаноле (1 мл) добавляли диэтилоксалат (0,404 мл, 2,96 ммоль) одной порцией и полученный в результате раствор перемешивали в течение 10 мин при комнатной температуре. Добавляли 2,4-диметил-5-нитропиридин (подготовительный пример 63, 0,400 г, 2,63 ммоль) в виде суспензии в смеси диэтиловый эфир (1 мл)/этанол(1,5 мл) и перемешивание продолжали в течение 16 ч при комнатной температуре. Смесь фильтровали,промывая холодным диэтиловым эфиром. Собранный осадок растворяли в воде и добавлением ледяной уксусной кислоты рН доводили до 4. Полученный в результате осадок собирали фильтрацией и сушили на воздухе. Твердое вещество распределяли между этилацетатом (150 мл) и водой (50 мл) и слои разделяли. Водный слой экстрагировали этилацетатом (320 мл) и объединенные органические фазы промывали рассолом (50 мл), сушили (MgSO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде красного твердого вещества, которое не требовало дальнейшей очистки.(15 мл) добавляли насыщенный водный раствор хлорида аммония (15 мл) и суспензию энергично перемешивали при комнатной температуре. Добавляли порциями порошок железа (1,38 г, 24,64 ммоль) и смесь нагревали с обратным холодильником в течение 2 ч, затем оставляли охлаждаться, после чего фильтровали через пробку целита и промывали теплым метанолом. Смесь концентрировали при пониженном давлении, остаток распределяли между этилацетатом (250 мл) и водой (250 мл) и слои разделяли. Водную фазу экстрагировали этилацетатом (350 мл), затем объединенные органические фазы промывали рассолом (100 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток адсорбировали на силикагеле и очищали флэш-хроматографией (SiO2, этилацетат) с получением указанного в заголовке соединения в виде светло-оранжевого твердого вещества.
МПК / Метки
МПК: C07D 471/00, A61P 9/10, C07D 519/00, A61K 31/437
Метки: ингибиторы, пирролопиридин-2-карбоновых, собой, представляющие, гликогенфосфорилазы, амиды, кислот
Код ссылки
<a href="https://eas.patents.su/30-9215-ingibitory-glikogenfosforilazy-predstavlyayushhie-sobojj-amidy-pirrolopiridin-2-karbonovyh-kislot.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы гликогенфосфорилазы, представляющие собой амиды пирролопиридин-2-карбоновых кислот</a>
Предыдущий патент: Фармацевтическая композиция, набор и способ лечения вич-инфекций
Следующий патент: Способы идентификации средств, модулирующих активность аспартилпротеазы asp2 человека
Случайный патент: Моечный узел для мойки по меньшей мере одного участка головки доильного стакана


































