Способ получения 7-альфа-карбоксил-9,11-эпоксистероидов и промежуточных продуктов, используемых для их получения, и общий способ эпоксидирования по олефиновым двойным связям
Номер патента: 9176
Опубликовано: 28.12.2007
Авторы: Андерсон Деннис К., Лосан Джон П., Ванцанелла Фортунато, Син Юань-Лун Л, Кунда Сэстри А., Ван Пин Т., Поццо Марк Дж., Муссиарьелло Дженнаро, Летендре Лео Дж., Баес Хулио А., Виецзорек Джозеф, Лю Синь, Эрб Дернхард, Нг Джон С.
Формула / Реферат
1. Способ получения соединения формулы
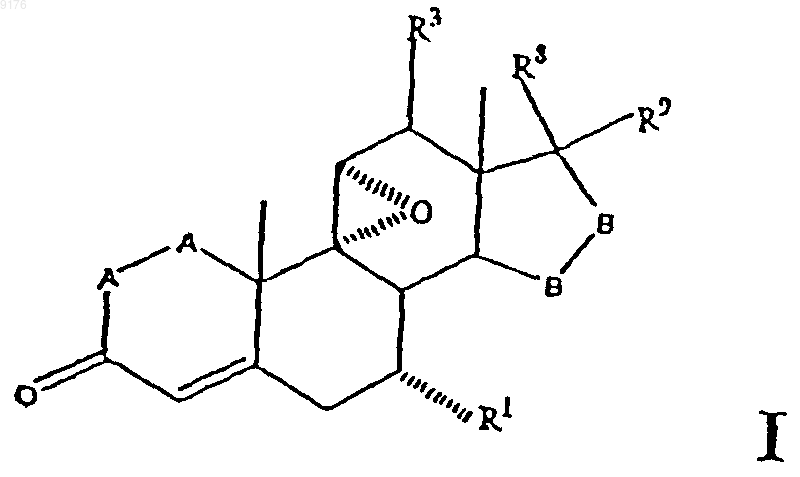
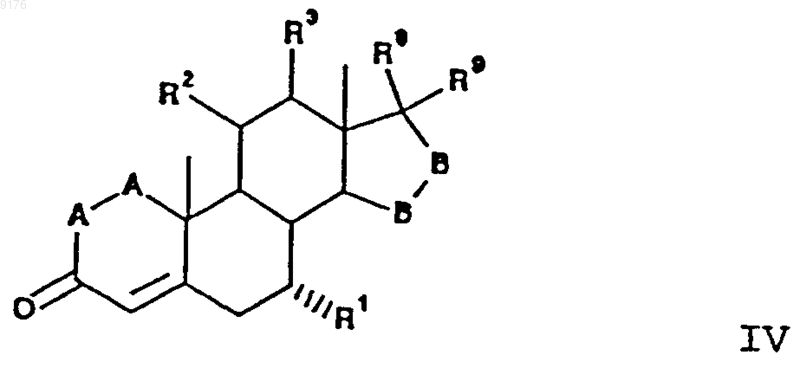
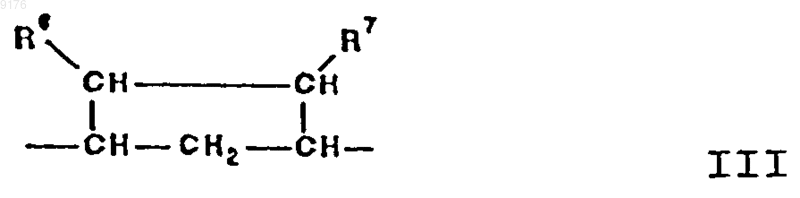
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигрушгу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
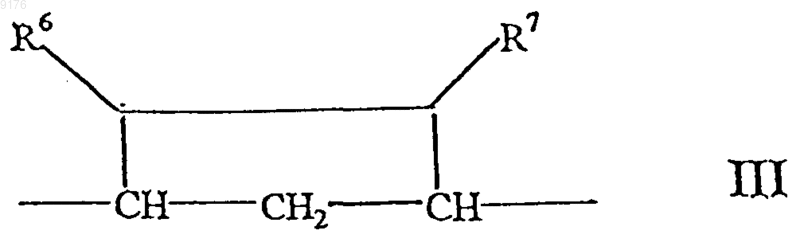
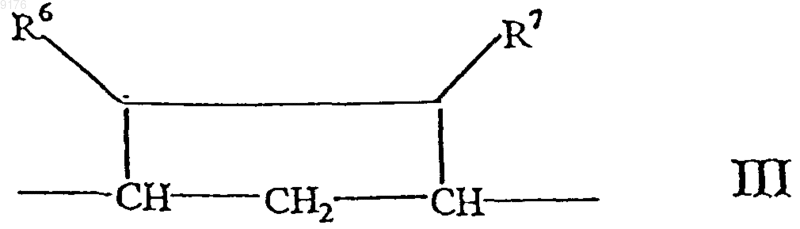
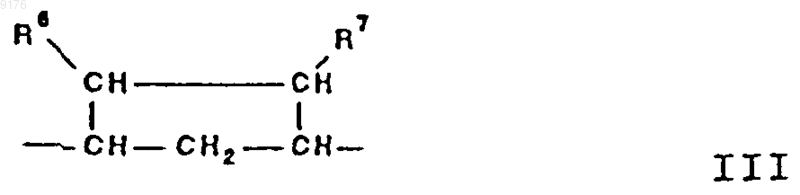
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
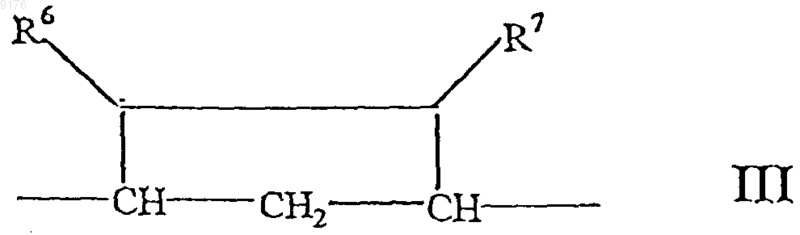
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, гидрокси, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 вместе образуют карбоциклическую или гетероциклическую структуру, или
R8 и R9 вместе с R6 или R7 образуют карбоциклическое или гетероциклическое кольцо, конденсированное с пятичленным кольцом D,
заключающийся во взаимодействии соединения формулы
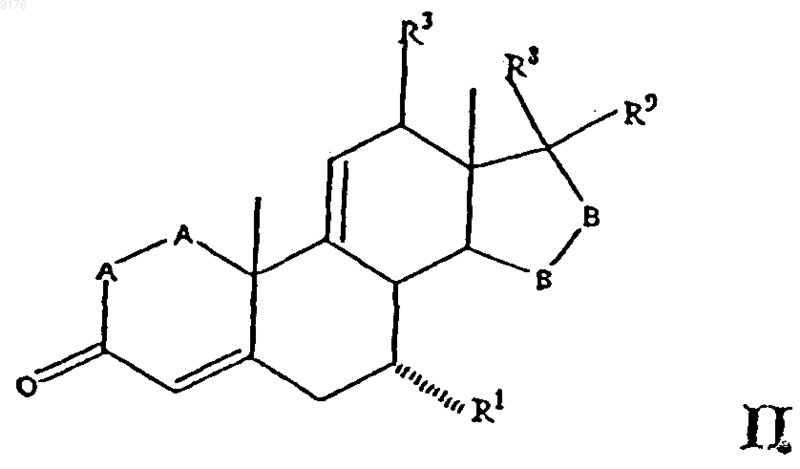
в которой -A-A-, R1, R3, -B-B-, R8 и R9 имеют значения, указанные выше, с пероксидным соединением в присутствии активатора пероксида, причем указанный пероксидный активатор соответствует формуле
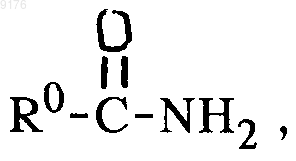
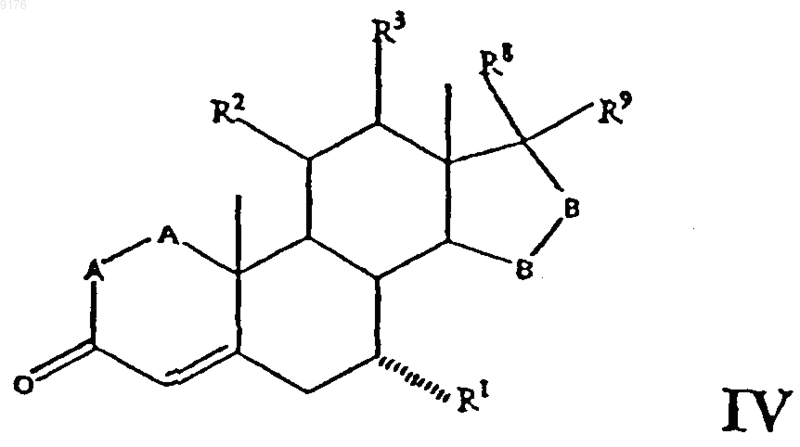
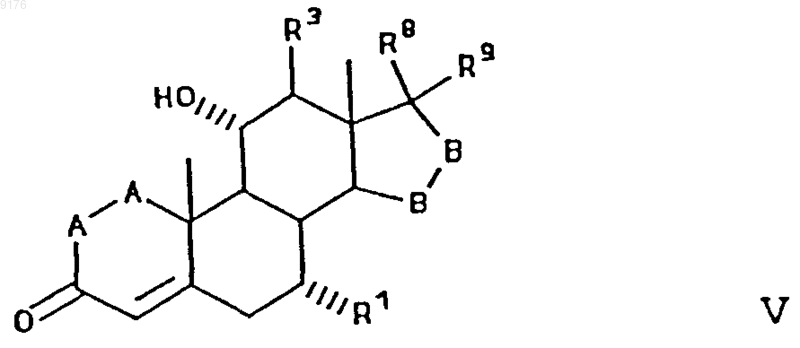
где R0 обозначает заместитель со способностью оттягивать электроны по силе не ниже, чем у монохлорметила, а само соединение формулы II получают удалением уходящей 11a-группы, такой как мезилокси, из соединения формулы
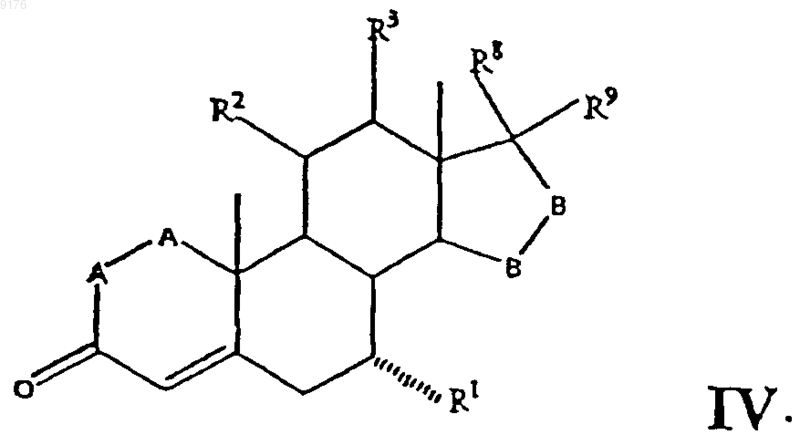
где -A-A-, R1, R3, -B-B-, R8 и R9 имеют указанные выше значения, a R2 обозначает уходящую группу, такую как мезилокси, отщепление которой обеспечивает образование двойной связи между 9- и 11-м углеродными атомами,
указанное соединение формулы IV получают взаимодействием C1-C7алкилсульфонилирующего или ацилирующего реагента или генерирующего галогенид агента, такого как сульфурилхлорид, с соединением формулы
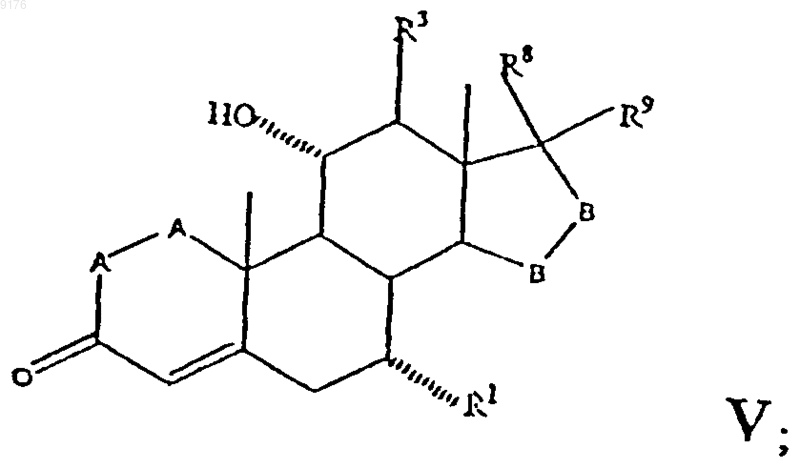
где -A-A-, R1, R3, -B-B-, R8 и R9 имеют указанные выше значения,
которое в свою очередь получают из соединения VI взаимодействием с алкоксидом щелочного металла формулы R10OM, где M обозначает щелочной металл, a R10OM - соответствует алкоксизаместителю при R1, и это соединение соответствует структурной формуле
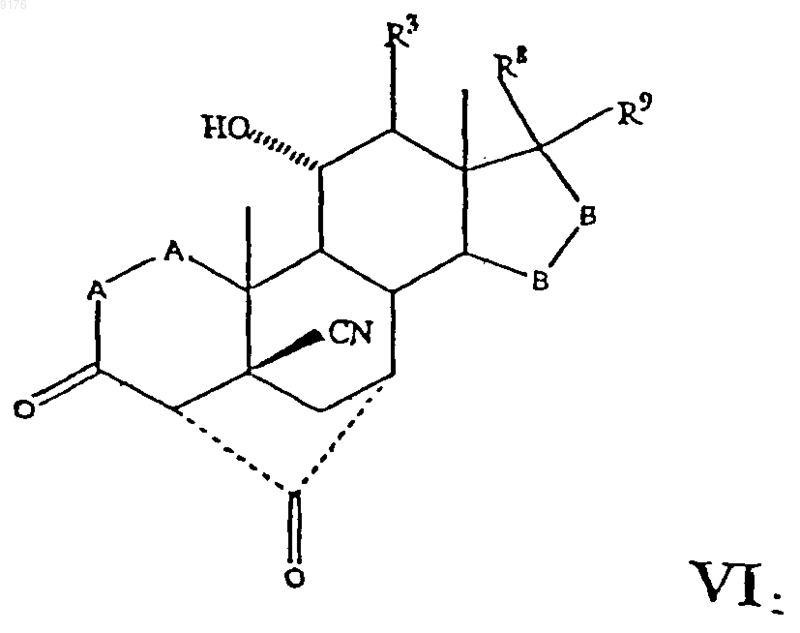
где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
получение которого осуществляют гидролизом соединения формулы
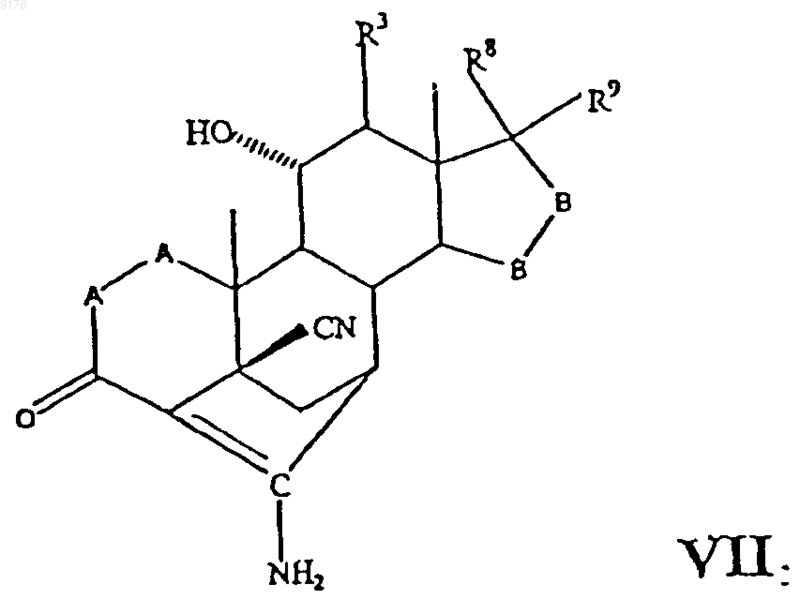
где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
которое в свою очередь получают реакцией соединения формулы

где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
с источником цианидных ионов в присутствии соли щелочного металла, а само соединение формулы VIII получают окислением субстрата формулы
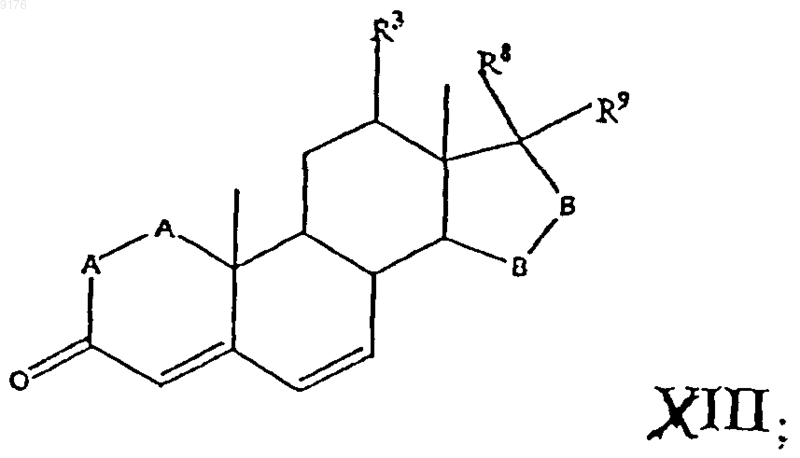
где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
ферментацией в присутствии микроорганизма, например, выбранного из рода Aspergillus ochraceus NRRL 405 (ATCC 18500), Aspergillus niger ATCC 11394, Aspergillus nidulans ATCC 11267, Rhizopus oryzae ATCC 11145, Rhizopus stolonifer ATCC 6227b, Trichothecium roseum ATCC 12519 и ATCC 8685, обеспечивающего эффективное введение в субстрат 11-гидроксигруппы с a-ориентацией; при этом имеется в виду, что там, где специально не указано, алкильная часть заместителя может содержать число углеродных атомов от 1 до 6.
2. Способ получения соединений формулы II по п.1
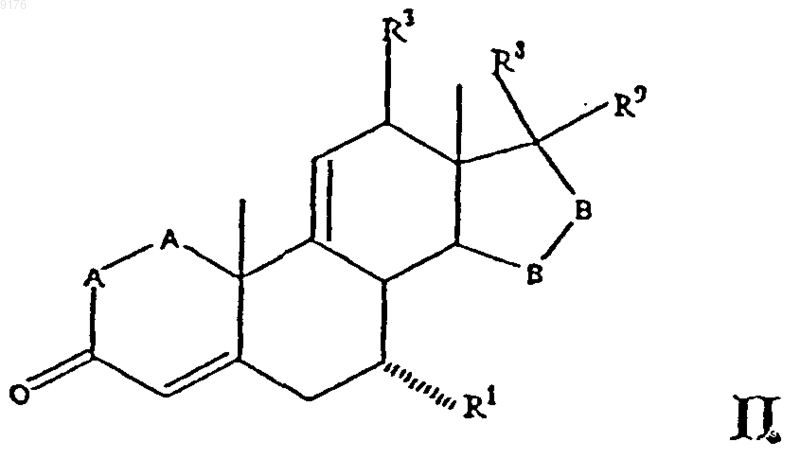
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4, R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
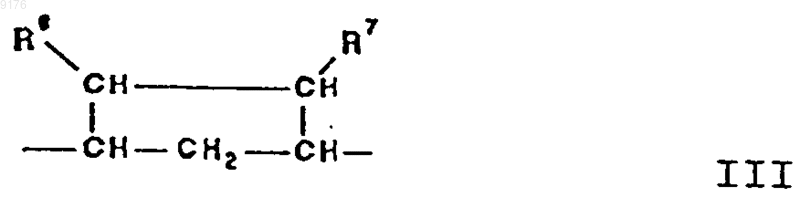
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, гидрокси, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 вместе образуют карбоциклическую или гетероциклическую структуру, или
R8 и R9 вместе с R6 или R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пятичленным кольцом D,
заключающийся в удалении 11a-уходящей группы, такой как мезилокси, из соединения формулы
в которой -A-A-, R1, R3, -B-B-, R8 и R9 имеют вышеуказанные значения, а R2 обозначает вышеуказанную уходящую группу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
3. Способ по п.2, в котором соединение формулы II соответствует формуле
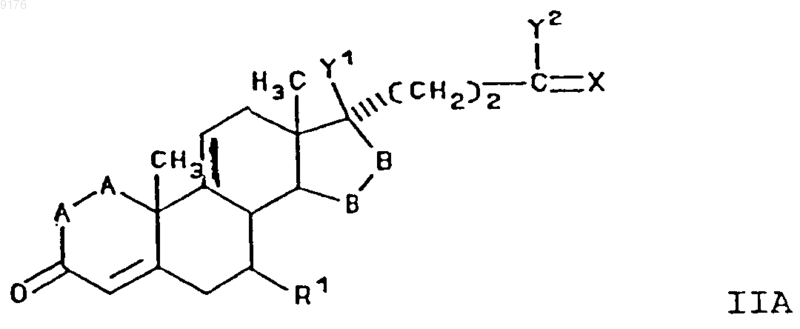
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
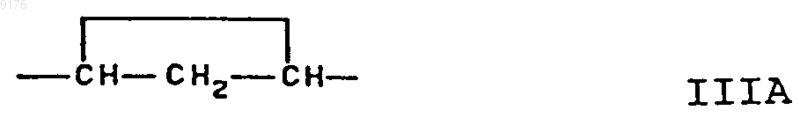
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный радикал,
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу,
а также солей соединений, в которых X обозначает оксогруппу, a Y2 обозначает гидроксил, включающий контактирование раствора, содержащего C1-C6алифатическую кислоту и соль C1-C6алифатической кислоты, с соединением формулы
в которой -A-A-, R1, -B-B-, X, Y1 и Y2 имеют значения, указанные для формулы IIA, a R2 обозначает
C1-C7алкилсульфонилокси- или ацилоксигруппу.
4. Способ по п.2, в котором соединение формулы IV представляет собой g-лактон неполного метилового эфира 17a-гидрокси-11a-(метилсульфонил)окси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты, а соединение формулы II представляет собой g-лактон неполного метилового эфира 17a-гидрокси-3-оксопрегна-4,9(11)диен-7a,21-дикарбоновой кислоты.
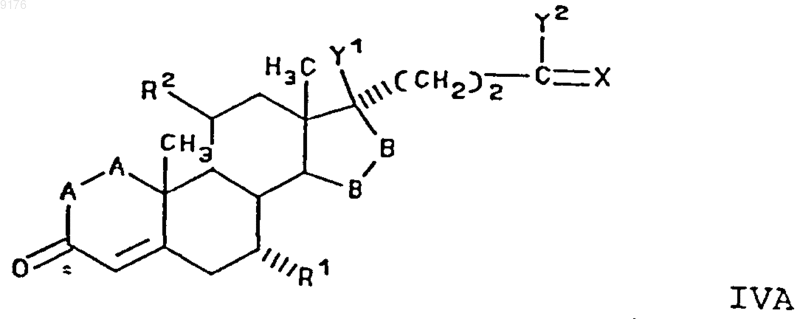
5. Способ получения соединения формулы IV по п.1
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
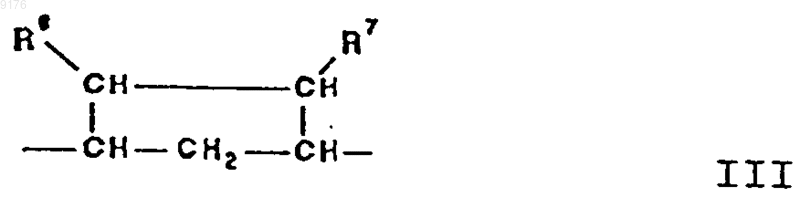
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую кольцевую структуру, сконденсированную с пентациклическим D-кольцом, a
R2 обозначает C1-C7алкилсульфонилоксигруппу, ацилоксигруппу или галогенид, включающий взаимодействие C1-C7алкилсульфонилирующего или ацилирующего реагента или образующего галогенид агента, такого, как тионил-галогенид, сульфурилгалогенид или оксалилгалогенид, с соединением формулы
где -A-A-, R1, R3, -B-B-, R8 и R9 имеют значения, указанные выше.
6. Способ по п.5, в котором соединение формулы IV соответствует формуле

в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный радикал,
R2 обозначает C1-C7алкилсульфонилоксигруппу или ацилоксигруппу,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу,
а также солей соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил, включающий взаимодействие C1-C6алкилсульфонила или ацилгалогенида в присутствии акцептора галогенида водорода с соединением формулы
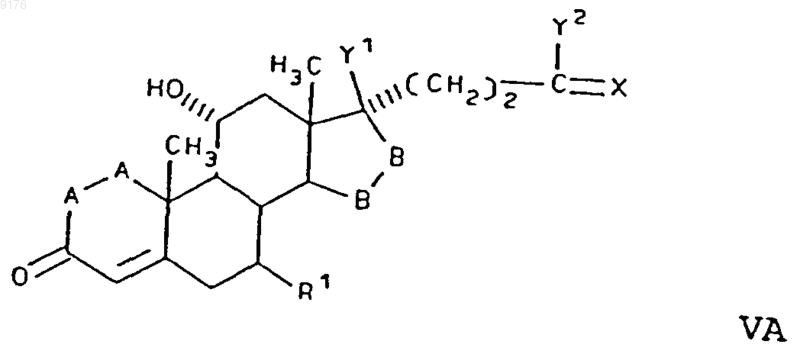
в которой -A-A-, R1, -B-B-, X, Y1 и Y2 имеют значения, указанные для формулы IVA.
7. Способ по п.5, в котором соединение формулы IV представляет собой g-лактон неполного метилового эфира 17a-гидрокси-11a-(метилсульфонил)окси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты, а соединение формулы V представляет собой g-лактон неполного метилового эфира 11a,17a-дигидрокси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты.
8. Способ получения соединения формулы V по п.1
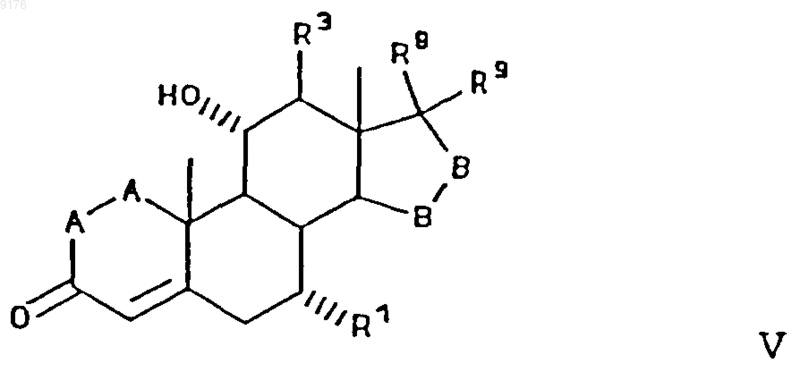
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
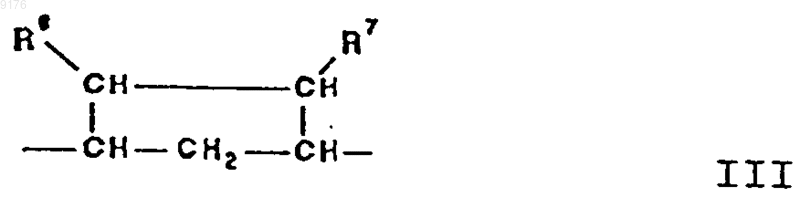
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую кольцевую структуру, сконденсированную с пятичленным D-кольцом,
включающий взаимодействие соединения формулы VI с алкоксидом щелочного металла формулы R10OM, где M обозначает щелочной металл, a R10O соответствует алкоксизаместителю при R1, и это соединение формулы VI соответствует структурной формуле
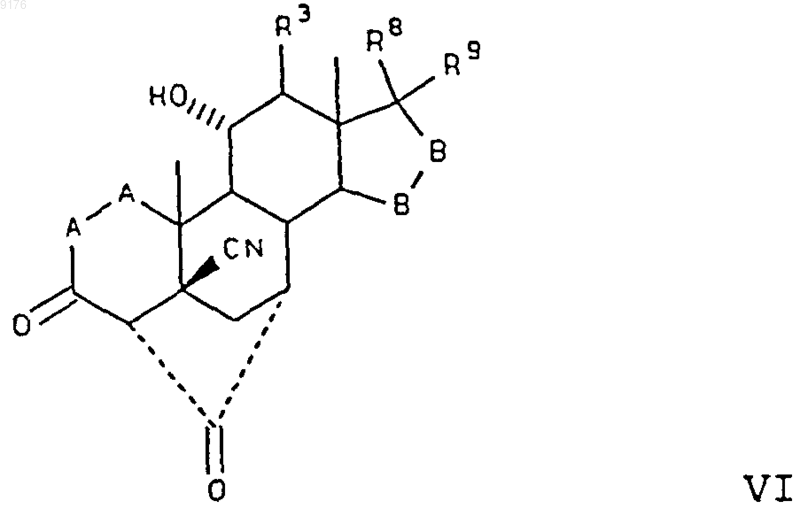
где -A-A-, R3, -B-B-, R8 ш R9 имеют значения, указанные выше.
9. Способ по п.8, в котором соединение формулы V соответствует формуле

в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный радикал,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
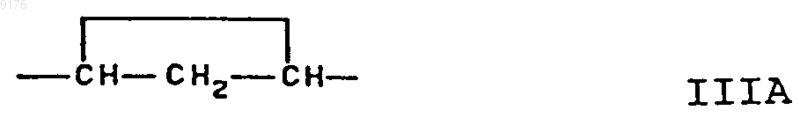
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу,
а также солей соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил, включающий взаимодействие соединения формулы VIA с алкоксидом щелочного металла, соответствующего формуле R10OM, в среде спирта формулы R10OM, где M обозначает щелочной металл, a R10OM соответствует алкоксизаместителю при R1, и это соединение формулы VIA соответствует структурной формуле
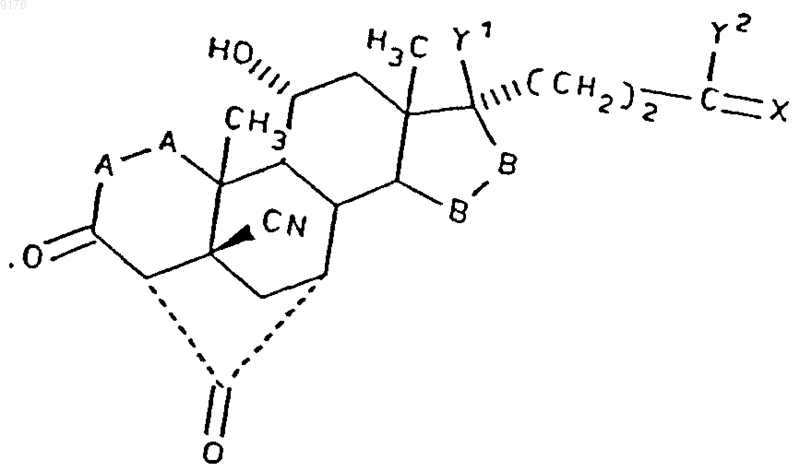
где -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы VA.
10. Способ по п.8, в котором соединение формулы V представляет собой g-лактон неполного метилового эфира 11a,17a-дигидрокси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты, а соединение формулы VI представляет собой 4'S(4'a),7'a-гексадекагидро-11'a-гидрокси-10'b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b[4,7]метано[17Н]циклопента[а]фенантрен}-5'b(2'Н)-карбонитрил.
11. Способ по п.8, в котором цианидный ион образуется как побочный продукт реакции и который далее включает удаление цианидного иона из реакционной зоны во время реакции с целью снизить степень любого взаимодействия цианидного иона с продуктом формулы V.
12. Способ по п.11, в котором цианидный ион удаляют из реакционной среды осаждением с помощью осадителя.
13. Способ по п.12, в котором реакцию проводят в среде растворителя, а осадитель представляет собой соль, включающую катион, который образует цианидное соединение более низкой растворимости в такой среде, чем растворимость в ней осадителя.
14. Способ по п.13, в котором катион выбирают из группы, включающей ионы щелочно-земельных металлов и ионы переходных металлов.
15. Способ получения соединения формулы VI по п.1
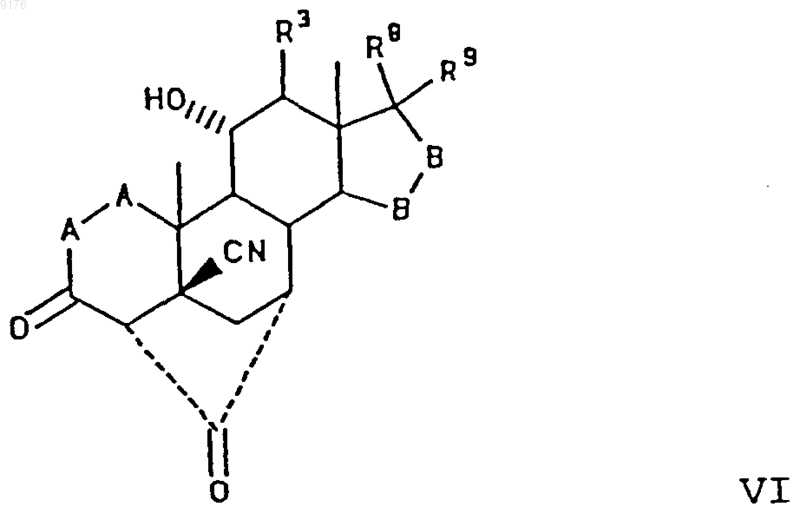
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом,
включающий гидролиз соединения формулы VII
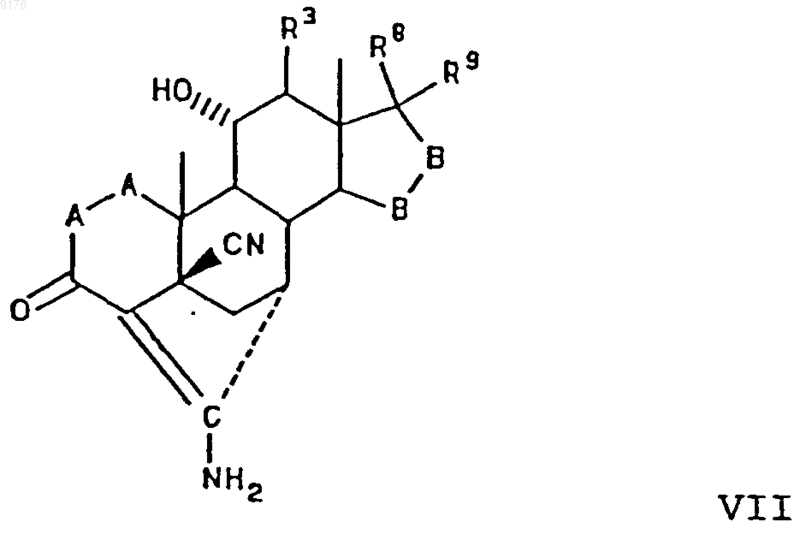
в которой -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше.
16. Способ по п.15, в котором соединение формулы VI соответствует формуле

в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
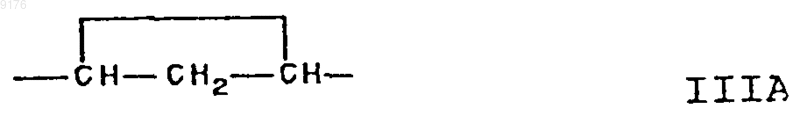
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, (C1-C7)алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу,
а также солей соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил, включающий гидролиз соединения формулы VIIA в присутствии кислоты и в среде органического растворителя и/или воды, причем это соединение формулы VIIA соответствует структурной формуле

в которой -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы VIA.
17. Способ по п.15, в котором соединение формулы VI представляет собой 4'S(4'a),7'a-гексадекагидро-11'a-гидрокси-10'b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'b(2'Н)-карбонитрил, а соединение формулы VII представляет собой 5'R(5'a),7'b,20'-аминогексадекагидро-11'b-гидрокси-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
18. Способ получения соединения формулы VII по п.1
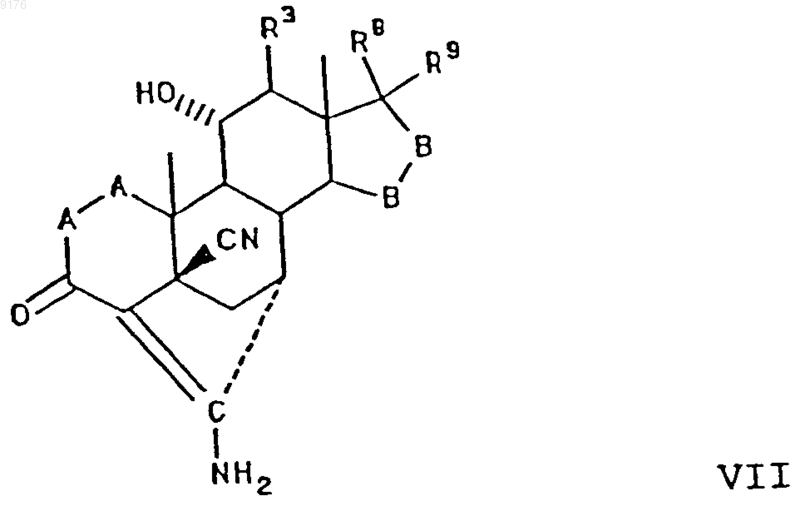
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, C1-C7алкоксиалкил, гидроксикарбонил, C1-C6алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, притом, что, где специально не указано, алкильная часть заместителя может содержать число атомов углерода от 1 до 6,
включающий взаимодействие соединения формулы VIII с источником цианидных ионов в присутствии соли щелочного металла, причем это соединение формулы VIII соответствует структурной формуле
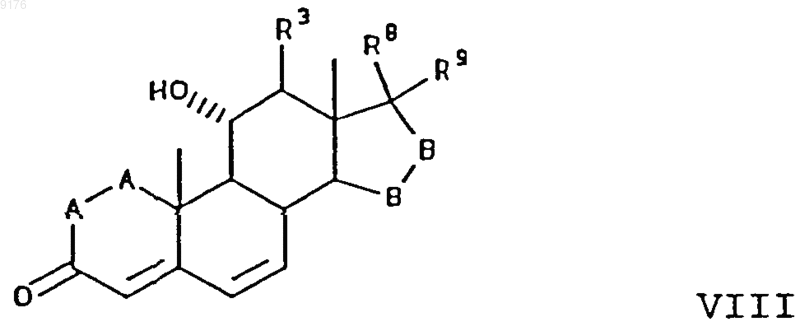
где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше.
19. Способ по п.18, в котором соединение формулы VII соответствует формуле
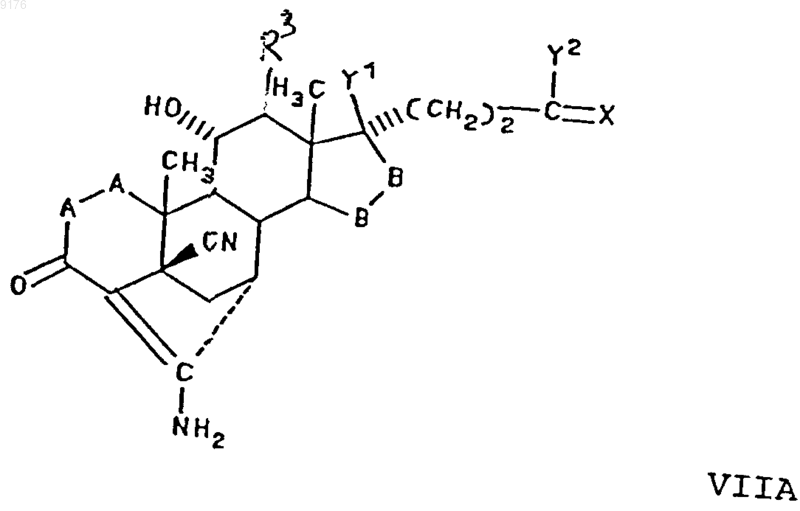
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-, -B-B- обозначает группу -CH2-CH2- либо
a- или b-ориентированную группу
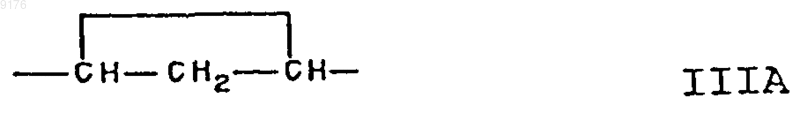
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу,
а также солей соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил, включающий взаимодействие источника цианидных ионов, такого, как кетонциангидрин, в присутствии LiCl и в присутствии основания с 11a-гидроксисоединением формулы
где -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы VIIA.
20. Способ по п.18, в котором соединение формулы VII представляет собой 5'R(5'a),7'b,20'-аминогексадекагидро-11'b-гидрокси-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы VIII представляет собой g-лактон 11a,17a-дигидрокси-3-оксопрегн-4,6-диен-21-карбоновой кислоты.
21. Способ по п.18, в котором источник цианидных ионов представляет собой цианид щелочного металла, а взаимодействие между соединением формулы VIII с цианидным ионом проводят в присутствии кислоты и воды.
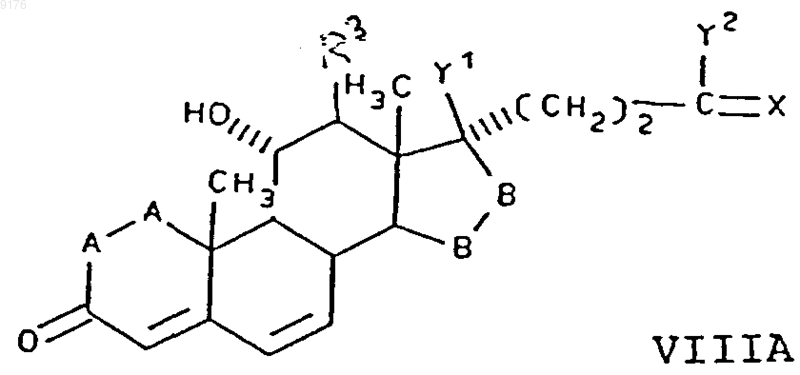
22. Способ получения соединения формулы VIII по п.1
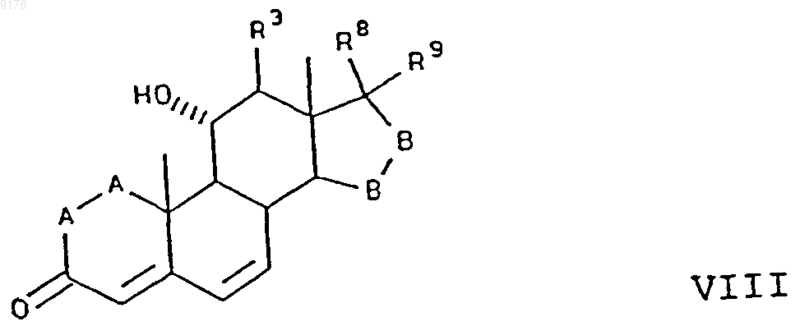
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
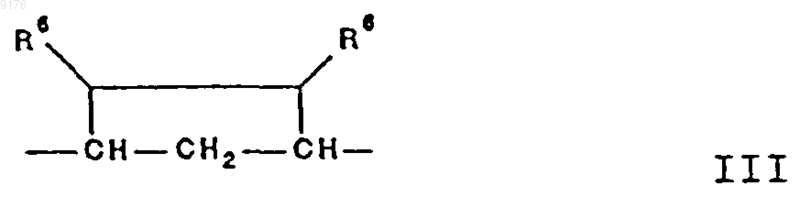
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий окисление субстратного соединения формулы XIII ферментацией в присутствии микроорганизма, например, выбранного из рода Aspergillus ochraceus NRRL 405 (ATCC 18500), Aspergillus niger ATCC 11394, Aspergillus nidulans ATCC 11267, Rhizopus oryzae ATCC 11145, Rhizopus stolonifer ATCC 6227b, Trichothecium roseum ATCC 12519 и ATCC 8685, обеспечивающего эффективное введение в это субстратное соединение 11-гидроксигруппы, с a-ориентацией, причем это субстратное соединение соответствует формуле
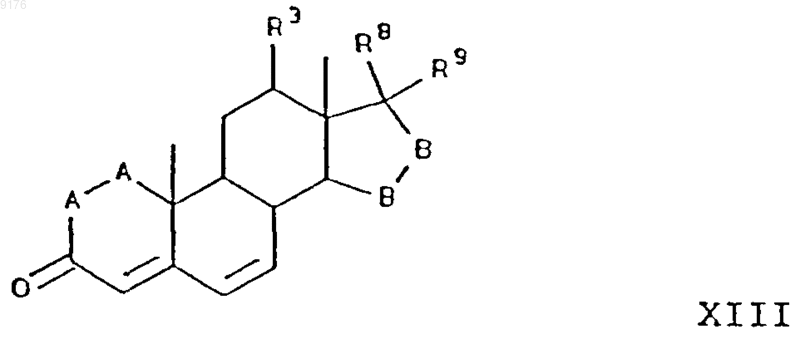
в которой -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше.
23. Способ по п.22, в котором соединение формулы XIII представляет собой g-лактон 11a,17a-дигидрокси-3-оксопрегн-4,6-диен-21-карбоновой кислоты.
24. Способ получения мексренонового производного формулы
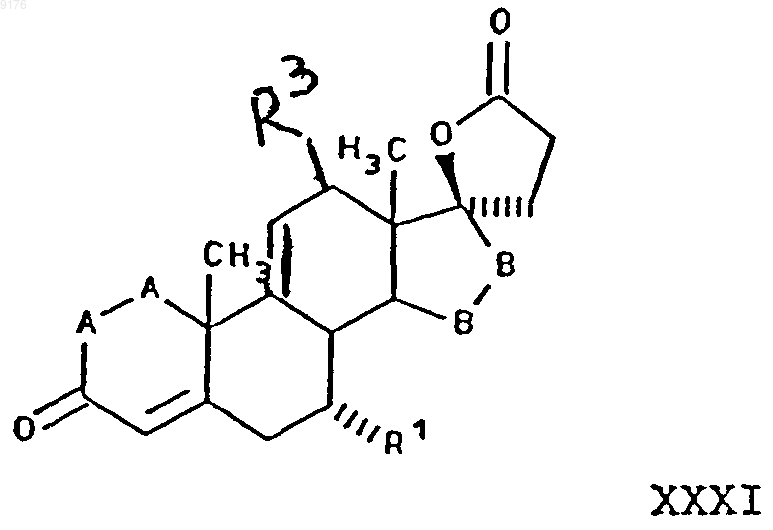
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
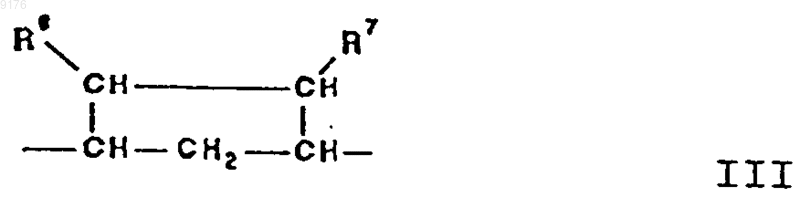
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу,
включающий взаимодействие соединения формулы XIV с алкоксидом щелочного металла формулы R10OM, где M обозначает щелочной металл, а R10O соответствует алкоксизаместителю при R1, причем это соединение соответствует структурной формуле
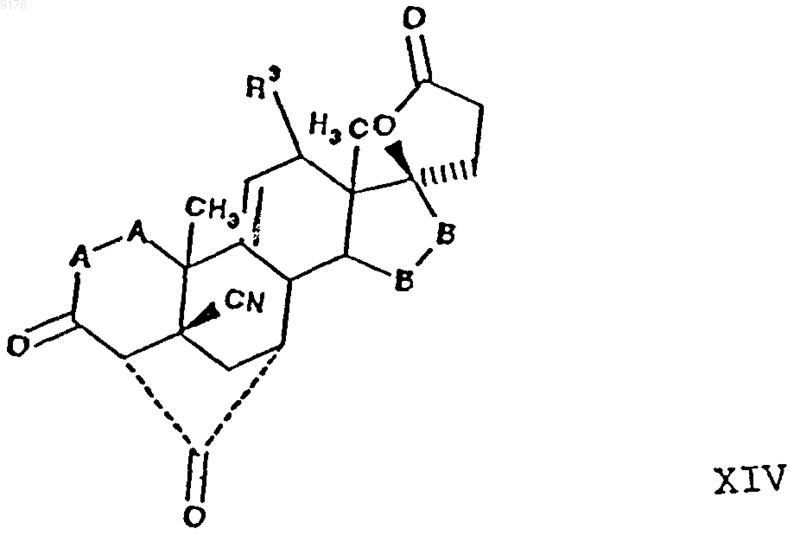
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
при этом получение самого соединения XIV осуществляют путем гидролиза соединения формулы
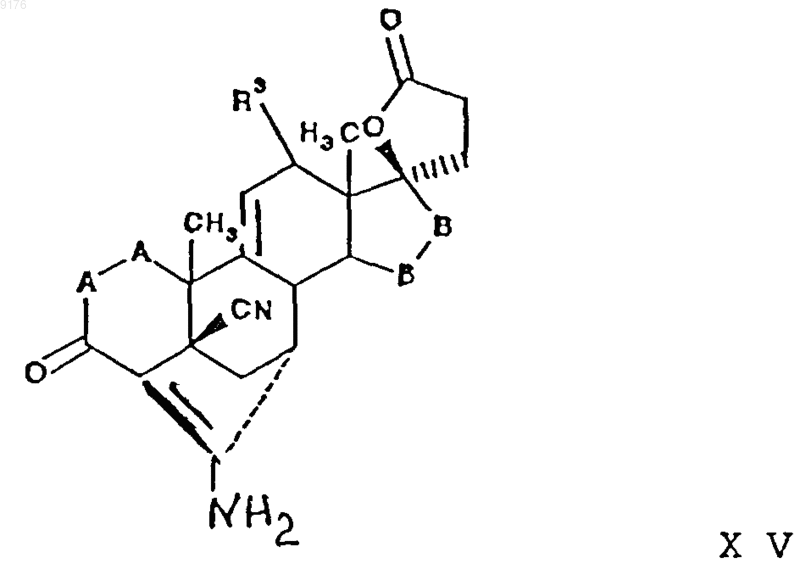
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
а само соединеэшх XV получают взаимодействием соединения формулы
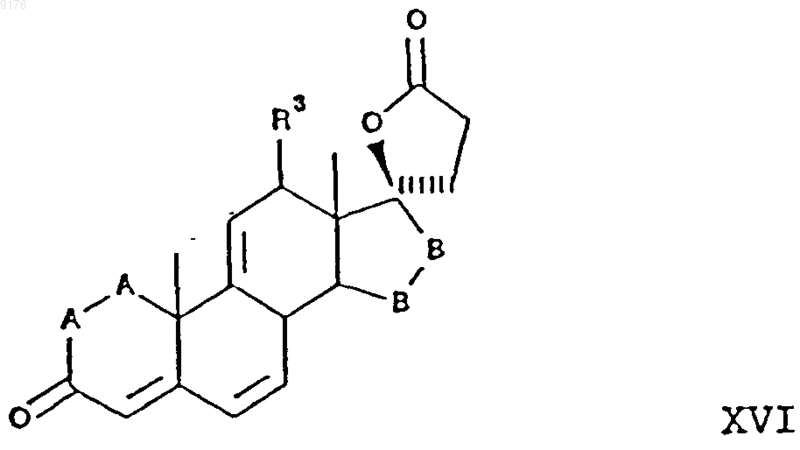
где -A-A-, R3 и -B-B- имеют вышеуказанные значения,
с источником цианидных ионов в присутствии соли щелочного металла, при этом соединение XVI получают из триенона формулы
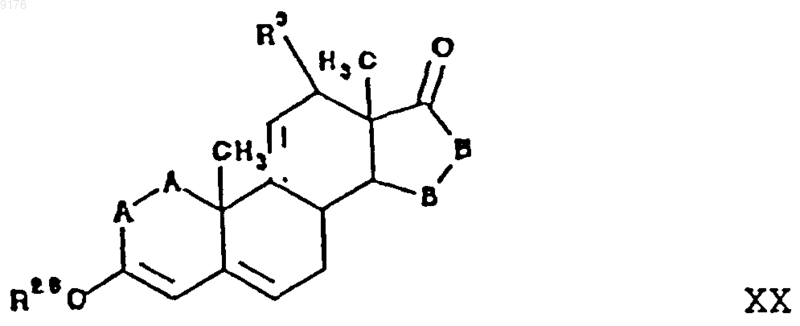
где -A-A- и R3 имеют значения, указанные для VIII,
-B-B- имеет значения, указанные для VIII, за исключением того, что ни R6, ни R7 не составляют части кольца, сконденсированного с D-кольцом в положениях 16, 17, a R6 обозначает C1-C7алкил,
путем последовательных стадий, включающих взаимодействие указанного соединения формулы XX с сульфонийилидом (с получением эпоксидного промежуточного продукта), взаимодействием указанного промежуточного эпоксида с NaCH(COOEt)2 в присутствии основания в растворителе, с последующей последовательной обработкой полученного в результате продукта нагреванием, водой и галогенидом щелочного металла с получением декарбоксилированного промежуточного соединения дальнейшей дегидрогенизацией указанного декарбоксилированного промежуточного продукта в промежуточный продукт формулы XVI.
25. Способ по п.24 в котором соединение формулы XIV представляет собой 4'S(4'a),7'a-1',2',3',4,4',5,5',6',7',8',10',12',13',14',15',16'-гексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н] циклопента[а]фенантрен}-5'-карбонитрил.
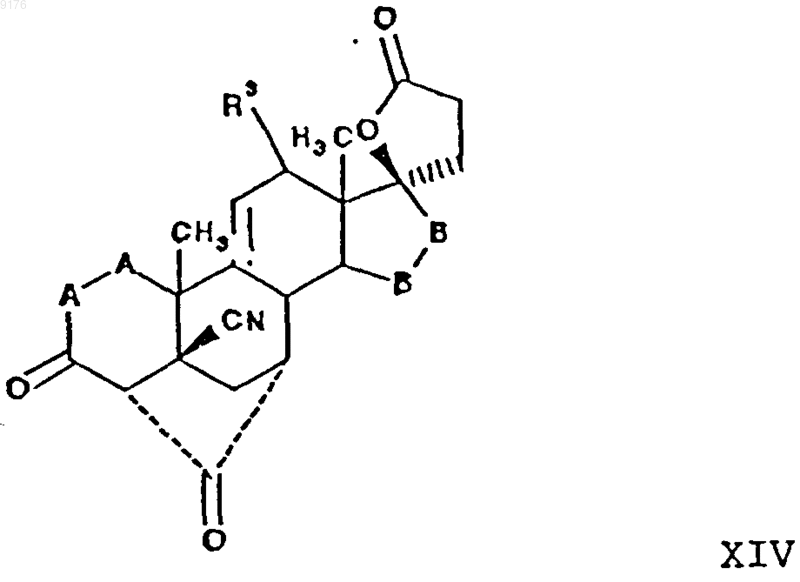
26. Способ получения соединения формулы XIV по п.24
в которой -A-A- обзначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
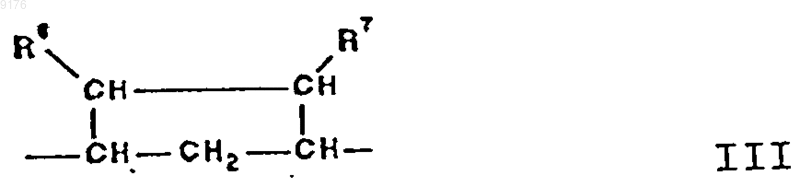
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу,
включающий гидролиз соединения формулы
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
27. Способ по п.26, в котором соединение формулы XIV представляет собой 4'S(4'a),7'a-1',2',3',4,4',5,5',6',7',8',10',12',13',14',15',16'-гексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы формулы XV представляет собой 5'R(5'a),7'b,20'-амино-1,2',3',4,5,6',7',8',10',12',13',14',15',16'-тетрадекагидро-10'a,13'a-диметил-3',5'-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
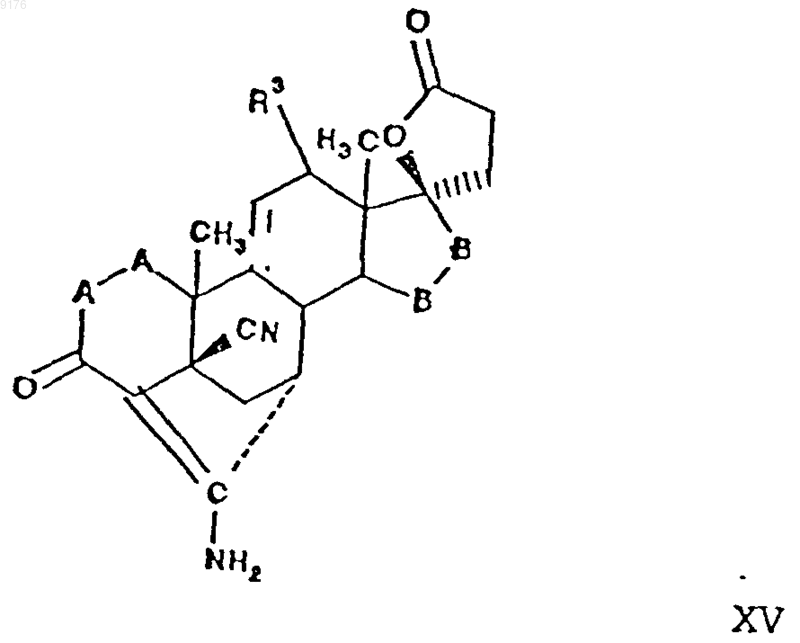
28. Способ получения соединения формулы XV по п.24

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
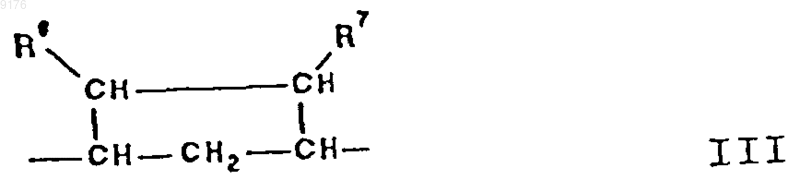
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу,
включающий взаимодействие соединения формулы XVI с источником цианидных ионов в присутствии соли щелочного металла, причем это соединение формулы XVI соответствует структурной формуле
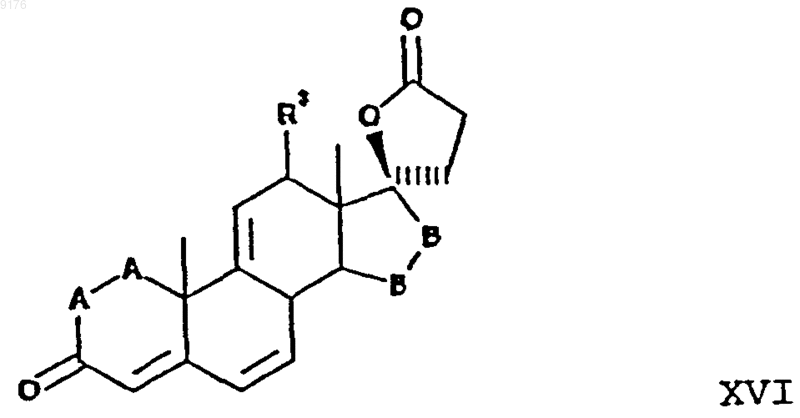
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
29. Способ по п.28, в котором соединение формулы XV представляет собой 5'R(5'a),7'b,20'-амино-1',2',3',4,5,6',7',8',10',12',13',14',15',16'-тетрадекагидро-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
30. Способ получения соединения, соответствующего формуле
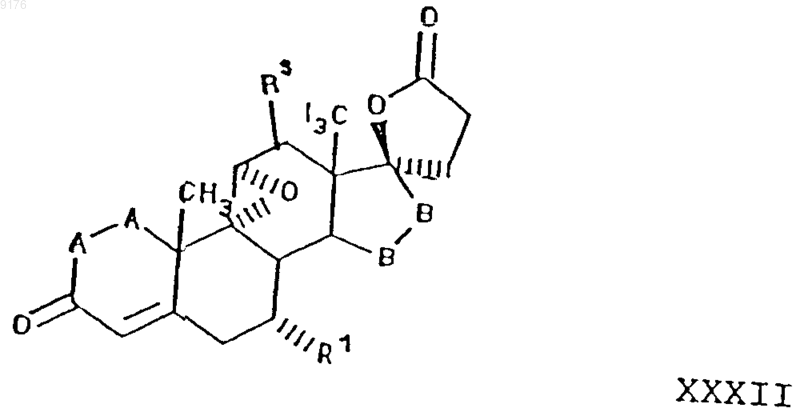
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов C,
включающий взаимодействие соединения формулы XXI с алкоксидом щелочного металла формулы R10OM, где M обозначает щелочной металл, a R10O соответствует алкоксизаместителю при R1,
причем это соединение формулы XXI соответствует структурной формуле
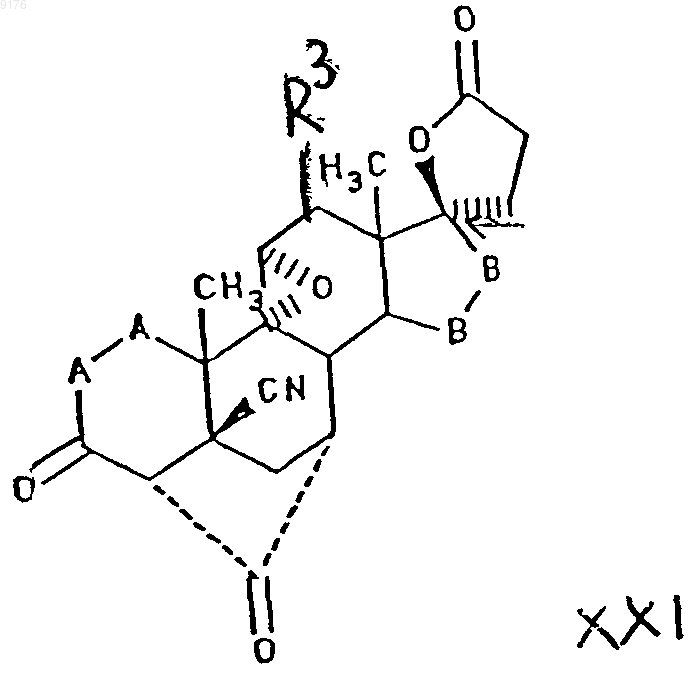
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
с получением его из соединения формулы
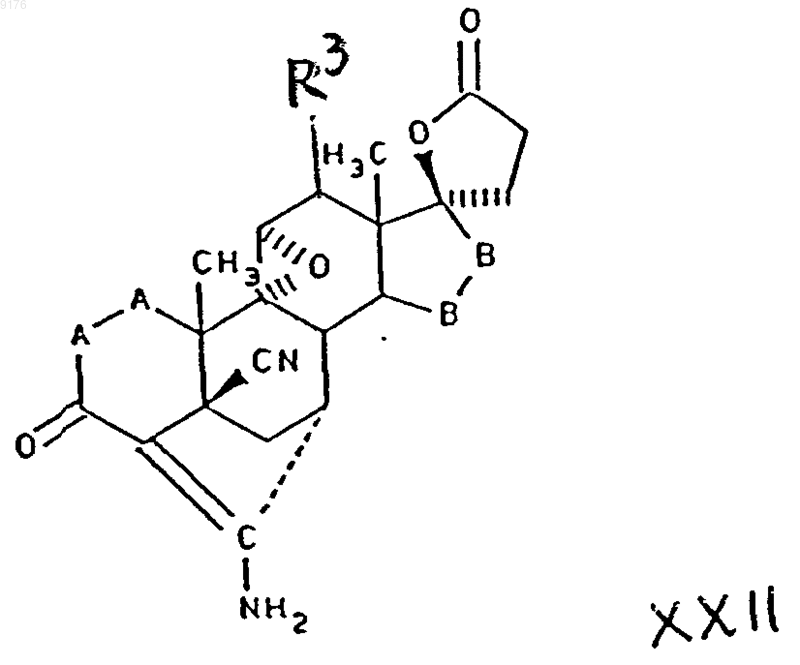
в которой -A-A-, R3 и -B-B- имеют вышеуказанные значения,
гидролизом последнего, которое в свою очередь получают взаимодействием соединения формулы
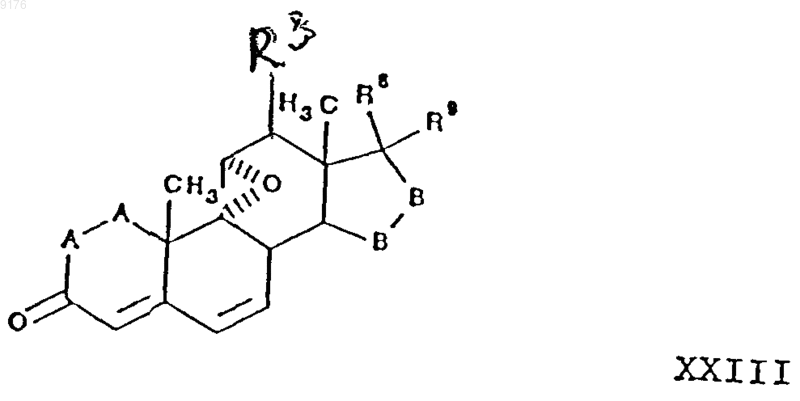
в которой -A-A-, R3, R4, R5 и -B-B- имеют вышеуказанные значения, a
R8 и R9 вместе образуют лактоновое кольцо, идентичное лактоновому кольцу соединения формулы XXII,
с источником цианидных ионов в присутствии соли щелочного металла, р само соединение XXIII получают из его 6,7-дигидропредшественника XXIV путем отщепления от последнего двух атомов водорода из положений 6 и 7
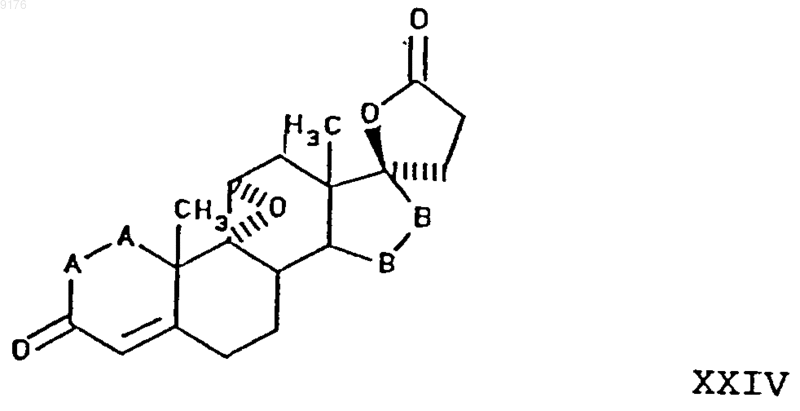
где -A-A-, -B-B- имеют вышеуказанные значения,
который в свою очередь получен из исходного соединения XX, по способу, описанному в п.24.
31. Способ получения соединения формулы XXXII по п.30
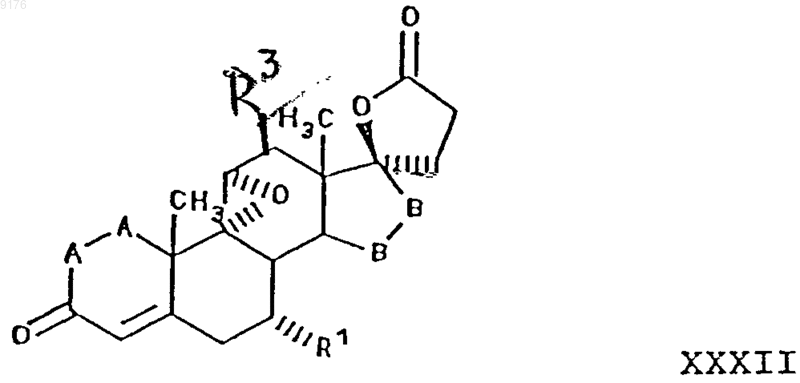
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, C1-C6алкоксиC1-C6алкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
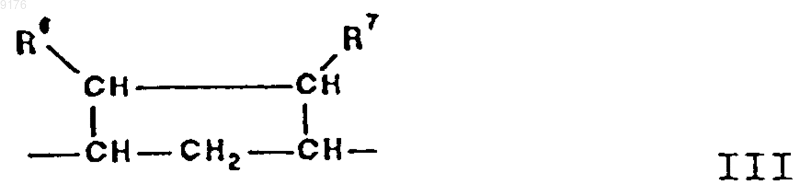
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу,
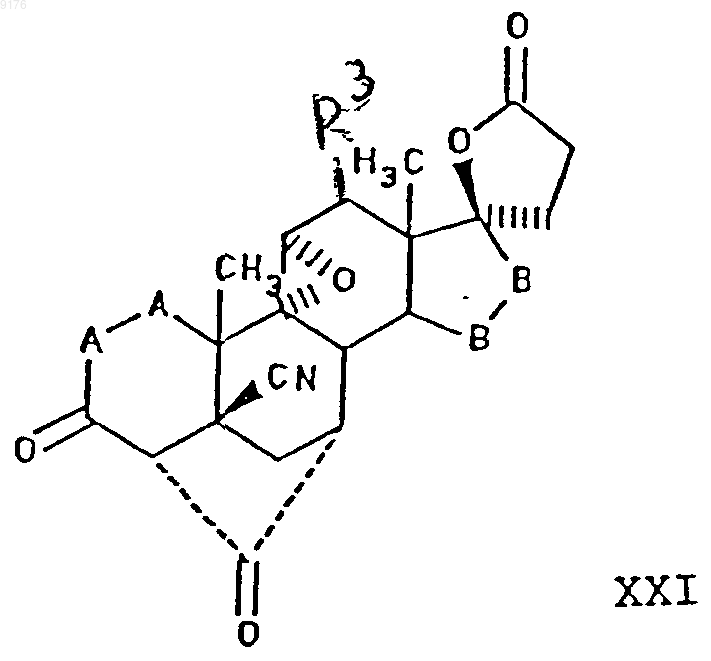
заключающийся во взаимодействии соединения формулы XXI с алкоксидом щелочного металла формулы R10OM, где M обозначает щелочной металл, а R10O соответствует алкоксизаместителю при R1, причем это соединение формулы XXI соответствует структурной формуле
где -A-A-, R3, R4, R5 и -B-B- имеют вышеуказанные значения, и где, если специально не указано, алкильная часть заместителя имеет число атомов углерода от 1 до 6.
32. Способ по п.30, в котором соединение формулы XXI представляет собой 4'S(4'a),7'a-9',11'a-эпоксигексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'-карбонитрил.
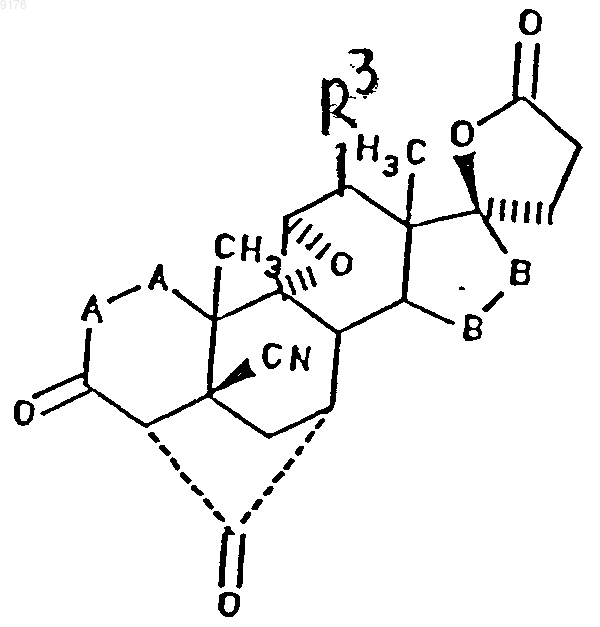
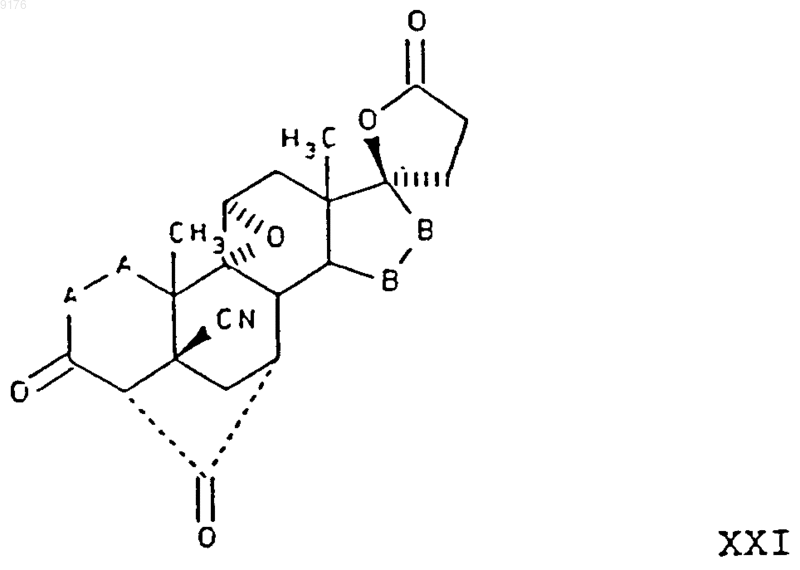
33. Способ получения соединения формулы XXI по п.30
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
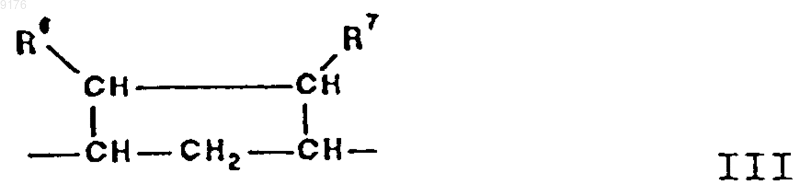
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя имеет число атомов углерода от 1 до 6,
заключающийся в том, что соединение формулы
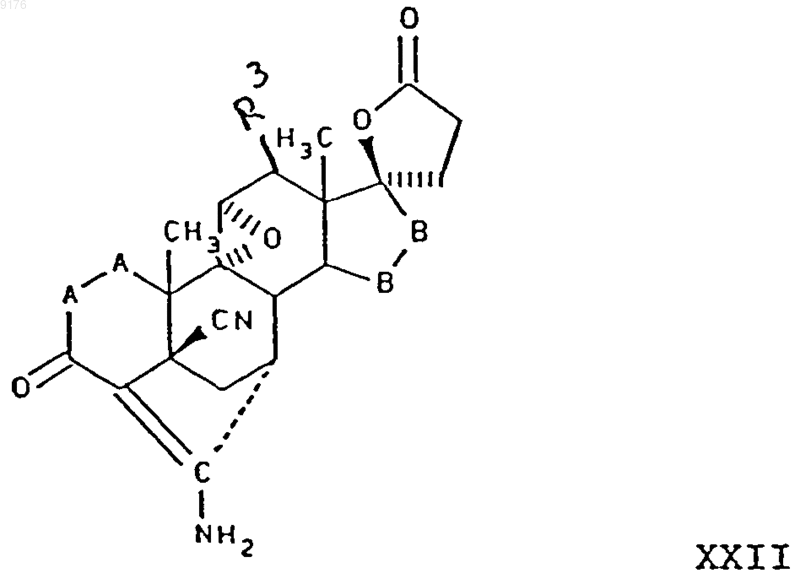
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
подвергают гидролизу.
34. Способ по п.33, в котором соединение формулы XXI представляет собой 4'S(4'a),7'a-9',11'a-эпоксигексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b[4,7]метано[17Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы XXII представляет собой 5'R(5'a),7'b,20'-амино-9,11b-эпоксигексадекагидро-10',13'-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метен[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
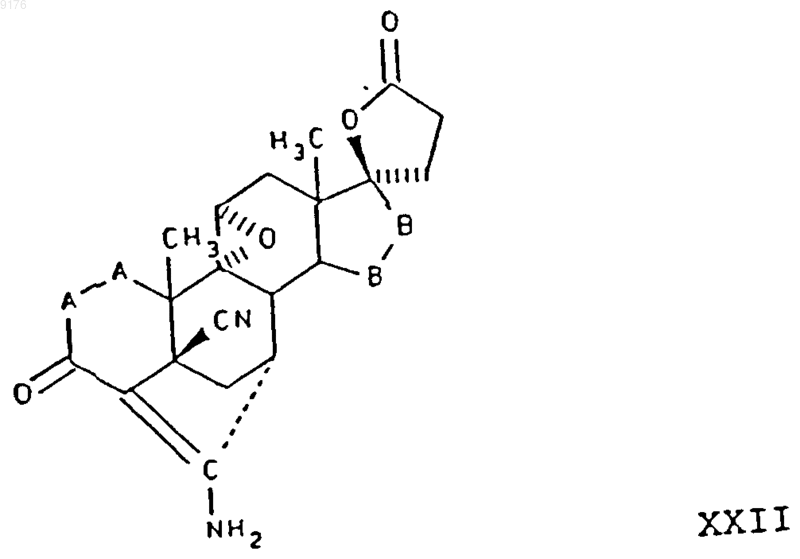
35. Способ получения соединения формулы XXII по п.30

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
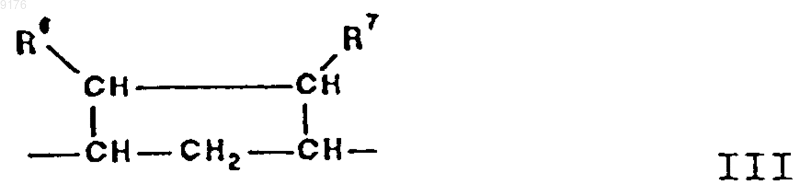
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя имеет число атомов углерода от 1 до 6,
включающий взаимодействие соединения формулы XXIII с источником цианидных ионов в присутствии соли щелочного металла, причем это соединение формулы XXIII соответствует структурной формуле
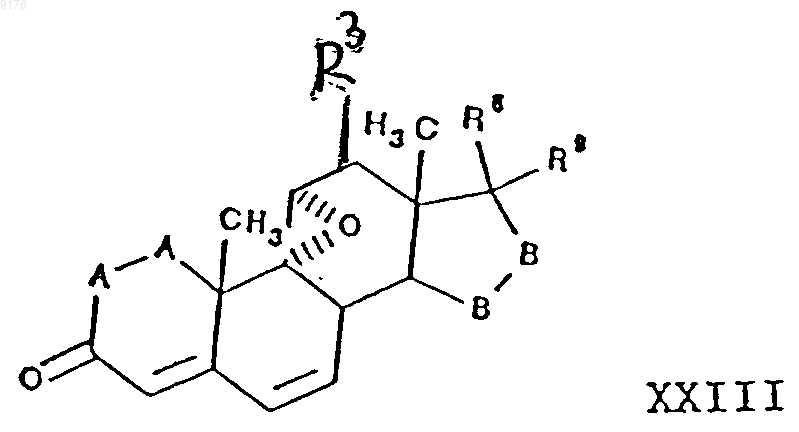
в которой -A-A- и -B-B- имеют значения, указанные выше, a
R3, R8, R9 имеют значения, указанные в п.30.
36. Способ по п.35, в котором соединение формулы XXII представляет собой 5'R(5'a),7'b,20'-амино-9,11b-эпоксигексадекагидро-10',13'-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы XXIII представляет собой g-лактон 9,11a-эпокси-17a-гидрокси-3-оксопрегна-4,6-диен-21-карбоновой кислоты.
37. Способ получения соединения формулы XXIII по п.30

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиC1-C6алкил, C1-C6алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
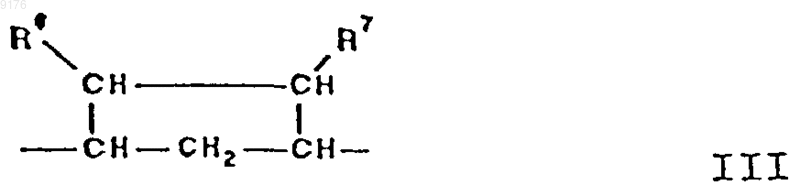
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу,
R8 ш R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, и где алкильная часть заместителя имеет число атомов углерода от 1 до 6,
включающий отщепление водородных атомов в 6- и 7-м положениях соединения формулы

в которой R3, -A-A- и -B-B- имеют значения, указанные выше.
38. Способ получения соединения формулы
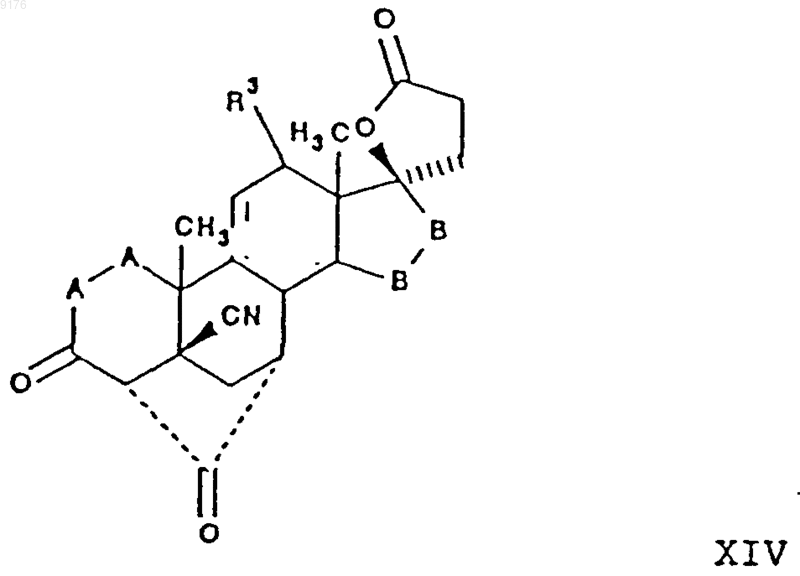
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил цианогруппу, арилоксигруппу, полученного по способу, описанному в п.26, и где алкильная часть заместителя имеет значения от 1 до 6,
включающий гидролиз соединения формулы
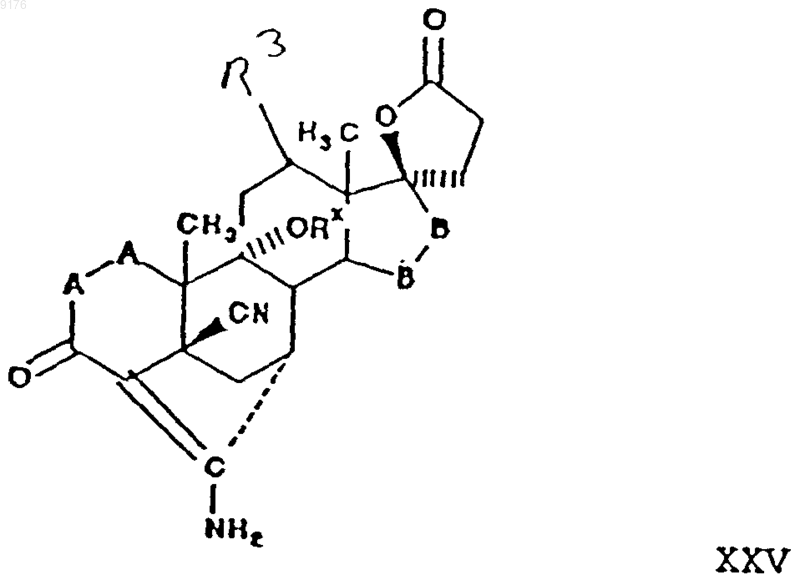
в которой Rx обозначает гидроксизащитную группу,
-A-A-, R3, -B-B- имеют значения, указанные выше,
при этом соединение формулы XXV получают из соединения формулы

в которой -A-A-, -R3 и -B-B- имеют вышеуказанные значения,
взаимодействием соединения формулы XXVI с источником цианидных ионов в присутствии соли щелочного металла, а само соединение формулы XXVI получают путем отщепления атомов водорода из 6,7-положений соединения формулы
в которой -A-A-, R3 и -B-B- имеют вышеуказанные значения.
39. Способ получения соединения формулы XIV по п.38

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
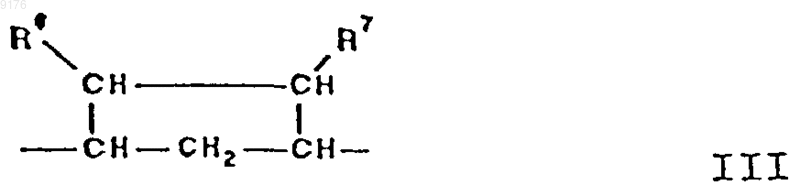
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где алкильная часть заместителя имеет число атомов углерода от 1 до 6,
включающий гидролиз соединения формулы
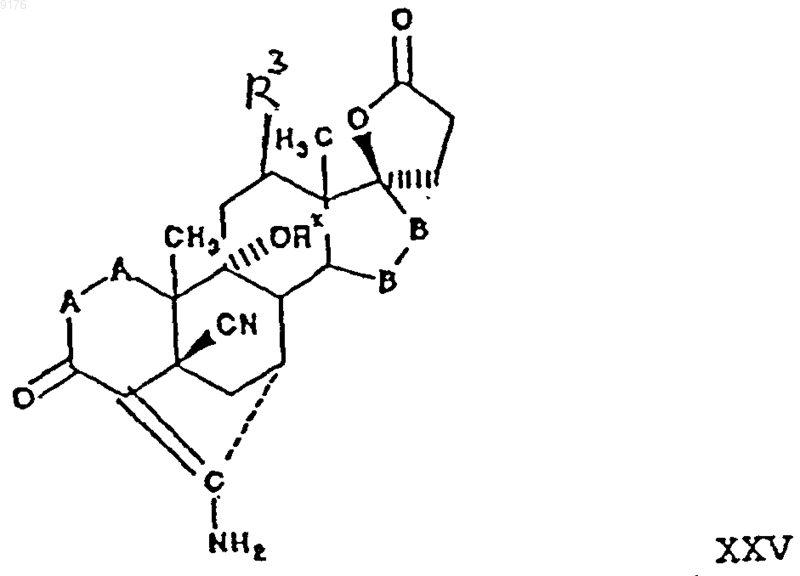
в которой Rx обозначает гидроксизащитную группу,
-A-A-, R3, -B-B- имеют значения, указанные выше.
40. Способ по п.39, в котором соединение формулы XIV представляет собой 4'S(4'a),7'a-1',2',3',4,4',5,5',6',7',8',10',12',13',14',15',16'-гексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы XXV представляет собой 5'R(5'a),7'b,20'-аминогексадекагидро-9'b-гидрокси-10'a,13'-диметил-3',5-диоксоспи-ро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
41. Способ получения соединения формулы XXV по п.38

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
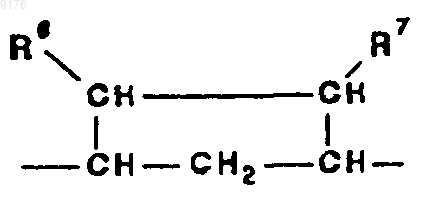
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
в которой Rx обозначает гидроксизащитную группу,
включающий взаимодействие соединения формулы XXVI с источником цианидных ионов в присутствии соли щелочного металла, причем это соединение формулы XXVI соответствует структурной формуле
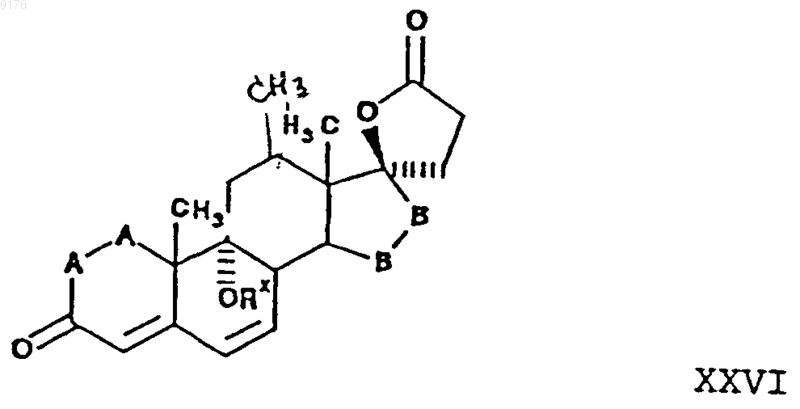
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
42. Способ по п.41, в котором соединение формулы XXV представляет собой 5'R(5'a),7'b,20'-аминогексадекагидро-9'b-гидрокси-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил, а соединение формулы XXVI представляет собой g-лактон 9a,17a-дигидрокси-3-оксопрегн-4,6-диен-21-карбоновой кислоты.
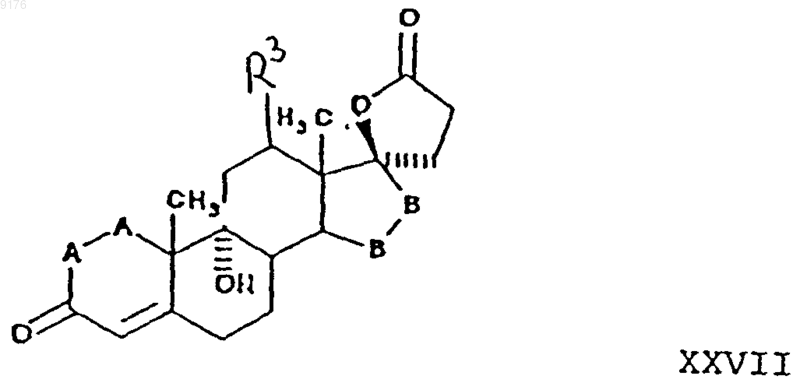
43. Способ получения соединения формулы XXVI по п.38
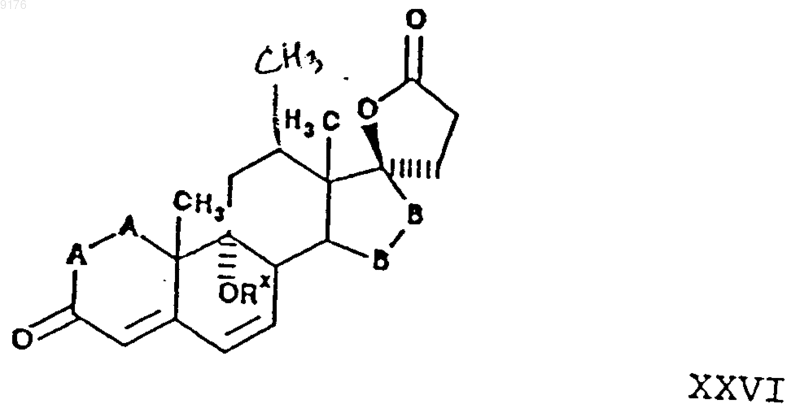
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независшью друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода, и
в которой Rx обозначает гидроксизащитную группу,
включающий отщепление атомов водорода из положений 6 и 7 соединения формулы XXVII

в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
44. Способ по п.43, в котором упомянутое соединение формулы XXVI представляет собой g-лактон 9a,17a-дигидрокси-3-оксопрегн-4,6-диен-21-карбоновой кислоты, а соединение формулы XXVII представляет собой g-лактон 9a,17a-дигидрокси-3-оксопрегн-4-ен-21-карбоновой кислоты.
45. Способ получения соединения формулы

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
R8 и R9 совместно образуют лактоновое кольцо, соответствующее таковому в исходном соединении 104,
включающий окисление этого соединения 104, соответствующего формуле
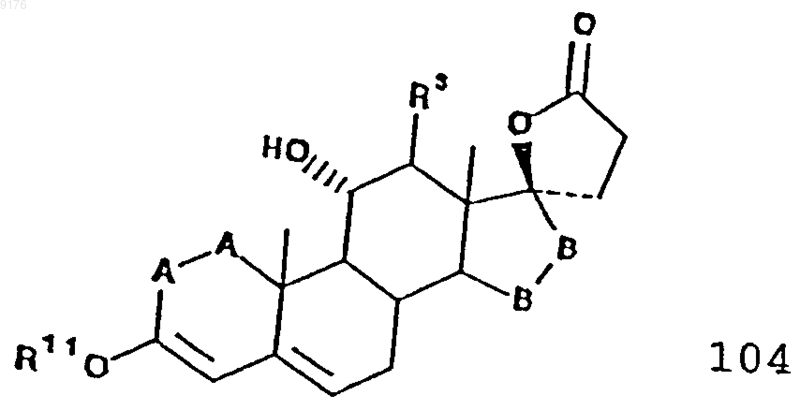
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
R11 обозначает C1-C4алкил,
в свою очередь соединение 104 получают термическим разложением соединения формулы 103 в присутствии галогенида щелочного металла, причем это соединение формулы 103 соответствует структурной формуле
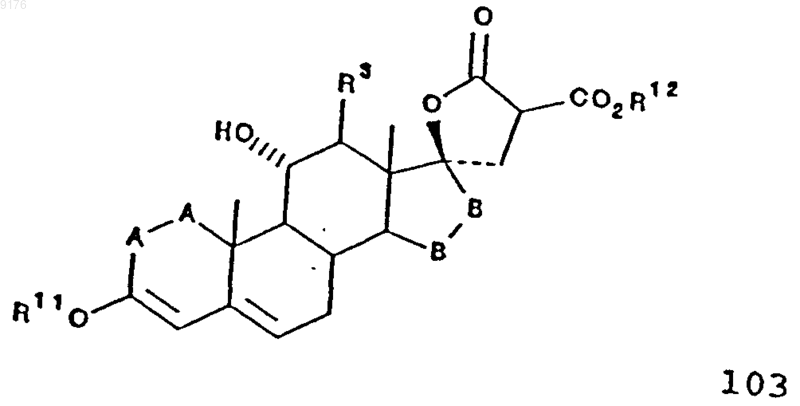
в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше,
R12 обозначает C1-C4алкил,
а соединение 103 получают способом, включающим конденсацию соединения формулы 102 с диалкилмалонатом в присутствии основания, причем это соединение формулы 102 соответствует структурной формуле
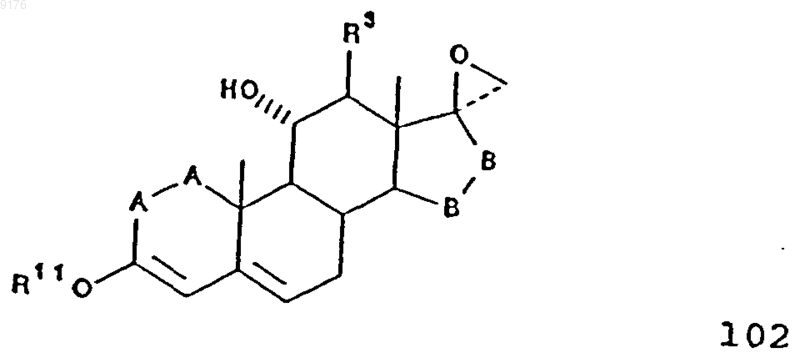
в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше,
и его получают взаимодействием соединения формулы 101 с сульфонийилидом в присутствии основания, причем это соединение формулы 101 соответствует структурной формуле

в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше,
а само соединение 101 получают способом, включающим взаимодействие соединения формулы XXXVIa с этерифицирующим реагентом в присутствии кислотного катализатора, причем это соединение формулы XXXVIa соответствует структурной формуле

в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
46.Способ получения соединения формулы VIII по п.45

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
R8 и R9 совместно образуют лактоновое кольцо, соответствующее таковому в исходном соединении 104,
включающий окисление соединения формулы, которая соответствует формуле 104
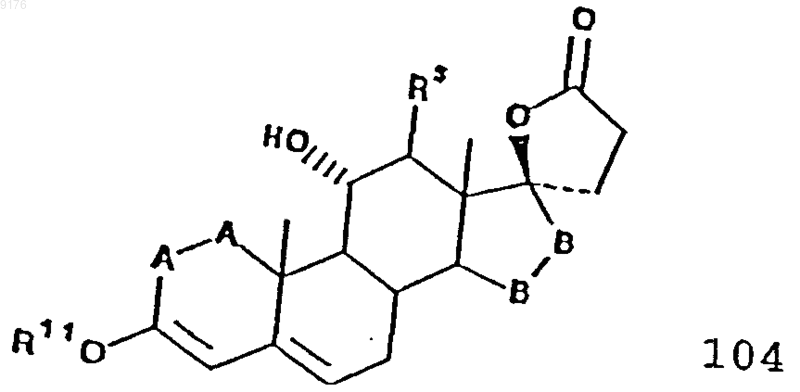
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше,
R11 обозначает C1-C4алкил.
47. Способ по п.45 или 46, в котором осуществляют контактирование соединения формулы 104 с окислителем.
48. Способ по п.47, в котором окислителем служит бензохиноновое производное.
49. Способ по п.48, в котором окислитель выбирают из группы, включающей 2,3-дихлор-5,6-дициан-1,4-бензохинон и тетрахлорбензохинон.
50. Способ по п.46, в котором осуществляют контактирование соединения формулы VIII с галоидирующим агентом с получением галоидированного промежуточного продукта, после чего осуществляют контактирование этого галоидированного промежуточного продукта с дегидрогалоидирующим агентом для дегидрогалоидирования этого галоидированного промежуточного продукта и получения соединения формулы 104.
51. Способ получения соединения формулы 104 по п.45
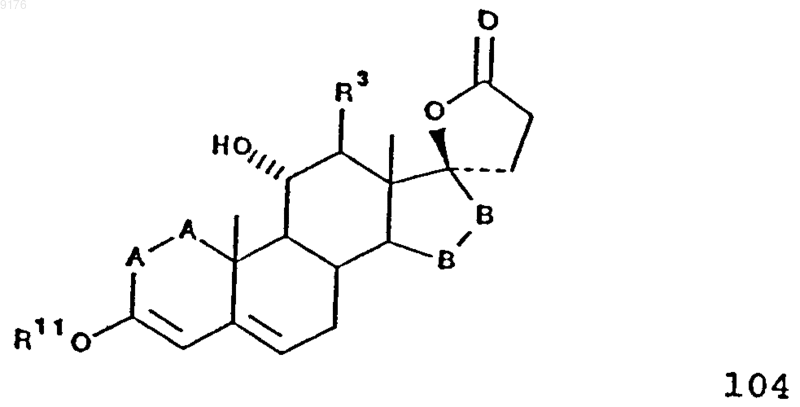
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR-CHR7- либо a- или b-ориентированную группу
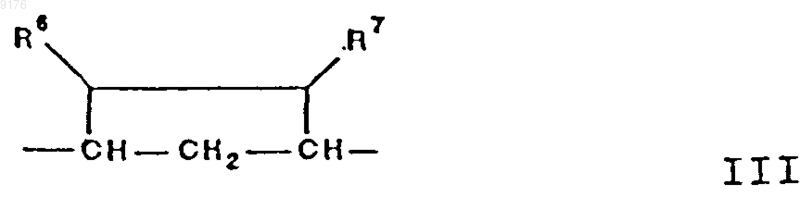
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий термическое разложение соединения формулы 103, в присутствии галогенида щелочного металла, причем это соединение формулы 103 соответствует структурной формуле
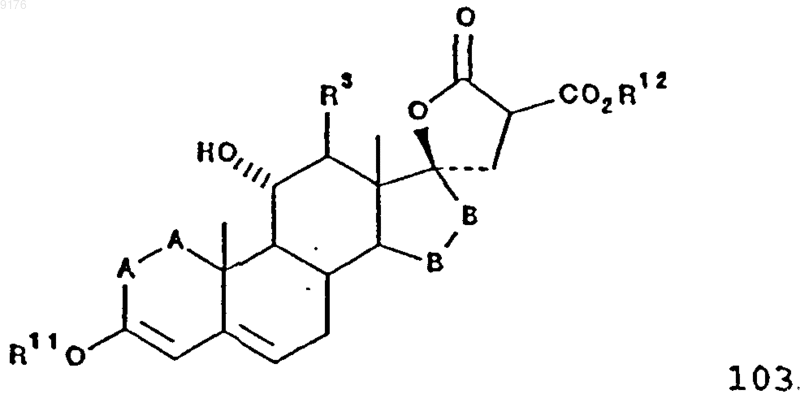
в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше,
R12 обозначает C1-C4алкил.
52. Способ получения соединения формулы 103 по п.45

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4, R5 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R11 обозначает C1-C4алкил,
R12 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий конденсацию соединения формулы 102 с диалкилмалонатом в присутствии основания, причем это соединение формулы 102 соответствует структурной формуле
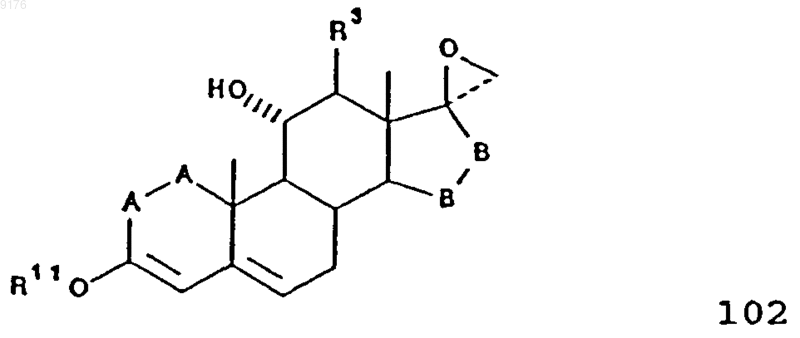
в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше.
53. Способ получения соединения формулы 102 по п.45

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4, R5 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и, где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий взаимодействие соединения формулы 101 с сульфонийилидом в присутствии основания, причем это соединение формулы 101 соответствует структурной формуле
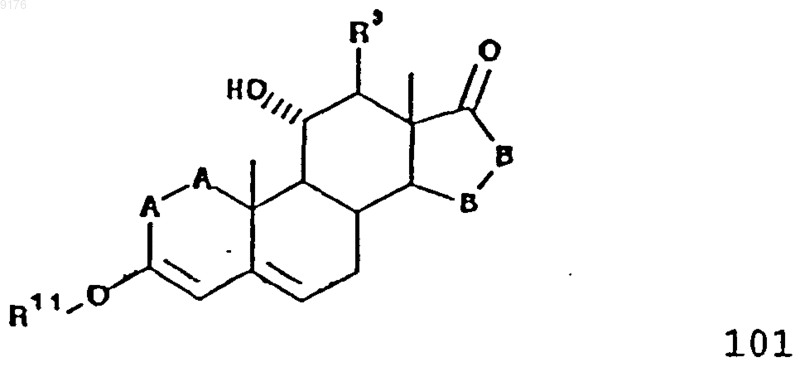
в которой -A-A-, R3, R11 и -B-B- имеют значения, указанные выше.
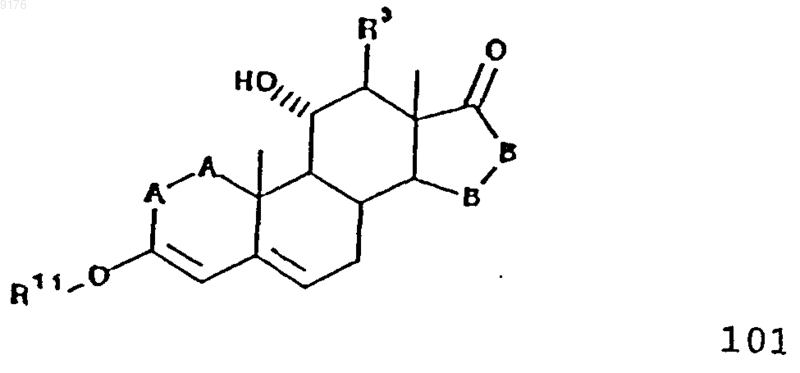
54. Способ получения соединения формулы 101 по п.45
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4, R5 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий взаимодействие соединения формулы XXXVI с этерифицирующим реагентом в присутствии кислотного катализатора, причем это соединение формулы XXXVI соответствует структурной формуле
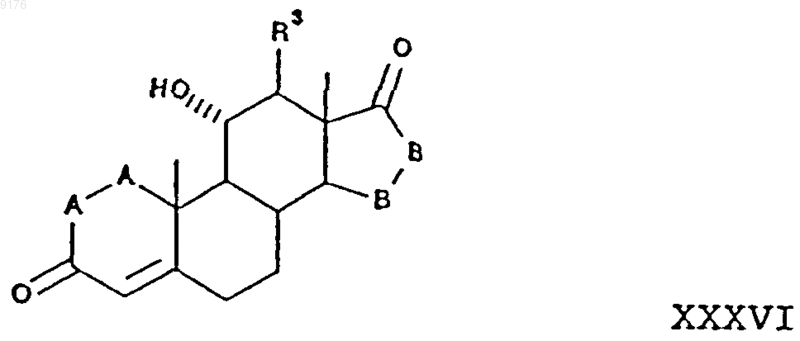
в которой -A-A-, R3 и -B-B- имеют значения, указанные выше.
55. Способ по п.54, в котором соединение формулы 101 получают взаимодействием соединения формулы XXXVI с триалкилортоформиатом в подкисленном спиртовом растворителе.
56. Способ получения соединения формулы
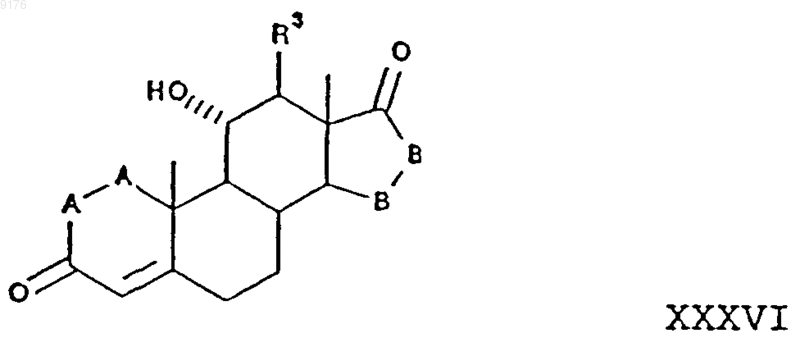
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий окисление субстратного соединения формулы XXXVII ферментацией в присутствии микроорганизма, например, выбранного из рода Aspergillus ochraceus NRRL 405 (ATCC 18500), Aspergillus niger ATCC 11394, Aspergillus nidulans ATCC 11267, Rhizopus oryzae ATCC 11145, Rhizopus stolonifer ATCC 6227b, Trichothecium roseum ATCC 12519 и ATCC 8685, обеспечивающего эффективное превращение этого субстратного соединения в соединение формулы
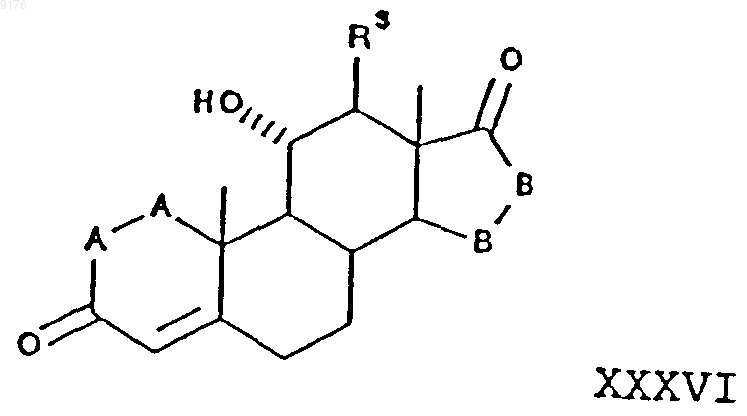
в которой -A-A-, -B-B- и R3 имеют значения, указанные выше,
такое субстратное соединение формулы XXXVII соответствует формуле
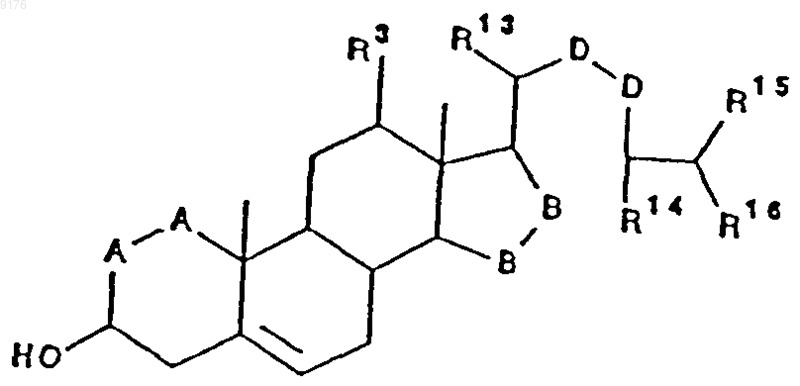
где -A-A-, R1, R3 и -B-B- имеют значения, указанные выше,
D-D обозначает группу -CH2-CH2- или -CH=CH-,
R13, R14, R15 и R16 независимо друг от друга выбирают из группы, включающей C1-C4алкил,
в которое и осуществляют введение 11a-гидроксильной группы посредством вышеуказанной биоконверсии.
57. Способ получения соединения формулы
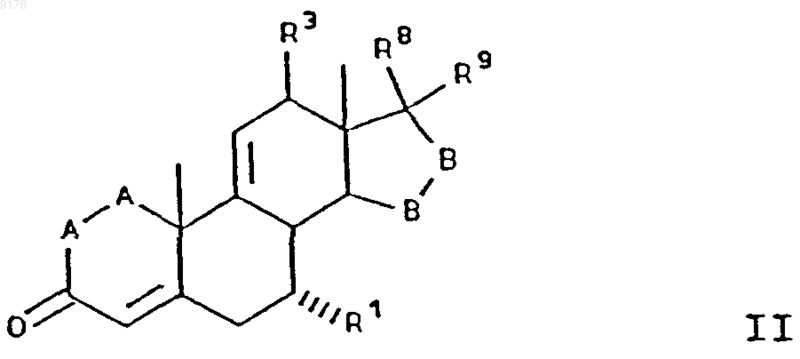
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, и где, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода,
включающий получение соединения формулы
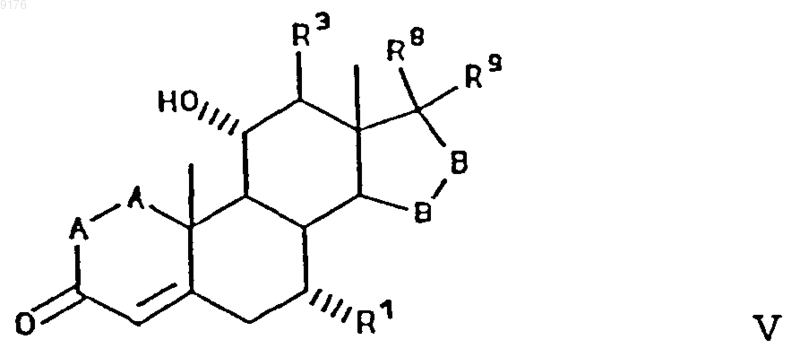
в которой -A-A-, R1, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
взаимодействием соединения формулы VI с алкоксидом щелочного металла формулы R10OM, в которой M обозначает щелочной металл, а R10O соответствует алкоксизаместителю при R1, причем это соединение формулы VI соответствует структурной формуле
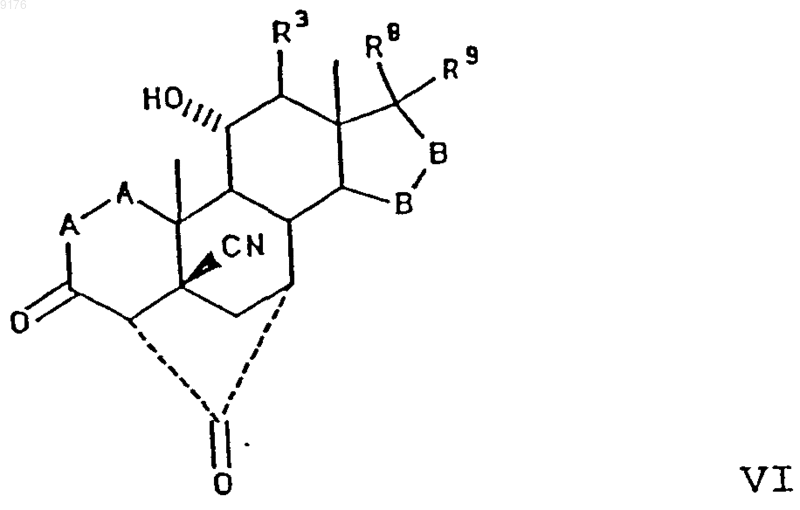
в которой -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
без выделения соединения формулы V в очищенной форме, взаимодействие этого соединения формулы V с низшим алкилсульфонилирующим или ацилирующим реагентом или с галоидгенерирующим агентом с получением соединения формулы
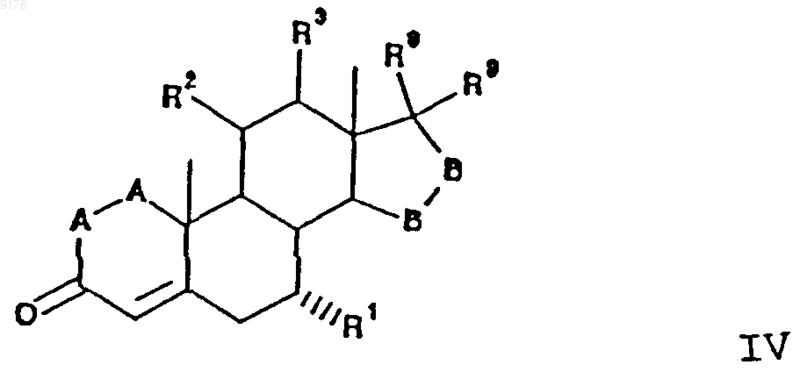
в которой -A-A-, R1, R3, -B-B-, R8 и R9 имеют значения, указанные выше,
R2 обозначает алкилсульфонилоксигруппу, уходящую ацилоксигруппу или галогенид,
без выделения соединения формулы IV в очищенной форме, удаление из него уходящей 11a-группы за счет взаимодействия с реагентом для ее удаления с получением этого соединения формулы II.
58. Способ по п.1, в котором, минуя выделение соединения формулы II в очищенном виде, проводят взаимодействие этого соединения формулы II с эпоксидирующим реагентом с получением соединения формулы
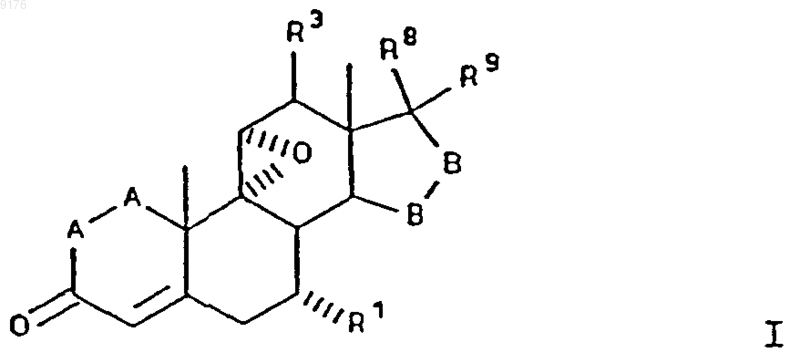
в которой -A-A-, R1, R3, -B-B-, R8 и R9 имеют значения, указанные в п.57.
59. Способ по п.58, в котором соединение формулы II получают взаимодействием соединения формулы IV с реагентом, удаляющим уходящую группу, включающим алифатическую кислоту, в присутствии алкоксида щелочного металла, из реакционного раствора упаривают летучие компоненты, водорастворимые компоненты реакционного раствора удаляют промывкой водным промывным раствором, в результате чего получают остаточный раствор соединения формулы II, приемлемый для превращения этого соединения формулы II в соединение формулы I, и с остаточным раствором соединения формулы II совмещают перекисный окислитель с целью обеспечить превращение этого соединения формулы II в соединение формулы I.
60. Способ по п.57, в котором соединение формулы V получают взаимодействием соединения формулы VI с алкоксидом щелочного металла в органическом растворителе с получением реакционного раствора с соединением формулы V; соединение формулы V экстрагируют из раствора, представляющего собой реакционный раствор с соединением формулы V, с использованием органического растворителя, в результате чего получают раствор с экстрактом соединения формулы V и в этот раствор с целью получения соединения формулы VI вводят C1-C7алкилсульфонилгалогенид, или ацилгалогенид, или галоидгенерирующий агент.
61. Способ по п.57, в котором соединение формулы IV получают взаимодействием соединения формулы V с реагентом, удаляющим уходящую группу, в органическом растворителе с получением реакционного раствора с соединением формулы IV; раствор, представляющий собой реакционный раствор с соединением формулы IV, пропускают через колонки с кислой, а затем с основными ионообменными смолами с целью удалить из него основные и кислотные примеси, в результате чего получают элюат соединения формулы IV и реагент для удаления уходящей алкилсульфонилокси- или ацилоксигруппы совмещают с раствором, представляющим собой элюат соединения формулы IV, с целью получения соединение формулы II.
62. Способ получения эпоксисоединения, включающий контактирование субстратного соединения, содержащего олефиновую двойную связь, с перекисным соединением в присутствии перекисного активатора, причем этот перекисный активатор соответствует формуле
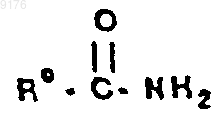
где R0 обозначает заместитель, способность которого - оттягивать электроны не ниже, чем у монохлорметила.
63. Способ по п.62, где перекисный активатор соответствует формуле
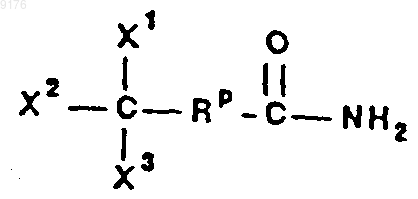
в которой значения X1, X2 и X3 независимо друг от друга выбирают из группы, включающей галоген, водород, алкил, галоалкил, цианогруппу и цианоалкил,
значения Rp выбирают из группы, включающей арилен и группу (CX4X5)n-, n обозначает 0 или 1, причем по меньшей мере один из X1, X2, X3, X4 и X5 обозначает галоген или перфторалкил.
64. Способ по п.62, в котором n обозначает 0 и по меньшей мере два из X1, X2 и X3 обозначают атомы галогена или пергалоалкил.
65. Способ по п.62, в котором все X1, X2, X3, X4 и X5 обозначают атомы галогена или пергалоалкил.
66. Способ по п.62, в котором перекисный активатор представляет собой тригалоацетамид.
67. Способ по п.66, в котором перекисный активатор представляет собой трихлорацетамид.
68. Способ по п.62, в котором субстратное соединение соответствует формуле
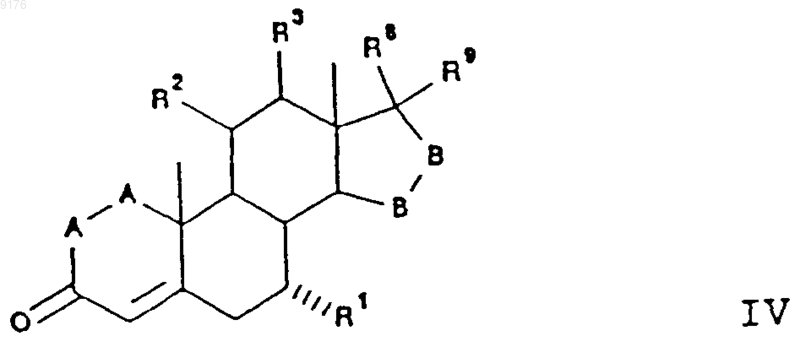
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4, R5 выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил,
C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
R2 означает C1-C7алкилсульфонилокси, ацилокси или галоидный остаток,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
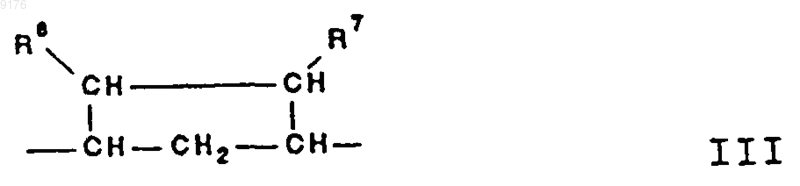
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу, арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу, арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместню ё R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
69. Способ по п.62, в котором субстратное соединение выбирают из группы, включающей соединения формул
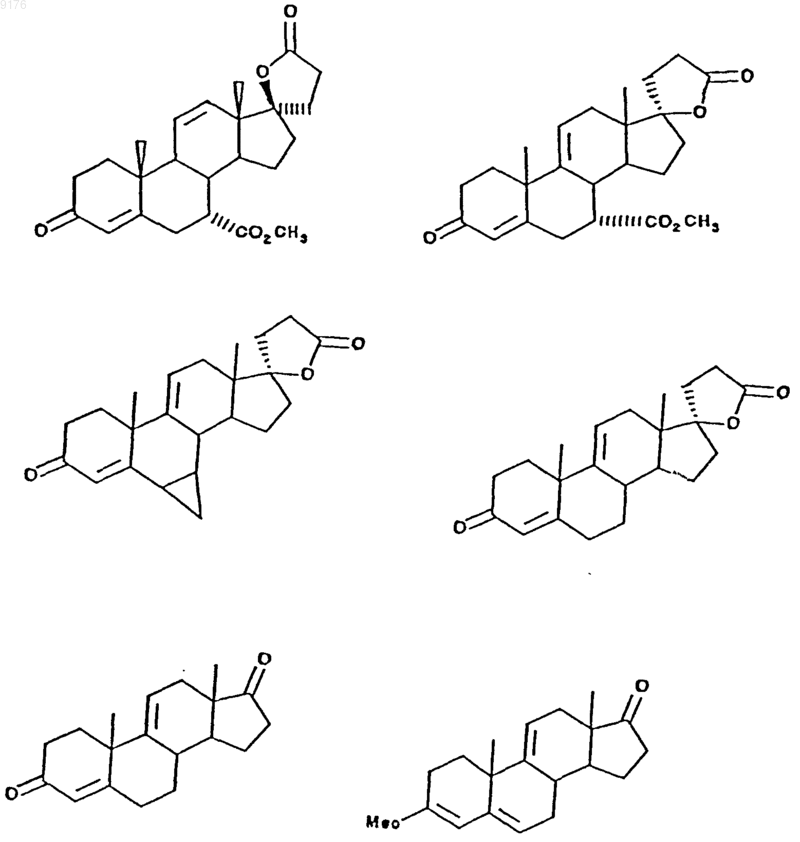
а продукт реакции эпоксидирования выбирают из группы, включающей соединения формул
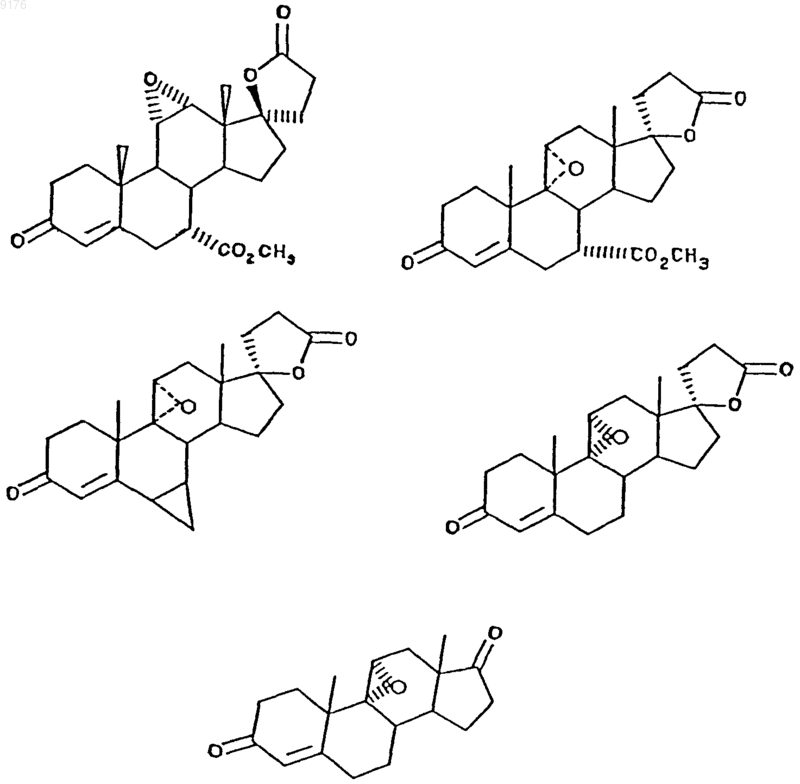
70. Соединение формулы
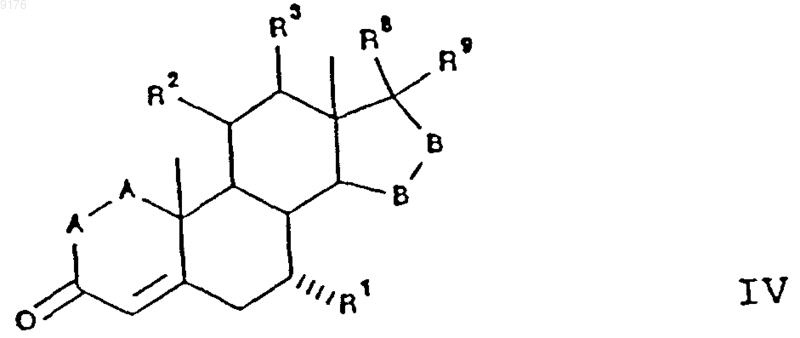
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, гидроксил, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом,
R2 обозначает C1-C7алкилсульфонилокси-, ацилокси или галоостаток, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
71. Соединение формулы IV по п.70, соответствующее формуле
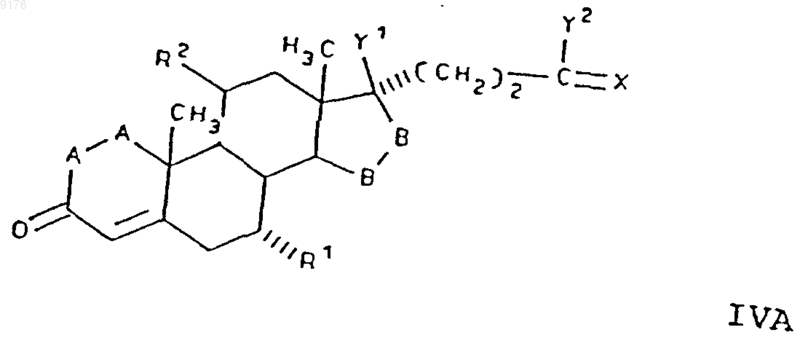
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
R1 обозначает a-ориентированный C1-C7алкоксикарбонилъный радикал,
R2 обозначает C1-C7алкилсульфонилоксигруппу или ацилоксигруппу,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу

X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или,
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или,
если X обозначает Н2, необязательно C1-C7алканоилоксигруппу, а также соли соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
72. Соединение формулы IV по п.70, представляющее собой g-лактон неполного метилового эфира 17a-гидрокси-11a-(метилсульфонил)окси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты.
73. Соединение формулы V
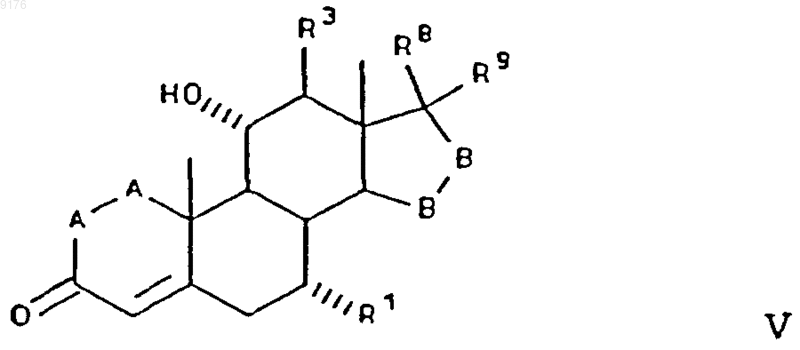
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный или гидроксикарбонильный радикал,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, гидроксил, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
74. Соединение формулы V по п.73, соответствующее формуле
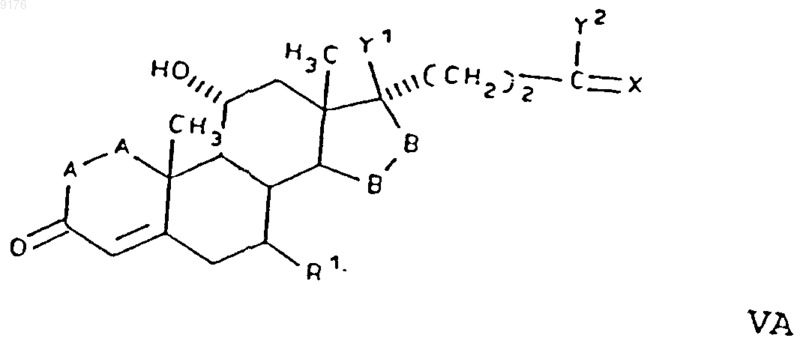
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный радикал,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
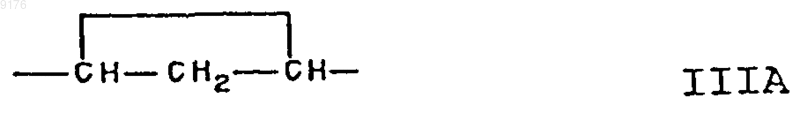
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает
Н2, необязательно C1-C7алканоилоксигруппу, а также соли соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
75. Соединение формулы V по п.73, представляющее собой g-лактон неполного метилового эфира 11a,17a-дигидрокси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты.
76. Соединение формулы
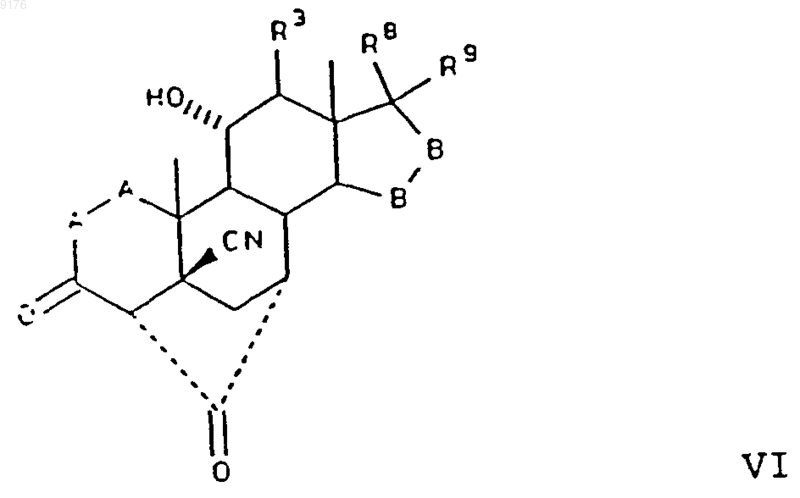
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
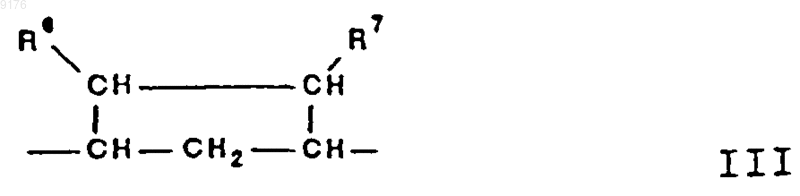
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу, -B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 ш R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, гидроксил, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
77. Соединение формулы VI по п.72, соответствующее формуле

в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-, -B-B- обозначает группу -CH2-CH2- либо
a- или b-ориентированную группу
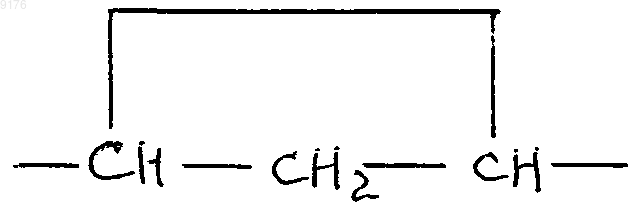
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу, а также соли соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
78. Соединение формулы VI по п.76, представляющее собой 4'S(4'a),7'a-гексадекагидро-11'a-гидрокси-10'b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'b(2'Н)-карбонитрил.
79. Соединение формулы
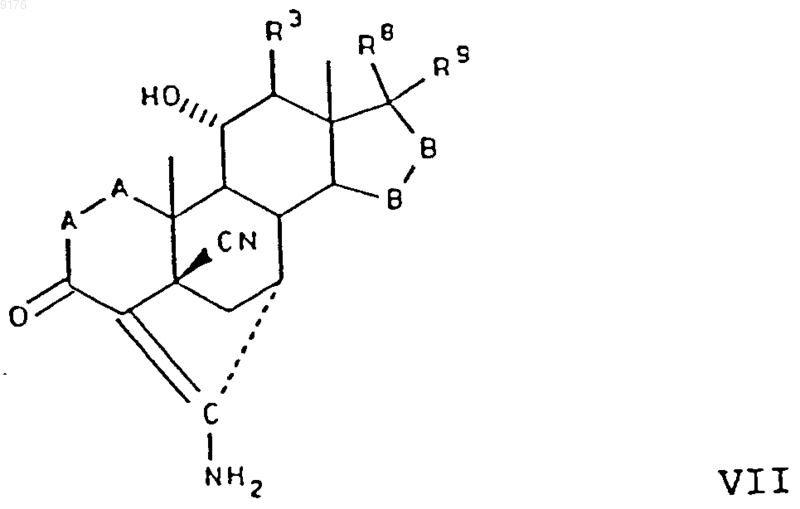
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
80. Соединение формулы VII по п.79, соответствующее формуле
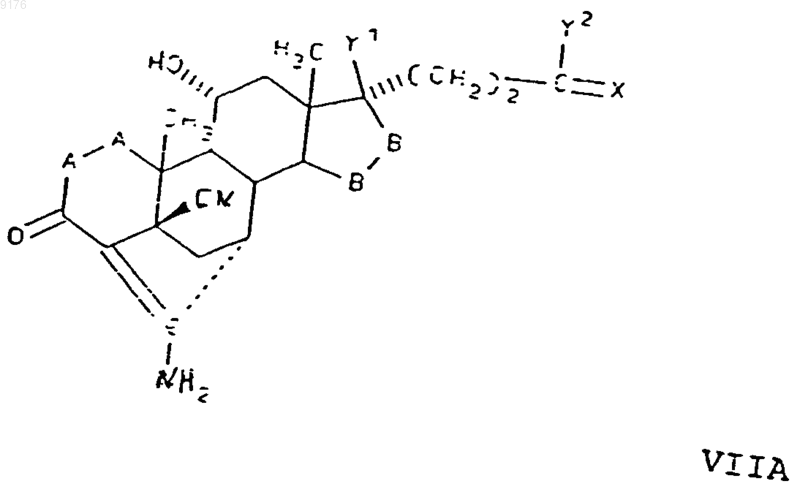
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-, -B-B- обозначает группу -CH2-CH2- либо
a- или b-ориентированную группу
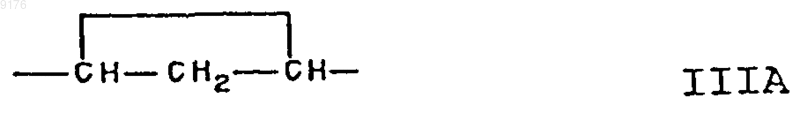
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или, если X обозначает Н2, необязательно
C1-C7алканоилоксигруппу, а также солисоединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
81. Соединение формулы VII по п.79, представляющее собой 5'R(5'a),7'b,20'-аминогексадекагидро-11'b-гидрокси-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
82. Соединение формулы

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
83. Соединение формулы VIII по п.82, соответствующее формуле
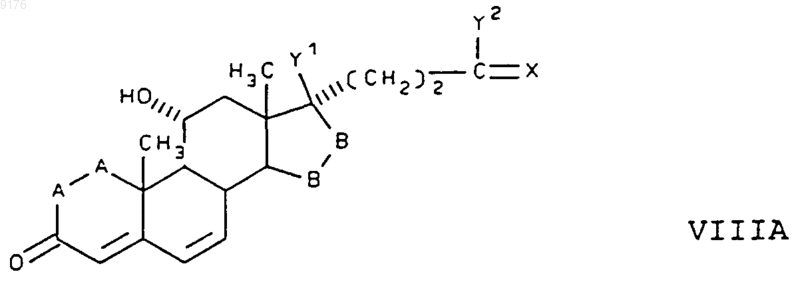
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
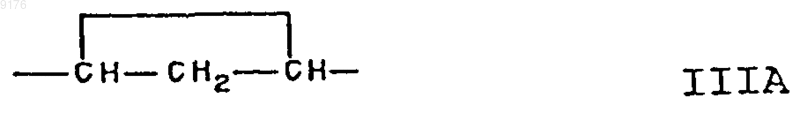
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или,
если X обозначает Н2, необязательно C1-C7алканоилоксигруппу, а также соли соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
84. Соединение формулы VIII по п.82, представляющее сосющ g-лактон 11a,17a-дигидрокси-3-оксопрегна-4,6-диен-21-карбоновой кислоты.
85. Соединение формулы

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу, и
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу.
86. Соединение формулы XIV по п.25, представляющее собой 4'S(4'a),7'a-1',2',3',4,4',5,5',6',7',8',10',12',13'14',15',16'-гексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H)17'b-[4,7]метано[17Н] циклопента[а]фенантрен}-5'-карбонитрил.
87. Соединение формулы

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
88. Соединение формулы XV по п.87, представляющее собой g-лактон неполного метилового эфира 9a,17a-дигидрокси-3-оксопрегн-4-ен-7a,21-дикарбоновой кислоты.
89. Соединение формулы
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6 -CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу.
90. Соединение формулы XXI по п.85, представляющее собой 4'S(4'a),7'a-9',11'a-эпоксигексадекагидро-10b,13'b-диметил-3',5,20'-триоксоспиро{фуран-2(3H),17'b-[4,7]метано[17Н]циклопента[а]фенантрен}-5'-карбонитрил.
91. Соединение формулы
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу
где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
92. Соединение формулы XXII по п.91, представляющее собой 5'R(5'a),7'b,20'-амино-9,11b-эпоксигексадекагидро-10',13'-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метен[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
93. Соединение формулы

в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
94. Соединение формулы XXIII по п.93, где R8 и R9 совместно с углеродным атомом, с которым они связаны, образуют структуру
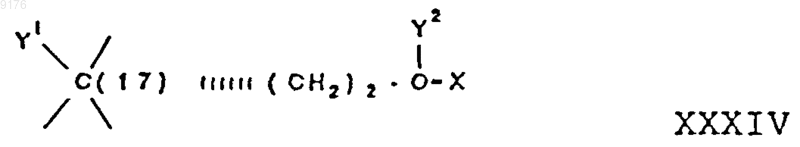
в которой X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или
если X обозначает Н2, необязательно C1-C7алканоилоксигруппу, а также соли соединений, в которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
95. Соединение формулы
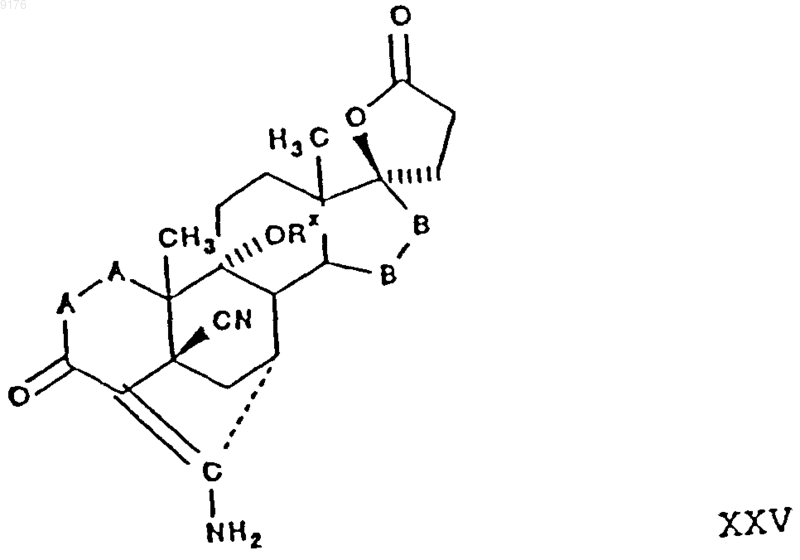
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоухэ, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу,
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру и
Rx выбирают из группы, включающей водород и гидроксизащитную группу.
96. Соединение формулы XXV по п.95, которое представляет собой 5'R(5'a),7'b,20'-аминогексадекагидро-9'b-гидрокси-10'a,13'a-диметил-3',5-диоксоспиро{фуран-2(3H),17'a(5'Н)-[7,4]метено[4Н]циклопента[а]фенантрен}-5'-карбонитрил.
97. Соединение формулы
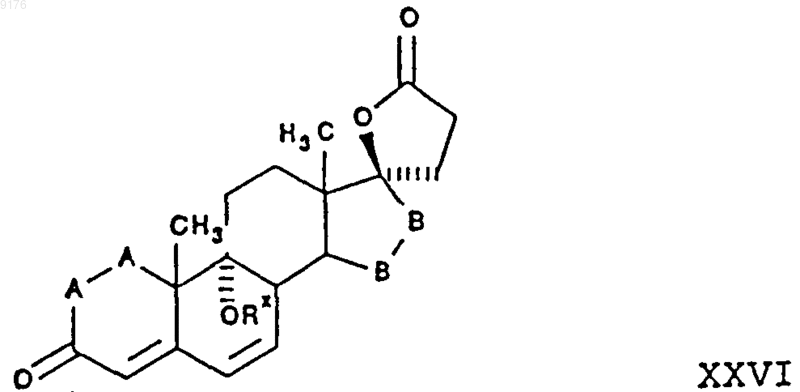
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген, C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
Rx выбирают из группы, включающей водород и гидроксизащитную группу, при том что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
98. Соединение формулы XXVI по п.97, представляющее собой g-лактон 9a,17a-дигидрокси-3-оксопрегна-4,6-диен-21-дикарбоновой кислоты.
99. Соединение формулы
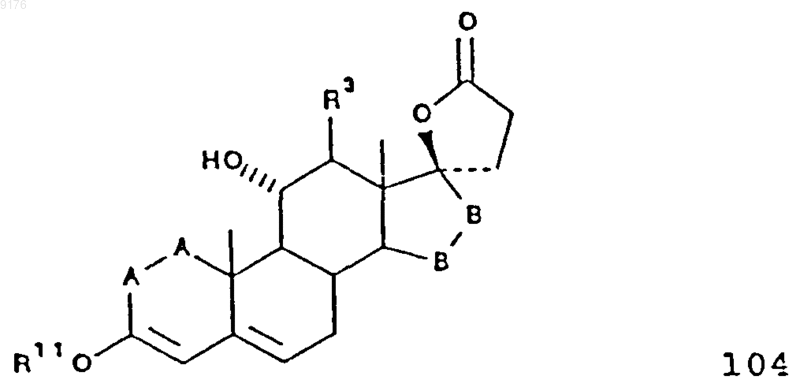
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
100. Соединение формулы 104 по п.99, представляющее собой g-лактон 3-этокси-11a,17a-дигидроксипрегна-3,5-диен-21-карбоновой кислоты.
101. Соединение формулы
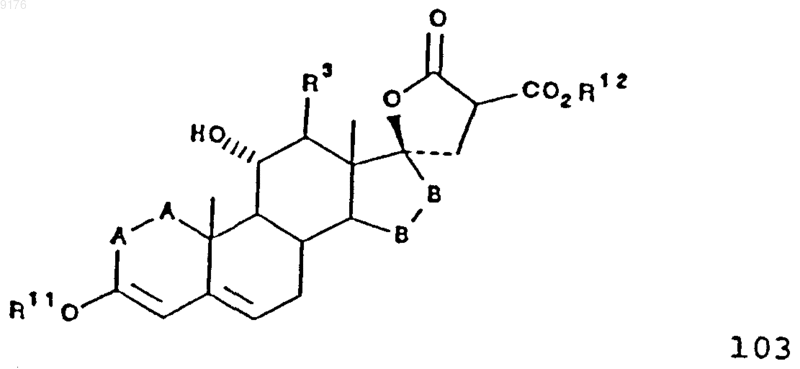
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
102. Соединение формулы 103 по п.101, представляющее собой g-лактон 3-этокси-11a,17a-дигидроксипрегна-3,5-диен-21,21-дикарбоновой кислоты.
103. Соединение формулы
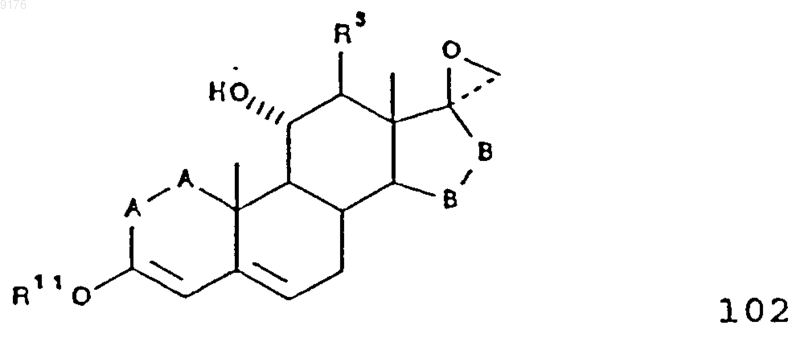
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
104. Соединение формулы 102 по п.103, представляющее собой 3-этоксиспиро[андрост-3,5-диен-17b,2'-оксиран]-11a-ол.
105. Соединение формулы
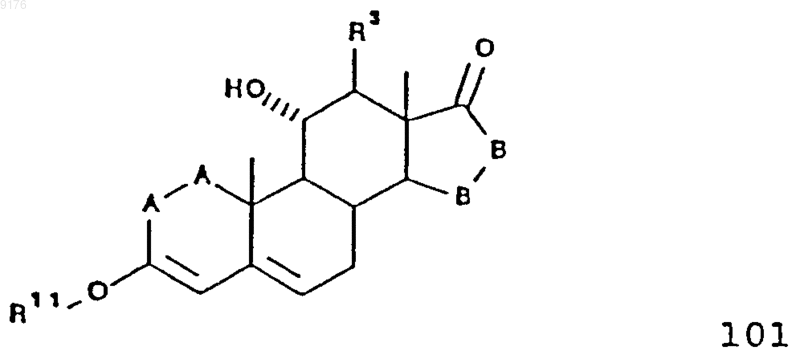
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R11 обозначает C1-C4алкил,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, при том, что, если специально не указано, алкильная часть заместителя содержит от 1 до 6 атомов углерода.
106. Соединение формулы 102 по п.105, представляющее собой 3-этокси-11a-гидроксиандрост-3,5-диен-17-он.
107. Соединение формулы
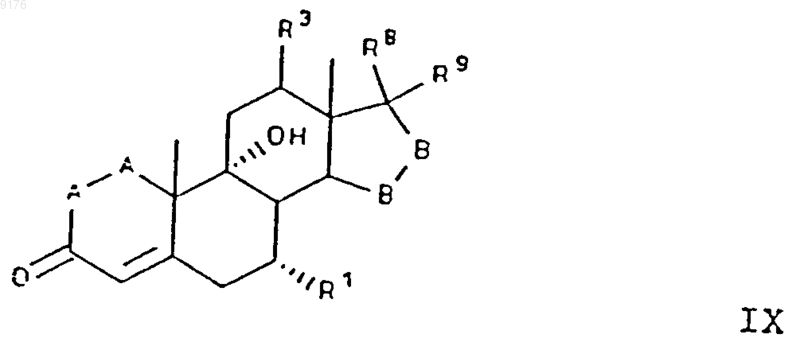
в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,
R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
-B-B- обозначает группу -CHR6-CHR7- либо a- или b-ориентированную группу

где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил, ацилоксиалкил, цианогруппу и арилоксигруппу, и
R8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,
C1-C7алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонилалкил, алкоксикарбонилалкил, ацилоксиалкил, цианогруппу и арилоксигруппу, или
R8 и R9 совместно образуют карбоциклическую или гетероциклическую структуру, или
R8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую структуру, конденсированную с пентациклическим D-кольцом, при том, что, если специально не указано,алкильная часть заместителя содержит от 1 до 6 атомов углерода.
108. Соединение формулы IX по п.107, соответствующее формуле
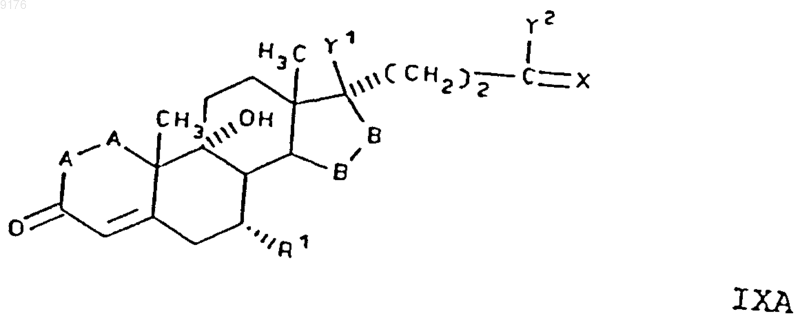
в которой -A-A- обозначает группу -CH2-CH2- или -CH=CH-,
R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, C1-C7алкил, C1-C7алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу и арилоксигруппу,
R1 обозначает a-ориентированный C1-C7алкоксикарбонильный радикал,
-B-B- обозначает группу -CH2-CH2- либо a- или b-ориентированную группу
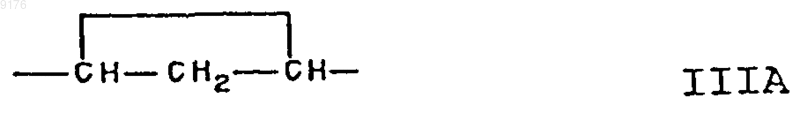
X обозначает два водородных атома или оксогруппу,
Y1 и Y2 совместно обозначают кислородный мостик -O- или
Y1 обозначает гидроксил и
Y2 обозначает гидроксил, C1-C7алкоксигруппу или
если X обозначает Н2, необязательно C1-C7алканоилоксигруппу, а также соли соединений, у которых X обозначает оксогруппу, a Y2 обозначает гидроксил.
Текст
009176 Предпосылки создания изобретения Настоящее изобретение относится к новым способам получения 9,11-эпоксистероидных соединений, прежде всего соединений 20-спироксанового ряда и их аналогов, новых промежуточных продуктов,которые могут быть использованы для получения стероидных соединений, и к способам получения таких новых промежуточных продуктов. В частности, объектом изобретения являются новые и усовершенствованные способы получения -лактона неполного метилового эфира 9,11-эпокси-17-гидрокси-3 оксопрегн-4-е-н-7,21-дикарбоновой кислоты (эплеренон; эпоксимексренон). Способы получения соединений 20-спироксанового ряда описаны в патенте США 4559332 (далее патент '332). Соединения, полученные в соответствии со способом по патенту '332, характеризуются наличием разомкнутого кислородсодержащего кольца Е общей формулы где R6 и R7, каждый, обозначает водород,X обозначает два водородных атома или оксогруппу,Y1 и Y2 совместно обозначают кислородный мостик -O- илиY2 обозначает гидроксил, (низш.)алкоксигруппу или, если X представляет собой Н 2,(низш.)алканоилоксигруппу,и включают также соли таких соединений, в которых X обозначает оксогруппу, a Y2 обозначает гидроксил, т.е. соответствующих 17-гидрокси-21-карбоновых кислот. В патенте США 4559332 описан ряд способов получения эпоксимексренона и родственных соединений формулы IA. Возникновение новой и более широкой области клинического применения эпоксимексренона создает необходимость в разработке усовершенствованных способов получения этого и других родственных стероидов. Краткое изложение сущности изобретения Основной задачей настоящего изобретения является разработка усовершенствованных способов получения эпоксимексренона, других 20-спироксанов и других стероидов, обладающих общими структурными особенностями. Другими задачами изобретения являются, в частности, разработка усовершенствованного способа, осуществление которого позволяет получать с высоким выходом продукты формулы IA и другие родственные соединения, разработка такого способа, который включает минимальное число стадий выделения, и разработка такого способа, который можно осуществлять с приемлемыми капитальными затратами и приемлемыми затратами на стадиях превращения. Таким образом, задачей настоящего изобретения является разработка ряда схем синтеза эпоксимексренона, промежуточных продуктов, которые могут быть использованы при получении эплеренона, и способа синтеза этих новых промежуточных продуктов. Эти новые схемы синтеза подробно представлены в описании предпочтительных вариантов осуществления. Новые промежуточные продукты по настоящему изобретению включают те, которые описаны непосредственно ниже. Соединение формулы IV соответствуют структуре в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, (низш.)алкил, (низш.)алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,-1 009176R2 обозначает уходящую 11-группу, отщепление которой обеспечивает образование двойной связи между 9- и 11-м углеродными атомами,-B-B- обозначает группу -CHR6-CHR7- либо - или -ориентированную группу где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу, иR8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу, илиR8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру, или 8 9R R совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую кольцевую структуру, конденсированную с пентациклическим D-кольцом. Соединение формулы IVA соответствует формуле IV, в которой R8 и R9 совместно с атомом углерода кольца, к которому они присоединены, образуют структуру Соединения формулы IVC, IVD и IVE являются аналогами соединений любой из формул IV, IVA иIVB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, R3 обозначает водород, a R1 обозначает алкоксикарбонил, предпочтительно метоксикарбонил. Соединения формулы IV могут быть получены взаимодействием (низш.)алкилсульфонилирующего или ацилирующего агента или образующего галогенид агента с соответствующим соединением, описываемым формулой V Соединение формулы V имеют структуру где значения -A-A-, -B-B-, R1, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы VA соответствует формуле V, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул VC, VD и VE являются аналогами соединений любой из формул V, VA и VB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, R3 обозначает водород,a R1 обозначает алкоксикарбонил, предпочтительно метоксикарбонил. Соединения формулы V могут быть получены взаимодействием алкоксида щелочного металла с соответствующим соединением фор-2 009176 мулы VI. Соединение формулы VI соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы VIA соответствует формуле VI, в которой R8 и R9 совместно с углеродным атомом кольца, с которым они связаны, образуют структуру Соединения формул VIC, VID и VIE являются аналогами соединений любой из формул VI, VIA иVIB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формул VI, VIA, VIB и VIC получают гидролизом соединений формул VII, VIIA,VIIB и VIIC соответственно. Соединение формулы VII соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы VIIA соответствует формуле VII, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул VIIC, VIID и VIIE являются аналогами соединений любой из формул VII, VIIA и VIIB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы VII могут быть получены цианированием соединений формулы VIII. Соединение формулы VIII соответствует структуре-3 009176 где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы VIIIA соответствует формуле VIII, в которой R8 и R9 совместно с атомом углерода кольца, к которому они присоединены, образуют структуру Соединения формул VIIIC, VIIID и VIIIE являются аналогами соединений любой из формул VIII,VIIIA и VIIIB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы VIII получают окислением субстрата, содержащего соединение формулы XIII, аналогично тому, как это изложено ниже, ферментацией, эффективной для введения 11-гидроксильной группы в субстрат в -ориентации. Соединение формулы XIV соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы XIVA соответствует формуле XIV, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул XIVC, XIVD и XIVE являются аналогами соединений любой из формул XIV,XIVA и XIVB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы XIV могут быть получены гидролизом соответствующего соединения формулы XV. Соединение формулы XV соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы XVA соответствует формуле XV, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул XVC, XVD и XVE являются аналогами соединений любой из формул XV,XVA и XVB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения общей формулы XV могут быть получены цианированием соответствующего соединения общей формулы XVI. Соединение формулы XXI соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы XXIA соответствует формуле XXI, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул XXIC, XXID и XXIE являются аналогами соединений любой из формул XXI,XXIA и XXIB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения общей формулы XXI могут быть получены гидролизом соответствующего соединения общей формулы XXII. Соединение формулы XXII соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы XXIIA соответствует формуле XXII, в которой R8 и R9 совместно с углеродным атомом кольца, к которому они присоединены, образуют структуру Соединения формул XXIIC, XXIID и XXIIE являются аналогами соединений любой из формулR3 обозначает водород. Соединения общей формулы XXII могут быть получены цианированием соединения общей формулы XXIII. Соединение формулы XXIII соответствует структуре где значения -A-A-, -B-B-, R3, R8 и R9 аналогичны указанным для формулы IV. Соединение формулы XXIIIA соответствует формуле XXIII, в которой R8 и R9 совместно с атомом углерода кольца, с которым они связаны, образуют структуру Соединения формул XXIIIC, XXIIID и XXIIIE являются аналогами соединений любой из формулXXIII, XXIIIA и XXIIIB соответственно, в которых -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-,a R3 обозначает водород. Соединения общей формулы XXIII могут быть получены окислением соединения формулы XXIV аналогично тому, как это изложено ниже. Соединение формулы 104 соответствует структуре где значения -A-A-, -B-B- и R3 такие же, как указанные для формулы IV, а R11 обозначает C1-C4 алкил. Соединение формулы 104 А соответствует формуле 104, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения общей формулы 104 могут быть получены термическим разложением соединения формулы 103. Соединение формулы 103 соответствует структуре где -A-A-, -B-B-, R3 и R11 имеют значения, указанные для формулы 104, a R12 обозначает-6 009176 Соединение формулы 103 А соответствуют формуле 103, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы 103 могут быть получены взаимодействием соответствующего соединения формулы 102 с диалкилмалонатом в присутствии основания,такого, как алкоксид щелочного металла. Соединение формулы 102 соответствует структуре где значения -A-A-, -B-B-, R3 и R11 такие же, как указанные для формулы 104. Соединение формулы 102 А соответствует формуле 102, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы 102 могут быть получены взаимодействием соответствующего соединения формулы 101 с триалкилсульфониевым соединением в присутствии основания. Соединение формулы 101 соответствует структуре где -A-A-, -B-B-, R3 и R11 имеют значения, указанные для формулы 104. Соединение формулы 101 А соответствует формуле 101, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Соединения формулы 101 могут быть получены взаимодействием 11-гидроксиандростен-3,17-диона или другого соединения формулы XXXIV с триалкилортоформиатом в присутствии кислоты. Если принять во внимание описание конкретных реакционных схем, которые приведены ниже, то очевидно, какое из этих соединений оказывается наиболее приемлемым для конкретной реакционной схемы. Соединения по настоящему изобретению можно эффективно использовать в качестве промежуточных продуктов для получения эпоксимексренона и других стероидов. Другие объекты и отличительные особенности изобретения отчасти очевидны и отчасти представлены ниже. Краткое описание чертежей На фиг. 1 изображена технологическая схема осуществления способа биоконверсии канренона или канренонового производного в соответствующее 11-гидроксисоединение. На фиг. 2 изображена технологическая схема осуществления предпочтительного варианта способа биоконверсии для 11-гидроксилирования канренона или канреноновых производных. На фиг. 3 изображена технологическая схема осуществления особенно предпочтительного варианта способа биоконверсии продуктов с 11-гидроксилированием канренона или канреноновых производных. На фиг. 4 показано распределение по размерам частиц канренона после их получения в соответствии со способом, представленным на фиг. 2. На фиг. 5 показано распределение по размерам частиц канренона после их стерилизации в биореакторе в соответствии со способом, представленным на фиг. 3. На всех чертежах одинаковые элементы обозначены одинаковыми позициями. Описание предпочтительных вариантов выполнения В соответствии с настоящим изобретением были разработаны различные новые технологические схемы для получения эпоксимексренона и других соединений формулы I где -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, (низш.)алкил, (низш.)алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруп-7 009176 пу, арилоксигруппу,R1 обозначает -ориентированный (низш.)алкоксикарбонильный или гидроксикарбонильный радикал,-B-B- обозначает группу -CHR6-CHR7- либо - или -ориентированную группу где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу иR8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу, илиR8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру, илиR8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую кольцевую структуру, сконденсированную с пентациклическим D-кольцом. В настоящем описании во всех случаях, если не указано иное, органические радикалы, которые обозначены как "низшие", соответственно "(низш.)", содержат не более 7, предпочтительно 1-4 атома углерода. Предпочтительный (низш.)алкоксикарбонильный радикал представляет собой радикал, полученный из алкилового радикала, содержащего 1-4 углеродных атома, такого, как метил, этил, пропил, изопропил,бутил, изобутил, втор-бутил и третбутил; особенно предпочтительными являются метоксикарбонил,этоксикарбонил и изопропоксикарбонил. Предпочтительный (низш.)алкоксирадикал представляет собой радикал, дериватизированный из вышеупомянутых C1-C4 алкильных радикалов, прежде всего из первичных C1-C4 алкильных радикалов; особенно предпочтителен метоксирадикал. Предпочтительный(низш.)алканоильный радикал представляет собой радикал, дериватизированный из прямоцепочечного алкила, содержащего 1-7 углеродных атомов; особенно предпочтительны формил и ацетил. В предпочтительном варианте метиленовый мостик в положении 15, 16 является-ориентированным. Предпочтительный класс соединений, которые могут быть получены в соответствии со способами по изобретению, составляют 20-спироксановые соединения, описанные в патенте США 4559332, т.е. соединения формулы IAR1 обозначает -ориентированный (низш.)алкоксикарбонильный или гидроксикарбонильный радикал,X обозначает два водородных атома, оксогруппу или =S,Y1 и Y2 совместно обозначают кислородный мостик -O- или(низш.)алканоилоксигруппу. Предпочтительные 20-спироксановые соединения, получаемые согласно новым способам по изобретению, представляют собой соединения формулы I, у которых Y1 и Y2 совместно обозначают кислородный мостик -O-. Особенно предпочтительными соединениями формулы I являются такие, у которых X обозначает оксогруппу. Из представителей 20-спироксановых соединений формулы IA, у которых X обозначает оксогруппу, наиболее предпочтительны такие, у которых Y1 и Y2 совместно обозначают кислородный мостик -O-. Как уже указано выше, 17-гидрокси-21-карбоновая кислота приемлема также в форме ее солей. При этом особого внимания заслуживают соли металлов и аммония, такие, как соли щелочных металлов и щелочно-земельных металлов, например соли натрия, кальция, магния и, что предпочтительно, калия и-8 009176 соли аммония, полученные с использованием аммиака или приемлемых, предпочтительно физиологически допустимых, органических азотсодержащих оснований. В качестве оснований особого внимания заслуживают не только амины, например (низш.)алкиламины (такие, как триэтиламин), гидрокси(низш.)алкиламины [такие, как 2-гидроксиэтиламин, ди(2-гидроксиэтил)амин и три(2-гидроксиэтил)амин], циклоалкиламины (такие, как дициклогексиламин) и бензиламины (такие, как бензиламин и N,N'дибензилэтилендиамин), но также и азотсодержащие гетероциклические соединения, например соединения ароматического характера (такие, как пиридин и хинолин), и соединения, включающие, по меньшей мере частично, замещенное гетероциклическое кольцо (такие, как N-этилпиперидин, морфолин, пиперазин и N,N'-диметилпиперазин). Кроме того, предпочтительные соединения включают соли щелочных металлов, прежде всего соли калия, соединений формулы IA, в которых R1 обозначает алкоксикарбонил, X обозначает оксогруппу, aY1 и Y2, каждый, обозначает гидроксил. Особенно предпочтительными соединениями формул I и IA являются, например, следующие: 9,11-эпокси-7-метоксикарбонил-20-спирокс-4-ен-3,21-дион,9,11-эпокси-7-этоксикарбонил-20-спирокс-4-ен-3,21-дион,9,11-эпокси-7-изопропоксикарбонил-20-спирокс-4-ен-3,21-дион и 1,2-дегидроаналог каждого из этих соединений,9,11-эпокси-6,7-метилен-20-спирокс-4-ен-3,21-дион,9,11-эпокси-6,7-метилен-20-спирокс-4-ен-3,21-дион,9,11-эпокси-6,7;15,16-бис-метилен-20-спирокс-4-ен-3,21-дион и 1,2-дегидроаналог каждого из этих соединений,9,11-эпокси-7-метоксикарбонил-17-гидрокси-3-оксопрегн-4-ен-21-карбоновая кислота,9,11-эпокси-7-этоксикарбонил-17-гидрокси-3-оксопрегн-4-ен-21-карбоновая кислота,9,11-эпокси-7-изопропоксикарбонил-17-гидрокси-3-оксопрегн-4-ен-21-карбоновая кислота,9,11-эпокси-17-гидрокси-6,7-метилен-3-оксопрегн-4-ен-21-карбоновая кислота,9,11-эпокси-17-гидрокси-6,7-метилен-3-оксопрегн-4-ен-21-карбоновая кислота,9,11-эпокси-17-гидрокси-6,7;15,16-бис-метилен-3-оксопрегн-4-ен-21-карбоновая кислота и соли щелочных металлов, прежде всего калиевая соль или аммониевая соль каждой из этих кислот, а также соответствующий 1,2-дегидроаналог каждой из упомянутых карбоновых кислот и их солей,метиловый эфир, этиловый эфир и изопропиловый эфир 9,11-эпокси-15,16-метилен-3,21 диоксо-20-спирокс-4-ен-7-карбоновой кислоты,метиловый эфир, этиловый эфир и изопропиловый эфир 9,11-эпокси-15,16-метилен-3,21 диоксо-20-спирокса-1,4-диен-7-карбоновой кислоты,метиловый эфир, этиловый эфир и изопропиловый эфир 9,11-эпокси-3-оксо-20-спирокс-4-ен-7 карбоновой кислоты,9,11-эпокси-6,7-метилен-20-спирокс-4-ен-3-он,9,11-эпокси-6,7;15,16-бис-метилен-20-спирокс-4-ен-3-он,а также метиловый эфир, этиловый эфир и изопропиловый эфир 9,11-эпокси-17-гидрокси-17(3-гидроксипропил)-3-оксоандрост-4-ен-7-карбоновой кислоты,9,11-эпокси-17-гидрокси-17-(3-гидроксипропил)-6,7-метиленандрост-4-ен-3-он,9,11-эпокси-17-гидрокси-17-(3-гидроксипропил)-6,7-метиленандрост-4-ен-3-он,9,11-эпокси-17-гидрокси-17-(3-гидроксипропил)-6,7;15,16-бис-метиленандрост-4-ен-3 он,включая 17-3-ацетоксипропиловые и 17-3-формилоксипропиловые аналоги упомянутых андростановых соединений, а также 1,2-дегидроаналоги всех упомянутых соединений андрост-4-ен-3-онового и 20-спирокс-4-ен-3-онового рядов. Химические названия соединений формул I и IA и аналогичных соединений, обладающих аналогичными характерными структурными отличиями, образуют в соответствии с современной номенклатурой следующим образом: в случае соединений, у которых Y1 совместно с Y2 обозначает -O-, образуют от названия 20-спироксана (так, например, соединение формулы IA, у которого X обозначает оксогруппу, a Y1 совместно с Y2 обозначает -O-, дериватизируют из 20-спироксан-21-она); в случае соединений, у которых Y1 и Y2, каждый, обозначает гидроксил, а X обозначает оксогруппу,образуют от названия 17-гидрокси-17-прегнен-21-карбоновой кислоты; в случае соединений, у которых Y1 и Y2, каждый, обозначает гидроксил, а X обозначает два водородных атома, образуют от названия 17-гидрокси-17-(3-гидроксипропил)андростана. Поскольку циклические формы и формы с разомкнутыми циклами, т.е. соответственно лактоны и 17-гидрокси-21-карбоновые кислоты, а также их соли, настолько родственны между собой, что эти последние можно рассматривать просто как гидратированные формы этих первых, все упомянутые формы,идет ли речь о конечных продуктах формулы I или об исходных материалах и промежуточных продуктах-9 009176 аналогичного строения, в каждом случае, если конкретно не указано иное, как в предыдущей части настоящего описания, так и в дальнейшем необходимо воспринимать в совокупности. В соответствии с изобретением для получения соединений формулы I с высоким выходом продукта при приемлемой себестоимости было разработано несколько самостоятельных технологических схем. Осуществление каждой из этих схем синтеза включает получение ряда промежуточных продуктов. Некоторые из этих промежуточных продуктов являются новыми соединениями, а способы получения этих полупродуктов являются новыми способами. Схема 1(с использованием в качестве сырья канренона или родственного вещества) Согласно одной из предпочтительных технологических схем получения соединений формулы I процесс целесообразно начинать с канренона или родственного исходного вещества формулы XIII в которой -A-A- обозначает группу -CHR4-CHR5- или -CR4=CR5-,R3, R4 и R5 независимо друг от друга выбирают из группы, включающей водород, галоген, гидроксил, (низш.)алкил, (низш.)алкоксигруппу, гидроксиалкил, алкоксиалкил, гидроксикарбонил, цианогруппу, арилоксигруппу,-B-B- обозначает группу -CHR6-CHR7- либо - или -ориентированную группу где R6 и R7 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу иR8 и R9 независимо друг от друга выбирают из группы, включающей водород, галоген,(низш.)алкоксигруппу, ацил, гидроксиалкил, алкоксиалкил, гидроксикарбонил, алкил, алкоксикарбонил,ацилоксиалкил, цианогруппу, арилоксигруппу, илиR8 и R9 совместно образуют карбоциклическую или гетероциклическую кольцевую структуру, илиR8 либо R9 совместно с R6 или с R7 образуют карбоциклическую или гетероциклическую кольцевую структуру, конденсированную с пентациклическим D-кольцом. С помощью способа биоконверсии такого типа, как проиллюстрированный на фиг. 1 и 2, в соединение формулы XIII вводят 11-гидроксигруппу с -ориентацией, получая таким образом соединение формулы VIII где значения -A-A-, -B-B-, R3, R8 и R9 указаны выше. В предпочтительном варианте соединение формулы XIII соответствует структуре в каждой из которых -A-A- обозначает группу -CH2-CH2- или -CH=CH-,-B-B- обозначает группу -CH2-CH2- либо - или -ориентированную группуX обозначает два водородных атома, оксогруппу или =S,Y1 и Y2 совместно обозначают кислородный мостик -O- или где -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы XIIIA. В более предпочтительном варианте R8 и R9 совместно образуют 20-спироксановую структуру где -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, a R3 обозначает водород. Предпочтительные микроорганизмы, которые можно использовать на этой стадии гидроксилирования, включаютTrichothecium roseum ATCC 12543. Другие предпочтительные организмы включают Fusarium oxysporum f. sp. cepae ATCC 11171 иRhizopus arrhizus ATCC 11145. Помимо перечисленных, группа организмов, которые проявляют действие в отношении этой реакции, включаетVerticillium theobromae ATCC 12474. Кроме того, проявление действия в отношении 11-гидроксилирования можно ожидать от микроорганизмов, к которым относятсяRhizopus nigricans [J. Steroid Biochem. (1987), 28 (2), 197-201]. Перед началом ферментации в производственном масштабе с целью гидроксилирования канренона или других субстратов формулы XIII в ферментационной системе для выращивания посевного материала, включающей ферментер для выращивания посевного материала или ряд из двух или большего числа таких ферментеров, готовят инокулят. В первый ферментер для выращивания посевного материала совместно с питательным раствором для выращивания клеток вводят суспензию спор рабочего экземпляра культуры. Если необходимый для процесса объем инокулята превышает тот, который получают в первом ферментере для выращивания посевного материала, этот объем можно постепенно и в геометрической прогрессии увеличить последовательным проведением процесса в остальных ферментерах линии наработки посевного материала. В предпочтительном варианте инокулят, получаемый в ферментационной системе для выращивания посевного материала, представляет собой массу жизнеспособных клеток, достаточную для достижения быстрого инициирования реакции в рабочем ферментере, относительно коротких циклов периодического процесса и высокой рабочей эффективности ферментера. Независимо от числа сосудов в цепи ферментеров для выращивания посевного материала в предпочтительном варианте размеры второго и последующих ферментеров должны быть такими, чтобы степень разбавления на каждом этапе этой линии была практически одинаковой. Начальная степень разбавления инокулята в каждом ферментере для выращивания посевного материала может быть приблизительно такой же, как и степень разбавления в рабочем ферментере. В рабочий ферментер совместно с инокулятом и питательным раствором загружают канренон или другой субстрат формулы XIII и проводят в нем реакцию гидроксилирования. Суспензию спор, загружаемую в ферментационную систему для выращивания посевного материала, извлекают из содержащей суспензию спор рабочего экземпляра культуры пробирки, взятой из множества пробирок, которые образуют банк клеток рабочих экземпляров культур и которые до применения хранят в криогенных условиях. В свою очередь банк клеток рабочих экземпляров культур получают из банка клеток штамма хозяина, который готовят следующим образом. Образец спор, полученный из соответствующего источника, например из Американской коллекции типовых культур, вначале суспендируют в водной среде, например, такой, как солевой раствор, питательный раствор или раствор поверхност- 12009176 но-активного вещества (в частности, неионогенного поверхностно-активного вещества, такого, как продукт Твин 20, в концентрации приблизительно 0,001 мас.%), и эту суспензию распределяют по культуральным чашкам, в каждой из которых содержится твердая питательная смесь, как правило, на основе неусвояемого полисахарида, такого, как агар, на которой споры размножаются. Предпочтительная твердая питательная смесь включает примерно от 0,5 до примерно 5 мас.% глюкозы, примерно от 0,05 до примерно 5 мас.% источника азота, например пептона, примерно от 0,05 до примерно 0,5 мас.% источника фосфора, например фосфата аммония или щелочного металла, такого, как вторичный кислый фосфат калия, примерно от 0,25 до примерно 2,5 мас.% лизата дрожжевых клеток или дрожжевого экстракта(или другого источника аминокислот, такого, как мясной экстракт или вытяжка из вещества срединного головного мозга), примерно от 1 до примерно 2 мас.% агара или другого неусвояемого полисахарида. Твердая питательная смесь может, но необязательно, далее включать и/или содержать примерно от 0,1 до примерно 5 мас.% солодового экстракта. Предпочтительные значения pH твердой питательной смеси,которые доводят до необходимого уровня добавлением гидроксида щелочного металла или ортофосфорной кислоты, находятся примерно от 5 до примерно 7. Для выращивания могут быть использованы, помимо прочих, следующие твердые среды. 1. Твердая среда 1: 1% глюкозы, 0,25% дрожжевого экстракта, 0,3% K2HPO4 и 2% агара (фирмыBacto); pH доводят до 6,5 добавлением 20% NaOH. 2. Твердая среда 2: 2% пептона (фирмы Bacto), 1% дрожжевого экстракта, 2% глюкозы и 2% агара (фирмы Bacto); pH доводят до 5 добавлением 10% H3PO4. 3. Твердая среда 2: 0,1% пептона (фирмы Bacto), 2% солодового экстракта (фирмы Bacto),2% глюкозы и 2% агара (фирмы Bacto); значение pH составляет 5,3. 4. Жидкая среда: 5% тростниковой мелассы, 0,5% кукурузного экстракта, 0,25% глюкозы,0,25% NaCl и 0,5% KH2PO4; pH доводят до 5,8. 5. Микологический агар Difco (с низким значением pH). Число агаровых чашек, используемых для создания банка клеток штамма хозяина, можно выбирать с учетом будущих потребностей в клетках штамма хозяина, но, как правило, таким путем готовят примерно от 15 до примерно 30 чашек. По прошествии приемлемого периода роста, например 7-10 дней,чашки освобождают выскабливанием в присутствии водного носителя, как правило, солевого или буферного раствора, собирая выращенные споры, и получаемую суспензию клеток штамма хозяина разделяют по маленьким пробиркам, например по 1 мл в каждой из множества 1,5-миллилитровых пробирок. С целью приготовить суспензию спор рабочего экземпляра культуры для использования в исследованиях или технологических процессах ферментации содержимое одной или нескольких из этих пробирок со спорами штамма хозяина второго поколения можно распределить между агаровыми чашками и инкубировать согласно тому, как это описано для приготовления суспензии клеток штамма хозяина. Когда планируют проведение обычных технологических процессов, для получения рабочего экземпляра культуры второго поколения может быть использовано 100-400 чашек. Содержимое каждой чашки выскабливают в отдельную пробирку с рабочим экземпляром культуры, причем каждая пробирка, как правило, содержит 1 мл полученного инокулята. При постоянной консервации как суспензию клеток штамма хозяина, так и рабочий инокулят второго поколения целесообразно хранить в паровом пространстве криогенного сосуда, содержащего жидкий N2 или другую криогенную жидкость. При осуществлении способа, проиллюстрированного на фиг. 1, готовят водную среду для выращивания, которая включает источник азота, такой, как пептон, дрожжевой продукт или эквивалент, глюкозу и источник фосфора, такой, как фосфатная соль. В такой среде в системе для выращивания посевного материала культивируют споры микроорганизма. Предпочтительным микроорганизмом является Aspergillus ochraceus NRRL 405 (ATCC 18500). Далее полученный таким образом расходный посевной материал совместно с субстратом формулы XIII вводят в рабочий ферментер. Культуральную жидкость перемешивают и аэрируют в течение времени, достаточного для достижения необходимой степени завершения реакции. Предпочтительная среда, вводимая в ферментер для выращивания посевного материала, представляет собой водную смесь, которая включает примерно от 0,5 до примерно 5 мас.% глюкозы, примерно от 0,05 до примерно 5 мас.% источника азота, например пептона, примерно от 0,05 до примерно 0,5 мас.% источника фосфора, например фосфата аммония или щелочного металла, такого, как первичный кислый фосфат аммония или вторичный кислый фосфат калия, примерно от 0,25 до примерно 2,5 мас.% лизата дрожжевых клеток или дрожжевого экстракта (или другого источника аминокислот, такого, как барда),примерно от 1 до примерно 2 мас.% агара или другого неусвояемого полисахарида. Особенно предпочтительная среда для выращивания посевного материала включает примерно от 0,05 до примерно 5 мас.% источника азота, такого, как пептон, примерно от 0,25 до примерно 2,5 мас.% дрожжевого автолизата или дрожжевого экстракта, примерно от 0,5 до примерно 5 мас.% глюкозы и примерно от 0,05 до примерно 0,5 мас.% источника фосфора, такого, как первичный кислый фосфат аммония. Особенно экономически выгодные технологические процессы проводят с использованием другой предпочтительной посевной культуры, которая включает от 0,5 до примерно 5 мас.% кукурузного экстракта, примерно от 0,25 до примерно 2,5 мас.% дрожжевого автолизата или дрожжевого экстракта, при- 13009176 мерно от 0,5 до примерно 5 мас.% глюкозы и примерно от 0,05 до примерно 0,5 мас.% первичного кислого фосфата аммония. Кукурузный экстракт является особенно экономичным источником белков, пептидов, углеводородов, органических кислот, витаминов, ионов металлов, микроэлементов и фосфатов. Вместо кукурузного экстракта или в дополнение к нему могут быть использованы сусла из других злаковых культур. В предпочтительном варианте значение pH среды поддерживают примерно от 5 до примерно 7, например, добавлением гидроксида щелочного металла или ортофосфорной кислоты. Когда источником азота и углерода служит кукурузный экстракт, pH предпочтительно доводить до интервала примерно от 6,2 до примерно 6,8. Значения pH среды, содержащей пептон и глюкозу, предпочтительно поддерживать примерно от 5,4 до примерно 6,2. Для наработки посевного материала могут быть использованы, помимо прочих,следующие среды. 1. Среда 1: 2% пептона, 2% дрожжевого автолизата (или дрожжевого экстракта) и 2% глюкозы;pH доводят до 5,8 добавлением 20% NaOH. 2. Среда 2: 3% кукурузного экстракта, 1,5% дрожжевого экстракта, 0,3% первичного кислого фосфата аммония и 3% глюкозы; pH доводят до 6,5 добавлением 20% NaOH. Споры микроорганизма вводят в эту среду из пробирки, содержащей, как правило, примерно 109 спор на 1 мл суспензии. Оптимальной продуктивности поколения семенного материала достигают тогда,когда начальное разбавление посевной культуры средой для выращивания не уменьшает плотности популяции спор до уровня ниже приблизительно 107/мл. В предпочтительном варианте споры культивируют в системе для наработки посевного материала до тех пор, пока объем уплотненных мицелиев (ОУМ) в ферментере для выращивания посевного материала не достигнет по меньшей мере 20%, предпочтительно 35-45%. Поскольку цикл в сосуде ферментера для наработки посевного материала (или любом сосуде из множества, которое включает линия ферментеров для наработки посевного материала) зависит от начальной концентрации в этом сосуде, для ускорения процесса в целом может возникнуть необходимость в осуществлении двух или трех стадий наработки посевного материала. Однако предпочитают избегать применения значительно больше трех последовательно установленных ферментеров для наработки посевного материала, поскольку в случае, если наработку посевного материала осуществляют чрезмерным числом стадий, это может негативно сказаться на активности. Наработку посевной культуры проводят с перемешиванием при температуре примерно от 23 до примерно 37C, предпочтительно примерно от 24 до примерно 28C. Культуру из системы для наработки посевного материала вводят в рабочий ферментер вместе с рабочей средой для выращивания. В одном из вариантов выполнения изобретения в качестве субстрата для реакции служит канренон или другой субстрат формулы XIII. В предпочтительном варианте субстрат вводят в рабочий ферментер в форме суспензии концентрацией 10-30 мас.% в среде для выращивания. Для увеличения площади поверхности, доступной для реакции 11-гидроксилирования, перед вводом в ферментер уменьшают размеры частиц субстрата формулы XIII пропусканием через микронную коллоидную мельницу, установленную вне технологической линии. Также раздельно вводят стерильную исходную питательную среду, содержащую глюкозу, и второй стерильный питательный раствор, содержащий дрожжевой продукт, такой, как дрожжевой автолизат (или эквивалентную аминокислотную композицию на основе других источников, таких, как барда). Эта среда представляет собой водную смесь, включающую примерно от 0,5 до примерно 5 мас.% глюкозы, примерно от 0,05 до примерно 5 мас.% источника азота, например пептона, примерно от 0,05 до примерно 0,5 мас.% источника фосфора, например фосфата аммония или щелочного металла, такого,как вторичный кислый фосфат калия, примерно от 0,25 до примерно 2,5 мас.% лизата дрожжевых клеток или дрожжевого экстракта (или другого источника аминокислот, такого, как барда), примерно от 1 до примерно 2 мас.% агара или другого неусвояемого полисахарида. Особенно предпочтительная рабочая среда для выращивания включает примерно от 0,05 до примерно 5 мас.% источника азота, такого, как пептон, примерно от 0,25 до примерно 2,5 мас.% дрожжевого автолизата или дрожжевого экстракта,примерно от 0,5 до примерно 5 мас.% глюкозы и примерно от 0,05 до примерно 0,5 мас.% источника фосфора, такого, как первичный кислый фосфат аммония. Другая предпочтительная рабочая среда включает примерно от 0,5 до примерно 5 мас.% кукурузного экстракта, примерно от 0,25 до примерно 2,5 мас.% дрожжевого автолизата или дрожжевого экстракта, примерно от 0,5 до примерно 5 мас.% глюкозы и примерно от 0,05 до примерно 0,5 мас.% первичного кислого фосфата аммония. В предпочтительном варианте pH рабочей ферментационной среды регулируют таким образом, как это описано выше в отношении среды для наработки посевного материала с теми же предпочтительными интервалами значений pH в случае соответственно среды на основе пептона/глюкозы и среды на основе кукурузного экстракта. Ниже представлены среды для выращивания, которые могут быть использованы при биоконверсии. 1. Среда 1: 2% пептона, 2% дрожжевого автолизата (или дрожжевого экстракта) и 2% глюкозы;pH доводят до 5,8 добавлением 20% NaOH. 3. Среда 3: 0,5% пептона, 0,5% дрожжевого автолизата (или дрожжевого экстракта) и 0,5% глюкозы; pH доводят до 5,8 добавлением 20% NaOH. 4. Среда 4: 3% кукурузного экстракта, 1,5% дрожжевого экстракта, 0,3% первичного кислого фосфата аммония и 3% глюкозы; pH доводят до 6,5 добавлением 20% NaOH. 5. Среда 5: 2,55% кукурузного экстракта, 1,275% дрожжевого экстракта, 0,255% первичного кислого фосфата аммония и 3% глюкозы; pH доводят до 6,5 добавлением 20% NaOH. 6. Среда 6: 2,1% кукурузного экстракта, 1,05% дрожжевого экстракта, 0,21% первичного кислого фосфата аммония и 3% глюкозы; pH доводят до 6,5 добавлением 20% NaOH. На протяжении всего цикла периодического процесса получения нестерильный канренон и стерильные питательные растворы поэтапно вводят в рабочий ферментер в соотношении 5:20, предпочтительно 10:15, более предпочтительно в практически равных количествах. Перед инокуляцией среды для наработки посевного материала субстрат целесообразно вначале вводить в количестве, достаточном для достижения концентрации примерно от 0,1 до примерно 3 мас.%, предпочтительно примерно от 0,5 до примерно 2 мас.%, а затем добавлять периодически, удобно каждые 8-24 ч, до достижения совокупного количества примерно от 1 до примерно 8 мас.%. Когда дополнительные количества субстрата вводят по прошествии каждых 8 ч, общее добавляемое количество может быть несколько меньше, например 0,25-2,5 мас.%, чем в случае, когда субстрат вводят в режиме ежедневной одноразовой добавки. В этом последнем случае может оказаться необходимой совокупная добавка канренона в интервале от 2 до примерно 8 мас.%. В предпочтительном варианте в качестве добавляемой питательной смеси, вводимой во время ферментационной реакции, используют концентрат, например смесь, включающую примерно от 40 до примерно 60 мас.%, стерильной глюкозы и примерно от 16 до примерно 32 мас.% стерильного дрожжевого экстракта или другого стерильного источника дрожжевого продукта (или другого источника аминокислот). Поскольку субстрат, вводимый в показанный на фиг. 1 рабочий ферментер, оказывается нестерильным, для предотвращения роста нежелательных микроорганизмов в ферментационный бульон периодически добавляют антибиотики. Без нежелательного влияния на рост культуры и биоконверсию можно добавлять такие антибиотики, как канамицин, тетрациклин и цефалексин. В предпочтительном варианте их вводят в ферментационный бульон в концентрации, находящейся, например, примерно от 0,0004 до примерно 0,002% в пересчете на общее количество бульона, включая, в частности, в примерно от 0,0002 до примерно 0,0006% канамицинсульфата, примерно от 0,0002 до примерно 0,006% тетрациклингидрохлорида и/или примерно от 0,001 до примерно 0,003% цефалексина также в пересчете на общее количество бульона. Длительность рабочего цикла периодического процесса ферментации, как правило, составляет приблизительно 80-160 ч. Таким образом, порции как субстрата формулы XIII, так и питательных растворов,как правило, добавляют каждые 2-10 ч, предпочтительно каждые 4-6 ч. В систему наработки посевного материала и в рабочий ферментер целесообразно также вводить пеногаситель. В предпочтительном варианте осуществления способа, представленного на фиг. 1, количество инокулята, вводимого в рабочий ферментер, составляет примерно от 0,5 до примерно 7 об.%, более предпочтительно примерно от 1 до примерно 2 об.%, в пересчете на общий объем смеси в ферментере, а концентрацию глюкозы поддерживают примерно от 0,01 до примерно 1,0 мас.%, предпочтительнее примерно от 0,025 до примерно 0,5 мас.%, более предпочтительно примерно от 0,05 до примерно 0,25 мас.%, при периодическом введении добавок, которые предпочтительно составляют примерно от 0,05 до примерно 0,25 мас.% в пересчете на общее количество загружаемого для рабочего цикла материала. Температуру во время ферментации целесообразно регулировать в интервале примерно от 20 до примерно 37C, предпочтительно примерно от 24 до примерно 28C, но во время реакции с целью поддержать объем уплотненных мицелиев (ОУМ) на уровне менее приблизительно 60%, более предпочтительно менее примерно 50%, и таким путем избежать ситуации, когда вязкость ферментационного бульона препятствует удовлетворительному перемешиванию, может возникнуть необходимость снижать температуру, например, ступенчато по 2C. Если растущая биомасса выступает над поверхностью жидкости, остающийся в этой биомассе субстрат может выйти из реакционной зоны и становится недоступным для реакции гидроксилирования. В первые 24 ч ферментационной реакции для оптимальной производительности необходимо добиться ОУМ в интервале 30-50%, предпочтительно 35-45%, но в дальнейшем условия предпочтительно регулируют таким образом, чтобы удержать дальнейший рост в вышеуказанных пределах. Во время реакции pH ферментационной среды поддерживают примерно от 5,0 до примерно 6,5, предпочтительно примерно от 5,2 до примерно 5,8 и перемешивание в ферментере осуществляют при скорости вращения примерно от 400 до примерно 800 об/мин. Содержания растворенного кислорода по меньшей мере приблизительно 10% от концентрации насыщения достигают аэрацией загруженной массы примерно от 0,2 до примерно 1,0 об./об.мин, поддерживая избыточное давление в пространстве ферментера над жидкостью от приблизительно атмосферного до примерно 1,0 бар, наиболее предпочтительно примерно 0,7 бар. При необходимости поддержать минимальное количество растворенного кислорода можно также увеличить ско- 15009176 рость перемешивания. Для ускорения конверсии субстрата содержание растворенного кислорода целесообразно поддерживать на уровне существенно выше 10%, а фактически оно достигает 50%. Для биоконверсии оптимальным является также поддержание pH на уровне 5,50,2. Пенообразование регулируют по мере необходимости добавлением обычного пеногасителя. После введения всего субстрата в предпочтительном варианте реакцию продолжают до тех пор, пока молярное соотношение между продуктом формулы VIII и оставшимся, непрореагировавшим субстратом формулы XIII не достигнет по меньшей мере приблизительно 9:1. Такой конверсии можно достичь в течение указанного выше 80-160-часового цикла периодического процесса. Было установлено, что высокая степень конверсии связана со снижением начального содержания питательных веществ до уровня, который ниже содержания в первоначально загруженной массе, а также с регулированием степени аэрации и скорости перемешивания таким образом, чтобы избежать выплескивания субстрата из жидкой питательной среды. При осуществлении способа, представленного на фиг. 1, после снижения содержания питательных веществ его поддерживают на уровне, который не превышает приблизительно 60%, предпочтительно примерно 50% от содержания в первоначально загруженной массе, тогда как в способах, представленных на фиг. 2 и 3, после снижения содержания питательных веществ его поддерживают на уровне, который не превышает приблизительно 80%, предпочтительно примерно 70% от содержания в первоначально загруженной массе. Предпочтительная степень аэрации не превышает одного объема на объем в минуту, более предпочтительно находится на уровне приблизительно 0,5 об./об.мин, тогда как предпочтительная скорость вращения при перемешивании не превышает 600 об/мин. Особенно предпочтительный способ получения соединения формулы VIII проиллюстрирован на фиг. 2. Предпочтительным микроорганизмом также является Aspergillus ochraceus NRRL 405 (ATCC 18500). При осуществлении этого способа предпочтительная среда для выращивания включает примерно от 0,5 до примерно 5 мас.% кукурузного экстракта, примерно от 0,5 до примерно 5 мас.% глюкозы, примерно от 0,1 до примерно 3 мас.% дрожжевого экстракта и примерно от 0,05 до примерно 0,5 мас.% фосфата аммония. Однако можно также использовать и другие рабочие среды для выращивания, которые представлены в настоящем описании. Посевную культуру готовят, по существу, так, как это изложено в описании способа, показанного на фиг. 1, используя любую среду для наработки посевного материала,представленную в настоящем описании. Суспензию канренона, не обработанного в микронной коллоидной мельнице, или другого субстрата формулы XIII в среде для выращивания готовят в асептических условиях в смесителе, предпочтительно при относительно высокой концентрации субстрата, находящейся примерно от 10 до примерно 30 мас.%. В предпочтительном варианте процесс приготовления в асептических условиях может включать стерилизацию или пастеризацию суспензии после смешения. Все количество стерильной суспензии субстрата, необходимое для периодического процесса получения, вводят в рабочий ферментер в начале процесса или периодическим поэтапным добавлением. Размер частиц субстрата уменьшают мокрым помолом в установленном на технологической линии насосе, который работает с высоким усилием сдвига и служит для подачи суспензии в рабочий ферментер, что позволяет,тем самым, исключить необходимость в применении установленной вне технологической линии микронной коллоидной мельницы. В тех случаях, когда асептические условия обеспечиваются не стерилизацией, а пастеризацией, степень агломерации может быть незначительной, но для позитивного контроля размеров частиц может оказаться необходимой помощь насоса, работающего с высоким сдвигом. Стерильную среду для выращивания и раствор глюкозы вводят в рабочий ферментер практически аналогично тому, как это изложено выше. Перед вводом все компоненты, подаваемые в рабочий ферментер, стерилизуют, исключая таким образом необходимость в использовании антибиотиков. В предпочтительном варианте при осуществлении способа, представленного на фиг. 2, инокулят вводят в рабочий ферментер в количестве, находящемся примерно от 0,5 до примерно 7%, ферментационная температура находится примерно от 20 до примерно 37C, предпочтительно примерно от 24 до примерно 28C, а pH регулируют примерно от 4,4 до примерно 6,5, предпочтительно примерно от 5,3 до примерно 5,5, например, введением газообразного аммиака, водного гидроксида аммония, водного гидроксида щелочного металла или ортофосфорной кислоты. Касательно способа, представленного на фиг. 1, следует отметить, что в предпочтительном варианте для регулирования роста биомассы таким образом, чтобы ОУМ не превышал 55-60%, контролируют температуру. Предпочтительное начальное содержание вводимой глюкозы находится примерно от 1 до примерно 4 мас.%, наиболее предпочтительно 2,5-3,5 мас.%, но в предпочтительном варианте во время ферментации содержанию позволяют медленно опускаться до уровня ниже примерно 1,0 мас.%. Дополнительное количество глюкозы вводят периодически в виде порций примерно от 0,2 до примерно 1,0 мас.% в пересчете на общее количество загружаемой массы с тем, чтобы поддержать концентрацию глюкозы в зоне ферментации в интервале примерно от 0,1 до примерно 1,5 мас.%, предпочтительно примерно от 0,25 до примерно 0,5 мас.%. Совместно с глюкозой можно, но необязательно, вводить источники азота и фосфора. Однако, поскольку все количество канренона загружают в начале периодического процесса, в то же самое время- 16009176 можно также вводить требуемое количество питательных веществ, содержащих азот и фосфор, что по мере протекания реакции позволяет использовать для добавок только раствор глюкозы. Скорость и тип перемешивания могут существенно варьироваться. Массоперенос между твердым субстратом и водной фазой при умеренно интенсивном перемешивании ускоряется. Однако с целью предотвратить разрушение миелина микроорганизмов следует применять мешалку с низкой степенью сдвига. В зависимости от вязкости культуральной жидкости, содержания кислорода и условий перемешивания, которые определяются типом сосуда, конфигурацией лопаток и вращающейся мешалки, оптимальную скорость вращения мешалки варьируют в интервале 200-800 об/мин. Обычно предпочтительная скорость вращения мешалки находится в интервале 350-600 об/мин. В предпочтительном варианте вращающаяся мешалка обеспечивает перекачивание массы в осевом направлении сверху вниз, что способствует хорошему перемешиванию ферментированной биомассы. В предпочтительном варианте массу аэрируют со степенью аэрации примерно от 0,3 до примерно 1,0 об./об.мин, предпочтительно 0,4-0,8 об./об.мин, а избыточное давление в пространстве над жидкостью в ферментере находится примерно от 0,5 до примерно 1,0 бар. В предпочтительном варианте температуру, режим перемешивания и аэрации и обратное давление регулируют таким образом, чтобы поддержать во время биоконверсии концентрацию растворенного кислорода на уровне по меньшей мере приблизительно 10 об.%, продолжительность периодического процесса, как правило, находится примерно от 100 до примерно 140 ч. Хотя принцип осуществления способа, представленного на фиг. 2, основан на раннем введении практически всего количества канренона, очевидно, что процесс роста в культуральной жидкости можно проводить до загрузки основной массы канренона. Определенную порцию канренона можно также, но необязательно, добавлять в рабочую массу позднее. Однако в рабочий ферментер в течение 48 ч после инициирования ферментации обычно следует вводить по меньшей мере приблизительно 75% стерильного канренона. Более того, для ускорения продуцирования фермента (ферментов) для биоконверсии по крайней мере примерно 25 мас.% канренона необходимо вводить в начале ферментации или по меньшей мере в течение первых 24 ч. В другом предпочтительном способе, который проиллюстрирован на фиг. 3, всю загружаемую массу и питательный раствор стерилизуют в рабочем ферментационном сосуде до введения инокулята. Питательные растворы, которые можно использовать, а также предпочтительные среди них, по существу,соответствуют таковым, которые описаны для способа, представленного на фиг. 2. В данном варианте выполнения изобретения сдвиговое действие вращающейся мешалки разрушает агломераты частиц субстрата, которые в противном случае могут образоваться во время стерилизации. Было установлено, что реакция протекает удовлетворительно, если средний размер частиц канренона составляет менее приблизительно 200 мкм и размер по крайней мере 75 мас.% частиц меньше 240 мкм. Установлено также, что применение приемлемой мешалки, например дисковой турбинной мешалки, при адекватной скорости перемешивания, находящейся в интервале 200-800 об/мин, при линейной скорости вращения наконечника по крайней мере приблизительно 400 см/с обеспечивает достижение такой степени сдвига, которой достаточно для поддержания таких размерных характеристик частиц, несмотря на агломерацию, тенденция к которой наблюдается при стерилизации в рабочем ферментере. Остальную часть способа, представленного на фиг. 3, осуществляют практически так же, как в и способе по фиг. 2. Способы, проиллюстрированные на фиг. 2 и 3, обладают некоторыми явными преимуществами перед способом, представленным на фиг. 1. Особое преимущество состоит в возможности использовать дешевую питательную основу, такую, как кукурузный экстракт. Другие преимущества состоят в том, что устраняется необходимость в использовании антибиотиков, в упрощении операций ввода сырья и в возможности стерилизации в массе канренона или другого субстрата формулы XIII. Еще одним особым преимуществом является возможность по ходу реакционного цикла использовать в качестве добавок простой глюкозный раствор вместо сложного питательного раствора. При осуществлении способов, проиллюстрированных на фиг. 1-3, продукт формулы VIII представляет собой твердое кристаллическое вещество, которое совместно с биомассой можно отделить от реакционной питательной среды фильтрованием или низкоскоростным центрифугированием. По другому варианту продукт можно экстрагировать из всей реакционной питательной среды органическими растворителями. Продукт формулы VIII выделяют экстракцией растворителями. Для выделения максимального количества продукта как жидкофазный фильтрат, так и биомассовый фильтровальный пирог или прессованную биомассу из центрифуги экстрагируют растворителем, так как с биомассой обычно связано 95% продукта. Для экстракции, как правило, можно использовать углеводородные, сложноэфирные, хлорированные углеводородные и кетоновые растворители. Предпочтительным растворителем является этилацетат. Другие, как правило, приемлемые растворители включают толуол и метилизобутилкетон. Для экстракции из жидкой фазы может оказаться целесообразным использовать растворитель в объеме, приблизительно равном объему реакционного раствора, с которым его вводят в контакт. Для извлечения продукта из биомассы последнюю суспендируют в растворителе,предпочтительно в большом избытке относительно первоначально загруженного количества субстрата,например 50-100 мл растворителя на 1 г первоначально загруженного количества канренона, и с целью- 17009176 обеспечить переход продукта из полостей и пор биомассы в фазу растворителя. Образовавшуюся суспензию в предпочтительном варианте кипятят с обратным холодильником в течение определенного интервала времени, продолжительность которого составляет от 20 мин до нескольких часов. После этого биомассу удаляют фильтрованием или центрифугированием и в предпочтительном варианте фильтровальный пирог промывают как свежим растворителем, так и деионизированной водой. Далее промывные воду и растворитель объединяют и фазам дают разделиться. Продукт формулы VIII из раствора выделяют кристаллизацией. Для достижения максимального выхода мицелий дважды вводят в контакт со свежим растворителем. После отстаивания с целью обеспечить полноту отделения водной фазы продукт выделяют из фазы растворителя. В наиболее предпочтительном варианте растворитель удаляют в вакууме до тех пор, пока не начинается кристаллизация, а затем концентрированный экстракт охлаждают и выдерживают при температуре 0-20C, предпочтительно примерно от 10 до примерно 15C в течение времени,достаточного для осаждения и роста кристаллов, как правило в течение 8-12 ч. Способы, представленные на фиг. 2 и 3, главным образом последний, являются особенно предпочтительными. Эти способы осуществляют при низкой вязкости, а их осуществление дает возможность четко регулировать технологические параметры, такие, как pH, температура и содержание растворенного кислорода. Более того, при этом без помощи антибиотиков упрощается поддержание стерильных условий. Процесс биоконверсии является экзотермическим, вследствие чего тепло необходимо отводить с помощью рубашки вокруг ферментера или змеевикового холодильника внутри рабочего ферментера. По другому варианту можно предусмотреть циркуляцию реакционной среды через внешний теплообменник. В предпочтительном варианте регулированием расхода вводимого в реактор воздуха в зависимости от данных измерений кислородного потенциала в питательной среде содержание растворенного кислорода поддерживают на уровне по меньшей мере приблизительно 5 об.%, предпочтительнее по крайней мере примерно 10 об.%, что является достаточным для того, чтобы обеспечить энергией реакцию и гарантировать конверсию глюкозы в CO2 и H2O. В предпочтительном варианте pH регулируют примерно от 4,5 до примерно 6,5. В каждом из альтернативных способов 11-гидроксилирования субстрата формулы XIII производительность ограничивается массопереносом из твердого субстрата в водную фазу или к границе между фазами, где, как полагают, протекает реакция. Как указано выше, производительность существенно не ограничивается скоростью массопереноса в том случае, если средний размер частиц субстрата уменьшают до уровня менее приблизительно 300 мкм, а размер по меньшей мере 75 мас.% частиц составляет менее 240 мкм. Однако при осуществлении этих способов производительность можно еще больше повысить в некоторых альтернативных вариантах, в которых обеспечивается загрузка существенной части канренона или другого субстрата формулы XIII в рабочий ферментер в органическом растворителе. В соответствии с одним из вариантов субстрат растворяют в несмешивающемся с водой растворителе и смешивают с водной фазой, содержащей инокулят и среду для выращивания, и поверхностно-активным веществом. К эффективным не смешивающимся с водой растворителям относятся, например, ДМФ,ДМСО, C6-C12 жирные кислоты, C6-C12-н-алканы, растительные масла, сорбитаны и водные растворы поверхностно-активных веществ. При перемешивании этой массы образуется эмульсионная реакционная система, характеризующаяся увеличенной площадью межфазной поверхности для массопереноса субстрата из органической жидкой фазы к реакционным участкам. Второй вариант состоит в изначальном растворении субстрата в смешивающемся с водой растворителе, таком, как ацетон, метилэтилкетон, метанол, этанол и глицерин, в концентрации, которая существенно превышает его растворимость в воде. При повышенной температуре приготовления исходного раствора субстрата повышается растворимость, благодаря чему еще больше увеличивается вводимое в реактор в форме раствора количество субстрата, и в результате возрастает полезная нагрузка реактора. Этот теплый раствор субстрата загружают в рабочий ферментер вместе с относительно холодной водной массой, содержащей среду для выращивания и инокулят. Когда раствор субстрата смешивают с водной средой, происходит осаждение субстрата. Однако в условиях существенного перенасыщения и умеренно интенсивного перемешивания наблюдается превышение скорости образования зародышей кристаллизации над скоростью роста кристаллов, в результате чего возникают очень тонкодисперсные частицы с высокой удельной площадью поверхности. Высокая удельная площадь поверхности способствует массопереносу между жидкой фазой и твердым субстратом. Более того, в присутствии смешивающегося с водой растворителя увеличивается также равновесная концентрация субстрата в водной жидкой фазе. Следовательно, увеличивается производительность. Хотя микроорганизм может не обладать необходимой толерантностью к высокой концентрации органического растворителя в водной фазе, этанол можно эффективно использовать, в частности, в концентрации примерно от 3 до примерно 5 мас.%. Третий вариант состоит в солюбилизации субстрата в водном циклодекстриновом растворе. Примеры циклодекстринов включают включают гидроксипропилциклодекстрин и метилциклодекстрин. Молярное соотношение субстрат/циклодекстрин может составлять примерно от 1:1 до примерно 1:1,5.- 18009176 Далее в асептических условиях смесь субстрат/циклодекстрин можно вводить в реактор для биоконверсии. 11-гидроксиканренон и другие продукты, полученные при осуществлении способа 11 гидроксилирования (формул VIII и VIIIA), являются новыми соединениями, которые можно выделять фильтрованием реакционной среды и экстракцией продукта из биомассы, собранной на фильтрующей среде. Для экстракции могут быть использованы обычные органические растворители, например этилацетат, ацетон, толуол, хлорированные углеводороды и метилизобутилкетон. Далее продукт формулыVIII можно перекристаллизовать из органического растворителя того же типа. Соединения формулы VIII обладают существенной ценностью как промежуточные продукты для получения соединений формулы I и особенно формулы IA. В предпочтительном варианте соединения формулы VIII соответствуют формуле VIIIA, в которой Далее в соответствии со способом, который представлен на схеме 1, в щелочных условиях проводят взаимодействие соединения формулы VIII с источником цианидного иона с получением енаминового соединения формулы VII где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные выше. В случае, когда субстрат соответствует формуле VIIIA, продукт соответствует формуле VIIA где -A-A-, -B-B-, R3, Y1, Y2 и X имеют значения, указанные для формулы XIII. Цианирование 11-гидроксильного субстрата формулы VIII можно проводить путем взаимодействия с источником цианидного иона, такого, как кетонциангидрин, а наиболее предпочтительно ацетонциангидрина, в присутствии основания и соли щелочного металла, наиболее предпочтительно LiCl. По другому варианту цианирование можно осуществлять без циангидрина путем использования цианида щелочного металла в присутствии кислоты. В варианте способа с кетонциангидрином эту реакцию проводят в растворе предпочтительно с использованием апротонного полярного растворителя, такого, как диметилформамид или диметилсульфоксид. Образование енамина требует по меньшей мере 2 моль источника цианидного иона на 1 моль субстрата, а в предпочтительном варианте источник цианида используют в небольшом избытке. Предпочтительным основанием является азотное основание, такое, как диалкиламин, триалкиламин, алканоламин,пиридин и т.п. Однако можно также использовать неорганические основания, такие, как карбонаты щелочных металлов и гидроксиды щелочных металлов. В предпочтительном варианте первоначально субстрат формулы VIII содержится в количестве примерно от 20 до примерно 50 мас.%, а основание содержится в количестве примерно от 0,5 до 2 экв. на 1 экв. субстрата. Температура реакции решающего значения не имеет, но проведение процесса при повышенной температуре повышает производительность. Так, например, в случае, когда в качестве основания используют триэтиламин, реакцию целесообразно проводить в интервале примерно от 80 до примерно 90C. При таких температурах реакция проходит до завершения в течение примерно от 5 до примерно 20 ч. Когда в качестве основания используют диизо- 19009176 пропилэтиламин и реакцию проводят при 105C, эта реакция завершается по истечении 8 ч. К концу реакционного периода растворитель удаляют в вакууме и оставшийся продукт в виде масла растворяют в воде и нейтрализуют до pH 7 разбавленной кислотой, предпочтительно соляной. Продукт из этого раствора выпадает в осадок, после чего его промывают дистиллированной водой и сушат на воздухе. Выделяющийся HCN можно удалить инертным газом и нейтрализовать щелочным раствором. Высушенный осадок растворяют в хлороформе или другом приемлемом растворителе, затем экстрагируют концентрированной кислотой, например 6 н. HCl. Добавлением неорганического основания, предпочтительно гидроксида щелочного металла, экстракт нейтрализуют до pH 7 и охлаждают до температуры на уровне 0C. Полученный осадок промывают и сушат, затем перекристаллизовывают из приемлемого растворителя,например ацетона, с получением продукта формулы VII, приемлемого для использования на следующей стадии данного способа. В другом варианте эту реакцию можно проводить в водном растворителе, включающем смешивающийся с водой органический растворитель, такой, как метанол, или в двухфазной системе, включающей воду и органический растворитель, такой, как этилацетат. В этом варианте продукт можно выделять разбавлением реакционного раствора водой и последующей экстракцией продукта с использованием органического растворителя, такого, как метиленхлорид или хлороформ, после чего проводят обратную экстракцию из такого органического экстракта с использованием концентрированной минеральной кислоты, например 2 н. HCl (см. патент США 3200113). В соответствии с еще одним вариантом реакцию можно проводить в смешивающемся с водой растворителе, таком, как диметилформамид, диметилацетамид, N-метилпирролидон или диметилсульфоксид, после чего полученный реакционный раствор разбавляют водой и сообщают ему щелочную реакцию, например, добавлением карбоната щелочного металла, затем охлаждают до 0-10C, вызывая тем самым осаждение продукта. В предпочтительном варианте эту систему "гасят" гипогалитом щелочного металла или другим реагентом, который эффективно предотвращает выделение цианида. После фильтрования и промывки водой выпавший в осадок продукт приемлем для использования на следующей стадии способа. В соответствии с дополнительным вариантом енаминовый продукт формулы VII может быть получен взаимодействием субстрата формулы VIII в присутствии источника протонов с избытком цианида щелочного металла, предпочтительно NaCN, в водном растворителе, включающем апротонный смешивающийся с водой полярный растворитель, такой, как диметилформамид или диметилацетамид. Предпочтительным источником протонов является минеральная кислота или C1-C5 карбоновая кислота, причем особенно предпочтительна серная кислота. В необычном случае, когда цианирующим реагентом служит LiCN в ДМФ, какая-либо необходимость в дискретном добавлении источника протонов отсутствует. В предпочтительном варианте цианидный ион вводят в реактор в количестве, находящемся примерно от 2,05 до 5 мол. экв. на 1 экв. субстрата. Полагают, что присоединению HCN по 4,5- и 6,7 двойным связям содействует минеральная кислота или другой источник протонов, поэтому в предпочтительном варианте его вводят в количестве по меньшей мере 1 мол. экв. на 1 мол. экв. субстрата, но реакционная система должна сохранять основность, что достигается поддержанием избытка цианида щелочного металла в сравнении с количеством содержащейся кислоты. Реакцию предпочтительнее проводить при температуре по меньшей мере приблизительно 75C, как правило 60-100C, в течение периода примерно от 1 до примерно 8 ч, более предпочтительно примерно от 1,5 до примерно 3 ч. К концу реакционного периода реакционную смесь охлаждают предпочтительно до почти комнатной температуры и полученный енамин осаждают подкислением реакционной смеси и смешением с холодной водой предпочтительно при температуре, близкой к температуре ледяной бани. Полагают, что подкисление вызывает замыкание 17-лактона, который проявляет тенденцию к размыканию цикла при превалировании основных условий во время цианирования. Реакционную смесь целесообразно подкислять с использованием той же самой кислоты, которая использовалась во время реакции, предпочтительно серной кислоты. В предпочтительном варианте воду добавляют в пропорции примерно от 10 до примерно 50 мол. экв. на 1 моль продукта. Соединения формулы VII являются новыми соединениями и обладают существенной ценностью как промежуточные продукты для получения соединений формулы I, прежде всего формулы IA. Предпочтительные соединения формулы VII соответствуют формуле VIIA, в которой -A-A- и -B-B-, каждый,обозначает группу -CH2CH2-, R3 обозначает водород, (низш.)алкил или (низш.)алкоксигруппу, a R8 и R9 совместно образуют 20-спироксановое кольцо Наиболее предпочтительным соединением формулы- 20009176 На следующей стадии схемы 1 синтеза енамин формулы VII гидролизуют с получением дикетонового соединения формулы VI где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные для формулы VIII. Для гидролиза можно использовать любую водную органическую или минеральную кислоту. Предпочтительна соляная кислота. С целью повысить производительность в предпочтительном варианте в качестве сорастворителя используют смешивающийся с водой органический растворитель, такой, как низший спирт. Кислота должна содержаться в пропорции по меньшей мере 1 экв. на 1 экв. субстрата формулы VII. В водной системе енаминовый субстрат формулы VII при примерно 80C в течение приблизительно 5 ч можно практически полностью превратить в дикетон формулы VII. Проведение процесса при повышенной температуре повышает производительность, но температура решающего значения не имеет. Приемлемую температуру выбирают, основываясь на летучести системы растворителя и кислоты. В предпочтительном варианте енаминовый субстрат формулы VII соответствует формуле а дикетоновый продукт соответствует формуле в каждой из которых -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы VIIIA. По истечении реакционного периода раствор охлаждают до 0-25C с целью кристаллизации продукта. Полученные кристаллы можно перекристаллизовать из приемлемого растворителя, такого, как изопропанол или метанол, с получением продукта формулы VI, который можно использовать на следующей стадии способа, но перекристаллизация обычно не обязательна. Продукты формулы VI являются новыми соединениями, которые обладают существенной ценностью как промежуточные продукты для получения соединений формулы I, а особенно формулы IA. Предпочтительные соединения формулы VI соответствуют формуле VIA, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, R3 обозначает водород, (низш.)алкил или (низш.)алкоксигруппу, a R8 и R9 совместно образуют 20-спироксановое кольцо Наиболее предпочтительным соединением формулы VI является 4'S(4'),7'-гексадекагидро-11'гидрокси-10',13'-диметил-3',5,20'-триоксоспирофуран-2(3H),17'(4,7)метано[17 Н]циклопента[а]фенантрен-5(2'Н)карбонитрил. В особенно предпочтительном варианте выполнения изобретения являющийся продуктом енамин формулы VII получают из соединения формулы VIII таким путем, который описан выше, и in situ пре- 21009176 вращают в дикетон формулы VI. В этом варианте выполнения изобретения проводят взаимодействие субстрата формулы VIII с избытком цианида щелочного металла в водном растворителе, содержащем источник протонов, или, что необязательно, с избытком кетонциангидрина в присутствии основания иLiCl, как это описано выше. Однако в предпочтительном варианте вместо охлаждения реакционной смеси, подкисления и добавления воды в пропорциях, рассчитанных с тем, чтобы вызвать осаждение енамина, избегают существенного охлаждения реакционной смеси. В смесь в конце реакции цианирования добавляют воду и кислоту, предпочтительно минеральную кислоту, такую, как серная, в количестве, достаточном для нейтрализации избытка цианида щелочного металла, для чего обычно требуется введение по меньшей мере 1 мол. экв. кислоты на 1 моль субстрата формулы VIII, предпочтительно примерно от 2 до примерно 5 мол. экв. на 1 экв. субстрата. При этом температуру поддерживают на достаточно высоком уровне, а степень разбавления увеличивают достаточно для того, чтобы избежать существенного осаждения и обеспечить возможность гидролиза енамина до дикетона в жидкой фазе. Таким образом,процесс проходит с минимальными препятствиями и высокой производительностью. В предпочтительном варианте гидролиз проводят при температуре по меньшей мере 80C, более предпочтительно в интервале примерно от 90 до примерно 100C в течение периода времени, продолжительность которого,как правило, составляет примерно от 1 до примерно 10 ч, более предпочтительно примерно от 2 до примерно 5 ч. Затем реакционную смесь охлаждают предпочтительно до температуры примерно от 0 до примерно 15C, целесообразно в ледяной бане до температуры примерно от 5 до примерно 10C с целью осаждения получаемого дикетона формулы VI. Твердый продукт можно выделить, в частности, фильтрованием, а примеси удалить промывкой водой. На следующей стадии схемы 1 синтеза проводят взаимодействие дикетонового соединения формулы VI с алкоксидом металла с целью размыкания кетонового мостика между 4- и 7-м положениями, разрыва связи между карбонильной группой и 4-м углеродным атомом, образования -ориентированного алканоилоксикарбонильного заместителя в 7-м положении и удаления цианида в 5-м положении. Продуктом этой реакции является гидроксиэфирное соединение, соответствующее формуле V где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные для формулы VIII, а R1 обозначает(низш.)алкоксикарбонил или гидроксикарбонил. Используемый для этой реакции алкоксид металла соответствует формуле R10OM, где M обозначает щелочной металл, a R10O - соответствует алкоксизаместителю при R1. Выход продукта в результате этой реакции оказывается наиболее удовлетворительным, когда алкоксид металла представляет собой метоксид калия или натрия, но могут быть использованы и другие (низш.)алкоксиды. Алкоксид калия особенно предпочтителен. Могут быть также использованы феноксиды, другие арилоксиды, равно как и арилсульфиды. Реакцию целесообразно проводить в среде спирта, соответствующего формуле R10OM,где значение R10 указано выше. Можно использовать другие обычные растворители. В предпочтительном варианте соединение формулы VI содержится в пропорции, находящейся примерно от 2 до примерно 12 мас.%, более предпочтительно по меньшей мере приблизительно 6 мас.%, a R10OM содержится в количестве, находящемся примерно от 0,5 до примерно 4 моль на 1 моль соединения. Температура решающего значения не имеет, но при повышенной температуре производительность возрастает. Продолжительность реакции, как правило, составляет примерно от 4 до примерно 24 ч, предпочтительно примерно от 4 до 16 ч. В зависимости от конкретно используемого растворителя эту реакцию целесообразно проводить при температуре кипения под атмосферным давлением с обратным холодильником. В процессе конверсии дикетона формулы VI в гидроксиэфир формулы VI, получаемый в качестве побочного продукта, цианидный ион способен взаимодействовать с продуктом с образованием 5-цианоэфира. Поскольку равновесие более устойчиво при низких концентрациях, в предпочтительном варианте эту реакцию проводят при довольно высокой степени разбавления, например, достигающей 40:1 в случае взаимодействия с метоксидом Na. Было установлено, что заметно более высокой производительности можно добиться с использованием не метоксида натрия, а метоксида калия, поскольку, когда в качестве реагента используют метоксид калия, разбавление на уровне приблизительно 20:1 обычно оказывается достаточным для сведения к минимуму степени обратного цианирования. При создании изобретения было, кроме того, установлено, что реакцию обратного цианирования можно ингибировать с помощью соответствующих химических или физических методов удаления из реакционной зоны образующегося в качестве побочного продукта цианидного иона. Таким образом, в еще одном варианте выполнения изобретения взаимодействие дикетона с алкоксидом щелочного металла можно проводить в присутствии осадителя для цианидного иона, например, такого, как соль, включающая катион, который образует нерастворимое цианидное соединение. Такие соли могут, например,- 22009176 включать йодид цинка, сульфат трехвалентного железа и, по существу, любую галогенидную, сульфатную и другие соли щелочно-земельных и переходных металлов, которые более растворимы, чем соответствующий цианид. Если йодид цинка содержится в количестве, приблизительно равном 1 экв. на 1 экв. дикетонового соединения, то согласно наблюдениям производительность реакции существенно возрастает в сравнении с производительностью процесса, проводимого в отсутствии галогенида щелочного металла. Даже когда для удаления цианидного иона используют осадитель, преимущество проведения процесса при довольно высокой степени разбавления сохраняется, но при применении осадителя молярное соотношение между растворителем и дикетоновым соединением можно существенно снизить в сравнении с соотношением во время реакций, проводимых в отсутствии такого агента. Выделение гидроксиэфира формулы V можно осуществлять в соответствии с любым из описанных ниже экстракционных и неэкстракционных методов. В предпочтительном варианте дикетоновое соединение формулы VI соответствует формуле а гидроксиэфирный продукт соответствует формуле в каждой из которых -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы XIIIA, а значенияR1 аналогичны указанным для формулы V. Продукты формулы V являются новыми соединениями, которые обладают существенной ценностью как промежуточные продукты для получения соединений формулы I, прежде всего формулы IA. Предпочтительные соединения формулы V соответствуют формуле VA, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, R3 обозначает водород, (низш.)алкил или (низш.)алкоксигруппу, a R8 и R9 совместно образуют 20-спироксановое кольцо Наиболее предпочтительным соединением формулы V является -лактон неполного метилового эфира 11,17-дигидрокси-3-оксопрегн-4-ен-7,21-дикарбоновой кислоты. Соединение формулы V может быть выделено подкислением реакционного раствора, например концентрированной HCl, охлаждением до комнатной температуры и экстракцией продукта органическим растворителем, таким, как метиленхлорид или этилацетат. Экстракт промывают водным промывным щелочным раствором, сушат и фильтруют, после чего растворитель удаляют. По другому варианту реакционный раствор, содержащий продукт формулы V, можно нейтрализовать концентрированной кислотой. Получаемый раствор концентрируют, охлаждают до 0-25C и получаемое твердое вещество выделяют фильтрованием. В соответствии с предпочтительным вариантом выделения продукта формулы V метанол и HCN удаляют перегонкой после истечения реакционного периода, причем перед перегонкой или во время нее добавляют воду и кислоту. Добавление воды перед перегонкой упрощает проведение операций, но постепенное добавление во время перегонки позволяет сохранять практически постоянный объем. По мере протекания перегонки из кубовых остатков кристаллизуется продукт формулы V. Осуществление такого способа выделения обеспечивает возможность получения высококачественного кристаллического продукта без операций экстракции. В соответствии с еще одним вариантом реакционный раствор, содержащий продукт формулы V,можно нейтрализовать минеральной кислотой, например 4 н. HCl, после чего перегонкой удаляют растворитель. При удалении растворителя обеспечивается также удаление из реакционного продукта оста- 23009176 точного количества HCN. Было установлено, что, когда, как это отмечено в настоящем описании, в качестве промежуточного продукта в процессе получения эпоксимексренона используют соединение формулы V, многочисленные экстракции растворителями для очистки соединения формулы V становятся необязательными. Действительно, такие экстракции часто можно полностью исключить. Когда для очистки продукта проводят экстракцию растворителями, промывки растворителями необходимо дополнять промывкой рассолом и щелочными промывками. Но, когда экстракции растворителями исключают, исключают также промывки рассолом и щелочами. Исключение экстракций и промывок заметно улучшает производительность процесса без ущерба для выхода или качества продукта, а также устраняет потребность в сушке промытого раствора осушителем, таким, как сульфат натрия. Сырой 11-гидрокси-7 алкоксикарбонильный продукт вновь растворяют растворителем на последующей стадии способа, которой является конверсия 11-гидроксильной группы в легко отщепляемую группу в 11-м положении, в результате чего образуется соединение формулы IV в которой значения -A-A-, R3, -B-B-, R8 и R9 аналогичны указанным для формулы VIII, значения R1 аналогичны указанным для формулыR2 обозначает арилсульфонилоксигруппу,(низш.)алкилсульфонилоксигруппу, ацилоксигруппу или галогенид. В предпочтительном варианте 11-гидроксил этерифицируют взаимодействием с низшим алкилсульфонилгалогенидом, ацилгалогенидом или ангидридом карбоновой кислоты, который добавляют в раствор, содержащий промежуточный продукт формулы V. Предпочтительны(низш.)алкилсульфонилгалогениды и особенно метансульфонилхлорид. По другому варианту 11-гидроксильную группу можно превратить в галоидную взаимодействием с приемлемым реагентом,таким, как тионилбромид, тионилхлорид, сульфурилхлорид и оксалилхлорид. Другие реагенты для получения эфиров 11-сульфокислоты включают тозилхлорид, бензолсульфонилхлорид и ангидрид трифторметансульфокислоты. Это взаимодействие проводят в растворителе, содержащем поглотитель галогенида водорода, такой, как триэтиламин и пиридин. Можно также использовать неорганические основания, такие, как карбонат Na или K. Предпочтительная начальная концентрация гидроксиэфира формулыV находится примерно от 5 до примерно 50 мас.%. В предпочтительном варианте этерифицирующий реагент содержится в небольшом избытке. Для проведения этой реакции особенно приемлемым растворителем является метиленхлорид, но можно также использовать другие растворители, такие, как дихлорэтан, пиридин, хлороформ, метилэтилкетон, диметоксиэтан, метилизобутилкетон, ацетон, прочие кетоны, простые эфиры, ацетонитрил, толуол и тетрагидрофуран. Реакционную температуру регулируют главным образом в зависимости от летучести растворителя. В метиленхлориде предпочтительная реакционная температура находится в интервале примерно от -10 до примерно 10C. Предпочтительный гидроксиэфирный субстрат формулы V соответствует формуле в каждой из которых значения -A-A-, -B-B-, Y1, Y2 и X аналогичны указанным для формулы XIII, R1 обозначает алканоилоксикарбонил или гидроксикарбонил, а значения R2 аналогичны указанным для формулы IV. Продукты формулы IV являются новыми соединениями, которые обладают существенной ценностью как промежуточные продукты при получении соединений формулы I, прежде всего формулы IA. Предпочтительные соединения формулы IV соответствуют формуле IVA, в которой -A-A- и -B-B-, каждый, обозначает группу -CH2-CH2-, R3 обозначает водород, (низш.)алкил или (низш.)алкоксигруппу, a R8 Наиболее предпочтительным соединением формулы IV является -лактон неполного метилового эфира 17-гидрокси-11-(метилсульфонил)окси-3-оксопрегн-4-ен-7,21-дикарбоновой кислоты. При необходимости соединение формулы IV можно выделять удалением растворителя. В предпочтительном варианте реакционный раствор вначале промывают водным щелочным раствором, например 0,5-2 н. NaOH, с последующей промывкой кислотой, например 0,5-2 н. HCl. После удаления растворителя продукт перекристаллизовывают, например, растворением продукта в метиленхлориде и затем добавлением другого растворителя, такого, как этиловый эфир, который снижает растворимость продукта формулы IV, вызывая его осаждение в кристаллической форме. При выделении продукта формулы IV или при приготовлении реакционного раствора для превращения промежуточного продукта формулы IV в промежуточный продукт формулы II, как это описано ниже, можно не использовать экстракцию и/или промывку, если вместо этого реакционный раствор обработать ионообменной смолой для удаления кислых и основных примесей. Раствор вначале обрабатывают анионообменной смолой, а затем катионообменной смолой. В другом варианте реакционный раствор можно вначале обработать неорганическими адсорбентами, такими, как основный оксид алюминия или основный диоксид кремния, с последующей промывкой разбавленной кислотой. Основный диоксид кремния или основный оксид алюминия, как правило, можно смешивать с реакционным раствором в пропорции примерно от 5 до примерно 50 г на 1 кг продукта, предпочтительно примерно от 15 до примерно 20 г на 1 кг продукта. Обработку ионообменными смолами или неорганическими адсорбентами можно проводить простым суспендированием смолы или неорганического адсорбента в реакционном растворе с перемешиванием при комнатной температуре и с последующим удалением смолы или неорганического адсорбента фильтрованием. В альтернативном предпочтительном варианте выполнения изобретения получаемое соединение формулы IV выделяют в сыром виде как концентрированный раствор путем удаления части растворителя. Этот концентрированный раствор используют непосредственно на следующей стадии способа,которой является удаление 11-уходящей группы соединения формулы IV, в результате чего образуется енэфир формулы где -A-A-, R3, -B-B-, R8 и R9 имеют значения, указанные для формулы VIII, а значения R1 аналогичны указанным для формулы V. Принимая во внимание цели проведения этой реакции, заместителем R2 в соединении формулы IV может быть любая уходящая группа, отщепление которой обеспечивает образование двойной связи между 9- и 11-м атомами углерода. Предпочтительной уходящей группой является (низш.)алкилсульфонилокси- или ацилоксизаместитель, который удаляют взаимодействием с кислотой и солью щелочного металла. Можно использовать минеральные кислоты, но предпочтительны низшие алифатические кислоты. Предпочтительный реагент для этой реакции далее включает соль щелочного металла используемой алифатической кислоты. В особенно предпочтительном варианте уходящая группа представляет собой мезилоксигруппу, а реагент для этой реакции включает муравьиную или уксусную кислоту и соли щелочного металла одной из этих кислот или другой низшей алифатической кислоты. Когда уходящая группа представляет собой мезилоксигруппу, а удаляющим реагентом являются муравьиная кислота и формиат калия, достигается относительно высокое соотношение между 9,11- и 11,12-олефинами. Если во время удаления уходящей группы в реакционной смеси содержится свободная вода, наблюдается тенденция к образованию примесей, в частности 7,9-лактона который трудно удалить из конечного продукта.- 25009176 Таким образом, для удаления воды, содержащейся в муравьиной кислоте, используют уксусный ангидрид или другой осушитель. Содержание свободной воды в реакционной смеси до реакции следует поддерживать на уровне ниже приблизительно 0,5 мас.%, предпочтительно ниже примерно 0,1 мас.%,как это определяют анализом Карла Фишера на воду, в пересчете на общее количество реакционного раствора. Хотя в предпочтительном варианте реакционную смесь содержат настолько сухой, насколько это оказывается практичным, удовлетворительных результатов достигают при 0,3 мас.% воды. Предпочтительная загружаемая реакционная смесь содержит примерно от 4 до примерно 50 мас.% соединения формулы IV в алифатической кислоте. В предпочтительном варианте соль щелочного металла этой кислоты содержится примерно от 4 до примерно 20 мас.%. В том случае, если в качестве осушителя используют уксусный ангидрид, в предпочтительном варианте он содержится примерно от 0,05 до примерно 0,2 моль на 1 моль алифатической кислоты. Было установлено, что, когда в качестве реагента для удаления уходящей группы и образования енэфира (9,11-олефина) используют удаляющий агент, представляющий собой сочетание трифторуксусной кислоты, трифторуксусного ангидрида и ацетата калия, содержание в реакционной смеси в качестве побочного продукта 7,9-лактона и 11,12-олефина является относительно низким. Трифторуксусный ангидрид служит осушителем и он должен содержаться в количестве по меньшей мере примерно 3 мас.%,более предпочтительно по крайней мере приблизительно 15 мас.%, наиболее предпочтительно около 20 мас.%, в пересчете на количество трифторуксусно-кислотного удаляющего реагента. По другому варианту 11-уходящие группы соединения формулы IV могут быть удалены с получением енэфира формулы II выдержкой при повышенной температуре раствора соединения формулы IV в органическом растворителе, таком, как ДМСО, ДМФ и диметилацетамид. Далее в соответствии с изобретением соединение формулы IV вначале вводят во взаимодействие с алкенилалканоатом, таким, как изопропенилацетат, в присутствии кислоты, такой, как толуолсульфокислота, или безводной минеральной кислоты, такой, как серная кислота, с получением 3-енольного эфира соединения формулы По другому варианту 3-енольный эфир может быть получен обработкой ангидридами карбоновых кислот и основанием, такими, как уксусная кислота и ацетат натрия. Дальнейшие альтернативные варианты включают обработку кетеном в присутствии кислоты с получением соединения формулы IV(Z). После этого осуществляют взаимодействие промежуточного продукта формулы IV(Z) с формиатом или ацетатом щелочного металла в присутствии муравьиной или уксусной кислоты с получением -9,11 енолацетата формулы который затем можно превращать в енэфир формулы II в органическом растворителе, предпочтительно в спирте, таком, как метанол, путем термической деструкции енолацетата либо путем его введения во взаимодействие с алкоксидом щелочного металла. Реакция отщепления является высоко селективной в отношении енэфира формулы II с предпочтением к 11,12-олефину и 7,9-лактону, и эта селективность сохраняется во время превращения енолацетата в енон. Предпочтительное соединение формулы IV соответствует формуле- 26009176 а енэфирный продукт соответствует формуле в каждой из которых -A-A-, -B-B-, Y1, Y2 и X имеют значения, указанные для формулы XIII, а значенияR1 аналогичны указанным для формулы V. При необходимости соединение формулы II можно выделить удалением растворителя, растворением твердого продукта в холодной воде и экстракцией органическим растворителем, таким, как этилацетат. После соответствующих стадий промывки и сушки продукт выделяют удалением экстракционного растворителя. Далее енэфир растворяют в растворителе, приемлемом для конверсии в продукт формулыI. По другому варианту этот енэфир можно выделять добавлением в получаемый концентрированный раствор воды и отфильтровыванием твердого продукта, в результате чего удаляется преимущественно 7,9-лактон. Конверсию субстрата формулы II в продукт формулы IA можно осуществлять аналогично тому, как это изложено в патенте США 4559332, который специально включен в настоящее описание в качестве ссылки, или, что более предпочтительно, проводить новую реакцию с использованием галоидацетамидного промотора, как это изложено ниже. В другом варианте выполнения изобретения гидроксиэфир формулы V можно превратить в енэфир формулы II без выделения промежуточного соединения формулы IV. В этом способе гидроксиэфир растворяют в органическом растворителе, таком, как метиленхлорид, и в раствор добавляют либо ацилирующий агент, например метансульфонилхлорид, либо галоидирующий агент, например сульфурилхлорид. Смесь перемешивают и в тех случаях, когда проводят галоидирование, добавляют акцептор HCl,такой, как имидазол. Смешение основания с раствором является высоко экзотермическим процессом,поэтому его следует осуществлять с регулируемой скоростью добавления и полным охлаждением. После добавления основания образовавшуюся смесь нагревают до умеренной температуры, например от 0C до комнатной или несколько повышенной температуры, и проводят реакцию, как правило, в течение 1-4 ч. После завершения реакции растворитель удаляют, предпочтительно в условиях высокого вакуума (например, 24-28 дюймов рт.ст.) при температуре от -10 до +15C, более предпочтительно примерно от 0 до примерно 5C, с целью концентрирования раствора и удаления избытка основания. Далее продукт вновь растворяют в органическом растворителе, предпочтительно в галоидированном растворителе, таком, как метиленхлорид, для превращения в енэфир. Реагент, отщепляющий уходящую группу, в предпочтительном варианте получают смешением органической кислоты, соли органической кислоты и осушителя, предпочтительно соответственно муравьиной кислоты, формиата щелочного металла и уксусного ангидрида, в сухом реакторе. Добавление уксусного ангидрида вызывает экзотермический процесс и приводит к выделению CO, вследствие чего необходимо соответствующим образом регулировать скорость добавления. Для ускорения удаления воды в предпочтительном варианте температуру во время этой реакции поддерживают в интервале 60-90C, наиболее предпочтительно примерно от 65 до примерно 75C. Далее этот реагент добавляют в получаемый раствор соединения формулы IV с целью вызвать реакцию отщепления. В предпочтительном варианте по истечении 4-8 ч реакционную смесь выдерживают при температуре по меньшей мере приблизительно 85C, но не выше примерно 95C, до тех пор, пока не удалится весь летучий дистиллят,а затем в течение еще некоторого периода времени для завершения реакции, как правило, примерно от 1 до 4 ч. Реакционную смесь охлаждают и после рекуперации с использованием стандартных экстракционных методов енэфир выделяют в требуемом виде выпариванием растворителя. Далее было установлено, что енэфир формулы II можно выделять из реакционного раствора другим способом, в котором устраняется потребность в экстракционных стадиях, следующих за реакцией удаления, обеспечивая тем самым экономию затрат, повышение выхода продукта и/или увеличение производительности. При осуществлении такого способа получаемый енэфир осаждают разбавлением реакционной смеси водой после удаления муравьиной кислоты. Затем фильтрованием выделяют продукт. Проведение стадий экстракции при этом не требуется. В соответствии с еще одним вариантом превращения гидроксиэфира формулы V в енэфир формулыII без выделения соединения формулы IV 11-гидроксильную группу гидроксиэфира формулы V замещают атомом галогена, после чего in situ термическим дегидрогалоидированием получают енэфир формулы II. Замещение гидроксильной группы атомом галогена осуществляют взаимодействием с сульфурилгалогенидом, предпочтительно с сульфурилхлоридом, на холоде в присутствии связывающего хлорид водорода агента, такого, как имидазол. Гидроксиэфир растворяют в растворителе, таком, как тетрагидрофуран, и охлаждают до температуры от 0 до -70C. Добавляют сульфурилгалогенид и реакционную смесь подогревают до умеренной температуры, например до комнатной температуры, и выдерживают в- 27009176 течение времени, достаточного для завершения реакции удаления, как правило в течение 1-4 ч. Такой вариант способа не только объединяет две стадии в одну, но позволяет исключить применение галоидированного реакционного растворителя, кислоты (такой, как уксусная) и осушителя (уксусного ангидрида или сульфата натрия). Более того, условия проведения реакции не требуют кипячения с обратным холодильником и исключают выделение в качестве побочного продукта CO, которое сопровождает применение уксусной кислоты в качестве осушителя. В соответствии с особенно предпочтительным вариантом выполнения изобретения дикетоновое соединение формулы VI можно превратить в эпоксимексренон или другое соединение формулы I без выделения в очищенном виде какого-либо промежуточного продукта. В соответствии с этим предпочтительным способом реакционный раствор, включающий гидроксиэфир, "гасят" раствором сильной кислоты, охлаждают до комнатной температуры, а затем экстрагируют приемлемым экстракционным растворителем. Перед экстракцией в реакционную смесь целесообразно добавлять водный раствор неорганической соли, например, концентрацией 10 мас.%. Экстракт промывают и сушат азеотропной перегонкой,удаляя метанольный растворитель, оставшийся после реакции отщепления кетона. Далее полученный концентрированный раствор, содержащий примерно от 5 до примерно 50 мас.% соединения формулы V, на холоде вводят в контакт с ацилирующим или алкилсульфонилирующим реагентом с получением эфира сульфо- или дикарбоновой кислоты. По завершении реакции алкилсульфонилирования или карбоксилирования реакционный раствор пропускают через колонку с кислой, а затем основной ионообменной смолой для удаления основных и кислых примесей. После каждого цикла колонку промывают соответствующим растворителем, например метиленхлоридом, для удаления из нее остаточного эфира сульфо- или дикарбоновой кислоты. Объединенные элюатные и промывные фракции совмещают и их объем уменьшают, предпочтительно в вакууме, с получением концентрированного раствора, содержащего эфир сульфо- или дикарбоновой кислоты формулы IV. Далее этот концентрированный раствор вводят в контакт с осушителем, включающим агент, обеспечивающий удаление уходящей 11-эфирной группы и отщепление водородного атома с образованием 9,11-двойной связи. В предпочтительном варианте этот реагент для удаления уходящей группы представляет собой описанный выше раствор муравьиной кислоты/формиата щелочного металла/уксусного ангидрида в качестве осушителя. После завершения реакции реакционную смесь охлаждают и в вакууме удаляют муравьиную кислоту и/или другие летучие компоненты. Остаток охлаждают до комнатной температуры, осуществляют соответствующие стадии промывки и затем сушат с получением концентрированного раствора, включающего енэфир формулы II. Затем этот енэфир можно превращать в эпоксимексренон или другое соединение формулы I в соответствии со способом, представленным в настоящем описании или в патенте США 4559332. В особенно предпочтительном варианте выполнения изобретения из реакционного раствора в вакууме удаляют растворитель и продукт формулы IV распределяют между водой и соответствующим органическим растворителем, например этилацетатом. Далее водный слой подвергают обратной экстракции органическим растворителем и продукт обратной экстракции промывают щелочным раствором,предпочтительно раствором гидроксида щелочного металла, содержащим галогенид щелочного металла. Органическую фазу концентрируют, предпочтительно в вакууме, с получением енэфира формулы II. Этот продукт формулы II далее можно растворять в органическом растворителе, например в метиленхлориде, и вводить в дальнейшую реакцию, как это изложено в патенте '332, с получением продукта формулы I. Было установлено, что когда в реакции эпоксидирования используют тригалоидацетонитрил, выбор растворителя имеет важное значение, причем большое предпочтение отдают галоидированным растворителям, а особенно предпочтителен метиленхлорид. Достижение удовлетворительного выхода продукта обеспечивают такие растворители, как дихлорэтан и хлорбензол, но в метиленхлоридной реакционной среде выход продукта обычно выше. В таких растворителях, как ацетонитрил и этилацетат, обычно выход продукта недостаточно высок, в то время как в результате реакции в таких растворителях, как метанол или смесь вода/тетрагидрофуран, целевой продукт получают с низким выходом. Далее в соответствии с настоящим изобретением было установлено, что использование в качестве перекисного активатора тригалоидацетамида вместо тригалоидацетонитрила дает возможность внести в синтез эпоксимексренона множество усовершенствований. В соответствии с особенно предпочтительным способом эпоксидирование проводят при взаимодействии вещества формулы IIA с перекисью водорода в среде трихлорацетамида в присутствии приемлемого буфера. В предпочтительном варианте эту реакцию проводят при pH в интервале примерно от 3 до примерно 7, наиболее предпочтительно примерно от 5 до примерно 7. Однако реакция может быть успешно осуществлена и вне этих предпочтительных интервалов значений pH. Особенно хорошие результаты получают при использовании буфера, включающего вторичный кислый фосфат калия и/или буфера, представляющего собой сочетание вторичного кислого фосфата калия и первичного кислого фосфата калия в соотношении, находящемся примерно от 1:4 до примерно 2:1, наиболее предпочтительно приблизительно при 2:3. Можно также использовать боратные буферы, но обычно при этом конверсия протекает медленнее, чем в случае вторичного кислого фосфата калия илиK2HPO4 или смесей K2HPO4/KH2PO4. Независимо от состава буфера, он должен обеспечивать поддержание pH в вышеуказанном интервале. Было установлено, что независимо от состава буфера в целом или точного значения pH, которое может быть установлено с его помощью, реакция протекает значительно более эффективно, если по меньшей мере часть буфера составляет ион вторичного кислого фосфата. Полагают, что этот ион может принимать существенное участие в качестве гомогенного катализатора при образовании аддукта или комплекса, включающего ион промотора и гидропероксид ион, образование которого, в свою очередь, может оказать существенное влияние на механизм реакции эпоксидирования в целом. Таким образом, необходимое количество вторичного кислого фосфата (предпочтительно K2HPO4) должно быть достаточно лишь для создания небольшой каталитической концентрации. Обычно в предпочтительном варианте содержание иона HPO4-2 должно составлять по меньшей мере приблизительно 0,1 экв., в частности примерно от 0,1 до примерно 0,3 экв. на 1 экв. вещества. Эту реакцию проводят в приемлемом растворителе, предпочтительно в метиленхлориде, но по другому варианту можно использовать и другие галоидированные растворители, такие, как хлорбензол или дихлорэтан. Было установлено, что приемлемыми являются также толуол и смеси толуола с ацетонитрилом. Не основываясь на какой-либо конкретной теории, полагают, что реакция наиболее эффективно протекает в двухфазной системе, в которой гидроперекисный промежуточный продукт образуется и распределяется в органической фазе с низким содержанием воды и взаимодействует в этой органической фазе с субстратом. Таким образом, предпочтительными растворителями являются те, в которых растворимость воды низка. Эффективному выделению продукта из толуола способствует введение другого растворителя, такого, как ацетонитрил. Использование толуола для конверсии веществ формулы II в продукты формулы I сообщает способу преимущество, поскольку вещества формулы II легко растворимы в толуоле, а продукты формулы I нет. Так, когда конверсия достигает уровня 40-50%, продукт выпадает в осадок, в результате чего образуется трехфазная смесь, из которой продукт можно эффективно выделить фильтрованием. Было установлено, что метанол, этилацетат, ацетонитрил самостоятельно, ТГФ и ТГФ/вода оказываются не столь эффективными для проведения конверсии на этой стадии способа как галоидированные растворители или толуол. Хотя трихлорацетамид является наиболее предпочтительным реагентом, могут быть также использованы и другие тригалоидацетамиды, такие, как трифторацетамид. Можно также применять тригалоидметилбензамид и другие соединения, содержащие между электроноакцепторной тригалоидметильной группой и карбонилом амида ариленовый остаток. Кроме того, приемлемы для использования 3,3,3-тригалоидпропионамиды, но в этом случае результат менее предпочтителен. Перекисный активатор может отвечать формулеR0C(O)NH2,0 где R обозначает группу, обладающую по меньшей мере такой же электронно-акцепторной способностью (как ее определяют по сигма-постоянной), что и монохлорметильная группа. Более конкретно перекисный активатор может соответствовать формуле где значения X1, X2 и X3 независимо друг от друга выбирают из галогена, водорода, алкила, галоидалкила, цианогруппы и цианоалкила, а значения RP выбирают из арилена и группы (CX4X5)n-, где n обозначает 0 или 1 и по меньшей мере один из X1, X2, X3, X4 и X5 обозначает галоген или перфторалкил. Когда любой из X1, X2, X3, X4 и X5 не обозначает галоген, он предпочтительно обозначает галоидалкил, наиболее предпочтительно пергалоидалкил. Особенно предпочтительными активаторами являются те, у которых n обозначает 0, и по меньшей мере два из X1, X2 и X3 обозначают атомы галогена, и те, у которых все X1, X2, X3, X4 и X5 обозначают атомы галогена или пергалоидалкилы. В предпочтительном варианте каждый из X1, X2, X3, X4 и X5 обозначает Cl или F, наиболее предпочтительно O, хотя могут оказаться приемлемыми также соединения со смешанными галогенами, равно как и перхлоралкил и пербромалкил, а также их сочетания. В предпочтительном варианте перекисный активатор содержится в количестве по меньшей мере приблизительно 1 экв., более предпочтительно примерно от 1,5 до примерно 2 экв. на 1 экв. первоначально содержащегося вещества. Перекись водорода необходимо вводить в реакцию, по меньшей мере, в умеренном избытке или ее вводят постепенно, по мере протекания реакции эпоксидирования. Хотя во время этой реакции расходуется всего от 1 до 2 экв. перекиси водорода на 1 моль вещества, в предпочтительном варианте перекись водорода загружают в значительном избытке в сравнении с количеством первоначально загружаемых исходного вещества и активатора. Не основываясь на какой-либо конкретной теории, полагают, что механизм реакции включает образование аддукта активатора и OOH, что эта реакция получения обратима и продукт способствует смещению равновесия реакции в обратном направлении и что, таким образом, для смещения равновесия во время этой реакции в сторону образования продукта эпоксидирования необходим существенный начальный избыток перекиси водорода. Поддержание тем- 29009176 пературы реакции в узком диапазоне решающего значения не имеет, поэтому процесс можно эффективно проводить в температурном интервале 0-100C. Оптимальная температура зависит от выбора растворителя. Обычно предпочтительная температура находится примерно от 20 до 30C, но в случае некоторых растворителей, например толуола, реакцию можно с успехом проводить в температурном интервале 60-70C. При 25C на реакцию, как правило, требуется менее 10 ч, обычно 3-6 ч. При необходимости в конце реакционного цикла с целью добиться полноты конверсии субстрата можно вводить дополнительные количества активатора и перекиси водорода. По завершении реакционного цикла водную фазу удаляют, органический реакционный раствор в предпочтительном варианте промывают для удаления водорастворимых примесей, после чего удалением растворителя можно выделить продукт. Перед удалением растворителя реакционный раствор следует обработать промывной жидкостью со щелочной реакцией, по меньшей мере, от слабой до умеренной,например раствором карбоната натрия. В предпочтительном варианте реакционную смесь промывают последовательно слабовосстановительным раствором, таким, как слабый (например, 3 мас.%) раствор сульфита натрия в воде; щелочным раствором, например раствором NaOH или KOH (предпочтительно приблизительно 0,5 н.); раствором кислоты, такой, как HCl (предпочтительно 1 н.), и в завершение нейтральной промывной жидкостью, представляющей собой воду или рассол, предпочтительно насыщенный рассол, с целью свести к минимуму потери продукта. Перед удалением реакционного растворителя можно с успехом добавлять другой растворитель, такой, как органический растворитель, предпочтительно этанол, благодаря чему продукт можно выделять кристаллизацией после перегонки для удаления более летучего реакционного растворителя. Необходимо отметить, что предлагаемый новый способ эпоксидирования с использованием трихлорацетамидного или другого нового перекисного активатора находит применение далеко за пределами различных схем получения эпоксимексренона и фактически может быть эффективным при получении эпоксидов через олефиновые двойные связи в самых различных субстратах, вступающих во взаимодействие в жидкой фазе. Такая реакция особенно эффективна при использовании ненасыщенных соединений, у которых имеются тетразамещенные и тризамещенные олефиновые углеродные атомы, т.е. соединений формул RaRbC=CRcRd и RaRbC=CRcH, где Ra-Rd обозначают заместители, отличные от водородных атомов. Эта реакция протекает наиболее быстро и полно в случае, когда исходным служит циклическое соединение с тризамещенной двойной связью или циклическое либо ациклическое соединение с тетразамещенными двойными связями. Примеры исходных веществ для этой реакции включают Поскольку эта реакция протекает более быстро и полно при наличии тризамещенных и тетразамещенных двойных связей, она особенно эффективна для селективного эпоксидирования через такие двой- 30
МПК / Метки
МПК: C12P 33/10, C07J 1/00, C07J 71/00, C07J 53/00, C07J 21/00, C12P 33/00, C07J 31/00
Метки: эпоксидирования, 7-альфа-карбоксил-9,11-эпоксистероидов, олефиновым, продуктов, связям, способ, двойным, общий, промежуточных, используемых, получения
Код ссылки
<a href="https://eas.patents.su/30-9176-sposob-polucheniya-7-alfa-karboksil-911-epoksisteroidov-i-promezhutochnyh-produktov-ispolzuemyh-dlya-ih-polucheniya-i-obshhijj-sposob-epoksidirovaniya-po-olefinovym-dvojjnym-svyazy.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 7-альфа-карбоксил-9,11-эпоксистероидов и промежуточных продуктов, используемых для их получения, и общий способ эпоксидирования по олефиновым двойным связям</a>
Предыдущий патент: Замещенные соединения миноциклина, фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния млекопитающего
Следующий патент: Способ выделения акрилонитрила или метакрилонитрила
Случайный патент: Производные мочевины и их применение в качестве ингибиторов инозин-5`-монофосфат- дегидрогеназы












