Способ селективного эпоксидирования для получения лекарственных соединений
Номер патента: 2547
Опубликовано: 27.06.2002
Авторы: Норман Брайан Х., Моухер Эрик Д., Хоард Дэвид В., Пейтел Винод Ф.
Формула / Реферат
1. Способ получения соединения формулы
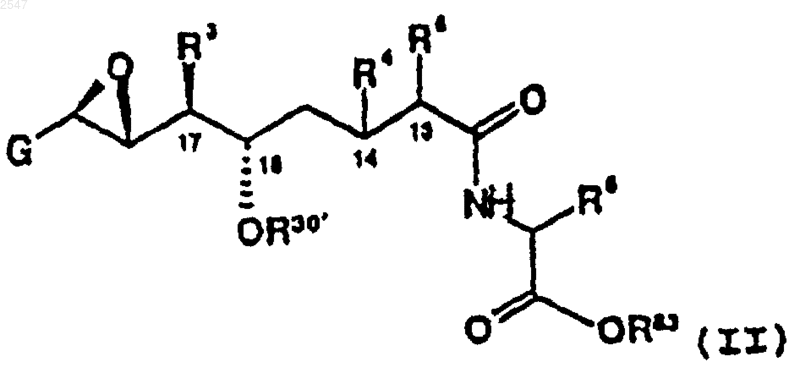
в которой
G является фенилом, необязательно замещенным заместителем, выбранным из группы, включающей галоген и C1-6алкил;
R3 является C1-С6алкилом;
R4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;
R83 является водородом, C1-С6алкилом, трихлорэтилом или -CH2SR81;
R30' является водородом, защитной группой для спирта или группой формулы
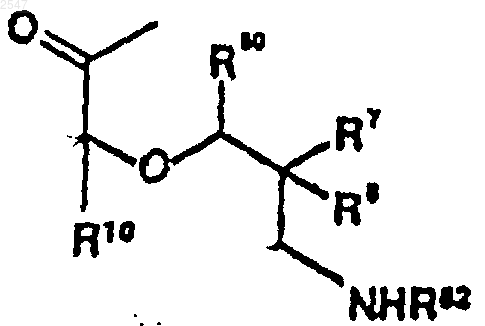
R7 и R8 независимо являются водородом или C1-С6алкилом;
или R7 и R8, вместе взятые, образуют циклопропильное или циклобутильное кольцо,
R10 является C1-С6алкилом,
R50 является (=O);
R6 является галогенС1-6алкоксифенилом
R81 является C1-С6алкилом, и
R82 является подвижной в присутствии основания защитной группой; или его фармацевтически приемлемой соли; при условии, что когда R83 является -СН2SR81, R30 не является водородом или защитной группой для спирта, включающий эпоксидирование соединения формулы
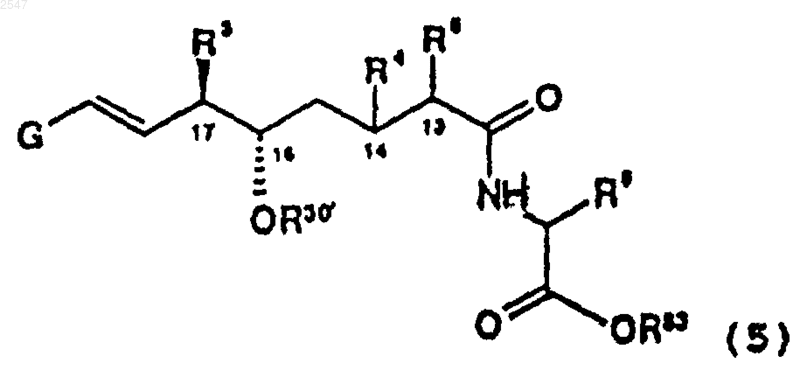
в которой G, R3, R4, R5, R6, R30 и R83 являются такими, как они определены выше; окислителем и хиральным кетоном с образованием соединения формулы (II); и необязательным образованием его фармацевтически приемлемой соли.
2. Способ по п.1, в котором G является фенилом, парафторфенилом, R30' является водородом.
3. Способ по п.1, в котором окислителем является оксон и хиральным кетоном является соединение формулы
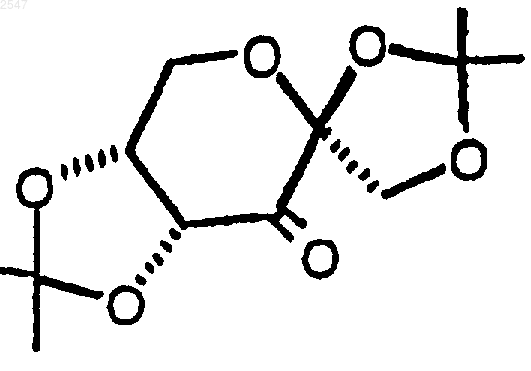
4. Способ по п.2, в котором G является фенилом и R83 является трихлорэтилом.
5. Способ по п.1, в котором соединение формулы (II) представлено формулой
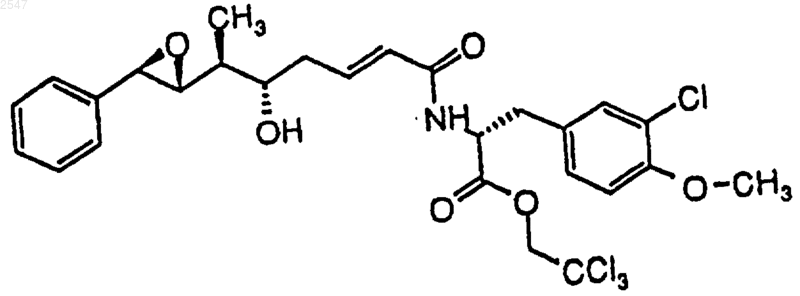
6. Соединение формулы
в которой
G является фенилом, необязательно замещенным галогеном и С1-С6алкилом,
R3 является C1-С6алкилом;
R4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;
R6 является галогенС1-6алкоксифенилом или его фармацевтически приемлемая соль.
7. Соединение по п.6, в котором G является фенилом, парафторфенилом.
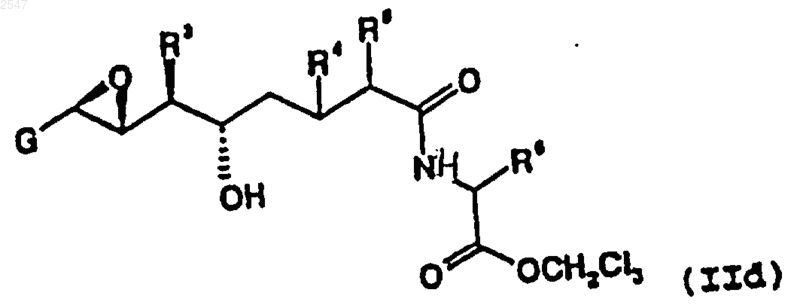
8. Соединение по п.6, которое представлено формулой
9. Соединение формулы
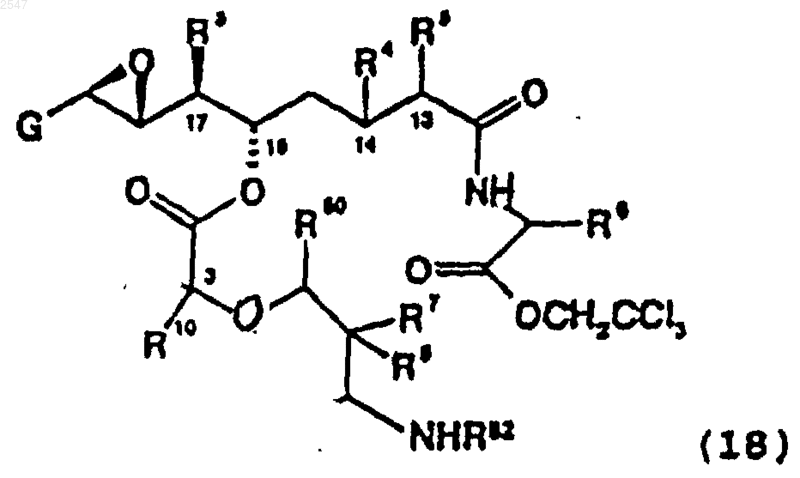
в которой
G является фенилом, необязательно замещенным заместителем, выбранным из группы, состоящей из галогена и C1-6алкила;
R3 является С1-С6алкилом;
R4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;
R7 и R8 независимо являются водородом или C1-С6алкилом; или
R7 и R8, вместе взятые, образуют циклопропильное или циклобутильное кольцо,
R10 является C1-С6алкилом,
R50 является (=О);
R6 является галогенС1-6алкоксифенилом;
R82 является водородом или подвижной в присутствии основания защитной группой; или его фармацевтически приемлемая соль.
10. Соединение по п.9, в котором G является фенилом, парафторфенилом.
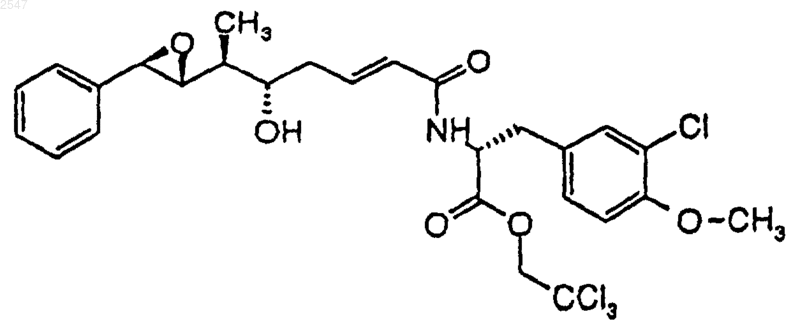
11. Соединение по п.9, представленное формулой
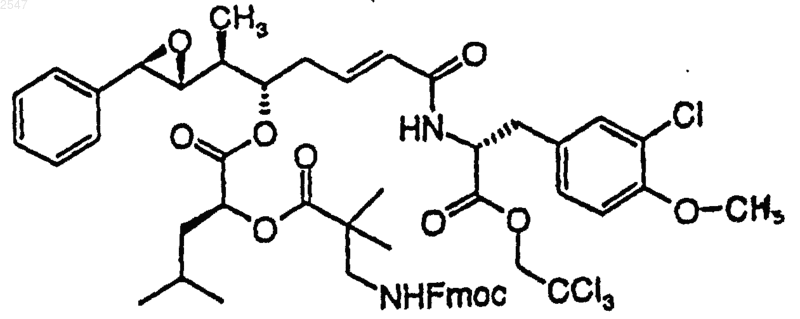
12. Соединение по п.9, которое представлено формулой
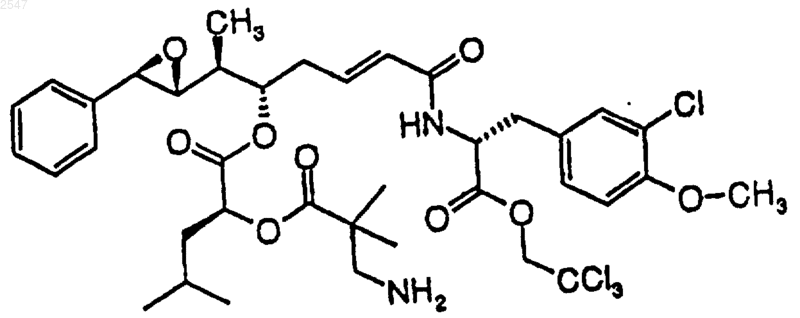
Текст
1 Опухолевые заболевания, характеризующиеся пролиферацией клеток, не подчиняются обычному контролю клеточного роста и являются основной причиной смерти людей и других млекопитающих. Клиническая практика в химиотерапии рака показала, что для лечения этих заболеваний необходимы новые и более эффективные лекарственные средства. Клиническая практика показала также, что лекарственные средства, которые разрушают систему микроканальцев цитоскелета, могут быть эффективными при ингибировании пролиферации разрастания опухолевых клеток. В настоящее время криптофициновые соединения могут быть получены с применением полного процесса синтеза; однако многие из пригодных криптофициновых соединений содержат подвижную эпоксидную группу. Barrow,R.A. et al., J. Am. Chem. Soc. 117, 2479 (1995). Заявители обнаружили, что наиболее предпочтительным может быть бета-эпоксид. Однако при синтезе некоторых криптофициновых соединений приведенной ниже формулы (1), описанном в статье Barrow et al., эпоксидирование осуществляют на последней стадии, которая обеспечивает селективность в отношении желательного эпоксида, равную только 2:1. Кроме того, разделение диастереомеров на этой стадии является также затруднительным. Хотя эпоксиды являются восприимчивыми к ряду реакционных условий, желательно осуществить эпоксидирование более раннего промежуточного соединения. Для избежания трудностей, возникающих при разделении диастереомеров, остается потребность в способах с более высокой стереоселективностью. Настоящее изобретение предусматривает более предпочтительный новый и эффективный способ получения криптофициновых соединений, имеющих эпоксидную функциональную группу. Эпоксидирование является селективным и может быть использовано на различных стадиях процесса синтеза. Настоящее изобретение относится к способу получения соединений формулыR4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;R30' является водородом, защитной группой для спирта или группой формулыR7 и R8 независимо является водородом или C1-C6 алкилом; или R7 и R8, вместе взятые, образуют циклопропильное или циклобутильное кольцо,R10 является C1-С 6 алкилом,R50 является (=O);R82 является подвижной в присутствии основания защитной группой; или его фармацевтически приемлемой соли; при условии, что когда R83 является -CH2SR81, R30 не является водородом или защитной группой для спирта,включающий эпоксидирование соединения формулы в которой G, R3, R4, R5, R6, R30 и R83 являются такими, как они определены выше; окислителем и хиральным кетоном с образованием соединения формулы (II); и необязательным образованием его фармацевтически приемлемой соли. Соединения формулы (II) являются пригодными в качестве промежуточных соединений при получении криптофициновых соединений, имеющих эпоксидную функциональную группу. Это изобретение, кроме того, включает новые соединения представленных здесь формул(IId), (18), пригодные при получении соединений формулы (II). Обозначения, используемые в описании:(a) обозначение относится к связи,которая выступает вперед за пределы плоскости страницы;(b) обозначение относится к связи,которая выступает в обратном направлении за пределы плоскости страницы и(c) обозначение относится к связи,для которой стереохимия не определена. Используемый в этом описании термин фармацевтически приемлемая соль относится или к соли с кислотой или к соли с основанием. Выражение фармацевтически приемлемая соль с кислотой означает нетоксичную соль соединений формулы II с органической или неорганической кислотой или любого из их промежуточных соединений. Пояснительные примеры неорганических кислот, которые образуют подходящие соли, включают хлористо-водородную, бромисто-водородную, серную и фосфорную кислоту и кислые металлические соли, например, вторичный кислый фосфорно-кислый натрий и кислый сернокислый калий. Поясни 3 тельные примеры органических кислот, которые образуют подходящие соли, включают моно-,ди- и трикарбоновые кислоты. Примерами таких кислот являются уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная,глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая, оксималеиновая, бензойная, оксибензойная, фенилуксусная, коричная, салициловая, 2-феноксибензойная и сульфоновые кислоты, например, птолуолсульфоновая кислота, метансульфоновая кислота и 2-оксиэтансульфоновая кислота. Такие соли могут существовать или в гидратированной или, по существу, в безводной форме. Выражение фармацевтически приемлемая соль с основанием означает нетоксичную соль с органическим или неорганическим основанием соединений формулы II или любого из их промежуточных соединений. Пояснительные примеры оснований, которые образуют подходящие соли, включают гидроксиды щелочного или щелочно-земельного металла, например,гидроксиды натрия, калия, кальция, магния или бария; аммиак и алифатические, циклические или ароматические органические амины, например, метиламин, диметиламин, триметиламин, диэтиламин, триэтиламин, изопропилдиэтиламин, пиридин и пиколин. Используемый в этом описании термин(=O) в комбинации с углеродом в кольце, к которому он присоединен, относится к карбонильной группе формулы Используемый в этом описании термин хиральный кетон относится к кетону, имеющему следующие общие признаки: 1) стереогенные центры расположены близко к реакционному центру и 2) кетон имеет конденсированное ядро и четвертичный центр а, связанный с карбонильной группой, и 3) одна сторона молекулы кетона является пространственно блокированной. Одним из особенно предпочтительных хиральных кетонов является кетон следующей структуры: Используемый в этом описании термин защитная группа для спирта может быть выбран с использованием общеизвестных публикаций. Термин относится к защитным группам для спирта, которые можно выбрать, например,из таких публикаций как Greene, T.W. "Protecting groups in Organic Synthesis", Wiley (NewYork, 1981). См., в частности, главу 2 этой публикации. Предпочтительные защитные группы для спирта выбирают из силильной и ацильной групп. В частности, предпочтительной группой(ТБДМС). Общий метод синтеза для получения соединения формулы (II), пригодного в качестве промежуточного соединения для получения эпоксидов формулы (I), представлен на схеме В. На схеме В R83' является водородом или C1-C6 алкилом; R82 является подвижной в присутствии основания защитной группой; R30' является защитной группой для спирта; и q представляет собой целое число, равное 1 или 2. Все другие заместители, если не указано иным образом,являются такими, как они были ранее определены. Используемые в схеме В реагенты, технологические процессы и методы хорошо известны и признаны специалистами в данной области. Схема В На схеме В, стадия 1, алкен формулы (5 а) эпоксидируют хиральным кетоном и окислителем с образованием фрагмента А-В -эпоксида формулы (IIа). На схеме В, стадия 2, у фрагмента А-В эпоксида формулы (IIа) осуществляют отщепление защитной группы с помощью подходящего агента, отщепляющего защищающую алкок 5 сигруппу, с образованием соединения формулы(IIb). Подходящим агентом, отщепляющим защитную группу для алкокси, является такой,который удаляет группу, защищающую гидроксигруппу, обозначенную заместителем R30',тогда как в отношении эпоксидной группы фрагмента А-В соединения формулы (IIа) он остается инертным. Предпочтительные агенты,отщепляющие защитную группу, включают агенты, являющиеся источниками основного фторида, например, тетрабутиламмонийфторид,пиридинийфторид,триэтиламмонийфторид,фторид цезия и т.д., при этом предпочтительным является тетрабутиламмонийфторид. Реакция отщепления защитной группы происходит в присутствии подходящего органического растворителя, например, тетрагидрофурана, необязательно в присутствии подходящего основания,например, бикарбоната натрия (NаНСО 3). Реакция происходит при температуре в диапазоне от примерно 0 до примерно 80 С, предпочтительно в диапазоне от примерно 20 до примерно 70 С. Реакцию осуществляют в течение от примерно 3 до примерно 24 ч. Неочищенный продукт (IIb) можно использовать без дальнейшей очистки. В альтернативном случае, соединение формулы(IIb) контактирует с агентом, образующим сложный тиоэфир, обеспечивая тем самым получение тиоэфира формулы (IIc). Термин агент, образующий сложный тиоэфир включает в себя любые подходящие средства или условия для образования сложноэфирной тиогруппы формулы (lIc). В это определение включены условия, описанные ниже,и/или аналогичные, описанным в: Оnо, N. et al.,Bull. Chem. Soc. Jpn. 51(8), 2401 (1978); Но, TseLok, Synth. Comm. 9(4), 267-270 (1979); Narasaka, К. et al., J. Am. Chem. Soc. 106(10), 29542960 (1984); L.G.Wade, Jr. et al., Tetrahedron Lett. 731-732 (1978); Mora, N. et al., Tetrahedron Lett. 34(15), 2461-2464 (1993); и Dossena, A. et al., J.Chem. Soc. Perkin Trans. I, 2737 (1981). Так, например, соединение формулы (IIb) можно обработать пространственно затрудненным алкилгалогенидом, например, третбутилбромидом и растворителем формулы (R81)(Me)SO, где R81 является таким, как он определен выше, в присутствии подходящего основания, например, бикарбоната натрия (NaHCO3). Предпочтительным для реакции растворителем является диметилсульфоксид (ДСО). Как пространственно затрудненный алкилгалогенид, так и подходящее основание добавляют в молярном избытке по отношению к соединению формулы(IIb), составляющем от примерно 7 до примерно 12. Реакция происходит при температуре в диа 002547 6 пазоне от примерно 0 до примерно 60 С, предпочтительно от примерно 10 до примерно 30 С. Реакцию осуществляют в течение от примерно 1 до примерно 24 ч. Неочищенный продукт (IIс) можно использовать без дальнейшей очистки. В альтернативном случае, тиоэфир формулы (IIс) можно выделить и очистить в соответствии с методами, хорошо известными специалистам в данной области, например, экстракцией, выпариванием, хроматографией и перекристаллизацией. В тех случаях, когда заместитель R83' представляет собой группу иную, чем водород, у соединения формулы (IIb) следует сначала отщепляют группу, защищающую карбоксигруппу. Отщепление защитной группы для карбокси в щелочных условиях известно специалистам в данной области. Так, например, соединение формулы (IIb) можно обработать подходящим основанием, например, гидроксидом лития(LiOH) в течение периода времени, достаточного для удаления защитной группы для карбокси,например, в течение от 1 до 24 ч. На схеме В, стадия 4, -эпокситиоэфир формулы (IIс) сочетают с карбоновой кислотой формулы в которой R7, R8, R9, R10, R50 и R82 являются такими, как они определены выше, при этом получают соединение формулы (8). Так например, карбоновую кислоту формулы (10a) растворяют в подходящем органическом растворителе, например, ДМФ, глиме, диоксане, ТГФ, СН 3 СN, EtOAc и галогенуглеводородах, при этом предпочтительным растворителем является дихлорметан. Затем этот раствор обрабатывают связующим реагентом. Возможные связующие реагенты включают N,N'-дициклогексилкарбодиимид (ДЦК), 1-этил-3-[3-(диметиламино)пропилкарбодиимид] и подобные реагенты, например, 4-диметиламинопиридининхлорхромат, которые активирует карбоновые кислоты для этерификации спиртами. Этот раствор может быть затем необязательно обработан подходящим основанием, например,твердым бикарбонатом натрия, после чего осуществляют взаимодействие с -эпокситиоэфиром формулы (IIc). Концентрация (10 а) после этих добавлений будет находиться в диапазоне от примерно 0,1 М до примерно 2,0 М. Реакция происходит при температуре в диапазоне от примерно -30 до примерно 60 С, предпочтительно от примерно 10 до примерно 30 С. Реакцию осуществляют в течение от примерно 0,5 до примерно 12 ч. Неочищенный продукт (8) можно использовать без дальнейшей очистки. В альтернативном случае соединение формулы (8) можно выделить и очистить в соответствии с 7 методами, хорошо известными специалистам в данной области, например экстракцией, выпариванием, хроматографией и перекристаллизацией. На схеме В, стадия 5, -эпокситиоэфир формулы (8) окисляют подходящим окислителем, при этом получают сульфон или сульфоксид формулы (9). Подходящий окислитель представляет собой реагент, способный к превращению сульфида формулы (8) в сульфон или сульфсксид формулы (9), при этом он остается инертным по отношению к эпоксидной группе молекулы. Подходящие окислители включают пероксомоно сульфат калия (оксон), м-ХПБК, метилтриоксорений (VII) и монопероксифталат магния, при этом предпочтительным является оксон. Так, например, сульфид формулы (8) обрабатывают подходящим основанием, например,бикарбонатом натрия, затем подходящим окислителем, например оксоном. Реакцию осуществляют в подходящем растворителе, например ацетоне, ДМФ, глиме, диоксане, СН 3 СN, спиртах, ТГФ, EtOAc, галогенуглеводородах, хлорбензоле и толуоле, при этом предпочтительным является ацетон. Обычно реакцию осуществляют при температурах от примерно -30 до примерно 50 С, предпочтительно от примерно -10 до примерно 10 С. Как правило, для протекания реакции требуется от примерно 15 мин до примерно 5 ч. Неочищенный сульфон или сульфоксид (9) можно применять без дальнейшей очистки. В альтернативном случает сульфон или сульфоксид формулы (9) можно выделить и очистить в соответствии с методами, хорошо известными специалистам в данной области,например, экстракцией, выпариванием, хроматографией и перекристаллизацией. На схеме В, стадия 6, у сульфона или сульфоксида формулы (9) отщепляют защитную группу с помощью подходящего агента, отщепляющего защитную группу, обеспечивая тем самым получение амина формулы (10). Подходящим агентом, отщепляющим защитную группу, является агент, способный к удалению подвижного в присутствии основания заместителя R82 в соединении формулы (9), тогда как в отношении эпоксидной группы молекулы он остается инертным. Подходящие агенты, отщепляющие защитную группу, включают основания, например вторичные и третичные амины и неорганические основания, например пиперидин, морфолин, дициклогексиламин, рдиметиламинопиридин, диизопропилэтиламин и подобные, при этом предпочтительным является пиперидин. Реакцию осуществляют в подходящем растворителе, например, ацетоне, ДМФ,глиме, диоксане, СН 3 СN, спиртах, ТГФ, EtOAc,галогенуглеводородах,хлорбензоле или толуоле. Обычно реакцию осуществляют при температурах в диапазоне от примерно 0 до 8 примерно 120 С. Как правило, для протекания реакции требуется от примерно 1 до примерно 72 ч. Соединение формулы (1) можно выделить и очистить методами, хорошо известными в данной области, например, экстракцией, выпариванием, хроматографией и перекристаллизацией. В альтернативном случае, соединение формулы (10) выделяют и, кроме того, его можно подвергнуть циклизации с помощью реагента, вызывающего образование цикла, при этом получают соединение формулы (I). Обычно сразу же после отщепления защитной группы у соединения формулы (9), оно подвергается самопроизвольной циклизации. Однако для некоторых определенных соединений формулы (9) может стать необходимой дополнительная стадия циклизации. Так, например, сульфид формулы (8), хотя он и является гораздо менее активным, чем его окисленный дубликат, при удалении подвижной в присутствии основания защитной группы можно подвергнуть циклизации с помощью подходящего агента, вызывающего образование цикла, например 2-гидроксипиридина, с образованием соединения формулы (I). Так, например, сульфид формулы (8) или альтернативно выбранное соединение формулы (10) нагревают в течение нескольких дней при температуре примерно 60 С в подходящем растворителе, например, в ДМФ, в присутствии пиперидина и 2 гидроксипиридина. Соединение формулы (I) выделяют и очищают методами, хорошо известными в данной области. На схеме D представлена схема синтеза для получения соединения формулы (II), где R83 является трихлорэтилом. Реагенты и исходные вещества легкодоступны специалистам в данной области. На схеме Р все другие заместители,если не указано иным образом, являются такими, как они были определены ранее. Схема D На схеме D, стадия 1, алкен формулы (16) эпоксидирируют хиральные кетоном и окислителем в соответствии с методом, представлен 9 ным на схеме А, обеспечивая тем самым получение -эпоксисоединения формулы (IId). На схеме D, стадия 2, -эпоксисоединение формулы (IId) сочетают с карбоновой кислотой формулы (IQ:a) в соответствии с методами, описанными на схеме В, стадия 4, с образованием соединения формулы (18). На схеме D, стадия 2 А, алкен формулы(17) эпоксидирируют хиральные кетоном и окислителем в соответствии с методом, представленным на схеме А, с образованием соединения формулы (18). На схеме D, стадия 3, у соединения формулы (18) отщепляют защитную группу с помощью подходящего агента, отщепляющего группу, защищающую основания, обеспечивая тем самым получение соединения формулы (19). Подходящим агентом, отщепляющим защитную группу для основания, является агент,способный к удалению подвижного в присутствии основания заместителя R82 в соединении формулы (18), тогда как в отношении эпоксидной группы молекулы он остается инертным. Подходящие агенты, отщепляющие защитную группу для основания, включают основания,например, вторичные и третичные амины и неорганические основания, например, пиперидин,морфолин, дициклогексиламин, р-диметиламинопиридин, диизопропилэтиламин и подобные, при этом предпочтительным является пиперидин. Эти агенты описаны в Greene, T.W.(New York, 1981). Реакцию осуществляют в подходящем растворителе, например, ацетоне,ДМФ глиме, диоксане, СН 3 СN, спиртах, ТГФ,ЕtOАс, галогенуглеводородах, хлорбензоле или толуоле. Обычно реакцию осуществляют при температурах в диапазоне от примерно 0 С до примерно 120 С. Как правило, для протекания реакции требуется от примерно 1 до примерно 72 ч. Соединение формулы (19) можно выделить и очистить методами, хорошо известными в данной области, например, экстракцией, выпариванием, хроматографией и перекристаллизацией. Обычно сразу же после отщепления у соединения формулы (18) защитной группы, оно подвергается самопроизвольной циклизации с образованием соединения формулы (I).R6 имеет определенное выше значение. Схема получения сложного эфира дополнительно разъяснена в разделе Приготовление, который предусматривает в интересах специалиста в данной области конкретное применение схемы. Схема получения сложного эфира применима для заявленных заместителей Аr. Схемы не ограничивают схемы синтеза только иллюстрированным фенильным кольцом. Специалист в данной области может предпочтительно широко использовать этот способ для обеспечения же 002547 10 лательных исходных материалов, предназначенных для получения заявленных соединений. Схема получения сложного эфира дополнительно разъяснена в разделе Приготовление, который предусматривает в интересах специалиста в данной области конкретное применение схемы. Схема Е получения сложного эфира применима для заявленных заместителей Аr. Схемы не ограничивают схемы синтеза только иллюстрированным фенильным кольцом. Специалист в данной области может предпочтительно широко использовать этот способ для обеспечения желательных исходных материалов, используемых в заявленных способах. Время, необходимое для проведения реакции, зависит от исходных материалов и рабочей температуры. Оптимальное время реакции для данного процесса, как правило, определяется целью, при этом оказывается предпочтение небольшой продолжительности реакции и максимальному выходу, которому благоприятствует,однако, продолжительное время реакции. Для дополнительной иллюстрации изобретения предусмотрены следующие примеры. Эти примеры ни в коем случае не следует истолковывать как примеры, ограничивающие объем изобретения. Приготовление 1. Стадия 1. Метил-5-фенилпент-2(Е)-еноат. Раствор триметилфосфонацетата (376 мг,417 мл, 2,07 моль) в ТГФ (750 мл) перемешивали при 0 С в 3 л трехгорлой круглодонной колбе, снабженной механической мешалкой и впускным отверстием для N2. К охлажденному раствору через делительную воронку добавили по каплям чистый тетраметилгуанидин (239 г, 260 мл, 2,07 моль). Охлажденный прозрачный бледно-желтый раствор перемешивали при 0 С в течение 25 мин. К реакционному раствору медленно по каплям добавили раствор гидрокоричного альдегида (90%, 253 г, 248 мл, 1,9 моль) в ТГФ (125 мл). После завершения добавления реакционную смесь перемешивали в течение 10 ч при температуре, доведенной до комнатной. Газовая хроматография показала соотношение продукта к исходному материалу, равное 95:5. В реакционный сосуд добавили 500 мл воды и реакционную смесь перемешивали в течение ночи, разделив ее на два слоя. Отделили органический слой, а водный слой экстрагировали трет-BuOMe. Органические слои объединяли и осушили над МgSO4, затем концентрировали в вакууме, при этом получили оранжевое масло. Неочищенный продукт перегнали при 129 С/ давлении 0,3 мм Нg, при этом получили 360,5 г прозрачного светло-желтого масла, выход 91,7%. В 12 л четырехгорлую круглодонную колбу, снабженную термопарой, механической мешалкой и впускным отверстием для азота, загрузили раствор еноатного эфира (310,5 г, 1,5 моль) в ТГФ (1,5 л) и охладили до -71 С с помощью изо-РrОН/СO2 бани. Для поддержания температуры реакции -50 С в реакционный сосуд добавили по каплям диизобутилкетон (2,5 л, 1,5 М в толуоле, 3,75 моль). После завершения добавления реакционную смесь перемешали в течение ночи при температуре реакции -50 С. Через 16 ч TLC (ТСХ) (тонкослойная хроматография) (гексан: EtOAc 3:1, SiO2) показала отсутствие исходного материала. Температуру реакции увеличили до -15 С. Реакционную смесь медленно гасили 1N НСl (150 мл). В этот момент реакционная смесь превратилась в желатинообразное твердое вещество. Для разбивания полутвердого вещества применяли шпатель и для получения более жидкой смеси добавили 1N HCl (200 мл). Для образования двухфазной системы загрузили концентрированную HCl(625 мл). Слои разделили и продукт экстрагировали трет-ВuОМе. Органический слой сушили над MgSO4 и концентрировали в вакууме, при этом получили прозрачное бледно-желтое масло, 247,8 г. Неочищенный продукт перегнали при 145 С/давлении 0,25 мм Нg, получили 209,7 г вышеназванного вещества, выход 86,2%. В 1 л трехгорлую круглодонную колбу,снабженную термопарой, механической мешалкой и впускным отверстием для азота, добавили СН 2 Сl2 (350 мл), высушенные молекулярные сита 4(30 г) и L-(+)-диэтилтартрат (7,62 г,0,037 моль). Полученную смесь охладили до 20 С и обработали Ti (O-i-Pr)4 (9,2 мл, 0,031 моль), затем для поддержания температуры добавили трет-бутилгидропероксид (4,0 М вCH2Cl2, 182 мл, 0,78 моль). После завершения добавления реакционную смесь перемешали в течение еще 30 мин и затем для поддержания температуры -20 С обработали раствором аллилового спирта (50 г, 0,31 моль) в СН 2 Сl2 (30 мл). Реакционную смесь перемешивали при этой же температуре в течение 5 ч, затем при 0 С отфильтровали в раствор гептагидрата сульфата железа (II) (132 г) и винной кислоты (40 г) в воде (400 мл). Смесь перемешали в течение 20 мин., затем перенесли в делительную воронку и экстрагировали трет-ВuОМе (2 х 200 мл). Объединенную органическую фазу в течение 1 ч при 0 С смешали с 30% раствором NaOH, содержащим NaCl. Слои опять разделили и водную фазу экстрагировали трет-ВuОМе. Объединенную органическую фазу промыли рассолом, сушили над MgSO4 и концентрировали, при этом получили 52,8 г названного вещества в виде янтарного масла. Стадия 4. (2R,3R)-2-гидрокси-3-метил-5 фенилпентан-1-ол. В 5 л трехгорлую круглодонную колбу,снабженную механической мешалкой, термопарой и впускным отверстием для азота, добавили гексан (1 л) и охладили до 0 С. Добавили 2,0 М раствор Ме 3 Аl в гексане (800 мл, 1,6 моль), затем, поддерживая температуру ниже 20 С, добавили раствор эпоксида (120 г, 0,677 моль) в гексане (250 мл)/CH2Cl2 (50 мл). После завершения добавления мутную реакционную смесь перемешивали в течение 35 мин при 5 С, после чего по каплям добавили раствор 10% НСl (300 мл) и затем концентрированную НСl (350 мл). Слои разделили и органическую фазу промыли рассолом и сушили над MgSO4. После удаления в вакууме летучих компонентов получили 122,1 г масла. Стадия 5. (2R,3R)-2-Гидрокси-3-метил-5 фенилпент-1-илтозилат. В 2 л трехгорлую круглодонную колбу,снабженную механической мешалкой и впускным отверстием для азота, добавили диол (58 г,0,30 моль), дибутилоксид олова (1,5 г, 0,006 13 моль, 2 мол.%), толуолсульфонилхлорид (57,5 г,0,30 моль), CH2Cl2 (580 мл) и триэтиламин (42 мл, 0,30 моль). Полученную смесь перемешали при комнатной температуре в течение 2-х ч (хотя реакция завершилась в течение 1 ч), фильтровали, промыли водой и сушили над MgSO4. После концентрирования летучих примесей в вакууме получили 104,1 г слегка янтарного масла. Стадия 6. (2R,3R)-2-[(трет-Бутилдиметилсилил)окси]-3-метил-5-фенилпент-1-илтозилат. Раствор тозилата (100 г, 0,29 моль) и триэтиламина (81,0 мл, 0,58 моль) в CH2Cl2 (1200 мл) обработали по каплям чистым TBS-OTf (99 мл, 0,43 моль) и продолжили перемешивание в течение еще 20 мин. Реакционную смесь дважды промыли рассолом, сушили над MgSO4 и концентрировали до остаточного влагосодержания. Масло растворили в минимальном количестве гексана и фильтровали через диоксидкремниевую прокладку, элюировали смесью гексана и EtOAc (9:1), при этом получили 134 г слегка янтарного масла. Стадия 7. (2R,3R,5RS)-2-[(трет-бутилдиметилсилил)окси]-3-метил-5-бром-5-фенилпент 1-илтозилат В 5 л трехгорлую круглодонную колбу,снабженную механической мешалкой, парциальным конденсатором горячего орошения и впускным отверстием для азота, добавили ССl4AIBN (16,5 г, 0,10 моль). Смесь дегазировали путем откачки газа под полным вакуумом при перемешивании и опять осуществили заполнение азотом (трижды). Затем реакционную смесь нагрели с обратным холодильником, после чего она приобрела темно-коричневую окраску. Через 15 мин энергичного нагрева с обратным холодильником реакционная смесь стала светложелтой, и хроматографический анализ показал,что реакция завершилась. После охлаждения до комнатной температуры реакционную смесь отфильтровали и фильтрат концентрировали до остаточного влагосодержания. Остаток повторно растворили в гексане и опять отфильтровали и концентрировали до остаточного влагосодержания, при этом получили 170,3 г названного вещества в виде янтарного масла. Стадия 8. (2R,3R)-2-[(трет-бутилдиметилсилил)окси]-3-метил-5-фенилпент-4(Е)-ен-1-илтозилат. В 2 л трехгорлую круглодонную колбу,снабженную механической мешалкой, парциальным конденсатором горячего орошения и впускным отверстием для азота, добавили раствор бромида (100 г, 0,186 моль) в ацетонитриле(700 мл). Добавили DBU (83,6 мл, 0,557 моль) и полученный темно-коричневый раствор перемешали в течение 15 мин в колбе с обратным холодильником. После охлаждения до комнатной температуры в вакууме удалили растворитель и остаток выпарили в CH2Cl2 (200 мл) и фильтровали через диоксид-кремниевую прокладку. Опять выпарили летучие компоненты и остаток растворили в EtOAc, промыли водой,рассолом, сушили над MgSO4 и концентрировали до остаточного влагосодержания. После осуществления препаративной хроматографии(Prep 500) получили желательное ненасыщенное соединение (50,3 г, за 4 стадии выход составил 60%). Стадия 9. (3S,4R)-3-[(трет-бутилдиметилсилил)окси]-4-метил-6-фенилгекс-5(Е)-ен-1 нитрил.DMSO (ДМСО) (диметилсульфоксиде) (1 л) и обработали KCN (14,2 г, 0,22 моль) и водой (25 мл), и полученную смесь перемешали в течение 18 ч под азотом при 60 С. После охлаждения до комнатной температуры реакционную смесь распределили между EtOAc (1 л) и водой (1 л). Водную фазу экстрагировали EtOAc (500 мл) и объединенную органическую фазу промыли рассолом и сушили над MgSO4. После осуществления флэш-хроматографии на силикагеле с применением CH2Cl2 получили желательный нитрил, выход которого составил 92%. Стадия 10. Метил(5S,6R)-5-[(трет-бутилдиметилсилил)окси]-6-метил-8-фенил-окта 2(Е),7(Е)-диеноат. Нитрил (14,67 г, 46,5 ммоль) растворили в толуоле (200 мл) и под азотом охладили до-78 С. При сильном перемешивании по каплям добавили 1,5 М раствор DIBAL в толуоле (37,2 мл, 55,8 ммоль). После завершения добавления удалили охлаждающую баню и реакционную смесь в течение 1 ч перемешали при комнатной температуре. Реакционную смесь осторожно влили в 1N HCl и смесь перемешали при комнатной температуре в течение 30 мин. Слои разделили и органическую фазу промыли насыщенным водным раствором натрийкалийтартра 15 та (дважды), рассолом и сушили над Na2SO4. В вакууме удалили летучие компоненты и полученное неочищенное бледно-желтое масло использовали непосредственно при осуществлении последующей конденсации. Полученный выше альдегид растворили вTHF (90 мл) и обработали при комнатной температуре под азотом триметилфосфонацетатом(7,0 мл, 55,8 ммоль). Реакционную смесь перемешали в течение 16 ч, затем распределили между EtOAc (200 мл) и водой (100 мл). Водную фазу реэкстрагировали EtOAc (100 мл) и объединенную органическую фазу промыли водой,рассолом и сушили над Na2SO4. В вакууме удалили летучие компоненты и полученное неочищенное желтое масло (17,0 г) подвергли хроматографии на силикагеле с применениемCH2Cl2:циклогексана (при соотношении компонентов в этой смеси от 1:1 до 2:1), при этом получили 13,67 г желательного сложного эфира,выход 78,5%. Приготовление 2.(1,00 г, 2,673 ммоль) растворили в ацетоне (44 мл) и затем при комнатной температуре добавили 1N водный раствор LiOH (26 мл). После этого мутную смесь разбавили ацетоном (20 мл) и полученную желтую смесь перемешали при комнатной температуре в течение 23,5 ч. Реакционную смесь разбавили простым диэтиловым эфиром (400 мл) и органические слои промыли 1N НСl (120 мл), рассолом (200 мл) и H2O (160 мл). Органические слои сушили (MgSO4) и концентрировали в вакууме, при этом получили желтое масло, которое очистили колоночной хроматографией (градиентное элюирование: 5% АсОН + 20% - 40% EtOAc/гексан) и получили карбоновую кислоту в виде желтого масла (960 мг, 100%).(ddd, J = 15,2, 7,6 и 7,9 Гц, 3-Н), 6,38 (d, J = 16 Гц, 8-Н), 6,16 (dd, J = 16 и 8 Гц, 7-Н), 5,85 (d, J = 15,8 Гц, 2-Н), 3,81-3,75 (м, 5-Н), 2,49-2,37 (м, 6 Н, 4-НН'), 1,12 (d, J = 6,7 Гц, 6-Ме), 0,91 (s, 9 Н,SiCMe3), 0,065 (s, SiMe), 0,068 (s, SiMe) част. на млн.; ИК (СНСl3) lмакс 2957, 2930, 2858, 1697,1258, 1098, 838 см-1; MS (FD) 360,2 (М+, 100); Аналитически вычислено для С 21 Н 32O3: С 69,95; Н 8,95 %; найдено: С 69,19; Н 8,39 %. Приготовление 3. К перемешанному раствору карбоновой кислоты, полученной в приготовлении 2, (720 мг, 2 ммоль) в сухом диметилфомамиде (5,50 мл) при комнатной температуре добавили 1 этил-3-(3-диметиламинопропил)карбодиимид(299 мг, 2,6 ммоль). Смесь перемешали в течение 2S ч и затем разбавили EtOAc (100 мл) и промыли 1N водным раствором НСl (2 х 50 мл),Н 2 О (75 мл), сушили (MgSO4) и концентрировали в вакууме, получив при этом масло. Неочищенный продукт очистили колоночной хроматографией (градиентное элюирование: 5-30%EtOAc/гексан), получили активный сложный эфир в виде бледно-желтого масла (724 мг,80%).(FD) 457 (М+, 100); Аналитически вычислено для С 25 Н 35NO5: С 65,61; Н 7,71; М 3,06 %; Найдено: С 65,51; Н 7,56; N 3,02 %. Приготовление 4. К перемешанному раствору активного сложного эфира, полученного в приготовлении 3, (2,50 г, 5,47 ммоль) в СН 3 СN (130 мл) при 0 С добавили 48% водный раствор HF (15 мл). Раствор перемешали при 0 С в течение 0,75 ч и затем при комнатной температуре в течение 4 ч. Реакционную смесь разбавили простым диэтиловым эфиром (300 мл) и промыли Н 2O до тех пор, когда рН промывки стал равен 7. Органические слои сушили (MgSO4) и концентрировали в вакууме, при этом получили желтый остаток, который перекристаллизовали из Et2O, получили спирт в виде белых кристаллов (1,46 г,78%). 1[a]D -57,8 (с 10,56, СНСl3); Аналитически вычислено для C19H21NO5S: С 66,46; Н 6,16; N 4,08 %; найдено: С 66,49; Н 6,16; N 4,07 %. Приготовление 5. К раствору активного сложного эфира, полученного в приготовлении 3, (2,90 г, 6,35 ммоль) в дихлорметане (20 мл) добавили ацетон(10 мл) и раствор охладили до 0 С. К перемешанному раствору водного NаНСО 3 (5,3 г, 63,5 ммоль) в Н 2 О (30 мл) (наблюдалось выделение газа) медленно добавили водный раствор оксона (11,7 г, 11 ммоль) в Н 2 О (30 мл). Полученный раствор добавили к реакционной смеси и перемешали при 0 С в течение 7 ч. (Тонкослойная хроматография показала степень конверсии 50%). Дополнительно добавили оксон (6 г) и ацетон (15 мл) и смесь перемешали в течение 1,5 ч (как показала тонкослойная хроматография, израсходовался весь SM). Реакционную смесь разбавили H2O (5 объемов) и продукт экстрагировали CH2Cl2 (5 х 100 мл). Органические слои объединили, сушили (MgSO4) и концентрировали в вакууме, получив при этом продукт в виде желтого клейкого твердого вещества(2,88 г). Тонкослойная хроматография и 1H ЯМР показали, что выход желательного эпоксидного продукта составил 90% (a:b = 1:1,62):10% SM. Неочищенный продукт очистили колоночной хроматографией (градиентное элюирование: 15-25% EtOAc: гексан, SiO2), при этом получили извлеченный стирол (389 мг, 13%) и эпоксид в виде желтого масла (2,38 г, 80%). Эпоксиды (2 г,a:b = 1:1,50) разделили HPLC (ВЭЖХ) (высокоэффективной жидкостной хроматографией) получив при этом в-эпоксид в виде белого кристаллического твердого вещества (1,17 г, 59%,99,8%) и а-эпоксид в виде белого кристаллического твердого вещества (0,864 г, 43,2%, 99%). Приготовление 6. 18 км; MS (FD) M/z 474 (М, 10), 416 ([М-СМе 3]+,100); Аналитически вычислено для C25H35NO6 требуется: С 63,40; Н 7,45; N 2,96 %; найдено: С 63,45; Н 7,31; N 3,21 %. Приготовление 7.(FD) м/z 474 (М+, 10), 416 ([М-СМе 3]+, 100); Аналитически вычислено для C25H35NO6 требуется: С 63,40; Н 7,45; N 2,96 %, Найдено: С 63,20; Н 7,63; N 3,07 %. Приготовление 8. в CH2Cl2 (18 мл) обработали mхлорпербензойной кислотой (0,96 г, 5,6 ммоль) и смесь перед выпариванием летучих компонентов перемешали в течение 4 ч, при этом получили бесцветное масло (2,88 г). Для разделения эпоксидов применяли препаративную ВЭЖХ(: 1,2:1), при этом получили желательный эпоксид в виде бесцветного твердого вещества 19 Дополнительный вариант получения эпоксидного фрагмента А кислоты. К перемешанному раствору кислоты 2 а'(1 М в МеОН, 28 мл, 28 смоль). После добавления NaHCO3 (23,3 мг, 0,277 ммоль) с помощью 2 М NaOH установили рН, равный 8,0 и приготовили смесь оксона (1,70 г, 2,77 ммоль) иNaHCO3 (722 мг, 8,59 ммоль). К 100 мг порции смеси оксона и NаНСО 3 добавили кетон (7) (143 мг, 0,554 ммоль). С помощью NaOH сразу же установили рН 7,8-8,0. В это время через шприцевидный насос к смеси добавили 95 мг порциями с интервалом в 10 мин оставшуюся часть смеси оксона и NаНСО 3 и раствор (143 мг, 0,554 ммоль) в СН 3 СN (500 мл). На протяжении всего опыта с помощью 2 М NaOH и 1N Н 2SO4 значение рН поддерживали в диапазоне 7,8-8,0. Анализ ВЭЖХ (C18 обращенная фаза, обнаружение при 220 им, скорость потока 1 мл/мин, СН 3 СN(0,05% TFA) / Н 2 О (0,05% TFA) - % СН 3 СN: от 80 до 90% в течение 10 мин), проведенный через 3 ч после добавления оксона, показал, что степень конверсии составила более 95% при соотношении / эпоксидов 5,0:1. Смесь профильтровали и влажный остаток промылиCH2Cl2(15 мл). Фильтрат промыли Н 2O (15 мл) и водную фазу реэкстрагировали CH2Cl2 (15 мл). Объединенные органические фазы промыли 0,1 М NaCl (10 мл) и H2O (10 мл), сушили (MgSO4) и концентрировали, получив при этом неочищенный продукт в виде желтого масла (104 мг,100%). Приготовление 10. Дополнительный вариант получения эпоксидного фрагмента А N-гидроксисукцинимидного эфира. Эпоксидирование N-гидроксисукцинимидного эфира, полученного в приготовлении 3,(127 мг, 0,277 ммоль) осуществили тем же самым способом, который описан в приготовлении 9, за исключением того, что после добавления тетрабутиламмонийгидроксида и перед добавлением бикарбоната натрия рН уменьшили до значения 5,6 с помощью 1N H2SO4. Анализ ВЭЖХ (тот же самый метод, который применяли для анализа в приготовлении 9), проведенный через 3,5 ч после добавления оксона, показал, что степень конверсии составила более 95% при соотношении / эпоксидов, равном 6,3:1. После добавления CH2Cl2 (6 мл) смесь профильтровали и влажный остаток промылиCH2Cl2 (14 мл). Фильтрат промыли Н 2 О (10 мл) и водную фазу реэкстрагировали CH2Cl2 (2 х 20 мл). Объединенные органические фазы сушили(МgSO4) и концентрировали до получения бес 002547 20 цветного масла. После хроматографии на силикагеле с помощью EtOAc/гексана (1:3) получили названное соединение в виде бесцветного твердого вещества (эпоксидная смесь с соотношением эпоксидов / 8:1, 82 мг, 63%). Приготовление 11. Получение -эпоксидного фрагмента А сложного метилового эфира. Эпоксидирование сложного метилового эфира, полученного в приготовлении 1, стадия 10, (104 мг, 0,278 ммоль) осуществили тем же самым способом, который описан в приготовлении 9, за исключением того, что после добавления тетрабутиламмонийгидроксида и перед добавлением бикарбоната натрия рН уменьшили до значения 3,3 с помощью 1N H2SO4. Анализ ВЭЖХ (тот же самый метод, который применяли для анализа в приготовлении 9, за исключением того, что % СН 3 СN: 95%), проведенный через 2 ч после добавления оксона, показал, что степень конверсии составила более 95% при соотношении / эпоксидов, равном 4,9:1. После добавления СН 2 Сl2 (6 мл) смесь профильтровали и влажный остаток промыли CH2Cl2 (14 мл). Фильтрат промыли Н 2 О (10 мл) и водную фазу реэкстрагировали CH2Cl2 (2 х 20 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали до получения неочищенного продукта в виде желтого масла (123 мг, 113%). 1 Заявка РСТ WO 97/07798, опубликованная 6 марта 1997 г., растворили в трифторуксусной кислоте (17 мл) и раствор перемешали под атмосферой сухого азота в течение 4,75 ч, затем концентрировали в вакууме и сушили под высоким вакуумом в течение 24 ч, получив соль амина в виде желтого вязкого масла (1,76 г,100%). К перемешанному раствору соли амина,полученной в приготовлении 12, (5,09 ммоль) в диоксане (20 мл) при комнатной температуре добавили бикарбонат натрия (2,14 г, 25,5 ммоль), затем ФМК Сl (1,58 г, 6,11 ммоль). Смесь разбавили Н 2 О (4 мл) и перемешали в течение 19 ч. Реакционную смесь гасили в 1 N водном растворе НСl (150 мл) и экстрагировалиEtOAc (2 х 100 мл). Объединенные органические слои промыли Н 2O (100 мл), сушили (МgSO4) и концентрировали в вакууме, получив при этом желтое клейкое твердое вещество. Неочищенный продукт очистили колоночной хроматографией (градиентное элюирование: 10-75%EtOAc: гексан, Biotage - SiO2), получив при этом амин с защитной ФМК группой в виде бледножелтого твердого вещества (850 мг, 37%) Продукт был загрязнен аминокислотой, которую удалили растворением продукта в EtOAc, и затем в течение нескольких часов его перемешали с 1N водным раствором НСl. Органические слои сушили и концентрировали до получения продукта (продукт:аминокислота 85:15).([М+1]+, 26); Аналитически вычислено для С 26 Н 31NО 6: С 68,86; Н 6,89; N 3,09%; найдено: С 68,92; Н 7,01;(1,2 мл), и реакционную смесь перемешали в течение 5 мин при 0 С и в течение 30 мин при комнатной температуре. После разбавления смеси EtOAc/гексаном (1:1, 15 мл), ее профильтровали через целит и осадок промыли смесью EtOAc/гексана (1:1, 15 мл). Фильтрат промыли 1 М НСl (10 мл), насыщенным раствором NаНСО 3 (10 мл), рассолом, сушили (МgSO4) и концентрировали до образования желтой пены. После хроматографии на силикагеле смесьюEtОАс/гексана (при соотношении компонентов в смеси от 1:2,5 до 1:1) получили названное соединение в виде бесцветной пены (864 мг,83,5%). 1(d, 1H, J = 15,7 Гц), 5,18 (м, 1H), 5,08-5,01 (м,2H), 4,77 и 4,67 (АВ квартет, 2H, J = 11,9 Гц),4,43-4,33 (м, 2H), 4,27 (dd, 1H, J = 7,4, 7,2 Гц),3,86 (s, 3 Н), 3,43 (d, 2H, J = 6,6 Гц), 3,21 (dd, 1H,J = 14,1, 5,7 Гц), 3,07 (dd, 1H, J = 14,2, 6,7 Гц),2,69-2,58 (м, 3 Н), 1,79-1,72 (м, 2H), 1,67-1,61 (м,1H), 1,29 (s, 3 Н), 1,20 (s, 3 Н), 1,17 (d, 3 Н, J = 6,8 Гц), 0,91 (d, 3 Н, J = 6,4 Гц), 0,87 (d, 3 Н, J = 6,4 Гц). Аналитически вычислено для C53H58Cl4Am. Chem. Soc. 117, 2479-2490 (1995 осуществили тем же самым способом, который описан в способе приготовления 9, за исключением того,что после добавления тетрабутиламмонийгидроксида и перед добавлением бикарбоната натрия рН уменьшили до значения 4,4 с помощью 23 1N Н 2SO4. Реакция завершилась до добавления смеси оксона/NаНСО 3 и кетона. Анализ ВЭЖХ (тот же самый метод, который применяли для анализа продукта, полученного в приготовлении 9, за исключением того,что % СН 3 СN: от 70 до 85%, время 15 мин), показал, что исходный материал фрагмент А-В израсходовался, при этом после добавленияSО% смеси оксона/NаНСО 3 (1,6 эквивалента относительно предварительно медленно добавленных 2 эквивалентов соединения (7 получили смесь эпоксидов / с соотношением эпоксидов в этой смеси 5:1. После добавления СН 2 Сl2(24 мл) смесь профильтровали и влажный остаток промыли СН 2 Сl2(56 мл). Фильтрат промыли Н 2 О (40 мл) и водную фазу реэкстрагировали CH2Cl2 (2 х 20 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали, при этом получили неочищенный продукт в виде светло-желтой пены (798 мг, 119%), который непосредственно использовали в следующей реакции без очистки. 1 Получение -эпоксидного Seco с защитной ФМК (флуоренилметоксикарбонильной) группой для амино из Seco с защитной ФМК группой. К перемешанному раствору соединения,полученного в приготовлений 14, (382 мг, 0,373 ммоль) в CH3CN (4,7 мл) при 0 С добавили раствор Na2EDTA (1x10-4 М в H2O, 3,7 мл, 0,37 ммоль) и тетрабутиламмонийгидроксид (1 М в МеОН, 37 мл, 37 ммол). Перед добавлениемNаНСО 3 (31,3 мг, 0,373 ммоль) с помощью 1N Н 2SO4 рН уменьшили до значения 3-6. После приготовления смеси оксона (2,29 г, 3,72 ммоль) и NаНСО 3 (975 мг, 11,6 ммоль) 1N H2SO4 установили рН, равный 8,2, и добавили кетон (7)(385 мг, 1,49 ммоль). Затем 128 мг порциями с интервалом 10 мин добавили смесь оксона/NаНСО 3 и с помощью 2 М NaOH и 1N Н 2SO4 поддерживали рН при значении 7,8 - 8,2. Анализ ВЭЖХ (тот же самый метод, который применяли для анализа в приготовлении 9, за исключе 002547 24 нием того, что % СН 3 СN: 95%), проведенный через 1 ч после добавления оксона, показал, что степень конверсии составила 85% при соотношении в смеси / эпоксидов, равном 9,5:1. После добавления СН 2 Сl2 (8 мл) смесь профильтровали и влажный остаток промыли СН 2 Сl2 (19 мл). Фильтрат промыли Н 2 О (13 мл) и водную фазу реэкстрагировали СН 2 Сl2 (2 х 27 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали, при этом получили неочищенный продукт в виде пены бежевого цвета Получение -эпоксидного Seco с защитной ФМК (флуоренилметоксикарбонильной) группой для амино из -эпоксидного фрагмента А-В. К кислоте, полученной в приготовлений 13, (742 мг, 1,64 ммоль) сначала добавили раствор эпоксидного продукта примера 1 (788 мг,1,09 ммоль в СН 2 Сl2 (3,7 мл), затем - DMAP(26,6 мг, 0,218 ммоль) и смесь сразу же охладили до 0 С. После добавления раствора DCC (338 мг, 1,64 ммоль) в CH2Cl2 (1,2 мл) смесь перемешали в течение 5 мин при 0 С и в течение 1 ч при комнатной температуре. Затем смесь разбавили EtOAc/гексаном (1:1, 20 мл), фильтровали через целит и концентрировали до получения желтой пены. После хроматографии на силикагеле смесью EtОАс/гексана (при соотношении компонентов в смеси от 1:3 до 1:2) получили названное соединение в виде светло-желтой пены. (Смесь / эпоксидов с соотношением 7,8:1, 772 мг, 68%, вследствие загрязнения фрагмента А-В побочными продуктами, выход уменьшился до 55%). 1 25 Получение -эпоксидного Seco с защитной ФМК (флуоренилметоксикарбонильной) группой для амино из фрагмента А-В: Эпоксидирование при рН 10,5 с последующим сочетанием при предварительной активации C'D кислоты, защищенной ФМК. Эпоксидирование. К перемешанной смеси фрагмента А-В (4')Na2EDTA, 11,2 мл), кислого сульфата тетрабутиламмония (14,9 мг, 43,9 смоль) и кетона (7)(568 мг, 2,20 ммоль) в СН 3 СN (16,5 мл) при 0 С в течение 2 ч добавили раствор оксона (2,61 г, 4,24 моль) в водном растворе Na2EDTA (4 х 10-4 М 20 мл) и раствор К 2 СО 3 (0,89 М, 20 мл). Анализ ВЭЖХ (тот же самый метод, который применяли для анализа продукта, полученного в приготовлении 9, за исключением того, что % СН 3 СN: от 70 до 85%, время 15 мин) в конце добавления показал, что степень конверсии составила 95% при соотношении в смеси / эпоксидов, равном 6,5:1. Смесь разбавили CH2Cl2 (30 мл) и промыли Н 2 О (20 мл). Водный слой реэкстрагировали СН 2 Сl2 (2 х 30 мл) и объединенные органические слои сушили (МgSO4) и концентрировали до получения пены бледно-желтого цвета(995 мг), которую применяли на следующей стадии без дальнейшей очистки. Реакция сочетания. К раствору кислоты (10 а) (723 мг, 1,60 ммоль) и DMAP (26,9 мг, 0,220 ммоль) в CH2Cl2CH2Cl2 (1,3 мл). После перемешивания смеси в течение 5 мин добавили раствор неочищенного спирта в CH2Cl2 (1,5 мл) и реакционную смесь перемешали в течение 5 мин при 0 С и в течение 1 ч при комнатной температуре. Затем смесь разбавили EtOAc/гексаном (1:1, 20 мл), фильтровали через целит и концентрировали до получения желтой пены. После хроматографии на силикагеле смесью EtOAc/гексана (при соотношении компонентов в смеси от 1:3 до 1:2) получили названное соединение в виде светложелтой пены (соотношение / эпоксидов в смеси 10,3:1, 820 мг, 71%, загрязнено только 4% побочного продукта). Пример 5. Получение криптофицина 52 из криптофицина 51. Эпоксидирование криптофицина 51 (181 мг, 0,277 ммоль) осуществили тем же самым способом, который описан в способе приготовления 9, за исключением того, что после добавления тетрабутиламмонийгидроксида и перед добавлением бикарбоната натрия рН уменьшили с помощью 1N H2SO4 до значения 7,8. Ана 002547 26 лиз ВЭЖХ (тот же самый метод, который применяли для анализа продукта, полученного в приготовлении 9, за исключением: % CH3CN: от 60 до 90%, в течение 20 мин) в конце добавления оксона показал, что степень конверсии составила менее 10% при соотношении / эпоксидов, равном 5 - 7:1. Пример 6. Получение криптофицина 52 из эпоксидного Sесо с защитной ФМК (флуоренилметоксикарбонильной) группой для амино. К раствору -эпоксидного Sесо с защитной ФМК группой примера 3 (767 мг, 0,737 ммоль,вследствие загрязнения -эпоксидом и побочными продуктами содержание составило 0,54 ммоль) в DMF (74 мл) добавили пиперидин (364 л, 3,69 ммоль) и реакционную смесь перед ее разбавлением EtOAc (200 мл) и промывкой H2O(3 х 200 мл) перемешали в течение 20 ч. Объединенные водные слои реэкстрагировали EtOAc(60 мл), а объединенные органические слои сушили (МgSO4) и концентрировали до получения оранжевого масла. После кристаллизации из толуола (2,5 мл, внесения криптофицина 52 в качестве затравки) обеспечили названное соединение в виде бесцветного твердого веществаDMF (6,7 мл) при комнатной температуре добавили аминокислоту В (459 мг, 2,0 ммоль),представленную формулой(РСТ WO 97/07798, опубликована 6 марта 1997 г.); и затем при комнатной температуре под атмосферой N2 N,O-бис-(триметилсилил) ацетамид (618 мл, 2,5 ммоль). Полученную смесь нагрели до 55 С в течение 8 ч (образовался раствор), разбавили EtOAc (250 мл) и промыли 1N водным раствором НСl (3 х 80 мл), Н 2O(100 мл). Органические слои объединили, сушили (МgSO4) и концентрировали в вакууме, при этом получили желтую пену (590 мг), которую затем очистили колоночной хроматографией(SiO2, градиентное элюирование; СН 2 Сl2 - 510% МеОН: CH2Cl2), получили простой силиль 27 ный эфир в виде белой пены (489 мг, 89%). Метод А. К раствору простого силильного эфира,полученного в примере 7, (160 мг, 0,272 ммоль) в сухом DMF (3,5 мл) добавили бикарбонат натрия (228 мг, 2,72 ммоль) и затем гидрат твердого тетрабутиламмонийфторида (ТБАФ) (358 Ml,1,36 ммоль). Смесь нагрели до 60 С в течение 17 ч, и затем добавили дополнительно ТБАФ(358 мг, 1,36 ммоль) и нагрели в течение 9 ч,после чего опять добавили раствор 1 М ТБАФ вTHF (360 мл, 1,36 ммоль), вследствие чего реакционная смесь приобрела коричневый цвет. Смесь нагрели в течение 20 мин и затем ее гасили водой (100 мл) и экстрагировали EtOAc (3 х 50 мл). Органические слои объединили, сушили(Nа 2SO4) и концентрировали в вакууме, при этом получили коричневую маслянистую смолу(248 мг). Неочищенную карбоксилатную соль использовали на следующей стадии без дополнительной очистки. Пример 9. Метод В. К раствору простого силильного эфира,полученного в примере 7, (145 мг, 0,247 ммоль) в сухом тетрагидрофуране (3,0 мл) под атмосферой сухого азота добавили 1 М раствор тетрабутиламмонийфторида (800 л, 0,8 ммоль). Полученный раствор нагрели до 60 С в течение 17 ч, и затем процесс осуществили как описано выше, при этом получили коричневый остаток(166 мл, 94%). Неочищенную карбоксилатную соль использовали на следующей стадии без дополнительной очистки. К сухому раствору неочищенной карбоксилатной соли (0,272 ммоль) в DMSO (ДСО)(диметилсульфоксиде) (3,5 мл) в течение 2 ч при комнатной температуре и под атмосферой азота добавили бикарбонат натрия (274 мг, 3,26 ммоль) и затем медленно добавили раствор трет-бутилбромида (373 мг, 2,72 ммоль) вDMSO (1,5 мл). Смесь перемешали в течение еще 21 ч и затем гасили рассолом (50 мл) и экстрагировали EtOAc (3 х 30 мл). Объединенные органические фазы промыли водой (50 мл), сушили (Na2SO4) и концентрировали в вакууме,при этом получили неочищенный сложный эфир в виде смолистого твердого вещества (117 мг, 81%). Неочищенный спирт А-В применяли на следующей стадии без дополнительной очистки. Пример 11. К перемешанному раствору карбоновой кислоты D-C', полученной в приготовлении 13,(129 мг, 0,285 ммоль) в сухом дихлорметане (1,0 мл) при комнатной температуре под атмосферой сухого азота добавили DMAP (5,4 мг, 0,044 ммоль) и DCC (59 мг, 0,285 ммоль). Раствор перемешали в течение 0,5 ч, затем добавили твердый бикарбонат натрия (37 мг, 0,44 ммоль) и после этого раствор неочищенного спирта А-В примера 10 (117 мг, 0,22 ммоль) в сухом дихлорметане (1,2 мл). В течение 10 мин образовался осадок и смесь перемешали еще в течение 50 мин. Неочищенную реакционную смесь непосредственно нанесли на SiO2, находящийся в хроматографической колонке, и очистили (градиентное элюирование: 10-40% EtOAc: гексан) ,при этом получили метилсульфидный продукт в виде бледно-желтого твердого вещества (122 мг,46% за 3 стадии). 1 К перемешанному раствору метилсульфида примера 11 (56 мг, 0,058 ммоль) в ацетоне (10 мл) добавили бикарбонат натрия (64 мг, 0,764 ммоль) и затем водный раствор оксона (234 мг,0,382 ммоль) в Н 2 О (3,0 мл). Реакционную смесь перемешали при комнатной температуре в течение 20 мин (SM быстро превратился в сильнополярный составной сульфоксид и затем со временем в менее полярный сульфоновый продукт). Реакционную смесь гасили водой (40 мл) и экстрагировали EtOAc (3 х 20 мл). Органические слои промыли рассолом, сушили (МgSO4) и концентрировали в вакууме, получив при этом твердое вещество. Неочищенный продукт очистили колоночной хроматографией (SiO2, градиентное элюирование: 25-60% EtOAc: гексан),получили сульфон в виде белого пенистого твердого вещества (43 мл, 74%). 1 К перемешанному раствору сульфона примера 12 (18 мг, 17,98 смоль) в сухом DMF (2,0 мл) при комнатной температуре и под азотом добавили чистый пиперидин (8,9 мл, 90 смоль). Полученный раствор перемешали в течение 5 ч и затем концентрировали в вакууме, при этом получили неочищенный амин в виде пены. Амин растворили в толуоле (3 мл) и в течение 40 мин нагрели под азотом до 60 С. Реакционный раствор непосредственно очистили коло 002547 30 ночной хроматографией (SiO2, градиентное элюирование: 20-75% EtOAc: гексан), получили криптофицин 52 в виде белого стекла (6,1 мг,выход 51% за 2 стадии). 1(арр t, J = 6,3 Гц, 6 Н, 5-Н 3, 4-Ме) част. на млн. Степени превращения и соотношения / представлены ниже в табл. 1. Эпоксидирование завершили в CH3CN/H2O при 0 С и рН 7,8-8,2 с применением 4 эквивалентов соединения (7) (2 из четырех эквивалентов добавили в течение 4 ч) и смеси оксона (10 эквивалентов) и NаНСО 3(31 эквивалент), которую добавили в течение 4 ч. Весь кетон (7) добавили вначале. Таблица 1. Асимметрическое эпоксидирование промежуточных криптофициновых соединений ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулыR4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;R30' является водородом, защитной группой для спирта или группой формулыR7 и R8 независимо являются водородом или C1-С 6 алкилом; или R7 и R8, вместе взятые, образуют циклопропильное или циклобутильное кольцо,R10 является C1-С 6 алкилом,R50 является (=O);R82 является подвижной в присутствии основания защитной группой; или его фармацевтически приемлемой соли; при условии, что когда R83 является -СН 2SR81, R30 не является водородом или защитной группой для спирта,включающий эпоксидирование соединения формулы в которой G, R3, R4, R5, R6, R30 и R83 являются такими, как они определены выше; окислителем и хиральным кетоном с образованием соединения формулы (II); и необязательным образованием его фармацевтически приемлемой соли. 2. Способ по п.1, в которомG является фенилом, парафторфенилом,R30' является водородом. 3. Способ по п.1, в котором окислителем является оксон и хиральным кетоном является соединение формулы 4. Способ по п.2, в котором G является фенилом и R83 является трихлорэтилом. 5. Способ по п.1, в котором соединение формулы (II) представлено формулойR4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;R6 является галогенС 1-6 алкоксифенилом или его фармацевтически приемлемая соль. 7. Соединение по п.6, в котором G является фенилом, парафторфенилом. 8. Соединение по п.6, которое представлено формулойR4 и R5, вместе взятые, образуют дополнительную связь между С-13 и С-14;R7 и R8 независимо являются водородом или C1-С 6 алкилом; илиR7 и R8, вместе взятые, образуют циклопропильное или циклобутильное кольцо,R10 является C1-С 6 алкилом,R50 является (=О);R82 является водородом или подвижной в присутствии основания защитной группой; или его фармацевтически приемлемая соль. 10. Соединение по п.9, в котором G является фенилом, парафторфенилом. 11. Соединение по п.9, представленное формулойG является фенилом, необязательно замещенным галогеном и С 1-С 6 алкилом,R3 является C1-С 6 алкилом;
МПК / Метки
МПК: C07D 301/03
Метки: соединений, селективного, эпоксидирования, лекарственных, способ, получения
Код ссылки
<a href="https://eas.patents.su/17-2547-sposob-selektivnogo-epoksidirovaniya-dlya-polucheniya-lekarstvennyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ селективного эпоксидирования для получения лекарственных соединений</a>
Предыдущий патент: Производные арилсульфонилгидроксамовой кислоты
Следующий патент: Способ обработки материалов, загрязненных органическими веществами
Случайный патент: Захват для объектов












