Замещенные бициклогексанкарбоновые кислоты и их производные в качестве антагонистов рецептора возбуждающих аминокислот, способ их получения и применение.
Номер патента: 894
Опубликовано: 26.06.2000
Авторы: Хелтон Дэвид Р., Мэсси Стивен М., Монн Джеймс Э., Домингес-Фернандес Кармен
Формула / Реферат
1. Соединение формулы
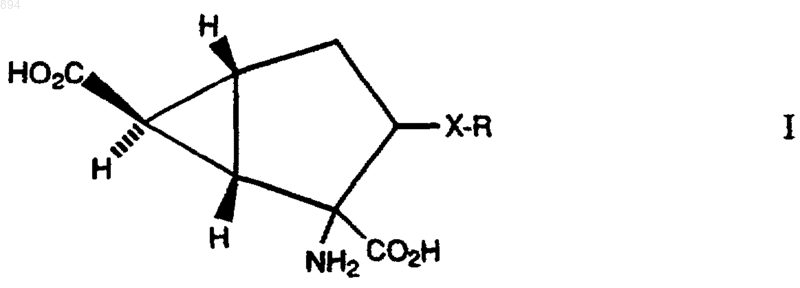
где Х представляет собой связь, S, О или NRa; R представляет собой группу (1-4С)алкил или группу фенил(1-4С)алкил, либо дифенил(1-4С)алкил, в которой фенильное кольцо является незамещенным или замещенным одним, двумя или тремя заместителями, выбранными независимо из галогена, (1-4С)алкила, (1-4С)алкокси, (1-4С)фторалкила, (1-4С)фторалкокси, фенила, фенокси, 3-трифторметилфенокси и 4-хлорфенокси; Ra представляет водород или группу формулы (CO)nRb; n равно 0 или 1; и Rb имеет значения, как определено для R; или его нетоксичный метаболически лабильный сложный эфир или амид; или их фармацевтически приемлемая соль.
2. Соединение по п.1, где R представляет собой группу бензил или дифенилметил, в которой любое фенильное кольцо является незамещенным или замещенным как определено в п.1.
3. Соединение по п.1, где R представляет собой метил, фенилпропил, бензил, 2-фторбензил, 3-фторбензил, 4-фторбензил, 2,3-дифторбензил, 2,4-дифторбензил, 2,5-дифторбензил, 3,5-дифторбензил, 3,4-дифторбензил, 2,3,4-трифторбензил, 2-хлорбензил, 3-хлорбензил, 4-хлорбензил, 2,3-дихлорбензил, 2-хлор-5-трифторметилбензил, 3-хлор-4-фторбензил, 2-метилбензил, 3-метилбензил, 4-метилбензил, 4-фтор-3-метилбензил, 3-фтор-2-метилбензил, 3,5-диметилбензил, 4-изопропилбензил, 2,4-диметилбензил, 2,5-диметилбензил, 2-метоксибензил, 3-метоксибензил, 4-метоксибензил, 3-фтор-4-метоксибензил, 3-метил-4-метоксибензил, 4-трифторметилбензил, 3-фтор-5-трифторметилбензил, 3-трифторметоксибензил, 3-тетрафторэтоксибензил, 4-фенилбензил, 3-феноксибензил, 3-(3-трифторметилфенокси)бензил, 3-(4-хлорфенокси)бензил или дифенилметил.
4. Соединение по любому из пп.1-3, где Х представляет собой связь.
5. Соединение по любому из пп.1-4, которое имеет стереохимию, показанную ниже.
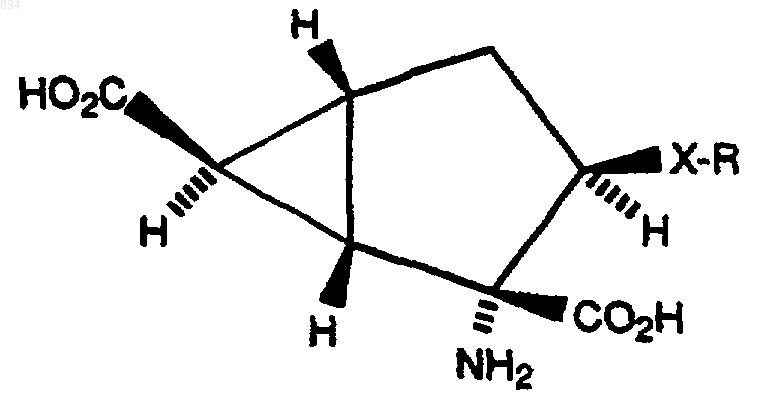
6. Способ получения соединения формулы I, который включает:
а) гидролиз соединения формулы II
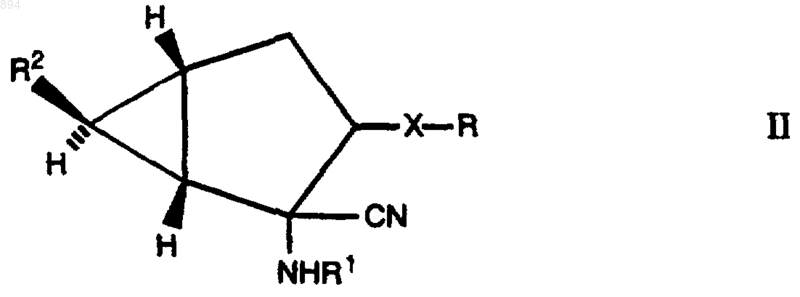
где R1 представляет атом водорода или ацильную группу, а R2 представляет карбоксильную группу или эстерифицированную карбоксильную группу, или его соли;
b) гидролиз соединения формулы III
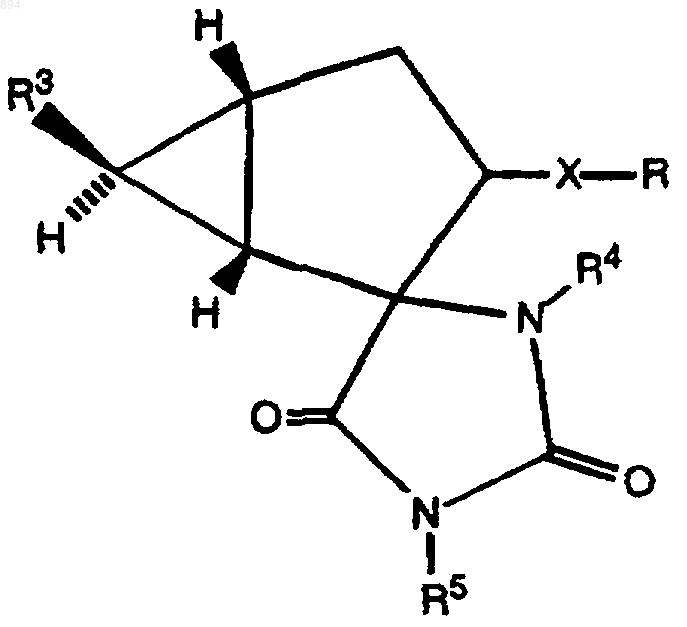
где R3 представляет карбоксильную группу или эстерифицированную карбоксильную группу, а R4 и R5, каждый независимо, представляют атом водорода, (2-6С)алканоильную группу, (1-4С)алкильную группу, (3-4С)алкенильную группу или фенил (1-4С)алкильную группу, где фенил является незамещенным или замещенным галогеном, (1-4С)алкилом или (1-4С)алкокси, или его соли; или
с) удаление защитной группы из соединения формулы IV
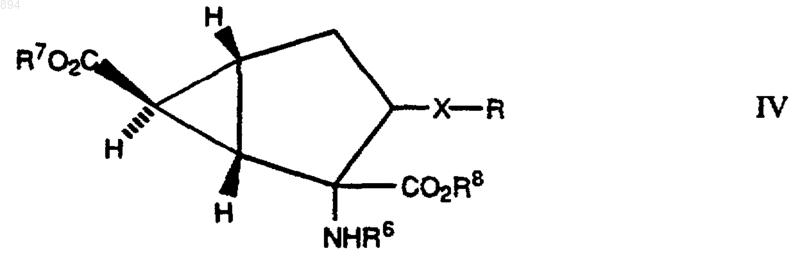
в которой R6 представляет атом водорода или защищающую атом азота группу, а каждый из R7 и R8 независимо представляет атом водорода или группу, защищающую карбоксильную группу, или из его соли;
с последующим, если необходимо и/или желательно,
(i) растворением соединения формулы I;
(ii) превращением соединения формулы I в его нетоксичный метаболически лабильный сложный эфир или амид; и/или
(iii) превращением соединения формулы I или его нетоксичного метаболически лабильного сложного эфира или амида в его фармацевтически приемлемую соль.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-5 и фармацевтически приемлемый носитель, разбавитель или наполнитель.
8. Соединение формулы II

где Х и R определены как указано в п.1, R1 представляет атом водорода или ацильную группу и R2 представляет карбоксильную группу или эстерифицированную карбоксильную группу, или его соль.
9. Соединение формулы III

где Х и R определены как указано в п.1, R3 представляет карбоксильную группу или эстерифицированную карбоксильную группу, а R4 и R5, каждый независимо, представляют атом водорода, (2-6С)алканоильную группу, (1-4С)алкильную группу, (3-4С)алкенильную группу или фенил(1-4С)алкильную группу, где фенил является незамещенным или замещенным галогеном, (1-4С)алкилом или (1-4С)алкокси, или его соль.
10. Соединение формулы IV
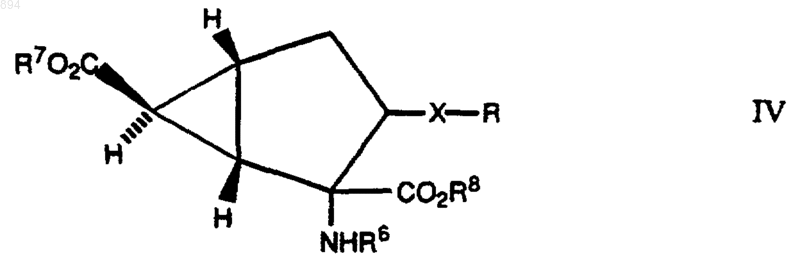
где Х и Rопределены как указано в п.1, R6 представляет атом водорода или защищающую атом азота группу, а каждый из R7 и R8 независимо представляет атом водорода или группу, защищающую карбоксильную группу, или его соль.
Текст
1 В центральной нервной системе (ЦНС) млекопитающих передача нервных импульсов регулируется взаимодействием между нейротрансмиттером (медиатором), который высвобождается передающим нейроном, и поверхностным рецептором на воспринимающем нейроне, причем такое взаимодействие вызывает возбуждение этого воспринимающего нейрона.L-Глутамат, который является преобладающим медиатором в ЦНС, опосредует главный путь возбуждения в организме млекопитающих и рассматривается как возбуждающая аминокислота (ВАК). Рецепторы, которые реагируют на глутамат, называются рецепторами возбуждающих аминокислот (рецепторы ВАК). СмотриPharm. Sci., 11, 25 (1990). Возбуждающие аминокислоты являются физиологически очень важными, играющими роль в разнообразных физиологических процессах, таких как долгосрочная потенция (познавательная способность и память), развитие синаптической пластичности, двигательного контроля, дыхания, сердечно-сосудистой регуляции и сенсорного восприятия. Рецепторы возбуждающих аминокислот классифицируют на два главных типа. Рецепторы, которые непосредственно связаны с открытием катионных каналов в клеточной мембране нейронов, называют "ионотропными". Этот тип рецептора подразделен, по меньшей мере, на три подтипа, которые устанавливаются по деполяризующим действиям селективных агонистов(NMDA),-амино-3 гидрокси-5-метилизоксазол-4-пропионовой кислоты (АМРА) и каиновой кислоты (КА). Вторым главным типом рецептора является G-белок или связанный со вторичным мессенджером"метаботропный" рецептор возбуждающих аминокислот. Этот второй тип связан с множественными системами вторичного мессенджера,которые способствуют гидролизу фосфоинозитида, активации фосфолипазы D, усиливают или уменьшают образование цАМФ (циклического аденозинмонофосфата) и изменяют функцию ионных каналов. Schoepp and Conn, Trends inPharmacol. Sci., 14, 13 (1993). Оба типа рецепторов проявляют не только способность опосредовать нормальную синаптическую трансмиссию вдоль возбуждающих путей, но также принимают участие в модификации синаптических связей во время развития и на протяжении жизни. Schoepp, Bockaert and Sladeczek, Trends inJohnson, Brain Research Reviews, 15, 41 (1990). Избыточная или несвойственная стимуляция рецепторов возбуждающей аминокислоты ведет к повреждению или потере нервных клеток путем механизма, известного как эксцито 000894 2 токсичность. Предполагается, что этот процесс опосредует нейронную дегенерацию в различных состояниях. Медицинские последствия такой нейронной дегенерации делают ослабление этих дегенеративных нейрологических процессов важной терапевтической задачей. Метаботропные рецепторы глутамата являются очень гетерогенным семейством рецепторов глутамата, которые связаны с множественными путями вторичных мессенджеров. Эти рецепторы функционируют так, что модулируют пресинаптическое высвобождение глутамата и постсинаптическую чувствительность нервной клетки к возбуждению глутаматом. Соединения,которые модулируют функцию этих рецепторов,в частности агонисты и антагонисты глутамата,пригодны для лечения острых и хронических нейродегенеративных состояний и в качестве антипсихотических, противосудорожных, анальгезирующих, анксиолитических, антидепрессивных и противорвотных средств. Данное изобретение представляет соединение формулы в которой Х обозначает связь, S, О или NRa; R обозначает (1-4 С) алкильную группу или (1-4 С) алкильную группу, замещенную ароматической группой, которая является необязательно замещенной; Ra обозначает водород или группу формулы (CO)nRb; n равно 0 или 1; Rb обозначает то же, что описано для R; или его нетоксичный метаболически лабильный сложный эфир или амид; или его фармацевтически приемлемую соль. Следует учитывать, что соединения формулы I содержат, по меньшей мере, четыре асимметричных атома углерода; три находятся в кольце циклопропана, а два находятся в кольце циклопентана. Данное изобретение включает все стереоизомерные формы соединений формулы I, включая как отдельные энантиомеры,так и их смеси. Предпочтительно соединения формулы I имеют конфигурацию, показанную ниже Наиболее предпочтительна конфигурация формулы Ib. Как используется здесь, термин "алкил" обозначает группу с прямой или разветвленной цепью. Примеры значений для (1-4 С) алкильной группы включают метил, этил, пропил, изопропил, бутил и изобутил. Термин "ароматическая группа", как он здесь используется, обозначает фенил. 3 Термин "необязательно замещенная", как используется в термине "необязательно замещенная ароматическая группа", здесь обозначает, что могут присутствовать один, два или три заместителя, причем указанные заместители выбираются из атомов и групп, которые, когда присутствуют в соединении формулы I, не препятствуют соединению формулы I функционировать в качестве модулятора функции метаботропного рецептора глутамата. Примерами таких атомов и групп, которые могут присутствовать в необязательно замещенной ароматической группе, являются галоген, (1-4 С)алкил, (1-4 С)алкокси, необязательно замещенный фенил, необязательно замещенная фенокси, (1-4 С)фторалкил и (1-4 С)фторалкокси. Примерами конкретных значений являются фтор, хлор, бром, йод, метил, метокси, фенокси,3-трифторметилфенокси, 4-хлорфенокси, трифторметил, трифторметокси и тетрафторэтокси. Примерами значений для необязательно замещенной ароматической группы являются фенил, 2-дифенил, 3-дифенил, 4-дифенил, 2 фторфенил, 3-фторфенил, 4-фторфенил, 2,3 дифторфенил, 2,4-дифторфенил, 2,5-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2,3,4 трифторфенил, 2-хлорфенил, 3-хлорфенил, 4 хлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил,3,4-дихлорфенил, 3,5-дихлорфенил, 3-хлор-4 фторфенил, 2-бромфенил, 3-бромфенил, 4 бромфенил, 2-метилфенил, 3-метилфенил, 4 метилфенил,3,5-диметилфенил,4-фтор-3 метилфенил, 3-фтор-2-метилфенил, 2-метоксифенил, 3-метоксифенил, 4-метоксифенил, 3,5 диметилфенил,2,3-диметоксифенил,2,5 диметоксифенил, 3,4-диметоксифенил, 3,5 диметоксифенил, 3-фтор-4-метоксифенил, 2 трифторметилфенил, 3-трифторметилфенил, 4 трифторметилфенил, 2-фтор-3-трифторметилфенил, 3-трифторметил-4-фторфенил, 3-трифторметил-5-фторфенил, 2-хлор-5-трифторметилфенил, 2-фтор-5-трифторметилфенил, 3 трифторметоксифенил,3-тетрафторэтоксифенил, 2-феноксифенил и 3-феноксифенил. Примерами значений для R, когда он представляет (1-4 С) алкильную группу, являются метил, этил и пропил. Примерами значений для R, когда он представляет (1-4 С) алкильную группу, замещенную ароматической группой, являются фенил(1-4 С) алкил и дифенил(1-4 С)алкил, особенно бензил и дифенилметил-группы, которые являются незамещенными или замещенными на фениле одним, двумя или тремя заместителями, выбранными независимо из галогена, (1-4 С) алкила,(1-4 С)алкокси, (1-4 С)фторалкила, (1-4 С)фторалкокси, фенила, фенокси, 3-трифторметилфенокси и 4-хлорфенокси. Предпочтительно R представляет фенил(1-4 С)алкил и дифенил(1-4 С)алкилгруппу, особенно бензил или дифенилметилгруппу, где какое-либо фенильное кольцо является незаме 000894 4 щенным или замещенным одним, двумя или тремя заместителями, выбранными независимо из фтора, хлора, метила, изопропила, метокси,трифторметила, трифторметокси, тетрафторэтокси, фенила, фенокси, 3-трифторметилфенокси и 4-хлорфенокси. Конкретными значениями для R являются метил, фенилпропил, бензил, 2-фторбензил, 3 фторбензил, 4-фторбензил, 2,3-дифторбензил,2,4-дифторбензил,2,5-дифторбензил,3,5 дифторбензил, 3,4-дифторбензил, 2,3,4-трифторбензил, 2-хлорбензил, 3-хлорбензил, 4 хлорбензил,2,3-дихлорбензил,2-хлор-5 трифторметилбензил, 3-хлор-4-фторбензил, 2 метилбензил, 3-метилбензил, 4-метилбензил, 4 фтор-3-метилбензил, 3-фтор-2-метилбензил, 3,5 диметилбензил, 4-изопропилбензил, 2,4-диметилбензил,2,5-диметилбензил,2-метоксибензил, 3-метоксибензил, 4-метоксибензил, 3 фтор-4-метоксибензил, 3-метил-4-метоксибензил, 4-трифторметилбензил, 3-фтор-5-трифторметилбензил, 3-трифторметоксибензил, 3-тетрафторэтоксибензил, 4-фенилбензил, 3-феноксибензил, 3-(3-трифторметил-фенокси)бензил,3-(4-хлорфенокси)бензил и дифенилметил. Предпочтительным значением для Ra является водород. Х предпочтительно обозначает связь. Данное изобретение включает фармацевтически приемлемые соли соединений формулыI. Эти соли могут существовать в соединении с кислотной или основной частью молекулы и могут существовать как кислотно-аддитивные соли, соли первичного, вторичного, третичного или четвертичного аммония, щелочного или щелочно-земельного металла. Обычно кислотно-аддитивные соли получают реакцией кислоты с соединением формулы I. Соли щелочного и щелочно-земельного металла получают обычно реакцией гидроксидной формы желательной соли металла с соединением формулы I. Кислоты, обычно используемые для образования таких солей, включают неорганические кислоты, такие как хлористоводородная, бромистоводородная, йодистоводородная, серная и фосфорная кислота, а также органические кислоты, такие как паратолуолсульфоновая, метансульфоновая, щавелевая, парабромфенилсульфоновая, угольная, янтарная, лимонная,бензойная и уксусная кислота и аналогичные неорганические и органические кислоты. Поэтому такие фармацевтически приемлемые соли включают сульфат, пиросульфат, бисульфат,сульфит, бисульфит, фосфат, соли аммония,моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, йодид,ацетат, пропионат, деканоат, каприлат, акрилат,формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат,себацинат, фумарат, гиппурат, бутин-1,4-диоат,гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, ме 5 токсибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, а-гидроксибутират, гликолат, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат, соли магния, тетраметиламмония, калия, триметиламмония, натрия, метиламмония, кальция и подобные соли. Фармацевтически приемлемый метаболически лабильный сложный эфир и амид соединений формулы I являются эфирными или амидными производными соединений формулыI, которые гидролизуются in vivo с образованием указанного соединения формулы I и фармацевтически приемлемого спирта или амина. Примеры метаболически лабильных сложных эфиров включают сложные эфиры, образованные с (1-6 С)алканолами, в которых принадлежащая алканолу часть молекулы может быть необязательно замещена (1-8 С)алкоксигруппой,например, с метанолом, этанолом, пропанолом и метоксиэтанолом. Примеры метаболически лабильных амидов включают амиды, образованные с аминами, такими как метиламин. Согласно другому аспекту, данное изобретение предоставляет способ получения соединения формулы I, который содержит а) гидролиз соединения формулы II в которой R1 обозначает атом водорода или ацилгруппу, и R2 обозначает карбоксильную группу или сложноэфирную карбоксильную группу, или его соли; б) гидролиз соединения формулы III в которой R3 обозначает карбоксильную группу или сложноэфирную карбоксильную группу, иR4 и R5, каждый независимо, обозначает атом водорода, (2-6 С)алканоилгруппу, (1-4 С)алкилгруппу, (3-4 С)алкенилгруппу или фенил (14 С)алкилгруппу, где фенил является незамещенным или замещенным галогеном, (14 С)алкилом или (1-4 С)алкокси, или его соли; или в) удаление защитной группы у соединения формулы IV 6 в которой R6 обозначает атом водорода или защищающую азот группу и каждый из R7 и R8 независимо обозначает атом водорода или группу, защищающую карбоксил, или у его соли; после этого, если необходимо и/или желательно,(i) растворение соединения формулы I;(ii) превращение соединения формулы I в нетоксичный метаболически лабильный сложный эфир или амид его и/или(iii) превращение соединения формулы I или его нетоксичного метаболически лабильного сложного эфира или амида в фармацевтически приемлемую соль его. Защита карбоксильной кислотной и аминогрупп подробно описана в McOmie, ProtectingGroups in Organic Chemistry, Plenum Press, NY,1973 и Green and Wuts, Protecting Groups in Organic Synthesis, 2nd. Ed., John WileySons, NY,1991. Примеры карбоксизащитных групп включают алкилгруппы, такие как метил, этил, третбутил и трет-амил; аралкилгруппы, такие как бензил, 4-нитробензил, 4-метоксибензил, 3,4 диметоксибензил, 2,4-диметоксибензил, 2,4,6 триметоксибензил, 2,4,6-триметилбензил, бензгидрил и тритил; силилгруппы, такие как триметилсилил и трет-бутилдиметилсилил; и аллилгруппы, такие как аллил и 1-(триметилсилилметил)проп-1-ен-3-ил. Примеры аминозащитных групп включают ацилгруппы, такие как группы формулы R11CO, где R11 обозначает(1-6 С)алкил, (3-10 С)циклоалкил, фенил(1-6 С) алкил, фенил, (1-6 С)алкокси, фенил(1-6 С) алкокси или (3-10 С)циклоалкокси, где фенилгруппа может быть необязательно замещена одним или двумя заместителями, независимо выбранными из амино, гидрокси, нитро, галогена, (1-6 С)алкила, (1-6 С)алкокси, карбокси,(1-6 С)алкоксикарбонила,карбамоила,(16 С)алканоиламино, (1-6 С)алкилсульфониламино, фенилсульфониламино, толуолсульфониламино и (1-6 С)фторалкила. Соединения формулы II обычно гидролизуют в присутствии кислоты, такой как хлористоводородная кислота или серная кислота, или основания, такого как гидроксид щелочного металла, например, гидроксид натрия. Гидролиз обычно проводят в водном растворителе, таком как вода, и при температуре в диапазоне от 50 до 200 С. Соединения формулы III обычно гидролизуют в присутствии основания, например, гидроксида щелочного металла, такого как гидроксид лития, натрия или калия, или гидроксида щелочно-земельного металла, такого как гидроксид бария. Подходящая реакционная среда включает воду. Температуру обычно поддерживают в диапазоне от 50 до 150 С. Предпочтительными значениями для R1 являются водород и (2-6 С)алканоилгруппы, такие как ацетил. Предпочтительными значениями для R2,когда он представляет сложноэфирную карбок 7 сильную группу, являются (1-6 С)алкоксикарбонилгруппы, такие как этоксикарбонил. Защитная группа у соединений формулыIV может быть удалена обычным способом. Так,алкилгруппа, защищающая карбоксил, может быть удалена гидролизом. Гидролиз обычно может быть проведен нагреванием соединения формулы IV в присутствии либо основания, например, гидроксида щелочного металла, такого как гидроксид лития, натрия или калия, или гидроксида щелочно-земельного металла, такого как гидроксид бария, либо в присутствии кислоты, такой как хлористо-водородная кислота. Гидролиз обычно проводят при температуре в диапазоне от 10 до 300 С. Аралкилгруппа, защищающая карбоксил, обычно может быть удалена гидрированием. Гидрирование обычно может быть осуществлено путем реакции соединения формулы IV с водородом в присутствии, в качестве катализатора, металла VIII группы,например, палладиевого катализатора, такого как палладий на активированном угле. Подходящие растворители для реакции включают спирты, такие как этанол. Реакцию обычно проводят при температуре в диапазоне от 0 до 100 С. Ацил, защищающий аминогруппу, обычно также удаляют гидролизом, например, как описано для удаления алкила, защищающего карбоксильную группу. Соединения формулы II могут быть получены реакцией соединения формулы V с цианидом щелочного металла, таким как цианид лития, натрия или калия, и с галогенидом аммония, таким как хлорид аммония; Обнаружено, что предпочтительно проводить реакцию под воздействием ультразвука. Так, галогенид аммония преимущественно смешивают с чистым для хроматографии оксидом алюминия в присутствии подходящего разбавителя, такого как ацетонитрил. Смесь затем подвергают воздействию ультразвука, после чего добавляют соединение формулы V и снова подвергают смесь воздействию ультразвука. Затем добавляют цианид щелочного металла с последующим дополнительным воздействием ультразвуком. Полученная смесь диастереоизомерных аминонитрилов может быть затем подвергнута реакции с ацилирующим агентом, таким как ацетилхлорид, в присутствии подходящего основания, например, амина, такого как этилдиизопропиламин, и в присутствии подходящего растворителя, такого как дихлорметан, чтобы получить смесь диастереомерных ациламинонитрилов. Желательный диастереоизомер обычно может быть отделен от этой смеси, например,путем хроматографии. 8 Соединения формулы III могут быть получены путем реакции соединения формулы V с цианидом щелочного металла, таким как цианид лития, натрия или калия, и карбонатом аммония в водном спирте, таком как водный этанол. Обычно реакцию проводят при температуре в диапазоне от 35 до 150 С. Если желательно,соединения формулы III могут быть затем алкилированы, например, с использованием соответствующего соединения формулы R4Cl и/илиR5Cl. Соединения формулы V, где Х обозначает связь, и R обозначает группу (1-6 С)алкил или замещенный (1-6 С)алкил, могут быть получены гидрированием соединения формулы VI где Ra = обозначает группу, способную гидрироваться до группы R. Например, когда RX обозначает незамещенную или замещенную бензильную группу, Ra обозначает незамещенную или замещенную фенильную группу. Альтернативно, соединения формулы VI могут быть подвергнуты реакции с подходящим металлорганическим реагентом, таким как цинкорганический реагент, например, бромид фенилцинка, чтобы получить соединение формулы V. Полученное соединение формулы V может быть подвергнуто эпимеризации, например, путем обработки сильным основанием, таким как этоксид натрия в этаноле. Гидрирование обычно проводят в присутствии, в качестве катализатора, металла VIII группы, такого как никель Ренея. Подходящие растворители включают сложные эфиры, такие как этилацетат. Температуру обычно поддерживают в диапазоне от 0 до 100 С. Соединения формулы VI могут быть получены путем дегидратации соединения формулы Дегидратацию обычно осуществляют в присутствии дегидратирующего агента, например, сульфонилхлорида, такого как птолуолсульфонилхлорид или метансульфонилхлорид. Альтернативно, соединения формулы V могут быть получены путем гидрирования соединения формулы VII в присутствии палладиевого катализатора, например, палладия на угле. Соединения формулы VII могут быть получены реакцией соединения формулы VIII 9 с сильным основанием (например, литийбис(триметилсилил)амидом) с образованием енолат-соли. Енолат-соль затем подвергают реакции с альдегидом формулы RaCHO в присутствии кислоты Льюиса, такой как ВF3-эфират. Подходящие растворители для реакции включают простые эфиры, такие как тетрагидрофуран. Альтернативно, соединения формулы VI могут быть получены реакцией соединения формулы VIII с альдегидом формулы RaCHO в присутствии пирролидина. Подходящие растворители для реакции включают спирты, такие как этанол. Реакцию обычно проводят при температуре в диапазоне от 0 до 100 С. Соединения формулы VI могут быть также получены путем реакции соединения формулыVIII с альдегидом формулы RaCHO в присутствии основания, такого как гидроксид натрия, и в водной реакционной среде, такой как вода. В условиях этой реакции защитная группа R2 может быть удалена гидролизом. Она может быть повторно введена, например, этиловая защитная группа может быть повторно введена путем реакции соединения формулы VI с этилхлорформиатом в присутствии основания, такого как триэтиламин. Соединения формулы VIII известны и могут быть получены путем реакции циклопентен 1-она с карбоксизащищенным (диметилсульфуранилиден)ацетатом. Подходящие растворители для реакции включают ароматические углеводороды, такие как толуол. Желательный диастереомерный продукт может быть выделен путем хроматографии. Получение 1S, 5R, 6S-2-оксабицикло [3.1.0]гексан-6-карбоновой кислоты описано в примере 19 в опубликованной Европейской патентной заявкеEP-A1-0696577. Соединения формулы V, где Х обозначает связь, могут быть также получены путем алкилирования соли енола соединения формулыVIII. Подходящие алкилирующие агенты включают соединения формулы RZ, где Z обозначает уходящий атом или группу, например, атом галогена, такой как бром. Так, соединение формулы VIII обычно превращают в соль енола путем реакции с сильным основанием, таким как литий (триметилсилил)амид, затем ее подвергают реакции с алкилирующим агентом. Подходящие растворители для реакции включают простые эфиры, такие как простой диэтиловый эфир и тетрагидрофуран. Альтернативно, соединения формулы V могут быть получены путем реакции соединения формулы IX 10 реакции включают ароматические углеводороды, такие как толуол. Соединения формулы V, где Х обозначаетNH, могут быть получены путем алкилирования соединения формулы Х Алкилирование может быть осуществлено с использованием обычной методики, например,путем реакции соединения формулы Х с соединением формулы RZ, где Z обозначает уходящий атом или группу, например, атом галогена,в присутствии основания. Соединения формулы Х могут быть получены несколькими способами из соединения формулы VIII. Согласно одному способу, соединение формулы VIII подвергают реакции с соединением формулы RONO в присутствии основания,такого как алкоксид щелочного металла, с образованием оксима. Реакцию обычно проводят в соответствии со способом, описанным в Williams, J.R. et al., J. Org. Chem., 1982, 47, 2536 иWheeler, T.N. and Mainwald., J. Org Synth. VI,1988, 840. Оксим затем восстанавливают, например, путем гидрирования в присутствии палладиевого катализатора или с использованием цинка в уксусной кислоте. Процедуры восстановления, как правило, придерживаются соответствующих способов, описанных в J. Med.Chem., 1984, 27, 20 и Fischer, H. Org Synth. Ill,1955, 513. Согласно другому способу, соединение формулы VIII подвергают реакции с арилсульфонилазидом в присутствии основания, такого как литийдиизопропиламид или литийбис(триметилсилил)амид, чтобы получить азид. Реакцию обычно проводят в соответствии со способом, описанным в Evans, D.A., et al., J. Am.Chem. Soc., 1990, 112, 4011-4030. Азид затем восстанавливают, например, путем гидрирования в присутствии палладия на угле, или используя хлорид олова (II). Восстановление обычно осуществляют в соответствии со способом, описанным Evans, et al. (см. выше). Согласно еще одному способу, соединение формулы VIII подвергают реакции с соединением формулы C(NO2)4 в присутствии основания,такого как литийдиизопропиламид или литийбис-(триметилсилил)амид, чтобы получить нитросоединение. Реакцию, как правило, проводят в соответствии со способом, описанным в Rathore, R., et al., Tetrahedron Lett., 1993, 49, 18591862. Нитросоединение затем восстанавливают,например, с использованием формиата аммония в присутствии палладиевого катализатора. Восстановление обычно осуществляют в соответствии со способом, описанным в Ram, S. et al.,Tetrahedron Lett., 1984, 25, 3415-3418.S, могут быть получены путем реакции соединения формулы VIII с соединением формулы RS-S-R в присутствии основания. Реакцию обычно проводят в соответствии со способом, описанным в Trost, B.M. et al., J. Am. Chem. Soc.,1975, 97, 438-440. Соединения формулы V, где X обозначает О, могут быть получены путем алкилирования соединения формулы XI Алкилирование может быть осуществлено с использованием обычного способа. Например,соединение формулы XI может быть подвергнуто реакции с соединением формулы R-Z, где Z обозначает уходящий атом или группу, например, атом галогена, в присутствии основания. Альтернативно, соединения формулы V, где R обозначает ароматическую группу, могут быть получены путем реакции соответствующего фенола формулы ROH с соединением формулыXI согласно методу хорошо известной реакцииMitsunobu. Этот фенол формулы ROH подвергают реакции с соединением формулы XI в присутствии триарилфосфина и диэтилазодикарбоксилата. Соединения формулы XI могут быть получены путем реакции соединения формулы VIII с диметилдиоксираном в присутствии основания. Реакцию обычно проводят в соответствии со способом, описанным в Guertin, K.R., et al., Tetrahedron Lett., 1991, 32, 715. Многие из промежуточных соединений,описанных здесь, например, соединения формулII, III и IV, как полагают, являются новыми и представляют собой дальнейшие аспекты изобретения. Конкретная доза вводимого соединения,согласно этому изобретению, будет, конечно,определяться конкретными обстоятельствами в каждом конкретном случае, включая вводимое соединение, путь введения, конкретное состояние, подвергаемое лечению и подобные соображения. Соединения могут вводиться разными путями, включая пероральное, ректальное, чрескожное, подкожное, внутривенное, внутримышечное или интраназальное введение. Альтернативно, соединения могут быть введены путем непрерывного вливания. Обычная суточная доза будет содержать от около 0,01 мг/кг до около 100 мг/кг активного соединения этого изобретения. Предпочтительно суточные дозы будут около 0,05 до около 50 мг/кг, более предпочтительно от около 0,1 до около 25 мг/кг. Показано, что разнообразные физиологические функции подвержены влиянию избыточной или несвойственной стимуляции передачи возбуждающей аминокислоты. Соединения формулы I данного изобретения, как полагают, 000894 12 имеют способность лечить разнообразные неврологические расстройства у млекопитающих,связанные с этим состоянием, включая острые неврологические расстройства, такие как церебральные нарушения после операции шунтирования на сердце и трансплантации, удар, церебральная ишемия, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца и гипогликемическое нейронное расстройство. Соединения формулы I, как полагают, имеют способность лечить разнообразные хронические неврологические расстройства,такие как болезнь Альцгеймера, хорея Хантингтона, боковой амиотрофический склероз,СПИД-индуцированная деменция, глазное поражение и ретинопатия, расстройства познавательной способности и идиопатическая или вызванная лекарством болезнь Паркинсона. Данное изобретение предоставляет также способы лечения этих расстройств, которые содержат введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I или его фармацевтически приемлемого метаболически лабильного сложного эфира или амида или его фармацевтически приемлемой соли. Соединения формулы I данного изобретения, как представляется, имеют также способность лечить разнообразные другие неврологические расстройства у млекопитающих, которые ассоциируются с глутаматной дисфункцией,включая мышечные спазмы, судороги, головные боли при мигрени, недержание мочи, синдром отмены никотина, психоз, (такой как шизофрения), толерантность к опиату и синдром его отмены, тревожное состояние, рвота, отек мозга,хроническая боль и поздняя дискинезия. Соединения формулы I являются также полезными в качестве тимолептических и анальгезирующих средств. Таким образом, данное изобретение предоставляет также способы лечения этих расстройств, которые включают введение пациенту, при необходимости этого, эффективного количества соединения формулы I или его фармацевтически приемлемого метаболически лабильного сложного эфира или амида или его фармацевтически приемлемой соли. Были проведены эксперименты для демонстрации способности соединений формулы I воздействовать на рецепторы возбуждающей аминокислоты. Сродство к метаботропным рецепторам глутамата было продемонстрировано путем селективного смещения 1S,3R-ACPDчувствительного связывания [3 Н]глутамата с мембранами клеток мозга крысы. Связывание[3H] глутамата осуществляют с необработанными мембранами переднего мозга крысы, как описано Schoepp and True: Schoepp and True,Neuroscience Lett., 145, 100-104 (1992) и Wrightet al., J. Neurochemistry 63: 938-945 (1994). Обнаружено, что продукты из приведенных здесь примеров дают IС 50 менее, чем 10 мкМ в этом 13 испытании. Например, найдено, что продукт из примера 1 имеет IC50 0,32 мкМ. Основываясь на исследованиях опосредуемых рецептором изменений во внутриклеточных вторичных мессенджерах, метаботропный рецептор глутамата является либо связанным с улучшенным гидролизом фосфоинозитида, либо снижает стимулированное форсколином образование цАМФ. Соединения могут быть также испытаны на способность предотвращать ингибирование mGluR агонистом(IS,3R-ACPD, 20 мкМ) стимулируемого форсколином (30 мкМ) образования цАМФ с использованием срезов гипоталамуса крысы, как описаноInternational 22:277-283 (1993) и mGluR2 экспрессирующих ненейронных клеток человека(D.D. Schoepp et al., Neurоpharmacology, 34: 843850, (1995). При испытании продукта из приведенного здесь примера 4 установлено, что он обнаруживает анксиолитический эффект в мышиной модели каскадного плюс лабиринта (Lister, Psychopharmacology, 92: 180-185, 1987). При испытании продукта из приведенного здесь примера 25 установлено, что он обнаруживает нейролептические свойства на мышиной кондиционированной модели реакции активного избегания. (PfeifferJenney, Ann. N.Y. Acad.Plenum Press, 1978). Согласно другому аспекту, данное изобретение предоставляет способ модулирования одной или нескольких функций метаботропного рецептора глутамата в организме теплокровного млекопитающего, который включает введение эффективного количества соединения формулыI или его нетоксичного метаболически лабильного сложного эфира или амида или его фармацевтически приемлемой соли. Соединения данного изобретения перед употреблением предпочтительно вводят в состав лекарственных препаратов. Поэтому другим аспектом данного изобретения является фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый носитель, разбавитель или наполнитель. Данные фармацевтические композиции готовят путем известных процедур с использованием, хорошо известных и легко доступных ингредиентов. При получении препаратов данного изобретения активный ингредиент будет обычно смешиваться с носителем или разбавляться носителем, или может быть заключен внутрь носителя, и может быть в форме капсулы, саше, бумажного или другого контейнера. Когда носитель служит в качестве разбавителя,он может быть твердым, полутвердым или жидким материалом, который действует как носи 000894 14 тель, разбавитель или среда для активного ингредиента. Препараты могут быть в форме таблеток, пилюль, порошков, пастилок, саше,крахмальных облаток, эликсиров, суспензий,эмульсий, растворов, сиропов, аэрозолей, мазей,содержащих, например, вплоть до 10 мас.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков. Некоторые примеры подходящих носителей, наполнителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит,крахмалы, камедь акации, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция,микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, водный сироп, метилцеллюлозу, метил- и пропилгидроксибензоаты,тальк, стеарат магния и минеральное масло. Препараты дополнительно могут включать смазывающие агенты, смачиватели, эмульгирующие и суспендирующие вещества, консерванты,подслащиватели или ароматизирующие вещества. Препараты изобретения могут быть составлены так, чтобы обеспечивать быстрое, замедленное или задержанное высвобождение активного ингредиента после введения пациенту путем использования процедур, хорошо известных в этой области. Препараты предпочтительно готовят в унифицированной лекарственной форме, каждая доза содержит от около 5 до около 500 мг, более предпочтительно около 25 до около 300 мг активного ингредиента. Термин "унифицированная лекарственная форма" относится к физически дискретной единице, пригодной как унифицированные дозировки для людей и других млекопитающих, каждая единица содержит предопределенное количество активного материала,рассчитанное на то, чтобы получить желаемый терапевтический эффект, в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем. Следующие примеры препаратов являются только иллюстративными и не предназначаются для какого-либо ограничения объема изобретения. Препарат 1. Твердые желатиновые капсулы получают,используя следующие ингредиенты: Количество,мг/капсула Активный ингредиент 250 Крахмал, высушенный 200 Стеарат магния 10 Общее 460 мг Указанные выше ингредиенты смешивают и набивают в твердые желатиновые капсулы в количествах по 460 мг. Компоненты смешивают и спрессовывают в форме таблеток, каждая массой 665 мг. Препарат 3. Аэрозольный раствор готовят с содержанием следующих компонентов: Масса, % Активный ингредиент 0,25 Этанол 29,75 Пропеллант 22 (хлордифторметан) 70,00 Общее 100,00 Активное соединение смешивают с этанолом и смесь добавляют к порции Пропелланта 22, охлажденного до -30 С и переносят в заполняющее устройство. Необходимое количество вводят затем в контейнер из нержавеющей стали и разбавляют оставшимся пропеллантом. Затем в контейнер вставляют клапанные узлы. Препарат 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента, готовят следующим образом: Активный ингредиент 60 мг Крахмал 45 мг Микрокристаллическая целлюлоза 35 мг Поливинилпирролидон 4 мг Натрий-карбоксиметилкрахмал 4,5 мг Стеарат магния 0,5 мг Тальк 1 мг Общее 150 мг Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно смешивают. Раствор поливинилпирролидона смешивают с полученными порошками, которые затем пропускают через сито 14 меш США. Полученные таким образом гранулы сушат при 50 С и пропускают через сито 18 меш США. Натрий-карбоксиметилкрахмал,стеарат магния и тальк предварительно пропускают через сито 60 меш США, затем добавляют к гранулам, которые после перемешивания прессуют на таблетировочной машине, чтобы получить таблетки, каждая массой 150 мг. Препарат 5. Капсулы, содержащие по 80 мг медикамента каждая, получают следующим образом: 16 Активный ингредиент Крахмал Микрокристаллическая целлюлоза Стеарат магния Общее Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 45 и набивают в твердые желатиновые капсулы в количествах по 200 мг. Препарат 6. Суппозитории, каждый содержащий 225 мг активного ингредиента, могут быть получены следующим образом: Активный ингредиент 225 мг Диглицериды насыщенных жирных 2000 мг кислот Общее 2225 мг Активный ингредиент пропускают через сито 60 меш США и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием необходимого минимума тепла. Смесь затем разливают в форму для суппозитория номинальной емкостью 2 г и оставляют остывать. Препарат 7. Суспензии, каждая из которых содержит по 50 мг медикамента на дозу 5 мл, готовят следующим образом: Активный ингредиент 50 мг Натрий-карбоксиметилцеллюлоза 50 мг Сироп 1,25 мл Раствор бензойной кислоты 0,10 мл Ароматизаторq.v. Очищенная вода до общего объема 5 мл Медикамент пропускают через сито 45 меш США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом, чтобы получить мягкую пасту. Раствор бензойной кислоты, ароматизатор и краситель разбавляют некоторым количеством воды и добавляют при перемешивании. Затем добавляют достаточное количество воды для получения необходимого объема. Препарат 8. Внутривенный препарат может быть получен, как следует: Активный ингредиент 100 мг Маннит 100 мг 5 н. Гидроксид натрия 200 мл Очищенная вода до общего объема 5 мл Следующие примеры иллюстрируют изобретение. Следующие аббревиатуры используются в дальнейшем: EtOAc, этилацетат; THF, тетрагидрофуран; EtOH, этанол; IPA, изопропиловый спирт; DBU, 1,8-диазабицикло[5.4.0]ундец-7-ен;Et2O, диэтиловый эфир; DMAP, 4-диметиламинопиридин; ТsОН, п-толуолсульфоновая кислота; GC, газовая хроматография; nОе, ядерный эффект Оверхаузера; TLC, тонкослойная хроматография; HPLC, жидкостная хроматография под высоким давлением; m-СРВА, мхлорпербензойная кислота; FDMS, полевая десорбционная масс-спектрометрия. Препаративный пример 1. Бромид карбоэтоксиметил-диметилсульфония. Раствор этилбромацетата (265 г) и диметилсульфида (114 г) в ацетоне (500 мл) перемешивают при комнатной температуре. Спустя три дня указанное в заголовке соединение выделяют из реакционной смеси путем фильтрования. Температура плавления 88-90 С. Препаративный пример 2. (1SR,5RS,6SR) Этил-2-оксобицикло[3.1.0]гексан-6-карбоксилат. Суспензию бромида карбоэтоксиметилдиметилсульфония (45,5 г) в толуоле (350 мл) обрабатывают 1,8-диазабицикло[5.4.0]ундец-7 еном (30,2 г). Полученную смесь перемешивают при комнатной температуре. Через один час смесь обрабатывают 2-циклопентен-1-оном(19,57 г). После дополнительных 18 ч реакционную смесь добавляют к раствору 1 н. хлористоводородная кислота/хлорид натрия. Полученную смесь экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле, элюируют с линейным градиентом от 10% этилацетат/гексан до 50% этилацетат/гексан, чтобы получить 22,81 г указанного в заголовке соединения. Температура плавления: 36-38 С. FDMS: m/z = 168 (М+). Анализ, рассчитанный для C9H12O3: С 64,27; Н 7,19. Обнаружено: С 64,54; Н 7,11. Пример 1. Смесь 1SR,2SR,3RS,5RS,6SR-2 амино-3-(3-фенилпропил)бицикло[3.1.0]гексан 2,6-дикарбоновой кислоты и 1SR,2RS,3RS,5RS,6SR-2-aмино-3-(3-фенилпропил)бицикло[3.1.0]гексан-2,6-дикарбоновой кислоты.(а) 1SR,5RS,6SR-Этил-2-оксо-3-(3-фенил 1-гидроксипропил)-бицикло [3.1.0]гексан-6-карбоксилат. К раствору продукта препаратинового примера 2 (2,0 г, 11,9 ммоль) в безводном THF(200 мл) под N2 при -78 С добавляют литийбис(триметилсилил)амид (1 М в THF, 13,1 мл,13,1 ммоль). К этому раствору с помощью канюли добавляют предварительно смешанный раствор гидроциннамальдегида (2,0 г, 14,3 ммоль) и BF3Et2O (2,0 г, 14 ммоль) в безводномTHF (100 мл). Через 3 ч реакционную смесь гасят насыщенным раствором NH4Cl. Реакционную смесь распределяют между Et2O и H2O,органическую фазу отделяют, сушат (MgSO4) и концентрируют при пониженном давлении. Продукт очищают путем хроматографии (10%b) 1SR,5RS,6SR-Этил-2-оксо-3-3-фенил) пропен-1-ил)бицикло-[3.1.0]гексан-6-карбоксилат. К охлажденному раствору продукта со стадии (а) (1,9 г, 6,3 ммоль) в CH2Cl2 (15 мл) подN2 добавляют DBU (1,9 г, 12,6 ммоль) и метансульфонилхлорид (0,9 г, 6,3 ммоль). Реакции позволяют происходить при окружающей температуре в течение 16 ч, затем добавляют дополнительное количество DBU (1,9 г, 12,6 ммоль) и реакционную смесь нагревают с обратным холодильником в течение 4 ч. Реакционную смесь промывают 1 н. НС 1, органическую фазу сушат (MgSО 4) и концентрируют при пониженном давлении. Сырой продукт очищают(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-(3-фенилпропил)бицикло-[3.1.0]гексан-6-карбоксилат. Продукт со стадии (b) (0,97 г, 3,4 ммоль) иNi Ренея (0,25 г) объединяют в EtOAc и подвергают воздействию H2 (4,22 кг/кв.см) от 5 до 30 мин. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении с получением 0,95 г (97%) указанного в заголовке соединения. FDMS: M+ = 286. Анал. рассч. для С 18 Н 22 О 30,25H2O: С 74,33; Н 7,80. Обнаружено: С 74,33; Н 7,73.(d) К раствору продукта стадии (с) (0,8 г,2,8 ммоль) в EtOH (40 мл) добавляют раствор(NH4)2CO3 (0,95 г, 12,2 ммоль) и KCN (0,26 г,4,0 ммоль) в Н 2 О (40 мл). Реакционную смесь перемешивают при 60 С в течение 96 ч, затем охлаждают до окружающей температуры и частично концентрируют. Промежуточный продукт гидантоин собирают путем фильтрования, затем восстанавливают в ацетонитриле (25 мл) и обрабатывают DMAP (0,054 г, 0,4 ммоль) и раствором ди-трет-бутилдикарбоната (1,6 г, 7,6 ммоль) в СН 3 СN (5 мл). Реакционную смесь перемешивают в течение ночи, затем распределяют между водным NaHSO4 и Et2O. Изолированную органическую фазу сушат (MgSO4) и концентрируют, чтобы собрать 1,0 г бис-дитрет-бутилкарбаматзащищенного гидантоина. Этот продукт объединяют с 2 н. гидроксидом натрия (5 мл) и перемешивают в течение 24 ч. Водный НСl (6 н., 6 мл) добавляют и смесь перемешивают в течение дополнительных 72 ч. Реакционную смесь концентрируют и затем воссоздают в 20 мл смеси EtOH/H2O (1:1). Доводят рН до 3 и раствор охлаждают до 0 С. Твердые вещества отфильтровывают и промывают Н 2 О и ацетоном, чтобы собрать 0,212 г указанного в заголовке соединения. Дополнительные 0,064 г указанного в заголовке соединения получают катионообменной хроматогра 19 фией фильтрата (катионообменная смола Dowex 50WX8-100). В целом получают 0,276 г (33%) указанного в заголовке соединения. Т.пл. = 248249 С;a) 1SR,3SR,5RS,6SR-Этил-2-oкco-3-2,5 диметил)фенил-гидроксиметил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное в заголовке соединение получают способами из примеров 1(а) и 1(b), используя продукт препаративного примера 2 (5,0 г,29,8 ммоль) и 2,5-диметилбензальдегид (4,8 г,35,8 ммоль). Указанное в заголовке соединение(4,7 г, 52%) получают после очистки HPLC (5%b) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2,5 диметил)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное в заголовке соединение получают гидрогенолизом продукта стадии (а) (4,1 г,13,6 ммоль), используя 5% Pd на угле (1,0 г) при 4,22 кг/кв.см Н 2 в течение 24 ч при окружающей температуре. Фильтрование катализатора и испарение растворителя дает 3,6 г (93%) указанного в заголовке соединения. FDMS: M+ = 286. Анал. рассч. для С 18 Н 22O3: С 75,50; Н 7,74. Обнаружено: С 75,71; Н 7,78.c) 1SR, 2SR, 3SR, 5RS, 6SR-Этил-2 аминоацетил-2-циано-3-2,5-диметил)бензил) бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-32,5-диметил)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Смесь KCN (3,7 г, 56 ммоль),NH4Cl (3,0 г, 56 ммоль) и Аl2O3 (37 г) в СН 3 СN подвергают воздействию ультразвука под N2 в ультразвуковой ванне Branson 3200 в течение 1 ч. Затем добавляют продукт стадии (b) (0,6 г, 5,6 ммоль) и подвергают воздействию ультразвука в течение 72 ч при 45 С. Реакционную смесь фильтруют через Celite и фильтрат концентрируют до сухости. Промежуточный продукт аминонитрил, полученный таким образом, растворяют в СН 2 Сl2, охлаждают до 0 С и обрабатывают ацетилхлоридом (1,5 г, 19,2 ммоль) иN,N-диизопропилэтиламином (2,5 г, 19,2 ммоль) в CH2Cl2. Реакции позволяют происходить при окружающей температуре в течение 1 ч, затем смесь распределяют между CH2Cl2 и Н 2 О. Органическую фазу отделяют, сушат (MgSO4) и концентрируют при пониженном давлении. Сырой продукт очищают HPLC (10% EtOAc/гексан до 80% EtOAc/гексан) . Из этого получают 1,0 г[3.1.0]гексан-6-карбоксилат со стадии (с) (0,8 г,2,4 ммоль) нагревают с обратным холодильником в 5 н. НСl в течение ночи. Реакционную смесь затем концентрируют до сухости и очищают путем анионообменной хроматографии(Bio-Rad AG 1-X8, элюируют водным пиридином). Концентрирование элюента дает белое твердое вещество, которое промывают H2O,чтобы получить 0,11 г (15%) указанного в заголовке соединения. Т.пл. 250 С. Анал. рассч. для C17H21N1O40,2H2O: С 67,31; Н 7,03; N 4,56; Обнаружено: С 66,63; Н 6,99; N 4,62. Пример 3. 1SR,2SR,3SR,5RS,6SR-2-Aмино 3-4-фенил)бензил)бицикло[3.1.0]-гексан-2,6 дикарбоновая кислота. а) 1SR,5RS,6SR-Этил-2-oкco-3-(4-фенилбензилиденил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное в заголовке соединение получают способом из примера 1(а), используя продукт препаративного примера 2 (5,0 г, 29,7 ммоль) и 4-дифенилкарбоксальдегид (6,5 г, 35,8 ммоль), с последующей дегидратацией промежуточного продукта карбинола каталитическимTsOH и кипячением с обратным холодильником в толуоле. Сырой продукт очищают HPLC (10%b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-4 фенил)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное в заголовке соединение получают в соответствии со способом из примера 1(с), используя продукт стадии (а) (3,5 г, 10,5 ммоль) и Ni Ренея (0,9 г) . Продукт очищают(100 мл) добавляют продукт стадии (b) (2,4 г, 7,2 ммоль) при окружающей температуре. Реакционную смесь оставляют перемешиваться при окружающей температуре до тех пор, пока она не будет признана готовой путем GC, затем подкисляют 1 н. НСl. Продукт распределяют между Et2O и водным NаНСО 3. Органическую фазу отделяют, сушат над МgSO4 и концентрируют до сухости, получая указанное в заголовке соединение (2,2 г, 92%). Т.пл = 140-142 С;[3.1.0]гексан-6-карбоксилат. Указанное в заголовке соединение получают, используя способ примера 1(d) и используя продукт стадии (с) (2,1 г, 6,3 ммоль), KCNAl2O3 (41 г), с последующим ацетилированием ацетилхлоридом (1,3 г, 16,8 ммоль) и N,Nдиизопропилэтиламином (2,2 г, 16,8 ммоль) вCH2Cl2. Указанное в заголовке соединение (0,6 г, 26%) получают кристаллизацией из CH2Cl2.(e) Указанное в заголовке соединение получают способом из примера 2(d), используя продукт стадии (d) (0,6 г, 1,5 ммоль) при орошении флегмой из 2 или 5 н. НСl. Реакционную смесь испаряют до сухости. Сырой продукт затем растворяют в H2O при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают H2O, IPA и EtOAc, получая 0,06 г (11%) указанного в заголовке соединения в виде белого твердого вещества. Т.пл = 260-261 С; FDMS:a) 1SR,5RS,6SR-Этил-2-оксо-3-3-метил) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное в заголовке соединение получают способами из примеров 1(а) и 1(b), используя продукт препаративного примера 2 (6,0 г,35,7 ммоль) и 3-метилбензальдегид (5,1 г, 42,8 ммоль), с последующей дегидратацией промежуточного продукта карбинола каталитическимTsOH и кипячением с обратным холодильником в толуоле. Сырой продукт очищают HPLC (5% 22 Указанное в заголовке соединение получают, используя способ из примера 1(с), используя продукт стадии (а) (5,8 г, 21,5 ммоль) и Ni Ренея (1,5 г). Очистка HPLC (5% EtOAc/гексан до 50% EtOAc/гексан) дает 4,5 г (77%) указанного в заголовке соединения: FDMS: M+ = 272; Анал. рассч. для С 17 Н 20 О 3: С 74,97; Н 7,40. Обнаружено: С 75,18; Н 7,44.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-3-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают, используя способ из примера 2(с) с использованием продукта стадии (b) (3,0 г, 11,0 ммоль), KCN(7,2 г, 110 ммоль), NH4Cl (5,9 г, 110 ммоль) и Аl2O3 (40 г) с последующим ацилированием ацетилхлоридом (2,4 г, 30,3 ммоль) и N,Nдиизопропилэтиламином (3,9 г, 30,3 ммоль). Сырой продукт очищают HPLC (10%EtOAc/гексан до 80% EtOAc/гексан). Из этого получают 2,2 г (58%) 1SR,2SR,3SR,5RS,6SRЭтил-2-аминоацетил-2-циано-3-3-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилата (А) и 0,90 г (24%) 1SR,2RS,3SR,5RS,6SP-этил-2 аминоацетил-2-циано-3-3-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилата (В). (А): Т.пл. = 166-168 С. FDMS: М+ = 340. Анал. рассч. для C20H24O3N2: С 70,57; Н 7,11, N 8,23; Обнаружено: С 70,35; Н 7,17; N 8,39. (В): Т.пл. = 58-62 С. FDMS: М+ + 1 = 341. Анал. рассч. для С 20H24 О 3N2: С 70,57; Н 7,11, N 8,23; Обнаружено: С 70,80; Н 7,19; N 8,23. nOe подтверждение стереохимии.d) Указанное в заголовке соединение получают, используя способ из примера 3(е) с использованием продукта стадии (с) (1,0 г, 2,9 ммоль) при кипячении с обратным холодильником в 5 н. НСl в течение ночи. Собирают 0,64 гa) 1SR,5RS,6SR-Этил-2-oкco-3-2,4-диметилбензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 1(а), используя продукт препаративного примера 2: (8,1 г, 48,1 ммоль) и 2,4 диметилбензальдегид (7,74 г, 57,8 ммоль). Дегидратации промежуточного продукта карбинола достигают кипячением с обратным холодильником с TsOH в толуоле. Сырой продукт очищают HPLC (10% EtOAc/гексан до 50%b) 1SR,3RS,5RS,6SR-Этил-2-oкco-3-2,4 диметил)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с), но используя продукт со стадии(с) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2,4 диметил)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают, используя способ из примера 3(с) с использованием продукта со стадии (b) (1,0 г, 3,5 ммоль) и металлического Na (0,1 г, 4,3 г-атом). Экстракционная переработка дает 1,0 г (99%) указанного в заголовке соединения. FDMS: М+ = 286; Анал. рассч. для С 18 Н 22O3: С 75,50; Н 7,74. Обнаружено: С 75,61; Н 7,51.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-2,4-диметил)-бекзил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии (с) (1,2 г, 4,2 ммоль), NH4Cl (2,2 г, 42 ммоль), KCN (2,7 г, 42 ммоль), Аl2O3 (48 г). Сырой аминонитрил ацетилируют ацетилхлоридомC21H26N2O30,7EtOAc: С 68,70; Н 7,65, N 6,73; Обнаружено: С 68,82; Н 7,48; N 6,94. е) Указанное в заголовке соединение получают способом из примера 3(е) с использованием 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил 2-циано-3-2,4-диметил)бензил)бицикло[3.1.0] гексан-6-карбоксилата со стадии (d) (0,32 г, 0,9 ммоль) при кипячении с обратным холодильником в 5 н. НСl, получая 0,235 г (86%) указанного в заголовке соединения. Т.пл. 250 С. FDMS: М+ = 303. Анал. рассч. для C17H21NO4: С 67,31; Н 6,98, N 4,62. Обнаружено: С 67,10; Н 7,07; N 4,89. Пример 6. 1SR,2SR,3SR,5RS,6SR-Амино-34-(2-пропилбензил)бицикло-[3.1.0]гексан-6 карбоновая кислота. 24 а) 1SR,5RS,6SR-Этил-2-оксо-3-4-(2 пропилбензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают, используя способ из примера 1(а) с использованием продукта препаративного примера 2(4,2 г, 25 ммоль) и 4-изопропил-бензальдегида (4,4 г, 30 ммоль). Дегидратацию промежуточного продукта карбинола осуществляют с каталитическим TsOH и при кипячении с обратным холодильником в толуоле. Сырой продукт очищаютb) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-4-(2 пропилбензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают, используя способ из примера 1 (с) с использованием продукта стадии (а) (2,1 г, 7 ммоль) и Ni Ренея(0,5 г). Сырой продукт очищают HPLC (5%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-4-(2 пропилбензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают, используя способ из примера 3(с) с использованием продукта стадии (b) (1,8 г, 5,9 ммоль) и Na (0,15 г, 6,5 г-атом). Экстракционная переработка дает 1,8 г (99%) указанного в заголовке соединения.(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-4-(2-пропилбензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-(2 пропилбензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии (с) (1,7 г, 5,7 ммоль), KCN (3,7 г, 57 ммоль), NH4Cl (3,1 г, 57 ммоль) и Аl2O3 (50 г). Промежуточный продукт аминонитрил ацилируют, используя ацетилхлорид (0,6 г, 7 ммоль) иN,N-диизопропилэтиламин (0,9 г, 7 ммоль). Сырой продукт очищают HPLC (10% EtOAc/гексан до 90% EtOAc/гексан), получая 0,8 г (38%) 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-4-(2-пропилбензил)бицикло[3.1.0] гексан-6-карбоксилата (А) и 0,3 г (14%) 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано 3-4-(2-пропилбензил)бицикло[3.1.0]гексан-6 карбоксилата (В). (А): Т.пл. = 225-227 С. FDMS:(е) Указанное в заголовке соединение получают путем использования 2SR диастереомерного продукта стадии (d) (0,6 г, 1,6 ммоль) при кипячении с обратным холодильником в 5 н НСl (50 мл) в течение ночи. Реакционную смесь концентрируют до сухости, получая 0,53 г(89%) указанного в заголовке соединения без дальнейшей очистки. Т.пл. = 250 С. FDMS: M+= 317. Анал. рассч. для C18H24ClNO40,25NH4Cl: С 58,87; Н 6,86, N 4,77. Обнаружено: С 58,74; Н 6,93; N 5,54. Пример 7. 1SR,2SR,3SR,5RS,6SR-2-Aмино 3-3-метил-4-метокси)бензил)-бицикло[3.1.0] гексан-6-карбоновая кислота. а) 1SR,5RS,6SR-Этил-2-оксо-3-3-метил 4-метокси)-бензилиденил)бицикло[3.1.0]гексан 6-карбоксилат. Указанное соединение получают, используя способ, описанный в примерах 1(а) и 1(b), используя продукт препаративного примера 2 (4,2 г, 25 ммоль) и 3-метил-панизальдегид (4,5 г, 30 ммоль). Дегидратацию промежуточного продукта карбинола осуществляют с каталитическим TsOH при кипячении с обратным холодильником в толуоле. Сырой продукт очищают HPLC (5% EtOAc/гексан до 50% EtOAc/гексан) с получением 5,2 г (69%) указанного в заголовке соединения: Т.пл = 126128 С; FDMS: M+ = 300; Анал. рассч. для С 18H20O4: С 71,98; Н 6,71. Обнаружено: С 71,99; Н 6,77.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 метил-4-метокси)-бензил)бицикло[3.1.0]гексан 6-карбоксилат. Указанное соединение получают способом из примера 1(с) с использованием продукта стадии (а) (3,5 г, 11,7 ммоль) и Ni Ренея (0,88 г),получая 3,4 г (96%) указанного в заголовке соединения. FDMS: M+ = 302; Анал. рассч. для(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 метил-4-метокси)-бензил)бицикло[3.1.0]гексан 6-карбоксилат. Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (b) (2,9 г, 9,6 ммоль) и Na (0,23 г, 10,1 гатом). Переработка дает 1,8 г (62%) указанного в заголовке соединения. FDMS: М+ = 302; Анал. рассч. для C18H22O4: С 71,50; Н 7,33. Обнаружено: С 71,20; Н 7,06.(d) 1SR, 2SR, 3SR, 5RS, 6SR-Этил-2-амино ацетил-2-циано-3-3-метил-4-метокси)бензил) бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-33-метил-4-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (1,7 г, 5,6 ммоль), NH4C1 (3,0 г, 56,2 ммоль), KCN (3,7 г,56,2 ммоль) и Аl2 О 3 (40 г). Промежуточный продукт аминонитрил ацетилируют ацетилхло 000894 26 ридом (0,6 г, 7,8 ммоль) и N,N-диизопропилэтиламином (1,0 г, 7,8 ммоль). Сырой продукт очищают HPLC (10% EtOAc/гексан до 80%(e) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-3 метил-4-метокси)-бензил)бицикло[3.1.0]гексан 2,6-дикарбоксилат. Указанное соединение получают способом из примера 3(е) с использованием продукта стадии (d) (0,25 г, 0,65 ммоль). После переработки подкислением СН 3 СO2 Н получают 0,165 г (77%) указанного в заголовке соединения. Т.пл. 275 С. FDMS: M+ = 319. Анал. рассч. для C17H21NO50,33 СН 3 СO2 Н: С 60,07; Н 5,58, N 4,47. Обнаружено: С 63,13; Н 6,59; N 4,43. Пример 8. 1SR, 2SR, 3SR, 5RS, 6SR-2 Амино-3-2-метил)бензил)бициклоa) 1SR,5RS,6SR-Этил-2-оксо-3-2-метил) бензилиденил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1 (а), используя продукт препаративного примера 2 (4,0 г, 23,8 ммоль) и 2 метилбензальдегид (3,4 г, 28,6 ммоль). Дегидратацию промежуточного продукта карбинола осуществляют с каталитическим TsOH при кипячении с обратным холодильником в толуоле. Сырой продукт очищают HPLC (10%(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-2 метил)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с) с использованием продукта стадии (а) (3,0 г, 11,1 ммоль) и Ni Ренея (0,75 г). Фильтрование катализатора и испарение дают 2,5 г (81%) указанного соединения. FDMS: M+ = 272; Анал. рассч. для С 17 Н 20 О 3: С, 74,97; Н, 7,40. Обнаружено: С, 74,94; Н, 7,54. 27 Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (b) (2,5 г, 9,2 ммоль). Экстракционной переработкой получают 2,4 г (96%) указанного соединения. Т.пл. = 67-69 С; FDMS: M+= 272; Анал. рассч. для С 17H20O3: С 74,97; Н 7,40. Обнаружено: С 75,23; Н 7,29.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-2-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (2,2 г, 8,1 ммоль), NH4Cl (4,3 г,80,7 ммоль), KCN (5,3 г, 80,7 ммоль) и Al2O3 (41 г). Промежуточный продукт аминонитрил (2 г,6,75 ммоль) ацетилируют ацетилхлоридом (0,8 г, 10 ммоль) и N,N-диизопропилэтиламином (1,3 г, 10 ммоль). Очистка сырого продукта HPLC(е) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-2 метил)бензил)-бицикло[3.1.0]гексан-2,6-дикарбоксилат. Указанное соединение получают путем использования 1SR,2SR,3SR,5RS,6SR-этил-2 аминоацетил-2-циано-3-2-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилата со стадии (d)(0,65 г, 2 ммоль) при нагревании с обратным холодильником в 5 н. НСl (35 мл) в течение ночи. Концентрирование реакционной смеси до сухости дает 0,6 г (85%) указанного в заголовке соединения. Т.пл. 250 С. FDMS: M+ = 289. Анал. рассч. для C16H19NO4HCl0,9NH4Cl: С 51,39; Н 6,36, N 7,12. Обнаружено: С 51,38; Н 6,37; N 7,27. Пример 9. 1SR,2SR,3SR,5RS,6SR-2-Амино 3-бензилбицикло[3.1.0]гексан-2,6-дикарбоновая кислота. а) 1SR,5RS,6SR-2-Oкco-3-бeнзилидeнилбициклo[3.1.0]гексан-6-карбоксилат. Раствор продукта препаратинового примера 2(1,68 г, 10,0 ммоль) и бензальдегида (1,17 г,11,0 ммоль) в 1 н. NaOH (25 мл) тщательно перемешивают при окружающей температуре в течение 72 ч. Реакционную смесь распределяют между 1 н. NaOH и Et2O и органическую фазу сбрасывают. Водную фазу подкисляют 5 н. НСl и экстрагируют Et2O. Органическую фазу сушат(b) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-(фенилгидроксиметил)-бицикло[3.1.0]гексан-6 карбоксилат. Получают по существу, как в способе из примера 1(а), используя продукт препаративного примера 2(5,24 г, 31,2 ммоль) и бензальдегид(5,06 г, 46,8 ммоль) в отсутствие BF3Et2O. Сырой карбинольный продукт очищают HPLC(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-бензилбицикло[3.1.0]-гексан-6-карбоксилат. Указанное соединение получают гидрогенолизом продукта стадии (b) (1,3 г, 4,7 ммоль) в(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-бензилбицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 2 (с) с использованием продукта стадии (с) (0,52 г, 2,0 ммоль), KCN (1,3 г, 20 ммоль), NH4Cl (1,1 г, 20 ммоль) и Аl2O3 (13 г) . Промежуточный продукт аминонитрил ацилируют, используя ацетилхлорид (0,5 г, 6,3 ммоль) и N,N-диизопропилэтиламин (1,3 г, 1,0 ммоль). Сырой продукт очищают HPLC (33%(e) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-бензилбицикло[3.1.0]-гексан-2,6-дикарбоксилат. Указанное соединение получают способом из примера 2(d), используя продукт стадии (d)(0,07 г, 0,2 ммоль). Очистку осуществляют катионообменной хроматографией (катионообменная смола Dowex 50WX8-100), получая 0,045 г (76%) указанного в заголовке соединения. Т.пл. = 252-253 С; FDMS: М+ + 1 = 276; Анал. рассч. для C15H17NO40,4H2O: С 63,77; Н 6,35, N, 496. Обнаружено: С 63,76; Н 6,29, N 4,81. Пример 10. 1SR,2RS,3SR,5RS,6SR-2-Амино-3-2-хлор)бензил)бицикло-[3.1.0]гексан-2,6 дикарбоновая кислота.(a) 1SR,5RS,6SR-2-Oксо-3-2-хлор)бензилиденил)бицикло-[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 1(а), используя продукт препаративного примера 2 (8,41 г, 50 ммоль) и 2 хлорбензальдегид (8,0 г, 57 ммоль). Продукт выделяют фильтрованием осадка, который получается при подкислении водной фазы, получая 13,1 г (99%) указанного в заголовке соединения: Т.пл. 183-185 С; FDMS: M+ = 262; Анал. рассч. для С 14 Н 11 СlO3: С 64,01; Н 4,22. Обнаружено: С 64,26; Н 4,31. 13 С-ЯМР (DMSO) 25,17,28,06, 30,17,35,36, 128,00, 128,99, 130,41, 130,47,131,52, 132,77, 135,14, 136,39, 171,73, 200,75.(b) 1SR,5RS,6SR-Этил-2-oкco-3-2-хлор) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. К раствору продукта стадии (а) (12,2 г,46,5 ммоль), Et3N (5,18 г, 51,1 ммоль) и DMAP(0,57 г, 4,65 ммоль) в CH2Cl2 (250 мл) при 5 С добавляют по каплям этилхлорформиат (8,23 г,51,2 ммоль) в СН 2 Сl2 (25 мл) в течение периода 10 мин. После перемешивания при окружающей температуре в течение ночи реакционную смесь распределяют между CH2Cl2 и насыщенным водным раствором NаНСО 3. Органическую фазу отделяют, промывают 1 н. НСl, сушат (MgSO4) и концентрируют при пониженном давлении, чтобы получить 13,2 г (98%) указанного в заголовке соединения: Т.пл. 95-96 С; FDMS: M+ = 290; Анал. рассч. для C16H15ClO3: С 66,10; Н 5,20. Обнаружено: С 66,08; Н 5,27.(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-2 хлор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1 (с) с использованием продукта стадии (b) (6,0 г, 20,7 ммоль) и Ni Ренея (1,5 г). Сырой продукт очищают(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2 хлор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 3 (с) с использованием продукта стадии (с) (5,3 г, 18,1 ммоль) и Na (0,44 г, 19 гатом). Переработка дает 3,0 г (57%) указанного в заголовке соединения.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-2-хлор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии(d) (3,0 г, 10,2 ммоль), NH4Cl (5,5 г, 103 ммоль),KCN (6,7 г, 103 ммоль) и Аl2O3 (50 г). Промежуточное соединение аминонитрил ацетилируют ацетилхлоридом (1,2 г, 15,1 ммоль) и N,Nдиизопропилэтиламином (2,0 г, 15,1 ммоль). 30 Сырой продукт очищают HPLC (10%(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-2-хлор)бензил)бицикло[3.1.0]гексан 6-карбоксилат со стадии (е) (0,20 г, 0,55 ммоль). После переработки получают 0,12 г (70%) указанного в заголовке соединения. Т.пл = 145146 С;(a) 1SR,5RS,6SR-2-Oксо-3-3-хлор)бензилиденил)бицикло-[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 9(а), используя продукт препаративного примера 2 (8,41 т, 50 ммоль) и 3 хлорбензальдегид (8,0 г, 57 ммоль). Продукт выделяют фильтрованием осадка, полученного после подкисления водной фазы, получая 13,2 г(b) 1SR,5RS,6SR-Этил-2-оксо-3-3-хлор) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 10(b) с использованием продукта стадии (а) (11,6 г, 44,2 ммоль), Et3N (4,92 г,48,6 ммоль), DMAP (0,54 г, 4,42 ммоль) и этилхлорформиат (7,58 г, 48,6 ммоль). Сырой продукт (11,1 г) очищают HPLC (10% EtOAc/гексан до 50% EtOAc/гексан), получая 9,5 г (74%) указанного в заголовке соединения: Т.пл. 79-81 С;(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 хлор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с), используя продукт стадии (b) (7,0 г, 24,1 ммоль) и Ni Ренея (1,75 г). Испарение растворителя дает 6,8 г (96%) ука 31 занного в заголовке соединения. FDMS: М+ = 292; Анал. рассч. для С 16 Н 17 СlO3: С 65,64; Н 5,85. Обнаружено: С 65,98; Н 5,95.(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 хлор)бензил)бицикло-[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (с) (6,5 г, 22,2 ммоль) и[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-3-хлор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (d) (3,6 г, 12,3 ммоль), NH4Cl (6,5 г,123 ммоль), KCN (8,0 г, 123 ммоль) и Аl2O3 (40 г). Полученный аминонитрил ацетилируют с использованием ацетилхлорида (1,9 г, 24,6 ммоль) и N,N-диизопропилэтиламина (3,2 г,24,6 ммоль). Сырой продукт очищают HPLC(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (е) (1,0 г, 27 ммоль). Продукт выделяют осаждением при рН 3, получая 0,535 г (62%) указанного соединения. Т.пл. = 243-244 С. FDMS: M+ + 1 = 310. Анал. рассч. для C15H16ClNO4: С 58,16; Н 5,21, N 4,52. Обнаружено: С 57,87; Н 5,20; N 4,40. Пример 12. 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-2-метокси)бензилбицикло-[3.1.0]гексан 2,6-дикарбоновая кислота.(а) 1SR,5RS,6SR-2-Oксо-3-2-метокси) бензилиденил)бицикло-[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (8,41 г, 50 ммоль) и 2-метоксибензальдегид (7,49 г, 55,0 ммоль). Продукт выделяют фильтрованием осадка, полученного при подкислении водной фазы, получая 12,7 г (98%) указанного в заголовке соединения: Т.пл. 180-182 С; FDMS: M+ = 258; Анал. рассч. для C15H14O4: С 69,76; Н 5,46. Обнаружено: С 70,03; Н 5,41.(b) 1SR,5RS,6SR-Этил-2-оксо-3-2-метокси)бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 10 (b) с использованием продукта стадии (а) (12,2 г, 47,2 ммоль), Et3N (5,3 г,52 ммоль), DMAP (0,6 г, 4,7 ммоль) и этилхлорформиата (5,6 г, 52 ммоль), получая 13,1 г (97%) указанного в заголовке соединения: Т.пл. 7274 С; FDMS: M+ = 286; Анал. рассч. для(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-2 метокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1 (с), используя продукт стадии(b) (7,0 г, 24,4 ммоль). Испарение растворителя дает 6,9 г (98%) указанного в заголовке соединения. FDMS: M+ = 288; Анал. рассч. для С 17 Н 20O4: С 70,81; Н 6,99. Обнаружено: С 70,57; Н 7,13.(d) 1SR, 3SR, 5RS, 6SR-Этил-2-оксо-3-2 метокси)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают,используя способ из примера 3(с) с использованием продукта стадии (с) (6,3 г, 21,9 ммоль) и[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-2-метокси)-бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии(d) (3,0 г, 10,4 ммоль), NH4Cl (5,6 г, 104 ммоль),KCN (6,8 г, 104 ммоль) и Аl2O3 (50 г). Полученный аминонитрил ацетилируют с использованием ацетилирующего агента (1,1 г, 13,8 ммоль) иN,N-диизопропилэтиламина (1,8 г, 13,8 ммоль). Очистка сырого продукта HPLC (10%(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-2-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилат (0,25 г, 0,7 ммоль) со стадии(е). После переработки получают 0,18 г (86%) 33 После переработки получают 0,18 г (86%) указанного соединения. Т.пл. = 238-239 С. FDMS: М+ = 305. Анал. рассч. для C16H19NO5: С 62,94; Н 6,27, N 4,59; Обнаружено: С 62,69; Н 6,39; N 4,32. Пример 13. 1SR,2SR,3SR,5RS,6SR-2-Амино-3-3-метокси)бензил)бицикло-[3.1.0]гексан 2,6-дикарбоновая кислота.(a) 1SR,5RS,6SR-2-Oксо-3-3-метокси) бензилиденил)бицикло-[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (8,41 г, 50 ммоль) и 3 метоксибензальдегид (7,49 г, 55,0 ммоль). Продукт выделяют фильтрованием осадка, который образуется при подкислении водной фазы, получая 12,2 г (94%) указанного в заголовке соединения: Т.пл. 179-181 С; FDMS: М+ = 258; Анал. рассч. для C15H14O4: С 69,76; Н 5,46. Обнаружено: С 70,00; Н 5,45.(b) 1SR,5RS,6SR-Этил-2-окco-3-3-метокси)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 10 (b) с использованием продукта стадии (а) (11,9 г, 46 ммоль), Et3N (5,1 г, 50,7 ммоль), DMAP (0,6 г, 4,6 ммоль) и этилхлорформиата (5,0 г, 46 ммоль), получая 13,1 г (99%) указанного в заголовке соединения: Т.пл. 102104 С; FDMS: M+ = 286; Анал. рассч. для(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 метокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с), используя продукт стадии (b)(8,0 г, 27,9 ммоль) и Ni Ренея (2,0 г). Испарение растворителя дает 6,0 г (75%) указанного в заголовке соединения. FDMS: M+ = 288; Анал. рассч. для C17H20O4: С 70,81; Н 6,99. Обнаружено: С 70,84; Н 7,20.(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 метокси)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (с) (6,0 г, 20,8 ммоль) и Na (0,48 г, 21 гатом). Сырой продукт очищают HPLC (5%[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-3-метокси)-бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадииKCN (7,0 г, 108 ммоль) и А 12 О 3 (50 г) в 100 мл ацетонитрила. После 72 ч твердые вещества отфильтровывают и фильтрат испаряют, чтобы получить аминонитрил, который ацетилируют ацетилхлоридом (1,2 г, 15 ммоль) и N,Nдиизопропилэтиламином (1,9 г, 15 ммоль). Сырой продукт очищают HPLC (10% EtOAc/гексан до 80% EtOAc/гексан), получая 1,5 г (38%) 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-3-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилата (А) и 1,0 г (26%) смеси (А) и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-3-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилата (В). А: Т.пл. = 171-172 С.(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт со стадии (e) (1,2 г, 3,4 ммоль). После переработки получают 0,78 г (76%) указанного соединения. Т.пл. = 235-236 С. FDMS:(a) 1SR,5RS,6SR-2-Oксо-3-4-метокси)бензилиденил)бицикло[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (8,41 г, 50 ммоль) и 4-метоксибензальдегид (7,49 г, 55,0 ммоль). Продукт выделяют фильтрованием осадка,полученного при подкислении водной фазы,получая 12,5 г (97%) указанного в заголовке соединения: Т.пл. 192-194 С; FDMS: М+ = 258; Анал. рассч. для C15H14O4: С 69,76; Н 5,46. Обнаружено: С 70,78; Н 5,51. 13 С-ЯМР (DMSO) 24,17, 27,25, 29,77, 34,57, 54,90, 114,02, 126,81,130,05, 131,95, 133,03, 160,05, 171,07, 199,94.(b) 1SR,5RS,6SR-Этил-2-oкco-3-4-метокси)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 10 (b) с использованием продукта стадии (а) (11,7 г, 45,3 ммоль), Et3N (5,0 г, 49,4 ммоль), DMAP (0,55 г, 4,5 ммоль) и этилхлорформиата (4,9 г, 45,3 ммоль), получая 11,6 г(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-4 метокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с), используя продукт стадии(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-4 метокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (с) (6,3 г, 21,9 ммоль) и Na (0,50 г, 21,9 гатом), чтобы получить 4,5 г (71%) указанного в заголовке соединения. FDMS: М+ = 288; Анал. рассч. для С 17 Н 20O4: С, 70,81; Н, 6,99. Обнаружено: С 71,04; Н 7,03.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-метокси) бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии(d) (3,9 г, 13,9 ммоль), NH4Cl (7,4 г, 138 ммоль),KCN (9,0 г, 138 ммоль) и Аl2O3 (50 г) в 100 мл ацетонитрила. После 72 ч твердые вещества отфильтровывают и фильтрат испаряют, чтобы получить аминонитрил, который ацетилируют ацетилхлоридом (1,5 г, 19,0 ммоль) и N,Nдиизопропилэтиламином (2,5 г, 19 ммоль). Сырой продукт очищают HPLC (10% EtOAc,гексан до 80% EtOAc/гексан), получая 1,55 г (31%) 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-4-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилата (А) и 0,7 г (14%) 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-4-метокси)бензил)бицикло[3.1.0]гексан-6-карбоксилата (В). (А): Т.пл. = 201-203 С.(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR изомерный продукт со стадии (е) (0,5 г, 1,4 ммоль). После переработки получают 0,373 г(а) 1SR,5RS,6SR-2-Oксо-3-4-фтор)бензилиденил)бицикло-[3.1.0]гексан-6-карбоновая кислота. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (4,2 г, 25 ммоль) и 4 фторбензальдегид (3,4 г, 27,5 ммоль). Продукт 36 выделяют фильтрованием осадка, полученного после подкисления водной фазы, получая 5,9 г(b) 1SR,5RS,6SR-Этил-2-оксо-3-4-фтор) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 10 (b) с использованием продукта стадии (а) (5,7 г, 23,0 ммоль), Et3N (2,6 г,25,0 ммоль), DMAP (0,30 г, 2,5 ммоль) и этилхлорформиата (2,5 г, 23,0 ммоль), получая 5,9 г(c) 1SR, 3RS, 5RS, 6SR-Этил-2-оксо-3-4 фтор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с), используя продукт стадии (b)(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-4 фтор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (с) (2,3 г, 8,3 ммоль) и Na (0,20 г, 8,7 гатом). Переработка дает 1,9 г (83%) указанного в заголовке соединения. FDMS: M+ = 276; Анал. рассч. для C16H17FO3: С 69,55; Н 6,20. Обнаружено: С 69,69; Н 6,23.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-фтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии (d) (1,8 г, 6,5 ммоль), NH4Cl (3,5 г, 65 ммоль), KCN (4,2 г, 65 ммоль) и Аl2O3 (40 г). Промежуточный продукт аминонитрил ацетилируют ацетилхлоридом (0,6 г, 7,5 ммоль) иN,N-диизопропилэтиламином (1,0 г, 7,5 ммоль) в CH2Cl2. Сырой продукт очищают HPLC (10%(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR изомерный продукт стадии (е) (0,3 г, 0,9 ммоль). После переработки получают 0,17 г(a) 1SR,5RS,6SR-Этил-2-оксо-3-4-метил) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Раствор, содержащий продукт препаратинового примера 2(4,0 г, 23,8 ммоль), 4 метилбензальдегид (3,0 г, 24,9 ммоль) и пирролидин (1,2 мл) в EtOH (50 мл) перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют до сухости и остаток очищают HPLC (10% EtOAc/гексан до 50% EtOAc/гексан), получая 5,9 г (92%) указанного в заголовке соединения: Т.пл. = 127-129 С;(b) 1SR,3RS,5RS,6SR-Этил-2-оксo-3-4 метил)бензил)бицикло-[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (5,1 г, 18,9 ммоль), и Ni Ренея(1,3 г). Сырой продукт очищают HPLC (5%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-4 метил)бензил)бицикло-[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (3,5 г, 12,8 ммоль) иNa (0,34 г, 14,7 г-атом). Сырой продукт очищают HPLC (10% EtOAc/гексан до 50%[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2(с) с использованием продукта стадии (с) (2,5 г, 9,2 ммоль), KCN (6,0 г, 92 ммоль), NH4Cl (4,9 г, 92 ммоль) и Аl2O3 (30 г). Промежуточный продукт аминонитрил ацилируют ацетилхлоридом (1,1 г, 13,5 ммоль) и N,Nдиизопропилэтиламином (1,8 г, 13,5 ммоль). Сырой продукт очищают HPLC (10%(e) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт со стадии (d) (1,05 г, 3,1 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3,фильтруют и промывают H2O, IPA и EtOAc,получая 0,47 г (52%) указанного в заголовке соединения. Т.пл. = 248-249 С. FDMS: М+ = 289. Анал. рассч. для C16H19NO40,33H2O: С 65,07; Н 6,62; N 4,84. Обнаружено: С 64,85; Н 6,55; N 4,76. Пример 17. 1SR,2SR,3SR,5RS,6SR-2 Амино-3-3-фтор)бензил)бицикло-[3.1.0]гексан-2,6-дикарбоновая кислота.(a) 1SR,5RS,6SR-2-Oксо-3-3-фтор)бензилиденил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (4,2 г, 25 ммоль) и 3 фторбензальдегид (3,4 г, 27,5 ммоль). Продукт выделяют фильтрованием осадка, который образуется при подкислении водной фазы, получая 6,1 г (100%) указанного в заголовке соединения: Т.пл. 180-181 С; FDMS: М+ = 246; Анал. рассч. для C14H11FO30,75 Н 2 О: С 64,74; Н 4,85. Обнаружено: С 67,39; Н 4,38.(b) 1SR,5RS,6SR-Этил-2-окo-3-3-фтор) бензилиденил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 10 (b) с использованием продукта стадии (а) (6,1 г, 24,8 ммоль), Et3N (2,8 г, 27,2 ммоль), DMAP (0,30 г, 2,5 ммоль) и этилхлорформиата (2,7 г, 24,8 ммоль), получая 5,4 г(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 фтор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с), используя продукт стадии (b) (4,9 г, 17,9 ммоль) и Ni Ренея (1,3 г). Продукт очищают HPLC (5% EtOAc/гексан до 50% EtOAc/гексан), получая 4,6 г (93%) указанного в заголовке соединения. FDMS: M+ + 1 = 277; Анал. рассч. для C16H17FO3: С 69,55; Н 6,20. Обнаружено: С 69,67; Н 6,18.(d) 1SR,3SR,5RS,6SR-Этил-2-oксо-3-3 фтор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 3(с) с использованием продукта стадии (с) (4,4 г, 16 ммоль) и Na (0,37 г, 16 г-атом). Переработка дает 4,2 г (96%) указанного в заголовке соединения. Т.пл. = 67-69 С. FDMS: M+ = 276; Анал. рассч. для C16H17FO3: С 69,55; Н 6,20. Обнаружено: С 69,71; Н 6,11.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-3-фтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2(с) с использованием продукта стадии (d) (3,7 г, 13,5 ммоль), NH4Cl (7,2 г, 135 ммоль), KCN (8,8 г, 135 ммоль) и Al2O3(34 г). Промежуточную смесь аминонитрилов ацетилируют ацетилхлоридом (1,67 г, 21,3 ммоль) и N,N-диизопропилэтиламином (2,75 г,21,3 ммоль) в CH2Cl2. Сырой продукт очищают(f) Указанное в заголовке соединение получают согласно способу из примера 3(е), используя 2SR продукт стадии (е) (1,0 г, 2,9 ммоль). После переработки получают 0,67 г(а) 1SR,5RS,6SR-Этил-2-оксо-3-3,5-дифтор)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 16 (а), используя продукт препаративного примера 2 (6,3 г, 37,4 ммоль), 3,5 дифторбензальдегид (5,3 г, 37,3 ммоль) и пирролидин (1,1 мл) в EtOH (150 мл). Осадок, который образуется, отфильтровывают, промывают 40 Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (6,5 г, 22,3 ммоль) и Ni Ренея(1,6 г). Сырой продукт очищают HPLC (5%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3,5 дифтор)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,4 г, 18,4 ммоль) и Na (0,42 г,18,4 г-атом), получая после переработки 4,9 г(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3,5-дифтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3,5 дифтор)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанные соединения получают согласно способу из примера 2(с) с использованием продукта стадии (с) (4,3 г, 14,6 ммоль), KCN (9,5 г,146 ммоль), NH4Cl (7,8 г, 146 ммоль) и Аl2O3 (37 г). Промежуточные продукты аминонитрилы ацилируют с использованием ацетилхлорида(1,84 г, 23,4 ммоль) и N,N-диизопропилэтиламина (3,0 г, 23,4 ммоль). Сырые продукты очищают HPLC (10% EtOAc/гексан до 80%(е) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (d) (1,7 г, 4,7 ммоль) и 2 н. НСl (100 мл). После переработки получают до 1,1 г (78%) указанного соединения. Т.пл. = 250 С. FDMS: М+ + 1 = 312. Анал. рассч. для(a) 1SR,5RS,6SR-Этил-2-оксо-3-3-фенокси)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 16 (а) с использованием продукта препаративного примера 2 (5,0 г, 29,7 ммоль), 3-феноксибензальдегида (5,0 г,25,2 ммоль) и пирролидина (1 мл) в EtOH (150(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 фенокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (7,5 г, 21,8 ммоль) и Ni Ренея(1,9 г). Сырой продукт очищают HPLC (10%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 фенокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (6,5 г, 18,5 ммоль) и Na (0,43 г,18,5 г-атом), получая после переработки 5,5 г[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-3-фенокси)-бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2(с) с использованием продукта стадии(с) (5,0 г, 14,3 ммоль), KCN (9,3 г, 143 ммоль),NH4Cl (7,6 г, 143 ммоль), и А 12 О 3 (50 г). Промежуточные продукты аминонитрилы ацилируют с использованием ацетилхлорида (1,5 г, 19,1 ммоль) и N,N-диизопропилэтиламина (2,5 г,19,1 ммоль). Сырые продукты очищают HPLC(e) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (d) (2,1 г, 5 ммоль) и 2 н. НСl (100 мл). После переработки и осаждения при рН 5 получают 0,98 г (53%) указанного соединения. Т.пл. = 241-242 С. FDMS: M+ - СO2 Н(а) 1SR,5RS,6SR-Этил-2-оксо-3-3-трифторметокси)-бензилиденил)-бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают способом из примера 16(а) с использованием продукта препаративного примера 2 (4,1 г, 24,5 ммоль), 3 трифторметоксибензальдегида (4,9 г, 24,5 ммоль) и пирролидина (1 мл) в EtOH (150 мл). Осадок, который образуется, отфильтровывают,промывают EtOH и сушат, чтобы получить 6,55 г (79%) указанного в заголовке соединения: Т.пл. 96-97 С; FDMS: M+ + 1 = 341; Анал. рассч. для C17H15F3O4: С 60,00; Н 4,44. Обнаружено: С 60,27; Н 4,43.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 трифторметокси)-бензил)-бицикло [3.1.0]гексан 6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (6,2 г, 18,2 ммоль) и Ni Ренея(1,5 г). Сырой продукт очищают HPLC (10%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 трифторметокси)-бензил)бицикло[3.1.0]гексан 6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (4,9 г, 17,9 ммоль) и Na (0,41 г,17,9 г-атом), получая после переработки 4,6 г(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3-трифторметокси)бензил) бицикло[3.1.0]гексан-6-карбоксилат и 1SR, 2RS,3SR, 5RS, 6SR-этиил-2-аминоацетил-2-циано-33-трифторметокси)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии (с) (4,2 г, 15,3 ммоль), KCN (9,4 г, 144 ммоль), NH4Cl (7,7 г, 144 ммоль), и Аl2O3 (50 г). Промежуточные продукты аминонитрилы ацилируют с использованием ацетилхлорида (1,6 г,20,4 ммоль) и N,N-диизопропилэтиламина (2,6 г, 20,4 ммоль). Сырые продукты очищают HPLC(е) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт со стадии (d) (1,5 г, 1,86 ммоль) и 2 н HCl (100 мл). После переработки и осаждения при рН 5 получают 0,34 г (26%) указанного соединения. Т.пл. 250 С. FDMS: М+ + 1 = 360. Анал. рассч. для C16H16F3NO5: С 53,49; Н 4,49; N 3,90. Обнаружено: С 53,44; Н 4,40; N 3,86. Пример 21. 1SR,2SR,3SR,5RS,6SR-2 Амино-3-3-фтор-4-метокси)бензил)-бицикло(a) 1SR,5RS,6SR-Этил-2-оксо-3-3-фтор-4 метокси)бензил-иденил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 16(а) с использованием продукта препаративного примера 2 (5,5 г, 32,4 ммоль), 3 фтор-4-метокси-бензальдегида (5,0 г, 32,4 ммоль) и пирролидина (1 мл) в EtOH (150 мл). Осадок, который образуется, отфильтровывают,промывают EtOH (содержащим толуол) и сушат, чтобы получить 7,75 г (79%) указанного в заголовке соединения:FDMS: М+ = 304; Анал. рассч. для C17H17FO40,1 толуол: С 67,81; Н 5,72. Обнаружено: С 68,01; Н 5,71.(b) 1S,R, 3RS, 5RS, 6SR-Этил-2-оксо-3-3 фтор-4-метокси)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (7,0 г, 23,0 ммоль) и Ni Ренея(1,75 г). Сырой продукт очищают HPLC (5%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 фтор-4-метокси)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3 (с) с использованием продукта стадии (b) (5,3 г, 17,3 ммоль) и Na (0,40 г,17,3 г-атом), получая после переработки 4,9 г(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-оксо-33-фтор-4-метокси)-бензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3RS,5RS,6SRэтил-2-оксо-3-3-фтор-4-метокси)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта стадии (с) (4,5 г, 14,6 ммоль), KCN (10 г, 154 ммоль), NH4Cl (8,5 г, 158 ммоль), и Аl2O3 (40 г). Промежуточные продукты аминонитрилы ацилируют с использованием ацетилхлорида (1,8 г, 000894 44 22,6 ммоль) и N,N-диизопропилэтиламина (2,9 г, 22,6 ммоль). Сырые продукты очищают HPLC(e) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт со стадии (d) (0,7 г, 1,86 ммоль) и 2 н HCl (75 мл). После переработки и осаждения при рН 5 получают 0,5 г (86%) указанного соединения. Т.пл. 250 С. FDMS: М+ = 323. Анал. рассч. для C16H18FNO5: С 59,44; Н 5,61; N 4,33; Обнаружено: С 59,42; Н 5,58; N 4,44. Пример 22. 1SR,2SR,3SR,5RS,6SR-2Aмино-3-3-хлор-4-фтор)бензил)бицикло[3.1.0] гексан-2,6-дикарбоновая кислота.(а) 1SR,5RS,6SR-этил-2-оксо-3-3-хлор-4 фтор)бензил-иденил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 16(а) с использованием продукта препаративного примера 2 (5,0 г, 30,3 ммоль), 3-хлор-4-фторбензальдегида (4,8 г, 30,3 ммоль) и пирролидина (1,1 мл) в EtOH (150 мл). Осадок, который образуется, отфильтровывают,промывают EtOH и сушат, чтобы получить 7,2 г(b) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 хлор-4-фтор)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) и способу из примера 3(с) с использованием в первом способе продукта стадии (а) (6,7 г, 22,7 ммоль) и Ni Ренея (1,7 г). Сырой продукт с этой стадии очищают HPLC(5% EtOAc/гексан до 50% EtOAc/гексан), получая 5,8 г (86%) 3RS диастереомера, который подвергают воздействию условий из примера 3(с), используя Na (0,44 г, 19,3 ммоль) в EtOH,чтобы получить 5,5 г (95%) 1SR,3SR,5RS,6SRэтил-2-оксо-3-3-хлор-4-фтор)бензил)бицикло(c) 1SR,2SR,3SR,5RS,6SR-Этил-2-оксо-33-хлор-4-фтор)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 2(с) с использованием продукта стадии (b) (5,2 г, 16,7 ммоль), KCN (10,9 г, 167 ммоль), NH4Cl (9,0 г, 167 ммоль), и Аl2O3 (53 г). Промежуточные продукты аминонитрилы аци 45 лируют с использованием ацетилхлорида (1,7 г,22,2 ммоль) и N, N-диизопропилэтиламина (2,8 г, 22,2 ммоль). Сырые продукты очищают кристаллизацией из CH2Cl2, что дает 1,1 г (17%) указанного в заголовке соединения. Т.пл. = 232234 С. FDMS: M+ = 378. Анал. рассч. для(d) Указанное в заголовке соединение получают способом из примера 3(е), используя продукт со стадии (с) (0,75 г, 2 ммоль) и 2 н. HCl(100 мл). После переработки получают 0,56 г(а) 1SR,5RS,6SR-Этил-2-оксо-3-3,4-дифтор)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают способом из примера 16(а) с использованием продукта препаративного примера 2 (5,9 г, 35,2 ммоль),3,4-дифторбензальдегида (5,0 г, 35,2 ммоль) и пирролидина (1 мл) в EtOH (150 мл). Осадок,который образуется, отфильтровывают, промывают EtOH (содержащим толуол) и сушат, получая 7,46 г (73%) указанного в заголовке соединения: Т.пл. 120-121 С; FDMS: М+ + 1 = 293; Анал. рассч. для C16H14F2O30,3 толуол: С 67,95; Н 5,17. Обнаружено: С 68,20; Н 5,09.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3,4 дифтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с) с использованием продукта стадии (а) (6,4 г, 21,9 ммоль) и Ni Ренея (1,4 г). Сырой продукт очищают HPLC (5% EtOAc/гексан до 50% EtOAc/гексан), получая 5,9 г (91%) указанного в заголовке соединения: FDMS: M+ = 294; Анал. рассч. для С 16 Н 16F2O30,1H2O: С 64,90; Н 5,52. Обнаружено: С 64,57; Н 5,37.(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3,4 дифтор)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,5 г, 18,7 ммоль) и Na (0,42 г,18,7 г-атом), получая после переработки 5,0 г[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-aминоацетил-2-циано-3-3,4-дифтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают способом из примера 2 (с) с использованием продукта 46 стадии (с) (4,5 г, 15,3 ммоль), KCN (10 г, 153 ммоль), NH4Cl (8,2 г, 153 ммоль) и А 12 О 3 (35 г). Промежуточные продукты аминонитрилы ацилируют с использованием ацетилхлорида (1,87 г, 23,9 ммоль) и N,N-диизопропилэтиламина(3,1 г, 23,9 ммоль). Кристаллизация из СН 2 Сl2 дает 1,3 г (23%) 1SR,2SR,3SR,5RS,6SR-этил-2 аминоацетил-2-циано-3-3,4-дифтор)бензил) бицикло[3.1.0]-гексан-6-карбоксилата (А). Оставшиеся сырые продукты очищают HPLC (10%(е) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (d) (0,37 г, 01 ммоль) и 2 нHCl (100 мл). После переработки получают 0,15 г (47%) указанного соединения. Т.пл. = 248249 С. FDMS: M+ + 1 = 312. Анал. рассч. для(a) 1SR,5RS,6SR-2-оксо-3-4-хлор)бензилиденил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 9 (а), используя продукт препаративного примера 2 (8,41 г, 50,0 ммоль) и 4 хлорбензальдегида (8,0 г, 57 ммоль). Продукт выделяют фильтрованием осадка, полученного при подкислении водной фазы, получая 13,1 г(b) 1SR,5RS,6SR-Этил-2-оксо-3-4-хлор) бензилиденил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 10(b) с использованием продукта стадии (а) С 12,8 г, 48,7 ммоль), Et3N(c) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-4 хлор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают способом из примера 1(с), используя продукт стадии (b)(d) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-4 хлор)бензил)бицикло-[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (с) (2,4 г, 8,2 ммоль) и Na (0,20 г,8,7 г-атом). Переработка дает 2,1 г (88%) указанного в заголовке соединения. FDMS: M+ = 292; Анал. рассч. для С 16 Н 17 СlO3: С 65,64; Н 5,85; С 1 12,11. Обнаружено: С 65,40; Н 5,95; Сl 12,31.[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-хлор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2(с) с использованием продукта стадии (d) (2,0 г, 6,8 ммоль), NH4Cl (3,7 г,68 ммоль), KCN (4,4 г, 68 ммоль) и А 12 О 3 (40 г). Промежуточные продукты аминонитрилы ацетилируют ацетилхлоридом (0,63 г, 8,0 ммоль) и(21%) 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-3-4-хлор)бензил)бицикло[3.1.0]гексан-6-карбоксилата (А). Оставшиеся сырые продукты очищают HPLC (10% EtOAc/гексан до 80% EtOAc/гексан), получая 0,32 г (13%) (А) и 0,50 г (20%) 1SR,2RS,3SR,5RS,6SR-этил-2 аминоацетил-2-циано-3-4-хлор)бензил)бицикло[3.1.0]гексан-6-карбоксилата (В). (А): Т.пл. = 257-260 С. FDMS: M+ = 360. Анал. рассч. для(f) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (е) (0,28 г, 0,78 ммоль). После переработки получают 0,20 г (83%) указанного соединения. Т.пл. = 259-261 С. FDMS: M+(a) 1SR,5RS,6SR-Этил-2-оксо-3-2,3,4 трифтор)бензил-иденил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 16(а) с использованием продукта препаративного примера 2 (4,7 г, 27,9 ммоль), 2,3,4-трифторбензальдегида (4,7 г, 29,4 ммоль) и пирролидина (1 мл) в EtOH (100(b) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2,3,4-трифтор)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают последовательно согласно способу из примера 1(с) и способу из примера 3(с) с использованием в первом способе продукта стадии (а) (5,2 г, 16,7 ммоль) и Ni Ренея (1,3 г). Сырой продукт с этой стадии очищают HPLC (10% EtOAc,гексан до 25% EtOAc/гексан), получая 4,8 г (92%) 3RS диастереомера, который подвергают воздействию условий из примера 3(с), используя Na(c) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-2,3,4-трифтор)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 2 (с) с использованием продукта стадии (с)(4,0 г, 12,8 ммоль), KCN (8,3 г, 128 ммоль),NH4Cl (6,9 г, 128 ммоль) и Аl2O3 (40 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида (1,4 г, 18,2 ммоль) и N,N-диизопропилэтиламина (2,4 г,18,2 ммоль). Сырой продукт очищают кристаллизацией из СН 2 Сl2, чтобы получить 2,2 г (47%) указанного в заголовке соединения. Т.пл. = 246249 С. FDMS: M+ = 380. Анал. рассч. для(d) Указанное в заголовке соединение получают способом из примера 3(е), используя 2SR продукт стадии (с) (0,52 г, 1,4 ммоль) и 2 н.HCl (100 мл). Продукт выделяют при рН 5, получая 0,3 г (68%) указанного соединения. Т.пл.(a) (1SR,3RS,5RS,6SR) Этил-2-оксо-3 метилбицикло[3.1.0]-гексан-6-карбоксилат. К раствору продукта препаратинового примера 2 (317 мг, 1,88 ммоль) в безводном THF(30 мл) при -78 С и под аргоном добавляют 1 М раствор гексаметилдисилазида лития в THF (1,9 мл, 1,88 мл). Реакционную смесь перемешивают в течение 45 мин при этой температуре и затем этот раствор выпускают из канюли поверх раствора метилйодида (0,35 мл, 5,6 ммоль) в THF(10 мл) при -78 С. Реакционную смесь перемешивают в течение 1 ч при -78 С и в течение но 49 чи при комнатной температуре, гасят насыщенным раствором хлорида аммония (20 мл) и экстрагируют метиленхлоридом (3 х 50 мл). Объединенные органические фазы сушат над МgSO4,фильтруют и испаряют до сухости. Очистка сырого продукта флеш-хроматографией (гексан,этилацетат 4:1) дает указанное в заголовке соединение в виде бледно-желтого масла. Выход: 70%. 1H ЯМР (CDCl3), : 4,0 (q, 2H, J=7,1 Гц),2,32-2,1 (m, 3H), 1,98-1,85 (m, 2 Н), 1,75-1,6 (m,1H), 1,15 (t, 3H, J=7,1 Гц), 0,9 (d, 3H, J=6,9 Гц). 13 С ЯМР (СDСl3), : 212, 170,26, 60,95, 31,46,35,77, 35,21, 27,19, 27,07, 13,95, 13,79.(b) (1SR,2SR,3SR,5RS,6SR)-Этил-2-спиро 5-гидантоин-3-метилбицикло[3.1.0]гексан-6 карбоксилат. К раствору продукта стадии (а)(500 мг, 2,7 ммоль) в этаноле (1,3 мл) и воде (3,3 мл) добавляют цианид калия (195 мг, 3 ммоль) и карбонат аммония (782 мг, 8,1 ммоль). Смесь нагревают при 55 С в течение ночи и полученное твердое вещество отфильтровывают и промывают EtOH-H2O, чтобы получить указанное в заголовке соединение. Выход: 40%. 1H ЯМР(с) Смесь продукта стадии (b) и 12 н. раствора HCl (10 мл) кипятят с обратным холодильником в реакторе в течение ночи. Полученный раствор испаряют до сухости, получая белое твердое вещество. Указанное в заголовке соединение выделяют как цвиттерион после ионообменной хроматографии на Dowex 50 х 8 50-100 меш с использованием в качестве элюента смеси пиридин-вода 10%. Выход: 40%. 1H ЯМР (D2O-Pyr-ds), : 2,0-1,7 (m, 6H), 0,9 (d, 3H) 13 С ЯМР (D2O-Pyr-d5), : 179,95, 173,37, 70,08,36,46, 33,69, 31,79, 26,44, 23,75, 12,18, ИК (KBr) 1697,57, 1678,28 см-1. Пример 27. 1SR,2SR,3SR,5RS,6SR-2 Амино-3-4-фтор-3-метил)бензил)бицикло[3.1.0]гексан-2,6-дикарбоновая кислота.(a) 1SR.5RS,6SR-Этил-2-оксо-3-4-фтор-3 метил)бензил-иденил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 18(а) с использованием продукта приготовления 2 (17,0 г, 101 ммоль), 4 фтор-3-метилбензальдегида (15 г, 108 ммоль) и пирролидина (2 мл) в EtOH (200 мл). Осадок,который образуется, отфильтровывают и сушат,получая 16,5 г (57%) указанного в заголовке соединения: Т.пл. 147-149 С.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-4 фтор-3-метил)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (15,3 г, 53,1 ммоль) и Ni Ренея(3,8 г). Сырой продукт очищают HPLC (10%(c) 1SR,2SR,3SR,5RS,6SR-Этил-2-оксо-34-фтор-3-метил)-бензил)бицикло[3.1.0]гексан 6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (14,0 г, 48,2 ммоль) и(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-4-фтор-3-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-34-фтор-3-метил)бензил)бицикло[3.1.0]гексан 6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (12,0 г, 41,3 ммоль), KCN (26,9 г, 413 ммоль), NH4Cl (22,1 г, 413 ммоль) и Al2O3(100 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида(4,7 г, 59,7 ммоль) и N,N-диизопропилэтиламина (7,7 г, 59,7 ммоль). Сырой продукт очищают HPLC (20% EtOAc/гексан до 60%(e) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-4 фтор-3-метил)бензил)-бицикло[3.1.0]гексан-2,6 дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя 2SR продукт стадии (d) (3,6 г, 10,0 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3,фильтруют и промывают Н 2 О, IPA и EtOAc,получая 2,48 г (81%) указанного соединения. Т.пл. = 243-246 С. FDMS: М+ - 45(СO2 Н) =262. Анал. рассч. для C16H18FNO4: С 60,80; Н 5,74, N 4,43. Обнаружено: С 61,03; Н 5,48; N 4,67. Пример 28 1SR,2SR,3SR,5RS,6SR-2Aмино-3-3-фтор-5-(трифторметилбензил)бицикло[3.1.0]гексан-2,6-дикарбоновая кислота.(а) 1SR,5RS,6SR-Этил-2-оксо-3-3-фтор-5(трифторметил-бензилиденил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 18 (а), используя продукт препаративного примера 2 (4,4 г, 26,0 ммоль), 3 фтор-5-(трифторметил)бензальдегид (5,0 г, 26,0 ммоль) и пирролидин (1,0 мл) в EtOH (150 мл). Продукт осаждают из раствора и отфильтровывают, получая 7,1 г (80%) указанного в заголовке соединения: Т.пл. 131-133 С. FDMS: М+ =(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3 фтор-5-(трифторметилбензил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (6,4 г, 18,6 ммоль), Ni Ренея(1,6 г) с H2 при 3,52 кг/кв.см. Сырой продукт очищают HPLC (10% EtOAc/гексан до 50%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 фтор-5-(трифторметилбензил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,8 г, 16,9 ммоль) и Na (0,39 г,16,9 г-атом). Реакционную смесь концентрируют, чтобы получить 4,6 г (80%) указанного в заголовке соединения. Т.пл. = 105-107 С.(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3-фтор-5-(трифторметил бензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR, 2RS, 3SR, 5RS, 6SR-этил-2-аминоацетил-2 циано-2-3-фтор-5-(трифторметилбензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (4,0 г, 11,6 ммоль), KCN (7,5 г,116 ммоль), NH4Cl (6,2 г, 116 ммоль) и Аl2O3 (40 г). Промежуточный продукт аминонитрил ацетилируют с использованием ацетилхлорида (1,4 г, 18,2 ммоль) и N,N-диизопропилэтиламина(е) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-3 фтор-5-(трифторметилбензил)бицикло[3.1.0] гексан-2,6-дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя 2SR продукт стадии(d) (1,7 г, 4,3 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают H2O,IPA и EtOAc, получая 1,07 г (69%) указанного соединения. Т.пл.250 С. FDMS: M+ + 1 = 362.(a) 1SR,5RS,6SR-Этил-2-oксo-3-2-хлор-5(трифторметил-бензилиденил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 18(а), используя продукт препаративного примера 2 (4,0 г, 24,0 ммоль), 2 хлор-5-(трифторметил)бензальдегид (5,1 г, 24,0 ммоль) и пирролидин (1,0 мл) в EtOH (150 мл). Выделяют 4,2 г (49%) указанного в заголовке соединения: Т.пл. 87-89 С. FDMS: M+ = 358; Анал. рассч. для C17H14ClF3O3: С 56,92; Н 3 93. Обнаружено: С 57,16; Н 4,07.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-2 хлор-5-(трифторметилбензил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (4,1 г, 11,4 ммоль), Ni Ренея (1,0 г) с Н 2 при 2,81 кг/кв.см. Сырой продукт очищают HPLC (10%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2 хлор-5-(трифторметилбензил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (3,8 г, 10,5 ммоль) и Na (0,24 г, 10,4 г-атом). Реакционную смесь концентрируют, чтобы получить 3,5 г(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-2-хлор-5-(трифторметил бензил)бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-2-хлор-5-(трифторметилбензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (3,4 г, 9 4 ммоль), KCN (6,1 г,94 ммоль), NH4Cl (5,0 г, 94 ммоль) и Аl2O3 (44 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида (1,0 г,12,7 ммоль) и N,N-диизопропилэтиламина (1,7 г, 12,7 ммоль). Сырой продукт очищают HPLC(e) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-2 хлор-5-(трифторметилбензил)бицикло[3.1.0] гексан-2,6-дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя 2SR продукт стадии(d) (1,2 г, 2,8 ммоль). Сырой продукт растворяют в Н 2O при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О,IPA и EtOAc, получая 0,9 г (85%) указанного соединения. Т.пл. = 252-254 С. FDMS: M+ + 1 = 378. Анал. рассч. для C16H15ClF3NO4: С 50,87; Н 4,00; N 3,71; Обнаружено: С 50,94; Н 4,22; N 3,68. Пример 30. 1SR,2SR,3SR,5RS,6SR-2-Амино-3-3-фтор-2-метил)бензил)бицикло-[3.1.0] гексан-2,6-дикарбоновая кислота.(a) 1SR,5RS,6SR-Этил-2-оксо-3-3-фтор-2 метил)бензил-иденил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 18(а) с использованием продукта препаративного примера 2(6,0 г, 36,0 ммоль), 3-фтор-2-метилбензальдегида (5,0 г,36,2 ммоль) и пирролидина (1,0 мл) в EtOH (150 мл). Выделяют 6,2 г (60%) указанного в заголовке соединения: Т.пл. 96-98 С. FDMS: M+ = 288. Анал. рассч. для C17H17F1O3: С 70,82; Н 5,94. Обнаружено: С 71,07; Н 5,98.(b) 1SR,3RS,5RS,6SR-Этил-2-oкco-3-3 фтор-2-метил)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (6,1 г, 21,1 ммоль) и Ni Ренея (1,5 г) с Н 2 при 2,81 кг/кв.см. Сырой продукт очищают HPLC (5% EtOAc/гексан до 50%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-3 фтор-2-метил)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,4 г, 18,6 ммоль) и Na (0,43 г,18,6 г-атом). Реакционную смесь концентрируют, чтобы получить 5,0 г (93%) указанного в заголовке соединения. Т.пл. = 77-79 С. FDMS:(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3-фтор-2-метил)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (4,7 г, 16,2 ммоль), KCN (10,5 г,162 ммоль), NH4Cl (8,7 г, 162 ммоль), и Аl2 О 3(50 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида 54 очищают кристаллизацией из CH2Cl2 и кристаллизуют второй раз из EtOAc, получая 1,3 г(е) 1SR,2SR,3SR,5RS,6SR-2-Амино-3-3 фтор-2-метил)бензил)-бицикло[3.1.0]гексан-2,6 дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя продукт стадии (d) (1,0 г, 2,8 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О, IPA и EtOAc, получая 0,38 г[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 18 (а), используя продукт препаративного примера 2 (3,6 г, 21,4 ммоль), 3(1,1,2,2-тетрафторэтокси)бензальдегид (5,0 г,21,5 ммоль) и пирролидина (1,0 мл) в EtOH (150 мл). Сырой продукт очищают HPLC (5%[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (5,6 г, 15,0 ммоль) и Ni Ренея(1,4 г). Сырой продукт очищают HPLC, (5%[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (4,8 г, 12,8 ммоль) и Na (0,29 г,12,8 г-атом). Реакционную смесь концентрируют, чтобы получить 4,3 г (90%) указанного в заголовке соединения. Т.пл. = 56-58 С. FDMS: 55 Указанное соединение получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (3,8 г, 10,1 ммоль), KCN (6,6 г,101 ммоль), NH4Cl (5,4 г, 101 ммоль), и Аl2O3(40 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида(1,1 г, 14,3 ммоль) и N,N-диизопропилэтиламина (1,8 г, 14,3 ммоль). Сырой продукт очищают HPLC (10% EtOAc/гексан до 80%[3.1.0]гексан-2,6-дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя продукт со стадии(d) (1,8 г, 3,8 ммоль). Сырой продукт растворяют в Н 2 О при 10 рН и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О,IPA и EtOAc, получая 0,89 г (59%) указанного соединения. Т.пл. 250 С. FDMS: M+ 45(СO2 Н)(0,65 г, 93 г-атом) в Et2O подвергают воздействию ультразвука под N2, используя ультразвуковую ванну Branson 3200, в течение 1 ч при окружающей температуре. Реакционную смесь охлаждают до 0 С и добавляют по каплям в течение 1,5 ч смесь 1SR,5RS,6SR-этил-2-оксо-3(бензилиденил)бицикло[3.1.0]гексан-6-карбоксилата (6,0 г, 23,4 ммоль), NiAcAc (0,1 г, 0,4 ммоль). Реакционную смесь затем перемешивают при окружающей температуре в течение 3 ч и гасят насыщенным водным NH4Cl. Реакционную смесь распределяют между водным NH4Cl и Et2O. Органический слой промывают солевым раствором, сушат с MgSO4, фильтруют и концентрируют при пониженном давлении. Сырой продукт очищают HPLC (10% EtOAc/гексан до 50% EtOAc/гексан), получая 1,8 г (23%) указанного в заголовке соединения: Т.пл. 110-114 С;[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 2 (с) с использованием про 000894 56 дукта стадии (а) (1,7 г, 5,0 ммоль), KCN (3,2 г,50 ммоль), NH4Cl (2,6 г, 50 ммоль) и Аl2O3 (28 г). Промежуточный продукт аминонитрил ацилируют, используя ацетилхлорид (1,0 г, 7,5 ммоль) и N,N-диизопропилэтиламин (0,6 г, 7,5 ммоль). Сырой продукт очищают HPLC (10%(c) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-1,1 дифенил)метил)-бицикло[3.1.0]гексан-2,6 дикарбоновая кислота. Указанное соединение получают способом из примера 3(е) с использованием продукта стадии (b) (0,42 г, 1,0 ммоль). Сырой продукт растворяют в Н 2O при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О, IPA и EtOAc, получая 0,26 г (70%) указанного в заголовке соединения. Т.пл. = 238-240 С.(a) 1SR,5RS,6SR-Этил-2-оксо-3-2,5 дифтор)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 18(а) с использованием продукта препаративного примера 2 (5,8 г, 34,5 ммоль), 2,5-дифторбензальдегида (4,9 г, 34,5 ммоль) и пирролидина (1,0 мл) в EtOH (150 мл). Сырой продукт очищают(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-2,5 дифтор)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (8,3 г, 28,4 ммоль) и Ni Ренея(2,0 г). Сырой продукт очищают HPLC (10%(c) 1SR,3SR,5RS,6SR-Этил-2-оксо-3-2,5 дифтор)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (8,0 г, 27,2 ммоль) и Na (0,63 г,27,2 г-атом). Реакционную смесь концентрируют, чтобы получить 7,2 г (90%) указанного в заголовке соединения. Т.пл. = 65-68 С. FDMS:[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (6,9 г, 23,5 ммоль), KCN (15,3 г,23,5 ммоль), NH4Cl (12,5 г, 23,5 ммоль) и Аl2O3(50 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида(4,4 г, 34 ммоль). Сырой продукт очищают кристаллизацией из CH2Cl2, получая 1,65 г (19%) 1SR,2SR,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-2,5-дифтор)бензил)бицикло[3.1.0] гексан-6-карбоксилата. Т.пл. = 192-196 С.(е) 1SR,2SR,3SR,5RS,6SR-2-Амино-3-2,5 дифтор)бензил)-бицикло[3.1.0]гексан-2,6 дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя 2SR продукт стадии(d) (1,3 г, 3,6 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О,IPA и EtOAc, получая 0,84 г (71%) указанного соединения. Т.пл. = 243-245 С. FDMS: М+ + 1 = 312. Анал. рассч. для C15H15F2NO4: С 57,88; Н 4,86, N 4,50. Обнаружено: С 57,88; Н 5,02; N 4,61. Пример 34. 1SR,2SR,3SR,5RS,6SR-2 Амино-3-3,5-диметил)бензил)бицикло-[3.1.0] гексан-2,6-дикарбоновая кислота.(a) 1SR,5RS,6SR-Этил-2-оксо-3-3,5-диметил)бензилиденил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 18 (а), используя продукт препаративного примера 2(5,6 г, 34,3 ммоль),3,5-диметилбензальдегид (4,6 г, 34,3 ммоль) и пирролидин (1,1 мл) в EtOH (150 мл). Путем фильтрования выделяют 7,2 г (77%) указанного в заголовке соединения. Т.пл. 104-105 С; FDMS: М+ = 284; Анал. рассч. для C18H20O3: С 76,03; Н 7,09. Обнаружено: С 76,12; Н 6,92.(b) 1SR,3RS,5RS,6SR-Этил-2-оксо-3-3,5 диметил)бензил)-бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (6,3 г, 22,2 ммоль) и Ni Ренея(1,6 г). Сырой продукт очищают HPLC (10%(c) 1SR,3SR,5RS,6SR-Этил-2-oкco-3-3,5 диметил)бензил)-бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,8 г, 20,3 ммоль) и Na(d) 1SR, 2SR, 3SR, 5RS, 6SR-Этил-2-аминоацетил-2-циано-3-3,5-диметил)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (4,5 г, 15,7 ммоль), KCN (10,2 г,157 ммоль), NH4Cl (8,4 г, 157 ммоль), и Аl2O3(45 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида(1,9 г, 24,5 ммоль) и N,N-диизопропилэтиламина (3,2 г, 24,5 ммоль). Сырой продукт очищают путем кристаллизации из смеси(е) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-3,5 диметил)бензил)-бицикло[3.1.0]гексан-2,6 дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя продукт со стадии(d) (1,1 г, 3,1 ммоль). Сырой продукт растворяют в H2O при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2O,IPA и EtOAc, получая 0,74 г (78%) указанного в заголовке соединения. Т.пл. 260 С. FDMS: М+(а) 1SR,5RS,6SR-Этил-2-oкco-3-3-(3(трифторметил-фенокси)бензилиденил)бицикло[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 18(а), используя продукт препаративного примера 2 (3,1 г, 18,8 ммоль), 3(3-(трифторметил)фенокси)бензальдегид (5,0 г,18,8 ммоль) и пирролидин (1,0 мл) в EtOH (150 мл). Путем фильтрования выделяют 6,1 г (78%) указанного в заголовке соединения: Т.пл. 98100C; FDMS: M+ = 416; Анал. рассч. для С 23 Н 19F3 О 4: С 66,34; Н 4,60. Обнаружено: С 66,53; Н 4,67.[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (5,6 г, 13,5 ммоль) и Ni Ренея(1,4 г). Сырой продукт очищают HPLC (10%[3.1.0]гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (5,2 г, 12,4 ммоль) и Na (0,29 г,12,4 г-атом). Реакционную смесь концентрируют, чтобы получить 4,7 г (90%) указанного в заголовке соединения. FDMS: M+ = 418; Анал. рассч. для С 23 Н 21F3O40,1 СН 2 Сl2: С 65,00; Н 5,00. Обнаружено: С 65,06; Н 5,05.(d) 1SR, 2SR, 3SR, 5RS, 6SR-Этил-2aминоацетил-2-циано-3-3-(3-(трифторметил)феноксибензил)бицикло[3.1.0]гексан-6 карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2 аминоацетил-2-циано-3-3-(3-(трифторметил) феноксибензил)бицикло[3.1.0]-гексан-6 карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (4,3 г, 10,3 ммоль), KCN (6,7 г,103 ммоль), NH4Cl (5,5 г, 103 ммоль) и Аl2O3 (40 г) . Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида (1,1 г,13,4 ммоль) и N,N-диизопропилэтиламина (1,7 г, 13,4 ммоль). Сырой продукт очищают HPLC,получая 1,9 г (38%) 1SR,2SR,3SR,5RS,6SR-этил 2-аминоацетил-2-циано-3-3-(3-(трифторметил) феноксибензил)-бицикло[3.1.0]гексан-6 карбоксилата (А) и 0,6 г (12%) диастереомера,1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2 циано-3-3-(3-(трифторметил)феноксибензил) бицикло[3.1.0]гексан-6-карбоксилата (В). (А): Т.пл. = 164-166 С. FDMS: M+ = 486. Анал. рассч. для C26H25F3N2O4: С 64,19; Н 5,18, N 5,76; Обнаружено: С 64,28; Н 5,04; N 5,78. (В):[3.1.0]гексан-2,6-дикарбоновая кислота. Указанное соединение получают способом из примера 3(e), используя 2SR продукт стадии (d) (1,4 г,2,9 ммоль). Сырой продукт растворяют в Н 2 О при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2 О, IPA и(a) 1SR,5RS,6SR-Этил-2-оксо-3-3-(4 хлор)фенокси)бензилиденил)бицикло[3.1.0] гексан-6-карбоксилат. Указанное соединение получают согласно способу из примера 18(а), используя продукт препаративного примера 2 (4,2 г, 25,0 ммоль), 3(4-хлорфенокси)бензальдегид; (5,8 г, 25,0 ммоль) и пирролидин (1,0 мл) в EtOH (150 мл). Путем фильтрования выделяют 8,9 г (93%) ука 000894(b) 1SR,3RS,5RS,6SR-Этил-2-oкco-3-3-(4 хлор)фенокси)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 1(с) с использованием продукта стадии (а) (8,3 г, 21,7 ммоль) и Ni Ренея (2,0 г). Сырой продукт очищают HPLC(c) 1SR,3SR,5RS,6SR-Этил-2-оксo-3-3-(4 хлор)фенокси)-бензил)бицикло[3.1.0]гексан-6 карбоксилат. Указанное соединение получают согласно способу из примера 3(с) с использованием продукта стадии (b) (7,7 г, 20,0 ммоль) и(d) 1SR,2SR,3SR,5RS,6SR-Этил-2-аминоацетил-2-циано-3-3-(4-хлор)фенокси)бензил) бицикло[3.1.0]гексан-6-карбоксилат и 1SR,2RS,3SR,5RS,6SR-этил-2-аминоацетил-2-циано-33-(4-хлор)фенокси)бензил)бицикло[3.1.0]гексан-6-карбоксилат. Указанные соединения получают согласно способу из примера 2 (с) с использованием продукта стадии (с) (6,0 г, 15,6 ммоль), KCN (10,1 г,156 ммоль), NH4Cl (8,3 г, 156 ммоль) и Al2O3 (50 г). Промежуточный продукт аминонитрил ацилируют с использованием ацетилхлорида (2,2 г,28,0 ммоль) и N,N-диизопропилэтиламина (3,3 г, 25,5 ммоль). Сырой продукт очищают HPLC(e) 1SR,2SR,3SR,5RS,6SR-2-Aмино-3-3(4-хлор)фенокси)-бензил)бицикло[3.1.0]гексан 2,6-дикарбоновая кислота. Указанное соединение получают способом из примера 3(е), используя 2SR продукт стадии(d) (2,4 г, 5,3 ммоль). Сырой продукт растворяют в Н 2O при рН 10 и фильтруют. Продукт осаждают при рН 3, фильтруют и промывают Н 2O,IPA и EtOAc, получая 0,97 г (46%) указанного соединения. Т.пл. = 250-253 С. FDMS: M+ = 401. Анал. рассч. для C21H20ClNO5: С 62,77; Н 5,02, N 3,49. Обнаружено: С 62,70; Н 5,13; N 3,26.
МПК / Метки
МПК: C07D 233/58, A61K 31/19, C07C 211/38
Метки: замещенные, бициклогексанкарбоновые, получения, качестве, аминокислот, кислоты, рецептора, применение, возбуждающих, антагонистов, способ, производные
Код ссылки
<a href="https://eas.patents.su/30-894-zameshhennye-biciklogeksankarbonovye-kisloty-i-ih-proizvodnye-v-kachestve-antagonistov-receptora-vozbuzhdayushhih-aminokislot-sposob-ih-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бициклогексанкарбоновые кислоты и их производные в качестве антагонистов рецептора возбуждающих аминокислот, способ их получения и применение.</a>


































