7 – алкиниламино – триазолопиримидины, способ их получения и их применение для борьбы с патогенными грибами, а также содержащие их средства
Номер патента: 8920
Опубликовано: 31.08.2007
Авторы: Шерер Мария, Штирль Райнхард, Райнхаймер Йоахим, Гипзер Андреас, Швёглер Аня, Гевер Маркус, Блеттнер Карстен, Штратманн Зигфрид, Шёфль Ульрих, Мюллер Бернд, Тормо И Бласко Хорди, Грамменос Вассилиос, Шивек Франк, Гроте Томас, Шэфер Петер
Формула / Реферат
1. 7-Алкиниламинотриазолопиримидины формулы I
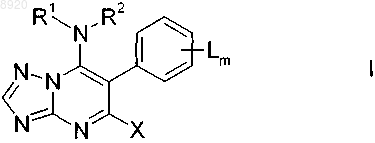
в которой заместители имеют следующие значения:
L означает независимо друг от друга галоген, С1-С6-алкил, С1-С6-галогеналкил, S(O)nA1,
А1 означает C1-C8-алкил,
n равно 0,
m равно 1, 2, 3, 4 или 5, причем по меньшей мере одна группа L находится в орто-положении к связи с триазолопиримидиновым скелетом;
X означает галоген, циано, С1-С4-алкил или С1-С4-алкокси;
R1 водород или С1-С4-алкил;
R2 С3-С10-алкинил, который может быть незамещенным или частично или полностью галогенированным.
2. Соединения формулы I.1
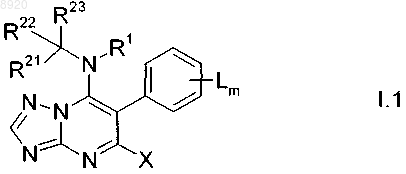
в которой
R21 означает метил или галогенметил;
R22 означает водород, метил или галогенметил;
R23 означает С2-С8-алкинил, который может быть незамещенным или частично или полностью галогенированным и/или может иметь от одной до трех групп Ra;
а другие заместители определены согласно п.1.
3. Соединения формулы I или I.1 согласно п.1 или 2, в которых X означает хлор или метил, в частности хлор.
4. Соединения формулы I или I.1 по одному из пп.1-3, в которых замещенная Lm фенильная группа означает группу А
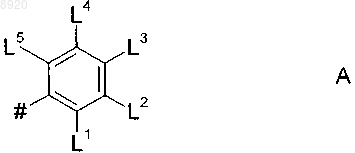
где # означает место связи с триазолопиримидиновым скелетом и
L1 означает фтор, хлор, СН3 или CF3;
L2, L4 означают независимо друг от друга водород или фтор;
L3 означает водород, фтор, хлор, СН3, ОСН3, амино, NHR или NR2 и
L5 означает водород, фтор или СН3.
5. Соединения формулы I по одному из пп.1-3, в которых замещенная Lm фенильная группа означает одну из следующих комбинаций заместителей: 2-фтор-6-хлор, 2,6-дифтор, 2,6-дихлор, 2-фтор-6-метил, 2,4,6-трифтор, 2,6-дифтор-4-метокси, пентафтор, 2-метил-4-фтор, 2-трифторметил, 2-метокси-6-фтор, 2-хлор, 2-фтор, 2,4-дифтор, 2-фтор-4-хлор, 2-хлор-4-фтор, 2,3-дифтор, 2,5-дифтор, 2,3,4-трифтор, 2-метил, 2,4-диметил, 2-метил-4-хлор, 2-фтор-4-метил, 2,6-диметил, 2,4,6-триметил, 2,6-дифтор-4-метил, 2-трифторметил-4-фтор, 2-трифторметил-5-фтор или 2-трифторметил-5-хлор.
6. Способ получения соединений формулы I по пп.1-5, включающий взаимодействие дигалогентриазолопиримидинов формулы II
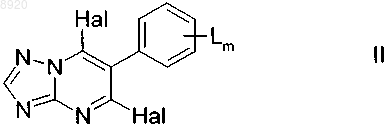
в которой заместители имеют указанные для формулы I значения и Hal означает атом галогена, в частности хлор, с аминами формулы III

7. Средство для борьбы с патогенными грибами, содержащее твердый или жидкий наполнитель и соединение формулы I по п.1.
8. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы или подлежащие защите от поражения грибами материалы, растения, почву или посевной материал обрабатывают эффективным количеством соединения формулы I по п.1.
Текст
008920 Настоящее изобретение относится к 7-алкиниламинотриазолопиримидинам формулы I в которой заместители имеют следующее значение:L означает независимо друг от друга галоген, С 1-С 6-алкил, C1-С 6-галогеналкил, C1-С 6-алкокси, амино, NHR, NR2, циано, S(O)nA1 или С(О)А 2,R означает C1-C8-алкил или C1-C8-алкилкарбонил; А 1 означает водород, гидрокси, C1-C8-алкил, C1-C8-алкиламино или ди(C1-C8-алкил)амино;n равно 0, 1 или 2; А 2 означает С 2-С 8-алкенил, C1-C8-алкокси, С 1-С 6-галогеналкокси или одну из названных для А 1 групп;m равно 1, 2, 3, 4 или 5, причем по меньшей мере одна группа L находится в орто-положении к связи с триазолопиримидиновым скелетом;R1 означает водород или С 1-С 4-алкил;R2 означает С 3-С 10-алкинил, который может быть незамещенным или частично или полностью галогенированным или может иметь от одной до трех групп Ra:Ra означает галоген, циано, нитро, гидрокси, C1-С 6-алкилкарбонил, С 3-С 6-циклоалкил, C1-С 6-алкокси, С 1-С 6-галогеналкокси, С 1-С 6-алкоксикарбонил, С 1-С 6-алкилтио, C1-С 6-алкиламино, ди-С 1-С 6-алкиламино, С 2-С 6-алкенил, С 2-С 6-алкенилокси, С 3-С 6-алкинилокси или С 3-С 6-циклоалкил,причем эти алифатические или алициклические группы, в свою очередь, могут быть частично или полностью галогенированы или могут иметь от одной до трех групп Rb:Rb означает галоген, циано, нитро, гидрокси, меркапто, амино, карбоксил, аминокарбонил, аминотиокарбонил, алкил, галоалкил, алкенил, алкенилокси, алкинилокси, алкокси, галогеналкокси, алкилтио,алкиламино, диалкиламино, формил, алкилкарбонил, алкилсульфонил, алкилсульфоксил, алкоксикарбонил, алкилкарбонилокси, алкиламинокарбонил, диалкиламинокарбонил, алкиламинотиокарбонил, диалкиламинотиокарбонил, причем алкильные группы в этих остатках содержат от 1 до 6 атомов углерода и названные алкенильные или алкинильные группы в этих остатках содержат от 2 до 8 атомов углерода. Кроме того, изобретение относится к способу получения этих соединений, к содержащим их средствам, а также к их применению для борьбы с фитопатогенными грибами. Из европейских заявок ЕР-А 71 792 и ЕР-А 550 113, в общем, известны 6-фенил-7-аминотриазолопиримидины. Описанные в этих известных публикациях соединения известны для борьбы с фитопатогенными грибами. Их действие, однако, во многих случаях не является удовлетворительным. Исходя из этого, задачей настоящего изобретения является разработка соединений с улучшенным действием и/или расширенным спектром действия. В соответствии с этим были разработаны предлагаемые соединения. Далее были разработаны способ и промежуточные продукты для их получения, содержащие их средства, а также способ борьбы с патогенными грибами при применении соединений I. Соединения формулы I отличаются от известных из вышеназванных источников выполнением замещения 6-фенильной группы, которая принудительно замещена в орто-положении. Соединения формулы I имеют по сравнению с известными соединениями повышенную эффективность против патогенных грибов. Соединения согласно изобретению могут быть получены различными путями. Предпочтительно их получают взаимодействием дигалогентриазолопиримидинов формулы II, где Hal означает атом галогена,такой как бром или, в частности, хлор, с аминами формулы III при известных из WO 98/46608 условиях Взаимодействие соединения II с аминами формулы III осуществляют предпочтительно при температуре от 0 до 70 С, предпочтительно от 10 до 35 С, предпочтительно в присутствии инертного растворителя,такого как простой эфир, например диоксан, диэтиловый эфир или тетрагидрофуран, галогенированные углеводороды, такие как дихлорметан, и ароматические углеводороды, такие как, например, толуол. Применение основания, такого как третичные амины, например триэтиламин, или ароматических оснований, таких как карбонат калия, является предпочтительным, в качестве основания может также служить избыточный амин формулы III. Амины формулы III в настоящее время известны или могут быть получены известными методами,например из соответствующих спиртов через тозилаты и фталимиды [ср. публикацию J. Am. Chem. Soc.,том 117, стр. 7025 (1995); международную заявку WO 93/20804], восстановлением соответствующих нитрилов [ср. публикации Heterocycles, том 35, стр. 2 (1993); Synthetic Commun., том 25, стр. 413 (1995);Tetrahedron Lett., стр. 2933 (1995)], или восстановительным аминированием кетонов [ср. публикации J.Am. Chem. Soc., том 122, стр. 9556 (2000); Org. Lett., стр. 731 (2001); J. Med. Chem., стр. 1566 (1988)], из соответствующих галогенидов [ср. публикацию Synthesis, стр. 150 (1995)] и, в случае неоходимости, последующим алкилированием. Построение группы CR1R2 может, в случае необходимости, осуществляться реакцией Гриньяра на соответствующих нитрилах или ангидридах карбоновой кислоты [ср. публикацию J. Org. Chem., стр. 5056 (1992); Tetrahedron Lett., стр. 2933 (1995)]. Соединения формулы I, в которой X означает циано или С 1-С 4-алкокси (формула I.B), предпочтительно могут быть получены из соединений формулы I, в которой X означает галоген [Hal], предпочтительно хлор, которые соответствуют формуле I.A. Соединения I.A подвергают взаимодействию с соединениями М-Х' (формула IV) с получением соединений I.B. Соединения IV в зависимости от вводимой группы X' представляют собой неорганический цианид или алкоксилат. Взаимодействие осуществляется предпочтительно в присутствии инертного растворителя. Катион М в формуле IV имеет малое значение, из практических соображений обычно предпочтительны соли аммония, тетраалкиламмония или щелочных или щелочно-земельных металлов. Обычно температура реакции составляет от 0 до 120 С, предпочтительно от 10 до 40 С [ср. публиацию J. Heterocycl. Chem., том 12, стр. 861-863 (1975)]. Пригодные растворители включают простой эфир, такой как диоксан, диэтиловый эфир и предпочтительно тетрагидрофуран, галогенированные углеводороды, такие как дихлорметан, и ароматические углеводороды, такие как толуол. Соединения I, при которых X означает С 1-С 4-алкил (формула I.C), предпочтительно могут быть получены из исходных веществ формулы I.A кратко изложенным ниже путем. Соединения формулы I.C, при которых X" означает С 1-С 4-алкил, могут быть получены реакцией сочетания 5-галогентриазолопиримидинов формулы I.A с металлорганическими реагентами формулы V. При одной форме выполнения способа взаимодействие осуществляется при катализе на переходном металле, таком как катализ на никеле или палладии. В формуле V X" означает С 1-С 4-алкил и М означает ион металла валентностью Y, как, например, В,Zn или Sn. Эта реакция может осуществляться, например, аналогично методам из следующих публикаций: J. Chem. Soc. Perkin Trans. 1, 1187 (1994), ebenda 1, 2345 (1996); WO 99/41255; Aust. J. Chem., том 43,стр. 733 (1990); J. Org. Chem., том 43, стр. 358 (1978); J. Chem. Soc. Chem. Commun. стр. 866 (1979);Tetrahedron Lett., том 34, стр. 8267 (1993); ebenda, том 33, стр. 413 (1992). Соединения формулы I, при которых X означает С 1-С 4-алкил или С 1-С 4-галогеналкил (формула I.C),могут быть предпочтительно получены следующим синтезом. Исходя из 5-аминотриазола VI и кетоэфира VII получают 5-алкил-7-гидрокси-6-фенилтиоазолопиримидины VIII. В формуле VII R означает С 1-С 4-алкильную группу, в частности метил или этил. Применением легко доступных сложных эфиров 2-фенилацетуксусной кислоты формулы VIIa, где Х"=СН 3,получают 5-метил-7-гидрокси-6-фенилтриазолопиримидины [ср. публикацию Chem. Pharm. Bull., 9, 801,(1961)]. 5-Аминотриазол VI может быть получен коммерческим путем. Получение исходных соединенийVII осуществляют предпочтительно при известных из ЕР-А 10 02 788 условиях. Полученные таким образом 5-алкил-7-гидрокси-6-фенилтриазолопиримидины VIII подвергают взаимодействию с агентами галогенирования [HAL] с получением 7-галогенотриазолопиримидинов формулы IX. Предпочтительны агенты хлорирования или бромирования, такие как фосфороксибромид, фосфороксихлорид, тионилхлорид, тионилбромид или сульфурилхлорид. Взаимодействие может осуществлять-2 008920 ся в самом веществе или в присутствии растворителя. Обычная температура реакции составляет от 0 до 150 С или предпочтительно от 80 до 125 С. Взаимодействие соединения IX с аминами формулы III проводят предпочтительно при температуре от 0 до 70 С, предпочтительно от 10 до 35 С, преимущественно в присутствии инертного растворителя,такого как простой эфир, например диоксан, диэтиловый эфир или, в частности, тетрагидрофуран, галогенированные углеводороды, такие как дихлорметан, и ароматические углеводороды, такие как, например, толуол [ср. WO 98/46608]. Предпочтительно применение основания, такого как третичные амины, например триэтиламин, или неорганического основания, такого как карбонат калия, также и амин формулы III может служить в качестве основания. Соединения формулы I.C альтернативно могут быть получены из соединений I.A и малонатов формулы Малонаты известны из литературных источников [J. Am. Chem. Soc., Bd. 64, 2714 (1942); J. Org.Chem., Bd. 39, 2172 (1974); Helv. Chim. Acta, Bd. 61, 1565 (1978)] или могут быть получены согласно цитируемым литературным источникам. Последующее омыление сложного эфира XII осуществляется при, в общем, обычных условиях, в зависимости от различных структурных элементов может быть предпочтительным щелочное или кислотное омыление соединений XII. При условиях омыления сложного эфира может полностью или частично осуществляться декарбоксилирование в соединение I.C. Декарбоксилирование производится обычно при температуре от 20 до 180 С, предпочтительно от 50 до 120 С, в инертном растворителе, в случае необходимости в присутствии кислоты. Пригодными кислотами являются соляная кислота, серная кислота, фосфорная кислота, муравьиная кислота, уксусная кислота, п-толуолсульфокислота. Пригодными растворителями являются вода, алифатические углеводороды, такие как пентан, гексан, циклогексан и петролейный эфир, ароматические углеводороды, такие как толуол, о-, м- или п-ксилол, галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир,трет-бутиметиловый эфир, диоксан, анизол и тетрагидрофуран, нитрилы, такие как ацетонитрил и пропионитрил, кетоны, такие как ацетон, метиленкетон, диэтилкетон и трет-бутилметилкетон, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол и трет-бутанол, а также диметилсульфоксид,диметилформамид и диметилацетамид, особенно предпочтительно проведение реакации в соляной кислоте или в уксусной кислоте. Могут применяться также и смеси названных растворителей. Реакционные смеси перерабатываются обычным образом, например смешением с водой, разделением фаз и, в случае необходимости, хроматографической очисткой сырых продуктов. Промежуточные и конечные продукты имеются, например, в форме бесцветных или слегка коричневатых вязких масел,которые при пониженном давлении и при умеренно повышенной температуре освобождаются от летучих частей и очищаются. Если промежуточные и конечные продукты получают в качестве твердых веществ,очистка может осуществляться также и перекристаллизацией или дигерированием. Если отдельные соединения формулы I не доступны вышеприведенным путем, они могут быть получены дериватезированием других соединений формулы I. Если при синтезе получают смеси изомеров, в общем, разделение не обязательно требуется, так как отдельные изомеры во время переработки для применения или при применении (например, при воздействии света, кислот или оснований) могут превращаться друг в друга. Соответствующие превращения могут также происходить после применения, например, при обработке растений, в обработанных растениях или в патогенном грибе, с которым требуется бороться. При приведенных в вышестоящих формулах определениях символов применяются сборные понятия, которые, в общем, представляют собой следующие заместители: галоген означает фтор, хлор, бром и йод; алкил означает насыщенные, неразветвленные или разветвленные углеводородные остатки с числом атомов углерода от 1 до 4 или 8, например С 1-С 6-алкил, такой как метил, этил, пропил, 1-метилэтил,бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метил-3 008920 бутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил; галогеналкил означает неразветвленные или разветвленные алкильные группы с числом атомов углерода от 1 до 2, 4 или 6 (как приведено выше), причем в этих группах частично или полностью атомы водорода могут быть заменены атомами галогена, как приведено выше, в частности С 1-галогеналкил,такой как хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил,хлорфторметил, дихлорфторметил, хлордифторметил; алкинил означает неразветвленные или разветвленные алкильные группы с числом атомов углерода от 2 до 4, 6, 8 или 10 и одной или двумя двойными связями в любом положении, например С 2-С 6-алкинил,такой как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил,3-метил-1-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4 гексинил, 5-гексинил, 1-метил-2-пентинил, 1-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-3-пентинил,2-метил-4-пентинил, 3-метил-1-пентинил, 3-метил-4-пентинил, 4-метил-1-пентинил, 4-метил-2-пентинил,1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 3,3-диметил-1-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2-пропинил. Если R2 имеет центр хиральности, то (R)- и (S)-изомеры и рацематы соединений формулы I включены в объем настоящего изобретения. Особенно предпочтительные формы выполнения промежуточных продуктов в отношении заместителей соответствуют промежуточным продуктам остатков Lm, R1, R2 и X формулы I. С учетом соответствующего назначению применения триазолопиримидинов формулы I предпочтительны следующие значения заместителей, а именно как для отдельных соединений, так и в комбинации. Особенно предпочтительным объектом являются соединения I, в которых R2 означает водород. Предпочтительны соединения формулы I, в которых R1 означает метил или этил. Соединения формулы I, в которой группа R2 в -положении имеет разветвление (формула I.1), являются предпочтительными объектами изобретения: При этом R21 означает метил или галогенметил, R22 - водород, метил или галогенметил и R23 - С 2-С 8 алкинил, который может быть незамещенным или частично или полностью галогенированным и/или может иметь от одной до трех групп Ra. Остальные заместители соответствуют заместителям в формуле I. Особенно предпочтительны соединения I.1, при которых R23 означает неразветвленный или разветвленный С 2-С 8-алкинил, который может быть незамещенным или частично или полностью галогенированным и/или может иметь от одной до трех групп C1-С 3-алкокси. Особенно предпочтительный объект представляют собой соединения I, при которых R23 означает разветвленный или неразветвленный С 2-С 8 алкинил, который является неразветвленным или частично или полностью галогенированным. Другим предпочтительным объектом изобретения являются соединения формулы I, в которой R2 означает следующие группы: СН 2 ССН, СН 2 СССН 3, СН 2CССН 2 Сl, СН 2 СССН 2 СН 3, СН 2 СН 2 ССН,СН 2 СН 2 СССН 3, СН 2 СН 2 СССН 2 СН 3, СН 2 СН 2 СН 2 ССН, СН 2 СН 2 СН 2 СССН 3, СН 2 СН 2 СН 2 СССН 2 СН 3,СН(СН 3)ССН, СН(СН 3)СССН 3, СН(СН 3)СССН 2 Сl, СН(СН 3)СССН 2 СН 3, СН(СН 3)СН 2 ССН, СН(СН 3)СН 2 СССН 3,СН(СН 3)СН 2 СССН 2 Сl, СН(СН 3)СН 2CССН 2 СН 3, С(СН 3)2 ССН, С(СН 3)2 СССН 3, С(СН 3)2 СССН 2 СН 3,CH(CF3)CСН, CH(CF3)CCCH3, CH(CF3)CССН 2 Сl, CH(CF3)CССН 2 СН 3, CH(CF3)CH2CСН, CH(CF3)CH2CCCH3,CH(CF3)CH2CССН 2 Сl, СН(СF3)СН 2 СССН 2 СН 3, причем группы могут быть незамещенными или замещенными одной или тремя группами Ra. Соединения формулы I, в которой X означает галоген, в частности хлор (формула I.A), являются другими предпочтительными объектами настоящего изобретения. Предпочтительны также соединения I, при которых индекс m имеет значение 1, 2 или 3. Предпочтительны соединения I, при которых Lm означает фтор, хлор, метил, С 1-галогеналкил, метокси, амино, NHR или NR2, где R означает метил или ацетил. Кроме того, особенно предпочтительны соединения I, при которых замещенная Lm фенильная группа означает группу А-4 008920 гдепредставляет собой место связи с триазолопиримидиновым скелетом иL2, L4 - независимо друг от друга водород или фтор;L5 - водород, хлор, фтор или СН 3. Особенно предпочтительны соединения I, в котоорых Lm означает следующие комбинации заместителей: 2-фтор-6-хлор, 2,6-дифтор, 2,6-дихлор, 2-фтор-6-метил, 2,4,6-трифтор, 2,6-дифтор-4-метокси, пентафтор, 2-метил-4-фтор, 2-трифторметил, 2-метокси-6-фтор, 2-хлор, 2-фтор, 2,4-дифтор, 2-фтор-4-хлор,2-хлор-4-фтор, 2,3-дифтор, 2,5-дифтор, 2,3,4-трифтор, 2-метил, 2,4-диметил, 2-метил-4-хлор, 2-фтор-4 метил, 2,6-диметил, 2,4,6-триметил, 2,6-дифтор-4-метил, 2-тифторметил-4-фтор, 2-трифторметил-5-фтор или 2-трифторметил-5-хлор. Особенно предпочтительны соединения I, при которых X означает галоген или С 1-С 4-алкил, такой как хлор или метил, в частности хлор. В частности, предпочтительны сведенные в нижеследующие таблицы соединения формулы I. Приведенные в таблицах для одного заместителя группы представляют, кроме того, независимо от комбинации, особенно предпочтительные выполнения соответствующих заместителей. Таблица 1. Соединения формулы I, в которых X означает хлор, Lm означает 2-фтор-6-хлор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 2. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дифтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 3. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дихлор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 4. Соединения формулы I, в которых X означает хлор, Lm означает 2-фтор-6-метил и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 5. Соединения формулы I, в которых X означает хлор, Lm означеат 2,4,6-трифтор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 6. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дифтор-4-метокси и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 7. Соединения формулы I, в которых X означает хлор, Lm означает пентафтор и комбинация R1 и R2 соответствует соединению одной строки таблицы А. Таблица 8. Соединения формулы I, в которых X означает хлор, Lm означает 2-метил-4-фтор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 9. Соединения формулы I, в которых X означает хлор, Lm означает 2-трифторметил и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 10. Соединения формулы I, в которых X означает хлор, Lm означает 2-метокси-6-фтор и комбинация R1 2 и R соответствует соединению одной строки табл. А. Таблица 11. Соединения формулы I, в которых X означает хлор, Lm означает 2-хлор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 12. Соединения формулы I, в которых X означает хлор, Lm означает 2-фтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 13. Соединения формулы I, в которых X означает хлор, Lm означает 2,4-дифтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 14. Соединения формулы I, в которых X означает хлор, Lm означает 2-фтор-4-хлор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 15. Соединения формулы I, в которых X означает хлор, Lm означает 2-хлор-4-фтор и комбинация R1 и 2R соответствует соединению одной строки табл. А.-5 008920 Таблица 16. Соединения формулы I, в которых X означает хлор, Lm означает 2,3-дифтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 17. Соединения формулы I, в которых X означает хлор, Lm означает 2,5-дифтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 18. Соединения формулы I, в которых X означает хлор, Lm означает 2,3,4-трифтор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 19. Соединения формулы I, в которых X означает хлор, Lm означает 2-метил и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 20. Соединения формулы I, в которых X означает хлор, Lm означает 2,4-диметил и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 21. Соединения формулы I, в которых X означает хлор, Lm означает 2-метил-4-хлор и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 22. Соединения формулы I, в которых X означает хлор, Lm означеат 2-фтор-4-метил и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 23. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-диметил и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 24. Соединения формулы I, в которых X означает хлор, Lm означает 2,4,6-триметил и комбинация R1 и 2R соответствует соединению одной строки табл. А. Таблица 25. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дифтор-4-метил и комбинацияR1 и R2 соответствует соединению одной строки табл. А. Таблица 26. Соединения формулы I, в которых X означает хлор, Lm означает 2-трифторметил-4-фтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 27. Соединения формулы I, в которых X означает хлор, Lm означает 2-трифторметил-5-фтор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 28. Соединения формулы I, в которых X означает хлор, Lm означает 2-трифторметил-5-хлор и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица 29. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дифтор-5-циано и комбинацияR1 и R2 соответствует соединению одной строки табл. А. Таблица 30. Соединения формулы I, в которых X означает хлор, Lm означает 2,6-дифтор-4-метоксикарбонил и комбинация R1 и R2 соответствует соединению одной строки табл. А. Таблица А-7 008920 Соединения I пригодны в качестве фунгицидов. Они отличаются прекрасным действием против широкого спектра фитопатогенных грибов, в частности из класса Ascomyceten, Deuteromyceten, Oomyceten и Basidiomyceten. Они эффективны частично системически и могут применяться при защите растений в качестве лиственных и почвенных фунгицидов. Особое значение они имеют при борьбе с множеством грибов на различных культурных растениях,таких как пшеница, рожь, ячмень, овес, рис, кукуруза, злаки, бананы, хлопчатник, соя, кофе, сахарный тростник, виноград, плодовые и декоративные растения и овощные, такие как огурцы, бобовые, томаты,картофель и тыквенные, а также на семенах этих растений. Особенно они пригодны для борьбы со следующими болезнями растений: виды Alternaria на овощных и плодовых,виды Bipolaris- и Drechslera на зерновых, рисе и дернине,Blumeria graminis (настоящая мучнистая роса) на зерновых,Botrytis cinerea (плесневидная серая гниль) на клубнике, овощных, декоративных растениях и виноградных лозах,Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных,виды Fusarium- и Verticillium на различных растениях,виды Mycosphaerella на зерновых, бананах и земляном орехе,Phytophthora infestans на картофеле и томатах,Plasmopara viticola на виноградных лозах,Podosphaera leucotricha на яблоневых,Pseudocercosporella herpotrichoides на пшенице и ячмене,виды Pseudoperonospora на хмеле и огурцовых,виды Puccinia на зерновых,Pyricularia oryzae на рисе,виды Rhizoctonia на хлопчатнике, рисе и дернине,Septoria tritici и Stagonospora nodorum на пшенице,Uncinula necator на виноградных лозах,виды Ustilago на зерновых и сахарном тростнике, а также виды Venturia (парша) на яблоневых и грушевых. Соединения I пригодны, кроме того, для борьбы с патогенными грибами, такими как Paecilomycesvariotii, при защите материалов (например, древесины, бумаги, дисперсий для покрытий, волокон, соответственно тканей) и при защите запасов. Соединения I применяются таким образом, что грибы или подлежащие защите от них растения, посевной материал, материалы или почву обрабатывают фунгицидно эффективным (активным) количеством действующего вещества. Применение может осуществляться как перед, так и после инфекции грибами материалов, растений или семян. Фунгицидные средства содержат, в общем, между 0,1 и 95 мас.%, предпочтительно между 0,5 и 90 мас.% действующего вещества. Нормы расхода при применении для защиты растений в зависимости от желаемого эффекта составляют между 0,01 и 2,0 кг действующего вещества на гектар. При обработке посевного материала, в общем, необходимое количество действующего вещества составляет от 0,001 до 0,1 г, предпочтительно от 0,01 до 0,05 г на кг посевного материала. При применении для защиты материалов, соответственно, запасов нормы расхода зависят от области применения и желаемого эффекта. Обычные нормы расхода для защиты материалов составляют, например, от 0,001 г до 2 кг, предпочтительно от 0,005 г до 1 кг действующего вещества на кубометр обрабатываемого материала. Соединения I могут быть переведены в обычные препаративные формы, например растворы,эмульсии, суспензии, тонкие порошки, порошки, пасты и грануляты. Форма применения зависит от цели применения, она должна в любом случае обеспечивать тонкое и равномерное распределение соединения согласно изобретению. Препаративные формы получают известным образом, например разбавлением действующего вещества растворителями и/или наполнителями, возможно при применении эмульгаторов и диспергаторов,причем в случае воды в качестве разбавителя могут применяться другие органические растворители в качестве вспомогательных агентов. В качестве вспомогательных агентов пригодны, в основном, следующие: такие растворители, как ароматы (например, ксилол), хлорированные ароматы (например,хлорбензол), парафины (например, фракции нефти), спирты (например, метанол, бутанол), кетоны (например, циклогексанон), амины (например, этаноламин, диметилформамид) и вода; такие носители, как мука из натуральных горных пород (например, каолин, глина, тальк, мел) и мука из синтетических пород(например, высокодисперсные кремниевые кислоты, силикаты); такие эмульгаторы, как неионогенные и анионные эмульгаторы (например, простой полиоксиэтиленовый эфир спиртов жирного ряда, алкилсульфонаты и арилсульфонаты) и такие диспергаторы, как отработанные лигнинсульфитные щелочи и метилцеллюлоза.-8 008920 В качестве поверхностно-активных веществ пригодны щелочные, щелочно-земельные, аммониевые соли ароматических сульфокислот, например лингнинсульфокислоты, фенолсульфокислоты, нафталинсульфокислоты, дибутилнафталинсульфокислоты, а также кислот жирного ряда, алкилсульфонатов и алкиларилсульфонатов, алкилсульфатов, лаурилэфирсульфатов и сульфатов спиртов жирного ряда, а также соли сульфатированных гекса-, гепта- и октадеканолей или гликольэфиров спирта жирного ряда,продукты конденсации сульфонированного нафталина или его производных с формальдегидом, продукты конденсации нафталина, соответственно, нафталинсульфокислот с фенолом или формальдегидом,полиоксиэтиленоктилфенольный эфир, этоксилированный изооктил-, октил- или нонилфенол, алкилфенол- или трибутилфенилполигликолевый эфир, алкиларилполиэфирные спирты, изотридециловый спирт,конденсаты окиси этилена спирта жирного ряда, этоксилированное касторовое масло, полиоксиэтиленалкиловый эфир или полиоксипропилен, полигликольэфирный ацетат лауриловых спиртов, сложный эфир сорбита, лигнинсульфитные отработанные щелочи или метилцеллюлоза. Для получения предназначенных для непосредственного распрыскивания растворов, эмульсий, паст или маслянных дисперсий пригодны фракции минеральных масел от средней до высокой точек кипения,такие как керосин или дизельное масло, далее каменноугольные масла, а также масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например толуол, ксилол, парафин, тетрагидронафталин, алкилированные нафталины или их производные, метанол,этанол, пропанол, бутанол, циклогексанол, циклогексанон, изофорон, сильно полярные растворители,например диметилформамид, диметилсульфоксид, N-метилпирролидон, вода. Порошок, препарат для распыления и опудривания можно получить посредством смешения или совместного размола дествующих веществ с твердым наполнителем. Грануляты, например покрытые, пропитанные или гомогенные, получают обычно посредством соединения действующих веществ с твердым наполнителем. В качестве наполнителей, соответственно,твердых носителей служат, например, минеральные земли, такие как силикагель, кремниевые кислоты,силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция, сульфат магния, оксид магния, размолотые пластмассы, а также такие удобрения, как сульфаты аммония, фосфаты аммония, нитраты аммония, мочевины и растительные продукты, такие как,например, мука зерновых культур, мука древесной коры, древесная мука и мука ореховой скорлупы, целлюлозный порошок или другие твердые наполнители. Готовые препаративные формы содержат, в общем, от 0,1 до 95 мас.%, предпочтительно от 0,1 до 90 мас.% действующего вещества. Действующие вещества применяются при этом с чистотой от 90 до 100%, предпочтительно от 95 до 100% (по спектру ЯМР). Примерами препаративных форм являются следующие.I. 5 вес.ч. соединения согласно изобретению тщательно перемешивают с 95 вес.ч. с тонкодисперсным каолином. Таким образом получают средство для опыления, которое содержит 5 вес.% действующего вещества.II. 30 вес.ч. соединения согласно изобретению тщательно перемешивают со смесью из 92 вес.ч. порошкообразного силикагеля и 8 вес.ч. парафинового масла, который набрызган на поверхность этого силикагеля. Таким образом получают композицию действующего вещества с хорошей адгезионной способностью (содержание действующего вещества 23 вес.%).III. 10 вес.ч. соединения согласно изобретению растворяют в смеси, состоящей из 90 вес.ч. кислоты,6 вес.ч. продукта присоединения 8 до 10 молей этиленоксида к 1 молю N-моноэтаноламида масляной кислоты, 2 вес.ч. кальциевой соли додецилбензолсульфокислоты и 2 вес.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 9 вес.%).IV. 20 вес.ч. соединения согласно изобретению растворяют в смеси, состоящей из 60 вес.ч. циклогексанона, 30 вес.ч. изобутанола, 5 вес.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 5 вес.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 16 вес.%).V. 80 вес.ч. соединения согласно изобретению хорошо перемешивают с 3 вес.ч. натриевой соли диизобутилнафталинсульфокислоты, 10 вес.ч. натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 7 вес.ч. порошкообразного силикагеля и измельчают в молотковой мельницеVI. Смешивают 90 вес.ч. соединения согласно изобретению с 10 вес.ч. N-метилпирролидона и получают раствор, пригодный для применения в форме мельчайших капель (содержание действующего вещества 90 вес.%).VII. 20 вес.ч. соединения согласно изобретению растворяют в смеси, состоящей из 40 вес.ч. циклогексанона, 30 вес.ч. изобутанола, 20 вес.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 вес.ч. продукта присединения 40 молей этиленоксида к 1 молю касторового масла. Выливанием и тонким распределнием раствора в 100000 вес.ч. воды получают водную дисперсию, содержащую 0,02 вес.% действующего вещества.VIII. 20 вес.ч. соединения согласно изобретению хорошо перемешивают с 3 вес.ч. натриевой соли диизобутилнафталинсульфокислоты, 17 вес.ч. натриевой соли лигнинсульфокислоты из сульфитного отработанного щелока и 60 вес.ч. порошкообразного силикагеля и измельчают в молотковой мельнице. Тонким распределением смеси в 20000 вес.ч. воды получают раствор для опрыскивания, который содержит 0,1 вес.% дейстующего вещества. Действующие вещества могут применяться как таковые в форме своих композиций или же в приготовленной из них форме применения, например в форме подлежащих непосредственному распылению растворов, порошков, суспензий или дисперсий, эмульсий, масляных дисперсий, паст, распыляемых продуктов, препаратов для разбрызгивания или гранул, путем опрыскивания, мелкокапельного опрыскивания, опыливания, опудривания или полива. Используемые формы всецело зависят от цели применения,но во всех случаях должно быть обеспечено максимально тонкое распределение действущих веществ согласно изобретению. Используемые водные формы могут быть приготовлены из концентратов эмульсий, паст или смачиваемых порошков (порошки для разбрызгивания, масляные дисперсии) путем добавления воды. Для изготовления эмульсий, паст или масляных дисперсий вещества как таковые, или же растворенные в масле или растворителе, могут быть гомогенизированы в воде с помощью смачивающих агентов, активаторов адгезии, диспергаторов или эмульгаторов. Альтернативно возможно приготовление концентратов,состоящих из действующего вещества, смачивающего агента, активатора адгезии, диспергатора или эмульгатора и, при необходимости, растворителя или масла, которые пригодны для разбавления водой. Концентрация действующего вещества в готовых к применению препаратах может варьироваться в значительных пределах. В общем, она составляет от 0,0001 до 10%, предпочтительно от 0,01 до 1%. Действующие вещества могут также с хорошим успехом применяться при особенно низких нормах расхода (ULV), причем имеется возможность использовать составы с более чем 95 мас.% активного ингредиента или даже применять действующее вещество без добавок. К действующим веществам могут добавляться масла различного типа, гербициды, фунгициды, другие пестициды, бактерициды, в случае необходимости, также и непосредственно перед применением(смеси в баке). Эти средства могут смешиваться со средствами по изобретению в весовом соотношении от 1:10 до 10:1. При использовании в форме фунгицидов соединения согласно изобретению могут содержаться вместе с другими действующими веществами, например гербицидами, инсектицидами, регуляторами роста, фунгицидами или же удобрениями. При смешивании соединений формулы I или композиций, содержащих их в форме фунгицидных средств, с другими фунгицидами во многих случаях достигается расширение спектра фунгицидного действия. Нижеприведенный перечень фунгицидов, которые можно применять вместе с соединениями по изобретению, предназначен для иллюстрации возможности их комбинирования, однако, не налагает никаких ограничений: ацилаланины, такие как беналаксил, металаксил, офурац, оксадиксил,производные амина, такие как алдиморф, додин, додеморф, фенпропиморф, фенпропидин, квазатин, иминоктадин, спироксамин, тридеморф,анилинопиримидины, такие как пириметанил, мепанипирим или циродинил,антибиотики, такие как циклогексимид, гризеофульвин, касугамицин, натамицин, полиоксин или стрептомицин,азолы, такие как битертанол, бромоконазол, ципроконазол, дифеноконазол, динитроконазол, эпоксиконазол, фенбуконазол, флухиконазол, флузилазол, флутриафол, гексаконазол, имазалил, метконазол,миклобутанил, пенконазол, пропиконазол, прохлораз, протиоконазол, тебуконазол, триадимефон, триадименол, трифлумизол, тритиконазол,дикарбоксимиды, такие как ипродион, миклозолин, процимидон, винклозолин,дитиокарбаматы, такие как фербам, набам, манеб, манкозеб, метам, метирам, пропинеб, поликарбамат, тирам, зирам, зинеб,гетероциклические соединения, такие как анилазин, беномил, боскалид, карбендазим, карбоксин,оксикарбоксин, цианофамид, дазомет, дитианон, фамоксадон, фенамидон, фенаримол, фуберидазол, флутоланил, фураметпир, изопротиолан, мепронил, нуаримол, пробеназол, прохиназид, пирифенокс, пирохилон, хиноксифен, силтиофам, тиабендазол, тифлузамид, тиофанатметил, тиадинил, трициклазол, трифорин,медьсодержащие фунгициды, такие как Бордосская смесь, ацетат меди, оксихлорид меди, основный сульфат меди,нитрофенильные производные, такие как бинапакрил, динокап, динобутон, нитрофтализопропил,фенилпирролы, такие как фенпиклонил или флудиоксонил,сера,другие фунгициды, такие как ацибензолар-S-метил, бентиаваликарб, карпропамид, хлоротгалонил,цифлуфенамид, цимоксанил, дазомет, дикломезин, диклоцимет, диэтофенкарб, эдифенфос, этабоксам,фенгексамид, фентинацетат, феноксанил, феримзон, флуазинам, фозетил, фозетилалюминий, ипровали- 10008920 карб, гексахлорбензол, метрафенон, пенцикурон, пропамокарб, фталид, толоклофосметил, хинтозен, зоксамид,стробилурины, такие как азоксистробин, димоксистробин, флуоксастробин, крезоксимметил, метоминостробин, оризастробин, пикоксистробин, пираклостробин или трифлоксистробин,производные сульфеновой кислоты, такие как каптафол, каптан, дихлофлуанид, фолпет, толилфлуанид,амиды коричной кислоты и аналоги, такие как диметоморф, флуметовер или флуморф. Примеры синтеза С учетом модификации исходных соединений приемы, приведенные в примерах синтеза ниже, использовались для получения других соединений формулы I. Полученные соединения I вместе с их физическими данными приведены в таблице, которая следует далее. Пример 1. Получение 5-хлор-6-(2,4,6-трифторфенил)-7-пропаргиламино[1,2,4]триазоло[1,5-]пиримидина [I-1]. Раствор из 1,5 ммоля 5,7-дихлор-6-(2,4,6-трифторфенил)-[1,2,4]триазоло[1,5-]пиримидина [ср. WO 98/46607] в 20 мл дихлорметана при перемешивании смешивают с раствором из 1,5 ммоля пропаргиламина и 1,5 ммолей триэтиламина в 10 мл дихлорметана. Реакционную смесь перемешивают в течение 6 ч при 20-25 С, потом промывают раствором разбавленной НСl. После разделения фаз органическую фазу сушат и освобождают от растворителя. Из остатка после хроматографии на силикагеле получают 0,42 г указанного в заголовке соединения с т.пл. 141 С. Пример 2. Получение 5-циано-6-(2,4,6-трифторфенил)-7-N-метил-N-пропаргиламино[1,2,4]триазоло[1,5-]пиримидина. Смесь из 0,1 моля соединения I-2 и 0,25 моляцианида тетраэтиламмония в 750 мл диметилформамида перемешивают в течение приблизительно 16 ч при 20-25 С. После добавки воды и метил-третбутилового эфира и разделения фаз органическую фазу промывают водой. Затем сушат и освобождают от растворителя. Из остатка после хроматографии на силикагеле получают 4,72 г указанного в заголовке соединения с т.пл. 147 С. Пример 3. Получение 5-метокси-6-(2,4,6-трифторфенил)-7-N-метил-N-пропаргиламино[1,2,4]триазоло[1,5-]пиримидина. Раствор из 65 ммолей соединения I-2 в 400 мл безводного метанола смешивают с 71,5 ммолей раствора метанолята натрия (30%-го) при 20-25 С. Приблизительно через 16 ч перемешивания при этой температуре отгоняют растворитель, остаток загоружают в дихлорметан. Органическую фазу промывают водой и сушат, потом освобождают от растворителя. Из остатка после хроматографии на силикагеле получают 3,94 г указанного в заголовке соединения с т.пл. 119 С. Пример 4. Получение 5-метил-6-(2,4,6-трифторфенил)-7-N-метил-N-пропаргиламино[1,2,4]триазоло[1,5-]пиримидина. Смесь из 20 мл диэтилманолата и 0,27 г (5,65 ммоль) гидрида натрия (50% дисперсия в минеральном масле) в 50 мл ацетонитрила перемешивают при 20-25 С приблизительно 2 ч. Добавляют 4,7 ммоль соединения I-2, потом реакционную смесь перемешивают при 60 С приблизительно 20 ч. После добавки 50 мл водного раствора хлорида аммония реакционную смесь подкисляют разбавленным раствором НСl,потом смесь экстрагируют метил-трет-бутиловым эфиром. Собранные органические фазы после сушки освобождают от растворителя. Очищенный хроматографией на силикагеле сырой продукт загружают в конц. НСl, потом смесь перемешивают прибл. 24 ч при 80 С. После охлаждения реационную смесь настраивают водным раствором NaOH на значение рН 5 и экстрагируют метил-трет-бутиловым эфиром. Собранные органические фазы после сушки освобождают от растворителя. Из остатка после хроматографии на силикагеле получают 0,62 г указанного в заголовке соединения. 1 Вследствие затрудненного вращения фенильной группы могут существовать два диастереомера, которые могут различаться по их физическим свойствам. Примеры действия против патогенных грибов Фунгицидное действие соединений формулы I было продемонстрировано в следующих экспериментах. Действующие вещества, отдельно или совместно, использовались для получения исходного раствора, содержащего 0,25 вес.% действующего вещества в ацетоне или ДМСО. К этому раствору прибавляли 1 вес.% эмульгатора Uniperol EL (эмульгирующий и диспергирующий смачиватель на основе этоксилированных алкилфенолов) и смесь разбавляли водой до получения требуемой концентрации. Пример применения 1. Эффективность против ранней тли на томатах (Alternaria solani). Листья рассады томатов в горшках сорта "Grое Fleischtomate St. Pierre" опрыскивали водной суспензией, содержащей действующее вещество в концентрации, упомянутой ниже, до образования капель. На следующий день листья инфицировали водной суспензией зооспор Alternaria solani (0,17x106 спор на мл 2% биосолодового раствора). Растения затем помещали в насыщенную водяным паром камеру при температуре от 20 до 22 С. Через 5 дней заболевание распространилось до такой высокой степени на необработанных, однако, инфицированных растениях, что поражение можно было определить визуально в %. В этом испытании обработанные 250 млн.ч. действующего веществаI-3 иI-4 растения имели поражения до 3%, в то время как необработанные растения имели 80%-ное поражение. Пример применения 2. Защитная эффективность против бурой листовой ржавчины пшеницы, вызванной Puccinia recondita. Листья выращенной в горшках рассады пшеницы сорта "Kanzler" опыляли спорами бурой ржавчины (Puccinia recondita). Потом горшки помещали на 24 ч в камеру с высокой влажностью воздуха (от 90 до 95%) и от 20 до 22 С. В течение этого времени споры проросли и ростковые трубочки внедрились в ткань листьев. На следующий день инфицированные растения опрыскивали водной суспензией действующего вещества в указанной ниже концентрации до образования капель. Суспензия или эмульсия была приготовлена из основного раствора с 10% действующего вещества в смеси, состоящей из 89% ацетона и 1% эмульгатора. После подсушки напрысканного слоя опытные растения культивировали в теплице при температуре между 20 и 22 С и относительной влажности от 65 до 70% в течение 7 дней. Потом визуально определяли степень развития бурой ржавчины на листьях. В этом испытании обработанные 250 млн.ч. действующего веществаI-3 иI-4 растения имели поражения менее 3%, в то время как необработанные растения имели 80%-ное поражение. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 7-Алкиниламинотриазолопиримидины формулы I в которой заместители имеют следующие значения:L означает независимо друг от друга галоген, С 1-С 6-алкил, С 1-С 6-галогеналкил, S(O)nA1,А 1 означает C1-C8-алкил,n равно 0,m равно 1, 2, 3, 4 или 5, причем по меньшей мере одна группа L находится в орто-положении к связи с триазолопиримидиновым скелетом;R2 С 3-С 10-алкинил, который может быть незамещенным или частично или полностью галогенированным. 2. Соединения формулы I.1R21 означает метил или галогенметил;R23 означает С 2-С 8-алкинил, который может быть незамещенным или частично или полностью галогенированным и/или может иметь от одной до трех групп Ra; а другие заместители определены согласно п.1. 3. Соединения формулы I или I.1 согласно п.1 или 2, в которых X означает хлор или метил, в частности хлор. 4. Соединения формулы I или I.1 по одному из пп.1-3, в которых замещенная Lm фенильная группа означает группу А гдеозначает место связи с триазолопиримидиновым скелетом иL2, L4 означают независимо друг от друга водород или фтор;L5 означает водород, фтор или СН 3. 5. Соединения формулы I по одному из пп.1-3, в которых замещенная Lm фенильная группа означает одну из следующих комбинаций заместителей: 2-фтор-6-хлор, 2,6-дифтор, 2,6-дихлор, 2-фтор-6-метил,2,4,6-трифтор, 2,6-дифтор-4-метокси, пентафтор, 2-метил-4-фтор, 2-трифторметил, 2-метокси-6-фтор, 2 хлор, 2-фтор, 2,4-дифтор, 2-фтор-4-хлор, 2-хлор-4-фтор, 2,3-дифтор, 2,5-дифтор, 2,3,4-трифтор, 2-метил,2,4-диметил, 2-метил-4-хлор, 2-фтор-4-метил, 2,6-диметил, 2,4,6-триметил, 2,6-дифтор-4-метил, 2 трифторметил-4-фтор, 2-трифторметил-5-фтор или 2-трифторметил-5-хлор. 6. Способ получения соединений формулы I по пп.1-5, включающий взаимодействие дигалогентриазолопиримидинов формулы II в которой заместители имеют указанные для формулы I значения и Hal означает атом галогена, в частности хлор, с аминами формулы III 7. Средство для борьбы с патогенными грибами, содержащее твердый или жидкий наполнитель и соединение формулы I по п.1. 8. Способ борьбы с фитопатогенными грибами, отличающийся тем, что грибы или подлежащие за- 13008920 щите от поражения грибами материалы, растения, почву или посевной материал обрабатывают эффективным количеством соединения формулы I по п.1.
МПК / Метки
МПК: C07D 487/04, A01N 43/90
Метки: алкиниламино, получения, содержащие, грибами, триазолопиримидины, способ, также, средства, применение, борьбы, патогенными
Код ссылки
<a href="https://eas.patents.su/15-8920-7-alkinilamino-triazolopirimidiny-sposob-ih-polucheniya-i-ih-primenenie-dlya-borby-s-patogennymi-gribami-a-takzhe-soderzhashhie-ih-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">7 – алкиниламино – триазолопиримидины, способ их получения и их применение для борьбы с патогенными грибами, а также содержащие их средства</a>
Предыдущий патент: Модульные строительные элементы для возведения подпорной стенки и способ ее возведения
Следующий патент: Производные бензолсульфонамидов, способ их получения и их применение для лечения боли
Случайный патент: Способ и устройство для изготовления экструдированного изделия из пластмассы и изделие из пластмассы












