Производные пиридазин-3-она, их использование в качестве гербицидов и промежуточные соединения для их получения.
Номер патента: 868
Опубликовано: 26.06.2000
Авторы: Санемицу Юзуру, Катаяма Тадаси, Кавамура Синити, Мине Йоко
Формула / Реферат
1. Соединение формулы
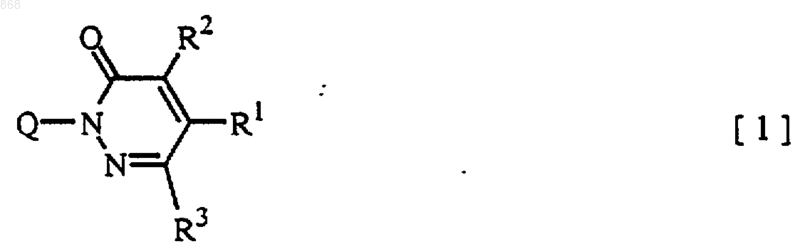
в которой R1 представляет C1-С3 галогеналкил;
R2 и R3 являются одинаковыми или различными и представляют водород, C1-С3алкил, C1-С3галогеналкил или C1-С3алкокси C1-С3алкил; и Q представляет [Q-1], [Q-2], [Q-3], [Q-4] формулы
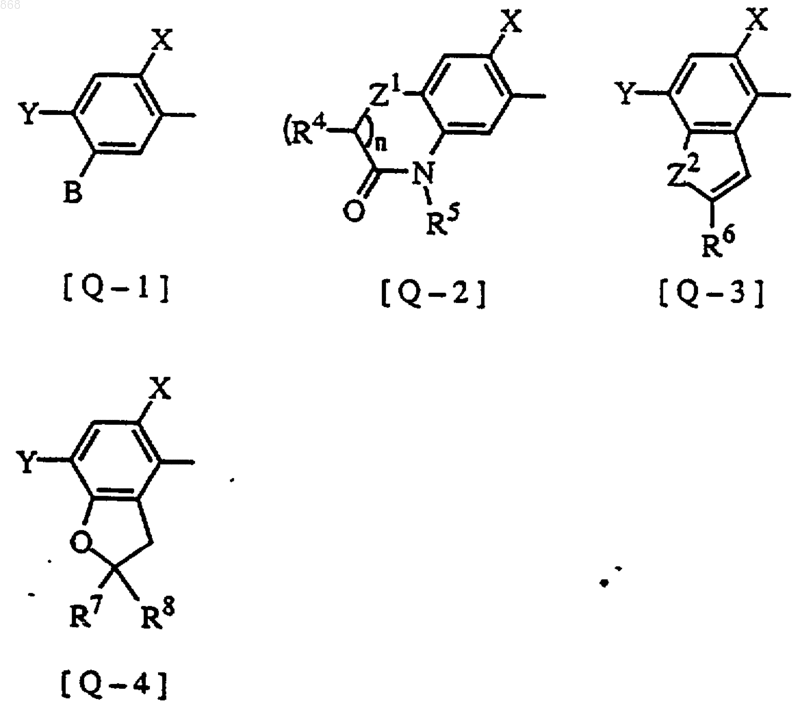
где в формуле Q-1
Х представляет Н, F или Сl,
Y представляет Сl, F или Вr,
R1 представляет СF3,
R2 представляет Н или СН3,
R3 представляет Н или СН3,
В представляет водород, нитро, OR10, SR10, SO2OR10, N(R11)R12, SO2(R11)R12, NR11(COR13), NR11(SO2R14), N(SO2R14)(SO2R15), N(SO2R14)(COR13), NHCOOR13, COOR10, CSN(R11)R12, COR16, CR17=CR18COR16, CR17=CR18COOR13, CR17=CR18CON(R11)R12, CR17=NOR33, CR17(Z2R34)2, OCO2R19 или OCOR19;
где R10 представляет водород, C1-C6алкил, C1-C6галогеналкил, С3-С8циклоалкил, бензил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С6галогеналкинил, циано C1-С6 алкил, С2-С8алкоксиалкил, C2-C8алкилтиоалкил, карбокси C1-С6 алкил, (C1-C8алкокси)карбонил C1-C6алкил, (C1-C6галогеналкококси)карбонил C1-С6алкил, {(C1-C4алкокси) C1-C4 алкокси}карбонил C1-С6алкил, (С3-С8циклоалкокси)карбонилС1-С6 алкил, (C1-C6алкил)карбонил C1-C6алкил, (C1-С6галогеналкил)карбонил C1-C6алкил, {(C1-C4алкокси) C1-C4 алкил}карбонил C1-C6алкил, (С3-С8циклоалкил)карбонил C1-C6 алкил, CH2CON(R11)R12, CH2COON(R11)R12, CH(C1-C4алкил)CON(R11)R12, СН(C1-C4алкил)COON(R11)R12, {(C1-C6алкокси)карбонил C1-С6 алкил}оксикарбонил C1-C6алкил или гидрокси C1-C6алкил;
R11 и R12 представляют независимо водород, C1-C6алкил, C1-C6галогеналкил, С3-С6алкенил, С3-C6алкинил, циано C1-С6алкил, С2-С8алкоксиалкил, С2-С8алкилтиоалкил, карбокси C1-C6алкил, (C1-C6 алкокси)карбонил C1-C6алкил, (С3-С8циклоалкокси)карбонил C1-C6 алкил, {(C1-C4алкокси) C1-C4алкокси}карбонил C1-C6алкил, или R11 и R12 объединены вместе, образуя тетраметилен, пентаметилен или этиленоксиэтилен;
R13 представляет водород, C1-C6алкил, C1-С6галогеналкил, С3-С8циклоалкил или С3-С6алкенил;
R14 и R15 представляют независимо C1-С6алкил, C1-С6галогеналкил или фенил, необязательно замещенный метилом или нитро;
R16 представляет водород, C1-C6алкил, C1-C6галогеналкил, C2-C6алкенил, C2-C6галогеналкенил, C2-C6алкинил, С2-С6галогеналкинил, C2-C8алкоксиалкил или гидрокси C1-C6алкил;
R17 и R18 независимо представляют водород или C1-C6алкил;
R19 представляет C1-С6алкил;
R33 представляет водород, C1-C6алкил, C1-С6галогеналкил, С3-С8циклоалкил, С3-С6алкенил, С3-С6галогеналкенил, С3-С6алкинил, С3-С6галогеналкинил, циано C1-C6алкил или (C1-С6 алкокси)карбонил С1-С6алкил;
R34 представляет C1-C6алкил, или два R34, объединены вместе, образуя (СН2)2 или (СН2)3; и
в формуле Q-2
Х представляет Н или F,
Z1 предсиавляет 0 или S,
n представляет 0 или 1,
R1 представляет СF3,
R2 представляет Н или СН3,
R3 представляет Н или СН3,
R4 представляет Н,
R5 представляет пропаргил или бутил;
в формуле Q-3
Х представляет F,
Y представляет Сl,
Z2 представляет 0,
R1 представляет СF3,
R2 представляет СН3,
R3 представляет Н,
R6 представляет СН3;
в формуле Q-4
Х представляет F,
Y представляет Сl,
R1 представляет СF3,
R2 представляет СН3,
R3 представляет Н,
R7 представляет СН3,
R8 представляет СН3, СООСН3, СН2ОН или СН2ОСОСН3;
W представляет водород, хлор или бром.
2. Соединение по п.1, в котором R1 представляет трифторметил.
3. Соединение по п.1, в котором R2 представляет водород или C1-С3алкил и R3 представляет водород или С1-С3алкил.
4. Соединение по п.1, в котором R1 представляет трифторметил, R2 представляет водород или C1-С3алкил и R3 представляет водород или C1-С3алкил.
5. Соединение по пп.1, 2, 3 или 4, в котором Q представляет [Q-1].
6. Соединение по пп.1, 2, 3 или 4, в котором Q представляет [Q-2].
7. Соединение по пп.1, 2, 3 или 4, в котором Q представляет [Q-3].
8. Соединение по пп.1, 2, 3 или 4, в котором Q представляет [Q-4].
9. Соединение по п.5, в котором В представляет OR10.
10. Соединение по п.5, в котором В представляет SR10.
11. Соединение по п.5, в котором В представляет N(R11)R12.
12. Соединение по п.5, в котором В представляет NR11(SO2R14).
13. Соединение по п.5, в котором В представляет COOR10.
14. Соединение по п.5, в котором Х представляет фтор, Y представляет хлор.
15. Соединение по п. 5, в котором Х представляет фтор и Y представляет хлор и В представляет OR10.
16. Соединение яю п.6, в котором Z1 представляет водород и n представляет 1.
17. Соединение по п.1, которое представляет 7-фтор-6-(5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2Н-1,4-бензоксазин-3-он (соединение 2-631).
18. Соединение по п.1, которое представляет 7-фтор-6-(4-метил-5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2Н-1,4-бензоксазин-3-он (соединение 2-251).
19. Соединение по п.1, которое представляет 6-(5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2Н-1,4-бензоксазин-3-он (соединение 2-583).
20. Соединение по п.1, которое представляет 6-(4-метил-5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2Н-1,4-бензоксазин-3-он (соединение 2-203).
21. Соединение по п.1, которое представляет 2-(4-хлор-2-фтор-5-изопропоксифенил)-4-метил-5-трифторметилпиридазин-3-он (соединение 1-476).
22. Соединение по п.1, которое представляет 2-(4-хлор-2-фтор-5-метоксифенил)-4-метил-5-трифторметилпиридазин-3-он (соединение 1-474).
23. Соединение по п.1, которое представляет 2-(4-хлор-2-фтор-5-этоксифенил)-4-метил-5-трифторметилпиридазин-3-он (соединение 1-475).
24. Соединение по п.1, которое представляет 2-(4-хлор-2-фтор-5-пропаргилоксифенил)-4-метил-5-трифторметилпиридазин-3-он (соединение 1-486).
25. Соединение по п.1, которое представляет метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-495).
26. Соединение по п.1, которое представляет этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-496).
27. Соединение по п.1, которое представляет пропил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-497).
28. Соединение по п.1, которое представляет изопропил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-500).
29. Соединение по п.1, которое представляет бутил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-498).
30. Соединение по п.1, которое представляет пентил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-499).
31. Соединение по п.1, которое представляет циклопентил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат (соединение 1-501).
32. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон- 2 -ил)фенокси}пропионат (соединение 1-504).
33. Соединение по п.1, которое представляет метил 2-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенокси}пропионат (соединение 1-503).
34. Соединение по п.1, которое представляет этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтиоацетат (соединение 1-577).
35. Соединение по п.1, которое представляет метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтиоацетат (соединение 1-576).
36. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтио}пропионат (соединение 1-585).
37. Соединение по п.1, которое представляет метил 2-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтио}пропионат (соединение 1-584).
38. Соединение по п.1, которое представляет метил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенокси}пропионат (соединение 1-1140).
39. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенокси}пропионат (соединение 1-1141).
40. Соединение по п.1, которое представляет этил 2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенилтиоацетат (соединение 1-1214).
41. Соединение по п.1, которое представляет метил 2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенилтиоацетат (соединение 1-1213).
42. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенилтио}пропионат (соединение 1-1222).
43. Соединение по п.1, которое представляет метил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенилтио}пропионат (соединение 1-1221).
44. Соединение по п.1, которое представляет изопропил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фенилтио}пропионат (соединение 1-1226).
45. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фениламино}пропионат (соединение 1-420).
46. Соединение по п.1, которое представляет этил 2-{2-хлор-4-фтор-5-(5-трифторметил-3-пиридазинон-2-ил)фениламино}пропионат (соединение 1-1057).
47. Соединение по п.1, которое представляет N-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенил}метансульфонамид (соединение 1-367).
48. Соединение по п.1, которое представляет N-{2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенил}хлорметансульфонамид (соединение 1-369).
49. Соединение по п.1, которое представляет N-{2-xлор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенил}метансульфонамид (соединение 1-398).
50. Соединение по п.1, которое представляет метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат (соединение 1-641).
51. Соединение по п.1, которое представляет этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат (соединение 1-642).
52. Соединение по п.1, которое представляет этил 2-хлор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат (соединение 1-621).
53. Соединение по п.1, которое представляет изопропил 2-хлор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат(соединение 1-625).
54. Соединение по п.1, которое представляет 2-(4-хлор-2-фтор-5-пропаргилоксифенил)-6-метил-5-трифторметилпиридазин-3-он (соединение 1-1441).
55. Гербицидная композиция, включающая гербицидно-эффективное количество соединения по п.1 и инертный носитель или разбавитель.
56. Способ борьбы с вредными сорняками, который включает применение к площади, на которой произрастают или могут произрастать вредные или неблагоприятные сорняки, гербицидно-эффективного количества соединения по п.1.
57. Использование соединения по п.1 в качестве гербицида.
58. Соединение формулы
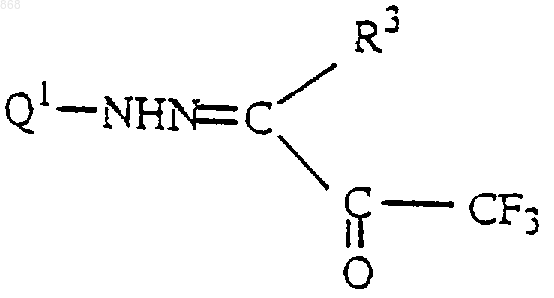
в которой R3 имеет значения, определенные в п.1, и Q1 представляет группу [Q1-1], [Q-2], [Q1-3], [Q-4] формулы
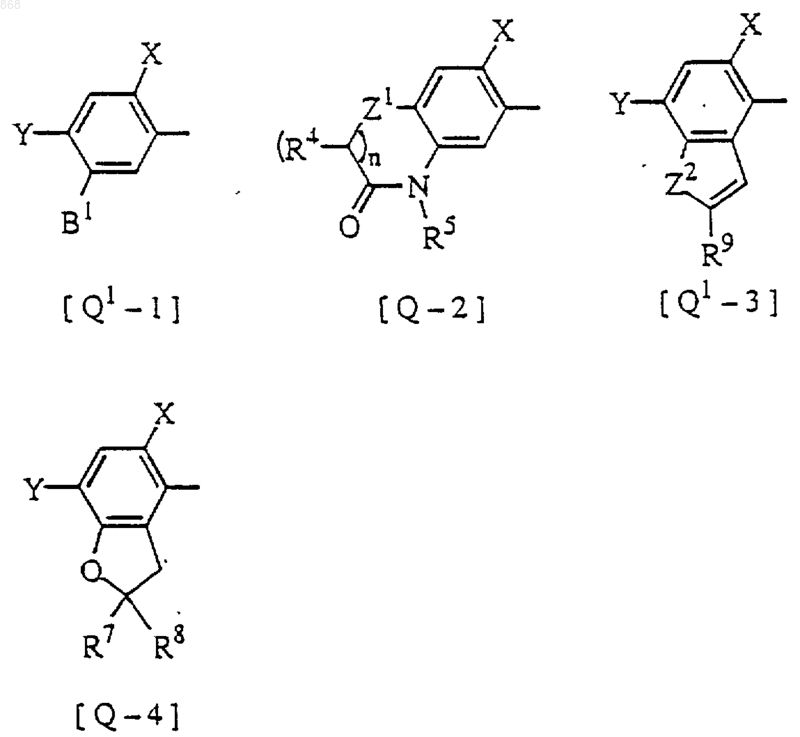
где X, Y, Z1, Z2, n, R4, R5, R7 и R8 имеют значения, определенные в п.1;
В1 представляет водород, нитро, OR27, SR27, SO2OR27, NR11(R12), SO2NR11(R12), NR11(COR13), NR11(SO2R14), N(SO2R14)(SO2R15), N(SO2R14)(COR13), NHCOOR13, COOR27, -CSNR11(R12), CR17=CR18COOR13, CR17=CR18CONR11(R12), CH2CHWCOOR13, CH2CHWCONR11(R12), CR17=NOR33, CR17(Z2R34)2, OCO2R19 или OCOR19; и
R9 представляет СН3;
R27 представляет водород, C1-C6алкил, C1-C6галогеналкил, С3-С8циклоалкил, бензил, С3-С6алкекил, С3-С6галогеналкенил, С3-С6 алкинил, С3-С6галогеналкинил, циано С1-С6алкил, C2-C8 алкоксиалкил, С2-С8алкилтиоалкил, карбокси C1-C6алкил, (С1-С8 алкокси)карбонил C1-C6алъшы, (C1-С6галогеналкокси)карбонил C1-C6 алкил, {(C1-C4алкокси)С1-С4алкокси}карбонил C1-C6алкил, (С3-С8 циклоалкокси)карбонил C1-C6алкил, CH2CON(R11)R12, CH2COON(R11)R12, CH(C1-C4алкил)CON(R11)R12, CH(C1-C4алкил)COON(R11)R12, {(C1-C6 алкокси)карбонил C1-С6алкил}оксикарбонил С1-С6алкил или гидрокси C1-C6алкил; и R11, R12, R13, R14, R15, R17, R18, R19, R33, R34 и Z2 имеют значения, определенные в п.1.
Текст
1 Область техники Настоящее изобретение относится к производным пиридазин-3-она, к их применению в качестве гербицидов и к промежуточным соединениям для их получения. Уровень техники Заявка ЕР-А-0029123 раскрывает процесс получения замещенных анилинов и новых замещенных анилинов. В частности, в ней говорится, что некоторые замещенные анилины,получаемые с помощью данного процесса, являются полезными в качестве важных исходных материалов для получения новых замещенных производных пиридазин-3-она, обладающих гербицидной активностью при послевсходовом применении. Данные производные пиридазин-3 она, однако, отличаются от соединений настоящего изобретения тем, что они имеют замещенную феноксифенильную группу в качестве существенного структурного элемента в положении 2 пиридазинонового кольца и, кроме того,они имеют совершенно отличные заместители в пиридазиноновом кольце. Раскрытие изобретения Авторы настоящего изобретения провели интенсивные исследования с целью нахождения соединений, имеющих превосходную гербицидную активность. В результате они обнаружили,что производные пиридазин-3-она, представленные формулой [I], изображенной ниже, обладают превосходной гербицидной активностью, и тем самым завершили настоящее изобретение. Таким образом, настоящее изобретение предоставляет соединения формулы где R1 представляет C1-С 3 галогеналкил; R2 и R3 являются одинаковыми или различными и представляют водород, C1-С 3 алкил C1-С 3 галогеналкил или C1-С 3 алкокси С 1-С 3 алкил; и Q представляет [Q-1], [Q-2], [Q-3], [Q-4] формулыR14 и R15 представляют независимо C1C6 алкил, C1-С 6 галогеналкил или фенил, необязательно замещенный метилом или нитро;R16 представляет водород, C1-С 6 алкил,C1-C6 галогеналкил, С 2-С 6 алкенил, C2-C6 галогеналкенил, C2-C6 алкинил, C2-C6 галогеналкинил,С 2-С 8 алкоксиалкил или гидрокси C1-C6 алкил;R17 и R18 независимо представляют водород или C1-С 6 алкил;R34 представляет C1-C6 алкил, или две группы R34, объединены вместе, образуя (СН 2)2 или (СН 2)3; в формуле Q-2 Х представляет Н или F, 3Z1 представляет 0 или S,n представляет 0 или 1,R1 представляет CF3,R2 представляет Н или СН 3,R3 представляет Н или СН 3,R4 представляет Н,R5 представляет пропаргил или бутил; в формуле Q-3 Х представляет F,Y представляет Сl,Z2 представляет 0,R1 представляет СF3,R2 представляет СН 3,R3 представляет Н,R6 представляет СН 3; в формуле Q-4 Х представляет F,Y представляет Сl,R1 представляет СF3,R2 представляет СН 3,R3 представляет Н,R7 представляет СН 3,R8 представляет СН 3, СООСН 3, СН 2 ОН или СН 2 ОСОСН 3;W представляет водород, хлор, или бром,(называемые здесь далее настоящие соединения(соединение; и гербицид, содержащий указанное соединение в качестве активного ингредиента. Настоящее изобретение предоставляет также соединение формулыCH(C1-C4 алкил) COON(R )R , (C1-C6 алкокси)карбонил C1-C6 алкилоксикарбонил C1-C6 алкил или гидрокси C1-C6 алкил; и R11, R12, R13,R14, R15, R17, R18, R19, R33, R34 и Z2 имеют значения, указанные выше. В указанном выше определении настоящих соединений примерами соответствующих заместителей являются следующие: Примеры C1-С 3 галогеналкила, представленного R1, включают трифторметил и хлордифторметил. Примеры C1-С 3 алкила, представленного R2 3 и R , включают метил, этил и изопропил. Примеры C1-С 3 галогеналкила, представленного R2 и R3, включают трихлорметил, трифторметил, дифторметил, хлордифторметил и пентафторэтил. Примеры C1-С 3 алкокси C1-С 3 алкила, представленного R2 и R3, включают метоксиметил. Примеры галогена, представленного X, Y и В включают хлор, фтор, бром или йод. Примеры C1-C6 алкила, представленногоR14 и R15, включают метил, этил, пропил, бутил и изопропил. Примеры C1-С 6 галогеналкила, представленного R14 и R15, включают трифторметил,2,2,2-трифторэтил, 2-хлорэтил, хлорметил и трихлорметил. Примеры фенила, необязательно замещенного метилом или нитро, который представленC1-C6 алкила, представленного R8, включают метиламинокарбонилоксиметил, этиламинокарбонилоксиметил и пропиламинокарбонилоксиметил. Примеры ди(С 1-С 6 алкил) аминокарбонилокси C1-C6 алкила, представленного R8, включают диметиламинокарбонилоксиалкил и диэтиламинокарбонилоксиалкил. В настоящих соединениях предпочитаемыми заместителями с точки зрения гербицидной активности соединений являются следующие:R1 предпочтительно представляет метил,замещенный одним или более атомами фтора,такой, как трифторметил или хлордифторметил,или этил, замещенный одним или более атомами фтора, такой, как пентафторэтил, и более предпочтительно трифторметил;R2 предпочтительно представляет C1-С 3 алкил такой, как метил или этил, или водород, и более предпочтительно метил или водород;R3 предпочтительно представляет C1-С 3 алкил такой, как метил или этил, или водород, и более предпочтительно метил или водород; иQ предпочтительно представляет [Q-1], [Q2], [Q-3] или [Q-4]. Предпочитаемыми примерами настоящих соединений с точки зрения их гербицидной активности являются соединения, которые содержат вышеуказанные предпочитаемым заместители в сочетании. Когда Q представляет [Q-1], более предпочитаемыми соединениями являются те, в которых Х является водородом или фтором, и Y представляет хлор. Среди данных соединений более предпочитаемыми являются те, в которых В представляет OR10, SR10, N(R11)R12,NR11(SO2R14) или COOR10. Среди этих соединений более предпочтительны такие, в которыхR10 представляет C1-C6 алкил, С 3-С 6 алкинил,(C1-C8 алкокси) карбонил C1-C6 алкил или (С 3-С 8 циклоалкокси)карбонил C1-С 6 алкил; R11 являет 11 ся водородом; R12 представляет (C1-C6 алкокси)карбонил C1-C6 алкил; и R14 представляет C1C6 алкил или C1-C6 галогеналкил. Когда Q представляет [Q-2], более предпочтительными являются соединения, в которых Х представляет фтор или водород; Z1 представляет кислород; R4 является водородом и n представляет 1. Среди этих соединений более предпочтительными являются соединения, в которых R5 представляют С 3-С 6 алкинил. Типичными примерами предпочитаемых соединений являются следующие: 7-фтор-6-(5-трифторметил-3-пиридазинон 2-ил)-4-пропаргил-2 Н-1,4-бензоксазин-3-он; 7-фтор-6-(4-метил-5-трифторметил-3 пиридазинон-2-ил)-4-пропаргил-2 Н-1,4 бензоксазин-3-он; 6-(5-трифторметил-3-пиридазинон-2-ил)-4 пропаргил-2 Н-1,4-бензоксазин-3-он; 6-(4-метил-5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2 Н-1,4-бензоксазин-3-он; 2-(4-хлор-2-фтор-5-изопропоксифенил)-4 метил-5-трифторметилпиридазин-3-он; 2-(4-хлор-2-фтор-5-метоксифенил)-4 метил-5-трифторметилпиридазин-3-он; 2-(4-хлор-2-фтор-5-этоксифенил)-4-метил 5-трифторметилпиридазин-3-он; 2-(4-хлор-2-фтор-5-пропаргилоксифенил)4-метил-5-трифторметилпиридазин -3-он; метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат; этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат; пропил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат; изопропил 2-хлор-4-фтор-5-(4-метил-5 трифторметил-3-пиридазинон-2-ил)феноксиацетат; бутил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат; пентил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксиацетат; циклопентил 2-хлор-4-фтор-5-(4-метил-5 трифторметил-3-пиридазинон-2-ил)феноксиацетат; этил 2-2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксипропионат; метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)феноксипропионат; этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил) фенилтиоацетат; метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтиоацетат; этил 2-2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилтиопропионат;N-2-хлор-5-(4-метил-5-трифторметил-3 пиридазинон-2-ил) фенилметансульфонамид; метил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат; этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат; этил 2-хлор-5-(4-метил-5-трифторметил-3 пиридазинон-2-ил)бензоат; изопропил 2-хлор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат; и 2-(4-хлор-2-фтор-5-пропаргилоксифенил)6-метил-5-трифторметилпиридазин-3-он. С точки зрения гербицидной активности более предпочитаемыми среди данных соединений являются следующие: 7-фтор-6-(5-трифторметил-3-пиридазинон 2-ил)-4-пропаргил-2 Н-1,4-бензоксазин-3-он; 7-фтор-6-(4-метил-5-трифторметил-3 пиридазинон-2-ил)-4-пропаргил-2 Н-1,4 бензоксазин-3-он; 6-(4-метил-5-трифторметил-3-пиридазинон-2-ил)-4-пропаргил-2 Н-1,4-бензоксазин-3-он; этил 2-2-хлор-4-фтор-5-(5-трифторметил 3-пиридазинон-2-ил) фениоксипропионат; и этил 2-2-хлор-4-фтор-5-(5-трифторметил 3-пиридазинон-2-ил) фенилтиопропионат. В дополнение к сказанному более предпочитаемыми с точки зрения их селективности среди сельскохозяйственных культур и сорняков являются следующие соединения: 2-(4-хлор-2-фтор-5-пропаргиоксифенил)-4 метил-5-трифторметилпиридазин-3-он;N-2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)фенилметансульфонамид; и этил 2-хлор-4-фтор-5-(4-метил-5-трифторметил-3-пиридазинон-2-ил)бензоат. Настоящие соединения могут быть получены, например, в соответствии с процессами получения, описанными ниже. Способ получения 1. Данным способом является процесс получения, в котором среди настоящих соединений соединение формулы: в которой R1, R2, R3 и Q1 имеют значения, указанные выше, получается с помощью реакции производного гидразона формулыR28 представляет C1-C6 алкил такой, как метил или этил; и Аr представляет необязательно замещенный фенил такой, как фенил. Реакция обычно проводится в растворителе. Температура реакции составляет обычно в интервале от -20 до 150 С, предпочтительно 0 100 С. Время реакции обычно составляет в пределах от момента до 72 ч. Количества реагентов,используемых в реакции, хотя соотношение 1 моля соединения [5] и 1 моля соединения [4] является идеальным, могут свободно варьировать в зависимости от условий реакции. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран (ТГФ) и этиленгликольдиметиловый эфир; нитросоединения, такие как нитрометан и нитробензол; амиды кислот, такие как формамид, N,N-диметилформамид и ацетамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиланилин, N,N-диэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду и их смеси. 14 По завершении реакции реакционный растворитель отгоняется из реакционной смеси и остаток подвергается хроматографии или реакционная смесь подвергается обычным процедурам последующей обработки, такой как экстракция органическим растворителем и концентрирование, с последующей, если необходимо,очисткой с помощью таких приемов, как хроматография или перекристаллизация. Таким образом, может быть выделено желаемое соединение настоящего изобретения. Вышеупомянутая реакция проводится через соединение формулы: где R1, R2, R3, R28 и Q1 имеют значения, указанные выше. Данный процесс получения может также проводиться с помощью выделения соединения[6] и осуществления внутримолекулярной циклизации соединения [6]. Циклизация обычно может проводиться в растворителе. Температура реакции обычно составляет в интервале от-20 С до 150 С, предпочтительно 50 - 150 С. Время реакции составляет обычно в пределах от момента до 72 ч. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод,дихлорметан, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; сложные эфиры, такие как этилформиат,этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как формамид, N,Nдиметилформамид и ацетамид; третичные амины такие, как пиридин, триэтиламин, диизопропилэтиламин,N,N-диметиланилин,N,Nдиэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; жирные кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду и их смеси. В качестве катализатора реакции могут использоваться кислоты, такие как серная кислота,или основания, такие как метилат натрия. 15 Способ получения 2. Данным способом является процесс согласно следующей схеме:R1, R2, R3, R4 и Х имеют значения, определенные выше; R22 представляет C1-C6 алкил; и D представляет хлор, бром, йод, метансульфонилокси, трифторметансульфонилокси или nтолуолсульфонилокси. Способ получения соединения [8] из соединения [7]. Соединение [8] может быть получено из реакции соединения [7] с нитрующим агентом в растворителе. Нитрующий агент: азотная кислота или аналогичные. Количество нитрующего агента: от 1 до 10 молей на моль соединения [7]. Растворитель: серная кислота. Температура: от -10 С до комнатной температуры. Время: от момента до 24 ч. Способ получения соединения [9] из соединения [8]. Соединение [9] может быть получено из реакции соединения [8] с соединением формулы где R4 и R22 имеют значения, указанные выше, в присутствии фторида калия в растворителе. Количество соединения [12]: от 1 до 50 молей на моль соединения [8]. Количество фторида калия: от 1 до 50 молей на моль соединения [8]. Растворитель: 1,4-диоксан или аналогичные. Температура: от комнатной до температуры дефлегмации при нагревании. Время: от момента до 96 ч. Способ получения соединения [10] из соединения [9]. Соединение [10] может получаться путем восстановления соединения [9] порошком желе 000868 16 за или аналогичным в присутствии кислоты в растворителе. Количество порошка железа: от 3 молей до избытка на моль соединения [9]. Кислота: уксусная кислота или аналогичные. Количество кислоты: от 1 до 10 молей. Растворитель: вода, этилацетат или аналогичные. Температура: от комнатной до температуры дефлегмации при нагревании. Время: от момента до 24 ч Способ получения соединения [11] из соединения [10]. Соединение [11] может получаться из реакции соединения [10] с соединением формулы[13],51 где R и D имеют значения, указанные выше. Реакция обычно проводится в присутствии основания в растворителе. Температура обычно составляет в пределах от -20 до 150 С, предпочтительно от 0 до 50 С. Время реакции обычно составляет в пределах от момента до 48 ч. Количества реагентов, используемых в реакции составляет обычно от 1 до 3 молей соединения[13] и обычно от 1 до 2 молей основания на моль соединения [10]. Примеры оснований, которые могут использоваться, включают неорганические основания, такие как гидрид натрия, гидрид калия,гидроокись натрия, гидроокись калия, карбонат калия и карбонат натрия; и органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин, 4-диметиламинопиридин, N,Nдиметиланилин и N,N-диэтиланилин. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлорбензол и дихлорбензол; простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир, нитросоединения, такие как нитробензол; амиды кислот, такие как формамид, N,N-диметилформамид и ацетамид; третичные амины такие, как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиланилин, N,N-диэтиланилин и N-метилморфолин; их смеси. По завершении реакции реакционная смесь, если необходимо, выливается в воду и подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей, если необходимо, очисткой с помощью таких приемов, как хроматография на колонке или перекристаллизация. Таким образом, может быть получено настоящее соединение [11]. где R1, R2, R3, R4, R22 и Х имеют значения, указанные выше. Способ получения соединения [15] из соединения [14]. Соединение [15] может получаться с помощью реакции соединения [14] с соединением формулы Температура: от -10 С до комнатной температуры. Время: от момента до 24 ч. Способ получения соединения [9] из соединения [16]. Соединение [9] может получаться с помощью реакции соединения [16] с соединением[17] в присутствии основания в растворителе. Количество соединения [17]: 1-2 моля на моль соединения [16]. Основание: гидрид натрия, карбонат калия или аналогичные. Количество основания: 1-2 моля на моль соединения [16]. Растворитель: 1,4-диоксан, N,N-диметилформамид или аналогичные. Температура: 0-100 С Время: от момента до 24 ч. Способ получения 3. Данным способом является способ получения в соответствии со следующей схемой: где R4 и R22 имеют значения, указанные выше, в присутствии основания в растворителе. Количество соединения [17]: 1 - 2 моля на моль соединения [14]. Основание: гидрид натрия, карбонат натрия или аналогичные. Количество основания: 1-2 моля на моль соединения [14]. Растворитель: 1,4-диоксан,N,Nдиметилформамид или аналогичные. Температура: 0-100 С. Время: от момента до 24 ч Способ получения соединения [9] из соединения [15]. Соединение [9] может быть получено из реакции соединения [15] с нитрующим агентом в растворителе. Нитрующий агент: азотная кислота или аналогичные. Количество нитрующего агента: 1-10 молей на моль соединения [15]. Растворитель: серная кислота, уксусная кислота или аналогичные. Температура: от -10 С до комнатной температуры. Время: от момента до 24 ч. Способ получения соединения [16] из соединения [14]. Соединение [16] может быть получено из реакции соединения [14] с нитрующим агентом в растворителе. Нитрующий агент: азотная кислота или аналогичные. Количество нитрующего агента: 1-10 молей на моль соединения [14]. Растворитель: серная кислота, уксусная кислота или аналогичные. где X, R1, R2, R3, R51 и D имеют значения, указанные выше. Способ получения соединения [19] из соединения [18]. Соединение [19] может получаться путем восстановления соединения [18] порошком железа или аналогичными в присутствии кислоты в растворителе. Количество порошка железа: от 3 молей до избытка на моль соединения [18]. Кислота: уксусная кислота или аналогичные. Количество кислоты: от 1 до 10 молей на моль соединения [18]. Растворитель: вода, этилацетат или аналогичные. Температура: от комнатной до температуры дефлегмации при нагревании. Время: от момента до 24 ч. Способ получения соединения [21] из соединения [20]. Вышеупомянутое соединение [9] также может получаться в соответствии со следующей схемой: 19 Соединение [20] может получаться с помощью реакции соединения [19] с тиоцианатом натрия, тиоцианатом калия или аналогичными в растворителе, и затем реакции его с бромом или хлором в растворителе. Количество тиоцианата натрия, тиоцианата калия или аналогичных: 1-10 молей на моль соединения [19]. Количество брома или хлора: 1-10 молей на моль соединения [19]. Растворитель: водная соляная кислота,водная уксусная кислота, водная серная кислота или аналогичные Температура: 0-50 С Время: от момента до 150 ч. Способ получения соединения [21] из соединения [20]. Соединение [21] может быть получено с помощью 1) реакции соединения [20] с нитритом натрия, нитритом калия или аналогичными в растворителе, и затем 2) нагревания его в кислотном растворе. Реакция 1) Количество нитрита натрия, нитрита калия или аналогичных: 1-2 моля на моль соединения [20] Растворитель: водная соляная кислота или водная серная кислота. Температура: от -10 до 10 С. Время: от момента до 5 ч. Реакция 2) Кислотный раствор: водная соляная кислота, водная серная кислота или аналогичные Температура: от 70 до температуры дефлегмации при нагревании. Время: от момента до 24 ч. Способ получения соединения [22] из соединения [21]. Соединение [22] может получаться с помощью реакции соединения [21] с соединением[13] в присутствии основания в растворителе. Количество соединения [13]: 1-3 моля на моль соединения [21]. Основание: гидрид натрия, карбонат калия или аналогичные. Количество основания: 1-2 моля на моль соединения [21]. Растворитель: 1,4-диоксан, N,N-диметилформамид или аналогичные. Температура: 0-100 С. Время: от момента до 48 ч. Способ получения 4. Данным способом является процесс получения в соответствии со следующей схемой: где X, R1, R2, R3 и R5 имеют значения, определенные выше. Способ получения соединения [24] из соединения [23]. Соединение [24] может получаться путем восстановления соединения [23] порошком железа или аналогичными в присутствии кислоты в растворителе. Количество порошка железа: от 3 молей до избытка на моль соединения [23]. Кислота: уксусная кислота или аналогичные. Количество кислоты: от 1 до 10 молей на моль соединения [23]. Растворитель: вода, этилацетат или аналогичные. Температура: от комнатной до температуры дефлегмации при нагревании. Время: от момента до 24 ч. Способ получения соединения [25] из соединения [24]. Соединение [25] может быть получено путем 1) реакции соединения [24] с нитритной солью в растворителе с образованием диазониевой соли и затем 2) повышения температуры,чтобы вызвать циклизацию диазониевой соли в растворителе. Реакция 1) Нитритная соль: нитрит натрия, нитрит калия или аналогичные. Количество нитритной соли: 1-2 моля на моль соединения [24]. Растворитель: водная соляная кислота,водная серная кислота или аналогичные. Температура: от -10 до 10 С. Время: от момента до 5 ч. Реакция 2) Растворитель: водная соляная кислота,водная серная кислота или аналогичные. Температура: от комнатной до 80 С. Время: от момента до 24 ч. Способ получения 5. Данным способом является способ получения в соответствии со следующей схемой: где Y1 представляет заместитель, отличный от нитро, который включен в определение Y; R101 представляет заместитель иной, чем водород,который включен в определение R10; и X, R1, R2 и R3 имеют значения, указанные выше. Способ получения соединения [27] из соединения [26]. Соединение [27] может получаться путем добавления азотной кислоты к соединению [26] в растворителе (смотри Organic Synthesis Collective, Vol. 1, стр. 372). Температура реакции обычно находится в интервале 0-100 С. Время реакции составляет обычно в пределах от момента до 24 ч. Количество реагентов, используемых в реакции, хотя количество 1 моль соляной кислоты на 1 моль соединения [26] является идеальным, могут свободно варьировать в зависимости от условий реакции. Примеры растворителей, которые могут использоваться, включают кислотные растворители, такие как серная кислота. Способ получения соединения [28] из соединения [27]. Соединение [28] может быть получено путем восстановления соединения [27] в растворителе (смотри Organic Synthesis Collective, Vol. 2,стр. 471, там же. Vol. 5, с. 829). Например, получение может достигаться с помощью добавления соединения [27], которое является чистым или растворенным в растворителе, таком как этилацетат, к смеси уксусной кислоты, порошка железа и воды. Температура реакции обычно составляет в интервале от 0 до 100 С. Время реакции составляет обычно в пределах от момента до 24 ч. После завершения реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться при добавлении воды,если необходимо, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей, если необходимо, очисткой с помощью приемов, как хроматография или перекристал 000868 22 лизация. Таким образом, может быть выделено целевое соединение. Способ получения соединения [29] из соединения [28]. Соединение [29] может получено путем 1) реакции соединения [28] с нитритной солью в растворителе и, затем, 2) нагревания его в кислотном растворителе. Реакция 1) Нитритная соль: нитрит натрия, нитрит калия или аналогичные. Количество нитритной соли: 1-2 моля на моль соединения [28]. Растворитель: водная соляная кислота,водная серная кислота или аналогичные. Температура: от -10 до 10 С. Время: от момента до 5 ч. Реакция 2) Кислотный растворитель: водная соляная кислота или водная серная кислота. Температура: от 70 С до температуры дефлегмации при нагревании. Время: от момента до 24 ч. Способ получения соединения [30] из соединения [29]. Соединение [30] может быть получено путем реакции соединения [29] с соединением формулы[31],101 где R и D имеют значения, указанные выше, в присутствии основания в растворителе. Реакция обычно проводится в растворителе. Температура реакции составляет обычно в пределах от -20 до 150 С, предпочтительно от 0 до 100 С. Время реакции обычно составляет в пределах от момента до 72 ч. Количества реагентов, используемых в реакции, хотя соотношение 1 моль соединения [31] и 1 моль основания к 1 молю соединения [29] является идеальным, могут свободно меняться в зависимости от условий реакции. Примеры оснований, которые могут использоваться, включают органические основания и неорганические основания, такие как карбонат калия, гидроокись натрия и гидрид натрия. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды такие, как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод,дихлорметан, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; сложные эфиры, такие как этилформиат, этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; 23 нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как формамид,N,N-диметилформамид и ацетамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиланилин, N,Nдиэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; их смеси. После завершения реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться путем добавления воды,если необходимо, или реакционная смесь подвергается обычным приемам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей очисткой, если необходимо, с помощью таких приемов, как хроматография или перекристаллизация. Таким образом, может быть выделено соединение. Способ получения 6. Им является способ получения в соответствии со следующей схемой: где R23 и R24 представляют независимо заместитель, отличный от водорода, который включен в определение R11 и R12; или COR13, SO2R14,SO2R15 или COOR10, где R10, R13, R14 и R15 имеют значения, указанные выше; X, Y1, R1, R2 и R3 имеют значения, указанные выше. Способ получения соединения [32] из соединения [28]. Соединение [32] может быть получено по реакции соединения [28] с соединением формулы:COOR10, где R10, R13, R14 и R15 имеют значения,указанные выше, обычно в присутствии основания и обычно в растворителе. Температура реакции обычно составляет в интервале от -20 С до 200 С, предпочтительно от 0 С до 180 С. Время реакции составляет обычно в интервале от момента до 72 ч. Коли 000868 24 чество реагентов, используемых в реакции, хотя соотношение 1 моль соединения [34] или [35] и 1 моля соединения [28] является идеальным,могут свободно меняться в зависимости от условий реакции. Примеры оснований, которые могут использоваться, включают органические основания, такие как пиридин и триэтиламин и неорганические основания. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды такие, как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод,дихлорметан, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофорон и циклогексанон; сложные эфиры, такие как этилформиат, этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как формамид,N,N-диметилформамид и ацетамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиланилин, N,Nдиэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; и их смеси. После завершения реакции реакционная смесь фильтруется для сбора выпавших в осадок кристаллов или реакционная смесь подвергается обычным приемам последующей обработки,таким как экстракция органическим растворителем и концентрирование, с последующей очисткой, если это необходимо, с помощью таких приемов, как хроматография на колонке или перекристаллизация. Таким образом, может быть выделен желаемый продукт. Способ получения соединения [33] из соединения [32]. Соединение [33] может получаться с помощью реакции соединения [32] с соединением[34] или [35]. Данный способ получения основан на способе получения соединения [32] из соединения [28]. Способ получения 7. Данным способом является способ получения согласно следующей схеме: 25 где X, Y, R1, R2, R3, R10, R11 и R12 имеют значения, указанные выше. Способ получения соединения [37] из соединения [36]. Соединение [37] может получаться по реакции соединения [36] с хлорсульфоновой кислотой без какого-либо растворителя или в растворителе. Количество хлорсульфоновой кислоты: от 1 моля до избытка на моль соединения [36]. Растворитель: серная кислота. Температура: 0- 70 С. Время: от момента до 24 ч.(смотри Org. Syn., Coll., Vol. 1, 8 (1941. Способ получения соединения [38] из соединения [37]. Соединение [38] может получаться с помощью реакции соединения [37] с соединением формулы:[40],10 где R имеет значения, указанные выше, в присутствии основания без какого-либо растворителя или в растворителе. Количество соединения [24]: 1 моля до избытка на моль соединения [37]. Основание: органические основания, такие как триэтиламин, или неорганические основания, такие как карбонат калия. Количество основания: 1-2 моля на моль соединения [37]. Растворитель: N,N-диметилформамид, 1,4 диоксан или аналогичные. Температура: 0 - 100 С. Время: от момента до 24 ч. Способ получения соединения [39] из соединения [37]. Соединение [39] может получаться с помощью реакции соединения [37] с соединением формулы:[41],11 12 где R и R имеют значения, указанные выше,в присутствии или в отсутствии основания без какого-либо растворителя или в растворителе. Количество соединения [41]: от 1 моля до избытка на моль соединения [37]. Основание: органические основания, такие как триэтиламин, или неорганические основания, такие как карбонат калия. Количество основания: 1-2 моля на моль соединения [37]. Растворитель: 1,4-диоксан, N,N-диметилформамид или аналогичные. Температура: 0 - 100 С. Время: от момента до 24 ч. Способ получения 8. Данным способом является способ получения согласно следующей схеме: где X, Y, R1, R2, R3, R11, R12, R17, R18 и R22 имеют значения, указанные выше. Способ получения соединения [43] из соединения [42]. Соединение [43] может быть получено из соединения [42] в соответствии с методом, описанным в JP-A 5-294920/1993, стр. 15-16. Способ получения соединения [44] из соединения [43]. Соединение [44] может получаться по реакции соединения [43] с соединением формулы:[46], в присутствии основания. Количество соединения [45] или [46]: 1-2 моля на моль соединения [43]. Растворитель: тетрагидрофуран, толуол или аналогичные. Основание: гидрид натрия или аналогичные. Количество основания: 1-2 моля на моль соединения [43]. Температура: 0 - 50 С. Время: от момента до 24 ч. Способ получения соединения [45] из соединения [44]. Соединение [45] может получаться по реакции соединения [44] с соединением формулы[41]. Способ получения 9. Данным способом является способ получения в соответствии со следующей схемой: где W2 представляет хлор или бром; и X, Y, R1,R2, R3 и R13 имеют значения, указанные выше. Условия реакции описываются, например,в патенте США 5,208,212. Получение может быть достигнуто путем превращения соединения [48] в диазониевую соль в растворе соляной кислоты, бромистоводородной кислоты или аналогичных в соответствии с обычным методом, а затем реакции его с соединением формулы:[50] где R имеет значения, указанные выше, в присутствии соли меди, такой как хлорид меди (II) или бромид меди (II), в растворителе, таком как ацетонитрил. Температура реакции обычно составляет в пределах от -20 до 150 С, предпочтительно 060 С. Время реакции составляет обычно в интервале от момента до 72 ч. После завершения реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться с помощью добавления воды, если необходимо, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделен желаемый продукт. Способ получения 10. Им является способ получения в соответствии со следующей схемой: 13 где W3 представляет хлор или бром; и X, Y1, R1,R2, R3 и R13 имеют значения, указанные выше. Способ получения соединения [51] из соединения [28]. Соединение [51] может быть получено с помощью 1) получения диазониевой соли из соединения [28] в растворителе, а затем 2) последующей реакции ее с йодидом калия или бромидом меди (I) в растворителе. Реакция 1) Диазотирующий агент: нитрит натрия,нитрит калия или аналогичные. Количество диазотирующего агента: 1-2 моля на моль соединения [28]. Растворитель: водный бромид водорода,водная серная кислота или аналогичные. Температура: от -10 до 10 С. Время: от момента до 5 ч. Реакция 2) Количество йодида калия или бромида меди (I) : от 1 моля до избытка на моль соединения[28]. Растворитель: водный бромид водорода,водная серная кислота или аналогичные. Температура: от 0 - 80 С. Время: от момента до 24 ч(смотри Org. Syn. Coll., Vol. 2, 604 (1943), и там же Vol. 1, 136 (1941. Способ получения соединения [52] из соединения [51]. Соединение [52] может быть получено с помощью реакции соединения [51] с соединением формулы:[53],13 где R имеет значения, указанные выше, в присутствии катализатора на основе переходного металла и основания в растворителе в атмосфере окиси углерода. Катализатор: РdСl2(РРh3)2 или аналогичные. Количество катализатора: от каталитического до 0,5 моля на моль соединения [51]. Количество соединения [53]: от 1 моля до избытка на моль соединения [51]. Основание: органические основания, такие как диэтиламин. Количество основания: 1-2 моля на моль соединения [51]. Растворитель: N,N-диметилформамид или аналогичные. Давление окиси углерода: 1-150 атм. Температура: 0-100 С. Время: от момента до 72 ч(смотри Bull. Chem. Soc. Jpn., 48 (7) 2075 (1975 Способ получения 11. Им является способ получения в соответствии со следующей схемой: где X, Y, R1, R2, R3 и R19 имеют значения, указанные выше. Соединение [55] может быть получено с помощью гидролиза соединения [54] в кислотном растворителе, таком как серная кислота,или в присутствии кислоты, такой как трибромид бора, в растворителе, таком как метиленхлорид. Температура реакции обычно составляет в интервале от -20 С до 150 С, предпочтительно 0 С - 100 С. Время реакции составляет обычно в интервале от момента до 72 ч. Количество кислоты, используемой в реакции, хотя соотношение 1 моль кислоты к 1 молю соединения [54] является идеальным, может свободно меняться в зависимости от условий реакции. По завершении реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться, если необходимо, с помощью добавления воды, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с после 29 дующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделен желаемый продукт. Способ получения 12. Данный способ является способом получения в соответствии со следующей схемой: где X, Y, R1, R2, R3, Z2 и R17 имеют значения,указанные выше; Z3 представляет кислород или серу; R25 представляет водород или C1-C5 алкил;R26 представляет C1-С 6 алкил, С 3-С 6 алкенил или С 3-С 6 алкинил. Соединение [57] может быть получено с помощью реакции соединения [56] с соединением формулы:[58],26 3 где R и Z имеют значения, указанные выше, в присутствии или отсутствии катализатора и обычно в растворителе. Количество соединения [58], используемое в реакции, хотя отношение 1 моля соединения[58] к 1 молю соединения [56] является идеальным, может свободно меняться в зависимости от условий реакции. Примеры катализатора, который может использоваться, включают n-толуолсульфоновую кислоту. Примеры растворителей, которые могут использоваться, включают толуол,ксилол или аналогичные, или соединение [56]. Температура реакции обычно составляет в пределах от 0 С до 200 С, предпочтительно 50- 150 С. Время реакции обычно составляет в интервале от момента до 72 ч. По завершении реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться, с помощью добавления воды,если необходимо, или реакционная смесь подвергается обычным процедурам последующей обработки, такой как экстракция органическим растворителем или концентрирование, с последующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделен желаемый продукт. (Способ получения 13) Данный способ является способом получения в соответствии со следующей схемой:X, Y, R1, R2 и R3 имеют значения, указанные выше. Способ получения соединения [59] из соединения [55] Соединение [59] может получаться с помощью реакции соединения [55] с 2,3 дихлорпропеном в присутствии основания в растворителе. Количество 2,3-дихлорпропена: 1-3 моля на моль соединения [55]. Основание: неорганические основания, такие как карбонат калия. Количество основания: 1-2 моля на моль соединения [55]. Растворитель: N,N-диметилформамид или аналогичные. Температура: 0-70 С. Время: от момента до 24 ч. Способ получения соединения [60] из соединения [59]. Соединение [60] может получаться с помощью нагревания соединения [59] в растворителе. Растворитель:N,N-диметилформамид,N,N-диметиланилин, N,N-диэтиланилин, nдиизопропилбензол или аналогичные. Температура: 70-200 С. Время: от момента до 24 ч. Способ получения соединения [61] из соединения [60]. Соединение [61] может быть получено из соединения [60] в соответствии со способом, по которому метильная группа в положении 2 бензофуранового кольца замещается другим заместителем, как описано в патенте США 5308829,колонки 2-11. Способ получения 14. Данный способ является способом получения в соответствии со следующей схемой: где X, Y, R1, R2, R3 и R7 имеют значения, указанные выше. Способ получения соединения [62] из соединения [55] Соединение [62] может получаться с помощью реакции соединения [55] с соединением формулы:[65],2 7 где W и R имеют значения, указанные выше, в присутствии основания в растворителе. Количество соединения [65]: 1-5 молей на моль соединения [55]. Основание: неорганические основания, такие как карбонат калия. Количество основания: 1-2 моля на моль соединения [55]. Растворитель: N,N-диметилформамид, 1,4 диоксан или аналогичные. Температура: 0-70 С. Время: от момента до 24 ч. Способ получения соединения [63] из соединения [62]. Соединение [63] может получаться с помощью нагревания соединения [62] в растворителе. Растворитель:N,N-диметилформамид,N,N-диметиланилин, N,N-диэтиланилин, nдиизопропилбензол или аналогичные Температура: 100-200 С. Время: от момента до 24 ч. Способ получения соединения [64] из соединения [63]. Соединение [64] может получаться с помощью нагревания соединения [63] в присутствии кислоты в растворителе. Кислота: органические кислоты, такие какn-толуолсульфоновая кислота, и неорганические кислоты, такие как серная кислота. Количество кислоты: от каталитического количества до 1 моля на моль соединения [63]. Растворитель: толуол, ксилол или аналогичные. Температура: 100-250 С. Время: от момента до 24 ч. Способ получения 15. Данным способом является способ получения в соответствии со следующей схемой: где R81 представляет заместитель, отличный от метила и гидроксиметила, который включен в определение R8; X, Y, R1, R2, R3 и R7 имеют значения, указанные выше. Способ получения соединения [66] из соединения [63]. Соединение [66] может быть получено с помощью реакции соединения [63] с перкислотой в растворителе. Перкислота: м-хлорпербензойная кислота или перуксусная кислота. Количество перкислоты: от 1 моля до избытка на моль соединения [63]. Растворитель: галогенированные углеводороды, такие как дихлорметан; и органические кислоты, такие как уксусная кислота. Температура: от -20 С до комнатной температуры. Время: от момента до 24 ч. Способ получения соединения [67] из соединения [66]. Соединение [67] может быть получено по реакции соединения [66] в присутствии основания в растворителе. Основание: карбонат калия или аналогичные. Количество основания: 1-2 моля на моль соединения [66]. Растворитель: метанол, этанол или аналогичные. Температура: 0-50 С. Время: от момента до 5 ч. Способ получения соединения [68] из соединения [67]. Соединение [68] может быть получено из соединения [67] в соответствии со способом, по которому гидроксиалкильная группа в положении 2 дигидробензофуранового кольца замещается другим заместителем, как описано в патенте США 5411935, колонки 5-10. Способ получения 16. Данный способ является способом получения в соответствии со следующей схемой: где W1 представляет галоген, предпочтительно хлор; R32 представляет водород или C1-C5 алкил; и X, Y, Z2, R1, R2, R3 R11, R12, R33 и R34 имеют значения, указанные выше. Способ получения соединения [69] из соединения [42]. Соединение [69] может получаться с помощью реакции соединения [42] с галогенирующим агентом, таким как тионилхлорид, в растворителе в соответствии с обычным способом. Способ получения соединения [70] из соединения [69]. Соединение [70] может получаться с помощью реакции соединения [69] с соединением формулы: где М представляет катион щелочного металла,предпочтительно катион лития или катион натрия; и R19, R22 и R32 имеют значения, указанные выше, давая соединение формулы: где X, Y, R1, R2, R3, R19, R22 и R32 имеют значения, указанные выше, и затем гидролиза и декарбоксилирования соединения [75]. Первая реакция обычно проводится в растворителе. Температура реакции обычно составляет в интервале -20 С - 50 С, предпочтительно она равна комнатной температуре. Время реакции обычно составляет в интервале от момента до 72 ч. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды такие, как гексан, гептан, лигроин, 000868 34 циклогексан и петролейный эфир; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; амиды кислот, такие как формамид, N,N-диметилформамид и ацетамид; соединения серы, такие как диметилсульфоксид и сульфолан; их смеси. Вторая реакция проводится в присутствии серной кислоты, бромистоводородной кислоты или аналогичных, в растворителе, таком как низшая карбоновая кислота, например, уксусная кислота, или без какого-либо растворителя. Температура реакции обычно составляет в пределах от 80 до 140 С, предпочтительно 100120 С. Время реакции обычно составляет в пределах от момента до 72 ч. Способ получения соединения [71] из соединения [70]. Соединение [71] может получаться с помощью реакции соединения [70] с соединением формулы:[76],33 где R имеет значения, указанные выше. Реакция проводится в низшим спирте, таком как метанол, этанол или изопропанол или в смешанном растворе такого низшего спирта и воды. Температура реакции составляет в интервале 0-80 С. Время реакции составляет в интервале от момента до 72 ч. Соединение [76] может использоваться в виде свободного основания или кислотноаддитивной соли, такой как гидрохлоридная соль или сульфатная соль. Вышеуказанная реакция может также проводиться добавлением основного катализатора,такого как органическое основание, например,пиридин; карбоната щелочного металла, например, карбоната натрия, карбоната калия или аналогичных; бикарбоната щелочного металла; или карбоната щелочно-земельного металла. Соединение [71] может также получаться по реакции соединения формулы:[78],33 где R и D имеют значения, указанные выше, в присутствии основания, и обычно в растворителе. Примеры оснований, которые могут использоваться, включают алкоголяты щелочного металла и гидриды щелочного металла, такие как гидрид натрия. Количество реагентов, используемых в реакции, хотя соотношение от 1 моля соединения[77] является идеальным, могут свободно меняться в зависимости от условий реакции. Примеры растворителей, которые могут использоваться, включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; амиды кислот, такие как формамид, N,N-диметилформамид и ацетамид; соединения серы, такие как диметилсульфоксид и сульфолан; спирты, такие как метанол,этанол, этиленгликоль и изопропанол; и смеси их. Реакционная температура в вышеуказанной реакции составляет в интервале -10 100 С, предпочтительно 0-80 С. Время реакции составляет в пределах от момента до 72 ч. Способ получения соединения [72] из соединения [70]. Соединение [72] может получаться с помощью реакции соединения [70] с соединением формулы: где R11 и R12 имеют значения, указанные выше. Реакция проводится в низшем спирте, таком как метанол, этанол или изопропанол, или в смешанном растворе такого низшего спирта и воды. Температура реакции составляет в интервале 0 - 80 С. Время реакции составляет в интервале от момента до 72 ч. Соединение [79] может использоваться в виде свободного основания или кислотноаддитивной соли, такой как гидрохлоридная соль или сульфатная соль. Вышеуказанная реакция может также проводиться с добавлением основного катализатора, такого как органическое основание, например, пиридин; карбоната щелочного металла,например, карбоната натрия, карбоната калия или аналогичных; бикарбоната щелочного металла; или карбоната щелочно-земельного металла. Способ получения соединения [73] из соединения [70]. Соединение [73] может быть получено с помощью реакции соединения [70] с соединением формулы:[80],2 34 где Z и R имеют значения, указанные выше,обычно в присутствии от каталитического количества до избытка кислоты, такой как nтолуолсульфоновая кислота, соляная или серная кислота, в органическом растворителе, таком как бензол или хлороформ. Температура реакции составляет в пределах от -30 С до температуры кипения реакционной смеси. Время реакции составляет в интервале от момента до 72 ч. Способ получения 17. Данным способом является способ получения в соответствии со следующей схемой: где Q1 и R1 имеют значения, указанные выше. Соединение [82] может быть получено по реакции соединения [81] с соединением формулы где R19 и R22 имеют значения, указанные выше,в растворителе. Температура реакции обычно составляет в интервале от 30 С до 120 С, предпочтительно 40- 80 С. Время реакции составляет обычно в интервале от 5 до 72 ч. Количества реагентов, используемых в реакции, хотя соотношение 1 моля соединения[83] и 1 моля соединения [81] является идеальным, могут свободно меняться в зависимости от условий реакции. Примеры растворителей, которые могут использоваться, включают третичные амины,такие как триэтиламин. После завершения реакции растворитель отгоняется из реакционной смеси и остаток подвергается хроматографии, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем или концентрирование, с последующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделено желаемое соединение настоящего изобретения. Способ получения 18. Данный способ является способом получения в соответствии со следующей схемой:R18 имеют значения, указанные выше); В 4 представляет заместитель, получаемый из В 3 с помощью защиты его кетонового или альдегидного фрагмента спиртом; и X,Y, R1, R2 и R3 имеют значения, указанные выше. 37 Способ получения соединения [100] из соединения [99]. Соединение [100] может быть получено по способу, описанному в способе получения 1 за исключением того, что вместо соединения [4] используется соединение[99]. Соединение [101] может получаться с помощью снятия защиты кетального или ацетального фрагмента соединения[100] обычным методом. Соединение [99] может получаться таким же образом, как описано ниже в способе получения соединения [4] за исключением того, что кетоновый или альдегидный фрагмент в заместителе В 3 соединения формулы где X,Y и В 4 имеют значения, указанные выше,и соединение[103] используется вместо соединения [91], как описано ниже. Соединение [5], которое является одним из исходных соединений при получении настоящих соединений по способу получения 1, может быть получено из промышленных или коммерческих источников или может быть получено,например, в соответствии со способом, описанным в Jikken Kagaku Kouza (Maruzen К.К.), 4-е изд., том 24, с. 259-260. Соединение [4], которое является другим исходным соединением в способе получения 1,может быть получено с помощью реакции соединения формулы где R1 и R3 имеют вышеуказанные значение; и V представляет йод, хлор или бром, с водой в присутствии основания, давая соединение формулы где R1 и R3 имеют вышеуказанные значения,(здесь и далее упоминаемая как реакция 1) и затем реакции соединения [85] с соединением формулы[86] 1 где Q имеет значения, указанные выше, (здесь и далее называемая реакцией 2). Соединение [85] может также вводиться в реакцию в виде его гидратного или ацетального производного в воде или спирте. Реакция 1 обычно проводится в растворителе. Температура реакции обычно составляет в пределах от 20 С до 100 С. Время реакции со 000868 38 ставляет обычно в интервале от момента до 24 ч. Количества реагентов, используемых в реакции, хотя отношение 2 молей воды и 2 молей основания к 1 молю соединения [84] является идеальным, могут свободно меняться, если необходимо. Примеры оснований, которые могут использоваться, включают органические основания и неорганические основания, такие как ацетат натрия и ацетат калия. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлорбензол и дихлорбензол; простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; сложные эфиры, такие как этилформиат, этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как N,Nдиметилформамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин,N,N-диметиланилин, N,N-диэтиланилин и Nметилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду; и их смеси. Реакция 2 обычно проводится в растворителе. Температура реакции составляет обычно в интервале от 20 до 200 С. Время реакции составляет обычно в интервале от момента до 72 ч. Количества реагентов, используемых в реакции, хотя отношение 1 моля воды соединения[86] к 1 молю соедиенения [84] является идеальным, могут свободно меняться в зависимости от условий реакции. Если необходимо, могут также использоваться гидрохлоридная соль или сульфатная соль соединения [86]. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод,дихлорметан, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; сложные эфиры, такие как этилформиат, этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как формамид, N,N-диметилформамид и ацетамид; 39 третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин, N,N-диметиланилин, N,N-диэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; жирные кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду; и их смеси. После завершения реакции реакционная смесь фильтруется для сбора кристаллов, которые могут осаждаться, с помощью добавления воды, если необходимо, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделен желаемый продукт. Среди примеров соединения [4] соединение формулы где Х имеет значения, указанные выше; Y2 представляет галоген; и В 2 представляет водород, галоген, C1-C6 алкокси или C1-C6 алкилтио,может также получаться в соответствии со следующей схемой: где X, Y2, В 2 и R22 имеют значения, указанные выше. Способ получения соединения [89] из соединения [88] Соединение [89] может получаться с помощью реакции соединения [88] с нитритной солью в соляной кислоте или серной кислоте с превращением его в диазониевую соль и затем реакции диазониевой соли с соединением формулы где R22 имеет вышеуказанные значения, в присутствии основания, такого как ацетат натрия или пиридин (смотри, например, Tetra hedron.Vol. 35, стр. 2013 (1979. Способ получения соединения [90] из соединения [89]. 40 Соединение [90] может получаться с помощью гидролиза соединения [89] обычно в присутствии основания в растворителе. Температура реакции составляет в пределах от 0 С до 150 С, предпочтительно 20100 С. Время реакции составляет в интервале от 1 до 24 ч, предпочтительно от 1 до 10 ч. Количество реагентов, используемых в реакции, хотя отношение 1 моля основания к 1 молю соединения [89] является идеальным, могут свободно меняться, если необходимо. Примеры оснований, которые могут использоваться, включают неорганические основания, такие как гидроокись калия, гидроокись лития, гидроокись бария и гидроокись натрия. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлорбензол и дихлорбензол; простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; кетоны, такие как ацетон, метилэтилкетон, изофорон и циклогексанон; нитросоединения, такие как нитрометан и нитробензол; амиды кислот, такие как N,Nдиметилформамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин,N,N-диметиланилин, N,N-диэтиланилин и Nметилморфолин; соединения серы, такие как диметилсульфоксид и сульфолан; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду и их смеси. Способ получения соединения [87] из соединения [90]. Соединение [87] может получаться с помощью нагревания соединения [90] в растворителе. Температура реакции составляет в пределах 50-200 С, предпочтительно 50-150 С. Время реакции составляет в интервале от момента до 72 ч. Примеры растворителей, которые могут использоваться, включают алифатические углеводороды, такие как гексан, гептан, лигроин,циклогексан и петролейный эфир; ароматические углеводороды, такие как бензол, толуол и ксилол; галогенированные углеводороды, такие как хлороформ, четыреххлористый углерод,дихлорметан, дихлорэтан, хлорбензол и дихлорбензол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и этиленгликольдиметиловый эфир; кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон, изофрон и циклогексанон; сложные эфиры, такие как этилформиат, этилацетат, бутилацетат и диэтилкарбонат; нитросоединения, такие как нитрометан и нитробензол; нитрилы, такие как ацетонитрил и изобутиронитрил; амиды кислот, такие как формамид, 41N,N-диметилформамид и ацетамид; третичные амины, такие как пиридин, триэтиламин, диизопропилэтиламин,N,N-диметиланилин, N,N-диэтиланилин и N-метилморфолин; соединения серы, такие как диметилсульфоксид или сульфолан; жирные кислоты, такие как муравьиная кислота, уксусная кислота и пропионовая кислота; спирты, такие как метанол, этанол, этиленгликоль и изопропанол; воду и их смеси. Вышеуказанная реакция может также проводиться с использованием металла, например,меди, в качестве катализатора. После завершения реакции реакционная смесь фильтруется для сбора выпавших в осадок кристаллов, или реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование, с последующей,если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделено желаемое соединение. Соединение [86] может быть также получено по следующей схемеOrganic Synthesis Collective, Vol. 1, стр. 442). Соединение [91] является известным или может быть получено в соответствии с таким способом, как описан в ЕР-61741-А; патенте США 4670046, патенте США 4770695, патенте США 4709049, патенте США 4640707, патенте США 4720927, патенте США 5169431; и JP-A 63-156787/1988. Некоторые примеры соединения [91] могут быть также получены в соответствии со следующей схемой: где R31 представляет COR16 или COOR10 Способ получения соединения [95] из соединения [94]. Соединение [95] может получаться с помощью реакции соединения [94] с азотной кислотой в растворителе. Температура реакции составляет обычно в пределах от 0 до 100 С. Время реакции обычно составляет в интервале от момента до 24 ч. Ко 000868 42 личества реагентов, используемых в реакции,хотя соотношение 1 моля азотной кислоты и 1 моля соединения [94] является идеальным, могут свободно меняться в зависимости от условий реакции. Примеры растворителей, которые могут использоваться, включают кислотные растворители, такие как смеси азотной и серной кислот(смотри Organic Synthesis Collective, Vol., 1, с. 372). Способ получения соединения [96] из соединения [95]. Соединение [96] может получаться с помощью восстановления соединения [95] в смеси уксусной кислоты, порошка железа и воды. Температура реакции обычно составляет в пределах 0-100 С. Время реакции составляет обычно в интервале от момента до 24 ч. После завершения реакции реакционная смесь подвергается обычным процедурам последующей обработки, таким как экстракция органическим растворителем и концентрирование с последующей, если необходимо, очисткой с помощью таких приемов, как колоночная хроматография или перекристаллизация. Таким образом, может быть выделено желаемое соединение (смотри Organic Synthesis Collective, Vol.,2, стр. 471 и там же. Vol. 5, с. 829). Настоящие соединения имеют превосходную гербицидную активность, и некоторые из них проявляют превосходную селективность между культурными растениями и нежелательными сорняками. В частности, настоящие соединения имеют гербицидную активность против различных нежелательных сорняков, перечисленных ниже, которые могут вызывать затруднения при обработке листвы и обработке почвы на нагорных или суходольных полях.Polygonaceae: горец вьюнковый (Polygonum convolvulus),горец бледный (Polygonum lapathifolium), горец пенсильванский (Polygonum pensilvanicum), горец персиколистный (Polygonum persicaria), щавель курчавый (Rumex crispus), щавель узколистный (Rumex obtusifolius), горец остроконечный японский (Polygonum cuspidatum).Crusiferae: редька дикая (Raphanus raphanistrum), горчица полевая (Sinapis arvensis), пастушья сумка обыкновенная (Capsella bursapastoris). 43 сесбания высокая (Sesbania exaltata), кассия узколистная (Cassia obtusifolia), десмодиум мохнатый флоридский (Desmodium tortuosum),клевер ползучий (Trifolium repens).rotundus), сыть желтая (Cyperus esculentus). Кроме того, некоторые из настоящих соединений не связаны с проблемами фитотоксичности по отношению к основным сельскохозяйственным культурам растений, таким как кукуруза (Zea mays), пшеница обыкновеннаяvulgaris), арахис обыкновенный (Arachis hypogaea), подсолнечник (Helianthus annuus) и брюква (Brassica napus); к садовым культурам, таким как цветы и декоративные растения; и овощным культурам. С помощью настоящих соединений можно достигать эффективной борьбы с нежелательными сорняками при беспахотном культивировании сои (Glycine max), кукурузы (Zea mays) и пшеницы (Triticum aestivum). Кроме того, некоторые из них не вызывают никаких проблем фитотоксичности по отношению к культурным растениям. Настоящие соединения обладают гербицидной активностью против различных нежелательных сорняков, приведенных ниже, при поливной обработке на затапливаемых полях.Gramineae: куриное просо рисовидное (EchinochloaScrophulariaceae: бедренец ложный обыкновенный (Lindernia procumbens).Cyperaceae: сыть бесформенная мелкоцветковая (Cuperus difformis), камыш джункойский (Scirpus juncoides), пушица игловидная (Eleocharis acicularis), сыть поздняя (Cyperus serotinus), пушицаUmbelliferae: омежник яванский (Oenanthe javanica). Кроме того, некоторые из настоящих соединений не имеют никаких проблем фитотоксичности по отношению к рису, пересаживаемому на затапливаемые поля. С помощью настоящих соединений можно достигать эффективной борьбы с различными нежелательными сорняками в плодовых питомниках, на сенокосных угодьях, газонах, в лесах,водных путях, каналах или других некультивируемых землях. Настоящие соединения обладают также гербицидной активностью против различных водных растений, таких как гиацинт водяной(Eichhornia crassipes), которые растут обычно на водных путях, в каналах или аналогичных. Настоящие соединения имеют по существу те же характеристики, что и свойства гербицидных соединений, описанных в публикации международной патентной заявки WO 95/34659. В тех случаях, когда культивируются культурные растения с устойчивостью, придаваемой геном устойчивости к гербицидам, описанной в данной публикации, настоящие соединения могут использоваться в более значительных дозах, чем дозы, используемые при обработке обычных культурных растений без толерантности, т.е. устойчивости к гербицидам, и, таким образом,появляется возможность достижения эффективной борьбы с другим нежелательным растением. Когда настоящие соединения используются в качестве активных ингредиентов гербицидов, они обычно смешиваются с твердыми или жидкими носителями или разбавителями, поверхностно-активными веществами и другими вспомогательными агентами, давая готовые препаративные формы, такие как эмульгируемые концентраты, смачиваемые порошки, текучие или сыпучие вещества, гранулы, концентрированные эмульсии и диспергируемые в воде гранулы. Эти готовые препаративные формы могут содержать любое из настоящих соединений в качестве активного ингредиента в количестве 0,001%-80% по весу, предпочтительно 0,005%70% по весу, в расчете на общий вес готовой препаративной формы. Примеры твердого носителя или разбавителя могут включать тонкодисперсные порошки или гранулы из следующих материалов; минеральные вещества, такие как каолиновая глина, аттапульгитная глина, бентонит, белая земля, пирофилит, тальк, диатомовая земля и кальцит; органические вещества, такие как порошок из ореховой скорлупы; водорастворимые органические вещества, такие как мочевина; неорганические соли, такие как сульфат аммония; и синтетическая гидратированная окись кремния. Примеры жидких носителей или разбавителей могут включать ароматические углеводороды, такие как метилнафталин, фенилкси 000868 46 лилэтан и алкилбензолы (например, ксилол); спирты, такие как изопропанол, этиленгликоль и 2-этоксиэтанол; сложные эфиры, такие как диалкиловые эфиры фталевой кислоты; кетоны,такие как ацетон, циклогексанон и изофорон; минеральные масла, такие как машинное масло; растительные масла, такие как соевое масло и хлопковое масло; диметилсульфоксид, N,Nдиметилформамид, ацетонитрил, N-метилпирролидон, воду и аналогичные. Примеры поверхностно-активных веществ,используемых в целях эмульгирования, диспергирования и распределения, могут включать поверхносто-активные агенты анионного типа,такие как алкилсульфаты, алкилсульфонаты,алкиларилсульфонаты, диалкилсульфосукцинаты и фосфаты полиоксиэтиленалкилариловых эфиров; и поверхностно-активные агенты неионного типа, такие как полиоксиэтиленалкиловые эфиры, полиоксиэтиленалкилариловые эфиры, полиоксиэтиленполиоксипропиленовые блок-сополимеры, сложные эфиры сорбитановых жирных кислот и полиоксиэтиленовые эфиры сорбитановых жирных кислот. Примеры вспомогательных агентов, использованных в готовых препаративных формах, могут включать лигнинсульфонаты, альгинаты, поливиниловый спирт, аравийскую камедь, карбоксиметилцеллюлозу (CMC) и фосфат изопропиловой кислоты (PAP). Настоящие соединения обычно преобразуются в готовые препаративные формы, как описано выше, и затем используются для предили послевсходовой обработки почвы, листвы,или поливной обработки нежелательных сорных растений. Почвенная обработка может включать обработку поверхности почвы или введение в почву. Обработка листвы может включать применение по отношению ко всем растениям и непосредственное применение, при котором химический препарат используется только по отношению к нежелательным сорнякам так,чтобы предохранить от обработки культурные растения. Настоящие соединения могут использоваться, если необходимо, в сочетании с другими соединениями, имеющими гербицидную активность. Примеры соединений, которые могут использоваться в сочетании с настоящими соединениями, могут включать различные соединения, описанные в каталоге 1995 издания Farm(Hakuyu-sha). Типичными примерами таких соединений являются следующие: атразин, цианазин, диметаметрин, метрибуцин, прометрин,симазин, симетрин, хлоротолурон, диурон, димурон, флуометурон, изопротурон, линурон,метабензтиазурон, бромоксинил, иоксинил,эталфлуралин, пендиметалин, трифлуралин, 47 ацифлуорфен, ацифлуорфен-натрий, бифенокс,хлометоксинил, фомезафен, лактофен, оксадиазон, оксифлуорфен, карфентразон, флумиклорак-пентил, флумиоксазин, флутиацет-метил,сульфентразон, тидиазимин, дифензокват, дикват, паракват, 2,4-D, 2,4-DB, DCPA, МСРА,МСРВ, кломепроп, клопиралид, дикамба, дитиопир, флуроксипир, мекопроп, наплоанилид,фенотиол, кинклорак, триклопир, ацетохлор,алахлор, бутахлор, диэтатилэтил, метолахлор,претилахлор, пропахлор, бенсульфурон-метил,хлорсульфурон, хлоримурон-этил, галосульфурон-метил, метсульфурон-метил, никосульфурон, примисульфурон, пиразосульфурон-этил,сульфометурон-метил, тифенсульфурон-метил,триасульфурон, трибенурон-метил, азимсульфурон, хлорансулам-метил, циклосульфамурон,флуметурам, флупирсульфурон, флазасульфурон, имазосульфурон, метосулам, просульфурон, римсульфурон, трифлусульфурон-метил,имазаметабенз-метил, имазапир, имазакин, имазетапир, имазамет, имазамокс, биспирибакметил, пириминобак-метил, пиритиобак-натрий,аллоксидим-натрий, клетодим, сетоксидим,тралкоксидим, диклофоп-метил, феноксапропэтил, феноксапроп-n-этил, флуазифоп-бутил,флуазифоп-n-бутил, галоксифоп-метил, хизалофоп-n-этил, цигалофоп-бутил, клодинафоппропаргил, бензофенап, кломазон, дифлуфеникан, норфлуоразон, пиразолат, пираоксифен,изоксафлутол,сулкотрион,глуфосинатаммоний, глифосат, бентазон, бентиокарб, бромобутид, бутамифос, бутилат, димепиперат,диметенамид, DSMA, ЕРТС, эспропкарб, изоксабен, мефенацет, молинат, MSMA, пиперофос, прибутикарб, пропанил, пиридат, триаллат,кафенстрол, флупоксам и тиафлуамид. Далее будут описаны типичные примеры таких сочетаний, в которых настоящие соединения обозначаются номерами данных соединений, показанными в таблицах 1-5. 1. Смесь одного соединения, выбранного из группы, состоящей из соединений 1-495, 1496, 1-499, 1-503 и 1-577, и одного соединения,выбранного из группы состоящей из атразина,цианазина, бромоксинила и бентазона, при весовом соотношении 1:1-100. 2. Смесь одного соединения, выбранного из группы, состоящей из соединений 1-495, 1496, 1-499, 1-503 и 1-577, и одного из соединений, выбранных из группы, состоящей из клетодима, сетоксидима, диклофоп-метила, хизалофоп-n-этила, лактофена, ацифлуорфена, ацифлуорфен-натрия, фомезафена, флумиклоракпентила и дикамба при весовом соотношении 1 : 0,5-50. 3. Смесь одного соединения, выбранного из группы, состоящей из соединений 1-495, 1496, 1-499, 1-503 и 1-577, и одного из соединений, выбранных из группы, состоящей из никосульфурона, примисульфурона, просульфурона,хлоримуран-этила, тифенсульфурона, римсуль 000868 48 фурона, галосульфурона, оксасульфурона, изоксафлутола, имазетапира и имазамокса, при весом соотношении 1: 0,1-10. 4. Смесь одного из соединений, выбранных из группы, состоящей из соединений 1-439, 1482, 1-486, 1-496, 1-1076, 1-1123 и 1-1441, и одного из соединений, выбранных из группы, состоящей из изопротурона, хлоротолурона, при весовом соотношении 1 : 1-100. 5. Смесь одного из соединений, выбранных из группы, состоящей из соединений 1-439, 1482, 1-486, 1-496, 1-1076, 1-1123 и 1-1441, и одного из соединений, выбранных из группы, состоящей из мекопропа, флуроксипира и иоксинила при весовом соотношении 1 : 0,5-50. 6. Смесь одного из соединений, выбранных из группы, состоящей из соединений 1-439, 1482, 1-486, 1-496, 1-1076, 1-1123 и 1-1441, и одного из соединений, выбранных из группы, состоящей из дифлуфеникана, метсульфуронметила, феноксапроп-этила и клодинафоппропаргила, при весовом соотношении 1 : 0,110. 7. Смесь одного из соединений, выбранных из группы, состоящей из соединений 1-1441, 11222 и 2-203, и одного из соединений, выбранных из группы, состоящей из глифосата, глуфосинат-аммония и параквата, при весовом соотношении 1 : 1-100. Более того, настоящие соединения могут использоваться в смеси с инсектицидами, акарицидами, нематоцидами, фунгицидами, регуляторами роста растений, удобрениями, средствами мелиорации почвы и аналогичными. Когда настоящие соединения используются в качестве активных ингредиентов гербицидов, количество, в котором они применяются,составляет обычно в пределах от 0,01 до 10000 г, предпочтительно 1-8000 г на гектар, хотя оно может сильно зависеть от погодных условий,типа готовых препаративных форм, времени и способа применения, почвеных условий, видов культурных растений, нежелательных сорняков и аналогичных. В случаях эмульгируемых концентратов, смачиваемых порошков, текучих препаратов, концентрированных эмульсий, вододиспергируемых гранул или аналогичных готовые формы препаратов применяются в заданых количествах после разбавления водой из расчета объема около 10 до 1000 л на гектар с добавлением, если необходимо, вспомогательных веществ или адьювантов, таких как агенты распределения. В случаях гранул или некоторых типов сыпучих или текучих веществ, готовые препаративные формы обычно применяются как таковые без какого-либо разбавления. Примеры применяемых, если необходимо,адьювантов могут включать, в дополнение к перечисленным выше поверхностно-активным веществам, кислоты полиоксиэтиленовых смол 49 масел сельскохозяйственных культур и растительные масла, такие как соевое масло, хлопковое масло и подсолнечное масло. Настоящие соединения могут также использоваться в качестве активных ингредиентов вспомогательных средств для сбора урожая,таких как дефолиантов и десикантов в случае хлопка, и десикантов для картофеля. В этих случаях настоящие соединения обычно преобразуются в готовые препаративные формы, таким образом, как и в случаях применения их в качестве активных ингредиентов гербицидов, и используются или сами по себе, или в сочетании с другими вспомогательными средствами обработки листвы перед сбором урожая. Настоящее изобретение далее будет проиллюстрировано следующими примерами получения, ссылочными примерами, примерами готовых препаративных форм и примерами испытаний; однако, настоящее изобретение не ограничивается этими примерами. Далее будут описаны примеры получения настоящих соединений и гидразонов формулы[2] в качестве промежуточных соединений, в которых настоящие соединения обозначены номерами данных соединений, приведенными в таблицах 1-5. Пример получения 1 (Получение соединения 2-631). К смешанному раствору 8,0 г (97,2 ммоль) ацетата натрия и 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 30 мин. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 4,4 г (18,7 ммоль) 7 фтор-6-гидразино-4-пропаргил-2 Н-1,4-бензоксазин-3-она, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и сушились, что давало 6,3 г (18,37 ммоль) 7 фтор-6-трифторацетилметилиденгидразино-4 пропаргил-2 Н-1,4-бензоксазин-3-она[другое наименование: 3,3,3-трифтор-2-оксопропаналь 1-(7-фтор-3-оксо-4-пропаргил-2 Н-1,4-бензоксазин-6-илгидразон)], т. пл. 190,6 С (разл.). К смешанному раствору 6,0 г (17,5 ммоль) вышеназванного соединения и 50 мл толуола добавлялось 9,1 г (26,2 ммоль) карбэтоксиметилентрифенилфосфорана, и смесь перемешивалась в условиях дефлегмации в течение 1 ч. Толуол отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, что давало 1,3 г (3,5 ммоль) 7 фтор-6-[5-трифторметил-3-пиридазинон-2-ил]4-пропаргил-2 Н-1,4-бензоксазин-3-она (соединение 2-631). Пример получения 2. (Получение соединения 1-476). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 100 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1-дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 70 С в течение 20 мин. Затем реакционная смесь охлаждалась до комнатной температуры, к ней добавлялся раствор 5,8 г (21,5 ммоль) 2-фтор-4-хлор 5-изопропоксифенилгидразина, растворенного примерно в 20 мл диэтилового эфира, и реакционная смесь перемешивалась при комнатной температуре в течение 1 ч. Эфирный слой отделялся и концентрировался. Затем к остатку добавлялось около 60 мл ТГФ, к смеси добавлялось 8,3 г (23,0 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 2 ч. Толуол отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле,давая 3,8 г (10,5 ммоль) 2-[2-фтор-4-хлор-5 изопропоксифенил]-4-метил-5-трифторметилпиридазин-3-она (соединение 1-476). Пример получения 3 (Получение соединения 1-391). Сначала 3,5 г (9,7 ммоль) 2-[2-фтор-4 хлор-5-изопропоксифенил]-4-метил-5-трифторметилпиридазин-3-она (соединение 1-476) растворялось примерно в 10 мл концентрированной серной кислоты при охлаждении льдом, и раствор подогревался до комнатной температуры. Спустя 10 мин, к реакционной смеси добавлялось около 100 мл воды, и выпавшие в осадок кристаллы собирались фильтрованием и промывались дважды 20 мл воды и один раз 10 мл гексана. Данные кристаллы перекристаллизовывались из изопропанола, что давало 3,2 г (9,0 ммоль) 2-[2-фтор-4-хлор-5-гидроксифенил]-4 метил-5-трифторметилпиридазин-3-она (соединение 1-391). Пример получения 4 (Получение соединения 1-486). Сначала 3,2 г (10 ммоль) соединения 1-391 растворялось примерно в 50 мл ДМФ, к смеси добавлялось 2,0 г (13 ммоль) карбоната калия при комнатной температуре и затем добавлялось 1,3 г (11 ммоль) пропаргилбромида, и смесь перемешивалась при комнатной температуре в течение 30 мин с последующим добавлением 100 мл воды. Выпавшие в осадок кристаллы собирались фильтрованием, промывались гексаном и перекристаллизовывались из изопропанола, давая 3,4 г (9 ммоль) соединения 1486.(60 вес.%, масляная дисперсия), и смесь оставлялась стоять при комнатной температуре в течение 30 мин с последующим добавлением 1.8 г(11 ммоль) этилбромацетата при охлаждении льдом. После перемешивания при комнатной температуре в течение 1 ч реакционная смесь экстрагировалась диэтиловым эфиром. Органический слой промывался 10% водной соляной кислотой, водным раствором бикарбоната натрия и затем насыщенным раствором хлористого натрия, и сушился безводным сульфатом магния. Растворитель отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 2,4 г Пример получения 6 (Получение соединения 2-251). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 4,4 г (18,7 ммоль) 7-фтор-6 гидразино-4-пропаргил-2 Н-1,4-бензоксазин-3 она, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и один 52 раз 10 мл гексана и затем растворялись в 50 мл толуола без сушки. К данному раствору добавлялось 8,8 г (24.3 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 1 ч, при этом происходила азеотропная дегидратация. Толуол отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 3,5 г (9,01 ммоль) соединения 2251. Пример получения 7 (Получение соединения 2-328). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 4,8 г (18,7 ммоль) 6-фтор-5 гидразино-3-(втор-бутил)-1,3-бензотиазол-2 она, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Затем к реакционной смеси добавлялось 100 мл простого эфира с последующим перемешиванием и разделением фаз, и органический слой концентрировался. Остаток растворялся в 50 мл ТГФ, к нему добавлялось 8,8 г (24,3 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 1 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, что давало 3,7 г (9,6 ммоль) соединения 2-328. Пример получения 8 (Получение соединения 1-347). Сначала 50 мл концентрированной серной кислоты охлаждалось льдом, в ней растворялось 7,0 г (22,8 ммоль) соединения 1-341. Затем добавлялось по каплям 1,51 г (24 ммоль) дымящей азотной кислоты при 5 С или ниже с последующим созреванием при 0-5 С в течение 1 ч. Смесь выливалась в 300 мл смеси льда и воды и экстрагировалась трижды 50 мл простого эфира. Объединенный эфирный слой промывался примерно 100 мл воды и нейтрализовался 100 мл водного раствора бикарбоната натрия с последующим разделением фаз. Органический слой сушился сульфатом магния и концентрировался до половины объема, и остаток подвергался колоночной хроматографии на силикагеле, давая 6,1 г (17,4 ммоль) соединения 1-347. Пример получения 9 (Получение соединения 1-353). Сначала смешивалось 5,0 г порошка железа, 75 мл уксусной кислоты и 10 мл воды и смесь подогревалась примерно до 80 С с последующим созреванием в течение примерно 15 мин. Затем 6,0 г (17,1 ммоль) соединения 1-347,растворенного в 40 мл этилацетата, добавлялось по каплям к вышеуказанной смеси при 80 С или ниже. После созревания примерно при 80 С в течение 1 ч реакционная смесь оставлялась стоять для охлаждения до комнатной температуры и экстрагировалась дважды 100 мл этилацетата. Объединенный этилацетатный слой промывался дважды 50 мл воды и нейтрализовался водным раствором бикарбоната натрия с последующим разделением фаз. Органический слой сушился сульфатом магния, и этилацетат отгонялся при пониженном давлении. Остаток подвергался колоночной хроматографии на силикагеле, давая 5,1 г (15,9 ммоль) соединения 1-353. Пример получения 10 (Получение соединения 1-420). Сначала 500 мг (1,6 ммоль) соединения 1353 смешивалось с 10 мл (77,3 ммоль) этил 2 бромпропионата, и смесь нагревалась в условиях дефлегмации примерно при 160 С в течение около 12 ч. После того, как реакционная смесь оставлялась охлаждаться, она подвергалась колоночной хроматографии на силикагеле, давая 60 мг (0,6 ммоль) соединения 1-420. Пример получения 11(Получение соединения 1-1622). Сначала 6 мл (55,4 ммоль) этилакрилата,0,5 г (4,8 ммоль) трет-бутилнитрита и 0,6 г (4,5 ммоль) хлорида меди (II) смешивалось вместе с 5 мл ацетонитрила с последующим охлаждением льдом. Затем добавлялось по каплям при 5С или ниже 1,0 г (3,1 ммоль) соединения 1-353,растворенного в 5 мл ацетонитрила, с последующим созреванием на протяжении ночи при комнатной температуре. Реакционная смесь выливалась в смесь льда и воды и дважды экстрагировалась 100 мл этилацетата. Объединенный этилацетатный слой промывался 50 мл разбавленной соляной кислотой и сушился сульфатом магния. Растворитель отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 0,51 г Пример получения 12 (Получение соединения 1-1221). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 5,2 г (18,7 ммоль) метил 2-(2 хлор-4-фтор-5-гидразинофенилтио)пропионата,и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием,промывались дважды 10 мл воды и один раз 10 мл гексана и затем сушились. Остаток растворялся в 50 мл ТГФ, к нему добавлялось 8,4 г(22,4 ммоль) карбэтоксиметилентрифенилфосфорана, и раствор перемешивался при комнатной температуре в течение 3 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии, давая 3,8 г Пример получения 13 (Получение соединения 2-821). К смешанному раствору 8,0 г (97,2 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,9 г (24,3 ммоль) 3,3 дибром-1,1,1-трифторбутанона, и реакции давали возможность протекать при 80 С в течение 30 мин. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 4,4 г (18,7 ммоль) 7 фтор-6-гидразино-4-пропаргил-2 Н-1,4-бензоксазин-3-она, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и сушились, давая 6,1 г (17,0 ммоль) 1,1,1 трифтор-2,3-бутандион-3-(7-фтор-3-оксо-4 пропаргил-2 Н-1,4-бензоксазин-6-илгидразона). К смешанному раствору 6,1 г (17,0 ммоль) вышеуказанного соединения и 50 мл ТГФ добавлялось 7,1 г (20,4 ммоль) карбэтоксиметилентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 1 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на си 55 Ссылочный пример 1. Данный пример является примером получения 3,3-дибром-1,1,1-трифтор-2-бутанона,используемого в примере получения 13. Сначала 34,0 г ацетата натрия растворялось в 270 мл уксусной кислоты, к которой добавлялось 25 г (0,20 моль) 1,1,1-трифтор-2 бутанона и при поддержании температуры при 15-20 С добавлялось по каплям на протяжении 45 мин 66,3 г (0,42 моль) брома. Реакционная смесь перемешивалась в течение 5 ч, при поддержании температуры при 15-20 С и затем оставлялась стоять при комнатной температуре в течение 68 ч. Поверхностный слой отбирался и промывался 600 мл концентрированной серной кислоты. Дополнительная промывка 307 мл концентрированной серной кислотой и перегонка при нормальном давлении давала 28 г (0,10 моль) 3,3-дибром-1,1,1-трифтор-2-бутанона. Пример получения 14 (Получение соединения 1-1346). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,9 г (24,3 ммоль) 3,3 дибром-1,1,1-трифтор-2-бутанона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 3,3 г (18,7 ммоль) 2 хлор-4-фтор-5-гидразинофенола, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и один раз 10 мл гексана,сушились и затем растворялись в 50 мл ТГФ. К данному раствору добавлялось 8,8 г (24.3 ммоль) карбэтоксиметилентрифенилфосфорана,и смесь перемешивалась при комнатной температуре в течение 3 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 0,51 г (1,6 ммоль) соединения 1-1346. Пример получения 15 (Получение соединения 1-1441). Сначала 3,2 г (10 ммоль) соединения 1-1346 растворялось примерно в 50 мл ДМФ, к нему добавлялось при комнатной температуре 2,0 г (13 ммоль) карбоната калия, а затем добавлялось 1,3 г (11 ммоль) пропаргилбромида, и смесь перемешивалась при комнатной температуре в течение 30 мин с последующим добавлением 100 мл воды. Выпавшие в осадок кристаллы собирались фильтрованием,промывались гексаном и перекристаллизовывались из изопропанола, давая 3,2 г (8,5 ммоля) соединения 1-1441. Пример получения 16 (Получение соединения 1-499). В данном примере следовали процедурам примера получения 5, за исключением того, что 1,8 г (1,1 ммоль) н-пентилхлорацетата использовалось вместо этилбромацетата. После добавления данного соединения реакционная смесь перемешивалась при 40 С в течение 3 ч и затем экстрагировалась диэтиловым эфиром. Органический слой промывался 10% водной соляной кислотой, водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия и сушился безводным сульфатом магния. Растворитель отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 3,8 г (8,0 ммоль) соединения 1-499. Пример получения 17 (Получение соединения 2-203). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 4,0 г (18,7 ммоль) 6-гидразино 4-пропаргил-2 Н-1,4-бензоксазин-3-она, и реакционная смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и один раз 10 мл гексана и затем растворялись в 50 мл ТГФ без суш 57 ки. К данному раствору добавлялось 8,8 г (24,3 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 3 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 3,3 г (8,8 ммоль) соединения 2-203. Пример получения 18 (Получение соединения 1-1222). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 50 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1 дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 80 С в течение 1 ч. Затем реакционная смесь охлаждалась до 0 С, к ней добавлялось 5,5 г (18,7 ммоль) этил 2-(2 хлор-4-фтор-5-гидразинофенилтио)пропионата,и смесь перемешивалась при комнатной температуре в течение 2 ч. Выпавшие в осадок кристаллы собирались фильтрованием, промывались дважды 10 мл воды и один раз 10 мл гексана, сушились и затем растворялись в 50 мл ТГФ. К данному раствору добавлялось 8,4 г (22,4 ммоль) карбэтоксиметилентрифенилфосфорана,и смесь перемешивалась при комнатной температуре в течение 3 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 4,3 г (9,9 ммоль) соединения 1-1222. Пример получения 19 (Получение соединения 1-476). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 100 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1-дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 70 С в течение 20 мин. Затем реакционная смесь охлаждалась до комнатной температуры, к ней добавлялся раствор 5,8 г (21,5 ммоль) 2-фтор-4-хлор 5-изопропоксифенилгидразина, растворенного в около 20 мл диэтилового эфира, и реакционная смесь перемешивалась при комнатной температуре в течение 1 ч. Эфирный слой отделялся,промывался один раз 10 мл насыщенного раствора хлористого натрия и сушился сульфатом магния. Диэтиловый эфир отгонялся, давая 6,5 г(млн.дол. 1,39 (6 Н, д., J=6,0 Гц), 4,38-4,52 (1 Н,м.), 7,15 (1 Н, д., J=10,5 Гц), 7,22 (1 Н, д., J=7,3 Гц), 7,43 (1 Н, кв., J=1,7 Гц), 9,18 (1 Н, шир.). Данное соединение растворялось в 50 мл ТГФ. К данному раствору добавлялось 8,3 г(23,0 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 2 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 3,8 г (10,5 ммоль) 2-[2-фтор-4-хлор-5-изопропоксифенил]-4-метил-5-трифторметилпиридазин 3-она (соединения 1-476). Пример получения 20 (Получение соединения 1-642). К смешанному раствору 5,3 г (53,5 ммоль) ацетата натрия и около 100 мл воды добавлялось при охлаждении льдом 6,6 г (24,3 ммоль) 1,1-дибром-3,3,3-трифторацетона, и реакции давали возможность протекать при 70 С в течение 20 мин. Затем реакционная смесь охлаждалась до комнатной температуры. Отдельно 5,8 г(21,5 ммоль) неочищенного хлоргидрата этил 2 хлор-4-фтор-5-гидразинобензоата, растворялось в 30 мл воды, к смеси добавлялось 100 мл диэтилового эфира, и при охлаждении смесь нейтрализовалась с помощью добавления насыщенного раствора бикарбоната натрия с последующей промывкой насыщенным раствором хлористого натрия, что давало раствор этил 2 хлор-4-фтор-5-гидразинобензоата в диэтиловом эфире. Данный раствор добавлялся к вышеуказанной реакционной смеси с последующим энергичным перемешиванием при комнатной температуре в течение 2 ч. Эфирный слой отделялся, промывался один раз 10 мл насыщенного раствора хлористого натрия и сушился сульфатом магния. Диэтиловый эфир отгонялся. Остаток растворялся в 50 мл ТГФ, к которому добавлялось 8,3 г (23,0 ммоль) карбэтоксиэтилидентрифенилфосфорана, и смесь нагревалась в условиях дефлегмации в течение 2 ч. ТГФ отгонялся при пониженном давлении, и остаток подвергался колоночной хроматографии на силикагеле, давая 3,8 г (10,0 ммоль) соединения 1642. Ссылочный пример 2. Данный пример является примером получения хлоргидрата этил 2-хлор-4-фтор-5 гидразинобензоата, используемого в примере получения 20. Сначала 50 г (0,29 моль) 2-хлор-4 фторбензойной кислоты растворялось в 150 мл соляной кислоты при комнатной температуре, к ней добавлялось по каплям при 35-45 С смешанная кислота из 28 мл (0,31 моль) дымящей азотной кислоты и 56 мл концентрированной серной кислоты. Затем раствор перемешивался при 40 С в течение 1 ч и выливался в 250 мл смеси льда и воды. Выпавшие в осадок кристаллы собирались фильтрованием и перекристаллизовывались из смешанного раствора гексана и этилацетата, что давало 55 г (0,25 моль) 2-хлор 4-фтор-5-нитробензойной кислоты. Затем 55 г(0,25 моль) 2-хлор-4-фтор-5-нитробензойной кислоты растворялось в 50 мл этилацетата, к которому добавлялось 33 г (0,28 моль) тионилхлорида, и смесь нагревалась в условиях дефлегмации в течение 3 ч, и затем оставлялась стоять для охлаждения до комнатной температуры. Затем 20 мл этанола и 30 мл триэтиламина добавлялись при охлаждении льдом, и смесь перемешивалась при комнатной температуре в течение 2 ч. Растворитель отгонялся, и остаток очищался с помощью колоночной хроматографии на силикагеле, что давало 57 г (0,23 моль) этил 2-хлор-4-фтор-5-нитробензоата. Затем смешивались 60 г порошка железа и 500 мл 10% уксусной кислоты, и смесь нагревалась до 40 С. Отдельно 50 г (0,20 моль) этил 2 хлор-4-фтор-5-нитробензоата растворялось в смешанном растворе 20 мл уксусной кислоты и 20 мл этилацетата и к вышеуказанному раствору добавлялся по каплям смешанный раствор порошок железа-уксусная кислота. Затем реакционная смесь перемешивалась при 50 С в течение 1 ч и фильтровалась через целит. Фильтрат экстрагировался 100 мл этилацетата. Этилацетатный слой промывался водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия и сушился сульфатом магния. Растворитель отгонялся, и остаток очищал 000868 60 ся с помощью хроматографии на силикагеле,что давало 40 г (0,18 моль) этил 5-амино-2-хлор 4-фторбензоата. Затем 19 г (87,4 ммоль) этил 5-амино-2 хлор-4-фторбензоата растворялось в 120 мл соляной кислоты с последующим охлаждением до 0 С, к смеси при температуре 10 С или ниже добавлялся по каплям раствор 6,3 г (91,7 ммоль) нитрита натрия, растворенного в 10 мл воды. Смесь перемешивалась при 0 С в течение 30 мин и затем охлаждалась до -30 С, в нее выливался раствор 58 г (0,31 моль) безводного хлорида олова (II), растворенного в 40 мл соляной кислоты, с последующим дополнительным перемешиванием при 0 С в течение 3 ч. Выпавшие в осадок кристаллы собирались фильтрованием и затем сушились, давая 13,6 г (50,7 ммоль) неочищенного хлоргидрата этил 2-хлор-4-фтор-5 гидразинобензоата. Пример получения 21 (Получение соединения 1-1789). Сначала 5,0 г (15,5 ммоль) соединения 1391 растворялось примерно в 50 мл ДМФ, к смеси при комнатной температуре добавлялось 2.8 г (20,2 ммоль) карбоната калия, а затем 1,5(17,1 ммоль) 3-бром-2-метил-1-пропена, и смесь перемешивалась при комнатной температуре в течение 30 мин с последующим добавлением 100 мл воды. Выпавшие в осадок кристаллы собирались фильтрованием, промывались гексаном и перекристаллизовывались из изопропанола, давая 4,4 г (13,2 ммоль) соединения 11789. Пример получения 22 (Получение соединения 4-451). Сначала 4,0 г (12,0 ммоль) соединения 11789 растворялось в 20 мл N,N-диметиланилина, и раствор нагревался при 180 С в течение 3 ч. После охлаждения до комнатной температуры добавлялось 100 мл этилацетата, и смесь промывалась 1 норм. водной соляной кислотой и насыщенным раствором хлористого натрия и сушилась сульфатом магния. Растворитель отгонялся, и выпавшие в осадок кристаллы перекристаллизовывались из изопропанола, давая 3,4 г (10,2 ммоль) 2-[4-хлор-6-фтор-3-гидрокси 2-(2-метил-2-пропенил)]-4-метил-5-трифторметилпиридазин-3-она, т.пл. 133,2 С. Продукт растворялся в 30 мл ксилола, к нему добавлялось каталитическое количество nтолуолсульфоновой кислоты, и смесь нагревалась в условиях дефлегмации в течение 1 ч. После охлаждения до комнатной температуры добавлялось 100 мл этилацетата, и смесь промывалась водным раствором бикарбоната натрия и раствором хлористого натрия, и сушилась сульфатом магния; растворитель отгонялся, и оста
МПК / Метки
МПК: C07C 251/76, A01N 43/58, C07D 237/14
Метки: использование, промежуточные, соединения, качестве, получения, пиридазин-3-она, производные, гербицидов
Код ссылки
<a href="https://eas.patents.su/30-868-proizvodnye-piridazin-3-ona-ih-ispolzovanie-v-kachestve-gerbicidov-i-promezhutochnye-soedineniya-dlya-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридазин-3-она, их использование в качестве гербицидов и промежуточные соединения для их получения.</a>
Предыдущий патент: Циклическое соединение, способ его получения и способ получения смеси диастереомеров
Следующий патент: Синергетические гербицидные смеси, содержащие циклогексеноноксимовые эфиры
Случайный патент: Применение cci-779 в качестве противоопухолевого средства


































