Циклическое соединение, способ его получения и способ получения смеси диастереомеров
Номер патента: 867
Опубликовано: 26.06.2000
Авторы: Тодзо Тосиаки, Симизу Садахиро, Ебата Тутому, Хираи Кеиити, Охта Наоки, Саито Татсуру, Акиба Тосифуми
Формула / Реферат
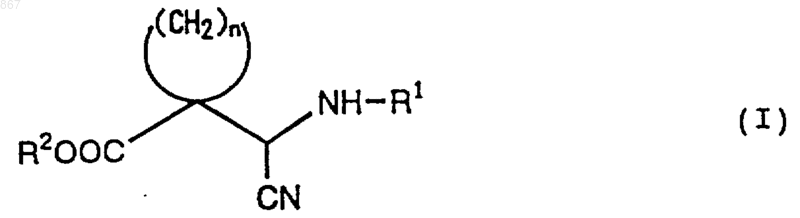
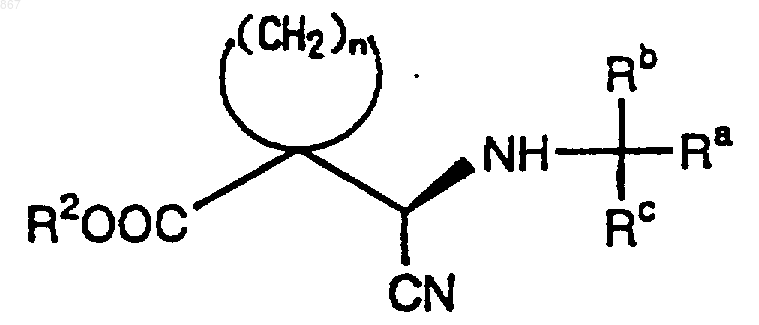
1. Циклическое соединение, представленное формулой (I)
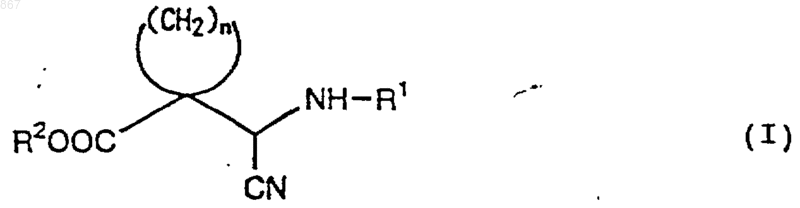
где n является целым числом от 2 до 5;
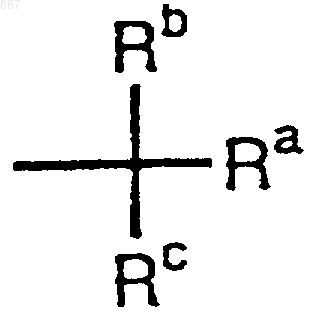
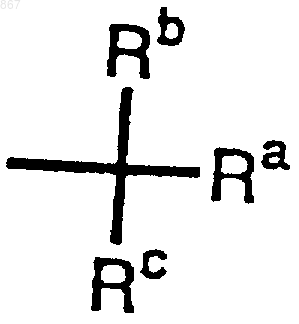
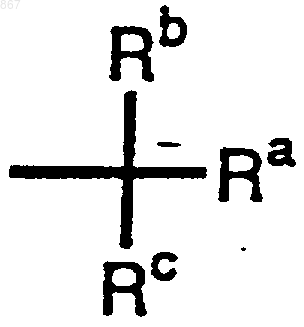
R1 представляет атом водорода или заместитель, изображаемый формулой
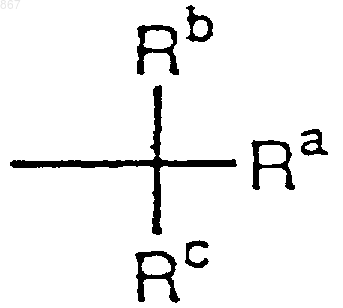
где каждый из Ra, Rb и Rc отличается один от другого и представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода; и
R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что исключается соединение, в котором n равен 2, R1 является атомом водорода и R2 представляет собой этильную группу, или его соль.
2. Соединение или его соль по п.1, отличающееся тем, что имеет конфигурацию
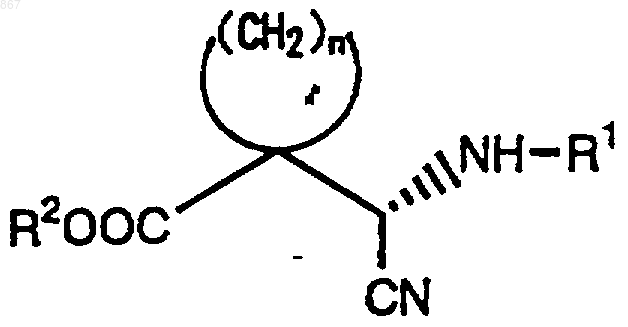
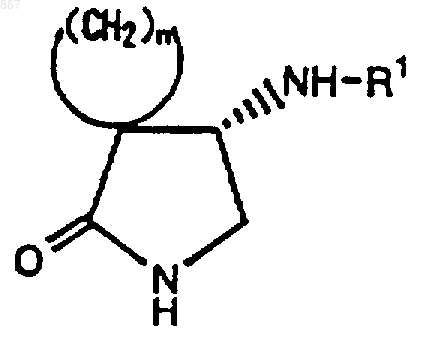
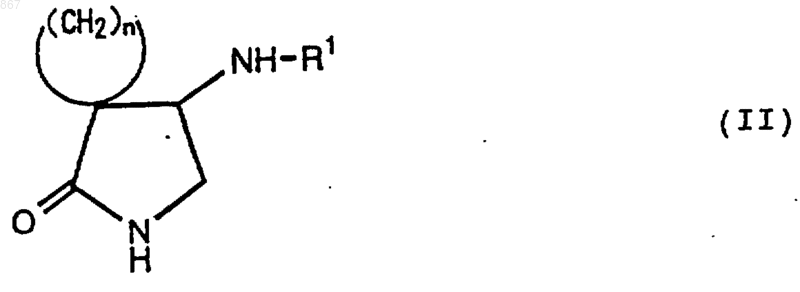
3. Циклическое соединение, представленное формулой (II)
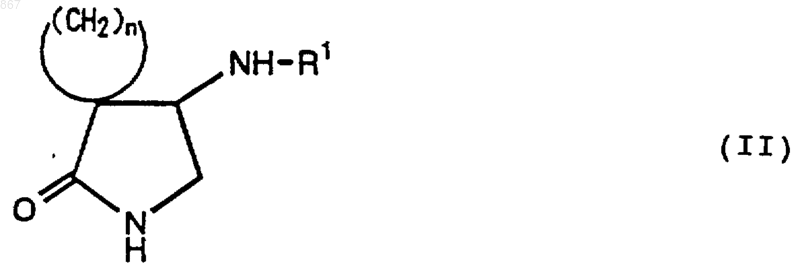
где n является целым числом от 2 до 5;
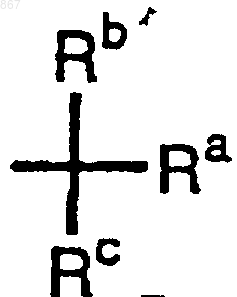
R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra , Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода; и его соль.
4. Соединение или его соль по п.3, отличающееся тем, что Ra, Rb и Rc отличаются один от другого.
5. Соединение или его соль по п.3 или 4, отличающееся тем, что имеет конфигурацию
6. Циклическое соединение, представленное формулой (III)

где n является целым числом от 2 до 5;
R11 представляет заместитель, изображаемый формулой
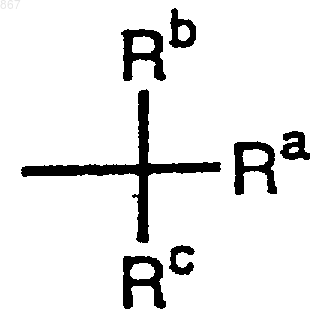
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc отличаются один от другого, и его соль.
7. Соединение или его соль по п.6, отличающееся тем, что имеет конфигурацию
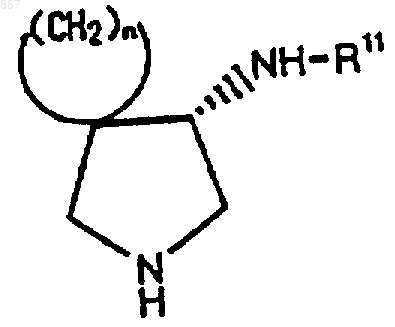
8. Способ получения циклического соединения, представленного формулой (I)
где n является целым числом от 2 до 5;
R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода, и
R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,
включающий взаимодействие соединения, изображаемого формулой (IV)

где n является целым числом от 2 до 5, и R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, с цианистым водородом в присутствии соединения, изображаемого формулой (V), или его соли,
NH2R1 (V),
где R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода.
9. Способ по п.8, отличающийся тем, что Ra, Rb и Rc отличаются один от другого.
10. Способ по п.9, отличающийся тем, что соединение формулы (V) является одним оптически активным соединением.
11. Способ получения циклического соединения, представленного формулой (II)
где n является целым числом от 2 до 5;
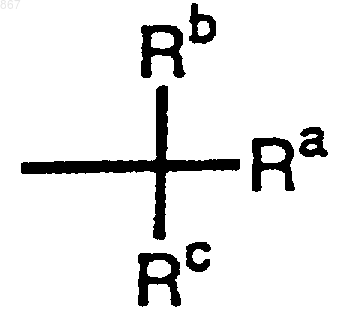
R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы , атом водорода или алкильную группу с 1-4 атомами углерода,
включающий восстановление цианогруппы соединения, изображаемого формулой (I)
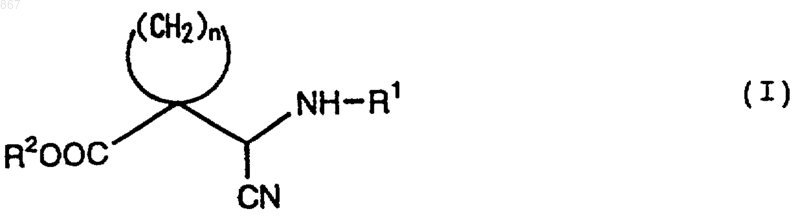
где n является целым числом от 2 до 5;
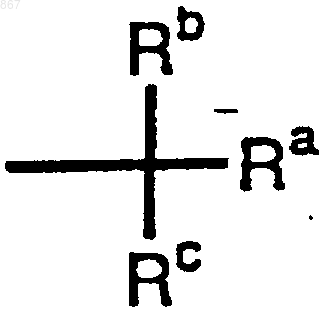
R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы; атом водорода или алкильную группу с 1-4 атомами углерода; и
R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,
и последующее осуществление циклизации получающегося в результате аминосоединения.
12. Способ по п.11, отличающийся тем, что Ra, Rb и Rc отличаются один от другого.
13. Способ по п.12, отличающийся тем, что соединение формулы (I) является одним оптически активным соединением.
14. Способ получения циклического соединения, представленного формулой (III-1)

где n является целым числом от 2 до 5;
R1 представляет атом водорода или заместитель, изображаемый формулой
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную шыш нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода,
включающий восстановление соединения, изображаемого формулой (II)
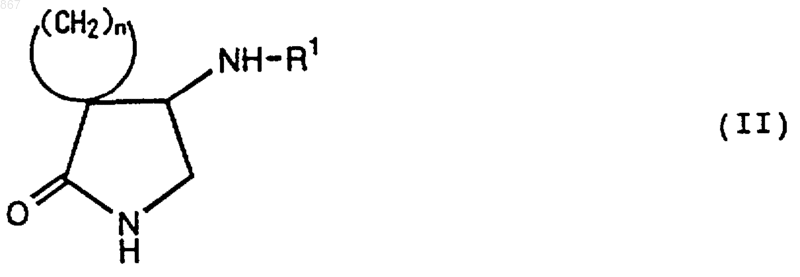
где n является целым числом от 2 до 5;
R1 представляет атом водорода или заместитель, изображаемый формулой
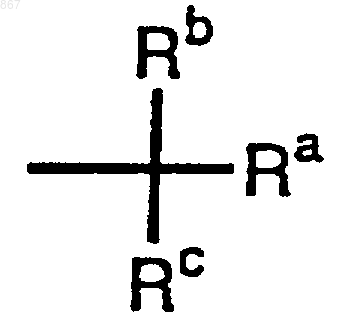
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода.
15. Способ по п.14, отличающийся тем, что Ra, Rb и Rc отличаются один от другого.
16. Способ по п. 15, отличающийся тем, что соединение формулы (II) является одним оптически активным соединением.
17. Способ получения циклического соединения, представленного формулой (VI), или его соли,

где n является целым числом от 2 до 5;
включающий удаление заместителя R12 из соединения формулы (III-2)

где n является целым числом от 2 до 5;
R12 представляет заместитель, изображаемый формулой
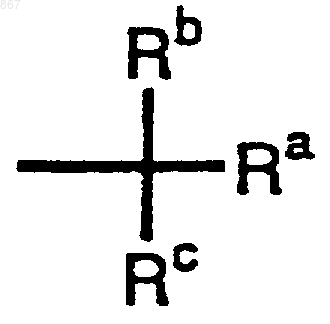
где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода.
18. Способ по п.17, отличающийся тем, что соединение формулы (III-2) является одним оптически активным соединением.
19. Способ получения смеси диастереомеров соединения, изображаемого формулой (I-1)
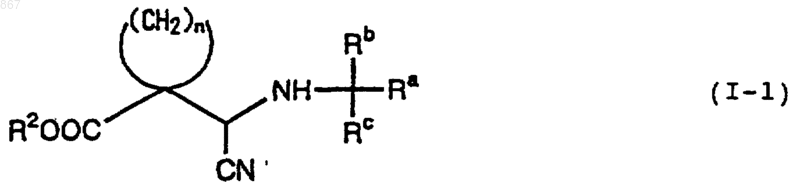
где n является целым числом от 2 до 5;
каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc отличаются один от другого; и
R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,
включающий обработку одного оптически активного соединения формулы (I-1) в протонном растворителе для осуществления его изомеризации.
20. Способ по п.19, отличающийся тем, что соединение формулы (I-1) имеет конфигурацию
21. Способ по п.19 или 20, отличающийся тем, что указанную обработку для изомеризации осуществляют в условиях нагревания.
22. Способ по п.21, отличающийся тем, что указанный протонный растворитель является этанолом.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новому соединению, применяемому при получении производного хинолина, которое, как ожидают,является превосходным антибактериальным средством, к промежуточному соединению и к новому способу синтеза упомянутых веществ с малым числом стадий и азотсодержащих гетероциклических соединений со спироциклической структурой, которые получают из соединения, изображаемого формулой (I), в частности,оптически активного производного азаспиро[2.4] гептана. Предпосылки создания изобретения Вышеуказанное соединение, изображаемое формулой (VI) где n является целым числом от 2 до 5,получают с помощью многостадийного способа с использованием в качестве исходного вещества этилацетоацетата (JP-А-2-231475). Кроме того, оптически активную форму этого соединения получают путем получения диастереомера с оптически активной защитной группой, выделения его с использованием препаративной высокоэффективной жидкостной хроматографии и последующего удаления защитной группы (JP-A-3-95176). Однако такой способ требует сложных операций, следовательно, остаются возможности для улучшения такого промышленного способа производства. Соответственно, целью настоящего изобретения является способ дешевого, с небольшим числом стадий и промышленно выгодного получения азотсодержащих гетероциклических соединений со спироциклической структурой, в частности, оптически активного производного азаспиро [2.4] гептана. Описание сущности изобретения Авторы настоящего изобретения провели интенсивные исследования и обнаружили, что соединение формулы (I) можно легко получить из известного соединения формулы (IV)(I), полученное таким образом, можно легко превратить в соединение формулы (II) На основе этих открытий осуществлено настоящее изобретение. Авторы настоящего изобретения также нашли способ, с помощью которого желаемое соединение формулы (VI) можно легко получить из соединения формулы которое получают путем восстановления соединения формулы (II). Авторы настоящего изобретения также обнаружили, что когда соединение (IV) вводят в реакцию с цианистым водородом в присутствии оптически активного амина или его соли, получают преимущественно один из образовавшихся при этом двух диастереомеров. Авторы настоящего изобретения также обнаружили, что один из двух диастереомеров,полученных выше, легко эпимеризуется при обработке протонным растворителем, так что можно получить смесь двух диастереомеров. Соответственно, настоящее изобретение относится к соединению, изображаемому формулой (I)n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, приR2 представляет собой этильную группу, и к его солям. Настоящее изобретение также относится к соединению, изображаемому формулой (II)n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу(которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы), атом водорода или алкильную группу с 1-4 атомами углерода; и к его солям. Настоящее изобретение также относится к соединению, изображаемому формулой (III)R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода; который включает введение во взаимодействие соединения, изображаемого формулой где n является целым числом от 2 до 5, и R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, с цианистым водородом в присутствии соединения, изображаемого формулой (V)(V) или его соли,где R1 представляет атом водорода или заместитель, изображаемый формулойn является целым числом от 2 до 5; где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нит-рогруппы,атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc отличаются друг от друга, и к его солям. Настоящее изобретение также относится к способу получения соединения, изображаемого формулой (I) где n является целым числом от 2 до 5; где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы,состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода. Настоящее изобретение также относится к способу получения соединения, изображаемого формулой (II) где n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой 5 где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы,состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода,который включает восстановление цианогруппы соединения, изображаемого формулой (I) где n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Rа, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода и последующее осуществление циклизации получающегося в результате аминосоединения. Настоящее изобретение также относится к способу получения соединения, изображаемого формулой (III-I) где n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода,который включает восстановление только что описанного соединения формулы (II). 6 Настоящее изобретение также относится к способу получения соединения, изображаемого формулой (VI) где n является целым числом от 2 до 5,который включает удаление заместителяR12 из соединения формулы (III-2) где n является целым числом от 2 до 5; и где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода. Настоящее изобретение также относится к способу получения соединения, изображаемого формулой (I) где n является целым числом от 2 до 5,R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы,состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, диастереоселективным методом, а именно, методом, при котором получают, преимущественно,один из двух диастереомеров указанного соединения, который включает введение во взаимодействие соединения, изображаемого формулой где n является целым числом от 2 до 5, и R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, с цианистым водородом в присутствии одной оптически активной формы соединения, изображаемого формулой (V)(V),или его соли,где R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильнуто группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нит-рогруппы,атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода. Настоящее изобретение также относится к способу получения смеси диастереомеров соединения, изображаемого формулой (I-1) где n является целым числом от 2 до 5; каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена, и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода; и R представляет атом водорода или алкильную группу с 1-4 атомами углерода,который включает обработку одного оптически активного соединения формулы (I-1) в протонном растворителе для осуществления его изомеризации. Далее настоящее изобретение будет описываться подробнее. Термин "одно оптически активное соединение", использованный здесь,означает, что соединение состоит из любого одного из множества оптических изомеров, когда они существуют, и включает не только соединение, полностью свободное от других оптических изомеров, но также соединение, являющееся по степени чистоты химически чистым. Иными словами, оно может содержать другие оптические изомеры, при условии, что 8 они не оказывают влияния на физические константы и физиологическую активность соединения. В первую очередь описывается соединение настоящего изобретения, изображаемое формулой (I) В этой формуле n является целым числом от 2 до 5, а заместитель R1 представляет собой атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода. Когда заместитель R1 представляет собой заместитель, изображаемый формулой он может являться любой группой, которая не изменяется при реакции конверсии цианогруппы соединения формулы (I) в аминометильную группу, но, предпочтительно, является группой,в которой Ra, Rb и Rc отличаются один от другого. Иллюстративными примерами в таком случае являются (R)- и (S)-1-фенилэтил, (R)- и (S)1-фенилпропил, (R)- и (S)-1-фенил-2-(п-толил) этил, (R)- и (S)-1-(1-нафтил)этил и подобные группы. Из этих групп предпочтительной, с учетом простоты и легкости получения, является (R)(S)-1-фенилэтильная группа, а ее фенильная группа может иметь другие заместители. Например, это может быть по меньшей мере один заместитель, выбираемый из группы, состоящей из алкильной группы с 1-4 атомами углерода,алкоксильной группы с 1-4 атомами углерода,атома галогена и нитрогруппы. Иллюстративными примерами таких групп являются (R)- и(S)-1-(2,4-динитрофенил)этил, (R)- и (S)-1-(3,5 дихлорфенил)этил, (R)- и (S)-1-(3,5-динитрофенил)этил и подобные группы. Заместитель R1 может являться группой,защитной для аминогруппы. В таком случае, R1 может являться защитной группой, которая не изменяется при реакции конверсии цианогруппы соединения формулы (I) в аминоме 9 тильную группу. Иллюстративными примерами таких групп, защищающих аминогруппу, являются алкоксикарбонильные группы, такие как трет-бутоксикарбонил, 2,2,2-трихлорэтоксикарбонил и подобные группы, аралкилоксикарбонильные группы, такие как бензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил и подобные группы, алифатические или ароматические ацильные группы, такие как ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и подобные группы, и аралкильные группы, такие как бензил, п-нитробензил, п-метоксибензил, трифенилметил и подобные группы. Среди таких защитных групп предпочтительными являются аралкильные группы - в связи с простотой и легкостью получения. Предпочтительной из этих групп является бензильная группа. Фенильная группа бензильной группы может также иметь заместители. Например, она может содержать, по меньшей мере,один заместитель, выбираемый из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы. Иллюстративными примерами таких групп, отличающихся от бензильной группы, являются 4 метоксибензил, 4-хлорбензил, 4-нитробензил,2,4-дихлорбензил,2,4-динитробензил,3,5 дихлорбензил, 3,5-динитробензил и подобные группы. Заместитель R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, но "алкильная группа" может быть линейной или разветвленной алкильной группой. Кроме того, заместитель R2 не ограничивается всегда такой алкильной группой, при условии, что она функционирует как отщепляющая группа. Далее описывается соединение настоящего изобретения, изображаемое формулой (II) В этой формуле n является целым числом от 2 до 5, а заместитель R1 представляет собой атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы,состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода. В качестве заместителя формулы могут использоваться те же группы, которые описаны при рассмотрении соединения формулы (I). Кроме того, заместитель R1 может представлять собой группу, защитную для аминогруппы, как и в соединении формулы (I). Далее описывается соединение, изображаемое формулой (III) В этой формуле n является целым числом от 2 до 5, а заместитель R11 представляет собой заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы,состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы , атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc отличаются один от другого. Иллюстративными примерами заместителя, изображаемого формулой являются (R)- и (S)-1-фенилэтил, (R)- и (S)-1 фенилпропил, (R)- и (S)-1-фенил-2-(п-толил) этил, (R)- и (S)-1-(1-нафтил) этил и подобные группы. Из этих групп предпочтительной, с учетом простоты и легкости получения, является (R)или (S)-1-фенилэтильная группа, а ее фенильная группа может иметь другие заместители. Например, это может быть, по меньшей мере, один заместитель, выбираемый из группы, состоящей из алкильной группы с 1-4 атомами углерода,алкоксильной группы с 1-4 атомами углерода,атома галогена и нитрогруппы. Иллюстративными примерами таких групп являются (R)- и(S)-1-(2,4-динитрофенил)этил, (R)- и (S)-1-(3,5 дихлорфенил)этил, (R)- и (S)-1-(3,5-динитрофенил)этил и подобные группы. Далее описывается способ получения соединений настоящего изобретения, в первую очередь, соединения, изображаемого формулой В соответствии с настоящим изобретением, соединение, изображаемое приведенной далее формулой (IV-2), используют для синтеза одного из соединений формулы (I), в котором n равен 2, а это исходное соединение можно синтезировать известным способом. Например, его можно получить из эфира 1-цианоциклопропанкарбоновой кислоты по приведенной далее реакционной схеме, когда используют способ,описанный Meyers et al., (J.Org. Chem., 1973, 38,36). Получение соединения формулы (I) из соединения формулы (IV) можно осуществить путем введения во взаимодействие соединения формулы (IV) с цианистым водородом в присутствии соединения, изображенного формулой (V)(V) или его соли,где R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы , атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra,Rb и Rc не являются одновременно атомами водорода. Примерами солей в таком случае являются соли присоединения кислот, такие как гидрохлориды, гидробромиды, нитраты и подобные соли неорганических кислот. Каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена по меньшей мере одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, и Ra, Rb и Rc, предпочтительно, могут отличаться один от другого. Иными словами, предпочтительно соединение с асимметричным атомом углерода, как соединение формулы (V). Более предпочтителен любой из двух оптических изомеров, а именно, одно оптически активное соединение. 12 Иллюстративными примерами соединения формулы (V) являются (R)- и (S)-1-фенилэтиламин, (R)- и (S)-1-фенилпропиламин, (R)- и(S)-1-фенил-2-(n-толил)этиламин, (R)-и (S)-1-(1 нафтил)этиламин, (R)- и (S)-1-(4-метоксифенил) этиламин, (R)- и (S)-1-(4-хлорфенил) этиламин,(R)- и (S)-1-(4-нитрофенил) этиламин, (R)- и (S)1-(2,4-дихлорфенил)этиламин, (R)-и (S)-1-(2,4 динитрофенил)этиламин, (R)- и (S)-1-(3,5 дихлорфенил)этиламин, (R)- и (S)-1-(3,5 динитрофенил)этиламин и подобные группы. Цианистый водород, который используют в этой реакции, можно генерировать вне реакционной системы и вводить в реакционную систему, или генерировать непосредственно в реакционной системе. Его получение в реакционной системе можно осуществить с применением реакции обмена соли - цианида калия, цианида натрия, цианида лития и подобных цианидов щелочных металлов - с различными веществами кислотной природы, как правило, с хлористоводородной кислотой, в воде. С другой стороны,его можно генерировать, добавляя гидросульфит натрия или подобный восстановитель к только что описанным цианидам щелочных металлов. В этой связи, вместо цианистого водорода можно использовать триметилсилилцианид или подобный органический цианид, или цианид диэтилалюминия или подобный металлоорганический цианид. В этой реакции можно использовать любой растворитель, при условии, что он инертен в отношении реакции, предпочтительно, воду или растворитель, который смешивается с водой. Примерами растворителей, смешивающихся с водой, являются спирты, такие как метанол,этанол, пропанол, изопронол и подобные спирты, простые эфиры, такие как тетрагидрофуран,диоксан и подобные эфиры, кетоны, такие как ацетон и подобные кетоны, и азотсодержащие растворители, такие как ацетонитрил и подобные растворители. При необходимости, эти растворители можно использовать в виде растворителей, содержащих воду. Эту реакцию осуществляют при температуре приблизительно от 20 до 100 С, предпочтительно от 50 С до температуры кипения используемого растворителя. Когда эту реакцию осуществляют с одним оптически активным амином, продукт представляет смесь двух диастереомеров, но один из диастереомеров образуется предпочтительнее,чем другой. Иными словами, такая реакция является диастереоселективной реакцией. Например, когда в качестве амина используют (S)-1 фенилэтиламин, продукт представляет смесь 1[(S)-1-циано-[(S)-1-фенилэтиламино]-метил)-1 этоксикарбонилциклопропана и его диастереомера 1-[(R)-1-циано-[(S)-1-фенилэтиламино] метил]-1-этоксикарбонилциклопропана при соотношении образования 73:27. В этой связи,когда используют (R)-1-фенилэтиламин, про 13 дукт представляет смесь 1-[(S)-1-циано-[(R)-1 фенилэтиламино]метил]-1-этоксикарбонилциклопропана и его диастереомера 1-[(R)-1-циано[(R)-1-фенилэтиламино]метил]-1-этоксикарбонилциклопропана, а соотношение при образовании соединений составляет 3:7. Полученные таким образом два диастереомера можно разделить с помощью обычно применяемых способов, таких как колоночная хроматография на силикагеле, тонкослойная хроматография, высокоэффективная жидкостная хроматография и подобных способов. Из разделенных таким образом оптических изомеров изомер, который не требуется, можно превратить в смесь диастереомеров, содержащую нужный изомер, обрабатывая его в протонном растворителе, для легкого осуществления эпимеризации, т.е. конвертируя конфигурацию атома углерода, связанного с цианогруппой. Затем соединение с нужной конфигурацией можно отделить от смеси. Такую обработку можно осуществить при нагревании. Можно использовать любой протонный растворитель, при условии, что он инертен в отношении соединения, причем его предпочтительными примерами являются метанол,этанол, пропанол, изопропанол и подобные спирты. Можно также использовать смесь этих протонных растворителей с другими растворителями. Примерами таких растворителей являются простые эфиры, такие как тетрагидрофуран и подобные эфиры, кетоны, такие как ацетон и подобные кетоны, азотсодержащие растворители, такие как ацетонитрил и подобные растворители, ароматические углеводороды, такие как толуол и т.п., и алифатические углеводороды, такие как гексан и подобные алифатические углеводороды. Иными словами,когда полученный выше 1-[(R)-1-циано-[(S)-1 фенилэтиламино]метил]-1-этоксикарбонилциклопропан кипятят с обратным холодильником в течение 30 мин в этаноле, он становится смесью 1-[(S)-1-циано-[(S)-1-фенилэтиламино]метил]-1 этоксикарбонилциклопропана и 1-[(R)-1-циано[(S)-1-фенилэтиламино]-метил]-1-этоксикарбонилциклопропана при соотношении 73:27. Таким образом, его можно легко перевести в оптически активную форму с любой одной конфигурацией. В этой связи, соединение формулы (I), в котором заместитель R1 является алкоксикарбонильной группой, аралкилоксикарбонильной группой или алифатической или ароматической ацильной группой, можно легко получить путем конверсии из соединения формулы (I), в котором R1 является атомом водорода, с помощью обычно используемой реакции замещения. Далее описывается способ получения соединения формулы (II) из соединения формулы(I). Соединение формулы (II) можно получить посредством восстановления цианогруппы со 000867 14 единения формулы (I) и последующего осуществления циклизации образовавшегося таким образом аминосоединения. Восстановление и циклизацию можно осуществить, восстанавливая исходное соединение в атмосфере водорода в присутствии катализатора и осуществляя, затем, конденсационную циклизацию при непрерывном нагревании. С другой стороны, аминосоединение приведенной далее формулы, полученное реакцией восстановления, можно сразу выделить и затем нагревать для осуществления циклизации. Можно использовать любую реакцию, при условии, что при этой реакции не затрагивается сложный эфир и R1, а цианогруппа может восстановиться до аминометильной группы. Примерами таких реакций являются реакция каталитического гидрирования, при которой используются палладированный углерод, никель Ренея и подобные катализаторы, из которых особенно предпочтительна реакция с использованием никеля Ренея. При таком взаимодействии можно использовать любой растворитель, при условии, что он инертен в отношении реакции. Предпочтительными примерами таких растворителей являются метанол, этанол, пропанол, изопропанол и подобные спирты, и 1,4-диоксан и подобные простые эфиры. Эти растворители могут использоваться с растворением в них аммиака. В зависимости от требований, такие растворители можно использовать в смеси с водой. Растворитель,содержащий аммиак, можно получить путем растворения в растворителе газообразного аммиака или путем смешивания его с водным раствором аммиака. Реакцию каталитического гидрирования осуществляют при температуре приблизительно от 0 до 40 С, предпочтительно -от 5 С до комнатной температуры. Реакцию циклизации осуществляют при температуре приблизительно от 0 до 200 С, предпочтительно от комнатной температуры до 180 С. Давление газообразного водорода в процессе каталитического гидрирования может составлять от 1 до 100 атмосфер,предпочтительно от 20 до 70 атмосфер. Когда реакцию каталитического гидрирования осуществляют приблизительно при комнатной температуре, иногда может оказаться необходимым осуществление реакции циклизации путем непрерывного нагревания реакционной системы при температуре от 50 до 180 С. Далее описывается способ получения соединения формулы (III-1) из соединения формулы (II). Соединение формулы (III-1) можно получить путем восстановления соединения формулы (II). Вообще, карбонильную часть амидной группы восстанавливают путем взаимодействия 15 с ней гидрирующего агента. Примерами гидрирующего агента для использования в этой реакции являются алюмогидридные соединения,такие как алюмогидрид лития, алюмобис(2 метоксиэтокси)гидрид натрия и подобные соединения, и различные соединения бора (например, диборан, и подобные соединения), которые используются в системе сочетания борогидрида натрия с метансульфоновой кислотой,трифторид бора и подобные соединения, из которых особенно предпочтительными являются алюмогидрид лития и алюмобис(2-метоксиэтокси)гидрид натрия. Это взаимодействие обычно осуществляют в присутствии растворителя, который особо не ограничивается, при условии, что он инертен для реакции. Примерами растворителя являются диэтиловый эфир, тетрагидрофуран и подобные простые эфиры, и толуол и подобные углеводородные растворители, из которых предпочтительным является тетрагидрофуран. Это взаимодействие осуществляют при температуре от 0 С до температуры кипения используемого растворителя, предпочтительно от комнатной температуры до 100 С. Далее описывается способ получения соединения формулы (VI) из соединения формулы(III-2). Соединение формулы (VI) можно получить путем удаления из соединения формулы(III-2) посредством его каталитического гидрирования или кислотного гидролиза. Например, когда используют каталитическое гидрирование, в качестве катализатора можно использовать палладированный углерод,гидроксид палладия, никель Ренея и подобные катализаторы, из которых особенно предпочтительными являются палладированный углерод и гидроксид палладия. При этой реакции можно использовать любой растворитель, при условии,что он инертен в отношении реакции. Предпочтительными примерами растворителя являются метанол, этанол, пропанол, изопропанол и подобные спирты, и тетрагидрофуран и подобные простые эфиры. Эти растворители можно использовать с добавлением воды. При необходимости, эти растворители можно использовать с добавлением уксусной кислоты, хлористоводородной кислоты и подобных кислот. Это взаимодействие осуществляют при температуре от 0 С до 100 С, предпочтительно от 5 до 50 С. Давление газообразного водорода при указанной реакции может находиться в пределах от 1 до 100 атмосфер, предпочтительно от 1 до 50 атмосфер. Вышеуказанные способы можно суммировать в следующем виде (например, в случае,когда R2 является этильной группой). Оптически активную форму (антипод) соединения, изображаемого формулой (VI) можно получить по приведенной ниже схеме Иными словами, соединение формулы (I) получают путем взаимодействия соединения формулы (IV) с цианистым водородом в присутствии одного оптически активного соединения формулы (V) или его соли. Термин "одно оптически активное соединение соединения формулы (V)" обозначает любой из двух оптических изомеров, когда они существуют в соединении формулы (V), в которых Ra, Rb и Rc отличаются один от другого. Когда такое взаимодействие осуществляют с одним оптически активным амином, как показано выше, соединение формулы (I) образуется в виде смеси двух диастереомеров, но развивается диастереоселективная реакция, и один из диастереомеров образуется в преимущественном количестве по сравнению с другим. Полученные таким образом два диастереомера можно разделить с помощью обычно применяемых средств и получить только необходимый оптический изомер. В этой связи, один из полученных таким образом оптически активных изомеров, который не является необходимым, можно легко превратить в нужный изомер, осуществляя эпимеризацию в протонном растворителе,т.е., конверсией конфигурации атома углерода,связанного с цианогруппой, так что возможно получение только одного оптически активного вещества с любой одной конфигурацией. 17 Затем, путем восстановления цианогруппы полученного таким образом одного оптически активного соединения формулы (I) получают соединение формулы (II) в виде одного оптически активного соединения, а затем осуществляют циклизацию полученного таким образом аминосоединения. Затем, путем восстановления полученного таким образом одного оптически активного соединения формулы (II) получают соединение формулы (III-1) в виде одного оптически активного соединения. Наконец, подвергая одно оптически активное соединение формулы (III-2) каталитическому гидрированию или кислотному гидролизу,получают соединение формулы (VI) в виде одного оптически активного соединения. С другой стороны, оптически активную форму (антипод) соединения формулы (VI) можно также получить путем образования солей диастереомеров рацемата соединения, изображаемого формулой (VI), с оптически активной кислотой, такой как винная кислота, и последующего осуществления оптического расщепления. Так как соединение формулы (VI) является двухосновным соединением, получают две диастереомерные соли [соединение (VI): винная кислота = 1:1, и соединение (VI): винная кислота = 1:2], которые можно получить селективно. Например, (S)-форму соединения формулы (VI) можно получить путем образования его соли 1:1 с D-винной кислотой и выделения указанной соли путем рекристаллизации для осуществления оптического расщепления. Примерами предпочтительных растворителей, которые используют в этом случае, являются метанол, этанол и подобные спиртовые растворители, которые можно использовать одни или в смеси с водой. Полученное таким образом соединение формулы (VI) можно вводить в отличное антибактериальное средство по способу, описанному в JP-A-2-231475 и JP-A-3-95176. Наилучшие варианты осуществления настоящего изобретения Ниже приводятся примеры осуществления настоящего изобретения как иллюстрации, но не как ограничения. Пример 1. 1-(1-Амино-1-цианометил)-1 этоксикарбонилциклопропан В колбу типа "баклажан" загружают 3,49 г цианида калия и 3,74 г хлорида аммония, исодержимое растворяют в 20 мл воды. После добавления к раствору 40 мл концентрированного водного раствора аммиака к нему же, по каплям,при комнатной температуре, добавляют 5,01 г этил-1-формилциклопропан-1-карбоксилата,растворенного в 30 мл этанола, и реакционный раствор перемешивают в течение 2 ч при 50 С. Убедившись в полноте осуществления реакции,реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем по 000867 18 лучающийся в результате органический слой промывают водой и рассолом, сушат над безводным сульфатом магния, и после удаления нерастворимого вещества фильтрацией концентрируют при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле(3 Н, т, J= 7,3 Гц), 1,40-1,44 (2 Н, м), 2,03 (2 Н,ушс), 3,61 (1 Н, с), 4,21 (2 Н, к, J=7,3 Гц). ИК (КВr) см-1: 2988, 1724, 1378, 1192. М.с. (m/z): 169, 128. Пример 2. 1-(1-Бензиламино-1-цианометил)-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 131 мг цианида калия и 539 мг бензиламина, и содержимое диспергируют в 1 мл воды. Добавляют к этой смеси, по каплям и при комнатной температуре,146 мг этил-1-формилциклопропан-1-карбоксилата, растворенного в 2 мл этанола, а затем добавляют по каплям 0,2 мл концентрированной соляной кислоты. Реакционный раствор перемешивают в течение 2,5 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают рассолом, сушат над безводным сульфатом натрия, и, после удаления нерастворимого вещества фильтрацией, концентрируют при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагелеM.c. (m/z): 259, 232, 106, 91. Пример 3. 1-(1-Бензиламино)-1-цианометил)-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 501 мг этил-1-формилциклопропан-1-карбоксилата и 2 мл воды, к которым затем добавляют 1,13 г гидросульфита натрия и 345 мг цианида калия. Добавляют к этой смеси, по каплям и при комнатной температуре, 564 мг бензиламина, растворенного в 5 мл этанола, а затем реакционный раствор перемешивают в течение 2,5 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают рассолом, сушат над безводным сульфатом магния, и, после удаления не 19 растворимого вещества фильтрацией, концентрируют при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле(79%) названного в заголовке соединения в виде бесцветного масла. Спектральные данные полученного таким образом маслянистого продукта соответствуют результатам для соединения примера 2. Пример 4. 1-(1-трет-Бутоксикарбониламино-1-цианометил)-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 100 мг 1-(1-амино-1-цианометил)-1-этоксикарбонилциклопропана, который затем растворяют в 1 мл толуола. Затем, при охлаждении на ледяной бане, добавляют 300 мг ди-трет-бутилдиткарбоната и 0,2 мл триэтиламина, после чего перемешивают в течение 5 ч при комнатной температуре. После завершения реакции, реакционный раствор промывают насыщенным водным раствором лимонной кислоты и рассолом,сушат над безводным сульфатом натрия, и, после удаления нерастворимого вещества фильтрацией, концентрируют при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан:этилацетат = 5:1) и получают 112 мг (70%) названного в заголовке соединения в виде бесцветного масла. 1(3 Н, т, J=7,3 Гц), 1,46(9 Н, с), 4,08-4,09 (3 Н, м),5,78 (1 Н, уш). Пример 5. 7-Амино-4-оксо-5-азаспиро[2.4] гептан. Загружают в автоклав 1,0 г 1-(1-амино-1 цианометил)-1-этоксикарбонилциклопропана,0,4 мл никеля Ренея и 4,0 мл насыщенного аммиаком этанола, и содержимое перемешивают при 80 С в течение 4 ч в атмосфере водорода при давлении 20 кг/см 2. После завершения реакции катализатор удаляют путем фильтрации и получающийся в результате фильтрат концентрируют при пониженном давлении. Получают 692 мг (92%) названного в заголовке соединения в виде бесцветных кристаллов. Полученный таким образом продукт перекристаллизовывают из этилацетата и диэтилового эфира и используют как образец для анализа. Т.пл. 97-99 С. 1M.c. (m/z): 127,110. Элементный анализ для С 6 Н 10N20 : вычислено (%): C 57,12; H 7,99; N 22,21; найдено (%): C 57,00; H 7,83; N 22,18. 20 Пример 6. 7-Бензиламино-4-оксо-5-азаспиро[2.4]гептан. Загружают в автоклав 61,3 мг 1-(1 бензиламино-1-цианометил)-1-этоксикарбонилциклопропана, 0,2 мл никеля Ренея и 2,0 мл насыщенного аммиаком этанола, и содержимое перемешивают при комнатной температуре в течение 2 ч в атмосфере водорода при давлении 30 кг/см 2. После завершения реакции катализатор удаляют путем фильтрации, и получающийся в результате фильтрат концентрируют при пониженном давлении. Получают 51,32 мг (количеств.выход) названного в заголовке соединения в виде светло-желтого масла. 1M.c. (m/z): 217, 91, 75. Пример 7. 7-трет-Бутоксикарбониламино 4-оксо-5-азаспиро[2.4]гептан. Загружают в автоклав 112 мг 1-(1-третбутоксикарбониламино-1-цианометил)-1-этоксикарбонилциклопропана, 0,5 мл никеля Ренея и 3,0 мл насыщенного аммиаком этанола, и содержимое перемешивают при 80 С в течение 2 ч в атмосфере водорода при давлении 65 кг/см 2. После завершения реакции катализатор удаляют путем фильтрации и получающийся в результате фильтрат концентрируют при пониженном давлении. Получают 86 мг (91%) названного в заголовке соединения в виде бесцветных кристаллов. Полученное таким образом соединение перекристаллизовывают из этилацетата и диэтилового эфира и используют как образец для анализа. Т.пл. 178-181 С. 1M.c. (m/z ): 227, 171,110. Элементный анализ для C11H18N2O3: вычислено (%): С 58,39; Н 8,01; N 12,38; найдено (%): С 58,22; Н 8,04; N12,19. Пример 8. п-Толуолсульфонат 7-амино-5 азаспиро[2.4]гептана. Загружают в колбу 50 мг 7-амино-4-оксо 5-азаспиро[2.4]гептана, и атмосферу в колбе замещают азотом. Затем добавляют 1,0 мл тетрагидрофурана для растворения соединения в колбе, к получающемуся в результате раствору добавляют, по каплям, при комнатной температуре, 2,0 мл алюмогидрида лития (1 М раствор в тетрагидрофуране), и затем смесь кипятят с обратным холодильником в течение 7,5 ч. Убедившись в завершении реакции, прекращают ее,добавляя насыщенный водный раствор хлорида аммония, и затем нерастворимое вещество уда 21 ляют фильтрацией. Получающийся в результате фильтрат концентрируют при пониженном давлении и получают 42,5 мг (95,7%) бесцветного маслянистого вещества. Полученное таким образом маслянистое вещество растворяют в этаноле и смешивают с 2 эквивалентами моногидрата п-толуолсульфоновой кислоты. После этого добавляют диэтиловый эфир, и выпавшие кристаллы перекристаллизовывают из этанола и диэтилового эфира, чтобы использовать в качестве образца для анализа. Т.пл. 232-238 С. 1(4 Н, д, J=8,3 Гц), 7,63 (4 Н, д, J=8,3 Гц). ИК (КВr) см-1: 2988, 1206, 1172, 1124, 682,568. Элементный анализ для C20H28N2O6S2: вычислено (%): C 52,61; Н 6,18; N 6,14; найдено (%): С 52,66; Н 6,19; N 6,19. Пример 9. (S)-7-Амино-5-азаспиро[2.4] гептан. Загружают в колбу 375 мг 7-амино-5 азаспиро[2.4]гептана, диспергируют в 22,0 мл метанола, и затем смешивают с 1,0 г D-винной кислоты, растворенной в 4,0 мл воды. Получающийся в результате раствор охлаждают на ледяной бане и при охлаждении вносят затравку и перемешивают все время, и затем выпавшие при этом кристаллы собирают фильтрацией. При трехкратном повторении этой стадии получают 361 мг (38,6%) бесцветных призматических кристаллов. Т.пл. 158-163 С. 1(4 Н, м), 3,07 (1 Н, д, J=12,2 Гц), 3,47-3,63 (3 Н, м),3,90 (1 Н, дд, J=7,3 и 13,9 Гц ), 4,19 (2 Н, с). ИК (КВr) см-1: 2928, 2832, 1628, 1574, 1396,1306, 1128, 610. Элементный анализ для С 10 Н 18N2O6H2O: вычислено (%): С 42,85; Н 7,19; N 9,99; найдено (%): С 42,95; Н 7,08; N 9,87. Оптическую чистоту полученного таким образом(S)-7-амино-5-азаспиро[2.4]гептана измеряют следующим образом. Порцию в 18 мг каждого полученного таким образом кристаллического соединения и его рацемат растворяют в 1 мл тетрагидрофурана и смешивают с 50 мг 3,5-динитробензоилхлорида. К этой смеси добавляют по каплям, при охлаждении на водяной бане 0,006 мл триэтиламина и затем перемешивают в течение 30 мин при комнатной температуре. Раствор смешивают с насыщенным водным раствором бикарбоната натрия и хлороформом, разделяют фазы, и получающийся в результате хлороформный слой анализируют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).(Условия ВЭЖХ) Колонка: SUMICHIRAL ОА-4600 ( 4,6 мм х 250 мм). Подвижная фаза: гексан:1,2-дихлорэтан: этанол =60:40:5. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания: (S)-форма - 6,8 мин,(R)-форма - 10,0 мин. Результаты анализа кристаллов: 6,8 мин (97%, (S) - форма); 10,0 мин (3%, (R) - форма). Пример 10. 1-[(RS)-1-Циано-[(S)-1-фенилэтиламино]метил]-1-этокси-карбонилциклопропан. Способ 1. В колбу типа "баклажан" загружают 134 мг цианида калия, 606 мг (S)-фенилэтиламина и 1 мл воды. После добавления по каплям и при комнатной температуре 142 мг этил-1 формилциклопропан-1-карбоксилата,растворенного в 2 мл этанола, получающуюся в результате смесь смешивают с 0,2 мл концентрированной хлористоводородной кислоты и перемешивают в течение 3 ч при той же температуре, а затем в течение 2,5 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают водой и рассолом и сушат над безводным сульфатом магния и после удаления нерастворимого вещества фильтрацией испаряют растворитель при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан: этилацетат=10:1), и получают 245 мг (87%) смеси диастереомеров в виде бесцветного масла. Способ 2. В колбу типа "баклажан" загружают 10 г этил-1-формил-циклопропан-1-карбоксилата, к которому затем добавляют, в указанном порядке и при 0 С, 12,8 г (S)-1-фенилэтиламина, растворенного в 100 мл этанола, 6,9 г цианида калия,растворенного в 40 мл воды, и 22 г гидросульфита натрия. Реакционную смесь перемешивают в течение 2 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают водой и рассолом и сушат над безводным сульфатом магния, и, после удаления нерастворимого вещества фильтрацией, испаряют раствритель при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан:этилацетат = 8:1), и получают 15,7 г (82%) смеси диастереомеров в виде бесцветного масла. Вычисляют соотношение образования двух диастере 23 омеров в указанных далее условиях анализа. Кроме того эти диастереомеры можно разделить тонкослойной хроматографией(Условия ВЭЖХ) Колонка: CHIRALCEL OJ ( 4,6 мм х 250 мм). Подвижная фаза: гексан:1,2-дихлорэтан: этанол:метанол = 500:10:1:1. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания: диастереомер A S)-(S)-форма) - 17 минM.c. (m/z ): 273, 246, 142, 105. Пример 11. 1-[(RS)-1-Циано-(S)-1-(1-нафтил)этиламино]метил]-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 426 мг этил-1-формилциклопропан-1-карбоксилата, к которому затем добавляют, в указанном порядке и при 0 С, 771 мг (S)-1-(1-нафтил) этиламина,растворенного в 5 мл этанола, 293 мг цианида калия, растворенного в 2 мл воды, и 937 мг гидросульфита натрия. Реакционную смесь перемешивают в течение 3,5 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают водой и рассолом и сушат над безводным сульфатом магния, и, после удаления нерастворимого вещества фильтрацией, испаряют растворитель при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан:этилацетат = 5:1), и получают 698 мг (72%) смеси диастереомеров в виде бесцветного масла. Вычисляют соотношение образования двух диастереомеров в указанных далее условиях анализа. 24 Подвижная фаза: гексан:1,2-дихлорэтан: этанол = 500:10:2. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания: диастереомер А - 31 мин (72%); диастереомер В - 40 мин (28%). 1(1 Н, ушк ), 7,42-8,38(7 Н, м). Пример 12. 1-[(RS)-1-Циано-[(S)-1-фенилпропиламино]метил]-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 136 мг цианида калия, 501 мг (S)-1-фенилпропиламина и 1 мл воды. После добавления, по каплям и при комнатной температуре, 152 мг этил-1 формилциклопропан-1-карбоксилата,растворенного в 2 мл этанола, получающуюся в результате смесь смешивают с 0,2 мл концентрированной соляной кислоты и перемешивают в течение 1 ч при той же температуре, а затем в течение 2 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают водой и рассолом и сушат над безводным сульфатом магния, и, после удаления нерастворимого вещества фильтрацией, испаряют растворитель при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан:этилацетат =1=:1) , и получают 181 мг (59%) смеси диастереомеров в виде бесцветного масла. Вычисляют соотношение образования двух диастереомеров при указанных далее условиях анализа.(Условия ВЭЖХ) Колонка: CHIRALCEL OJ ( 4,6 мм х 250 мм). Подвижная фаза: гексан:1,2-дихлорэтан: этанол = 500:10:2. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания: диастереомер А - 12 мин (72%); диастереомер В - 16 мин (28%). Диастереомер А. 1 25 Пример 13. 1-[(RS)-1-Циано-[(S)-1-фенил 2-п-толилэтиламино]метил]-1-этоксикарбонилциклопропан. В колбу типа "баклажан" загружают 133 мг цианида калия, 1,0 г (S)-1-фенил-2-п-толилэтиламина и 1 мл воды. После добавления, по каплям и при комнатной температуре, 146 мг этил 1-формилциклопропан-1-карбоксилата, растворенного в 2,5 мл этанола, получающуюся в результате смесь смешивают с 0,2 мл концентрированной соляной кислоты и перемешивают в течение 1 ч при той же температуре, а затем в течение 2 ч при 50 С. Убедившись в полноте осуществления реакции, реакционный раствор смешивают с водой со льдом и, экстрагируют этилацетатом. Затем получающийся в результате органический слой промывают водой и рассолом и сушат над безводным сульфатом магния, и, после удаления нерастворимого вещества фильтрацией, испаряют растворитель при пониженном давлении. После этого, получающийся в результате остаток подвергают колоночной хроматографии на силикагеле (гексан:этилацетат=10:1), и получают 251 мг (67%) смеси диастереомеров в виде бесцветного масла. Находят, основываясь на интегральном соотношении ЯМР, что соотношение двух диастереомеров составляет 4:1. 1 Н-ЯМР (СDСl3) : 0,62-0,88 (2 Н, м), 1,04(3 Н х 4/5, т, J=7,3 Гц), 1,11(3 Н х 1/5, т, J=7,3 Гц),1,25-1,45 (2 Н, м), 2,30(3 Н х 1/5, с), 2,32(3 Н х 4/5,с), 2,64(1 Н х 4/5, с), 2,73-3,03(2 Н, м), 3,06(1 Н х 1/5, с), 3,78-4,23(ЗН,м), 7,03-7,40(9 Н, м). Пример 14. Эпимеризация 1-[(R)-1-циано[(S)-1-фенилэтиламино]метил]-1-этоксикарбонилциклопропана. Порцию в 10 мг 1-[(R)-1-циано-[(S)-1 фенилэтиламино]метил]-1-этоксикарбонилциклопропана, полученного в изобретательском примере 10, смешивают с 1 мл этанола и кипятят с обратным холодильником в течение 30 мин. После завершения реакции реакционный раствор концентрируют при пониженном давлении и получают смесь диастереомеров 1-[(S)-1 циано-[(S)-1-фенилэтиламино]метил]-1-этоксикарбонилциклопропана и 1-[(R)-1-циано-[(S)-1 фенилэтиламино]метил]-1-этокси-карбонилциклопропана(Условия ВЭЖХ) Колонка: CHIRALCEL OJ ( 4,6 мм х 250 мм). Подвижная фаза: гексан:1,2-дихлорэтан: этанол:метанол= 500:1=:1:1. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания: диастереомер А S)-(S)-форма) - 17 мин(S)-7-[(S)-1-Фенилэтил]амино-4-оксо-5 азаспиро [2.4]гептан. В автоклав загружают 1,0 г 1-[(S)-1-циано[(S)-фенилэтиламино]метил]-1-этоксикарбонилциклопропана, 1,7 мл никеля Ренея и 17 мл насыщенного аммиаком этанола, и содержимое перемешивают при комнатной температуре в течение 1,5 ч в атмосфере водорода при давлении 35 кг/см 2. После завершения реакции катализатор удаляют с помощью фильтрации, а получающийся в результате фильтрат концентрируют при пониженном давлении. Получающийся в результате остаток растворяют в 20 мл этанола, помещают в автоклав и греют при 180 С в течение 8,5 ч. После завершения реакции удаляют растворитель при пониженном давлении, а получающийся в результате остаток смешивают с изопропанолом перемешивают и получают 621 мг (74%) названного в заголовке соединения в форме слегка желтоватых кристаллов. Полученное таким образом соединение перекристаллизовывают из этанола и изопропанола и используют в качестве образца для анализа. Т.пл. 126,5-127,5 С. 1(1 Н, к, J=6,6 Гц), 5,45 (1 Н, ушс), 7,21-7,34 (5 Н,м). Ту же реакцию осуществляют с использованием смеси диастереомеров, полученной в примере 10. Результаты анализа полученного таким образом продукта приводятся далее. Т.пл. 107-110,5 С. 1(1 Н х 27/100, д, J=6,6 Гц), 1,322 (1 Н х 73/100, д,J=6,6 Гц), 2,91 (1 Н х 27/100, дд, J=5,3 и 9,2 Гц),3,14 (1 Н х 73/100, дд, J =4,6 и 6,9 Гц), 3,24 (1 Н х 73/100, дд, J=4,6 и 9,2 Гц), 3,36 (1 Н х 27/100, дд,J=7,3 и 9,2 Гц), 3,44 (1 Н х 27/100, дд, J=5,3 и 7,3 Гц), 3,63 (1 Н, дд, J=6,9 и 9,2 Гц), 3,75 (1 Н х 27/100, к, J=6,6 Гц), 3,84 (1 Н х 73/100, к, J =6,6 Гц), 7,21-7,34 (5 Н, м). Пример 16. (S)-7-[(S)-1-фенилэтил]амино 5-азаспиро [2.4]гептан. В колбу загружают 200 мг (S)-7-[(S)-1 фенилэтил]амино-4-оксо-5-азаспиро[2.4]гептана и атмосферу в колбе заменяют на азот. Затем добавляют 5 мл тетрагидрофурана для растворения соединения в колбе, к получающемуся в результате раствору при 0 С добавляют по каплям 5,0 мл алюмогидрида лития (1 М раствор в тетрагидрофуране) и затем смесь кипятят с обратным холодильником в течение 1 ч. Убедившись в завершении реакции, реакцию прекращают, добавляя насыщенный водный раствор хлорида аммония и затем нерастворимое вещество удаляют путем фильтрации. Получающийся в результате фильтрат концентрируют при 27 пониженном давлении и обрабатывают этилацетатом и рассолом и образовавшийся органический слой сушат над безводным сульфатом натрия. После этого, удаляют нерастворимое вещество путем фильтрации, а получающийся в результате фильтрат концентрируют при пониженном давлении, и получают 181 мг (96%) бесцветного маслянистого вещества. 1H-ЯМР (СDCl3): 0,41-0,50(3 Н, м), 0,680,80 (1 Н, м), 1,32 (3 Н, д, J=6,6 Гц), 2,47 (1 Н, дд,J=3,3 и 5,0 Гц), 2,68 (1 Н, д, J=10,9 Гц), 3,10 (1 Н,дд, J=5,0 и 11,2 Гц), 3,74 (1 Н,к, J=6,6 Гц), J=6,6 Гц), 7,19-7,35 (5 Н, м). Пример 17. Дигидрохлорид (S)-7-амино-5 азаспиро[2.4]гептана. Загружают в автоклав 79 мг (S)-7-[(S)-1 фенилэтил]амино-5-азаспиро[2.4]гептана, 37 мг 20% гидроксида палладия, 2 мл этанола, 1 мл воды и 0,5 мл концентрированной соляной кислоты, и содержимое перемешивают при комнатной температуре в течение ночи в атмосфере водорода (40 кг/см 2). После завершения реакции кристаллы удаляют фильтрацией, а получающийся в результате фильтрат концентрируют при пониженном давлении и получают 72 мг(82%) названного в заголовке соединения в виде бесцветных кристаллов. Полученное таким образом кристаллическое вещество перекристаллизовывают из этанола и диэтилового эфира и используют в качестве образца для анализа. Т.пл. 240-248 С (разложение). 1(1 Н, дд, J=3,3 и 7,6 Гц), 4,01 (1 Н, дд, J=7,6 и 13,9 Гц). Оптическую чистоту полученного таким образом(S)-7-амино-5-азаспиро[2.4]гептана измеряют следующим образом. Порцию в 18 мг каждого полученного таким образом кристаллического соединения и его рацемат растворяют в 1 мл тетрагидрофурана и смешивают с 50 мг 3,5-динитробензоилхлорида. К этой смеси добавляют по каплям, при охлаждении на ледяной бане 0,06 мл триэтиламина, и затем перемешивают в течение 30 мин при комнатной температуре. Раствор смешивают с насыщенным водным раствором бикарбоната натрия и хлороформом, разделяют фазы и получающийся в результате хлороформный слой анализируют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).(Условия ВЭЖХ) Колонка: SUMICHIRAL OA-46004,6 мм х 250 мм). Подвижная фаза: гексан:1,2-дихлорэтан: этанол =60:40:5. Скорость потока: 1,0 мл/мин. Детектор: детектор поглощения УФизлучения (254 нм). Время удерживания:n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc отличается один от другого и представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что исключается соединение, в котором n равен 2, R1 является атомом водорода и R2 представляет собой этильную группу, или его соль. 2. Соединение или его соль по п.1, отличающееся тем, что имеет конфигурациюn является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra , Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 ато 29 мами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода; и его соль. 4. Соединение или его соль по п.3, отличающееся тем, что Ra, Rb и Rc отличаются один от другого. 5. Соединение или его соль по п.3 или 4,отличающееся тем, что имеет конфигурацию 30 мами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода, иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,включающий взаимодействие соединения, изображаемого формулой (IV) где n является целым числом от 2 до 5, и R2 представляет атом водорода или алкильную группу с 1-4 атомами углерода, с цианистым водородом в присутствии соединения, изображаемого формулой (V), или его соли,NH2R1(V),1 где R представляет атом водорода или заместитель, изображаемый формулойn является целым числом от 2 до 5; где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc отличаются один от другого, и его соль. 7. Соединение или его соль по п.6, отличающееся тем, что имеет конфигурацию 8. Способ получения циклического соединения, представленного формулой (I) где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb и Rc не являются одновременно атомами водорода. 9. Способ по п.8, отличающийся тем, чтоRa, Rb и Rc отличаются один от другого. 10. Способ по п.9, отличающийся тем, что соединение формулы (V) является одним оптически активным соединением. 11. Способ получения циклического соединения, представленного формулой (II)n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулойn является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 ато где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы ,атом водорода или алкильную группу с 1-4 атомами углерода, 31 включающий восстановление цианогруппы соединения, изображаемого формулой (I)n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы; атом водорода или алкильную группу с 1-4 атомами углерода; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,и последующее осуществление циклизации получающегося в результате аминосоединения. 12. Способ по п.11, отличающийся тем, чтоRa, Rb и Rc отличаются один от другого. 13. Способ по п.12, отличающийся тем, что соединение формулы (I) является одним оптически активным соединением. 14. Способ получения циклического соединения, представленного формулой (III-1)R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода. 15. Способ по п.14, отличающийся тем, чтоRa, Rb и Rc отличаются один от другого. 16. Способ по п. 15, отличающийся тем,что соединение формулы (II) является одним оптически активным соединением. 17. Способ получения циклического соединения, представленного формулой (VI), или его соли, гдеn является целым числом от 2 до 5; включающий удаление заместителя R12 из соединения формулы (III-2)n является целым числом от 2 до 5;R1 представляет атом водорода или заместитель, изображаемый формулой где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода,включающий восстановление соединения,изображаемого формулой (II)n является целым числом от 2 до 5;n является целым числом от 2 до 5; где каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу,которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы,атом водорода или алкильную группу с 1-4 атомами углерода. 18. Способ по п.17, отличающийся тем, что соединение формулы (III-2) является одним оптически активным соединением. 19. Способ получения смеси диастереомеров соединения, изображаемого формулой (I-1)n является целым числом от 2 до 5; каждый из Ra, Rb и Rc представляет фенильную, фенилметильную или нафтильную группу, которая может быть замещена, по меньшей мере, одним заместителем, выбираемым из группы, состоящей из алкильной группы с 1-4 атомами углерода, алкоксильной группы с 1-4 атомами углерода, атома галогена и нитрогруппы, атом водорода или алкильную группу с 1-4 атомами углерода, при условии, что Ra, Rb иRc отличаются один от другого; иR2 представляет атом водорода или алкильную группу с 1-4 атомами углерода,включающий обработку одного оптически активного соединения формулы (I-1) в протонном 34 растворителе для осуществления его изомеризации. 20. Способ по п.19, отличающийся тем, что соединение формулы (I-1) имеет конфигурацию 21. Способ по п.19 или 20, отличающийся тем, что указанную обработку для изомеризации осуществляют в условиях нагревания. 22. Способ по п.21, отличающийся тем, что указанный протонный растворитель является этанолом.
МПК / Метки
МПК: C07C 253/30, C07D 209/54
Метки: смеси, способ, соединение, диастереомеров, циклическое, получения
Код ссылки
<a href="https://eas.patents.su/18-867-ciklicheskoe-soedinenie-sposob-ego-polucheniya-i-sposob-polucheniya-smesi-diastereomerov.html" rel="bookmark" title="База патентов Евразийского Союза">Циклическое соединение, способ его получения и способ получения смеси диастереомеров</a>
Предыдущий патент: Устройство и способ молотьбы табака
Следующий патент: Производные пиридазин-3-она, их использование в качестве гербицидов и промежуточные соединения для их получения.
Случайный патент: Шлифовальное устройство для трубных соединений на бурильной колонне












