Кристаллическая форма эплеренона
Номер патента: 8449
Опубликовано: 29.06.2007
Авторы: Синг Йуен-Лунг Л., Ферро Леонард Дж., Карлос Марлон В., Питц Марк А., Борчардт Томас Б., Вечорек Джозеф Дж., Литтл Клэй Р., Бартон Кэтлин П., Йан Крис Й., Год Генри Т., Пилипоскас Дэниел Р., Мудипалли Партха С., Гэнсер Скотт, Десай Субхаш, Стал Гленн Л.
Формула / Реферат
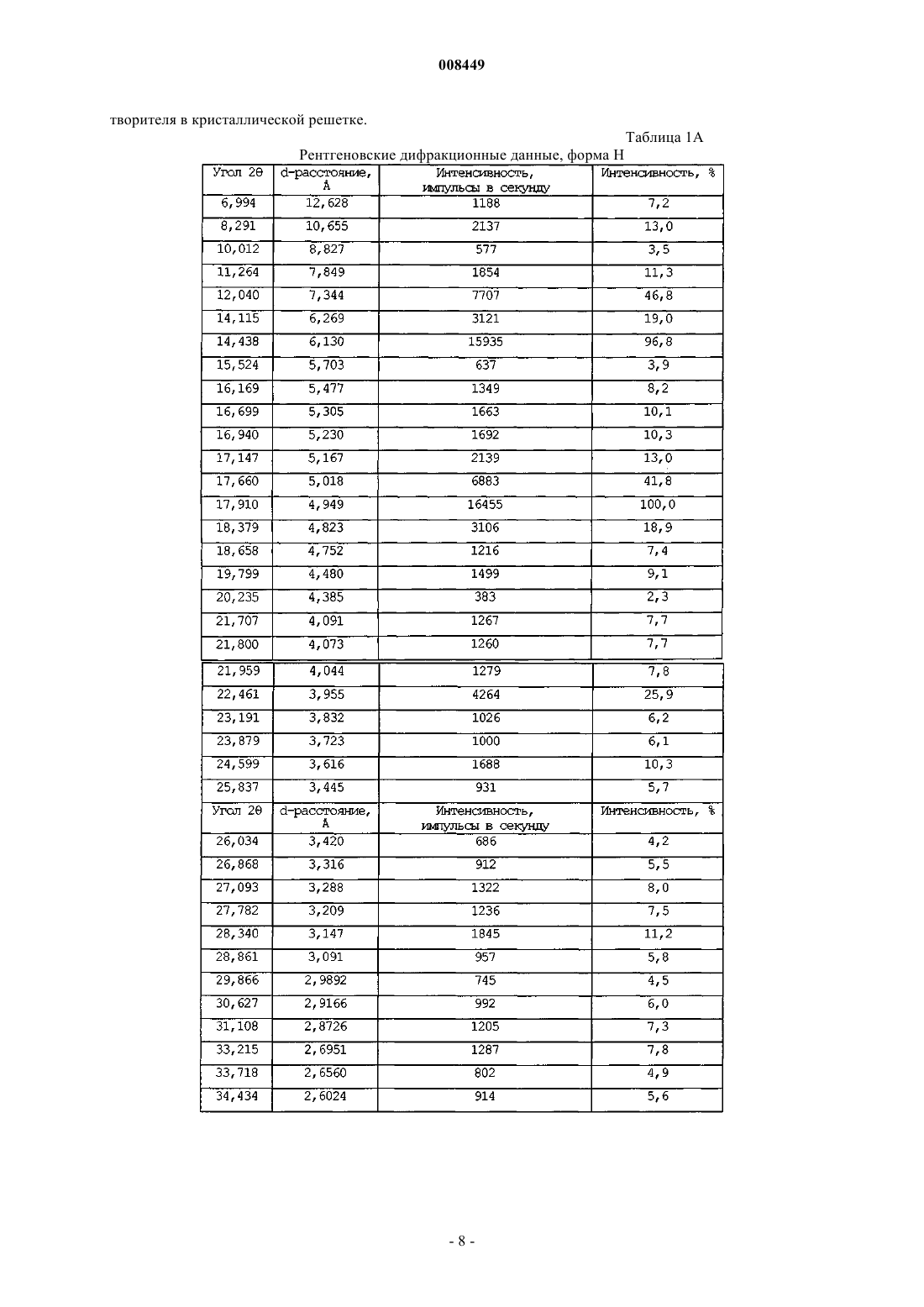
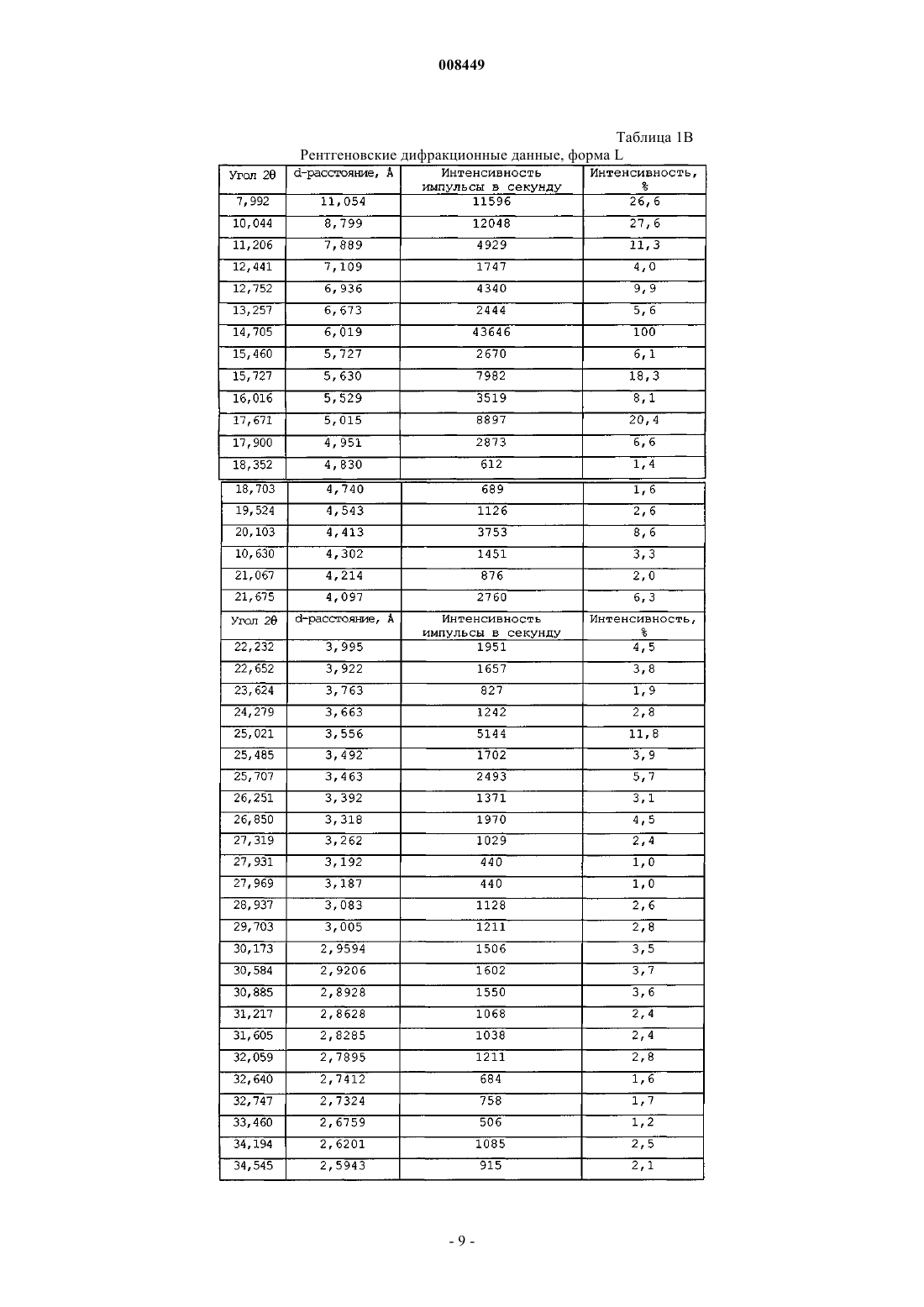
1. Фармацевтическая композиция в оральной дозированной форме, включающая от около 10 до около 1000 мг эплеренона и по крайней мере один фармацевтически приемлемый наполнитель, причем эплеренон, присутствующий в композиции, имеет фазовую чистоту формы L кристаллического эплеренона от около 90 до около 100% и форма L кристаллического эплеренона характеризуется порошковой рентгенограммой при длине волны 1,54056 Е, включающей один или более пик, выбранный из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
2. Композиция по п.1, где фазовая чистота составляет от около 95 до около 100% формы L кристаллического эплеренона.
3. Композиция по п.2, где эплеренон представляет собой практически чистую фазу формы L кристаллического эплеренона.
4. Композиция по п.1, которая практически свободна от одной или более форм Н кристаллического эплеренона, сольватированного кристаллического эплеренона и аморфного эплеренона.
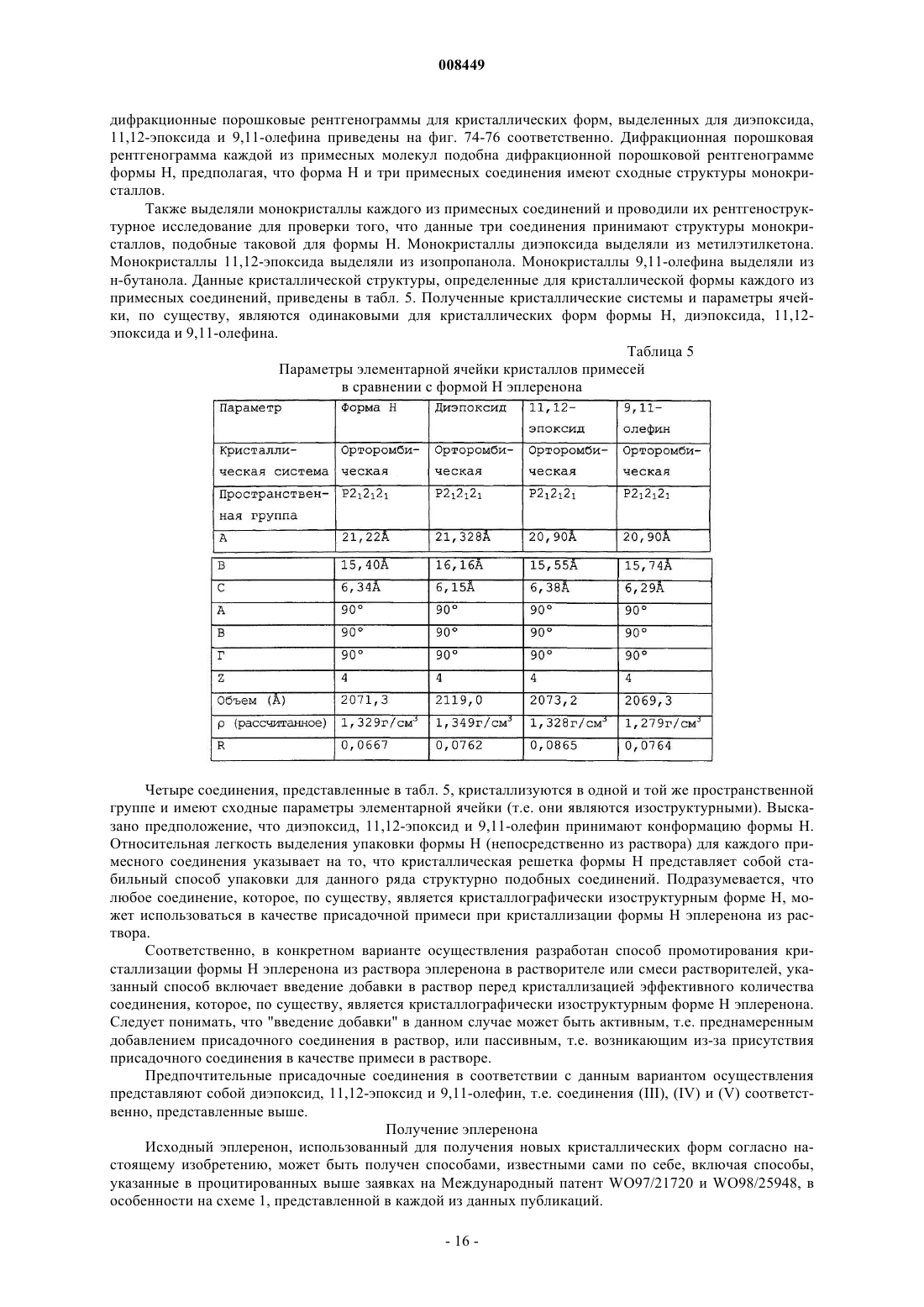
5. Композиция по п.1, где эплеренон состоит из одной или более (i) форм Н кристаллического эплеренона, имеющего орторомбическую кристаллографическую систему, (ii) сольватированной кристаллической формы эплеренона и (iii) аморфного эплеренона.
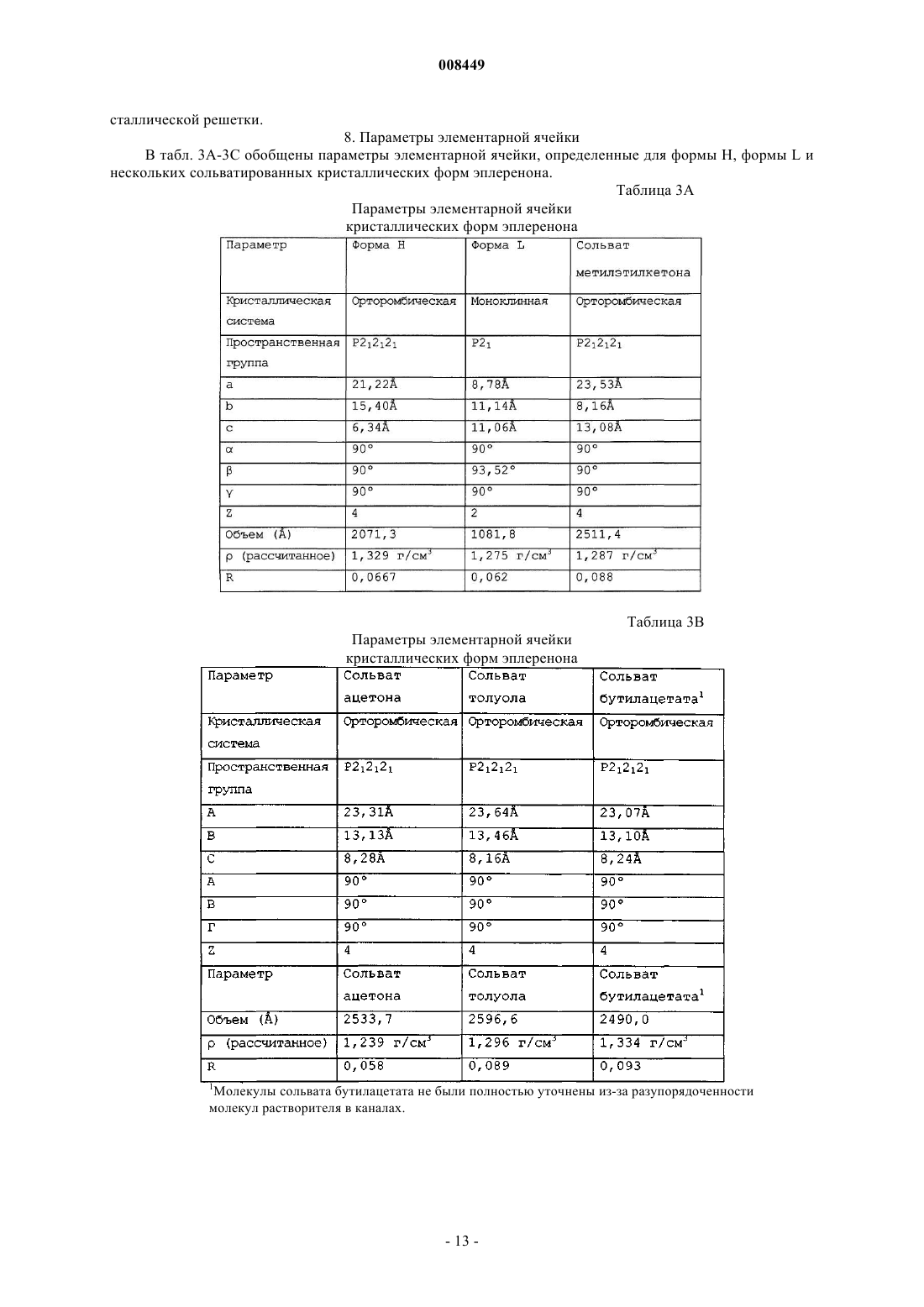
6. Композиция по п.1, где форма L кристаллического эплеренона характеризуется одним или более параметрами элементарной ячейки, выбранной из группы, состоящей из:
(а) моноклинной кристаллографической системы,
(b) P21 пространственной группы,
(с) значение ячейки а, b, с составляет около 8,78 Е, около 11,14 Е и около 11,06 Е соответственно,
(d) значение элементарной ячейки a, b, g составляет соответственно около 90ш, около 93,52ш и около 90ш,
(е) объем 1081,8 Е, и
(f) значение Z составляет 2.
7. Композиция по п.1, где порошковая рентгенограмма включает два или более пика, выбранные из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
8. Композиция по п.1, где порошковая рентгенограмма включает три или более пика, выбранные из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
9. Композиция по п.1, где порошковая рентгенограмма включает пики, выбранные из группы, состоящей из 8,0+0,2ш 2q , 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
10. Композиция по п.1, где форма L кристаллического эплеренона характеризуется порошковой рентгенограммой без существенного пика при 12,0+0,2ш 2q.
11. Композиция по п.1, где форма L кристаллического эплеренона характеризуется порошковой рентгенограммой в основном как показано в табл. 1В.
12. Композиция по п.1, где форма L кристаллического эплеренона характеризуется спектром инфракрасного поглощения, полученным на преобразователе Фурье, включающим одну или более полосы абсорбции, выбранные из группы, состоящей из около 1655 и около 1724 см-1.
13. Композиция по п.11, где форма L кристаллического эплеренона характеризуется спектром инфракрасного поглощения, полученным на преобразователе Фурье, включающим полосы абсорбции, выбранные из группы, состоящей из около 1655 и около 1724 см-1.
14. Композиция по п.1, где форма L кристаллического эплеренона характеризуется спектром инфракрасного поглощения, полученным на преобразователе Фурье, без существенной абсорбционной полосы при около 1399 см-1 или без существенной абсорбционной полосы при около 1739 см-1.
15. Композиция по п.1, где форма L кристаллического эплеренона характеризуется спектром инфракрасного поглощения, полученным на преобразователе Фурье, по существу, как показано на фиг. 36.
16. Композиция по п.1, где форма L кристаллического эплеренона характеризуется интервалом плавления от около 223 до около 242шС, определенным дифференциальной сканирующей калориметрией при скорости нагревания 10шС/мин.
17. Композиция по п.1, где форма L кристаллического эплеренона характеризуется термограммой дифференциальной сканирующей калориметрии, имеющей единственный эндотерм, который проявляется в температурном интервале плавления от около 237 до около 242шС.
18. Композиция по п.1, где форма L кристаллического эплеренона характеризуется одним или более следующими признаками:
а) порошковой рентгенограммой при длине волны 1,54056 Е, включающей пики при 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q;
b) спектром инфракрасного поглощения, полученным на преобразователе Фурье, включающим полосы абсорбции при около 1655 и около 1724 см-1; и
с) термограммой дифференциальной сканирующей калориметрии, имеющей единственный эндотерм, который проявляется в температурном интервале плавления от около 237 до около 242шС.
19. Композиция по п.18, где форма L кристаллического эплеренона характеризуется двумя или более следующими признаками:
а) порошковой рентгенограммой при длине волны 1,54056 Е, включающей пики при 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q;
b) спектром инфракрасного поглощения, полученным на преобразователе Фурье, включающим полосы абсорбции при около 1655 и около 1724 см-1; и
с) термограммой дифференциальной сканирующей калориметрии, имеющей единственный эндотерм, который проявляется в температурном интервале плавления от около 237 до около 242шС.
20. Композиция по п.19, где форма L кристаллического эплеренона характеризуется:
а) порошковой рентгенограммой при длине волны 1,54056 Е, включающей пики при 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q;
b) спектром инфракрасного поглощения, полученным на преобразователе Фурье, включающим полосы абсорбции при около 1655 и около 1724 см-1; и
с) термограммой дифференциальной сканирующей калориметрии, имеющей единственный эндотерм, который проявляется в температурном интервале плавления от около 237 до около 242шС.
21. Композиция по п.1, дополнительно включающая форму Н кристаллического эплеренона, где указанная форма Н кристаллического эплеренона имеет орторомбическую кристаллографическую систему.
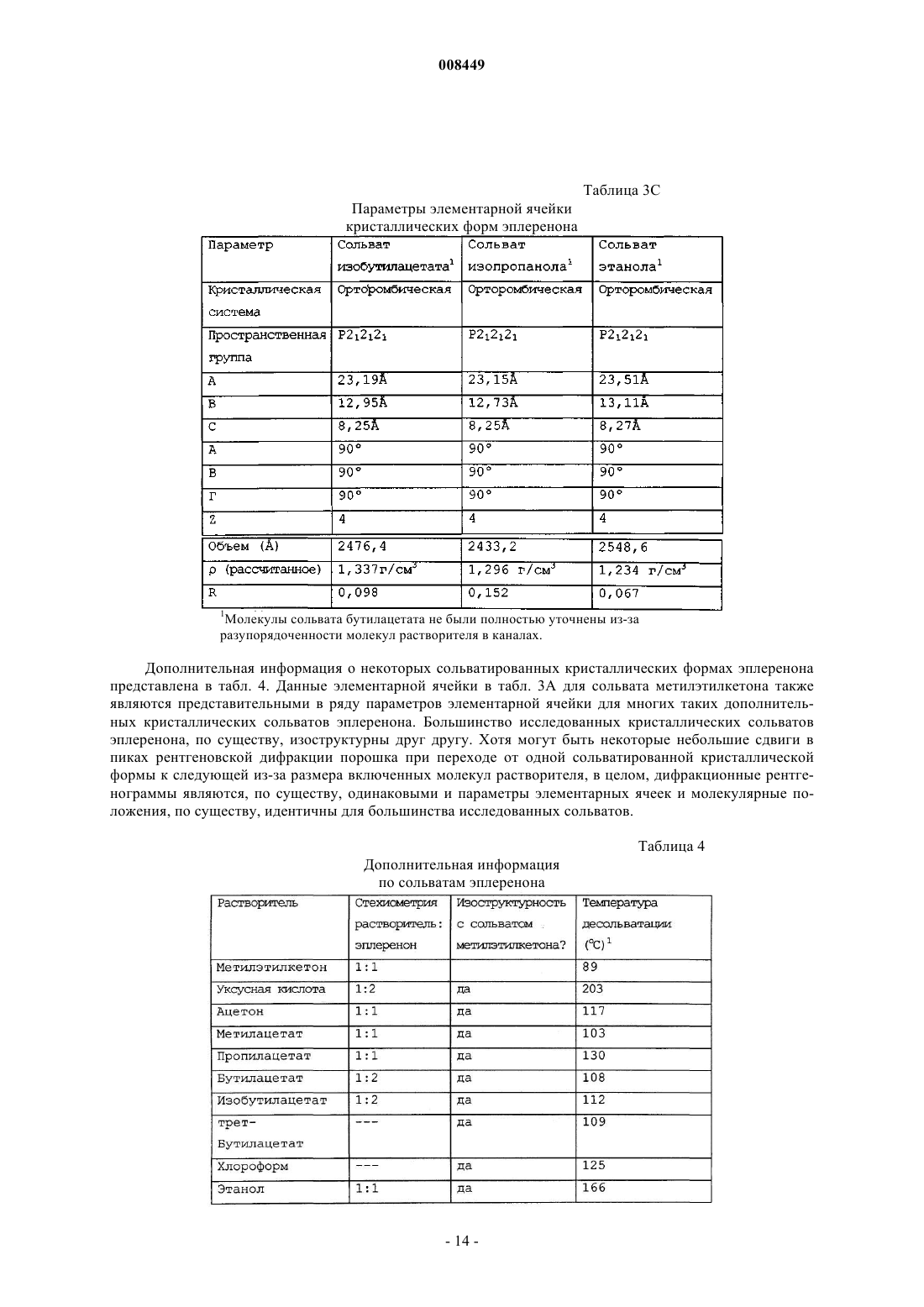
22. Композиция по п.1, дополнительно включающая сольватированную кристаллическую форму эплеренона.
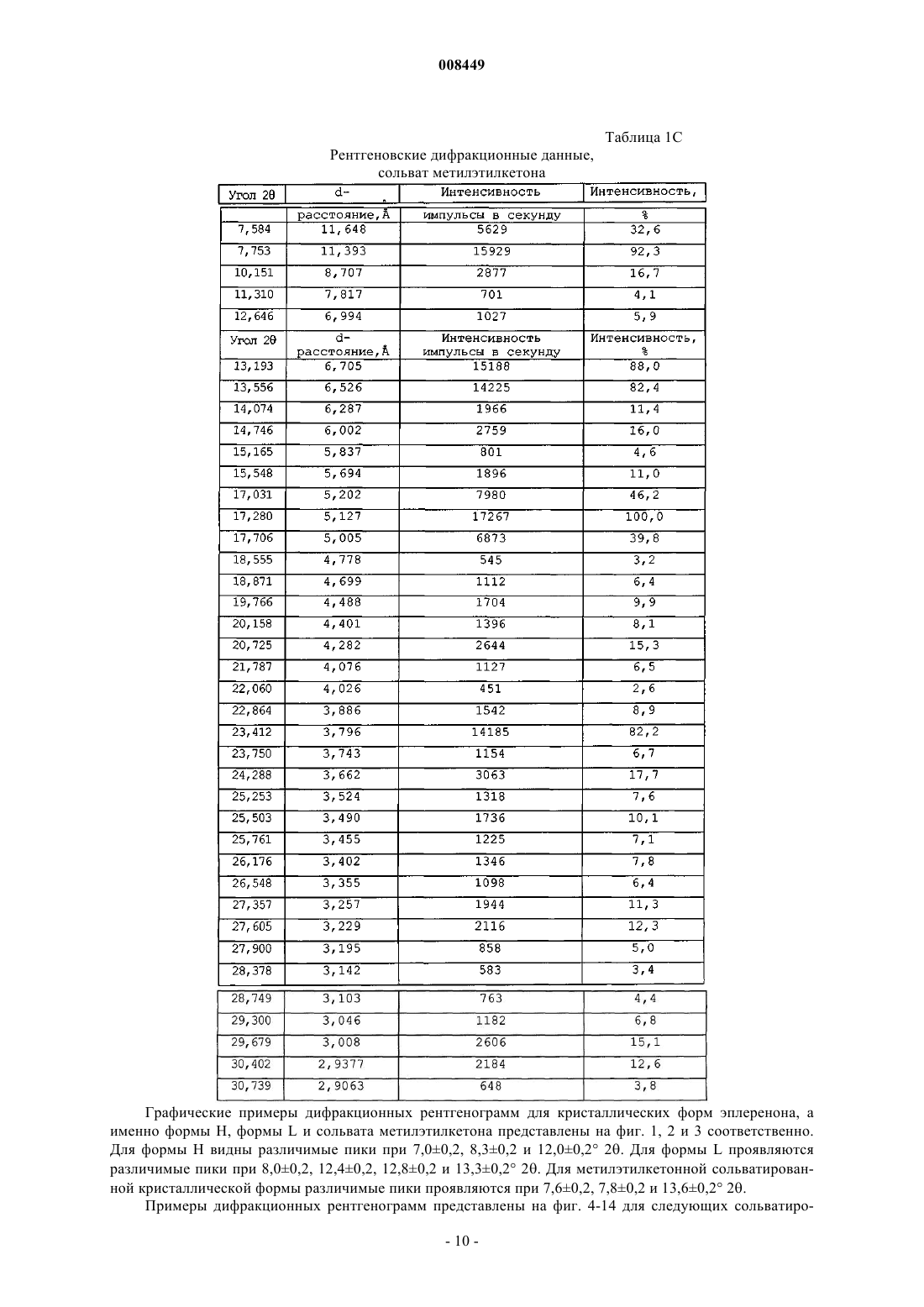
23. Композиция по п.22, где сольватированная кристаллическая форма эплеренона представляет собой сольват метилэтилкетона кристаллического эплеренона.
24. Композиция по п.1, дополнительно включающая аморфный эплеренон.
25. Композиция по п.1, где оральная дозированная форма является твердой оральной дозированной формой, выбранной из группы, состоящей из таблеток, капсул и порошков.
26. Композиция по п.1, где форма L кристаллического эплеренона имеет D90 размер частиц в интервале от около 25 до около 400 мкм.
27. Композиция, включающая сольватированную кристаллическую форму эплеренона и фармацевтически приемлемый наполнитель.
28. Композиция по п.27, где сольватированная кристаллическая форма выбрана из группы, состоящей из сольватов метилэтилкетона, 1-пропанола, 2-пентанона, уксусной кислоты, ацетона, бутилацетата, хлороформа, изобутанола, этаноыр, изобутилацетата, метилацетата, этилпропионата, н-бутанола, н-октанола, изопропанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола, метанола и трет-бутилацетата и их смеси.
29. Композиция по п.27, где сольватированная кристаллическая форма выбрана из группы, состоящей из сольватов 1-пропанола, 2-пентанона, уксусной кислоты, бутилацетата, хлороформа, изобутанола, изобутилацетата, метилацетата, этилпропионата, н-бутанола, н-октанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола, метанола и трет-бутилацетата и их смеси.
30. Композиция по п.27, где сольватированная кристаллическая форма эплеренона содержит одну или более сольватированных форм, выбранных из группы, состоящей из кристаллического сольвата метилэтилкетона и кристаллического сольвата этанола.
31. Композиция по п.27, где сольватированная кристаллическая форма не является сольватом метиленхлорида, метиленхлорида/простого этилового эфира, простого этилового эфира, метиленхлорида/изопропанола и этилацетата.
32. Композиция по п.27, где сольватированная кристаллическая форма не является сольватом метиленхлорида, метиленхлорида/простого этилового эфира, простого этилового эфира, метиленхлорида/изопропанола, этилацетата, метилэтилкетона, этанола и ацетона.
33. Способ получения формы L кристаллического эплеренона, включающий:
а) дигерирование исходного эплеренона с высокой степенью чистоты в растворителе, способном образовывать сольватированную кристаллическую форму эплеренона, или в смеси, включающей такой растворитель;
b) кристаллизацию эплеренона из растворителя или смеси растворителей с образованием сольвата; и
с) десольватирование сольвата с получением формы L кристаллического эплеренона, имеющей моноклинную кристаллографическую систему и порошковую рентгенограмму при длине волны 1,54056 Е, включающую один или более пиков, выбранных из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
34. Способ по п.33, где растворитель выбирают из группы, состоящей из метилэтилкетона, 2-пентанона, уксусной кислоты, ацетона, бутилацетата, хлороформа, изобутанола, этанола, изобутилацетата, метилацетата, этилпропионата, н-бутанола, н-октанола, изопропанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола и трет-бутилацетата и их смеси.
35. Способ по п.33, где растворитель или смесь растворителей выбирают из группы, состоящей из метилэтилкетона, этанола и их смеси.
36. Способ по п.33, где растворитель отличен от метиленхлорида, метиленхлорида/простого этилового эфира, простого этилового эфира, метиленхлорида/изопропанола и этилацетата и их смеси.
37. Способ по п.33, где растворитель отличен от метиленхлорида, метиленхлорида/простого этилового эфира, простого этилового эфира, метиленхлорида/изопропанола, этилацетата, метилэтилкетона, этанола и ацетона.
38. Способ по п.33, дополнительно включающий измельчение эплеренона до или после кристаллизации до D90 размера частиц менее чем около 400 мкм.
39. Способ по п.33, дополнительно включающий измельчение эплеренона до или после кристаллизации до D90 размера частиц в интервале от около 40 до около 100 мкм.
40. Способ по п.33, где чистота исходного высокочистого эплеренона составляет по крайней мере около 98%.
41. Способ по п.33, где стадия дигерирования далее включает нагревание исходного высокочистого эплеренона в растворителе или смеси растворителей при температуре кипения растворителя или смеси растворителей.
42. Способ получения формы L кристаллического эплеренона, включающий:
а) кристаллизацию эплеренона из растворителя, способного образовывать сольватированную кристаллическую форму эплеренона, или в смеси, включающей такой растворитель; и
b) десольватирование сольвата с получением формы L кристаллического эплеренона, имеющей моноклинную кристаллографическую систему и порошковую рентгенограмму при длине волны 1,54056 Е, включающую один или более пиков, выбранных из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
43. Способ промотирования кристаллизации формы L кристаллического эплеренона из раствора эплеренона в растворителе или смеси растворителей, включающий внесение в раствор до кристаллизации эффективного количества затравки.
44. Способ по п.43, где затравкой является форма L кристаллического эплеренона.
45. Способ получения фармацевтической композиции, пригодной для лечения или профилактики альдостерон-опосредованного болезненного состояния или заболевания, включающий:
а) приготовление десольватированной формы L кристаллического эплеренона из растворителя или смеси растворителей;
b) уменьшение кристаллографического размера частиц формы L кристаллического эплеренона, причем полученный D90 размер частиц находится в интервале от около 40 до около 100 мкм; и
с) смешивание терапевтически эффективного количества формы L кристаллического эплеренона с уменьшенным кристаллографическим размером частиц по крайней мере с одним фармацевтически приемлемым носителем с образованием фармацевтической композиции.
46. Способ по п.45, включающий:
а) кристаллизацию формы L кристаллического эплеренона из растворителя или смеси растворителей с получением сольватированной формы L кристаллического эплеренона; и
b) десольватирование сольватированной формы L кристаллического эплеренона с получением формы L кристаллического эплеренона, имеющей моноклинную кристаллографическую систему и порошковую рентгенограмму при 12 длине волны 1,54056 Е, включающую один или более пиков, выбранных из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q;
с) уменьшение кристаллографического размера частиц формы L кристаллического эплеренона, причем полученный D90 размер частиц находится в интервале от около 40 до около 100 мкм; и
d) смешивание терапевтически эффективного количества формы L кристаллического эплеренона с уменьшенным кристаллографическим размером частиц по крайней мере с одним фармацевтически приемлемым носителем с образованием фармацевтической композиции.
47. Способ получения формы L кристаллического эплеренона, включающий:
а) дигерирование исходного эплеренона в этаноле;
b) кристаллизацию эплеренона из этанола с образованием этанольного сольвата кристаллической формы;
с) растворение формы этанольного сольвата в метилэтилкетоне;
d) кристаллизацию эплеренона из метилэтилкетона с образованием метилэтилкетонного сольвата кристаллической формы; и
е) десольватирование метилэтилкетонного сольвата с получением формы L кристаллического эплеренона, имеющей моноклинную кристаллографическую систему и порошковую рентгенограмму при длине волны 1,54056 Е, включающую один или более пиков, выбранных из группы, состоящей из 8,0+0,2ш 2q, 12,4+0,2ш 2q, 12,8+0,2ш 2q и 13,3+0,2ш 2q.
48. Способ лечения или профилактики альдостерон-опосредованного болезненного состояния или заболевания, включающий введение субъекту терапевтически или профилактически эффективного количества фармацевтической композиции по п.45.
49. Способ по п.48, где субъект нуждается в лечении или профилактике альдостерон-опосредованного болезненного состояния или заболевания.
50. Способ по п.48, где болезненное состояние или заболевание выбирают из группы, состоящей из гипертензии, сердечной недостаточности, цирроза печени, избытка коллагена, фиброза, гипертрофии доброкачественной простаты и депрессии.
51. Способ по п.50, уфх болезненным состоянием или заболеванием является гипертензия.
52. Способ по п.50, где болезненным состоянием или заболеванием является сердечная недостаточность.
53. Применение композиции по п.1 в производстве лекарственного средства для лечения или профилактики альдостерон-опосредованного болезненного состояния или заболевания.
54. Применение формы L кристаллического эплеренона в качестве активного начала при лечении или профилактики альдостерон-опосредованного болезненного состояния или заболевания.
Текст
008449 Данное изобретение относится к фармацевтическим агентам, активным в качестве антагонистов альдостеронового рецептора, более конкретно к антагонисту альдостеронового рецептора - эплеренону. В частности, изобретение относится к новой кристаллической форме эплеренона, к способам получения данной кристаллической формы, к фармацевтическим композициям, включающим данную кристаллическую форму, к способам лечения и/или профилактики альдостерон-опосредованных болезненных состояний и/или нарушений, включая болезненные состояния и нарушения, связанные с гиперальдостеронизмом, такие как гипертензия, с использованием такой кристаллической формы и применению данной кристаллической формы при получении лекарственных средств. Соединение метил, водород-9,11-эпокси-17-гидрокси-3-оксопрегн-4-ен-7,21-дикарбоксилат, -лактон, имеющее структуру (I) и известное как эплеренон, впервые было описано в патенте США 4559332 Grob et al., в котором описан класс 9,11-эпоксистероидных соединений и их солей. Эплеренон является антагонистом альдостеронового рецептора и может вводиться в терапевтически эффективном количестве в том случае, когда показано введение антагониста альдостеронового рецептора, как, например, при лечении патологического состояния, связанного с гиперальдостеронизмом, включая гипертензию, сердечные нарушения, включая сердечную недостаточность, и цирроз печени. Процитированный выше патент США 4559332, который включен в данное описание в качестве ссылки, раскрывает получение эплеренона и фармацевтических композиций, содержащих эплеренон. Дополнительные способы получения 9,11-эпоксистероидных соединений и их солей, включая эплеренон,описаны в публикациях международных патентов WO97/21720 и WO 98/25948. В публикации Grob et al. (1997), "Steroidal aldosterone antagonists: increased selectivity of 9,11-epoxyderivatives (Стероидные антагонисты альдостерона: повышенная селективность 9,11-эпоксипроизводных)", Helvetica Chimica Acta, 80, 566-585 описан рентгеноструктурный анализ кристаллической структуры сольвата эплеренона, полученного кристаллизацией эплеренона из системы растворителей хлористый метилен/диэтиловый эфир.De Gasparo et al. (1989), "Antialdosterones: incidence and prevention of sexual side effects (Антиальдостероны: сфера действия и профилактика сексуальных побочных действий), Journal of Steroid Biochemistry 32 (13), 223-227, описал применение эплеренона, не включенного в состав рецептуры и имеющего размер частиц 20 мкм, при исследовании единичной дозы эплеренона. Спиронолактон-20-спироксанстероид, имеющий структуру (II) и обладающий активностью в качестве антагониста альдостеронового рецептора, коммерчески доступен и используется для лечения гипертензии. Спиронолактон, однако, обладает антиандрогенной активностью, которая может привести к гинекомастии (увеличению молочных желез) и импотенции у мужчин. Он также обладает слабой прогестагенной (способствующей наступлению или сохранению беременности) активностью, что может привести к нарушениям менструального цикла у женщин. Соответственно, имеется интерес к разработке дополнительных активных антагонистов альдостеронового рецептора, таких как эплеренон, которые не взаимодействуют с другими стероидными рецепторными системами, такими как глюкокортикоидная, прогестиновая и андрогенная стероидными рецепторными системами, и/или которые обеспечивают более широкий круг лечения. В публикации Агафонова и др. (1991), "Polimorphism of spirolactone (Полиморфизм спиролактона),Journal of Pharmaceutical Sciences, 80(2), 181-185 описаны ацетонитрильный сольват, этанольный сольват,этилацетатный сольват, метанольный сольват и две несольватированные кристаллические формы спиронолактона. Аналогично, Brittan (1999), Polymorphism in Pharmaceutical Solids, pp.114-116, 207, 235 и 261(Marcel Dekker) описал данные твердые формы спиронолактона. Эплеренон обладает очень низкой растворимостью в водной среде, и высвобождение лекарственного средства в желудочно-кишечном тракте из пероральных лекарственных форм часто является ограничивающим фактором в отношении биодоступности лекарственного средства, и, более конкретно, в от-1 008449 ношении скорости начала терапевтического действия после перорального введения. Краткое изложение сущности изобретения В настоящее время разработана новая кристаллическая форма эплеренона, обладающая высокой степенью физической стабильности при обычных температурах хранения и применения, а также другими уникальными свойствами по отношению к другим твердым формам эплеренона. Данная кристаллическая форма полностью охарактеризована в данном описании, но упоминается для удобства как "форма L". В первом своем аспекте изобретение относится к новой кристаллической форме L эплеренона. Среди свойств, отличающих форму L от другой кристаллической формы, упоминаемой как "форма Н", является то, что форма L представляет собой моноклинную кристаллическую систему с рентгеновской порошковой дифрактограммой с пиком при 8,00,2 2 и температурой плавления примерно от 223 до примерно 242 С, в зависимости от способа, которым ее получают, как описано далее. Во втором аспекте изобретение относится к лекарственному веществу эплеренон, включающему форму L эплеренона, по крайней мере, в обнаруживаемом количестве. В третьем аспекте изобретение относится к лекарственному веществу эплеренон, являющемуся по существу фазово-чистой формой L эплеренона. Термин "фазово-чистый" в данном описании относится к чистоте в отношении других твердых форм эплеренона, а необязательно подразумевает высокую степень химической чистоты в отношении других соединений. В четвертом аспекте изобретение относится к сольватированным кристаллическим формам эплеренона, которые при десольватации могут приводить к форме L эплеренона. В пятом аспекте изобретение относится к фармацевтическим композициям, включающим форму L эплеренона, необязательно сочетающуюся с одной или несколькими другими твердыми состояниями эплеренона, при общем количестве эплеренона в единичной препаративной лекарственной форме примерно от 10 до примерно 1000 мг и дополнительно содержащую один или несколько фармацевтически приемлемых эксципиентов. В шестом аспекте изобретение относится к способам получения формы L эплеренона и получения композиций, включающих форму L эплеренона. В седьмом аспекте изобретение относится к способу профилактики и/или лечения альдостеронопосредованного болезненного состояния или нарушения, включающему введение субъекту терапевтически эффективного количества эплеренона, где по крайней мере часть фракции эплеренона представляет собой форму L эплеренона. Дополнительные аспекты изобретения обсуждаются в описании данного изобретения. Краткое описание чертежей На фиг. 1 показана дифракционная порошковая рентгенограмма формы Н эплеренона. На фиг. 2 показана дифракционная порошковая рентгенограмма формы L эплеренона. На фиг. 3 показана дифракционная порошковая рентгенограмма сольвата метилэтилкетона эплеренона. На фиг. 4 показана дифракционная порошковая рентгенограмма сольвата н-пропилового спирта эплеренона. На фиг. 5 показана дифракционная порошковая рентгенограмма сольвата тетрагидрофурана эплеренона. На фиг. 6 показана дифракционная порошковая рентгенограмма сольвата этилпропионата эплеренона. На фиг. 7 показана дифракционная порошковая рентгенограмма сольвата уксусной кислоты эплеренона. На фиг. 8 показана дифракционная порошковая рентгенограмма сольвата ацетона эплеренона. На фиг. 9 показана дифракционная порошковая рентгенограмма сольвата толуола эплеренона. На фиг. 10 показана дифракционная порошковая рентгенограмма сольвата изопропанола эплеренона. На фиг. 11 показана дифракционная порошковая рентгенограмма сольвата этанола эплеренона. На фиг. 12 показана дифракционная порошковая рентгенограмма сольвата изобутилацетата эплеренона. На фиг. 13 показана дифракционная порошковая рентгенограмма сольвата бутилацетата эплеренона. На фиг. 14 показана дифракционная порошковая рентгенограмма сольвата метилацетата эплеренона. На фиг. 15 показана термограмма, полученная способом дифференциальной сканирующей калориметрии (ДСК), неизмельченной формы L эплеренона, непосредственно кристаллизованного из метилэтилкетона. На фиг. 16 показана ДСК термограмма неизмельченной формы L эплеренона, полученного десольватацией сольвата, полученного кристаллизацией высокочистого эплеренона из метилэтилкетона. На фиг. 17 показана ДСК термограмма формы L эплеренона, полученного измельчением продукта десольватации сольвата, полученного кристаллизацией высокочистого эплеренона из метилэтилкетона.-2 008449 На фиг. 18 показана ДСК термограмма неизмельченной формы Н эплеренона, полученного десольватацией сольвата, полученного вывариванием эплеренона низкой чистоты из подходящих растворителей. На фиг. 19 показаны ДСК термограммы сольвата н-пропилового спирта эплеренона. На фиг. 20 показаны ДСК термограммы сольвата тетрагидрофурана эплеренона. На фиг. 21 показаны ДСК термограммы сольвата этилпропионата эплеренона. На фиг. 22 показаны ДСК термограммы сольвата уксусной кислоты эплеренона. На фиг. 23 показаны ДСК термограммы сольвата хлороформа эплеренона. На фиг. 24 показаны ДСК термограммы сольвата ацетона эплеренона. На фиг. 25 показаны ДСК термограммы сольвата толуола эплеренона. На фиг. 26 показаны ДСК термограммы сольвата изопропанола эплеренона. На фиг. 27 показаны ДСК термограммы сольвата трет-бутилацетата эплеренона. На фиг. 28 показаны ДСК термограммы сольвата этанола эплеренона. На фиг. 29 показаны ДСК термограммы сольвата изобутилацетата эплеренона. На фиг. 30 показаны ДСК термограммы сольвата бутилацетата эплеренона. На фиг. 31 показаны ДСК термограммы сольвата метилацетата эплеренона. На фиг. 32 показаны ДСК термограммы сольвата пропилацетата эплеренона. На фиг. 33 показаны ДСК термограммы сольвата н-бутанола эплеренона. На фиг. 34 показаны ДСК термограммы сольвата н-октанола эплеренона. На фиг. 35 показаны инфракрасные (ИК) спектры (диффузное отражение, DRIFT) формы Н эплеренона. На фиг. 36 показаны ИК-спектры (диффузное отражение, DRIFT) формы L эплеренона. На фиг. 37 показаны ИК-спектры (диффузное отражение, DRIFT) сольвата метилэтилкетона эплеренона. На фиг. 38 показаны ИК-спектры (диффузное отражение, DRIFT) эплеренона в растворе хлороформа. На фиг. 39 показаны ИК-спектры сольвата н-пропилового спирта эплеренона. На фиг. 40 показан ИК-спектр сольвата тетрагидрофурана. На фиг. 41 показан ИК-спектр сольвата этилпропионата эплеренона. На фиг. 42 показан ИК-спектр сольвата ацетона эплеренона. На фиг. 43 показан ИК-спектр сольвата толуола эплеренона. На фиг. 44 показан ИК-спектр сольвата изопропанола эплеренона. На фиг. 45 показан ИК-спектр сольвата этанола эплеренона. На фиг. 46 показан ИК-спектр сольвата изобутилацетата эплеренона. На фиг. 47 показан ИК-спектр сольвата н-бутилацетата эплеренона. На фиг. 48 показан ИК-спектр сольвата пропилацетата эплеренона. На фиг. 49 показан ИК-спектр сольвата метилацетата эплеренона. На фиг. 50 показан ИК-спектр сольвата пропиленгликоля эплеренона. На фиг. 51 показан ИК-спектр сольвата трет-бутилацетата эплеренона. На фиг. 52 показан 13 С ЯМР спектр формы Н эплеренона. На фиг. 53 показан 13 С ЯМР спектр формы L эплеренона. На фиг. 54 показан профиль термогравимерических анализов сольвата метилэтилкетона эплеренона. На фиг. 55 показан профиль термогравимерических анализов сольвата н-пропилового спирта эплеренона. На фиг. 56 показан профиль термогравимерических анализов сольвата тетрагидрофурана эплеренона. На фиг. 57 показан профиль термогравимерических анализов сольвата этилпропионата эплеренона. На фиг. 58 показан профиль термогравимерических анализов сольвата уксусной кислоты эплеренона. На фиг. 59 показан профиль термогравимерических анализов сольвата хлороформа эплеренона. На фиг. 60 показан профиль термогравимерических анализов сольвата ацетона эплеренона. На фиг. 61 показан профиль термогравимерических анализов сольвата толуола эплеренона. На фиг. 62 показан профиль термогравимерических анализов сольвата изопропанола эплеренона. На фиг. 63 показан профиль термогравимерических анализов сольвата этанола эплеренона. На фиг. 64 показан профиль термогравимерических анализов сольвата изобутилацетата эплеренона. На фиг. 65 показан профиль термогравимерических анализов сольвата н-бутилацетата эплеренона. На фиг. 66 показан профиль термогравимерических анализов сольвата метилацетата эплеренона. На фиг. 67 показан профиль термогравимерических анализов сольвата н-пропилацетата эплеренона. На фиг. 68 показан профиль термогравимерических анализов сольвата пропиленгликоля эплеренона. На фиг. 69 показан профиль термогравимерических анализов сольвата н-бутанола эплеренона.-3 008449 На фиг. 70 показан профиль термогравимерических анализов сольвата н-октанола эплеренона. На фиг. 71 показан профиль термогравимерических анализов сольвата н-бутилацетата эплеренона. На фиг. 72 представлена сканирующая электронная микрофотография формы L эплеренона,полученной десольватацией сольвата метилэтилкетона эплеренона. На фиг. 73 представлена сканирующая электронная микрофотография формы L эплеренона,полученной непосредственной кристаллизацией из этилацетата. На фиг. 74 показана дифракционная порошковая рентгенограмма кристаллической формы 7 метил,водород-45; 9,11-диэпокси-17-гидрокси-3-оксо-17-прегнан-7,21-дикарбоксилата, лактона ("диэпоксид"), выделенного из метилэтилкетона. На фиг. 75 показана дифракционная порошковая рентгенограмма кристаллической формы 7 метил,водород-11,12-эпокси-17-гидрокси-3-оксо-17-прегн-4-ен-7,21-дикарбоксилата, -лактона("11,12-эпоксид"), выделенного из изопропанола. На фиг. 76 показана дифракционная порошковая рентгенограмма кристаллической формы 7 метил,водород-17-гидрокси-3-оксо-17-прегна-4,9(11)-диен-7,21-дикарбоксилата, -лактона("9,11 олефин"), выделенного из н-бутанола. На фиг. 77 проиллюстрирована взаимосвязь между свободной энергией Гиббса и температурой для энантиотропно родственных полиморфов. На фиг. 78 показана дифракционная порошковая рентгенограмма сырого осадка сольвата метилэтилкетона, полученного кристаллизацией из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. На фиг. 79 показана дифракционная порошковая рентгенограмма высушенных твердых веществ,полученных при кристаллизации из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. На фиг. 80 показана дифракционная порошковая рентгенограмма высушенных твердых веществ,полученных при кристаллизации из метилэтилкетона с добавлением 3% диэпоксида без измельчения (а) и с измельчением (b) сольвата перед сушкой. На фиг. 81 показана дифракционная порошковая рентгенограмма сырого осадка сольвата метилэтилкетона, полученного кристаллизацией из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 5% и (d) 10% 11,12-эпоксида. На фиг. 82 показана дифракционная порошковая рентгенограмма высушенных твердых веществ,полученных при кристаллизации из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 5% и (d) 10% 11,12-эпоксида. На фиг. 83 показан кубический график чистоты продукта, чистоты исходного материала, скорости охлаждения и конечной температуры на основании данных, представленных в табл. 7 А примера 7 данного описания. На фиг. 84 показан график в полулогарифмическом масштабе, полученный с использованием кубического графика фиг. 83 для определения тех переменных, которые оказывают статистически значимое влияние на чистоту продукта. На фиг. 85 представлен график взаимосвязи на основе данных, представленных в табл. 7 А примера 7 данного описания, показывающий взаимосвязь влияния чистоты исходного вещества и конечной температуры на чистоту продукта. На фиг. 86 показан кубический график весовой фракции формы Н, чистоты исходного материала,скорости охлаждения и конечной температуры на основании данных, представленных в табл. 7 А примера 7 данного описания. На фиг. 87 показан график в полулогарифмическом масштабе, полученный с использованием кубического графика фиг. 86 для определения тех переменных, которые оказывают статистически значимое влияние на весовую фракцию формы Н. На фиг. 88 представлен график взаимосвязи на основе данных, представленных в табл. 7 А примера 7 данного описания, показывающий взаимосвязь влияния чистоты исходного вещества и конечной температуры на весовую фракцию формы Н. На фиг. 89 показана дифракционная рентгенограмма аморфного эплеренона. На фиг. 90 показана ДСК термограмма аморфного эплеренона. На фиг. 91 показаны скорости растворения, измеренные для четырех образцов полиморфов эплеренона. Подробное описание изобретения Как и для всех фармацевтических соединений и композиций, химические и физические свойства эплеренона являются важными при его коммерческой разработке. Данные свойства включают в себя, но не ограничиваются ими, (1) свойства упаковки, такие как молярный объем, плотность и гигроскопичность, (2) термодинамические свойства, такие как температура плавления, давление пара и растворимость, (3) кинетические свойства, такие как скорость растворения и стабильность, включая стабильность в условиях окружающей среды, в особенности к влаге и при условиях хранения, (4) поверхностные свой-4 008449 ства, такие как площадь поверхности, смачиваемость, межфазное натяжение и форма, (5) механические свойства, такие как твердость, прочность на растяжение, прессуемость, обработка, текучесть и смешиваемость; и (6) фильтрационные свойства. Данные свойства могут влиять, например, на технологический процесс и хранение фармацевтических композиций, включающих эплеренон. Желательны такие твердые формы эплеренона, которые обеспечивают улучшение одного или нескольких данных свойств относительно других твердых форм эплеренона. В соответствии с настоящим изобретением разработаны новые твердые формы эплеренона. Конкретно, они включают различные сольватированные кристаллические формы, по крайней мере две несольватированные и негидратированные кристаллические формы (обозначенные "форма Н" и "формаL"), и аморфную форму эплеренона. Каждая твердая форма эплеренона, рассмотренная в настоящем изобретении, обладает одним или несколькими вышеописанными благоприятными химическими и/или физическими свойствами по отношению к другим твердым формам, описанным в данном изобретении или иначе описанным в литературе. Форма Н и форма L упоминаются в приоритетных документах, заявляемых здесь, как "форма I" и "форма II" соответственно и иногда описываются в качестве "высокоплавкого полиморфа" и "низкоплавкого полиморфа" соответственно. Настоящее изобретение относится к форме L эплеренона. Форма L обладает более высокой физической стабильностью при температурах ниже температуры энантиотропного перехода (как обсуждается далее в настоящем описании), чем, например, форма Н. Твердые формы эплеренона, такие как форма L,которые не требуют специальных условий обработки или хранения и которые исключают необходимость в частой изобретательной замене, являются желательными. Например, выбор твердой формы эплеренона,которая является физически стабильной во время способа получения (такого как измельчение эплеренона для получения материала с уменьшенным размером частиц и увеличенной площадью поверхности) может исключить необходимость в специальных условиях обработки и повышении стоимости, обычно возникающих в связи с такими специальными условиями обработки. Аналогично, выбор твердой формы эплеренона, которая является стабильной в широком диапазоне условий хранения (особенно принимая во внимание различные возможные условия хранения, которые могут возникнуть во время срока службы продукта эплеренона), может помочь исключить полиморфные и другие изменения разложения эплеренона, которые могут привести к потере продукта или ухудшению эффективности продукта. Следовательно, выбор твердой формы эплеренона, такой как форма L, обладающей большей физической стабильностью, обеспечит значимое преимущество перед менее стабильными формами эплеренона. Форма Н эплеренона также имеет преимущество по сравнению с другими твердыми формами. В частности, она обладает более быстрой скоростью растворения (приблизительно на 30% быстрее) в водной среде, чем, например, форма L эплеренона при температуре ниже температуры энантиотропного перехода (как обсуждается далее в настоящем описании). Когда растворение эплеренона в желудочнокишечном тракте является скорость-контролирующей стадией для доставки эплеренона к целевым клеткам или тканям (мишеням), более быстрое растворение обычно приводит к улучшенной биодоступности. Следовательно, форма Н может обеспечить улучшенный профиль биодоступности по сравнению с формой L. Кроме того, выбор твердой формы эплеренона, имеющей более быструю скорость растворения по сравнению с другими твердыми формами с меньшей скоростью растворения, аналогичным образом обеспечивает большую гибкость в выборе эксципиентов и рецептуре фармацевтической композиции, в частности, в тех составах, которые предназначены для проявления немедленного высвобождения эплеренона. Изобретение также относится к сольватированным кристаллическим формам эплеренона. Такие сольватированные формы могут использоваться в качестве промежуточных соединений при получении формы Н и формы L, особенный интерес в контексте настоящего изобретения представляют сольватированные кристаллические формы эплеренона, которые при десольватации могут давать форму L эплеренона. Конкретное преимущество от применения сольватированной кристаллической формы в качестве промежуточного соединения заключается в "собственном микроизмельчении" кристалла, которое происходит при десольватации, как обсуждается далее в данном изобретении. Такое "собственное микроизмельчение" может снижать или исключать требования в отношении измельчения. Кроме того, когда все еще требуется дополнительное измельчение, более легко измельчать некоторые сольваты перед стадией десольватации, чем измельчать форму Н или форму L после десольватации сольватированной кристаллической формы. Фармацевтически приемлемые сольватированные кристаллические формы эплеренона также могут непосредственно использоваться в фармацевтических композициях. В одном варианте осуществления изобретения сольватированные кристаллические формы, используемые в таких непосредственно получаемых композициях, не содержат хлористого метилена, изопропанола или диэтилового эфира; в другом варианте осуществления они не содержат хлористого метилена, изопропанола, диэтилового эфира, метилэтилкетона или этанола; и еще в одном варианте осуществления не содержат хлористого метилена, изопропанола, диэтилового эфира, метилэтилкетона, этанола, этилацетата или ацетона. Наиболее предпочтительны для такого применения сольватированные кристаллические формы эплеренона, по существу,-5 008449 исключающие растворители, которые не являются фармацевтически приемлемыми растворителями. Сольватированные кристаллические формы, используемые в фармацевтических композициях,обычно и предпочтительно включают фармацевтически приемлемый более высококипящий растворитель и/или растворитель с водородными связями, такой как бутанол, но не ограничиваясь им. Предполагается, что сольватированные кристаллические формы совместно могут предлагать ряд различных скоростей растворения и, когда растворение эплеренона в желудочно-кишечном тракте является скоростьконтролирующей стадией доставки эплеренона к клеткам или тканям-мишеням, диапазон различной биодоступности по отношению к форме Н и форме L. Изобретение также относится к аморфной форме эплеренона. Аморфный эплеренон полезен в качестве промежуточного соединения для получения формы Н и формы L эплеренона. Кроме того, предполагается, что аморфный эплеренон обладает другой скоростью растворения и, когда аморфный эплеренон присутствует в фармацевтической композиции, растворение эплеренона в желудочно-кишечном тракте представляет собой скорость-контролирующую стадию доставки эплеренона к клеткам-мишеням, такой аморфный эплеренон может обеспечивать другую биодоступность по отношению к форме Н и форме L. Также представляют интерес комбинации твердых форм, выбранных из группы, состоящей из формы Н эплеренона, формы L эплеренона, сольватированных кристаллических форм эплеренона и аморфного эплеренона. Такие комбинации полезны, например, при получении фармацевтических композиций,обладающих множеством профилей растворения, включая композиции контролируемого высвобождения. В одном варианте осуществления настоящего изобретения предложена комбинация твердых форм,включающая форму L эплеренона, по крайней мере, в обнаруживаемом количестве, при балансе из одной или нескольких твердых форм, выбранных из формы Н эплеренона, сольватированных кристаллических форм эплеренона и аморфного эплеренона. В зависимости от предназначаемого применения твердой формы эплеренона, соображения технологического процесса могут повлиять на выбор конкретной твердой формы или на конкретную комбинацию таких твердых форм. Фазово-чистую форму L, например, обычно легче получить, чем фазовочистую форму Н. Смесь формы Н и формы L, однако, обычно более легко получить, чем фазово-чистую форму L. При этом возможно использование исходного материала эплеренона относительно низкой химической чистоты. Применение сольватированной кристаллической формы вместо формы Н или формыL в композиции исключает стадию технологического процесса, а именно десольватацию, для таких способов, которые в противном случае должны были происходить путем десольватации сольватированной кристаллической формы. В альтернативном случае стадия десольватации могла бы быть исключена, если, например, форму L непосредственно кристаллизуют из подходящего растворителя, исключая получение и десольватацию промежуточной сольватированной кристаллической формы. Такие способы описаны далее в настоящем описании более подробно. Определения В данном описании приняты следующие термины. Термин "аморфный" применительно к эплеренону относится к твердому состоянию, где молекулы эплеренона присутствуют в беспорядочном расположении и не образуют определяемую кристаллическую решетку или элементарную ячейку. При исследовании методом рентгеновской дифракции порошка аморфный эплеренон не дает каких-либо характеристичных кристаллических пиков. Термин "температура кипения" означает температуру кипения вещества или раствора при применяемых условиях способа. Термин "кристаллическая форма" применительно к эплеренону относится к твердой форме, где молекулы эплеренона расположены с образованием определенной кристаллической решетки, (i) включающей определенные элементарные ячейки и (ii) дающей дифракционные пики при действии рентгеновского облучения. Термин "кристаллизация" может относиться к кристаллизации и/или перекристаллизации в зависимости от используемых условий, относящихся к получению исходного материала эплеренона. Термин "вываривание" означает способ, в котором суспензию твердого эплеренона в растворителе или смеси растворителей нагревают при температуре кипения растворителя или смеси растворителей при применяемых условиях способа. Термин "непосредственная кристаллизация" относится к кристаллизации эплеренона непосредственно из подходящего растворителя без образования и десольватации промежуточной сольватированной кристаллической твердой формы эплеренона. Термин "лекарственное вещество эплеренона" означает эпреленон сам по себе, как указано в контексте, в котором используется этот термин, и может относиться к эплеренону, не входящему в состав рецептуры, или к эплеренону, присутствующему в качестве ингредиента фармацевтической композиции. Термин "размер частиц" относится к размеру частиц, измеренному с помощью обычных способов измерения размера частиц, хорошо известных в данной области, таких как рассеяние лазерного света,седиментационное фракционирование потока, фотонная корреляционная спектроскопия или дисковое центрифугирование."D90 размер частиц" представляет собой такой размер частиц, что 90% по весу частиц является-6 008449 меньшим, чем D90 размер частиц, измеренный с помощью обычных способов измерения размера частиц. Термин "ДСК" означает дифференциальную сканирующую калориметрию. Термин "ВЭЖХ" означает жидкостную хроматографию высокого давления. Термин "ИК" означает инфракрасный. Термин "чистота", если не указано другого, означает химическую чистоту эплеренона в соответствии с общепринятым ВЭЖХ анализом. Как использовано в данном описании "эплеренон низкой чистоты" обычно означает эплеренон, который содержит эффективное количество промотора роста кристаллов формы Н и/или ингибитора роста кристаллов формы L. Как использовано в данном описании, "эплеренон высокой чистоты" обычно означает эплеренон, который не содержит или содержит меньше эффективного количества промотора роста кристаллов формы Н и/или ингибитора роста кристаллов формы L. Термин "фазово-чистый" означает чистоту твердого эплеренона в отношении конкретной кристаллической или аморфной формы эплеренона, как определено описанными здесь аналитическими способами инфракрасной спектроскопии. Термин "XRPD" означает рентгеновскую дифракцию порошка. Термин "об./мин" означает обороты в минуту. Термин "ТГА" означает термогравиметрический анализ. Термин "Тпл" означает температуру плавления. Определение характеристик кристаллических форм 1. Молекулярная конформация Рентгеноструктурный анализ монокристалла указывает, что молекулярная конформация эплеренона различна для формы Н и формы L, в частности в отношении ориентации сложноэфирной группы в 7 положении стероидного кольца. Ориентацию сложноэфирной группы можно определять с помощью(торсионного) угла закручивания С 8-С 7-С 23-O1. В кристаллической решетке формы Н молекула эплеренона принимает конформацию, в которой метоксигруппа сложного эфира ориентирована приблизительно вдоль С-Н связи в 7-положении, а карбонильная группа расположена примерно над центром В-стероидного кольца. Торсионный угол (угол закручивания) С 8-С 7-С 23-O1 составляет приблизительно -73,0 в такой конформации. При такой ориентации карбонильный атом кислорода сложноэфирной группы (O1) находится в близком контакте с атомом кислорода 9,11-эпоксидного кольца (O4). Расстояние O1-O4 составляет примерно 2,97 , которое даже меньше расстояния контакта ван-дер-Ваальса, составляющего примерно 3,0(при оценке ван-дерВаальсова радиуса кислорода в 1,5 ). В кристаллической решетке формы L молекула эплеренона принимает конформацию, в которой сложноэфирная группа повернута приблизительно на 150 относительно таковой в форме Н, и торсионный угол С 8-С 7-С 23-O1 составляет приблизительно +76,9. При такой ориентации метоксигруппа сложного эфира направлена к 4,5-алкеновому сегменту А-стероидного кольца. При такой ориентации расстояние между каким-либо атомом кислорода сложноэфирной группы (O1, O2) и атомом кислорода 9,11 эпоксидного кольца (O4) увеличивается по сравнению с расстоянием, определенным для формы Н. Расстояние O2-O4 составляет приблизительно 3,04 , попадая как раз выше расстояния контакта ван-дерВаальса. Расстояние O1-O4 составляет примерно 3,45 . В сольватированных кристаллических формах, которые к настоящему времени проанализированы с помощью рентгеноструктурного дифракционного исследования их монокристаллов, молекула эплеренона, как показано, принимает конформацию, характерную для формы L. 2. Рентгеновская дифракция порошка Различные кристаллические формы эплеренона анализировали с использованием либо порошкового дифрактометра Siemens D5000, либо дифрактометра Inel Multipurpose. Для порошкового дифрактометраSiemens D5000 исходные данные измеряли для значений 2 (два тета) от 2 до 50 с шагом 0,020 и шаговым периодом 2 с. Для дифрактометра Inel Multipurpose образцы помещали в алюминиевые держатели для образцов, и исходные данные собирали в течение 30 мин при всех значениях 2 одновременно. В табл. 1 А-1 С указаны существенные параметры главных пиков в единицах значений 2 и интенсивности для кристаллических форм эплеренона: формы Н (полученной десольватацией сольвата этанола, полученного вывариванием эплеренона низкой чистоты), формы L (полученной десольватацией сольвата метилэтилкетона, полученного перекристаллизацией эплеренона высокой чистоты) и сольвата метилэтилкетона (полученного превращением при комнатной температуре суспензии эплеренона высокой чистоты в метилэтилкетоне) соответственно (рентгеновское облучение при длине волны 1,54056 ). Незначительные сдвиги в положении пиков могут присутствовать на дифракционных рентгенограммах формы Н и формы L в результате пространственных дефектов кристаллических дифракционных плоскостей, связанных с путем получения формы Н и формы L (т.е. десольватацией сольвата). Кроме того, форма Н выделена из сольвата, полученного вывариванием неочищенного эплеренона. Такой способ приводит к более низкой общей химической чистоте (приблизительно 90%) формы Н. Наконец, ожидается, что сольватированные формы эплеренона будут демонстрировать некоторый сдвиг в положении дифракционных пиков вследствие повышенной подвижности молекул растворителя в кристаллах рас-7 008449 творителя в кристаллической решетке. Таблица 1 А Рентгеновские дифракционные данные, форма Н Графические примеры дифракционных рентгенограмм для кристаллических форм эплеренона, а именно формы Н, формы L и сольвата метилэтилкетона представлены на фиг. 1, 2 и 3 соответственно. Для формы Н видны различимые пики при 7,00,2, 8,30,2 и 12,00,2 2. Для формы L проявляются различимые пики при 8,00,2, 12,40,2, 12,80,2 и 13,30,2 2. Для метилэтилкетонной сольватированной кристаллической формы различимые пики проявляются при 7,60,2, 7,80,2 и 13,60,2 2. Примеры дифракционных рентгенограмм представлены на фиг. 4-14 для следующих сольватиро- 10008449 ванных кристаллических форм эплеренона: сольвата н-пропилового спирта, сольвата тетрагидрофурана,сольвата этилпропионата, сольвата уксусной кислоты, сольвата ацетона, сольвата толуола, сольвата изопропанола, сольвата этанола, сольвата изобутилацетата, сольвата бутилацетата, сольвата метилацетата и сольвата пропилацетата, соответственно. 3. Температура плавления/разложения Температуры плавления и/или разложения несольватированных кристаллических форм эплеренона определяли с использованием дифференциального сканирующего калориметра ТА Instruments 2920. Каждый образец в количестве 1-2 мг помещали либо в герметически закрытый, либо в открытый алюминиевый лоток и нагревали, обеспечивая скорость подъема температуры примерно 10 С/мин. Температурный диапазон плавления/разложения определяли из экстраполированного начала к максимуму эндотермы плавления/разложения. Плавление формы Н и формы L эплеренона связывали с химическим разложением и потерей уловленного растворителя из кристаллической решетки. На температуру плавления/разложения также влияла обработка твердого вещества перед анализом. Например, неизмельченная форма L с D90 размером частиц примерно 180-450 мкм, полученная непосредственной кристаллизацией из подходящего растворителя или десольватацией сольвата, полученного кристаллизацией высокочистого эплеренона в подходящем растворителе или смеси растворителей,обычно имела диапазон плавления/разложения примерно от 237 до примерно 242 С. Измельченная форма L, имеющая D90 размер частиц примерно от 80 до примерно 100 мкм, полученная кристаллизацией сольвата из раствора высокочистого эплеренона в подходящем растворителе или смеси растворителей,десольватацией сольвата и измельчением полученной формы L, обычно имеет более низкий и более широкий диапазон плавления/разложения примерно от 223 до примерно 234 С. Неизмельченная форма Н сD90 размером частиц примерно 180-450 мкм, полученная десольватацией сольвата, полученного вывариванием эплеренона низкой чистоты, обычно имела более высокий диапазон плавления/разложения примерно от 247 до примерно 251 С. Примеры ДСК термограмм (а) неизмельченной формы L, непосредственно кристаллизованной из метилэтилкетона, (b) неизмельченной формы L, полученной десольватацией сольвата, полученного кристаллизацией высокочистого эплеренона из метилэтилкетона, (с) формы L,полученной измельчением десольватированного сольвата, полученного кристаллизацией высокочистого эплеренона из метилэтилкетона, и (d) неизмельченной формы Н, полученной десольватаций сольвата,полученного вывариванием эплеренона низкой чистоты из метилэтилкетона, показаны на фиг. 15, 16, 17 и 18 соответственно. ДСК термограммы сольватированных форм эплеренона определяли с использованием дифференциального сканирующего калориметра Perkin Elmer Pyris 1. Каждый образец в количестве 1-2 мг помещали в открытый алюминиевый лоток и нагревали, обеспечивая скорость подъема температуры примерно 10 С/мин. Один или несколько эндотермических случаев при более низких температурах связывали с изменениями энтальпии, происходящими при потере растворителя из кристаллической решетки сольвата. Наиболее высокую температурную эндотерму или эндотермы связывали с плавлением/разложением формы L или формы Н эплеренона. Примеры ДСК термограмм показаны на фиг. 19-34 для следующих сольватных кристаллических форм эплеренона: сольвата н-пропилового спирта, сольвата тетрагидрофурана, сольвата этилпропионата,сольвата уксусной кислоты, сольвата хлороформа, сольвата ацетона, сольвата толуола, сольвата изопропанола, сольвата трет-бутилацетата, сольвата этанола, сольвата изобутилацетата, сольвата бутилацетата,сольвата метилацетата, сольвата пропилацетата, сольвата н-бутанола и сольвата н-октанола, соответственно. 4. Спектроскопия инфракрасного поглощения Спектры инфракрасного поглощения несольватированных формы Н и формы L получали с использованием спектрофотометра Nicolet DRIFT (диффузное отражение, инфракрасный Фурьепреобразователь) Magna System 550. Использовали коллекторную систему Spectra-Tech и чашки для микрообразцов. Анализ образцов (5%) проводили в бромиде калия и сканировали от 400 до 4000 см-1. Инфракрасные спектры эплеренона в разбавленном растворе хлороформа (3%) или в сольватированных кристаллических формах получали с помощью спектрофотометра Biorad FTS-45. Образцы раствора в хлороформе анализировали с использованием ячейки для раствора с длиной пути 0,2 мм с пластинами из соли хлорида натрия. Сольватные FT-ИК спектры (ИК-спектры с Фурье-преобразованием) регистрировали с использованием вспомогательного устройства IBM микро-MIR (множественное внешнее отражение). Образцы сканировали от 400 до 4000 см-1. Примеры инфракрасных спектров поглощения (а) формы Н, (b) формы L, (с) сольвата метилэтилкетона и (d) эплеренона в растворе хлороформа показаны на фиг. 35-38 соответственно. В табл. 2 приведены иллюстративные полосы поглощения для эплеренона в виде следующих кристаллических форм: форма Н, форма L и сольват метилэтилкетона. Для сравнения также приведены иллюстративные полосы поглощения для эплеренона в растворе хлороформа. Наблюдались различия между формой Н либо формой L, либо сольватом метилэтилкетона, например в карбонильной области спектра. Форма Н имеет сложноэфирную карбонильную полосу приблизительно при 1739 см-1, в то время как- 11008449 форма L и сольват метилэтилкетона имеют данную полосу приблизительно при 1724 и 1722 см-1 соответственно. Сложноэфирная карбонильная полоса проявляется приблизительно при 1727 см-1 в случае эплеренона в растворе хлороформа. Изменения частоты поглощения сложноэфирного карбонила между формой Н и формой L отражают изменения в ориентации сложноэфирной группы в двух кристаллических формах. Кроме того, полоса сложного эфира коньюгированного кетона в А-стероидном кольце смещается приблизительно от 1664-1667 см-1 или в форме Н, или в сольвате метилэтилкетона до примерно 1655 см-1 в форме L. Соответствующие карбонильные полосы проявляются примерно при 1665 см-1 в растворе хлороформа. Другое различие между формой Н и формой L наблюдалось в области С-Н напряженнодеформированного состояния. Форма Н имеет поглощение приблизительно при 1399 см-1, которое не наблюдается для формы L, сольвата метилэтилкетона или эплеренона в растворе хлороформа. Полоса при 1399 см-1 существует в области СН 2-отсечения для С 2 и С 21 метиленовых групп, смежных с карбонильными группами. ИК-полосы поглощения (см-1) для форм эплеренона Примеры спектров инфракрасного поглощения приведены на фиг. 39-51 для следующих сольватных кристаллических форм эплеренона: сольвата н-пропилового спирта, сольвата тетрагидрофурана,сольвата этилпропионата, сольвата уксусной кислоты, сольвата ацетона, сольвата толуола, сольвата изопропанола, сольвата этанола, сольвата изобутилацетата, сольвата бутилацетата, сольвата пропилацетата,сольвата метилацетата, сольвата пропиленгликоля и сольвата трет-бутилацетата соответственно. 5. Спектроскопия ядерного магнитного резонанса (ЯМР) Спектры 13 С ЯМР были получены в области 31,94 МГц. Примеры спектров 13 С ЯМР формы Н и формы L эплеренона показаны на фиг. 52 и 53 соответственно. В результате анализа данных, представленных на фиг. 52, форма Н эплеренона не была фазово-чистой и включала небольшое количество формы L эплеренона. Форма Н наиболее четко отличается по резонансу углерода в области 64,8, 24,7 и 19,2 м.д. Форма L наиболее четко отличается по резонансу углерода в области 67,1 и 16,0 м.д. 6. Термогравиметрия Термогравиметрический анализ осуществляли с использованием термогравиметрического анализатора ТА Instruments TGA 2950. Образцы помещали в открытые алюминиевые контейнеры в токе азота. Исходная температура составляла 25 С со скоростью повышения температуры примерно 10 С/мин. Примеры профилей термогравиметрического анализа показаны на фиг. 54-71 для следующих сольватированных кристаллических форм эплеренона: сольвата метилэтилкетона, сольвата н-пропилового спирта, сольвата тетрагидрофурана, сольвата этилпропионата, сольвата уксусной кислоты, сольвата хлороформа, сольвата ацетона, сольвата толуола, сольвата изопропанола, сольвата этанола, сольвата изобутилацетата, сольвата бутилацетата, сольвата метилацетата, сольвата пропилацетата, сольвата пропиленгликоля, сольвата н-бутанола, сольвата н-октанола и сольвата трет-бутилацетата соответственно. 7. Микроскопия Высокотемпературную микроскопию осуществляли для отдельных кристаллов сольвата метилэтилкетона эплеренона с использованием Linkam THMS 600 Hot Stage совместно с универсальным поляризованным оптическим микроскопом Zeiss. В поляризованном свете при комнатной температуре кристалл сольвата являлся двулучепреломляющим и прозрачным, указывая на то, что кристаллическая решетка имеет высокий порядок. При повышении температуры примерно до 60 С вдоль длинной оси кристалла начинали появляться заметные дефекты. Сканирующая электронная микрография формы L эплеренона,полученной десольватацией сольвата метилэтилкетона, показана на фиг. 72 и выявляет дефекты поверхности, поры, трещины и разломы внутри кристаллической решетки. Сканирующая электронная микрография формы L эплеренона, полученной непосредственной кристаллизацией из этилацетата, показана на фиг. 73 и здесь не проявляется подобных дефектов поверхности, пор, трещин и разломов внутри кри- 12008449 сталлической решетки. 8. Параметры элементарной ячейки В табл. 3 А-3 С обобщены параметры элементарной ячейки, определенные для формы Н, формы L и нескольких сольватированных кристаллических форм эплеренона. Таблица 3 А Параметры элементарной ячейки кристаллических форм эплеренона Таблица 3 В Параметры элементарной ячейки кристаллических форм эплеренона Молекулы сольвата бутилацетата не были полностью уточнены из-за разупорядоченности молекул растворителя в каналах. Таблица 3 С Параметры элементарной ячейки кристаллических форм эплеренона 1 Молекулы сольвата бутилацетата не были полностью уточнены из-за разупорядоченности молекул растворителя в каналах. Дополнительная информация о некоторых сольватированных кристаллических формах эплеренона представлена в табл. 4. Данные элементарной ячейки в табл. 3 А для сольвата метилэтилкетона также являются представительными в ряду параметров элементарной ячейки для многих таких дополнительных кристаллических сольватов эплеренона. Большинство исследованных кристаллических сольватов эплеренона, по существу, изоструктурны друг другу. Хотя могут быть некоторые небольшие сдвиги в пиках рентгеновской дифракции порошка при переходе от одной сольватированной кристаллической формы к следующей из-за размера включенных молекул растворителя, в целом, дифракционные рентгенограммы являются, по существу, одинаковыми и параметры элементарных ячеек и молекулярные положения, по существу, идентичны для большинства исследованных сольватов. Таблица 4 Дополнительная информация по сольватам эплеренона 1 Определена как экстраполированная температура десольватации по конечной стадии потери веса растворителя, определенной термогравиметрическим анализом при скорости нагрева 10 С/мин в токе азота. Однако на температуры десольватации может влиять способ получения сольвата. Различные способы могут давать различное число мест зародышеобразования, способных к инициированию десольватации в сольвате при более низкой температуре. Элементарная ячейка сольвата состоит из четырех молекул эплеренона. Стехиометрия молекул эплеренона и молекул растворителя в элементарной ячейке для ряда сольватов также указана в табл. 4. Элементарная ячейка формы Н состоит из четырех молекул эплеренона. Элементарная ячейка формы L состоит из двух молекул эплеренона. Элементарные ячейки сольватов превращаются во время десольватации в элементарные ячейки формы Н и/или формы L, где молекулы эплеренона подвергаются перемещению и вращению для заполнения пространства, освобожденного молекулами растворителя. В табл. 4 также приведены температуры десольватации для ряда различных сольватов. 9. Кристаллические свойства примесей Некоторые примеси эплеренона могут индуцировать образование формы Н во время десольватации сольвата. В частности, оценивали влияние следующих двух примесей: 7-метил,водород-4,5; 9,11 диэпокси-17-гидрокси-3-оксо-17-прегнан-7,21-дикарбоксилат, -лактон (III) ("диэпоксид") и 7 метил,водород-11,12-эпокси-17-гидрокси-3-оксо-17-прегн-4-ен-7,21-дикарбоксилат, -лактон (IV) Влияние данных примесей на кристаллическую форму эплеренона, полученную при десольватации,более подробно описано в примерах. Исходя из подобия монокристаллической структуры 7-метил,водород-17-гидрокси-3-оксо-17 прегна-4,9(11)-диен-7,21-дикарбоксилата, -лактона (V) ("9,11-олефин") и формы Н эплеренона, предполагается, что 9,11-олефин также может индуцировать образование формы Н во время десольватации сольвата. Монокристаллическую форму выделяли для каждого из соединений-примесей. Представительные- 15008449 дифракционные порошковые рентгенограммы для кристаллических форм, выделенных для диэпоксида,11,12-эпоксида и 9,11-олефина приведены на фиг. 74-76 соответственно. Дифракционная порошковая рентгенограмма каждой из примесных молекул подобна дифракционной порошковой рентгенограмме формы Н, предполагая, что форма Н и три примесных соединения имеют сходные структуры монокристаллов. Также выделяли монокристаллы каждого из примесных соединений и проводили их рентгеноструктурное исследование для проверки того, что данные три соединения принимают структуры монокристаллов, подобные таковой для формы Н. Монокристаллы диэпоксида выделяли из метилэтилкетона. Монокристаллы 11,12-эпоксида выделяли из изопропанола. Монокристаллы 9,11-олефина выделяли из н-бутанола. Данные кристаллической структуры, определенные для кристаллической формы каждого из примесных соединений, приведены в табл. 5. Полученные кристаллические системы и параметры ячейки, по существу, являются одинаковыми для кристаллических форм формы Н, диэпоксида, 11,12 эпоксида и 9,11-олефина. Таблица 5 Параметры элементарной ячейки кристаллов примесей в сравнении с формой Н эплеренона Четыре соединения, представленные в табл. 5, кристаллизуются в одной и той же пространственной группе и имеют сходные параметры элементарной ячейки (т.е. они являются изоструктурными). Высказано предположение, что диэпоксид, 11,12-эпоксид и 9,11-олефин принимают конформацию формы Н. Относительная легкость выделения упаковки формы Н (непосредственно из раствора) для каждого примесного соединения указывает на то, что кристаллическая решетка формы Н представляет собой стабильный способ упаковки для данного ряда структурно подобных соединений. Подразумевается, что любое соединение, которое, по существу, является кристаллографически изоструктурным форме Н, может использоваться в качестве присадочной примеси при кристаллизации формы Н эплеренона из раствора. Соответственно, в конкретном варианте осуществления разработан способ промотирования кристаллизации формы Н эплеренона из раствора эплеренона в растворителе или смеси растворителей, указанный способ включает введение добавки в раствор перед кристаллизацией эффективного количества соединения, которое, по существу, является кристаллографически изоструктурным форме Н эплеренона. Следует понимать, что "введение добавки" в данном случае может быть активным, т.е. преднамеренным добавлением присадочного соединения в раствор, или пассивным, т.е. возникающим из-за присутствия присадочного соединения в качестве примеси в растворе. Предпочтительные присадочные соединения в соответствии с данным вариантом осуществления представляют собой диэпоксид, 11,12-эпоксид и 9,11-олефин, т.е. соединения (III), (IV) и (V) соответственно, представленные выше. Получение эплеренона Исходный эплеренон, использованный для получения новых кристаллических форм согласно настоящему изобретению, может быть получен способами, известными сами по себе, включая способы,указанные в процитированных выше заявках на Международный патент WO97/21720 и WO98/25948, в особенности на схеме 1, представленной в каждой из данных публикаций.- 16008449 Получение кристаллических форм 1. Получение сольватированной кристаллической формы. Сольватированные кристаллические формы эплеренона могут быть получены кристаллизацией эплеренона из подходящего растворителя или из смеси подходящих растворителей. Подходящий растворитель или смесь подходящих растворителей обычно включает органический растворитель или смесь органических растворителей, которая солюбилизирует эплеренон вместе с любыми примесями при повышенной температуре, но при охлаждении предпочтительно кристаллизуется сольват. Растворимость эплеренона в таких растворителях или смеси растворителей обычно составляет примерно от 5 до примерно 200 мг/мл при комнатной температуре. Растворитель или смеси растворителей предпочтительно выбирают из таких растворителей, которые предварительно использовали в способе получения исходного материала эплеренона, в частности такие растворители, которые были бы фармацевтически приемлемыми, если будут содержаться в конечной фармацевтической композиции, включающей кристаллическую форму эплеренона. Например, система растворителей, включающая хлористый метилен, которая дает сольват, включающий хлористый метилен, обычно является нежелательной. Каждый используемый растворитель предпочтительно является фармацевтически приемлемым, в частности растворителем 2- или 3-го класса, как определено в "Impurities:guideline for residual solvents(Примеси: указания для остаточных растворителей)" International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use (Международная конференция по гармонизации технических требований для регистрации фармацевтических препаратов для применения человеком) (рекомендовано к принятию на 4 стадии процесса ICH 17 июля 1997 г., руководящим комитетом ICH). Еще более предпочтительно растворитель или смесь растворителей выбирают из группы,включающей метилэтилкетон, 1-пропанол, 2-пентанон, уксусную кислоту, ацетон, бутилацетат, хлороформ, этанол, изобутанол, изобутилацетат, метилацетат, этилпропионат, н-бутанол, н-октанол, изопропанол, пропилацетат, пропиленгликоль, трет-бутанол, тетрагидрофуран, толуол, метанол и третбутилацетат. Еще более предпочтительно, растворитель выбирают из группы, включающей метилэтилкетон и этанол. В другом варианте осуществления данного способа растворитель или смесь растворителей выбирают из группы, включающей 1-пропанол, 2-пентанон, уксусную кислоту, ацетон, бутилацетат, хлороформ,изобутанол, изобутилацетат, метилацетат, этилпропионат, н-бутанол, н-октанол, пропилацетат, пропиленгликоль, трет-бутанол, тетрагидрофуран, толуол, метанол и трет-бутилацетат. В другом варианте осуществления данного способа растворитель или смесь растворителей выбирают из группы, включающей 1-пропанол, 2-пентанон, уксусную кислоту, ацетон, бутилацетат, хлороформ,изобутанол, изобутилацетат, метилацетат, этилпропионат, н-бутанол, н-октанол, н-пропанол, пропилацетат, пропиленгликоль, трет-бутанол, тетрагидрофуран, толуол, метанол и трет-бутилацетат. Для получения сольватированной кристаллической формы эплеренона некоторое количество исходного эплеренона солюбилизируют в объеме растворителя и охлаждают до образования кристаллов. Температура растворителя, при которой эплеренон добавляют к растворителю, обычно будет выбираться на основе кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей, например, такая температура растворителя обычно составляет по крайней мере примерно 25 С, предпочтительно в интервале примерно от 30 С до температуры кипения растворителя и более предпочтительно в интервале примерно от на 25 С ниже температуры кипения растворителя до температуры кипения растворителя. Альтернативно, к эплеренону можно добавлять горячий растворитель, и смесь может быть охлаждена до образования кристаллов. Температура растворителя во время его добавления к эплеренону обычно будет выбираться на основе кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей, например, температура растворителя обычно составляет по крайней мере примерно 25C, предпочтительно примерно от 50 С до температуры кипения растворителя и более предпочтительно в интервале примерно от на 15 С ниже температуры кипения растворителя до температуры кипения растворителя. Количество исходного эплеренона, смешиваемого с данным объемом растворителя, аналогично будет зависеть от кривой растворимости растворителя или смеси растворителей. Обычно количество эплеренона, добавляемого к растворителю, не будет растворяться полностью в данном объеме растворителя при комнатной температуре. Для большинства описанных здесь растворителей, например, количество исходного эплеренона, смешиваемого с данным объемом растворителя, обычно превышает по крайней мере от 1,5 до 4,0 раз, предпочтительно примерно от 2,0 до примерно 3,5 раз и более предпочтительно примерно в 2,5 раза количество эплеренона, которое будет растворяться в данном объеме растворителя при комнатной температуре. После того, как исходный эплеренон полностью растворился в растворителе, раствор обычно медленно охлаждают для кристаллизации сольватированной кристаллической формы эплеренона. Для большинства описанных здесь растворителей, например, раствор охлаждают со скоростью, медленнее примерно 20 С/мин, предпочтительно со скоростью, составляющей примерно 10 С/мин или медленнее,более предпочтительно со скоростью примерно 5 С/мин или медленнее, и еще более предпочтительно со- 17008449 скоростью примерно 1 С/мин или медленнее. Конечная температура, при которой собирают сольватированную кристаллическую форму, будет зависеть от кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей конечная температура обычно составляет ниже примерно 25 С, предпочтительно ниже примерно 5 С и более предпочтительно ниже примерно -5 С. Снижение конечной температуры обычно благоприятствует образованию сольватированной кристаллической формы. Альтернативно, для получения сольвата могут быть использованы другие способы. Примеры таких способов включают, но не ограничиваются ими, (i) растворение исходного эплеренона в одном растворителе и добавление сорастворителя, способствующего кристаллизации кристаллической формы сольвата,(ii) испарительно-диффузионный рост сольвата, (iii) выделение сольвата упариванием, таким как упаривание с помощью роторного испарителя и (iv) преобразование суспензии. Кристаллы сольватированной кристаллической формы, полученной, как описано выше, могут быть отделены от растворителя любыми подходящими способами, такими как фильтрование или центрифугирование. Интенсивное перемешивание системы растворителя во время кристаллизации обычно приводит к кристаллическим частицам меньшего размера. 2. Получение формы L из сольвата. Форма L эплеренона может быть получена непосредственно десольватацией из сольватированной кристаллической формы. Десольватацию можно осуществлять любыми подходящими способами, такими как, но не ограничиваясь ими, нагревание сольвата, снижение давления среды, окружающей сольват, или их сочетанием. Если сольват нагревают для удаления растворителя, как, например, в печи, температура сольвата во время осуществления процесса обычно не превышает температуры энантиотропного перехода для формы Н и формы L. Данная температура предпочтительно не превышает примерно 150 С. Давление десольватации и время десольватации не являются узко критическими. Давление десольватации предпочтительно составляет примерно 1 атм или менее. Однако при понижении давления десольватации температура, при которой может быть осуществлена десольватация, и/или время десольватации также снижаются. В частности, для сольватов, имеющих более высокие температуры десольватации, сушка в вакууме позволяет применять более низкие температуры сушки. Время десольватации должно быть только достаточным для возможности завершения десольватации и, таким образом, для образования формы L. Для получения продукта, который содержит, по существу, целиком форму L, исходный эплеренон обычно представляет собой эплеренон высокой чистоты, предпочтительно, по существу, чистый эплеренон. Исходный эплеренон, используемый для получения формы L эплеренона, обычно имеет по крайней мере 90% чистоту, предпочтительно по крайней мере 95% чистоту и более предпочтительно по крайней мере 99% чистоту. Как более подробно обсуждается в данном изобретении, некоторые примеси в исходном эплереноне могут неблагоприятно влиять на выход и содержание формы L в продукте, получаемом при проведении процесса. Кристаллизованный продукт эплеренона, получаемый таким способом из исходного эплеренона высокой чистоты, обычно включает по крайней мере 10% формы L, предпочтительно по крайней мере 50% формы L, более предпочтительно по крайней мере 75% формы L, еще более предпочтительно по крайней мере 90% формы L, еще более предпочтительно по крайней мере примерно 95% формы L и еще более предпочтительно, по существу, представляет фазово-чистую форму L. 3. Получение формы Н из сольвата. Продукт, включающий форму Н, может быть получен, по существу, таким же способом, как указано выше для получения формы L, посредством (i) использования исходного эплеренона более низкой чистоты вместо исходного эплеренона высокой чистоты, (ii) внесения затравки в систему растворителей кристаллов фазово-чистой формы Н или (iii) сочетания (i) и (ii). 3.1. Использование примесей в качестве промоторов и ингибиторов роста кристаллов. Наличие и количество заданных примесей в исходном эплереноне в большей мере, нежели общее количество всех примесей в исходном эплереноне, влияет на способность образования кристаллов формы Н во время десольватации сольвата. Заданная примесь обычно представляет собой промотор роста формы Н или ингибитор роста формы L. Она может содержаться в исходном эплереноне, в растворителе или смеси растворителей перед добавлением исходного эплеренона и/или добавляться к растворителю или смеси растворителей после добавления исходного эплеренона. В статье Bonafede et al. (1995), "Selective nucleation and growth of an organic polymorph by ledgedirected epitaxy on a molecular crystal substrate(Селективное зародышеобразование и рост органических полиморфов путем непосредственноподстилающего эпитаксиального выращивания кристаллов на молекулярном кристаллическом субстрате)", J. Amer. Chem. Soc., 117(30), включенной в настоящее описание в качестве ссылки, обсуждается применение промоторов роста и ингибиторов роста полиморфных систем. Для настоящего изобретения подходящая примесь обычно включает соединение, имеющее структуру монокристалла, идентичную структуре монокристалла формы Н эплеренона. Примесь предпочтительно представляет собой соединение, имеющее дифракционную порошковую рентгенограмму, по существу, идентичную дифракционной порошковой рентгенограмме формы Н эплеренона, и более предпочтительно ее выбирают из группы,- 18008449 состоящей из диэпоксида, 11,12-эпоксида, 9,11-олефина и их сочетаний. Количество примеси, необходимое для получения кристаллов формы Н, обычно может зависеть,частично, от растворителя или смеси растворителей и растворимости примеси относительно эплеренона. Например, при кристаллизации формы Н из метилэтилкетона в качестве растворителя весовое соотношение диэпоксида к исходному эплеренону низкой чистоты обычно составляет по крайней мере примерно 1:100, предпочтительно по крайней мере примерно 3:100, более предпочтительно примерно от 3:100 примерно до 1:5 и еще более предпочтительно примерно от 3:100 примерно до 1:10. 11,12-Эпоксид имеет более высокую растворимость в метилэтилкетоне, чем диэпоксид, и обычно требуется большее количество 11,12-эпоксида для получения кристаллов формы Н эплеренона. Когда примесь включает 11,12 эпоксид, весовое соотношение диэпоксида к исходному эплеренону низкой чистоты обычно составляет примерно 1:5, более предпочтительно по крайней мере 3:25 и еще более предпочтительно примерно от 3:25 до примерно 1:5. Когда при получении кристаллов формы Н используют обе примеси, диэпоксид и 11,12-эпоксид, весовое соотношение каждой примеси к исходному веществу эплеренона может быть меньше, чем соответствующее соотношение, когда при получении кристаллов формы Н эплеренона используют только одну из примесей. Смесь формы Н и формы L эплеренона обычно получают при десольватации сольвата, содержащего заданную примесь. Весовая фракция формы Н в продукте, полученном при начальной десольватации сольвата, обычно составляет менее примерно 50%. Дополнительная обработка данного продукта кристаллизацией или вывариванием, как обсуждается ниже, обычно будет увеличивать весовую фракцию формы L в продукте. 3.2. Внесение затравки. Кристаллы формы Н также могут быть получены путем внесения затравки в систему растворителей фазово-чистых кристаллов формы Н (или промотора роста формы Н и/или ингибитора роста формы L,как ранее обсуждалось выше) перед кристаллизацией эплеренона. Исходный эплеренон может представлять собой либо эплеренон низкой чистоты, либо эплеренон высокой чистоты. Когда конечный сольват,полученный из какого-либо исходного материала, десольватируют, весовая фракция формы Н в продукте обычно составляет по крайней мере примерно 70% и может достигать примерно 100%. Весовое соотношение зародышевых кристаллов формы Н, добавляемых в систему растворителя к исходному эплеренону, добавляемому в систему растворителя, составляет по крайней мере примерно 0,75:100, предпочтительно примерно от 0,75:100 до примерно 1:20 и более предпочтительно примерно от 1:100 до примерно 1:50. Зародышевые кристаллы формы Н могут быть получены любыми способами,обсуждаемыми в данном изобретении для получения кристаллов формы Н, в частности получением кристаллов формы Н вывариванием, обсуждаемым далее. Зародышевые кристаллы формы Н могут добавляться однократно, добавляться множество раз или,по существу, непрерывно в течение некоторого периода времени. Однако добавление зародышевых кристаллов формы Н обычно завершают перед началом кристаллизации эплеренона из раствора, т.е. внесение затравки завершают перед достижением температуры помутнения (более низкая точка метастабильной зоны). Внесение затравки обычно осуществляют, когда температура раствора составляет примерно от на 0,5 С выше температуры помутнения до примерно на 10 С выше температуры помутнения, предпочтительно в диапазоне примерно от на 2-3 С выше температуры помутнения. Если температура выше температуры помутнения, при которой добавляют затравку, увеличивается, то обычно увеличивается количество затравки, необходимое для кристаллизации кристаллов формы Н. Внесение затравки предпочтительно осуществляют не только при температуре выше температуры помутнения, но и в пределах метастабильной зоны. Как температура помутнения, так и метастабильная зона зависят от растворимости эплеренона и концентрации его в растворителе или смеси растворителей. Например, для 12-кратного объемного разбавления с использованием метилэтилкетона самая высокая точка метастабильной зоны обычно составляет примерно от 70 до примерно 73 С, а более низкая точка метастабильной зоны (т.е. температура помутнения) составляет примерно от 57 до примерно 63 С. Для концентрации в 8 объемов метилэтилкетона метастабильная зона даже сужается, поскольку раствор является перенасыщенным. При такой концентрации температура помутнения раствора наблюдается при примерно от 75 до примерно 76 С. Поскольку температура кипения метилэтилкетона составляет примерно 80 С в условиях окружающей среды, внесение затравки для данного раствора обычно происходит между примерно 76,5 С и температурой кипения. Иллюстративный неограничивающий пример внесения затравки с использованием формы Н указан в заявке на изобретение в примере 7. Кристаллизованный продукт эплеренона, полученный с использованием промотора роста формы Н или ингибитора роста формы L и/или внесения затравки формы Н, обычно включает по крайней мере 2% формы Н, предпочтительно по крайней мере 5% формы Н, более предпочтительно по крайней мере 7% формы Н и еще более предпочтительно по крайней мере примерно 10% формы Н. Оставшийся кристаллизованный продукт эплеренона обычно представляет форму L. 3.3. Получение формы Н путем измельчения эплеренона. Еще в другом альтернативном варианте изобретения было установлено, что небольшое количество- 19008449 формы Н может быть получено путем подходящего измельчения эплеренона. В измельченном эплереноне наблюдалась концентрация формы Н вплоть до примерно 3%. 4. Получение формы L эплеренона из сольвата, полученного из эплеренона низкой чистоты. Как обсуждалось выше, кристаллизация эплеренона низкой чистоты с образованием сольвата с последующей десольватацией сольвата, обычно приводит к продукту, включающему как форму Н, так и форму L. Продукт, имеющий большее содержание формы L, может быть получен из эплеренона низкой чистоты, по существу, таким же способом, как указано выше, для получения формы Н с помощью внесения затравки кристаллов фазово-чистой формы L в систему растворителя или с использованием промотора роста формы L и/или ингибитора роста формы Н. Протоколы внесения затравки и весовое соотношение количества затравочных кристаллов формыL, добавляемых к системе растворителей, к количеству исходного эплеренона, добавляемого к системе растворителей, обычно являются такими же, что и обсуждавшиеся выше соотношения для получения формы Н эплеренона путем внесения затравки кристаллов фазово-чистой формы Н. Кристаллизованный продукт эплеренона, полученный таким образом, обычно содержит по крайней мере 10% формы L, предпочтительно по крайней мере 50% формы L, более предпочтительно по крайней мере 75% формы L, более предпочтительно по крайней мере 90% формы L, еще более предпочтительно по крайней мере 95% формы L и еще более предпочтительно представляет, по существу, фазово-чистую форму L. Описанные здесь протоколы внесения затравки, относящиеся к получению формы Н эплеренона,также позволяют улучшенный контроль размера частиц кристаллизованного эплеренона. 5. Кристаллизация формы L непосредственно из раствора. Форма L эплеренона также может быть получена непосредственной кристаллизацией эплеренона из подходящего растворителя или смеси растворителей без образования промежуточного сольвата и сопровождающей это необходимостью в десольватации. Обычно (i) растворитель имеет молекулярный размер,который несовместим с доступным пространством канала в кристаллической решетке сольвата, (ii) эплеренон и любые присутствующие примеси растворимы в растворителе при повышенных температурах и(iii) охлаждение приводит к кристаллизации несольватированной формы L эплеренона. Растворимость эплеренона в растворителе или смеси растворителей обычно составляет примерно от 5 до примерно 200 мг/мл при комнатной температуре. Растворитель или смесь растворителей предпочтительно включает один или несколько растворителей, выбранных из группы, состоящей из метанола, этилацетата, изопропилацетата, ацетонитрила, нитробензола, воды и этилбензола. Для кристаллизации формы L эплеренона непосредственно из раствора количество исходного эплеренона солюбилизируют в объеме растворителя и охлаждают до образования кристаллов. Температуру растворителя, при которой к растворителю добавляют эплеренон, обычно будут выбирать на основании кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей такая температура растворителя обычно будет составлять по крайней мере примерно 25 С,предпочтительно примерно от 30 С до температуры кипения растворителя и более предпочтительно в интервале примерно от на 25 С ниже температуры кипения растворителя до температуры кипения растворителя. Альтернативно, горячий растворитель можно добавлять к эплеренону, и смесь охлаждают до образования кристаллов. Температура растворителя во время его добавления к эплеренону обычно выбирается на основе кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей такая температура растворителя обычно составляет по крайней мере примерно 25 С,предпочтительно примерно от 50 С до температуры кипения растворителя и более предпочтительно в интервале примерно от на 15 С ниже температуры кипения растворителя до температуры кипения растворителя. Количество исходного эплеренона, смешиваемого с данным объемом растворителя, аналогично будет зависеть от кривой растворимости растворителя или смеси растворителей. Обычно количество эплеренона, добавляемого к растворителю, не будет растворяться полностью в данном объеме растворителя при комнатной температуре. Для большинства описанных здесь растворителей, например, количество исходного эплеренона, смешиваемого с данным объемом растворителя, обычно превышает по крайней мере от 1,5 до 4,0 раз, предпочтительно примерно от 2,0 до примерно 3,5 раз и более предпочтительно примерно в 2,5 раза количество эплеренона, которое будет растворяться в данном объеме растворителя при комнатной температуре. Для того чтобы гарантировать получение продукта, который включает, по существу, фазово-чистую форму L, исходный эплеренон обычно представляет собой эплеренон высокой чистоты. Исходный эплеренон предпочтительно имеет примерно 65% чистоту, более предпочтительно по крайней мере 90% чистоту, еще более предпочтительно по крайней мере примерно 98% чистоту и наиболее предпочтительно по крайней мере примерно 99% чистоту. После того, как исходный эплеренон полностью растворился в растворителе, раствор обычно медленно охлаждают для кристаллизации формы L эплеренона. Для большинства описанных здесь растворителей, например, раствор охлаждают со скоростью, медленнее примерно 1 С/мин, предпочтительно со- 20008449 скоростью, составляющей примерно 0,2 С/мин или медленнее и более предпочтительно со скоростью примерно от 0,05 до примерно 0,1 С/мин. Конечная температура, при которой собирают кристаллы формы L, будет зависеть от кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей конечная температура обычно составляет ниже примерно 25, предпочтительно ниже примерно 5 и более предпочтительно ниже примерно -5 С. Альтернативно, для получения кристаллов формы L эплеренона можно использовать другие способы. Примеры таких способов включают, но не ограничиваются ими, (i) растворение исходного вещества эплеренона в одном растворителе и добавление сорастворителя, способствующего кристаллизации формы L эплеренона, (ii) испарительно-диффузионный рост формы L эплеренона, (iii) выделение формы L эплеренона упариванием, таким как упаривание с помощью роторного испарителя и (iv) преобразование суспензии. Кристаллы формы L эплеренона, полученной, как описано выше, могут быть отделены от растворителя любыми подходящими способами, такими как фильтрование или центрифугирование. Кроме того, форма L эплеренона может быть получена вывариванием (как описано ниже) суспензии эплеренона высокой чистоты в метилэтилкетоне и фильтрованием вываренного эплеренона при температуре кипения суспензии. 6. Получение формы Н непосредственно из раствора. Существует гипотеза, что если кристаллизацию осуществлять при температуре, превышающей температуру энантиотропного перехода (Tt) для формы Н и формы L, в особенности, если присутствуют промоторы роста формы Н или ингибиторы роста формы L или в растворитель внесена затравка фазовочистых кристаллов формы Н, то форма Н будет непосредственно кристаллизоваться из раствора, поскольку форма Н является более стабильной при таких более высоких температурах. Используемая система растворителя предпочтительно включает высококипящий растворитель, такой как нитробензол. Подходящие промоторы роста формы Н включают, но не ограничиваются ими, соединения диэпоксид и 11,12-олефин, описанные ранее. 7. Вываривание эплеренона с растворителем. Сольватированные кристаллические формы, форма Н и форма L эплеренона также могут быть получены вывариванием исходного эплеренона в подходящем растворителе или смеси растворителей. В способе вываривания суспензию эплеренона нагревают при температуре кипения растворителя или смеси растворителей. Например, некоторое количество исходного эплеренона объединяют с некоторым объемом растворителя или смеси растворителей, нагревают до кипения с обратным холодильником и удаляют дистиллят, в то время как одновременно при отгонке дистиллята добавляют дополнительное количество растворителя. Альтернативно, дистиллят может быть сконденсирован и возвращен в цикл без добавления дополнительного растворителя во время процесса вываривания. Обычно, когда первоначальный объем растворителя удален или сконденсирован и рециркулирован, суспензию охлаждают и образуются сольватированные кристаллы. Сольватированные кристаллы могут быть отделены от растворителя любыми подходящими традиционными способами, такими как фильтрование или центрифугирование. Десольватация сольвата, как описано ранее, дает либо форму Н, либо форму L эплеренона в зависимости от присутствия или отсутствия селективных примесей в сольватированных кристаллах. Подходящий растворитель или смесь растворителей обычно включают один или несколько ранее раскрытых в данном описании растворителей. Например, растворитель может быть выбран из группы,состоящей из метилэтилкетона и этанола. Количество исходного эплеренона, добавляемого к используемому растворителю в способе вываривания, обычно является достаточным для поддержания существования суспензии (т.е. эплеренон в растворителе или смеси растворителей растворен не полностью) при температуре кипения растворителя или смеси растворителей. Иллюстративно можно использовать концентрации эплеренона, составляющие примерно 0,25 г/мл в метилэтилкетоне или примерно 0,125 г/мл в этаноле. Суспензию обычно медленно охлаждают, как только завершен оборот растворителя, для кристаллизации сольватированной кристаллической формы эплеренона. Для исследованных растворителей суспензию охлаждают со скоростью, составляющей менее примерно 20 С/мин, предпочтительно примерно 10 С/мин или медленнее, более предпочтительно примерно 5 С/мин или медленнее и еще более предпочтительно со скоростью примерно 1 С/мин или медленнее. Конечная температура, при которой собирают сольватированную кристаллическую форму, будет зависеть от кривой растворимости растворителя или смеси растворителей. Для большинства описанных здесь растворителей конечная температура обычно составляет ниже примерно 25 С, предпочтительно ниже примерно 5 С и более предпочтительно ниже примерно -5 С. Если требуется продукт, включающий в основном или полностью форму L, обычно вываривают исходный эплеренон высокой чистоты. Исходный эплеренон высокой чистоты обычно имеет по крайней мере примерно 98% чистоту, более предпочтительно по крайней мере примерно 99% чистоту и еще более предпочтительно по крайней мере примерно 99,5% чистоту. Полученный таким образом вываренный продукт эплеренона обычно содержит по крайней мере примерно 10%, предпочтительно по крайней мере- 21008449 примерно 50%, более предпочтительно по крайней мере примерно 75%, еще более предпочтительно по крайней мере примерно 90%, еще более предпочтительно по крайней мере примерно 95% формы L и наиболее предпочтительно, по существу, представляет собой фазово-чистую форму L. Если требуется продукт, включающий в основном или полностью форму Н, обычно вываривают исходный эплеренон низкой чистоты. Исходный эплеренон низкой чистоты обычно содержит столько промотора роста формы Н и/или ингибитора роста формы L, сколько необходимо для получения формы Н. Предпочтительно, исходный эплеренон низкой чистоты имеет по крайней мере примерно 65% чистоту, более предпочтительно по крайней мере примерно 75% чистоту и еще более предпочтительно по крайней мере примерно 80% чистоту. Вываренный продукт эплеренона, полученный таким образом,обычно включает по крайней мере примерно 10%, предпочтительно по крайней мере примерно 50%, более предпочтительно по крайней мере примерно 75%, еще более предпочтительно по крайней мере примерно 90%, еще более предпочтительно по крайней мере примерно 95% формы Н и наиболее предпочтительно представляет собой, по существу, фазово-чистую форму Н. 8. Получение аморфного эплеренона. Аморфный эплеренон может быть получен в небольших количествах подходящим измельчением твердого эплеренона, как, например раздавливанием, размалыванием и/или тонким измельчением. Фазово-чистый аморфный эплеренон, т.е. аморфный эплеренон, по существу не содержащий кристаллического эплеренона, может быть получен, например, лиофилизацией раствора эплеренона, в частности водного раствора эплеренона. Такие способы проиллюстрированы в примерах 13 и 14 данного описания. Дополнительные технологические соображения. 1. Обсуждение термодинамической стабильности. Форма L является более термодинамически стабильной, чем форма Н при температурах окружающей среды. Как описано в примере 5 настоящего описания, когда органическую суспензию, содержащую эквивалентные количества формы Н и формы L, оставляют на ночь при комнатной температуре и затем собирают полученное твердое вещество и анализируют его методом рентгеновской порошковой дифракции, аналитические результаты указывают, что эплеренон полностью превратился в форму L. Данные дифференциальной сканирующей калориметрии (ДСК), обсуждавшиеся выше, указывают, что форма Н является термодинамически более стабильной, чем форма L при повышенных температурах, так как она имеет более высокую температуру плавления/разложения. Взятые вместе, превращение суспензии и данные ДСК указывают, что форма Н и форма L являются энантиотропно родственными, т.е. изменение соотношения стабильности между двумя полиморфами происходит вокруг температуры фазового перехода(Tt), где форма L является более стабильной при более низких температурах. На фиг. 77 показана взаимосвязь свободной энергии Гиббса и температуры, обычно наблюдаемой для энантиотропно родственных полиморфов, таких как форма Н и форма L эплеренона, где I и II относятся к форме Н и L соответственно, Tt означает температуру фазового перехода, Тm относятся к температурам плавления формы Н и формы L, a L относится к жидкости или расплавленному состоянию. Соответственно, температуры процессов предпочтительно поддерживают ниже температуры фазового перехода во время получения композиций, включающих форму L. Например, температуры сушки,используемые при десольватации, обычно составляют ниже примерно 150 С, предпочтительно ниже примерно 125 С, более предпочтительно ниже примерно 115 С, более предпочтительно ниже примерно 110 С и еще более предпочтительно примерно от 80 до примерно 110 С. Кроме того, охлаждение (как например, с использованием жидкого азота) может оказаться необходимым во время стадий процесса уменьшения размера частиц для поддержания температуры кристаллов формы L ниже температуры фазового перехода. 2. Обсуждение собственного микроизмельчения Способ, использованный для получения кристаллического эплеренона, может влиять на свойства полученной кристаллической формы. Например, форма L, полученная десольватацией сольвата, в большей мере охвачена поверхностными дефектами, порами, трещинами и разломами в пределах кристаллической решетки, чем форма L, полученная непосредственной кристаллизацией из раствора. Такое "собственное микроизмельчение" десольватированного кристалла приводит к увеличению как доступной площади поверхности кристалла, так и скорости растворения кристалла. Время растворения, таким образом,может быть укорочено посредством выбора кристаллов формы L, полученных десольватацией, удлинено посредством выбора кристаллов формы L, полученных непосредственной кристаллизацией или другим образом отрегулировано посредством выбора подходящего сочетания кристаллов формы L, полученных десольватацией, и кристаллов формы L, полученных непосредственной кристаллизацией. Собственное микроизмельчение также может эффективно снижать, или исключать необходимость уменьшения размера кристаллических частиц на стадиях обработки, когда при получении фармацевтической композиции используют кристаллы формы L, полученные десольватацией. Однако одним из недостатков применения таких кристаллов формы L является необходимость стадии десольватации, которая не требуется для кристаллов формы L, получаемых непосредственной кристаллизацией. Твердые формы, охарактеризованные способом получения- 22008449 Варианты осуществления настоящего изобретения также включают конкретные твердые формы эплеренона и их сочетания, полученные в соответствии со способами, раскрытыми в данном изобретении. В частности, форма Н эплеренона, сама по себе или в сочетании с одной или несколькими дополнительными твердыми формами (включая сольватированные кристаллические формы, форму L и аморфный эплеренон), полученная, как указано в данном описании, представляет собой один из вариантов осуществления настоящего изобретения. Кроме того, сольватированные кристаллические формы, используемые в качестве промежуточных продуктов при получении формы Н эплеренона десольватацией и полученные, как указано в данной заявке, представляют собой варианты осуществления настоящего изобретения. Комбинации твердых форм В комбинациях, включающих первую твердую форму эплеренона и вторую твердую форму эплеренона, где первая и вторая твердые формы эплеренона выбраны из формы Н, формы L, сольватированного эплеренона и аморфного эплеренона, может использоваться любое подходящее весовое соотношение первой твердой формы ко второй. Обычно в таких комбинациях весовое соотношение первой твердой формы ко второй предпочтительно составляет примерно от 1:99 до примерно 99:1 и более предпочтительно по крайней мере примерно 1:9, более предпочтительно по крайней мере примерно 1:1, более предпочтительно по крайней мере 2:1, более предпочтительно по крайней мере примерно 5:1 и наиболее предпочтительно по крайней мере 9:1. В соответствии с вариантом осуществления настоящего изобретения первая твердая форма представляет собой форму Н, а вторая твердая форма - форму L. В другом варианте осуществления также присутствует третья твердая форма. Размер частиц эплеренона Хотя каждая из вышеуказанных твердых форм эплеренона и их сочетания могут охватывать широкий диапазон размеров частиц эплеренона, было установлено, что уменьшение размера частиц твердой формы эплеренона до D90 размера частиц меньше примерно 400 мкм может улучшить биодоступность как не включенного в состав рецептуры эплеренона, так и фармацевтических композиций, включающих твердую форму эплеренона. Соответственно, D90 размер частиц эплеренона, не входящего в состав фармацевтической композиции, или эплеренона, используемого в качестве исходного материала при получении фармацевтической композиции, обычно составляет менее примерно 400 мкм, предпочтительно менее примерно 200 мкм, более предпочтительно менее примерно 150 мкм, еще более предпочтительно менее примерно 100 мкм и еще более предпочтительно менее примерно 90 мкм. В одном варианте осуществления D90 размер частиц составляет не менее примерно 25 мкм. D90 размер частиц примерно от 25 до примерно 400 мкм обычно устанавливается как имеющий приемлемую биодоступность для большинства назначений, что позволяет исключить затраты и необходимость контроля за выбросом в окружающую среду, связанные с измельчением до меньших размеров. Приемлемая биодоступность в данном диапазоне размеров частиц, в частности, наблюдается, когда основная фракция эплеренона присутствует в виде формы Н эплеренона, благодаря, по крайней мере частично, более высокой скорости растворения кристаллической формы. Подходящий диапазон D90 размера частиц согласно данному варианту осуществления составляет примерно от 40 до примерно 100 мкм, другой подходящий диапазон - примерно от 30 до примерно 50 мкм, еще один подходящий диапазон - примерно от 50 до примерно 150 мкм, следующий подходящий диапазон - примерно от 75 до примерно 125 мкм. Для приведения твердого состояния эплеренона в состояние с любым желаемым диапазоном частиц, как указано выше, можно использовать любой способ измельчения, помола, микронизации или другой способ уменьшения размера частиц, известный в данной области. Например, для этой цели могут быть эффективными пневматическая или фрагментационная мельница. Было установлено, что когда желательна наиболее высокая биодоступность безотносительно стоимости, уменьшение размера частиц твердой формы эплеренона до D90 размера частиц менее примерно 15 мкм может дополнительно повысить биодоступность эплеренона, не входящего в состав фармацевтической композиции, и фармацевтической композиции, включающей такую твердую форму эплеренона,даже при сравнении с указанными выше диапазонами D90 размера частиц. В одном варианте осуществления D90 размер частиц составляет примерно от 0,01 мкм (10 нм) до примерно 15 мкм. Предпочтительно в таком варианте осуществления изобретения D90 размер частиц составляет менее примерно 10 мкм, более предпочтительно менее примерно 1 мкм, еще более предпочтительно менее примерно 800 нм, еще более предпочтительно менее примерно 600 нм и наиболее предпочтительно менее примерно 400 нм. В зависимости от использования подходящий диапазон D90 размера частиц составляет примерно от 100 до примерно 800 нм, другой подходящий диапазон - примерно от 200 до примерно 600 нм, еще один подходящий диапазон - примерно от 400 до примерно 800 нм, другой подходящий диапазон - примерно от 500 нм до примерно 1 мкм. Твердые формы эплеренона, имеющие D90 размер частиц менее примерно 15 мкм, могут быть получены в соответствии со способами, используемыми для уменьшения размера частиц, известными в данной области. Такие способы включают, но не ограничиваются, способами, описанными в следующих патентах и публикациях, каждая из которых включена в настоящее описание в качестве ссылки:- 23008449 Патент США 4826689, авторы ViolantoFischer. Патент США 5145684, авторы Liversidge et al. Патент США 5298262, авторы NaRajagopalan. Патент США 5302401, авторы Liversidge et al. Патент США 5336507, авторы NaRajagopalan. Патент США 5340564, авторы IlligSarpotdar. Патент США 5346702, авторы NaRajagopalan. Патент США 5352459, авторы Hollister et al. Патент США 5354560, автор Lovrecich. Патент США 5384124, авторы Courteille et al. Патент США 5429824, автор June. Патент США 5503723, авторы Ruddy et al. Патент США 5510118, авторы Bosch et al. Патент США 5518187, авторы Bruno et al. Патент США 5518738, авторы Eickhoff et al. Патент США 5534270, автор De Castro. Патент США 5536508, авторы Canal et al. Патент США 5552160, авторы Liversidge et al. Патент США 5560931, авторы Eickhoff et al. Патент США 5560932, авторы Bagchi et al. Патент США 5565188, авторы Wong et al. Патент США 5569448, авторы Wong et al. Патент США 5571536, авторы Eickhoff et al. Патент США 5573783, авторы DesienoStetsko. Патент США 5580579, авторы Ruddy et al. Патент США 5585108, авторы Ruddy et al. Патент США 5587143, автор Wong. Патент США 5591456, авторы Franson et al. Патент США 5622938, автор Wong. Патент США 5662883, авторы Bagchi et al. Патент США 5665331, авторы Bagchi et al. Патент США 5718919, авторы Ruddy et al. Патент США 5747001, авторы Wiedmann et al. Публикация Международного патента WO 93/25190. Публикация Международного патента WO 96/24336. Публикация Международного патента WO 98/35666. В иллюстративном способе грубый твердый эплеренон добавляют к жидкой среде, в которой он, по существу, не растворим, с образованием предварительно смешанной суспензии. Концентрация эплеренона в жидкой среде может изменяться примерно от 0,1 до примерно 60%, и предпочтительно она составляет примерно от 5 до примерно 30% по весу. Кажущаяся вязкость предварительно смешанной суспензии предпочтительно составляет менее примерно 1000 сП. Предварительная смесь может быть непосредственно подвергнута действию механических устройств, например, с использованием шаровой мельницы, для уменьшения D90 до желаемого диапазона. В альтернативном случае предварительную смесь первоначально могут перемешивать, например, с использованием вальцовой мельницы или смесителя типа Cowles, до получения гомогенной дисперсии, в которой отсутствуют большие агломераты, видимые визуально, а затем эту смесь подвергают истиранию,например, с использованием мельницы с рециркулируемой средой. Частицы могут быть измельчены в присутствии модифицирующего поверхность агента, например полимера или смачивающего агента. Альтернативно, частицы могут контактировать с агентом, модифицирующим поверхность, после истирания. Агент, модифицирующий поверхность, может снижать агломерацию частиц и давать другие преимущества. Частицы следует уменьшать в размере при температуре, которая не приводит к существенному разложению эплеренона. Обычно предпочтительными являются температуры обработки ниже примерно 3040C. Если желательно, технологическое оборудование может быть охлаждено с помощью соответствующего охлаждающего оборудования. Способ обычно осуществляют при температуре окружающей среды и при давлении, безопасном и эффективном для процесса измельчения. Например, для шаровой мельницы, мельницы тонкого помола и вибрационной мельницы обычными при обработке являются давления окружающей среды. Контроль за температурой может достигаться путем двойных стенок с циркуляцией жидкости между стенками или путем погружения мельничной камеры в ледяную воду. Подразумеваются давления обработки примерно от 0,07 до примерно 3,5 кг/см 2, при типичном давлении примерно от 0,7 до 1,4 кг/см 2. После завершения измельчения среду для измельчения отделяют от измельченного продукта в виде- 24008449 сухой или жидкой дисперсионной формы с использованием обычных способов отделения, таких как фильтрование, просеивание через сетчатый фильтр или т.п. Фармацевтические композиции Данное изобретение также относится к фармацевтическим композициям, включающим (i) форму L эплеренона, необязательно вместе с одним или несколькими дополнительными формами твердого эплеренона, выбранными из группы, включающей форму Н, сольватированные кристаллические формы и аморфный эплеренон, и (ii) один или несколько фармацевтически приемлемых носителей и/или разбавителей и/или вспомогательных веществ (совместно упоминаемых в данном описании как "эксципиенты") и необязательно (iii) один или несколько активных ингредиентов, отличных от эплеренона. В предпочтительном варианте осуществления, по существу, все количество эплеренона, содержащееся в композиции,присутствует в виде фазово-чистой формы L; однако, если присутствует сочетание твердых форм, предпочтительные весовые соотношения твердых форм указаны ранее в данном описании. Альтернативно, по существу, все количество эплеренона, содержащееся в композиции, может присутствовать в виде фазово-чистого сольватированного кристаллического эплеренона или в виде аморфного эплеренона. В другом варианте осуществления композиция включает как форму Н, так и форму L. Весовое соотношение формы L к форме Н в композиции обычно составляет примерно от 1:20 до примерно 20:1. В других вариантах осуществления данное весовое соотношение обычно составляет примерно от 10:1 до примерно 1:10, примерно от 5:1 до примерно 1:5, примерно от 2:1 до примерно 1:2, иллюстративно весовое соотношение может составлять примерно 1:1. Композиции изобретения могут быть приспособлены для любого подходящего пути введения,включая без ограничения пероральный, буккальный, сублингвальный, парентеральный, например внутрисосудистый, внутрибрюшинный, подкожный или внутримышечный, местный и ректальный (например,посредством суппозиториев) пути введения. Данные композиции включают эплеренон в желательном количестве в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами, подходящими для требуемого пути введения. 1. Пероральные композиции и их эксципиенты. Пероральные препаративные лекарственные формы таких композиций предпочтительно включают один или несколько эксципиентов, выбранных из группы, включающей разбавители, дезинтеграторы,связывающие агенты и адгезивы, смачивающие агенты, смазочные агенты и агенты против слипания. Более предпочтительные такие препаративные лекарственные формы являются таблетированными или инкапсулированными для удобного введения. Полученные таблетки или капсулы могут содержать рецептуру немедленного высвобождения и/или рецептуру контролируемого высвобождения, что может быть обеспечено, например, за счет дисперсии эплеренона в гидроксипропилметилцеллюлозе (НРМС). Благодаря подходящему выбору и сочетанию эксципиентов могут быть созданы композиции, проявляющие улучшенные характеристики в отношении, среди прочих свойств, эффективности, биодоступности, времени выведения из организма, стабильности, совместимости эплеренона с эксципиентами,безопасности, профиля растворения, профиля дезинтеграции и/или других фармакокинетических, химических и/или физических свойств. Эксципиенты предпочтительно являются водорастворимыми или вододиспергируемыми и обладают смачивающими свойствами, чтобы компенсировать низкую растворимость в воде эплеренона. Когда композиция составляется в виде таблетки, комбинация выбранных эксципиентов позволяет получить таблетки, которые могут проявлять, наряду с другими свойствами, повышенные профили растворимости и дезинтеграции, твердость, прочность на раздавливание и/или ломкость. 1.1. Разбавители. Композиции согласно изобретению необязательно включают в качестве эксципиентов один или несколько фармацевтически приемлемых разбавителей. Подходящие разбавители иллюстративно включают по отдельности либо в сочетании лактозу, включая безводную лактозу и моногидрат лактозы; крахмалы, включая непосредственно прессуемые крахмалы и гидролизуемые крахмалы (например, Celutab и Emdex); маннит; сорбит; ксилит; декстрозу (например Cerelose 2000) и моногидрат декстрозы; дигидрат двухосновного фосфата кальция; разбавители на основе сахарозы; кондитерские сахара; моногидрат моноосновного сульфата кальция; дигидрат сульфата кальция; гранулированный тригидрат лактата кальция; декстраты; инозит; гидролизованные крупяные твердые вещества; амилозу; целлюлозы, включая микрокристаллическую целлюлозу, источники пищевой марки - и аморфной целлюлозы (например,Rexcel) и порошковую целлюлозу; карбонат кальция; глицин; бентонит; поливинил-пирролидон и т.п. Такие разбавители, если они присутствуют, составляют в общем примерно от 5 до примерно 99%, предпочтительно примерно от 10 до примерно 85% и более предпочтительно примерно от 20 до примерно 80% от общего веса композиции. Выбранный разбавитель или разбавители предпочтительно проявляют подходящие свойства текучести и, где желательны таблетки, прессуемости. Лактоза и микрокристаллическая целлюлоза либо по отдельности, либо в сочетании являются предпочтительными разбавителями. Оба разбавителя являются химически совместимыми с эплереноном.- 25008449 Применение экстрагранулированной микрокристаллической целлюлозы (т.е. микрокристаллическая целлюлоза, добавленная к гранулированной во влажном состоянии композиции после стадии сушки) может использоваться для улучшения твердости (для таблеток) и/или времени дезинтеграции. Лактоза, в особенности моногидрат лактозы, является особенно предпочтительной. Лактоза обычно придает композициям, имеющим подходящие скорости высвобождения эплеренона, стабильность, текучесть перед прессованием и/или свойства высушивания при относительно низкой стоимости разбавителя. Она обеспечивает высокую плотность субстрата, что способствует уплотнению во время гранулирования (при использовании мокрого гранулирования) и, следовательно, улучшает свойства текучести смеси. 1.2. Дезинтеграторы. Композиции согласно изобретению необязательно включают один или несколько фармацевтически приемлемых дезинтеграторов в качестве эксципиентов, в частности для таблетированных составов. Подходящие дезинтеграторы включают либо по отдельности, либо в сочетании крахмалы, включая крахмал гликолят натрия (например, Explotab от Pen West) и предварительно желатинизированные кукурузные крахмалы (например National 1551, National 1550 и Colocorn 1500), глины (например VeegumHV), целлюлозы, такие как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза,карбоксиметилцеллюлоза и карбоксиметилцеллюлоза натрия (например Ac-Di-Sol от FMC), альгинаты,кросповидон и камеди, такие как аравийская, гуаровая, бобов робинии, карайевая, пектиновая и трагакантовая камеди. Дезинтеграторы могут быть добавлены на любой подходящей стадии во время получения композиции, особенно перед гранулированием или во время стадии смазки перед прессованием. Такие дезинтеграторы, если они присутствуют, составляют в целом примерно от 0,2 до примерно 30%, предпочтительно примерно от 0,2 до примерно 10% и более предпочтительно примерно от 0,2 до примерно 5% от общего веса композиции. Кроскармелоза натрия представляет собой предпочтительный дезинтегратор для разложения таблетки или капсулы, когда она присутствует, то предпочтительно составляет примерно от 0,2 до примерно 10%, более предпочтительно примерно от 0,2 до примерно 7% и еще более предпочтительно примерно от 0,2 до примерно 5% от общего веса композиции. Кроскармелоза натрия придает превосходную внутригранулярную дезинтегрирующую способность гранулированным композициям настоящего изобретения. 1.3. Связывающие агенты. Композиции согласно изобретению необязательно включают один или несколько фармацевтически приемлемых связывающих агентов или адгезивов в качестве эксципиентов, в особенности для составов в форме таблеток. Такие связывающие агенты и адгезивы предпочтительно придают достаточную прочность слипания таблетируемому порошку для осуществления обычных технологических операций, таких как сортировка по крупности (грохочение), смазка, прессование и упаковка, но все еще позволяющим таблеткам разлагаться, а композиции поглощаться при всасывании. Подходящие связывающие агенты и адгезивы включают либо по отдельности, либо в сочетании гуммиарабик; трагакантовую камедь; сахарозу; желатин; глюкозу; крахмалы, такие как, но не ограничиваясь ими, предварительно желатинизированные крахмалы (например National 1551 и National 1550); целлюлозы, такие как, но не ограничиваясь ими, метилцеллюлоза или карбоксиметилцеллюлоза натрия (например Tylose); альгиновую кислоту и соли альгиновой кислоты; алюмосиликат магния; полиэтиленгликоль (ПЭГ); гуаровую камедь; полисахаридные кислоты; бентониты; поливинилпирролидон (повидон или ПВП), например, повидон К-15,К-30 и К-29/32; полиметакрилаты; НРМС; гидроксипропилцеллюлозу (например Klucel); и этилцеллюлозу (например Ethocel). Такие связывающие агенты и/или адгезивы, если они присутствуют, составляют в целом примерно от 0,5 до примерно 25%, предпочтительно примерно от 0,75 до примерно 15% и более предпочтительно примерно от 1 до примерно 10% от общего веса композиции. НРМС представляет собой предпочтительный связывающий агент, используемый для придания когезивных свойств порошкообразной смеси композиции эплеренона. НРМС, если присутствует, составляет в целом примерно от 0,5 до примерно 10%, предпочтительно примерно от 1 до примерно 8% и более предпочтительно примерно от 2 до примерно 4% от общего веса композиции. Обычно может использоваться низкомолекулярная НРМС, имеющая вязкость примерно от 2 до примерно 8 сП, хотя вязкости примерно от 2 до примерно 6 сП являются предпочтительными, особенно вязкости примерно от 2 до примерно 4 сП. Вязкости НРМС измеряют в виде 2-процентного раствора в воде при 20 С. Содержание метоксигрупп в НРМС обычно составляет примерно от 15 до примерно 35%, тогда как содержание гидроксипропильных групп обычно составляет примерно до 15%, предпочтительно примерно от 2 до примерно 12%. 1.4. Смачивающие агенты. Эплеренон в значительной степени нерастворим в водном растворе. Соответственно, композиции изобретения необязательно, но предпочтительно, включают в качестве эксципиента один или несколько фармацевтически приемлемых смачивающих агентов. Такие смачивающие агенты предпочтительно выбирают для поддержания эплеренона в близкой взаимосвязи с водой, условие, которое, как предполагают, улучшает относительную биодоступность композиции.- 26008449 Неограничивающие примеры поверхностно-активных веществ, которые могут использоваться в качестве смачивающих агентов в композициях настоящего изобретения, включают четвертичные соединения аммония, например хлорид бензалькония, хлорид бензетония и хлорид цетилпиридиния, диоктилсульфосукцинат натрия, полиоксиэтиленалкилфениловые простые эфиры, например ноноксинол 9, ноноксинол 10 и октоксинол 9, полоксамеры (блоксополимеры полиоксиэтилена и полиоксипропилена),глицериды и масла полиоксиэтиленовых жирных кислот, например моно- и диглицериды полиоксиэтилен(8)каприловой/каприновой кислот (например Labrasol от Gattefosse), полиоксиэтилен(35) касторовое масло и полиоксиэтилен(40)гидрированное касторовое масло; полиоксиэтиленалкиловые простые эфиры, например полиоксиэтилен(20)цетостеариловый простой эфир, полиоксиэтиленовые сложные эфиры жирных кислот, например полиоксиэтилен(40)стеарат, полиоксиэтиленсорбитановые сложные эфиры, например полисорбат 20 и полисорбат 80 (например Tween 80 от ICI), пропиленгликолевые сложные эфиры жирных кислот, например пропиленгликольлаурат (например Lauroglycol отGattefosse), лаурилсульфат натрия, жирные кислоты и их соли, например олеиновая кислота, олеат натрия и олеат триэтаноламина, глицериновые сложные эфиры жирных кислот, например глицерилмоностеарат, сложные эфиры сорбита, например сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат и сорбитанмоностеарат, тилоксапол и их смеси. Такие смачивающие агенты, если они присутствуют, составляют в целом примерно от 0,25 до примерно 15%, предпочтительно примерно от 0,4 до примерно 10% и более предпочтительно примерно от 0,5 до примерно 5% от общего веса композиции. Предпочтительными являются смачивающие агенты, представляющие собой анионные поверхностно-активные вещества. Особенно предпочтительным смачивающим агентом является лаурилсульфат натрия. Лаурилсульфат натрия, если он присутствует, составляет примерно от 0,25 до примерно 7%, более предпочтительно примерно от 0,4 до примерно 4%, и еще более предпочтительно примерно от 0,5 до примерно 2% от общего веса композиции. 1.5. Смазочные вещества, глиданты и агенты против слипания. Композиции согласно изобретению необязательно включают один или несколько фармацевтически приемлемых смазочных веществ и/или глидантов в качестве эксципиентов. Подходящие смазочные вещества и/или глиданты включают либо индивидуально, либо в сочетании, глицерилбегапат (напримерCompritol 888); стеариновую кислоту и ее соли, включая стеараты магния, кальция и натрия; гидрированные растительные масла (например Sterotex); коллоидный диоксид кремния; тальк; воски; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; полиэтиленгликоли(например Carbowax 4000 и Carbowax 6000); олеат натрия; лаурилсульфат натрия и лаурилсульфат магния. Такие смазочные вещества и/или глиданты, если они присутствуют, составляют в сумме примерно от 0,1 до примерно 10%, предпочтительно примерно от 0,2 до примерно 8% и более предпочтительно примерно от 0,25 до примерно 5% от общего веса композиции. Стеарат магния представляет собой предпочтительное смазочное вещество, используемое, например, для снижения трения между оборудованием и гранулированной смесью во время прессования таблетированных составов. Подходящие агенты против слипания включают тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. Тальк представляет собой предпочтительный агент против слипания или глидант, используемый, например, для снижения прилипания состава к поверхности оборудования и также для снижения статических свойств смеси. Тальк, если он присутствует, составляет примерно от 0,1 до примерно 10%, более предпочтительно примерно от 0,25 до примерно 5% и еще более предпочтительно примерно от 0,5 до примерно 2% от общего веса композиции. 1.6. Другие эксципиенты. Другие эксципиенты, такие как красители, ароматизаторы и подсластители известны в области фармацевтики и могут использоваться в композициях настоящего изобретения. Таблетки могут быть с покрытием, например покрытием, растворяющимся в кишечнике, или не покрытыми. Композиции изобретения могут дополнительно включать, например, буферные агенты. 1.7. Предпочтительные пероральные композиции. В одном варианте осуществления композиция настоящего изобретения включает эплеренон в желательном количестве и один или несколько целлюлозных эксципиентов. Термин "целлюлозный эксципиент" охватывает целлюлозу или ее производное, включая, не ограничиваясь, очищенную целлюлозу,микрокристаллическую целлюлозу и алкилцеллюлозы и их производные и соли (например метилцеллюлоза, этилцеллюлоза, гидроксипропилцеллюлоза, НРМС, карбоксиметилцеллюлоза, карбоксиметилцеллюлоза натрия, включая кроскармелозу натрия и т.д.). Предпочтительно, по крайней мере один такой присутствующий целлюлозный эксципиент выбирают из группы, состоящей из (C1-6 алкил)целлюлоз и их производных и солей. Еще более предпочтительно, такой целлюлозный эксципиент выбирают из группы,состоящей из гидрокси(С 2-4 алкил)-(С 1-4 алкил)целлюлоз и их производных и солей. Композиции данного варианта осуществления изобретения предпочтительно дополнительно включают один или несколько эксципиентов, выбранных из группы, включающей разбавители, дезинтеграторы, связывающие агенты, смачивающие агенты, смазочные агенты и агенты, препятствующие слипанию.- 27008449 Более предпочтительно данные композиции включают один или несколько эксципиентов, выбранных из группы, состоящей из лактозы, микрокристаллической целлюлозы, кроскармелозы натрия, НРМС, лаурилсульфата натрия, стеарата магния и талька. Еще более предпочтительно данные композиции включают моногидрат лактозы, микрокристаллическую целлюлозу, кроскармелозу натрия и НРМС, наиболее предпочтительно дополнительно включают один или несколько дополнительных эксципиентов, выбранных из группы, состоящей из лаурилсульфата натрия, стеарата магния и талька. Перечисленные выше для настоящего варианта осуществления изобретения индивидуальные эксципиенты необязательно могут быть заменены, при желании, на другие подходящие эксципиенты. Подходящие эксципиенты-заменители химически совместимы как с эплереноном, так и с другими эксципиентами. Хотя можно использовать другие разбавители, дезинтеграторы, связывающие агенты и адгезивы,смачивающие агенты, смазочные агенты и/или агенты, препятствующие слипанию, и агенты скольжения,композиции, включающие наночастицы эплеренона, лактозу, микрокристаллическую целлюлозу, кроскармелозу натрия и НРМС и, необязательно, лаурилсульфат натрия, стеарат магния и/или тальк, обычно обладают превосходным сочетанием фармакокинетических, химических и/или физических свойств по сравнению с такими другими композициями. В другом варианте осуществления композиция согласно изобретению содержит примерно от 1 до примерно 95% эплеренона; примерно от 5 до примерно 99% фармацевтически приемлемого разбавителя; примерно от 0,5 до примерно 30% фармацевтически приемлемого дезинтегратора; примерно от 0,5% до примерно 25% фармацевтически приемлемого связывающего агента; где все проценты указаны по весу. Такая композиция дополнительно необязательно может включать примерно от 0,25 до примерно 15% фармацевтически приемлемого смачивающего агента; примерно от 0,1 до примерно 10% фармацевтически приемлемого смазывающего агента; и/или примерно от 0,1 до примерно 15% фармацевтически приемлемого агента, препятствующего слипанию. Еще в одном варианте осуществления композиция изобретения находится в форме единичной пероральной препаративной лекарственной формы, предпочтительно в виде таблетки или капсулы, включающей эплеренон и целлюлозный эксципиент, определенный ранее. Предпочтительно композиция включает один или несколько эксципиентов, выбранных из группы, состоящей из моногидрата лактозы,микрокристаллической целлюлозы, кроскармелозы натрия, гидроксипропилметилцеллюлозы, лаурилсульфата натрия, стеарата магния и талька. 2. Парентеральные композиции. Твердые формы эплеренона могут вводиться парентерально, например, в виде внутривенной, внутримышечной или подкожной инъекции суспензии эплеренона в твердом состоянии в жидком носителе,таком как, например, физиологический раствор, раствор декстрозы или вода. Суспензионные композиции могут включать подходящие ингредиенты, являющиеся эксципиентами, выбранные из раскрытых ранее в данном описании для пероральных композиций. 3. Чрескожные композиции. Другие композиции могут быть представлены в форме местной или чрескожной мази или крема,содержащих диспергированный в них эплеренон в твердом состоянии в количестве, например, примерно от 0,075 до примерно 30%, предпочтительно примерно от 0,2 до примерно 20% по весу и более предпочтительно примерно от 0,4 до примерно 15% по весу. Такая местная или чрескожная композиция может,при желании, включать соединение, которое усиливает абсорбцию или проницаемость эплеренона через кожу. Примеры таких усиливающих кожную проницаемость соединений включают диметилсульфоксид и родственные соединения. Новые твердые формы эплеренона также могут вводиться чрескожно с использованием пластыря либо резервуарного и пористо-мембранного типа, либо типа твердой матрицы. В любом случае эплеренон высвобождается непрерывно из резервуара или из микрокапсул через мембрану в эплеренонпроницаемый адгезив, который находится в контакте с кожей или слизистой субъекта. Если эплеренон абсорбируется через кожу, реципиенту можно вводить контролируемый или предварительно определенный ток эплеренона. В случае микрокапсул инкапсулирующий агент также может функционировать в качестве мембраны. Способы лечения или профилактики Настоящее изобретение также охватывает способ лечения и/или профилактики альдостеронопосредованных болезненных состояний или нарушений; способ включает лечение субъекта, имеющего или склонного к такому болезненному состоянию или нарушению, с помощью терапевтически эффективного количества эплеренона в твердом состоянии или фармацевтической композиции, содержащей твердое состояние эплеренона, по крайней мере обнаруживаемую фракцию твердого состояния эплеренона, представляющего форму L эплеренона, при балансе, включающие одну или несколько из формы Н эплеренона, сольватированного кристаллического эплеренона и аморфного эплеренона. Такой способ полезен для лечения и/или профилактики болезненного состояния или нарушения у субъекта, при которых показано введение антагониста альдостерона, включая, но не ограничиваясь ими, лечение состояния- 28008449 гиперальдостеронизма, такого как гипертензия, сердечных нарушений, включая сердечную недостаточность, цирроза печени, избыточного коллагена, фиброза, доброкачественной гипертрофии простаты и депрессии. Помимо применения при лечении человека, данные твердые формы эплеренона и их фармацевтические композиции также могут использоваться для ветеринарного лечения домашних, экзотических и сельскохозяйственных животных, например, лошадей, собак и кошек. Твердые формы эплеренона и их композиции также можно использовать в (i) комбинированной терапии частично или полностью вместо другого антагониста альдостеронового рецептора и/или в (ii) комбинированной терапии с другими лекарственными средствами. Выражение "комбинированная терапия" включает в себя введение каждого лекарственного средства последовательным образом в таком режиме,который будет обеспечивать положительное действие комбинации лекарственных средств, а также совместное введение лекарственных средств, по существу, одновременным способом, как, например, в отдельной капсуле или инъекции, содержащей фиксированное соотношение данных активных агентов или в виде множества отдельных препаративных лекарственных форм или инъекций, по одной для каждого агента. Неограничивающие примеры такой комбинированной терапии включают лечение сердечнососудистых заболеваний с использованием сочетания антагониста альдостеронового рецептора и антагониста рецептора ангиотензина II, как описано в публикации международного патентаWO96/24373,лечение застойной сердечной недостаточности с использованием сочетания антагониста альдостеронового рецептора и антагониста ангиотензина II, как описано в публикации международного патентаWO96/40257, и лечение сердечной недостаточности с использованием сочетания антагониста альдостеронового рецептора, ингибитора АХЭ и диуретика, как описано в публикации международного патентаWO96/24372, все данные публикации включены в настоящее описание в качестве ссылки. Примеры Следующие примеры содержат подробное описание способов получения рассмотренных в данном описании различных твердых форм эплеренона. Данное подробное описание включено в объем изобретения и иллюстрирует изобретение без ограничения каким-либо образом его объема. Все проценты приведены по весу, если не указано другого. Исходный эплеренон, использованный в каждом из следующих примеров, получали в соответствии со схемой 1, приведенной в международном патентеWO98/25948. Пример 1. Получение сольвата метилэтилкетона из исходного эплеренона высокой чистоты и получение формы L эплеренона из сольвата. А. Получение сольвата метилэтилкетона. Эплеренон высокой чистоты (99% чистоты, содержащий всего 0,2% диэпоксида и 11,12 эпоксида) в количестве 437 мг растворяли в 10 мл метилэтилкетона при нагревании до кипения на горячей плитке при перемешивании на магнитной мешалке при 900 об./мин. Полученный раствор оставляли охлаждаться до комнатной температуры при непрерывном перемешивании на магнитной мешалке. По достижении комнатной температуры раствор переносили на баню с температурой 1 С, непрерывно перемешивая в течение 1 ч. Твердый сольват метилэтилкетона собирали из холодного раствора с помощью фильтрования в вакууме. В. Получение формы L эплеренона. Твердый сольват метилэтилкетона, полученный, как описано выше, сушили в печи при 100 С в течение 4 ч при атмосферном давлении окружающей среды. С помощью ДСК и XRPD анализов определено, что сухое твердое вещество представляло собой чистую форму L. Пример 2. Получение дополнительных сольватов из исходного эплеренона высокой чистоты. Дополнительные сольватированные кристаллические формы получали по существу так, как описано в примере 1, заменяя метилэтилкетон на каждый из следующих растворителей: н-пропанол, 2 пентанон, уксусная кислота, ацетон, бутилацетат, хлороформ, этанол, изобутанол, изобутилацетат, изопропанол, метилацетат, этилпропионат, н-бутанол, н-октанол, пропилацетат, пропиленгликоль, третбутанол, тетрагидрофуран и толуол. Пример 3. Получение сольвата метилэтилкетона путем испарительно-диффузионного выращивания. Эплеренон (99,9% чистоты) в количестве 400 мг растворяли в 20 мл метилэтилкетона при нагревании на горячей плитке для получения исходного раствора. Исходный раствор объемом в 8 мл разбавляли до 10 мл метилэтилкетоном, полученный раствор представляет собой образец с 80% разбавлением. Исходный раствор объемом в 4 мл разбавляли до 10 мл метилэтилкетоном (образец с 40% разбавлением). Исходный раствор объемом в 2 мл разбавляли до 10 мл метилэтилкетоном (образец с 20% разбавлением). Образцы с различными разбавлениями в сцинтилляционных пробирках объемом 20 мл переносили в эксикатор, содержащий небольшое количество гексана в качестве антирастворителя. Эксикатор герметично закрывали и парам гексана давали возможность диффундировать в растворы метилэтилкетона. Кристаллы сольвата метилэтилкетона вырастали в образце с 80% разбавлением через 24 ч.- 29008449 Пример 4. Получение сольватных кристаллических форм эплеренона упариванием с использованием роторного испарителя. Примерно 400 мг эплеренона (99,9% чистоты) отвешивали в 250-миллилитровую круглодонную колбу. Растворитель, выбранный из метилэтилкетона и растворителей, перечисленных в примере 2, в количестве 150 мл добавляли в колбу и, если требовалось, раствор осторожно нагревали до растворения эплеренона. Полученный прозрачный раствор помещали на роторный испаритель Buchi при температуре бани примерно 85 С, и растворитель удаляли в вакууме. Удаление растворителя прекращали, когда в колбе оставалось приблизительно 10 мл растворителя. Полученные твердые вещества анализировали подходящим способом (например XRPD, ДСК, ТГА, микроскопия и т.д.) для определения формы кристалла. Пример 5. Преобразование суспензии. Приблизительно 150 мг формы L эплеренона и 150 мг формы Н эплеренона добавляли к 5 мл этилацетата. Полученную суспензию перемешивали в течение ночи на магнитной мешалке при 300 об./мин. На следующий день образец полученного твердого вещества собирали фильтрованием. Анализ образца с помощью XRPD показал, что образец полностью состоял из формы L эплеренона. Пример 6. Получение (а) сольвата из исходного эплеренона низкой чистоты и (b) формы Н кристаллического эплеренона из полученного сольвата. Готовили образцы, содержащие примеси различных количеств диэпоксида или 11,12-эпоксида, как определено ранее в данном описании, добавляя желаемое количество примеси в сцинтилляционную пробирку объемом 7 мл вместе с количеством эплеренона, достаточным для получения образца с общей массой 100 мг. Содержание примеси в каждом образце приведено в табл. 6 А и 6 В, где примесь представляет собой соответственно диэпоксид или 11,12-эпоксид. В каждую сцинтилляционную пробирку добавляли микроскопическую магнитную мешалку ("микроблоха") вместе с 1 мл метилэтилкетона. Пробирки неплотно закрывали, и твердые вещества растворяли при нагревании до кипения на горячей плитке с магнитным перемешиванием. По завершении растворения полученные растворы оставляли охлаждаться до комнатной температуры при непрерывном перемешивании. Полученные твердые вещества затем собирали фильтрованием в вакууме и сразу же анализировали с использованием XRPD. Затем твердые вещества помещали в печь с температурой 100 С и сушили в течение 1 ч при атмосферном давлении окружающей среды. Высушенные твердые вещества анализировали с помощью XRPD на содержание формы Н посредством мониторинга площади пика дифракции формы Н примерно при 12,1 2. Все XRPD дифракционные рентгенограммы регистрировали с использованиием дифрактометра Inel Multipurpose. Таблица 6 А Состав исходного эплеренона в примере 6 Таблица 6 В Состав исходного эплеренона в примере 6 А. Результаты для диэпоксида. На фиг. 78 показаны XRPD рентгенограммы для сырых брикетов сольвата метилэтилкетона, полученных при кристаллизации из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. Интенсивности пиков были нормализованы для легкости сравнения. На дифракционных рентгенограммах не присутствуют пики, характерные для формы Н или диэпоксида. Рентгенограммы являются характеристичными для метилэтилкетонного сольвата эплеренона. На фиг. 79 показаны XRPD рентгенограммы для сухих твердых веществ, полученных при кристаллизации из метилэтилкетона с добавлением (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. Интенсивности пиков были нормализованы для легкости сравнения. Форма Н не была обнаружена в сухих образцах,соответствующих кристаллизации из метилэтилкетона при добавлении диэпоксида на уровне 0 или 1%. Форму Н обнаруживали в сухих образцах, соответствующих кристаллизации из метилэтилкетона, где уровень добавления примеси составлял 3 и 5%. Площадь дифракционного пика формы Н примерно при 12,1 2 и установленное содержание формы Н для каждого образца приведены в табл. 6 С.
МПК / Метки
МПК: C07J 71/00, A61K 31/58
Метки: кристаллическая, форма, эплеренона
Код ссылки
<a href="https://eas.patents.su/30-8449-kristallicheskaya-forma-eplerenona.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая форма эплеренона</a>
Предыдущий патент: Новые производные бензимидазола, полезные в качестве антипролиферативных агентов
Следующий патент: Способ получения гранул мочевины
Случайный патент: Соединения пиперазинилпиразинов в качестве агонистов или антагонистов серотонин 5-ht2 рецептора