Агонисты рецепторов, активируемых пероксисомным пролифератором
Номер патента: 7163
Опубликовано: 25.08.2006
Авторы: Ксу Янпинг, Джонстон Ричард Дуэйн, Томпсон Ричард Крейг, Виннероски Леонард Лэрри Джуниор, Гибсон Трейси Энн, Ванг Ксиаодонг, Мантло Натан Брайан
Формула / Реферат
1. Соединение структурной формулы I
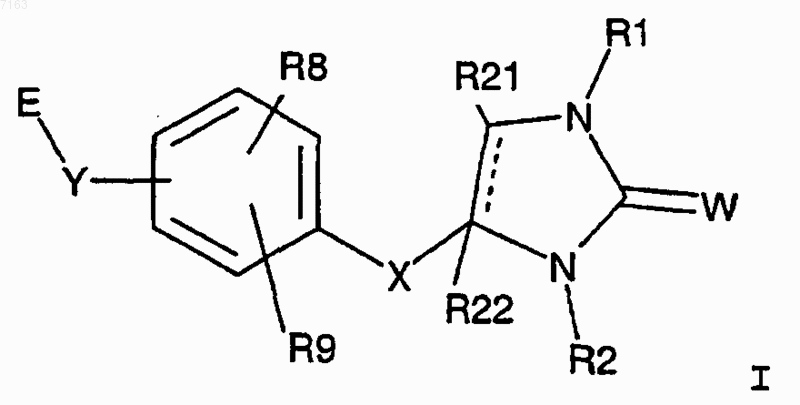
и его фармацевтически приемлемые соли, сольваты и гидраты, где:
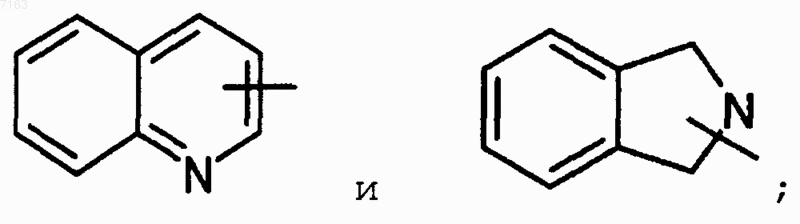
(a) Rl выбран из группы, состоящей из водорода, замещенной или незамещенной группы, выбранной из С1-С8 алкила, арил-С0-С4 алкила, гетероарил-С0-С4 алкила, С3-С6 циклоалкиларил-С0-С2 алкила и -СН2-С(О)-R17-R18, где R17 представляет собой О или NH и R18 представляет собой бензил или бензил, замещенный от одного до двух заместителей, каждый из которых независимо выбирается из группы, состоящей из CF3, С1-С4 алкил и галоген; и где каждый из замещенных фрагментов имеет от одного до трех заместителей, каждый из которых независимо выбирается из группы, состоящей из С1-С5 алкил, Cl-С5 алкокси, С0-С5 галоалкил, С1-С5 тригалоалкил, С1-С5 тригалоалкокси, нитро, циано, CHO, =СНO, гидроксил, С1-С4 алкановые кислоты, фенил, арилокси, SO2R7, SR7, бензилокси, алкилкарбоксамидо и COOH; R7 представляет собой С1-С4 алкил или гало С1-С4 алкил; и далее где арил представляет собой заместители, выбранные из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и дополнительно гетероарил выбирают из группы, состоящей из

(b) R2 представляет собой H или замещенную или незамещенную группу,
(с) выбранную из группы, состоящей из С1-С6 алкила, С1-С6 алкенила, арил-С0-С4 алкила, гетероарил-С0-С4 алкила, С1-С4 алкилсульфонамида, С1-С4 алкиламида, OR10 и С3-С6 циклоалкила, и где каждый из замещенных фрагментов имеет от одного до трех заместителей, выбранных из группы, состоящей из ОН, алкокси, галоалкил, амино, COOH, гетероарил-O-, гетероарил-С(O)-, алкил-O-, алкил-С(O), С3-С6 циклоалкил, арил-O-, арил-С(О)-, и далее, где арил представляет собой заместитель, выбранный из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и дополнительно гетероарил выбирают из группы, состоящей из

(d) W представляет собой О или S;
(e) X представляет собой необязательно замещенную С1-С5 алкиленовую связывающую группу, где один углеродный атом может быть необязательно заменен О, NH, S и необязательно два углеродных атома вместе могут образовывать двойную связь и где заместители, когда алкиленовая связывающая группа является замещенной, присутствуют в количестве от одного до трех, каждый из которых независимо выбирают из группы, состоящей из С1-С6 алкила, оксо, арил С0-С3, С1-С3 алкокси, гидрокси, С3-С6 циклолалкил и галоген; и где дополнительно арил выбирают из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила;
(f) Y выбран из группы, состоящей из С, О, S, NH и простой связи; и
(g) E выбран из группы, состоящей из C(R3)(R4)A, A и замещенной или незамещенной группы, выбранной из группы, состоящей из (СН2) nCOOR19, и где каждый из заместителей имеет от одного до трех заместителей, каждый из которых независимо выбирают из группы, состоящей из С1-С5 алкила, С1-С5 алкокси, С0-С5 галоалкил, С1-С5 тригалоалкила, С1-С5 тригалоалкокси, С1-С5 галоалкокси, нитро, циано, CHO, =O, гидроксил, С1-С4 алкановой кислоты, фенила, арилокси, SO2R7, SR7, бензилокси, алкилкарбоксамидо и СOOН; R7 представляет собой С1-С4 алкил или гало С1-С4;
(h) n представляет собой 0, 1, 2 или 3;
(i) A представляет собой функциональную группу, выбранную из группы, состоящей из карбоксила, С1-С3 алкилнитрила, карбоксамида, сульфонамида, сульфонамида, замещенного от одной до трех групп, каждую из которых независимо выбирают из группы, состоящей из С1-С4 алкила, Cl-C4 галоалкила, гетероарила и арила; ацилсульфонамида и ацилсульфонамида, замещенного от одного до трех заместителей, каждый независимо выбирают из группы, состоящей из С1-С4 алкила, С1-С4 галоалкила, гетероарила и арила;
тетразол, тетразол, имеющий от одного до трех заместителей, каждый из которых независимо выбирают из группы, состоящей из С1-С4 алкила, С1-С4 галоалкила, гетероарила и арила; и изоксазола; и далее где арил представляет собой заместитель, выбранный из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и далее гетероарил выбирают из группы, состоящей из
(j) R3 выбран из группы, состоящей из H, С1-С5 алкила, арил-С0-С2 алкокси и С1-С5 алкокси, и
(k) R4 выбран из группы, состоящей из H, галогена и замещенной или незамещенной группы, выбранной из С1-С5 алкила, С1-С5 алкокси, С3-С6 циклоалкила, арил-С0-С4 алкила, арил-С0-С2 алкокси и фенила; или R3 и R4 объединены друг с другом с образованием С3-С8 циклоалкила; и где когда R4 представляет собой замещенную группу и затем упомянутая ранее замещенная группа имеет от одного до четырех заместителей, каждый из которых независимо выбирают из группы, состоящей из галогена, фенила, С1-С4 алкокси, гидрокси, и арилС0-С2 аклкокси; и далее, где арил представляет собой заместитель, выбранный из группы состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и далее гетероарил выбирают из группы, состоящей из

(i) Rl9 выбран из группы, состоящей из водорода, необязательно замещенного арилметила и необязательно замещенного С1-С4 алкила; и где каждый из замещенных фрагментов имеет от одного до трех заместителей, каждый из которых независимо выбирают из группы, сосотящей из С1-С5 алкила, С1-С5 алкокси, С0-С5 галоалкила, С1-С5 тригалоалкила, С1-С5 тригалоалкокси, С1-С5 галоалкокси, нитро, циано, CHO, =O, гидроксил, C1-С4 алкановые кислоты, фенил, арилокси гидроксил, SO2R7,SR7, бензилокси, алкилкарбоксамидо и COOH; R7 представляет собой С1-С4 алкил или гало С1-С4 алкил; и далее где арил представляет собой заместитель, выбранный из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила;
(m) R8 выбран из группы, состоящей из водорода, С1-С4 алкила, С1-С4 алкиленила и галогена;
(n) R9 выбран из группы, состоящей из водорода, С1-С4 алкила, С1-С4 алкиленила, галогена, замещенного или незамещенного арила, замещенного или незамещенного арил-С1-С4 алкила, замещенного или незамещенного гетероарила, С1-С6 алкенила и OR10, и где каждый из замещенных фрагментов имеет от одного до трех заместителей, каждый из которых независимо выбирают из группы, состоящей из С1-С5 алкила, С1-С5 алкокси, С0-С5 галоалкила, С1-С5 тригалоалкила, С1-С5 тригалоалкокси, С1-С5 галоалкокси, нитро, циано, CHO, =O, гидроксил, С1-С4 алкановые кислоты, фенил, арилокси, SO2R7, SR7, бензилокси, алкилкарбоксамидо и СOOН; R7 представляет собой С1-С4 алкил или гало С1-С4 алкил; и далее, где арил представляет собой заместитель, выбранный из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и далее, где гетероарил выбирают из группы, сосотящей из

(о) R10 независимо выбран из группы, состоящей из водорода и С1-С4 алкила;
(р) R21 выбран из группы, состоящей из водорода, и группы, выбранной из группы, состоящей из С1-С6 алкила, арила, С1-С4 алкиларила и гетероарила; и далее где арил представляет собой заместитель, выбранный из группы, состоящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и далее, где гетероарил выбирают из группы, сосотящей из

(q) R22 выбран из группы, состоящей из водорода, и группы, выбранной из группы, состоящей из С1-С6 алкила, арила, С1-С4 алкиларила и гетероарила; и далее, где арил представляет собой заместитель, выбранный из группы, сосотящей из фенила, нафтила, антраценила, 1,2,3,4-тетрагидронафтила и бензодиоксила; и далее, где гетероарил выбирают из группы, сосотящей из

(r)---- представляет собой необязательную двойную связь.
2. Соединение по п.1, которое представлено следующей структурной формулой:
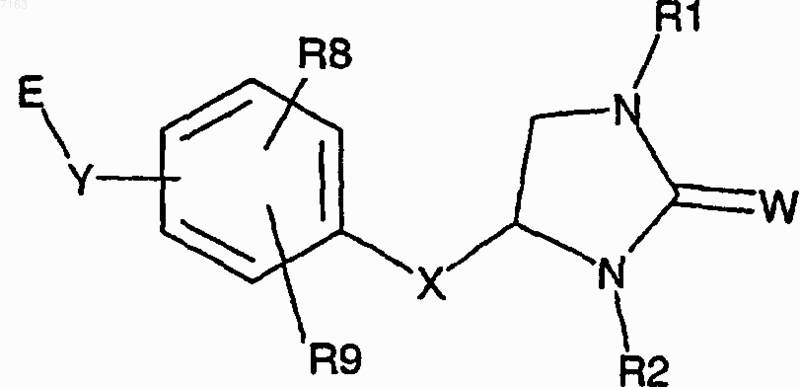
и его соли, сольваты и гидраты.
3. Соединение, представленное в п.1, представленное следующими структурными формулами:
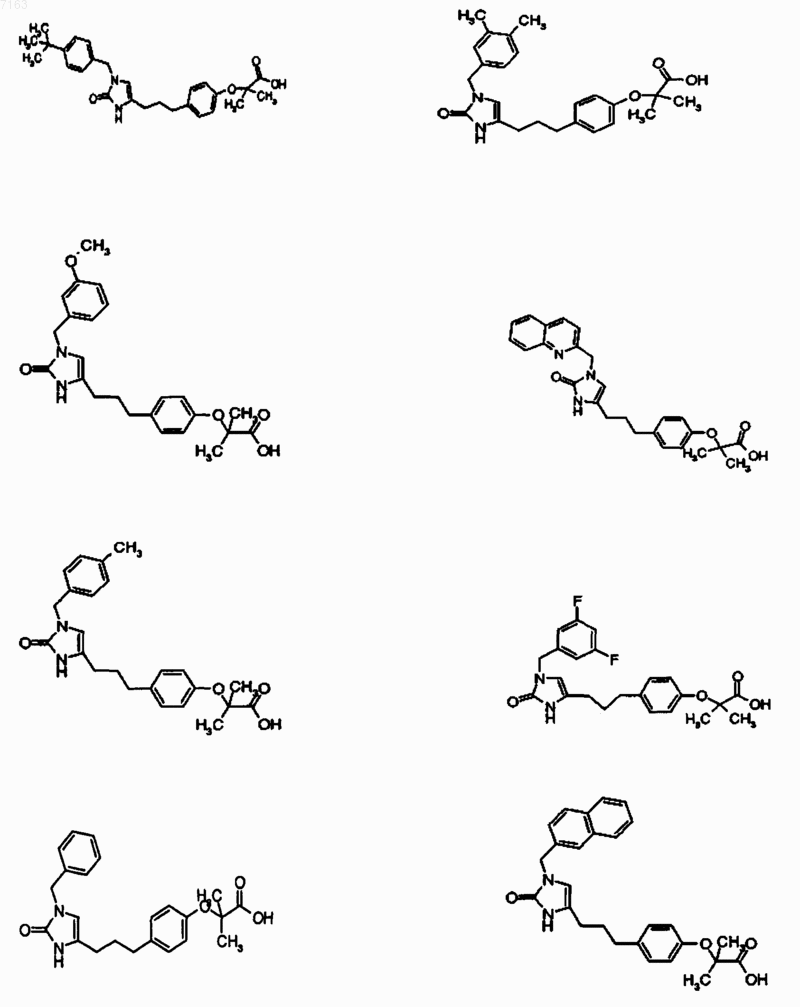
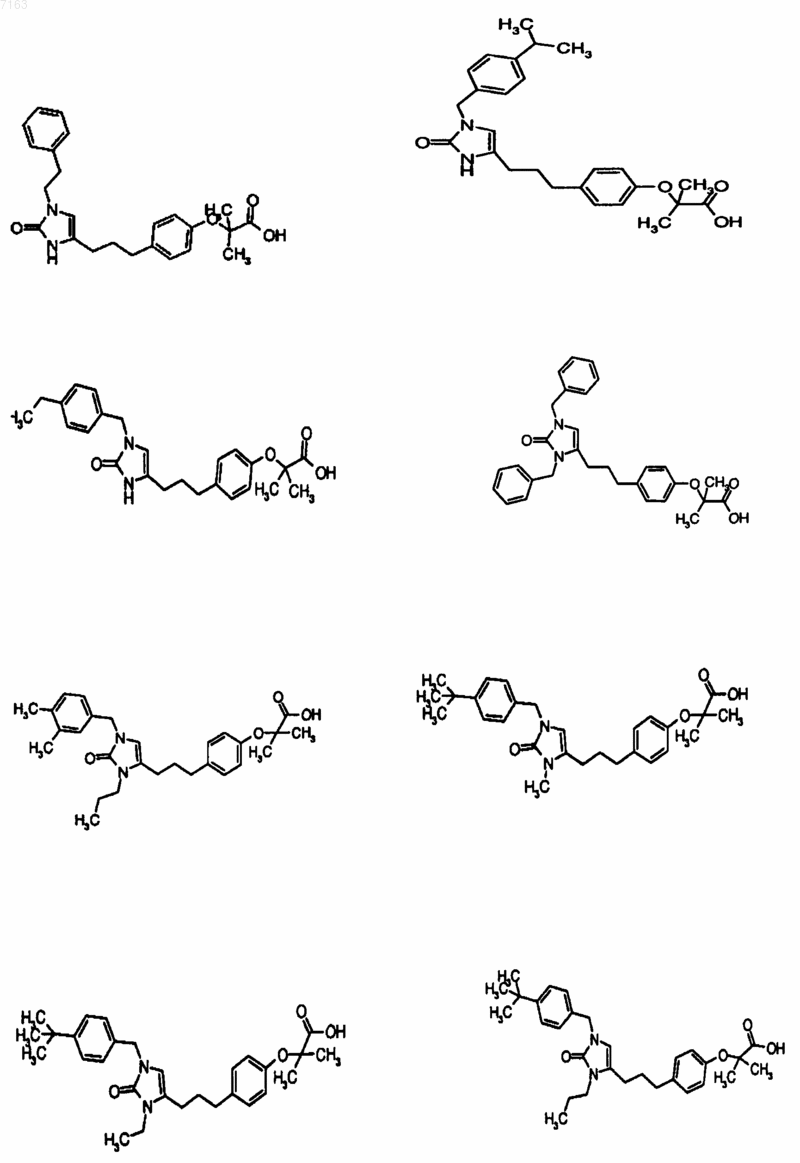
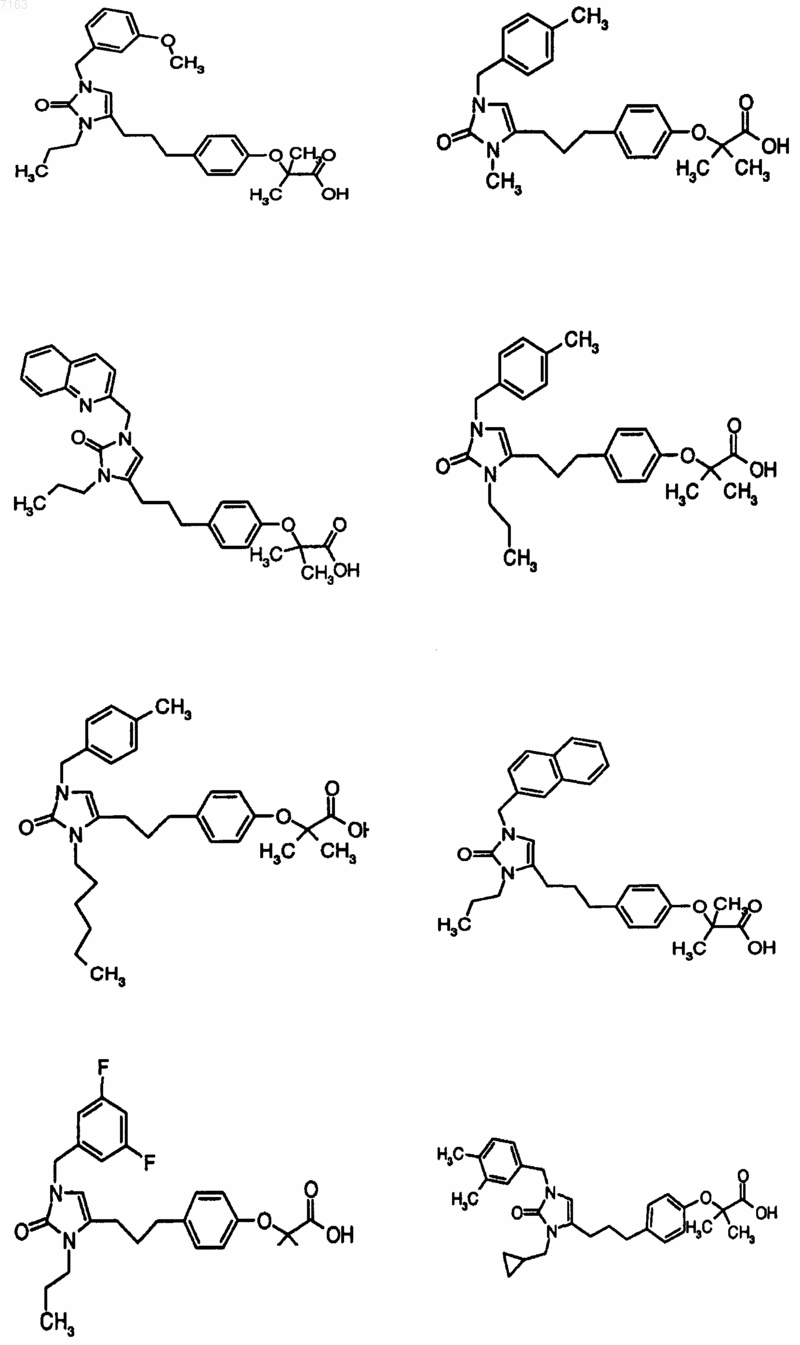
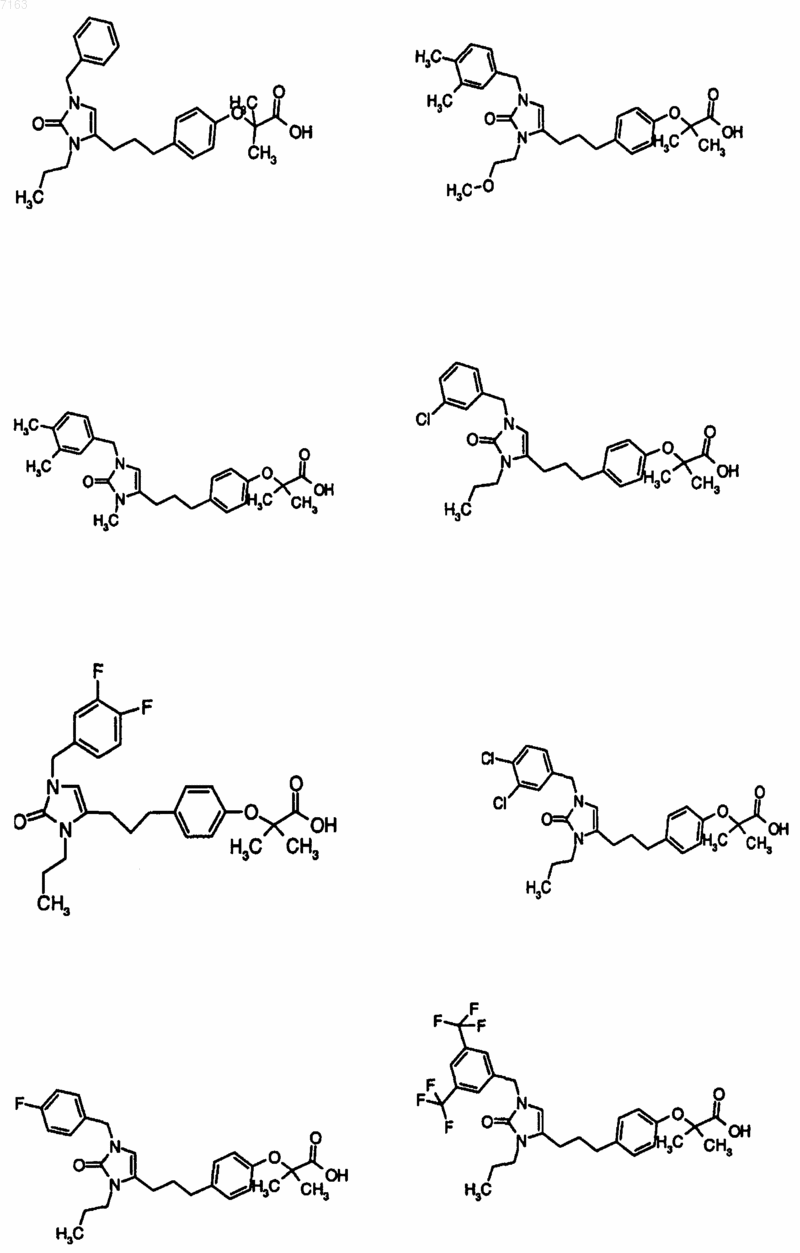
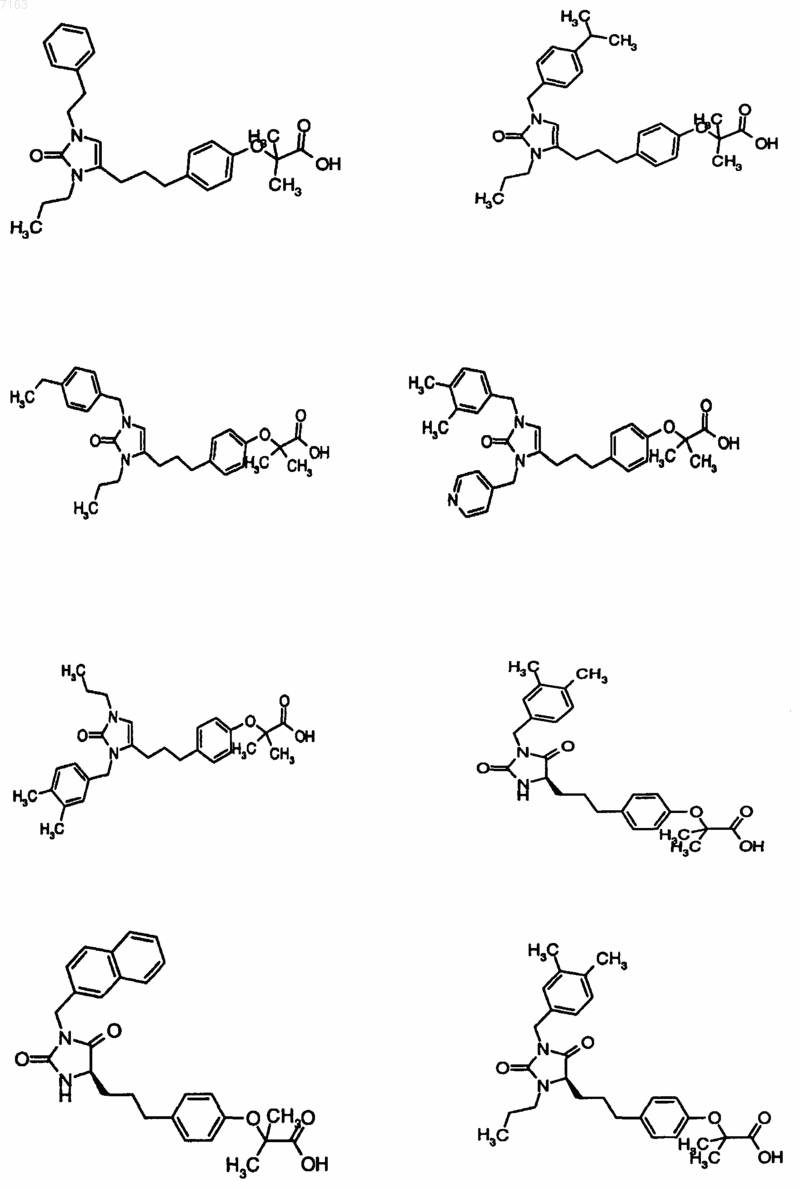
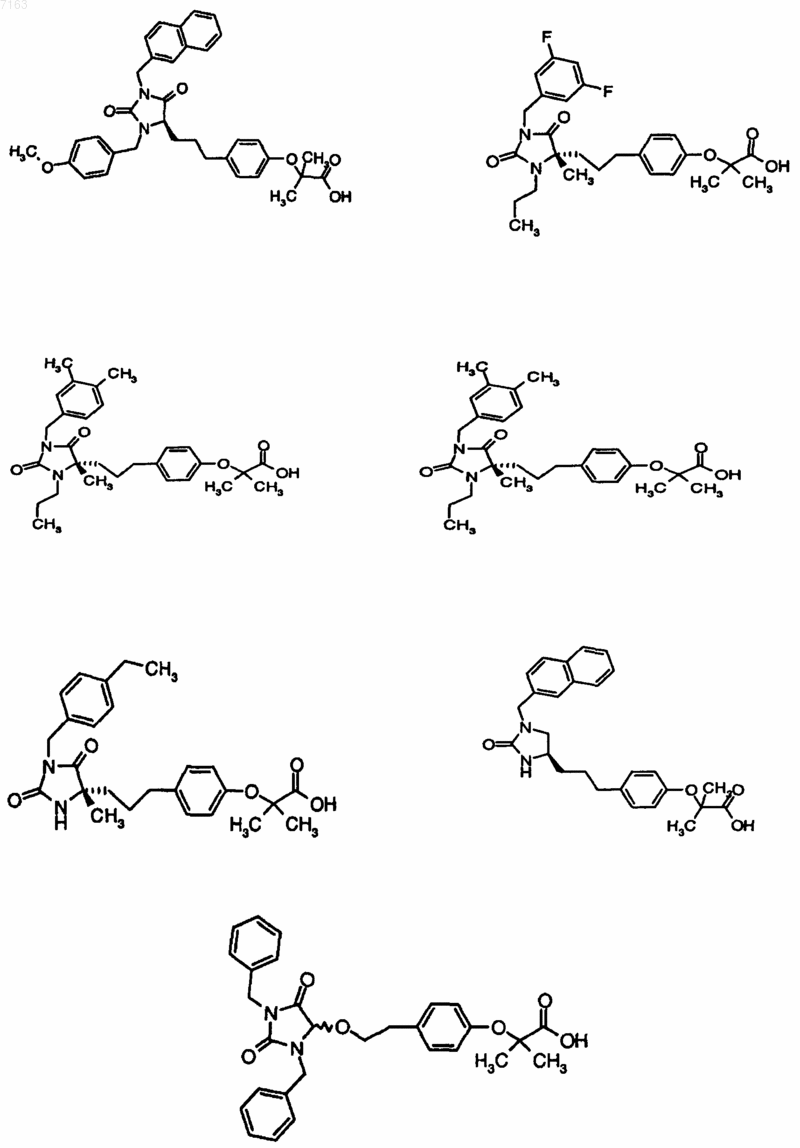
4. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и по крайней мере одно соединение по любому из пп.1-3 или его фармацевтически приемлемую соль, сольват или гидрат.
5. Способ модулирования рецептора, активированного пероксисомным пролифератором, включающий стадию введения рецептора в контакт по крайней мере с одним соединением по любому из пп.1-3 или его фармацевтически приемлемой(ым) солью, сольватом или гидратом.
6. Способ лечения сахарного диабета у млекопитающего, включающий стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества по крайней мере одного соединения по пп.1-3 или его фармацевтически приемлемой(ого) соли, сольвата или гидрата.
7. Способ профилактики сахарного диабета у млекопитающего, включающий стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества по крайней мере одного соединения по пп.1-3 или его фармацевтически приемлемой(ого) соли, сольвата или гидрата.
8. Способ лечения синдрома X у млекопитающего, включающий стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества по крайней мере одного соединения по пп.1-3 или его фармацевтически приемлемой(ого) соли, сольвата или гидрата.
9. Способ лечения сердечно-сосудистого заболевания у млекопитающего, включающий стадию введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества по крайней мере одного соединения по пп.1-3 или его фармацевтически приемлемой(ого) соли, сольвата или гидрата.
10. Применение соединения для изготовления лекарственного средства для лечения состояния, опосредованного рецептором, активированным пероксисомным пролифератором, причем указанное соединение или его фармацевтически приемлемая(ый) соль, сольват или гидрат является соединением по пп.1-3.
Текст
007163 Описание Предпосылки создания изобретения Рецепторы, активируемые пероксисомным пролифератором (PPAR), являются членами надсемейства ядерных рецепторов гормонов, представляющими собой лигандактивированные факторы транскрипции, регулирующие экспрессию генов. Уже открыты различные подтипы PPAR. Указанные подтипы включают, например, PPAR, PPAR и PPAR. Рецепторы PPAR, PPAR и PPAR причастны к сахарному диабету, сердечно-сосудистым заболеваниям, ожирению, синдрому X и желудочно-кишечным заболеваниям, таким как воспалительное заболевание кишечника. Синдром X представляет собой комбинацию симптомов, включающую гиперинсулемию в сочетании с гипертензией, повышенной массой тела, повышенными триглицеридами и повышенным LDL. Современное лечение синдрома X агонистами PPAR связано с применением тиазолидиндионов(TZD) или других усилителей чувствительности к инсулину (ISE). TZD - это класс агонистов PPARгамма, усиливающих, как известно, чувствительность клеток, чувствительных к инсулину. Не столько количество инсулина в крови, сколько усиление чувствительности к инсулину снижает вероятность гипогликемической комы. Однако TZD и ISE обычно имеют низкий эффект в предупреждении сердечнососудистой части синдрома X, поскольку их введение приводит не к снижению уровней триглицеридов иLDL-холестерина, а к повышению уровня HDL-холестерина. Кроме того, с лечением TZD обычно связаны клинически существенные побочные эффекты. Таким образом, существует потребность в новых фармацевтических средствах, влияющих на лечение или профилактику сердечно-сосудистого заболевания, в частности, связанного с синдромом X, с предупреждением или минимизацией при этом увеличения массы тела, и, более предпочтительно, с усилением чувствительности к инсулину. В соответствии с настоящим изобретением предлагаются новые соединения, обладающие требуемой фармакологической активностью. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям, представленным следующей структурной формулой Формула I и их фармацевтически приемлемым солям, сольватам и гидратам, где(a) R1 выбран из группы, состоящей из водорода, замещенной или незамещенной группы, выбранной из С 1-С 8 алкила, арил-С 0-С 4 алкила, гетероарил-С 0-С 4 алкила, С 3-С 6 циклоалкил-С 0-С 2 алкила и-CH2-C(O)-R17-R18, где R17 представляет собой O или NH и R18 представляет собой необязательно замещенный бензил;(b) R2 представляет собой H или замещенную или незамещенную группу, выбранную из группы,состоящей из С 1-С 6 алкила, С 1-С 6 алкенила, арил-С 0-С 4 алкила, гетероарил-С 0-С 4 алкила, С 1-С 4 алкилсульфонамида, С 1-С 4 алкиламида, OR10 и С 3-С 6 циклоалкила;(d) X представляет собой необязательно замещенную С 1-С 5 алкиленовую связывающую группу,где один углеродный атом может быть необязательно заменен O, NH, S, и, необязательно, два углеродных атома вместе могут образовывать двойную связь;(f) E выбран из группы, состоящей из C(R3)(R4)A, A и замещенной или незамещенной группы, выбранной из группы, состоящей из (CH2)nCOOR19, где(ii) A представляет собой функциональную группу, выбранную из группы, состоящей из карбоксила, С 1-С 3 алкилнитрила, карбоксамида, замещенного или незамещенного сульфонамида, замещенного или незамещенного ацилсульфонамида, замещенного или незамещенного тетразола и замещенного или незамещенного изоксазола;(iv) R4 выбран из группы, состоящей из H, галогена и замещенной или незамещенной группы, выбранной из С 1-С 5 алкила, С 1-С 5 алкокси, С 3-С 6 циклоалкила, арил-С 0-С 4 алкила, арил-С 0-С 2 алкокси и фенила; или R3 и R4 объединены друг с другом с образованием С 3-С 8 циклоалкила; и(v) R19 выбран из группы, состоящей из водорода, необязательно замещенного арилметила и необязательно замещенного С 1-С 4 алкила;(h) R9 выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкиленила, галогена, замещенного или незамещенного арила, замещенного или незамещенного арил-С 1-С 4 алкила, замещенного или незамещенного гетероарила, С 1-С 6 алкенила и OR10;(i) R10 независимо выбран из группы, состоящей из водорода и С 1-С 4 алкила;(j) R21 выбран из группы, состоящей из водорода, =O и замещенной или незамещенной группы,выбранной из группы, состоящей из С 1-С 6 алкила, арила, С 1-С 4 алкиларила и гетероарила;(k) R22 выбран из группы, состоящей из водорода и замещенной или незамещенной группы, выбранной из группы, состоящей из С 1-С 6 алкила, арила, С 1-С 4 алкиларила и гетероарила; и(1)представляет собой необязательную двойную связь. Соединение формулы I' и его фармацевтически приемлемые соли, сольваты и гидраты, где:(a) R1 выбран из группы, состоящей из водорода, замещенной или незамещенной группы, выбранной из С 1-С 8 алкила, арил-С 0-С 4 алкила, гетероарил-С 0-С 4 алкила, С 3-С 6 циклоалкил-С 0-С 2 алкила и CH2-C(O)-R17-R18, где R17 представляет собой O или NH и R18 представляет собой необязательно замещенный бензил:(b) R2 представляет собой H или замещенную или незамещенную группу, выбранную из группы,состоящей из С 1-С 6 алкила, С 1-С 6 алкенила, арил-С 0-С 4 алкила, гетероарил-С 0-С 4 алкила, С 1-С 4 алкилсульфонамида, С 1-С 4 алкиламида, OR10 и С 3-С 6 циклоалкила;(d) X представляет собой необязательно замещенную С 1-С 5 алкиленовую связывающую группу,где один углеродный атом может быть необязательно заменен O, NH или S;(f) E выбран из группы, состоящей из C(R3)(R4)A, A и замещенной или незамещенной группы, выбранной из группы, состоящей из (CH2)HCOOR19, где(ii) A представляет собой функциональную группу, выбранную из группы, состоящей из карбоксила, C1-С 3 алкилнитрила, карбоксамида, замещенного или незамещенного сульфонамида, замещенного или незамещенного ацилсульфонамида и замещенного или незамещенного тетразола;(iii) R3 представляет собой H, насыщенный или ненасыщенный С 1-С 5 алкил, арил-С 0-С 2 алкокси или С 1-С 5 алкокси;(iv) R4 представляет собой H, галоген, замещенную или незамещенную группу, выбранную из С 1 С 5 алкила, С 1-С 5 алкокси, С 3-С 6 циклоалкила, арил-С 0-С 4 алкила, арил-С 0-С 2 алкокси и фенила; или(v) R19 выбран из группы, состоящей из водорода, необязательно замещенного арилметила и необязательно замещенного С 1-С 4 алкила;(h) R9 выбран из группы, состоящей из водорода, С 1-С 4 алкила, С 1-С 4 алкиленила, галогена, замещенного или незамещенного арила, замещенного или незамещенного арил-С 1-С 4 алкила, замещенного или незамещенного гетероарила, С 1-С 6 алкенила и OR10;(i) R10 независимо выбран из группы, состоящей из водорода и С 1-С 4 алкила;(j) R21 выбран из группы, состоящей из водорода, =O и замещенной или незамещенной группы,выбранной из группы, состоящей из С 1-С 6 алкила, арила, С 1-С 4 алкиларила и гетероарила;(k) R22 выбран из группы, состоящей из водорода и замещенной или незамещенной группы, выбранной из группы, состоящей из С 1-С 6 алкила, арила, С 1-С 4 алкиларила и гетероарила; и(1)представляет собой необязательную двойную связь. Дополнительный вариант представляет собой соединение и фармацевтически приемлемые соли,сольваты и гидраты структурной формулы II: Другой дополнительный вариант представляет собой соединение и фармацевтически приемлемые соли, сольваты и гидраты структурной формулы III Еще один вариант настоящего изобретения представляет собой соединение формулы IV следующей структуры: и его соли, сольваты и гидраты. Одним предпочтительным вариантом настоящего изобретения является соединение, выбранное из 2-метил-3-(4-2-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]этоксифенил)-2-феноксипропионовой кислоты и 2-метил-3-(4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4 ил]пропилфенил)-2-феноксипропионовой кислоты. В следующем варианте настоящего изобретения заявленное соединение является соединением, меченым радиоизотопом. В одном из вариантов настоящее изобретение относится также к фармацевтическим композициям,содержащим по крайней мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль, сольват, гидрат или пролекарство и фармацевтически приемлемый носитель. В другом варианте настоящее изобретение относится к способу модулирования одного или нескольких PPAR рецепторов введением рецептора в контакт по крайней мере с одним соединением, представленным структурной формулой I, или его фармацевтически приемлемыми солями, сольватами и гидратами. В следующем варианте настоящее изобретение относится к способу селективного модулирования одного или нескольких PPAR рецепторов введением рецептора в контакт по крайней мере с одним соединением, представленным структурной формулой I, или его фармацевтически приемлемыми солями,сольватами и гидратами. Еще один вариант настоящего изобретения представляет собой преимущественно модулирование одного PPAR рецептора и дополнительно модулирование второго, отличного от первого, PPAR рецептора для обеспечения требуемого двойного агонизма. И в еще одном варианте настоящее изобретение относится к способу получения соединения, представленного структурной формулой I. Предполагается, что соединения по настоящему изобретению и их фармацевтически приемлемые соли, сольваты и гидраты эффективны при лечении и профилактике синдрома X, диабета типа II, гипергликемии, гиперлипидемии, ожирения, коагулопатии, гипертензии, атеросклероза и других нарушений,связанных с синдромом X и сердечно-сосудистыми заболеваниями. Кроме того, соединения оказывают меньше побочных эффектов, чем соединения, используемые в настоящее время для лечения указанных состояний. Далее, соединения по настоящему изобретению могут быть полезны для снижения фибриногена, повышения уровней HDL, лечения болезни почек, регулирования желаемой массы тела, лечения демиелинизирующих заболеваний, лечения некоторых вирусных инфекций и лечения болезни печени. Подробное описание изобретения Термины, использованные для описания настоящего изобретения, имеют следующие значения. При использовании в данном описании алкильные группы включают неразветвленные или разветвленные углеводороды, которые полностью насыщены. Указанные разветвленные углеводороды могут быть в соответствующих случаях первичными, вторичными, третичными или четвертичными. При использовании в данном описании алкиленовая связывающая группа представляет собой С 1 С 5 неразветвленную или разветвленную углеводородную группу. Однако термин алкиленовая связывающая группа, где один углеродный атом может быть необязательно заменен О, NH, S и необязательно два углеродных атома вместе могут образовывать двойную связь относится к алкиленовой связи,имеющей О, NH или S в связующем звене. Алкиленовые связывающие группы, имеющие два углерод-3 007163 ных атома, вместе образующих двойную связь, представляют собой, например, -CH-CHCH2-,-CH2CHCH-, -CH2CH2CHCH- и тому подобное. Например, но, не ограничиваясь ими, -CH2CH2O-,-CH2CH2NH-, -CH2CH2S-, -CH2OCH2-, -OCH2CH2- и тому подобное. Циклоалкильные группы при использовании в данном описании включают циклические углеводороды, которые частично или полностью насыщены. При использовании в данном описании арильные группы включают карбоциклические ароматические кольцевые системы (например, фенил), конденсированные полициклические ароматические кольцевые системы (например, нафтил и антраценил) и ароматические кольцевые системы, конденсированные с карбоциклическими неароматическими кольцевыми системами (например, 1,2,3,4-тетрагидронафтил и бензодиоксил). Гетероциклическаягруппа при использовании в данном описании представляет собой кольцевую систему, содержащую по крайней мере один гетероатом, такой как азот, сера или кислород. Гетероциклические группы включают бензофуранил, бензотиазолил, бензотиенил, изохинолил, изоксазолил, морфолино, оксадиазолил, пиридил, пиримидинил, пирролил, хинолил, тетрагидропиранил и тиенил. Гетероарил при использовании в данном описании представляет собой ароматическую кольцевую систему, конденсированные полициклические ароматические кольцевые системы и ароматические кольцевые системы, конденсированные с неароматическими кольцевыми системами, где по крайней мере один углеродный атом заменен гетероатомом, таким как атом азота, серы или кислорода. Может быть предпочтительным, чтобы гетероарил содержал 1-3 гетероатома. Может быть предпочтительным, чтобы гетероарил содержал 1-2 атома азота. Одной гетероарильной группой, которая может быть желательной,является группа: Другой гетероарильной группой, которая может быть желательной, является группа: Каждый из терминов аралкил, арилметил, арил-С 0-С 2 алкокси и арилокси представляет собой заместитель, в котором арильная группа связана с исходной молекулой через алкил, метил и окси,соответственно. Кроме того, когда словосочетание арил-С 0-С 2 алкокси представляет собой СО алкокси, это означает, что арил связан с исходной молекулой через оксигруппу. Примерами подходящих заместителей для R1, R5, E, R19 и R9, когда указанные R1, E, R5, R19 илиR9 представляет собой одну или несколько групп, независимо выбранных из группы, состоящей из С 1 С 8 алкила, С 1-С 4 алкила, арила, арилметила, (CH2)nCOOR19, С 1-С 6 алкенила, тио-С 1-С 4 алкила, тиоарила, С 1-С 4 алкоксиарила, С 1-С 4 алкокси-С 1-С 4 алкила, аминоарила, амино-С 1-С 4 алкила, арил-С 0-С 4 алкила, гетероарил-С 0-С 4 алкила, гетероциклической группы, -CH2-C(О)-R17-R18, С 3-С 6 циклоалкиларил-С 0-С 2 алкила и циклоалкила, тогда подходящие замещенные группы, включают, например, С 1-С 5 алкил, С 1-С 5 алкокси, С 0-С 5 галогеналкил, С 1-С 5 тригалогеналкил, С 1-С 5 тригалогеналкокси, С 1-С 5 галогеналкокси, нитро, циано, CHO, =O, гидроксил, С 1-С 4 алкановую кислоту, фенил, арилокси, SO2R7,SR7, бензилокси, алкилкарбоксамидо или COOH. R7 представляет собой алкил или галогеналкил. КогдаR1, R5, E, R19 или R9 является замещенной группой, предпочтительно имеется 1-3 заместителя в указанной группе R1, R5, E, R19 или R9. Особенно предпочтительной тригалогеналкильной группой является трифтор-С 1-С 5 алкил. Примеры подходящих заместителей для необязательно замещенной С 2-С 5 алкиленовой связывающей группы включают один или несколько заместителей, независимо выбранных из группы, состоящей из С 1-С 6 алкила, оксо, замещенного или незамещенного арил-С 0-С 3 алкила, С 1-С 3 алкокси,гидрокси, С 3-С 6 циклоалкила и галогена. Когда алкиленовая связывающая группа является замещенной группой, предпочтительно имеется от одного до трех независимых заместителей. Примеры подходящих заместителей для замещенного С 1-С 3 алкилена включают один или несколько заместителей, независимо выбранных из группы, состоящей из С 1-С 6 алкила, оксо, арил-С 0-С 3 алкила, С 1-С 3 алкокси, гидрокси и галогена. Когда алкилен является замещенной группой, предпочтительно имеется 1-3 независимых заместителя. Подходящие заместители для замещенных групп R2, где R2 представляет собой С 1-С 6 алкил, С 1 С 6 алкенил, арил-С 0-С 4 алкил, С 1-С 4 алкилсульфонамид, С 1-С 4 алкиламид, OR10 или С 3-С 6 циклоалкил, включают, например, одну или несколько групп, независимо выбранных из группы, состоящей из ОН, алкокси, галогеналкила, амино, COOH, гетероарил-O-, гетероарил-С(O)-, алкил-O-, алкил-С(О)-, С 3 С 6 циклоалкила, арил-O-, арил-С(О)-, гетероарила, арила, гетероциклоалкила, гетероциклоалкил-O- и гетероциклоалкил-С(О)-. Когда R2 является замещенной группой, предпочтительно имеется 1-3 независимых заместителя в указанной группе R2.-4 007163 Примеры подходящих заместителей для групп А, где А представляет собой сульфонамид, включают один или несколько заместителей, независимо выбранных из группы, состоящей из С 1-С 4 алкила, С 1 С 4 галогеналкила, замещенного или незамещенного гетероарила или замещенного или незамещенного арила. Когда группа А является замещенной группой, предпочтительно имеется 1-3 независимых заместителя в группе А. Примеры подходящих заместителей для групп А, где А представляет собой ацилсульфонамид и тетразол, включают, например, один или несколько заместителей, независимо выбранных из группы,состоящей из С 1-С 4 алкила, С 1-С 4 галогеналкила, замещенного или незамещенного гетероарила или замещенного или незамещенного арила. Подходящие заместители для R4, где R4 представляет собой С 1-С 5 алкил, С 1-С 5 алкокси, С 1-С 6 циклоалкил, арил-С 0-С 4 алкил, арил-С 0-С 2 алкокси или фенил, включают, например, галоген, фенил,С 1-С 4 алкокси, гидрокси и арил-С 0-С 2 алкокси. Когда R4 является замещенной группой, предпочтительно имеется 1-4 независимо выбранных заместителя в группе R4. Для соответственных фармацевтических композиций является предпочтительным, когда в соединениях по настоящему изобретению, представленных структурной формулой I, W представляет собой кислород. Соединения структурной формулы I могут содержать один или несколько хиральных центров и существуют в разных оптически активных формах. Когда соединения структурной формулы I содержат один хиральный центр, они существуют в двух энантиомерных формах и настоящее изобретение охватывает оба энантиомера и смеси энантиомеров, такие как рацемические смеси. Энантиомеры могут быть разделены методами, известными специалистам в данной области техники, например, образованием диастереоизомерных солей, которые могут быть разделены, например, кристаллизацией; образованием диастереоизомерных производных или комплексов, которые могут быть разделены, например, кристаллизацией, газожидкостной хроматографией или жидкостной хроматографией; осуществлением избирательного взаимодействия одного энантиомера со специфичным к энантиомеру реагентом, например, ферментативной этерификацией; или газожидкостной или жидкостной хроматографией в хиральной среде, например, на хиральном носителе, таком как диоксид кремния, со связанным хиральным лигандом или в присутствии хирального растворителя. Понятно, что в случае преобразования требуемого энантиомера в другой химический структурный объект одним из методов разделения, описанных выше, требуется дополнительная стадия для выделения требуемой энантиомерной формы. В соответствии с другим вариантом конкретные энантиомеры могут быть синтезированы методом асимметрического синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей или преобразованием одного энантиомера в другой методом асимметрического превращения. Когда соединение, представленное структурной формулой I, имеет более одного хирального заместителя, оно может существовать в диастереоизомерных формах. Диастереоизомерные пары могут быть разделены методами, известными специалистам в данной области техники, например, хроматографией или кристаллизацией, и отдельные энантиомеры могут быть выделены так, как описано выше. Настоящее изобретение включает каждый диастереоизомер соединений структурной формулы I и их смеси. Некоторые соединения структурной формулы I могут существовать в разных устойчивых конформационных формах, которые могут быть разделяемыми. Торсиональная асимметрия, обусловленная ограниченным вращением вокруг асимметрической одинарной связи, например, из-за пространственного затруднения или деформации кольца, может позволить разделение разных конформеров. Настоящее изобретение охватывает каждый конформационный изомер соединений структурной формулы I и их смеси. Некоторые соединения структурной формулы I могут существовать в цвиттерионной форме и настоящее изобретение охватывает каждую цвиттерионную форму соединений структурной формулы I и их смеси. Некоторые соединения структурной формулы I и их соли могут также существовать в форме сольватов, например, гидратов, и настоящее изобретение охватывает каждый сольват и их смеси. Фармацевтически приемлемая соль относится к солям соединений структурной формулы I, по существу нетоксичным по отношению к млекопитающим. Типичные фармацевтически приемлемые соли включают указанные соли, полученные осуществлением взаимодействия соединений по настоящему изобретению с минеральной или органической кислотой или органическим или неорганическим основанием. Такие соли известны как кислотно- и основно-аддитивные соли, соответственно. Следует понимать, что конкретный противоион, образующий часть всякой соли по настоящему изобретению, не имеет решающего значения, пока соль в целом является фармацевтически приемлемой и пока противоион не придает нежелательных свойств соли в целом. Благодаря своему кислотному фрагменту соединение структурной формулы I образует соли с фармацевтически приемлемыми основаниями. Некоторые примеры основно-аддитивных солей включают соли металлов, таких как алюминий; соли щелочных металлов, таких как литий, натрий или калий; соли щелочно-земельных металлов, таких как кальций и магний; и аммониевые или замещенные аммониевые соли. Примеры замещенных аммониевых солей включают, например, соли с низшими алкиламинами,такими как триметиламин, триэтиламин, гидроксиалкиламинами, такими как 2-гидроксиэтиламин, бис(2-5 007163 гидроксиэтил)амин или три(2-гидроксиэтил)амин, циклоалкиламинами, такими как бициклогексиламин, или дибензилпиперидином, N-бензилфенетиламином, дегидроабиетиламином, N,N'бисдегидроабиетиламином, глюкамином, N-метилглюкамином; основаниями пиридинового типа, такими как пиридин, коллидин, хинин или хинолин, и соли основных аминокислот, таких как лизин и аргинин. Примеры неорганических оснований включают, без ограничения, гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия, гидроксид кальция, карбонат кальция и тому подобное. Соединения структурной формулы I, замещенные основной группой, могут существовать в виде солей с фармацевтически приемлемыми кислотами. Настоящее изобретение охватывает такие соли. Примеры таких солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты,малеаты, ацетаты, цитраты, фумараты, тартраты [например, (+)-тартраты, (-)-тартраты или их смеси,включая рацемические смеси], сукцинаты, бензоаты и соли с аминокислотами, такими как глутаминовая кислота. Указанные соли могут быть получены способами, известными специалистам в данной области техники. Некоторые соединения структурной формулы I и их соли могут также существовать в форме сольватов, например, гидратов, и настоящее изобретение охватывает каждый сольват и их смеси. Кроме того, обычно является нежелательным изготавливать лекарственные средства, содержащие значительные количества органического растворителя (например, этилацетата) из-за возможной токсичности растворителя по отношению к его реципиенту и изменения действенности лекарственного средства в зависимости от растворителя. Кроме того, с точки зрения изготовления обычно является также менее желательным получение некристаллических веществ, когда указанное получение включает сбор конечного продукта фильтрованием. Операции указанного фильтрования часто труднее выполнять, когда собираемый материал некристаллический. Далее, обычно также является менее желательным, с производственной точки зрения, изготавливать лекарственные средства, содержащие значительные количества воды (гидратов), потому что уровень гидратации оказывает некоторое влияние на относительную влажность, при которой лекарственное средство получают и хранят. Другими словами, обычно гидрат более проблематичен в отношении изменения действенности лекарственного средства, чем безводная форма. Настоящее изобретение дает требуемую кристаллическую форму. Пролекарства представляют собой соединения по настоящему изобретению, которые содержат химически или метаболически отщепляемые группы и становятся в результате сольволиза или в физиологических условиях соединениями по настоящему изобретению, которые фармацевтически активны invivo. Пролекарства включают производные кислот, хорошо известные практикующим врачам в данной области, такие как, например, сложные эфиры, полученные взаимодействием исходного кислотного соединения с подходящим спиртом, или амиды, полученные взаимодействием исходного кислотного соединения с подходящим амином. Одинарные алифатические или ароматические сложные эфиры, производные по боковым кислотным группам соединений по настоящему изобретению, являются предпочтительными пролекарствами. В некоторых случаях является желательным получение пролекарств типа двойных сложных эфиров, таких как (ацилокси)алкиловые эфиры или алкоксикарбонил)окси) алкиловые эфиры. Особенно предпочтительными сложными эфирами в качестве пролекарств являются метиловый, этиловый, пропиловый, изопропиловый, н-бутиловый, изобутиловый, трет-бутиловый, морфолиноэтиловый и N,N-диэтилгликольамидоэфир. Пролекарства в виде метиловых сложных эфиров могут быть получены взаимодействием кислотной формы соединения формулы I в такой среде, как метанол, с кислотным или основным катализатором этерификации (например, NaOH, H2SO4). Пролекарства в виде этиловых сложных эфиров получают аналогичным образом с использованием этанола вместо метанола. Пролекарства в виде морфолинилэтиловых сложных эфиров могут быть получены взаимодействием натриевой соли соединения структурной формулы I (в такой среде, как диметилформамид) с 4-(2 хлорэтил)морфингидрохлоридом (поставляется фирмой Aldrich Chemical Co., Milwaukee, Wisconsin USA,ItemC4,220-3). Термин активный компонент означает соединения, в общем представленные структурной формулой I, а также соли, сольваты и пролекарства таких соединений. Термин фармацевтически приемлемый означает, что носитель, разбавитель, эксципиенты и соль должны быть совместимы с другими компонентами композиции и безвредны для реципиента. Фармацевтические композиции по настоящему изобретению изготавливают методами хорошо известными в данной области техники, с использованием хорошо известных и легко доступных компонентов. Профилактика относится к снижению вероятности того, что у реципиента возникнет или обнаружится какое-либо из патологических состояний, указанных в данном описании. Лечение относится к лечению лекарственным средством заболевания или состояния и профилактике или ослаблению ее(его) дальнейшего развития или уменьшению интенсивности симптомов, связанных с заболеванием или состоянием. Фармацевтически приемлемое количество означает то количество соединения или его соли, соль-6 007163 вата, гидрата или пролекарства, которое вызовет биологическую или медицинскую реакцию ткани, системы или млекопитающего. Такое количество может быть введено профилактически пациенту, предположительно подверженному проявлению болезни или состояния. Указанное количество, будучи введенным пациенту профилактически, может также эффективным в предотвращении или уменьшении тяжестиPPAR опосредованного состояния. Предполагается, что указанное количество включает количество, достаточное для модулирования PPAR рецептора или для профилактики или лечения заболевания или состояния. Состояния, которые предупреждают или лечат PPAR рецепторами, включают, но не ограничиваются ими, сахарный диабет, сердечно-сосудистое заболевание, синдром X, ожирение и желудочнокишечное заболевание. Млекопитающее - это отдельное животное, являющееся членом таксономического класса млекопитающие. Класс млекопитающих включает людей, обезьян, шимпанзе, горилл, крупный рогатый скот, свиней, лошадей, овец, собак, кошек, мышей и крыс. Введение соединений настоящего изобретения человеку является наиболее предпочтительным. Соединения и композиции по настоящему изобретению могут быть полезны для лечения и/или профилактики сердечно-сосудистого заболевания, для повышения уровня HDL-холестерина в сыворотке крови,для снижения уровней триглицеридов в сыворотке крови и для снижения уровня LDL-холестерина в сыворотке крови. Повышенные уровни триглицеридов и LDL и низкие уровни HDL считаются опасными факторами развития болезни сердца, внезапного мозгового удара и нарушений и заболеваний системы кровообращения. Соединения и композиции по настоящему изобретению могут быть также использованы для лечения и/или профилактики ожирения. Кроме того, указанные соединения и композиции могут быть полезны для лечения и/или профилактики инсулиннезависимого сахарного диабета (NIDDM) с понижением или отсутствием прироста массы тела пациента. Далее, соединения и композиции по настоящему изобретению могут быть использованы для лечения и/или профилактики острых или преходящих нарушений чувствительности к инсулину, например, иногда случающихся после хирургической операции, травмы, инфаркта миокарда и подобного. Обычный практикующий врач может определить, какому человеку будет польза от введения соединений и композиций по настоящему изобретению. В соответствии с настоящим изобретением предлагается также способ лечения и/или профилактики гипергликемии у человека или отличного от человека млекопитающего, включающий введение эффективного, нетоксичного количества соединения общей формулы (I) или его таутомерной формы и/или его фармацевтически приемлемой соли, и/или их фармацевтически приемлемого сольвата нуждающемуся в этом человеку или отличному от человека млекопитающему, страдающему от гипергликемии. Указанные соединения могут использоваться в качестве терапевтических веществ для профилактики или лечения синдрома X, сахарного диабета и связанных с ними эндокринных и сердечно-сосудистых расстройств и заболеваний у человека и животных, отличных от человека. Настоящее изобретение относится также к применению соединения формулы I, как описано выше,для изготовления лекарственного средства для лечения опосредованного PPAR рецептором состояния. Терапевтически эффективное количество соединения структурной формулы I может быть использовано для изготовления лекарственного средства, полезного для лечения синдрома X, диабета, лечения ожирения, снижения уровней триглицеридов, снижения уровня LDL, повышения уровня в плазме липопротеина высокой плотности и для лечения, профилактики или снижения риска развития атеросклероза,а также для предупреждения или снижения риска первого или последующего проявления атеросклероза у млекопитающих, в частности, у человека. В общем, терапевтически эффективное количество соединения по настоящему изобретению обычно снижает уровни триглицеридов в сыворотке крови примерно на 20% или более и повышает уровень HDL в сыворотке крови человека. Предпочтительно, рост уровняHDL составляет примерно 30% или более. Кроме того, терапевтически эффективное количество соединения, используемое для профилактики или лечения NIDDM, обычно снижает у пациента уровень глюкозы в сыворотке крови, а более конкретно HbA1c, примерно на 0,7% или более. Композиции, содержащие соединение структурной формулы I и/или его соли, целесообразно изготавливать в виде дозированной лекарственной формы. Каждая лекарственная форма предпочтительно содержит от примерно 1 до примерно 500 мг активного компонента. Но, конечно, понятно, что фактически вводимое количество соединения или соединений структурной формулы I в каждом конкретном случае определяется лечащим врачом. При использовании в данном описании термин синдром X включает преддиабетический синдром инсулинорезистентности и его осложнения, инсулинорезистентность, инсулиннезависимый диабет, дислипидемию, гипергликемию, ожирение, коагулопатию, гипертензию и другие осложнения, связанные с диабетом. Способы лечения, указанные выше, включают и лечение и/или профилактику любого одного из или любого сочетания следующих заболеваний: преддиабетический синдром инсулинорезистентности, его осложнения, инсулинорезистентность, инсулиннезависимый (или типа II) диабет, дислипидемия, гипергликемия, ожирение и осложнения, связанные с диабетом, включая сердечно-сосудистое заболевание, в частности, атеросклероз.-7 007163 Соединения по настоящему изобретению могут быть полезны при лечении PPAR опосредованных состояний и для применения в качестве средств исследования. Некоторые соединения и режимы в объеме настоящего изобретения являются предпочтительными. Следующие условия, варианты изобретения и характеристики соединений, перечисленные в форме таблицы, могут быть независимо скомбинированы с получением самых разных предпочтительных соединений и режимов лечения. Следующий перечень вариантов настоящего изобретения не следует считать как-то ограничивающим объем изобретения. Некоторыми предпочтительными характеристиками соединений формулы I являются следующие:(e) R3 и R4, каждый представляет собой C1-С 6 алкил;(v) R1 представляет собой замещенный арилалкил;(dd) Арил представляет собой фенильную группу;(ее) Гетероарильная группа содержит N;(gg) Соединение формулы I, которое селективно модулирует альфа-рецептор;(hh) Соединение формулы I, которое является коагонистом PPAR, модулирующим альфа-рецептор и гамма-рецептор; и(jj) Соединение формулы I для применения в лечении диабета типа II и/или синдрома X. Композиции изготавливают в виде лекарственных форм и вводят одним и тем же общим способом,подробно описанным ниже. Соединения по настоящему изобретению можно эффективно использовать в отдельности или в сочетании с одним или несколькими дополнительными активными средствами в зависимости от желаемой цели терапии. Комбинированная терапия включает введение разовой дозированной формы, содержащей соединение структурной формулы I и одно или несколько дополнительных активных средств, а также введение соединения структурной формулы I и каждого активного средства в его собственной отдельной дозированной форме. Например, соединение структурной формулы I или его соль и средство, стимулирующее секрецию инсулина, такое как бигуаниды, тиазолидиндионы, сульфонилмочевины, инсулин или ингибиторы -глюкозидазы, могут быть введены пациенту вместе в разовой пероральной дозированной форме, такой как таблетка или капсула, или каждое средство может быть введено в виде отдельной пероральной дозированной формы. При использовании отдельных дозированных форм соединение структурной формулы I и одно или несколько дополнительных активных средств могут быть введены по существу в одно и то же время, т.е. одновременно, или в разнесенные моменты времени, т.е. последовательно, и понятно, что комбинированная терапия включает все указанные режимы. Примером комбинированного способа лечения или профилактики атеросклероза является способ, в котором соединение структурной формулы I или его соли вводят в сочетании с одним или несколькими из следующих активных средств: средства против гиперлипидемии, средства, повышающие уровеньHDL в плазме крови, средства против гиперхолистеринемии, фибраты, витамины, аспирин и тому подобное. Как указано выше, соединения структурной формулы I могут быть введены в сочетании с более чем одним дополнительным активным средством. Другим примером комбинированной терапии может быть лечение диабета и связанных с ним расстройств, при котором соединения структурной формулы I, их соли могут быть эффективно использованы в сочетании, например, с сульфонилмочевинами, бигуанидами, тиазолидиндионами, ингибиторами глюкозидазы, другими средствами, стимулирующими секрецию инсулина, инсулином, а также описанными выше активными средствами для лечения атеросклероза. Соединения по настоящему изобретению и его фармацевтически приемлемые соли, сольваты и гидраты обладают ценными фармакологическими свойствами и могут быть использованы в фармацевтических композициях, содержащих терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемых солей, сложных эфиров или пролекарств в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Эксципиенты представляют собой инертные вещества, такие как, без ограничения, носители, разбавители, наполнители, корригенты, подслащиватели, смазывающие вещества, солюбилизаторы, суспендирующие вещества, смачивающие вещества, связывающие вещества, разрыхлители, инкапсулирующий материал и другие традиционные вспомогательные вещества. Подходящий состав композиции зависит от выбранного пути введения. Фармацевтические композиции обычно содержат от примерно 1 до примерно 99 массовых процентов активного компонента, которым является соединение по настоящему изобретению. Лекарственное средство предпочтительно приготавливают в виде единичной дозированной формы. Единичная дозированная форма - это физически дискретная единица, содержащая стандартную дозу,подходящую для введения людям или другим млекопитающим. Например, единичная дозированная форма может представлять собой капсулу или таблетку или много капсул или таблеток. Стандартная доза означает заданное количество активного соединения по настоящему изобретению, рассчитанное на создание требуемого терапевтического эффекта, в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Количество активного компонента в стандартной дозе можно изменять или регулировать от примерно 0,1 до примерно 1000 мг или более в соответствии с конкретным назначенным лечением. Схему лекарственного лечения с использованием соединений по настоящему изобретению выбирает обычный специалист в области медицины или ветеринарии с учетом самых разных факторов, включающих, без ограничения, вид, возраст, массу, пол и медицинское состояние реципиента, тяжесть состояния, которое нужно лечить, путь введения лекарственного средства, уровень метаболической и экскреторной деятельности реципиента, используемую лекарственную форму, используемые конкретное соединение и его соль и тому подобное. Соединения по настоящему изобретению предпочтительно вводят в виде разовой суточной дозы или общую суточную дозу можно вводить разделенными дозами два, три или более раз в сутки. Когда доставку лекарства производят с использованием чрескожных форм, то, конечно, введение происходит непрерывно. Подходящие пути введения фармацевтических композиций по настоящему изобретению включают,например, пероральное, капельное в глаза, ректальное, трансмукальное, местное или кишечное введение,парентеральное введение (инъекция ударной дозы вещества или вливание), включая внутримышечные,подкожные, интрамедуллярные инъекции, а также внутриоболочечное, прямое внутрижелудочковое,внутривенное, внутрибрюшинное, внутриносовое или внутриглазное введение. Соединения по настоящему изобретению могут быть также введены в системе прицельной доставки лекарственного вещества,такой как, например, липосома, покрытая антителом, специфичным к эндотелиальным клеткам. Для перорального введения из соединений можно легко изготовить лекарственные формы смешением активных соединений с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Указанные носители позволяют изготовить из соединений по настоящему изобретению лекарственные формы в виде таблеток, пилюль, порошков, саше, гранул, драже, капсул, жидкостей,эликсиров, настоек, гелей, эмульсий, сиропов, взвесей, суспензий и тому подобное, для перорального приема внутрь пациентом, которого нужно лечить. Фармацевтические препараты для перорального применения могут быть приготовлены смешиванием активного соединения с твердым эксципиентом, необязательным размалыванием полученной смеси и переработкой смеси гранул после добавления подходящих вспомогательных веществ, если требуется, с получением таблеток или ядер драже. Для перорального введения в форме таблеток или капсул активный компонент может быть смешан с нетоксичным фармацевтически приемлемым носителем для перорального применения, таким как (без ограничения) лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, карбонат кальция, фосфат кальция,сульфат кальция, карбонат натрия, маннит, сорбит и тому подобное; вместе, необязательно, с разрыхлителями, такими как (без ограничения) сшитый поливинилпирролидон, кукурузный крахмал, метилцеллюлоза, агар, бентонит, ксантановая камедь, альгиновая кислота или ее соль, такая как альгинат натрия, и тому подобное; и, необязательно, связывающими веществами, например, (без ограничения) желатином,аравийской камедью, природными сахарами, бета-лактозой, сахаристыми веществами из кукурузы, при-9 007163 родными и синтетическими камедями, трагакантом, альгинатом натрия, карбоксиметилцеллюлозой, полиэтиленгликолем, восками и тому подобное; и, необязательно, смазывающими веществами, например,(без ограничения) стеаратом магния, стеаратом натрия, стеариновой кислотой, олеатом натрия, бензоатом натрия, ацетатом натрия, хлоридом натрия, тальком и тому подобное. Когда единичной дозированной формой является капсула, она может содержать, в дополнение к описанным выше веществам, жидкий носитель, такой как жирное масло. Твердые лекарственные формы включают порошки, таблетки и капсулы. Твердым носителем может быть одно или несколько веществ, которые могут действовать как корригенты, смазывающие вещества,солюбилизаторы, суспендирующие вещества, связывающие вещества, разрыхлители для таблеток и инкапсулирующие материалы. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое смешано с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих пропорциях и смесь спрессована в таблетки требуемых формы и размера. В качестве покрытий или веществ для модификации физической формы лекарственного средства могут присутствовать другие вещества. Например, таблетки могут быть покрыты шеллаком, сахаром или тем и другим. Сироп или эликсир может содержать, кроме активного компонента, сахарозу в качестве подслащивающего вещества, метил- и пропилпарабены в качестве консервантов, краситель и корригент,такой как вишневый или апельсиновый ароматизатор. Стерильные жидкие препараты включают суспензии, эмульсии, сиропы и эликсиры. Активный компонент может быть растворен или суспендирован в фармацевтически приемлемом носителе, таком как стерильная вода, стерильный органический растворитель или смесь стерильной воды и стерильного органического растворителя. Активный компонент может быть также растворен в подходящем органическом растворителе, например, водном пропиленгликоле. Другие композиции могут быть изготовлены диспергированием тонкоизмельченного активного компонента в водном растворе крахмала или натрий-карбоксиметилцеллюлозы или в подходящем масле. Ядра драже снабжают подходящими покрытиями. Для этой цели можно использовать концентрированные растворы сахара, которые могут, необязательно, содержать гуммиарабик, тальк, поливинилпирролидон, карбополгель, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. В покрытия таблеток или драже могут быть добавлены красители или пигменты для идентификации и характеризации различных комбинаций доз активных соединений. Фармацевтические препараты, которые можно применять перорально, включают твердые капсулы с крышечкой, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активные компоненты в смеси с наполнителем, таким как лактоза, связывающими веществами, такими как крахмалы, и/или смазывающие вещества, такие как тальк или стеарат магния, и, необязательно, стабилизаторы. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все препараты для перорального введения должны иметь дозы, подходящие для такого введения. Особенно подходящими композициями для перорального введения являются стандартные лекарственные формы, такие как таблетки и капсулы. Для парентерального введения соединения по настоящему изобретению или их соли могут быть смешаны со стерильной водной или органической средой для образования впрыскиваемых растворов или суспензий. Лекарственные средства для инъекции могут находиться в единичной дозированной форме,такой как ампулы или многодозовые емкости, с добавленным консервантом. Композиции могут быть в виде суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать формообразующие вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Фармацевтические формы, подходящие для инъкционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для импровизированного приготовления стерильных инъекционных растворов или дисперсий. Во всех случаях форма должна быть стерильной и текучей в степени, обеспечивающей возможность каждого вида шприцевания. Она должна быть устойчивой в условиях производства и хранения и должна быть предохранена от загрязнения. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, предпочтительно в физиологически совместимых буферах, таких как раствор Хенкса, раствор Рингера или физиологический раствор,этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), подходящие их смеси и растительные масла. В обычных условиях хранения и применения указанные препараты содержат консервант, препятствующий размножению микроорганизмов. Инъекционные растворы, приготовленные описанным образом, могут быть затем введены внутривенно, внутрибрюшинно, подкожно или внутримышечно, причем предпочтительным для людей является- 10007163 внутримышечное введение. В лекарственной форме для трансмукального введения используют пенетранты, соответствующие барьеру, сквозь который нужно проникнуть. Такие пенетранты хорошо известны в данной области техники. Активные соединения могут быть также введены в нос, в виде, например, капель или струи жидкости. Для трансбуккального введения композициям может быть придана форма таблеток или пастилок,изготовленных обычным образом. Для введения ингаляцией соединения по настоящему изобретению целесообразно поставлять в виде ингалятора с сухим порошком или применять аэрозольным распылением из упаковок под давлением или распылителя с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае выдачи под действием давления аэрозоля дозирующее устройство может быть снабжено клапаном для выдачи дозированного количества. Для применения в ингаляторе или инсуффляторе могут быть изготовлены капсулы и картриджи из желатина, содержащие порошковидную смесь соединения и подходящей порошковидной основы, такой как лактоза или крахмал. Фармацевтические композиции по настоящему изобретению могут быть изготовлены известным самим по себе образом, например, с использованием обычных процессов смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, капсулирования, захватывания или лиофилизации. При изготовлении композиций по настоящему изобретению активный компонент обычно смешивают с носителем, разбавляют носителем или заключают в носителе, который может быть в виде капсулы, саше, бумаги или другой емкости. Когда носитель служит в качестве разбавителя, он может представлять собой твердый, лиофилизованный твердый или тестообразный, полутвердый или жидкий материал, который действует как носитель, или может быть в виде таблеток, пилюль, порошков, пастилок,эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (твердых или в жидкой среде) или мази,содержащих, например, до 10 мас.% активного соединения. Соединениям по настоящему изобретению перед введением предпочтительно придают лекарственную форму. Следующие лекарственные формы 1-8 являются лишь иллюстративными и не должны рассматриваться как каким-то образом ограничивающие объем настоящего изобретения. Активный компонент относится к соединению структурной формулы I или его солям. Лекарственная форма 1. Получают твердые желатиновые капсулы, используя следующие компоненты: Количество (мг/капсула) Активный компонент 250 Крахмал, высушенный 200 Стеарат магния 10 Итого 460 мг Лекарственная форма 2. Получают таблетки, используя следующие компоненты: Количество (мг/таблетка) Активный компонент 250 Целлюлоза, микрокристаллическая 400 Диоксид кремния, коллоидальный 10 Стеариновая кислота 5 Итого 665 мг Компоненты смешивают и прессуют в форме таблеток, каждая массой 665 мг. Лекарственная форма 3. Получают аэрозольный раствор, содержащий следующие компоненты: Масса Активный компонент 0,25 Этанол 25,75 Пропеллент 22 (хлордифторметан) 74,00 Итого 100 мг Активный компонент смешивают с этанолом и смесь добавляют к части пропеллента 22, охлажденной до 30C, и переносят в заполняющее устройство. Затем в сосуд из нержавеющей стали вводят необходимое количество и разбавляют его остатком пропеллента. Далее на сосуд устанавливают клапанное устройство. Лекарственная форма 4. Таблетки, содержащие каждая 60 мг активного компонента, изготавливают следующим образом: Активный компонент 60 мг Крахмал 45 мг Микрокристаллическая целлюлоза 35 мг Поливинилпирролидон (в виде 10% раствора в воде) 4 мг Натрий-карбоксиметилкрахмал 4,5 мг- 11007163 Стеарат магния 0,5 мг Тальк 5 мг Итого 665 мг Активный компонент, крахмал и целлюлозу пропускают через сито 45 по стандарту США и тщательно смешивают. С полученным порошком смешивают водный раствор, содержащий поливинилпирролидон, и затем смесь пропускают через сито 14 по стандарту США. Полученные при этом гранулы сушат при 50C и пропускают через сито 18 по стандарту США. Затем к гранулам добавляют натрийкарбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 по стандарту США, и после смешивания прессуют на таблеточной машине таблетки массой 150 мг каждая. Лекарственная форма 5. Капсулы, содержащие каждая 80 мг активного компонента, изготавливают следующим образом: Активный компонент 80 мг Крахмал 59 мг Микрокристаллическая целлюлоза 59 мг Стеарат магния 2 мг Итого 200 мг Активный компонент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 45 по стандарту США и помещают в твердые желатиновые капсулы в количестве 200 мг. В еще одном варианте соединений по настоящему изобретению соединение мечено радиоизотопом,таким как углерод-14, или тритировано. Такие меченные радиоизотопом или тритированные соединения применимы в качестве стандартов для анализов in vitro с целью идентификации новых агонистов PPAR и/или PPAR. Синтез Соединения по настоящему изобретению получают так, как конкретно описано в примерах. Кроме того, многие соединения получали по более общим схемам, показанным ниже. Могут быть эффективными также альтернативные способы синтеза, известные специалистам в данной области техники. Для получения некоторых соединений по настоящему изобретению может быть использован способ, показанный на следующей схеме: Взаимодействие промежуточного соединения А с избытком трифторуксусной кислоты при температуре окружающей среды в метиленхлориде в течение ночи дает фибратную кислоту (см. схему непо- 14007163 средственно над данным текстом). Фибратную кислоту промывают, пока в неочищенном продукте не останутся лишь следы трифторуксусной кислоты, и затем используют для получения соединений по настоящему изобретению. Схема 1. Общий пример А: Этиловый эфир 2-этокси-2-метил-3-(4-2-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]этоксифенил)пропионовой кислоты К раствору сложного -гидроксиэфира (0,04 г, 0,08 ммоль) в ДМФА добавляют оксид серебра (0,28 г, 1,2 ммоль) и этилиодид (0,07 мл, 1,0 ммоль). Смесь перемешивают при комнатной температуре в течение 16 ч и затем перемешивают при 50C еще 16 ч. Смесь фильтруют, фильтрат промывают водой и экстрагируют этилацетатом. Органический слой упаривают, сушат (MgSO4), концентрируют и хроматографируют (силикагель; гексан/EtOAc, 1:1-0:1). Выделяют сложный этиловый эфир в виде масла (25 мг,59%). MC (ESI) m/z 537 (М+Н)+. Эфир затем гидролизуют 5,0 н. NaOH в метаноле при 60C в течение 4 ч. Подкисляют концентрированной HCl, экстрагируют EtOAc, органический слой сушат (MgSO4) и концентрируют с получением указанной в заголовке кислоты. MC (ESI) m/z 509 (М+Н)+. Другие представители данного семейства можно получить таким же самым способом с использованием соответствующего алкилиодида. Схема 2 К смеси 54 мг (0,13 ммоль) этилового эфира 2-метил-3-4-[2-(3-метил-2-оксоимидазолидин-4 ил)этокси]фенил-2-феноксипропионовой кислоты в 2 мл сухого ДМФА при 0C в атмосфере азота добавляют 10 мг NaH (0,253 ммоль). Полученный раствор выдерживают при комнатной температуре в течение 20 мин. Затем добавляют 0,26 ммоль соответствующего арилгалогенида и полученную смесь выдерживают при комнатной температуре в течение 3 ч. Реакционную смесь разбавляют этилацетатом и 1 н.HCl. Органический слой затем промывают 1 н. HCl (2x10 мл) , насыщенным раствором соли (2x10 мл),сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученные сложные эфиры очищают флэшхроматографией, после чего они могут быть использованы в качестве исходных веществ в последующих реакциях сочетания или гидролизованы до конечных соединений. Для гидролиза сложный эфир растворяют в 2 мл MeOH и 0,3 мл 5 н. NaOH и смесь нагревают до 50C в течение 2 ч. Затем удаляют органический растворитель и остаток растворяют в CH2Cl2 и 1 н. HCl. Водный слой промывают CH2Cl2 (2x10 мл).- 15007163 Объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенное вещество очищают МС/ЖХ или флэш-хроматографией с получением конечных продуктов. Общий пример С. Связывание по Сузуки. К арилбромиду (или хлориду) (0,07 ммоль) в 1,4-диоксане (2 мл) в продутой N2 герметически закупоренной пробирке добавляют арилбороновую кислоту (0,12 ммоль), фторид цезия (0,18 ммоль) и тетракис(трифенилфосфин)Pd(0) (0,007 ммоль). Реакционную смесь перемешивают при 110C в течение 2 ч. Охлаждают, разбавляют EtOAc и гасят водой. Органический слой сушат (MgSO4) , фильтруют и концентрируют. Остаток гидролизуют 5,0 н. NaOH в метаноле при 60C в течение 2 ч. Подкисляют, экстрагируют EtOAc, неочищенную кислоту хроматографируют (силикагель; EtOAc/MeOH, 10:0-10:1). Общий пример D. Связывание по Бухвальду. Общая методика Фенилбромид (0,04 г, 0,067 ммоль), фенол (12 мг, 0,13 ммоль), Cs2CO3 (33 мг, 0,1 ммоль),(CuOTf)2PhH (2 мг), этилацетат (0,0033 ммоль, 5,0 мол.%) и толуол вводят в герметически закупоренную пробирку, продутую азотом. Смесь нагревают до 100C, пока не израсходуется фенилбромид, что определяют методом ЖХ-МС. Смесь охлаждают, разбавляют этилацетатом и промывают водой. Органический слой сушат (MgSO4), концентрируют и получают неочищенный продукт. Неочищенный сложный эфир затем гидролизуют 5,0 н. NaOH в MeOH при 60C в течение 2 ч. Подкисляют, экстрагируют этилацетатом, органический слой сушат (MgSO4), концентрируют и хроматографируют (силикагель;(3,4 г, 8,0 ммоль) и Cs2CO3 (3,6 г, 11 ммоль) смешивают в 10 мл ДМФА и нагревают при 55C в течение 18 ч. После охлаждения смесь разбавляют 100 мл воды и экстрагируют 3x20 мл этилацетата. Органику сушат, концентрируют и остаток очищают флэш-хроматографией с использованием смеси этилацетат/гексаны (7/3), получая 3,0 г (86%) указанного в заголовке соединения в виде масла. 1H ЯМР. Общий пример E. Метиловый эфир 3-4-[2-(1-замещенный бензил-3-метил-2-оксоимидазолидин-4 ил)этокси]фенил-2-изопропоксипропионовой кислоты. Получают, как в общем примере В, используя метиловый эфир 2-изопропокси-3-4-[2-(3-метил-2 оксоимидазолидин-4-ил)этокси]фенилпропионовой кислоты и соответствующий бензилгалогенид. Полученные сложные эфиры очищают флэш-хроматографией, после чего они могут быть использованы в качестве исходных веществ в последующих реакциях связывания или гидролизованы до конечных соединений. Для гидролиза сложный эфир растворяют в 2 мл MeOH и 0,3 мл 5 н. NaOH и смесь нагревают до 50C в течение 2 ч. Затем удаляют органический растворитель и остаток растворяют в CH2Cl2 и 1 н.HCl. Водный слой промывают CH2Cl2 (2x10 мл). Органические слои объединяют, сушат над Na2SO4,фильтруют и концентрируют в вакууме. Неочищенное вещество очищают МС/ЖХ или флэшхроматографией с получением конечных продуктов. Общий пример F. 3-4-[2-(1-Замещенный бифенил-4-илметил-3-метил-2-оксоимидазолидин-4 ил)этокси]фенил-2-изопропоксипропионовая кислота. Получают, как в общем примере С, связывая метиловый эфир 3-(4-2-[1-(4-бромбензил)-3-метил-2 оксоимидазолидин-4-ил]этоксифенил)-2-изопропоксипропионовой кислоты и соответствующую бороновую кислоту, с последующим гидролизом полученного продукта до карбоновой кислоты. Приведенные в данном описании примеры иллюстрируют настоящее изобретение и не должны рассматриваться как каким-то образом ограничивающие объем изобретения. Экспериментальная часть Инструментальный анализ Инфракрасные спектры снимали на спектрометре Perkin Elmer 781. 1H ЯМР-спектры снимали на спектрометре Varian (400 МГц) при температуре окружающей среды. Представлены следующие данные: химический сдвиг в м.д. относительно внутреннего стандарта тетраметилсилана на шкале , мультиплетность (ш=широкий, с=синглет, д=дублет, т=триплет, кв=квартет, квн=квинтет и м=мультиплет), интеграция, постоянная взаимодействия (Гц) и отнесение. 13C ЯМР-спектры снимали на спектрометре Varian(400 МГц) при температуре окружающей среды. Представлены химические сдвиги в м.д. относительно тетраметилсилана на шкалес использованием резонанса растворителя в качестве внутреннего стандарта (CDCl3 при 77,0 м.д. и ДМСО-d6 при 39,5 м.д.). Анализы сжиганием были выполнены на фирме EliLilly and Company Microanalytical Laboratory. Масс-спектры высокого разрешения были получены на спектрометрах VG ZAB 3F или VG 70 SE. Аналитическую тонкослойную хроматографию выполняли на пластинах EM Reagent со слоем силикагеля 60-F толщиной 0,25 мм. Визуализацию осуществляли УФсветом. Получения Получение 1. Получение 2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этилового эфира толуол-4-сульфоновой кислоты. Стадия А. Метиловый эфир (2,5-диоксоимидазолидин-4-ил)уксусной кислоты. 5-Гидантоинуксусную кислоту (20,57 г, 0,130 моль) в MeOH (210 мл) обрабатывали концентрированной H2SO4 (7 мл) и кипятили с обратным холодильником в атмосфере N2 в течение 2,5 ч. Полученный прозрачный раствор охлаждали и растворитель удаляли в вакууме с получением масла, которое разбавляли водой (65 мл) и экстрагировали 4 раза EtOAc. Органический слой сушили (MgSO4) и растворитель удаляли в вакууме с получением 19,81 г (88%) метилового эфира (2,5-диоксоимидазолидин-4-ил) уксусной кислоты. Масс-спектрометрия: (ES+) вычислено для C6H6N2O4 (М+1) 173. Найдено m/z 173 (100%). Раствор метилового эфира (2,5-диоксоимидазолидин-4-ил)уксусной кислоты (26,6 г, 0,155 моль) в ДМФА (500 мл) обрабатывали 4-метоксибензилхлоридом (26,6 г, 0,170 моль), MgSO4 (18,6 г, 0,154 моль) и затем 325 меш K2CO3 (42,71 г, 0,309 моль) при 0C. Полученную смесь нагревали до комнатной температуры в атмосфере N2 и затем нагревали при 45C в течение 4 ч. Реакционную смесь фильтровали и затем к фильтрату добавляли водный 2 н. раствор HCl (200 мл). Фильтрат экстрагировали EtOAc и органический слой сушили (MgSO4). Удаляли в вакууме растворитель с получением 11,43 г неочищенного продукта, который очищали флэш-хроматографией, используя градиент 3:1-1:1 смеси гексан-ацетон, получая 9,81 г (22%) метилового эфира [1-(4-метоксибензил)-2,5-диоксоимидазолидин-4-ил]уксусной кислоты. Масс-спектрометрия: (ES+) вычислено для C14H17N2O5 (М+1) 293. Найдено m/z 293 (100%). 1H ЯМР. Стадия С. Метиловый эфир [1-(4-метоксибензил)-3-метил-2,5-диоксоимидазолидин-4-ил]уксусной кислоты. Раствор при 0C метилового эфира [1-(4-метоксибензил)-2,5-диоксоимидазолидин-4-ил]уксусной кислоты (9,84 г, 33,7 ммоль) в ДМФА (30 мл) обрабатывали гидридом натрия (60% дисперсия, 1,37 г,34,3 ммоль), нагревали до комнатной температуры и перемешивали в атмосфере N2 в течение 20 мин. Полученную смесь охлаждали до 0C, затем обрабатывали метилиодидом (6,16 г, 43,4 ммоль) и затем нагревали до комнатной температуры и перемешивали в течение 16 ч. Реакционную смесь гасили водной 1 н. HCl (60 мл) и затем экстрагировали EtOAc и водой. Органический слой сушили (MgSO4) и удаляли в вакууме растворитель с получением неочищенного продукта, который очищали флэш-хроматографией,используя смесь гексан-ацетон (3:1), с получением 7,46 г (85%) метилового эфира [1-(4-метоксибензил)3-метил-2,5-диоксоимидазолидин-4-ил]уксусной кислоты. Масс-спектрометрия: (ES+) вычислено для Раствор метилового эфира [1-(4-метоксибензил)-3-метил-2,5-диоксоимидазолидин-4-ил]уксусной кислоты (7,45 г, 24,3 ммоль) в метаноле (100 мл) обрабатывали водным 5 н. раствором NaOH (49 мл) и кипятили с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и удаляли в вакууме растворитель. Полученный остаток подкисляли водным 1 н. раствором HCl (300 мл) и экстрагировали этилацетатом и водой. Органический слой сушили (MgSO4) и удаляли в вакууме растворитель с получением 7,73 г (100%) кислоты, которую использовали без очистки. Раствор неочищенной кислоты (7,73 г,примерно 24,3 ммоль) в ТГФ (100 мл) обрабатывали, добавляя по каплям 1M раствор комплекса боранТГФ в ТГФ (146 мл, 0,145 моль), и затем перемешивали при комнатной температуре в атмосфере N2 в течение 16 ч. Реакционную смесь гасили метанолом (100 мл) и перемешивали при комнатной температуре в течение 1 ч. Удаляли в вакууме растворитель с получением неочищенного продукта, который очищали флэш-хроматографией, используя смесь гексан-ацетон (2:1), с получением 4,76 г (74%) 4-(2 гидроксиэтил)-1-(4-метоксибензил)-3-метилимидазолидин-2-она. Масс-спектрометрия: (ES+) вычислено для C14H21N2O3 (М+1) 265. Найдено m/z 265 (100%). 1H ЯМР. Стадия E. 2-[1-(4-Метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этиловый эфир толуол-4 сульфоновой кислоты. Раствор 4-(2-гидроксиэтил)-1-(4-метоксибензил)-3-метилимидазолидин-2-она (4,75 г, 18,0 ммоль),пиридина (4,98 г, 62,9 ммоль) и 4-диметиламинопиридина (0,66 г, 5,40 ммоль) в CH2Cl2 (200 мл) обрабатывали п-толуолсульфоновым ангидридом (9,38 г, 28,7 ммоль) и реакционную смесь перемешивали при комнатной температуре в атмосфере N2 в течение 1,5 ч. Реакционную смесь промывали водным 1 н. раствором HCl (140 мл), органический слой сушили (MgSO4) и растворитель удаляли в вакууме с получением неочищенного продукта, который очищали флэш-хроматографией, используя смесь гексан-ацетон(3:1), с получением 6,93 г (92%) 2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этилового эфира толуол-4-сульфоновой кислоты. Масс-спектрометрия: (ES+) вычислено для C21H27N2O5S (М+1) 419. Найдено m/z 419 (100%). 1H ЯМР. Примеры соединений Пример 1. 2-(4-2-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-2-метилфенокси)-2-метилпропионовая кислота.(0,093 г, 0,287 ммоль). После нагревания при 65C в течение примерно 16 ч, реакционную смесь распределяли между этилацетатом (5 мл) и 1,0 н. водным раствором HCl (5 мл) и водный слой экстрагировали этилацетатом (2x5 мл). Объединенный органический слой промывали насыщенным раствором соли (3x5 мл) . Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Хроматография на силикагеле (0-40% ацетон/гексан) давала бесцветное масло (0,107 г, 91%). Масс-спектрометрия: Этиловый эфир 2-(4-2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-2-метилфенокси)-2-метилпропионовой кислоты (0,105 г, 0,217 ммоль) обрабатывали триэтилсиланом (0,064 г,0,743 ммоль) в TFA (8,0 мл) при комнатной температуре в течение примерно 6 ч. После выпаривания растворителя остаток очищали, используя силикагель (0-50% ацетон/гексан). Бесцветное масло (0,041 г,51%). Масс-спектрометрия: [EI+] 365 (М+Н)+, 729 (2 М+Н)+. Стадия С. 2-(4-2-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-2-метилфенокси)-2-метилпропионовая кислота. К раствору этилового эфира 2-метил-2-2-метил-4-[2-(3-метил-2-оксоимидазолидин-4-ил)этокси] феноксипропионовой кислоты (0,040 г, 0,110 ммоль) в ДМФА (2,0 мл) добавляли гидрид натрия (60% в минеральном масле, 0,0066 г, 0,165 ммоль) одной порцией. Смесь перемешивали 15 мин при комнатной температуре, затем добавляли 4-трет-бутилбензилбромид (0,030 мл, 0,165 ммоль). После перемешивания при комнатной температуре в течение 4 ч реакционную смесь распределяли между этилацетатом (5 мл) и- 19007163 насыщенным водным раствором NH4Cl (5 мл) и водный слой еще экстрагировали этилацетатом (3x5 мл) . Объединенный органический слой промывали насыщенным раствором соли (3x5 мл), сушили надNa2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали на силикагеле (040% ацетон/гексан). Полученный этиловый эфир обрабатывали смесью MeOH (2 мл)/5,0 н NaOH (1 мл) при комнатной температуре в течение ночи и затем концентрировали. Полученный остаток разбавляли водой (2 мл), охлаждали до 0C, подкисляли до рН=2 добавлением по каплям концентрированной HCl. Водную суспензию загружали в колонку Chem elut 1005 и элюировали, используя DCM (50 мл) . Выпаривание метиленхлорида давало указанное в заголовке соединение в виде бесцветного масла (0,022 г,42%). Масс-спектрометрия: [EI+] 483 (М+Н)+, [EI-] 481 (M-H)-. Пример 2. 2-(4-2-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-3-пропилфенокси)-2-метилпропионовая кислота. Стадия А. Этиловый эфир 2-(4-2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этокси 3-пропилфенокси)-2-метилпропионовой кислоты. Указанное в заголовке соединение получали по методике примера 1, стадия А, используя 2-[1-(4 метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этиловый эфир толуол-4-сульфоновой кислоты (0,200 г, 0,478 ммоль) и этиловый эфир 2-(4-гидрокси-3-пропилфенокси)-2-метилпропионовой кислоты (0,140 г,0,526 ммоль), что давало бесцветное масло (0,122 г, 50%). Масс-спектрометрия: [EI+] 513 (М+Н)+. Стадия В. Этиловый эфир 2-метил-2-4-[2-(3-метил-2-оксоимидазолидин-4-ил)этокси]-3-пропилфеноксипропионовой кислоты. Указанное в заголовке соединение получали по методике примера 1, стадия В, используя этиловый эфир 2-(4-2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-3-пропилфенокси)-2-метилпропионовой кислоты (0,120 г, 0,234 ммоль), что давало бесцветное масло (0,054 г, 57%). Массспектрометрия: [EI+] 393 (М+Н)+, 785 (2 М+Н)+. Стадия С. 2-(4-2-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]этокси-3-пропилфенокси)-2-метилпропионовая кислота. Указанное в заголовке соединение получали по методике примера 1, стадия С, используя этиловый эфир 2-метил-2-4-[2-(3-метил-2-оксоимидазолидин-4-ил)этокси]-3-пропилфеноксипропионовой кислоты (0,054 г, 0,138 ммоль), что давало бесцветное масло (0,051 г, 72%). Масс-спектрометрия: [EI+] 511(0,630 г, 1,60 ммоль) в этаноле (15 мл) добавляли иод (0,810 г, 3,20 ммоль) и затем сульфат серебра (0,998 г, 3,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Осадок удаляли фильтрованием и раствор концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель, градиентное элюирование 0-20% ацетоном в гексане) с получением белого пенистого твердого вещества (0,584 г, 70%). Масс-спектрометрия: [EI+] 521 (М+Н)+. Стадия В. 1-(4-трет-Бутилбензил)-4-[3-(4-метокси-3-метилфенил)пропил]-3-метилимидазолидин-2 он. 1-(4-трет-Бутилбензил)-4-[3-(3-иод-4-метоксифенил)пропил]-3-метилимидазолидин-2-он (0,300 г,0,580 ммоль), метилбороновую кислоту (0,069 г, 1,16 ммоль) и карбонат цезия (0,264 г, 1,7 4 ммоль) смешивали в диоксане (6,0 мл). После барботирования азотом в течение 15 мин добавляли хлорид 1,1'бис(дифенилфосфино)ферроценпалладия(II) (0,060 г, 0,015 ммоль). Реакционную смесь нагревали при 80C в течение 4 ч. Удаляли на роторном испарителе растворитель и неочищенный продукт очищали колоночной хроматографией (силикагель, градиентное элюирование 0-20% ацетоном в гексане) с получением желтого масла (0,153 г, 65%). Масс-спектрометрия: [EI+] 409 (М+Н)+, 817 (М+Н)+. Стадия С. 1-(4-трет-Бутилбензил)-4-[3-(4-гидрокси-3-метилфенил)пропил]-3-метилимидазолидин-2 он. К раствору 1-(4-трет-бутилбензил)-4-[3-(4-метокси-3-метилфенил)пропил]-3-метилимидазолидин-2 она (0,250 г, 0,612 ммоль) в DCM (2,0 мл) при -78 С добавляли по каплям раствор BBr3 (0,230 мл, 2,44 ммоль) в метиленхлориде (2,0 мл). Реакционную смесь держали 30 мин при примерно -78C, затем нагревали до 0 С и перемешивали в течение часа. Затем ее гасили добавлением смеси (1:1) MeOH/DCM (20 мл) и перемешивали еще час при 0C. Реакционную смесь распределяли между DCM (25 мл) и водой (25 мл), органический слой отделяли, промывали насыщенным раствором соли (3x25 мл), сушили надNa2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель, градиентное элюирование 0-20% ацетоном в гексане) с получением желтого масла (0,126 г, 53%). Масс-спектрометрия: [EI + ] 395 (М+Н)+, 789 (М+Н)+, [EI-] 509 (M-H)-. Стадия D. Этиловый эфир 2-(4-3-[1-(4-трет-бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]пропил-2-метилфенокси)-2-метилпропионовой кислоты. 1-(4-трет-Бутилбензил)-4-[3-(4-гидрокси-3-метилфенил)пропил]-3-метилимидазолидин-2-он (0,060 г, 0,152 ммоль) растворяли в ДМФА (1,5 мл) и к раствору добавляли этил 2-бромизобутират (0,141 г, 0,760 ммоль) и затем карбонат калия (0,105 г, 0, 760 ммоль). После нагревания при 50C в течение ночи реакционную смесь разбавляли этилацетатом (2 мл), промывали водой (2 мл), отделенный органический слой пропускали через колонку Chem elut и колонку промывали дополнительным DCM (50 мл). Выпаривание растворителя с последующей хроматографией на силикагеле, (градиентное элюирование 0-40% этилацетатом в гексане) давали масло (0,068 г, 88%). Масс-спектрометрия: [EI+] 510 (М+Н)+. Стадия E. 2-(4-3-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]пропил-2-метилфенокси)-2-метилпропионовая кислота. Этиловый эфир 2-(4-3-[1-(4-трет-бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]пропил-2-метилфенокси)-2-метилпропионовой кислоты (0,065 г, 0,128 ммоль) обрабатывали смесью (3:1) МеОН/5,0 н.NaOH (4 мл) при комнатной температуре в течение ночи и затем концентрировали. Полученный остаток разбавляли водой (2 мл), охлаждали до 0C, подкисляли до рН=2 добавлением по каплям концентрированной HCl. Водную суспензию загружали в колонку Chem elut и элюировали, используя DCM (50 мл). Выпаривание метиленхлорида давало указанное в заголовке соединение в виде масла (0,060 г, 98%). Масс-спектрометрия: [EI+] 481 (М+Н)+, [EI-] 479 (M-H)-. Пример 4. 2-(2-Бутил-4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]пропил фенокси)-2-метилпропионовая кислота. Указанное в заголовке соединение получали по методике примера 3, стадия D, используя 4-[3-(4 гидроксифенил)пропил]-3-метил-1-(4-трифторметилбензил)имидазолидин-2-он (0,445 г, 1,13 ммоль), что давало масло (0,464 г, 85%). Масс-спектрометрия: [EI+] 507 (М+Н)+. Стадия В. Этиловый эфир 2-(2-иод-4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин 4-ил]пропилфенокси) -2-метилпропионовой кислоты. Указанное в заголовке соединение получали по методике примера 3, стадия А, используя этиловый эфир 2-метил-2-(4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]пропилфенокси)-2 метилпропионовой кислоты (0,460 г, 0,960 ммоль), что давало масло (0,273 г, 48%). Масс-спектрометрия: Указанное в заголовке соединение получали по методике примера 3, стадия В, используя этиловый эфир 2-(2-иод-4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]пропилфенокси)-2 метилпропионовой кислоты (0,270 г, 0,430 ммоль) и н-бутилбороновую кислоту (0,218 г, 0,215 ммоль),что давало масло (0,115 г, 48%). Масс-спектрометрия: [EI+] 563 (М+Н)+. Стадия D. 2-(2-Бутил-4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]пропил фенокси)-2-метилпропионовая кислота. Указанное в заголовке соединение получали по методике примера 3, стадия E, используя этиловый эфир 2-(2-бутил-4-3-[3-метил-2-оксо-1-(4-трифторметилбензил)имидазолидин-4-ил]пропилфенокси)-2 метилпропионовой кислоты (0,110 г, 0,196 ммоль), что давало масло (0,029 г, 28%). Масс-спектрометрия:[EI+] 535 (М+Н)+, [EI-] 533 (M-H)-. В следующих примерах указанные в заголовках соединения получали по существу так же, как описано выше. Пример 5. 2-Метил-3-(4-2-[3-метил-2-оксо-1-(3-феноксибензил)имидазолидин-4-ил]этокси фенил)-2-феноксипропионовая кислота. К раствору LDA (1,5 M в циклогексане, 33 мл, 4 9,5 ммоль) в ТГФ (40 мл) при -78C добавляли по каплям раствор этилового эфира 2-(2-фторфенокси)пропионовой кислоты (7,70 г, 36,3 ммоль) в ТГФ (100 мл). После перемешивания в течение 30 мин при -78C в реакционную смесь впрыскивали раствор 4 иодметилфенилового эфира толуол-4-сульфоновой кислоты (12,8 г, 33,0 ммоль). Реакционную смесь перемешивали при -78C в течение одного часа, затем нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь обрабатывали 5,0 н. NaOH (50 мл) в присутствии метанола (200 мл). После выпаривания метанола водный раствор подкисляли концентрированной HCl до рН=1 и экстрагировали этилацетатом (2x300 мл). Объединенные органические слои сушили, фильтровали и концентрировали в вакууме. Остаток растворяли в MeOH (200 мл) и обрабатывали концентрированной серной кислотой (2 мл) при 80C в течение ночи. Реакционную смесь распределяли между этилацетатом (500 мл) и водой (500 мл), органический слой промывали насыщенным раствором соли (3x500 мл), сушили,фильтровали и концентрировали в вакууме. Соединение очищали хроматографией (силикагель, градиентное элюирование 0-20% этилацетатом в гексане) с получением масла (6,02 г, 60%), которое затем разделяли хиральной ВЭЖХ с получением энантиомера в виде масла (2,30 г). Масс-спектрометрия: [EI+] 322 (M+NH4)+, [EI-] 303 (M-H)-. Стадия В Метиловый эфир 2-(2-фторфенокси)-3-(4-2-[1-(4-метоксибензил)-3-метил-2 оксоимидазолидин-4-ил]этоксифенил)-2-метилпропионовой кислоты. Указанное в заголовке соединение получали по методике примера 1, стадия А, используя 2-[1-(4 метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этиловый эфир толуол-4-сульфоновой кислоты (0,888 г, 2,12 ммоль) и метиловый эфир 2-(2-фторфенокси)-3-(4-гидроксифенил)-2-метилпропионовой кислоты(0,645 г, 2,12 ммоль), что давало масло (0,95 г, 81%). Масс-спектрометрия: [EI+] 551 (М+Н)+. Стадия С. 2-(2-Фторфенокси)-3-(4-2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил] этоксифенил)-2-метилпропионовой кислоты. Указанное в заголовке соединение получали по методике примера 3, стадия E, используя метиловый эфир 2-(2-фторфенокси)-3-(4-2-[1-(4-метоксибензил)-3-метил-2-оксоимидазолидин-4-ил]этокси фенил)-2-метилпропионовой кислоты (0,224 г, 0,406 ммоль), что давало белое пенистое твердое вещество Указанное в заголовке соединение получали по существу способами, описанными выше, что давало белое пенистое твердое вещество (0,0858 г, 40%). Масс-спектрометрия: [EI+] 583 (М+Н)+, [EI-] 581 (MH)-. Пример 11. 3-(4-2-[1-(4-трет-Бутилбензил)-3-метил-2-оксоимидазолидин-4-ил]этоксифенил)-2-(2 фторфенокси)-2-метилпропионовая кислота. Указанное в заголовке соединение получали по методике, по существу такой, как описано выше,что давало белое пенистое твердое вещество (0,101 г, 77%). Масс-спектрометрия: [EI+] 563 (М+Н)+, [EI-] 561 (M-H)-. Пример 12. 2-(2-Фторфенокси)-2-метил-3-4-[2-(3-метил-1-нафталин-2-илметил-2-оксоимидазолидин-4-ил)этокси]фенилпропионовая кислота. Указанное в заголовке соединение получали по существу так, как описано выше, с выходом (0,0753 г, 58%) . Масс-спектрометрия: [EI+] 543 (М+Н)+, [EI-] 541 (M-H)-. Пример 13. Метиленхлоридный раствор (300 мл) 4-(4-метоксифенил)бутанола (10,0 г, 0,055 моль) охлаждали до 0C и перемешивали. Медленно добавляли к раствору пиридинийхлорхромата (17,8 г, 0,082 моль) и рас- 24007163 твор перемешивали, помещали под осушительную трубку и нагревали до комнатной температуры в течение ночи. Реакционную смесь фильтровали и фильтрат промывали насыщенным водным раствором соли и затем сушили над сульфатом натрия. Выпаривали растворитель с получением неочищенного продукта в виде масла. Очистка флэш-хроматографией (смесь гексаны-этилацетат) давала требуемый альдегид (6,8 г). C11H14O2 (MW=178,23); 1H ЯМР. Стадия В(100 мл) и воде (100 мл). Добавляли продукт примера 13, стадия А (6,7 г, 0,038 моль) и реакционную смесь перемешивали, нагревая при 45C в течение ночи. Реакционную смесь охлаждали, осадок отфильтровывали и промывали водой. Полученное твердое вещество растворяли в ТГФ и сушили над сульфатом натрия. Выпаривали растворитель с получением твердого вещества, которое промывали смесью этилацетат:гексаны (50:50) и затем сушили на воздухе с получением требуемого гидантоина (16,6 г). К охлажденному (0C) раствору трибромида бора (50 г, 200 ммоль) в CH2Cl2 (50 мл) добавляли раствор метил 4-[4-метоксифенил)бутирата (15,5 г, 74,4 ммоль) в CH2Cl2 (100 мл) по каплям в течение часа. После перемешивания в течение еще одного часа при 0C реакционную смесь обрабатывали смесью (1:1)CH3OH:CH2Cl2 (120 мл) при охлаждении и перемешивании в течение ночи при температуре окружающей среды. Смесь концентрировали с получением масла, которое распределяли между этилацетатом (150 мл) и водой (150 мл). Водный слой экстрагировали этилацетатом (2x50 мл) и объединенные органические экстракты промывали водой (50 мл), насыщенным раствором соли (50 мл), сушили и затем концентрировали с получением требуемого фенола в виде масла. С 11 Н 14 О 3 (MW=194,23); масс-спектроскопия: m/z Фенол со стадии А (18,6 г, 96 ммоль) растворяли в ДМФА (300 мл) и обрабатывали трет-бутил 2 бромизобутиратом (50 мл, 288 ммоль), порошкообразным K2CO3 (53,0 г, 384 ммоль) и MgSO4 (1,6 г, 96 ммоль) и полученную смесь нагревали при 75C в течение ночи. После охлаждения до температуры окружающей среды реакционную смесь декантировали в 1 н. водную HCl (300 мл) и экстрагировали диэтиловым эфиром (3x150 мл). Полученные после декантации твердые частицы промывали несколько раз диэтиловым эфиром. Содержавшие диэтиловый эфир экстракты и промывные воды объединяли, промывали 1 н. водной HCl (150 мл), сушили (Na2SO4) и концентрировали до темного масла. Очистка флэшхроматографией (градиентное элюирование, гексаны-смесь гексаны:этилацетат=95:5) давала требуемый простой эфир в виде масла. С 19 Н 28 О 5 (MW=336,43); масс-спектроскопия: m/z (М 1)=337. Стадия С Сложный диэфир со стадии В (10,7 г, 0,032 моль) растворяли в диоксане (100 мл), затем обрабатывали водным раствором (50 мл) LiOH (1,5 г, 0,063 моль). Полученную смесь перемешивали при комнат- 25007163 ной температуре в течение 2 ч, по истечении которых TCX показывала завершение реакции. Растворитель концентрировали до примерно 10 мл, затем остаток разбавляли водой (200 мл) и промывали эфиром(1x100 мл). Водный экстракт подкисляли 5 н. HCl (25 мл) и экстрагировали этилацетатом (2x150 мл). Объединенные органические экстракты сушили над Na2SO4 и концентрировали с получением требуемой карбоновой кислоты (10,6 г, 99%) . С 18 Н 26 О 5 (MW=332,40); масс-спектроскопия: m/z (M+NH4+)=340,3 Раствор в ТГФ (100 мл) карбоновой кислоты со стадии С (10 г, 0,031 моль) охлаждали до 0C и обрабатывали триэтиламином (5,6 мл, 0,040 моль) и затем этилхлорформиатом (3,8 мл, 0,040 моль). Почти сразу же образовывался густой белый осадок. Реакционную смесь нагревали до комнатной температуры и после перемешивания в течение ночи фильтровали. Фильтрат охлаждали до 0C и обрабатывали борогидридом натрия (3,5 г, 0,092 моль). Добавляли по каплям за 30-40 мин раствор метанола (20 мл) в ТГФ(40 мл), затем полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Снова охлаждали раствор до 0 С и осторожно гасили его добавлением 1 н. HCl (100 мл). Смесь разбавляли водой (400 мл) и экстрагировали CH2Cl2 (2x300 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали. Неочищенное масло очищали флэш-хроматографией (гексаны:этилацет=5:1) с получением требуемого спирта в виде бесцветного масла (8,69 г, 88%). Стадия E Спирт со стадии D (8,7 г, 0,028 моль) растворяли в CH2Cl2 и охлаждали до 0C. К раствору добавляли порциями пиридинийхлорхромат (9,0 г, 0,042 моль) и затем смесь нагревали до комнатной температуры. После перемешивания в течение ночи реакционную смесь фильтровали, используя целит. Фильтрат концентрировали и полученное неочищенное масло очищали хроматографией (гексаны:этилацет=10:1) с получением требуемого альдегида в виде бесцветного масла (4,45 г, 52%). Стадия F Цианид калия (1,1 г, 7,2 ммоль) и карбонат аммония (1,7 г, 18,0 ммоль) смешивали в метаноле (15 мл) и воде (15 мл). Добавляли альдегид со стадии E (1,1 г, 3,6 ммоль) и реакционную смесь перемешивали, нагревая до 50C. Через 3 ч добавляли еще карбонат аммония (1,7 г, 18,0 ммоль) и полученную смесь перемешивали в течение ночи при 50C. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и затем экстрагировали этилацетатом (2 раза). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали. Очистка хроматографией (градиент : гексаны : этилацетат=10:1-3:1-3:2) давала требуемый гидантоин (0,9 г, 66%). Гидантоин примера 14 (1,0 г, 2,66 ммоль) и 4-(трет-бутил)бензилбромид (0,63 мл, 2,93 ммоль) перемешивали в ДМФА (20 мл). Добавляли карбонат калия (порошкообразный, 1,5 г, 10,64 ммоль) и сульфат магния (0,5 г, 4,00 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь осторожно добавляли к 1 н. хлористо-водородной кислоте (50 мл) и полученный раствор экстрагировали дважды этилацетатом. Органические слои объединяли, промывали насыщенным водным раствором соли и затем сушили над сульфатом натрия. Выпаривание растворителя с последующей очисткой флэш-хроматографией (смесь гексаны-этилацетат) давали требуемый продукт (1,05 г). Гидантоин примера 15, стадия А (0,15 г, 0,29 ммоль) перемешивали в этаноле, медленно добавляли борогидрид натрия (0,11 г, 2,90 ммоль) и смесь перемешивали при температуре окружающей среды под осушительной трубкой в течение ночи. Реакционную смесь концентрировали и остаток растворяли в этилацетате, промывали водой и насыщенным водным раствором соли и затем сушили. Выпаривание растворителя с последующей очисткой флэш-хроматографией (смесь гексаны-этилацетат) давали требуемый продукт (0,071 г). Продукт примера 15, стадия В (0,071 г, 0,14 ммоль) перемешивали в метиленхлориде (4 мл) с трифторуксусной кислотой (0,1 мл, 1,3 ммоль) под сушильной трубкой в течение ночи. Выпаривали растворитель и затем остаток очищали флэш-хроматографией (этилацетат-гексаны) с получением требуемого продукта (0,035 г). Продукт получали по методике примера 15, стадия А, используя гидантоин примера 14 (1,0 г, 2,66 ммоль) и 3,4-диметилбензилхлорид (Transworld, 0,42 мл, 2,93 моль). Данную реакционную смесь нагревали до 50C для завершения реакции, получая требуемый продукт (0,550 г). По методике примера 15, стадия В, использовали алкилированный гидантоин примера 16, стадия А По методике примера 15, стадия С, использовали имидазолон со стадии В (0,032 г, 0,066 ммоль) и трифторуксусную кислоту (0,1 мл) с получением требуемого продукта (0,026 г). Указанное в заголовке соединение получали по существу по методике, описанной выше. Указанное в заголовке соединение получали по существу по методике, описанной выше.- 28007163 Гидантоин примера 14 (0,500 г, 0,0013 моль) растворяли в ДМФА и обрабатывали 3,5 дифторбромбензолом (0,189 г, 0,0015 моль) и порошкообразным K2CO3 (0,718 г, 0,0052 моль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь вливали в 1 н.HCl и смешивали с этилацетатом. Органический слой экстрагировали, промывали насыщенным раствором соли и затем сушили и концентрировали. Очистка неочищенного вещества флэш-хроматографией(гексаны:этилацетат=4:1, гексаны:этилацетат=1:1) давала требуемый гидантоин в виде прозрачного масла (0,420 г, 64%). Гидантоин со стадии А (0,410 г, 0,00082 моль) растворяли в метиленхлориде (5 мл), обрабатывали трифторуксусной кислотой (0,315 мл, 0,0041 моль) и перемешивали в течение ночи. Растворитель концентрировали и полученный продукт сушили в вакууме. Кислоту со стадии В (0,428 г, 0,00096 моль) растворяли в этаноле (20 мл) и обрабатывали борогидридом натрия (0,363 г, 0,0096 моль). Через один час добавляли дополнительный борогидрид натрия(0,363 г) и реакционную смесь перемешивали в течение ночи. К реакционной смеси добавляли 5 н. HCl(50 мл) и затем воду (50 мл). Водный раствор экстрагировали этилацетатом (2x50 мл). Органический слой промывали, сушили и концентрировали. Очистка флэш-хроматографией (100% этилацетат) давала требуемую кислоту в виде твердого вещества цвета красного бургундского вина (0,150 г, 36%). Раствор в ДМФА (20 мл) гидантоина примера 14 (455,2 мг, 1,21 ммоль) обрабатывали последовательно бензилбромидом (160 мкл, 1,35 ммоль), K2CO3 (0,44 г, 3,2 ммоль) и MgSO4 (0,48 г, 4,0 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили медленным добавлением 1 н. HCl. Полученную смесь экстрагировали этилацетатом (2x75 мл). Объединенные органические экстракты промывали насыщенным раствором соли, затем сушили над Na2SO4 и концентрировали. Очистка хроматографией (гексаны:этилацетат=2:1) давала требуемый алкилированный гидантоин в виде белого твердого вещества (512,0 мг, 91%).- 29007163 Раствор в CH2Cl2 (15 мл) сложного эфира со стадии А (495,5 мг, 1,06 ммоль) охлаждали до 0C и обрабатывали TFA (2 мл, 26 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Концентрировали растворитель с получением неочищенной кислоты. Удаляли следы TFA концентрированием из толуола (3x15 мл), затем продукт использовали в следующей реакции без дополнительной очистки.C23H26N2O5 (MW=410,47); масс-спектроскопия: (МН+)=411,1, (МН-)=409,2. Стадия С. Гидантоин со стадии В растворяли в этаноле (20 мл) и обрабатывали NaBH4 (400 мг, 10,5 ммоль). Через 3 ч добавляли к реакционной смеси дополнительный NaBH4 (200 мг, 4,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли к реакционной смеси дополнительный NaBH4 (370 мг, 9,7 ммоль) и продолжали перемешивание в течение примерно двух суток. Реакционную смесь гасили осторожным добавлением 5 н. HCl. Смесь перемешивали 30 минут, затем разбавляли водой и экстрагировали этилацетатом. Объединенные органические экстракты промывали, сушили и концентрировали. Очистка хроматографией (градиент: 100% СН 2 Сl2-5% метанол в CH2Cl2) давала требуемый имидазолон в виде стекловидного твердого вещества (93,2 мг, 22% за две стадии).C31H36N2O5 (MW=516,64); масс-спектроскопия: (МН+-трет-бутил)=461,2, (МН-)=515,4. Стадия В. Раствор в CH2Cl2 (15 мл) сложного эфира со стадии А (387,8 мг, 0,751 ммоль) охлаждали до 0C и обрабатывали TFA (2 мл, 26 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Концентрировали растворитель с получением неочищенной кислоты. Удаляли следы TFA концентрированием из толуола (3x15 мл), затем продукт использовали в следующей реакции без дополнительной очистки. Гидантоин со стадии В растворяли в смеси этанол-ТГФ (2:1, 30 мл) и обрабатывали NaBH4 (313 мг,8,2 ммоль) . Через 3 ч добавляли к реакционной смеси дополнительный NaBH4 (180 мг, 4,7 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили осторожным добавлением 5 н. HCl. Смесь перемешивали 30 мин, затем разбавляли водой (75 мл) и экстрагировали этилацетатом (2x75 мл). Объединенные органические экстракты промывали, сушили и концентрировали. Очистка хроматографией (градиент: 100% СН 2 Сl2-5% метанол в CH2Cl2) давала требуемый имидазолон в виде белой пены (109,0 мг, 33% за две стадии).
МПК / Метки
МПК: C07D 405/12, C07D 233/76, A61P 43/00, C07D 233/32, C07D 405/06, C07D 233/70, A61K 31/4166, C07D 401/06, C07D 403/12
Метки: агонисты, рецепторов, пролифератором, пероксисомным, активируемых
Код ссылки
<a href="https://eas.patents.su/30-7163-agonisty-receptorov-aktiviruemyh-peroksisomnym-proliferatorom.html" rel="bookmark" title="База патентов Евразийского Союза">Агонисты рецепторов, активируемых пероксисомным пролифератором</a>
Предыдущий патент: Триазатринафтирины и способ их получения, их соль, комплекс металла, способ и композиция для экстрагирования переходного металла
Следующий патент: Фунгицидные триазолопиримидины, способ их получения и их применение для борьбы с фитопатогенными грибами, а также содержащие их средства
Случайный патент: Частицы, содержащие эритропоэтин, для лечения и профилактики неврологических и гематологических заболеваний и нарушений












