Линейные основные соединения, имеющие антагонистическую активность в отношении nk-2, и их композиции
Номер патента: 7855
Опубликовано: 27.02.2007
Авторы: Джолитти Алессандро, Альтамура Мария, Паскуи Франко, Феди Валентина, Гуиди Антонио, Качальи Валерио, Хармат Николас, Нанничини Россано, Джаннотти Данило, Систо Алессандро, Маджджи Карло Альберто
Формула / Реферат
1. Соединения общей формулы (I)
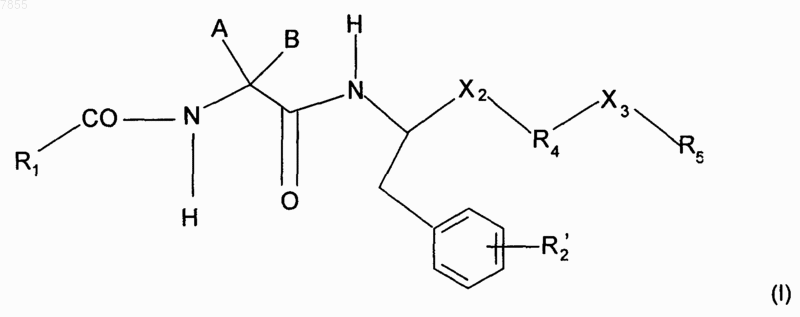
где R1 обозначает ароматическую группу, выбранную из группы, состоящей из бифенила, фенилэтилена, нафтила, фенилтиофена, бензотиофена, бензофурана и индола, необязательно N-замещенного C1-C6алкильной группой, которая может быть необязательно замещена одной, двумя или тремя группами, независимо выбранными из группы, состоящей из галогена, C1-C6алкила, необязательно замещенного не более, чем тремя атомами фтора, C1-C6алкилокси, ОН, NHR10 и N(R10)2, где R10 выбран из Н и С1-С6алкила;
R2' выбран из группы, состоящей из Н или С1-С6алкильной группы;
аминокислотный остаток общей формулы (II)
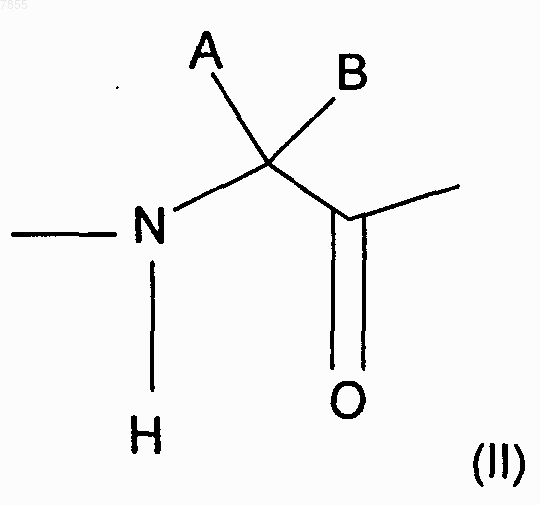
выбран из группы, состоящей из 1-аминоциклогексан-1-карбоновой кислоты (Ас6с), 1-аминоциклопентан-1-карбоновой кислоты (Ас5с), 1-аминоиндан-1-карбоновой кислоты (1-Aic), 1-аминоциклопентан-3-ен-1-карбоновой кислоты (Ас5с), 2-метилфенилаланина и 2-метил-2-этилглицина;
Х2 выбран из -CONH- и -CH2NH-;
группа -R4 - Х3 - R5 включает по меньшей мере одну основную аминогруппу и
R4 выбран из группы, состоящей из группы -(CH2)n-, где n равно 1-3, С5-С8циклоалкиленовой группы, выбранной из циклопентилена и циклогексилена, и алифатического гетероцикла, выбранного из пиперидина, пирролидина и пиперазина, необязательно замещенного одной или двумя C1-C6алкильными группами;
Х3 обозначает связь или группу, выбранную из -СО-, -CH2-, -CH2-CH2- и -NH-CO-;
R5 выбран из группы, состоящей из:
a) алифатического гетероцикла, выбранного из группы, состоящей из пиперидина, пирролидина, морфолина, диазепана, тетрагидропирана и 1,4-диокса-8-азаспиро[4,5]декана, необязательно замещенного одной или двумя группами, выбранными из C1-C6алкила, C1-C6алкилокси, ОН и цианометила;
b) азетидина, замещенного группой (CH2)n-R17, где R17 обозначает тетрагидропиран;
c) пиперидина, необязательно С-замещенного C1-C6алкильной группой и замещенного группой X5-R18, где Х5 обозначает связь или выбран из группы, состоящей из -C(R11)(R12)-, -СО-, CH2CH2- и -СОCH2-; a R18 выбран из группы, состоящей из тиофена, тетрагидропирана, тетрагидротиопирана, пирролидина, циклогексана, циклопентана, 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из C1-C6алкила, -NHR10, -NH(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1-C6алкила;
d) пиперазина, необязательно С-замещенного одной или двумя С1-С6алкильными группами и необязательно N-замещенного группой, выбранной из CH2CN и X4-R16, где Х4 обозначает связь или выбран из -CH2- и -СОCH2-, a R16 выбран из группы, состоящей из пиридина, тиофена, тетрагидропирана, морфолина, тетрагидрофурана и 1,3-диоксана;
e) аминогруппы, выбранной из NR11R12, -NH(CH2)m-NR11R12, где R11, R12 и m имеют определенные выше значения;
f) аминоциклогексана или циклогексана, необязательно замещенного на кольце группой -NR11R12, где R11 и R12 имеют определенные выше значения;
g) гетероароматического радикала, представленного пиридином.
2. Соединения общей формулы (I) по п.1, где
R1 обозначает ароматическую группу, выбранную из группы, состоящей из фенилэтилена, нафтила, бензотиофена, необязательно замещенного одной, двумя или тремя группами, независимо выбранными из галогена, C1-C6алкила, необязательно замещенного не более, чем тремя атомами фтора, C1-C6алкилокси, ОН, NHR10 и N(R10)2, где R10 выбран из Н и C1-C6алкила;
R2' обозначает Н;
аминокислотный остаток общей формулы (II) выбран из 1-аминоциклогексан-1-карбоновой кислоты (Ас6с) и 1-аминоциклопентан-1-карбоновой кислоты (Ас5с);
Х2 обозначает -CONH-;
группа -R4 - Х3 - R5 включает по меньшей мере одну основную аминогруппу и
R4 выбран из -(CH2)n-, где n равно 1-3, и пиперидина, необязательно замещенного C1-C6алкильной группой;
Х3 обозначает связь или он является группой, выбранной из -СО- и -CH2-;
R5 выбран из:
а) алифатического гетероцикла, выбранного из пиперидина и тетрагидропирана, необязательно замещенного одной или несколькими C1-С6алкильными группами;
b) пиперидина, необязательно С-замещенного С1-С6алкильной группой, замещенной группой X5-R18, где Х5 обозначает связь или он является группой, выбранной из -C(R11)(R12)- и -СО-, a R18 является группой, выбранной из тетрагидропирана, циклогексана и 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из C1-C6алкила, -NHR10 и -N(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1-C6алкила;
c) пиперазина, необязательно С-замещенного одной или двумя С1-С6алкильными группами и необязательно N-замещенного группой X4-R16, где X4 обозначает -CH2-, a R16 выбран из тетрагидропирана и 1,3-диоксана.
3. Соединения общей формулы (I) по п.1, где указанные соединения определяются следующими формулами:
1) N-[3-(морфолин-4-ил)пропил]амид Na[Na(бензо[b]тиофенил-2-илкарбонил)-1-аминоциклопентан-1-карбонил]-D-фенилаланина,
2) N-[(1S,2S)-2-аминоциклогексил]амид (1R,3S)-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-3-аминоциклопентан-1-карбоновой кислоты,
3) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(бифен-4-илкарбокси)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
4) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(N-(метил)индол-2-илкарбокси)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
5) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(4-(метил)циннамоил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
6) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(бензофуран-2-илкарбокси)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
7) N-[(1S,3R)-3-(морфолин-4-илметил)циклопентил]амид Na[Na(4-(метил)циннамоил)-(R,S)1-аминоиндан-1-карбокси]-D-фенилаланина,
8) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-амииноциклопентан-1-карбоновой кислоты,
9) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-4-метилфенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
10) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(4-метилциннамоил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
11) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(бензофуран-2-илкарбокси)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
12) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(бифен-4-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
13) Гидрохлоридная соль N-((1S,2S)-2-диметиламиноциклогексил)амида Ng{Na[Na(N-(метил)индол-2-илкарбокси)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
14) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-(R)-a-метил-a-этилглицил]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
15) Трифторацетатная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(4-метилциннамоил)-(R)-a-метил-a-этилглицил]-D-фенилаланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
16) Гидрохлоридная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(бифенил-4-карбокси)-1-аминоциклопентан-1-карбокси]-R-3-(4-(метил)фенил)аланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
17) Гидрохлоридная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(N-(метил)индол-2-илкарбокси)-1-аминоциклопентан-1-карбокси]-R-3-(4-метил)фенил)аланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
18) Гидрохлоридная соль N-((1S,2S)-2-аминоциклогексил)амида Ng{Na[Na(4-(метил)циннамоил)-1-аминоциклопентан-1-карбокси]-R-3-[(4-метил)фенил]аланил}-(1R,3S)-3-аминоциклопентан-1-карбоновой кислоты,
19) N-{3-[бис(н-бутил)амино]пропил}амид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланина,
20) N-[3-(морфолин-4-ил)пропил]амид Na[Na(бензо[b]тиофенил-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланина,
21) N-((1R,2S)-2-аминоциклогексил)амид 3-цис-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
22) Трифторацетатная соль N-(5-аминопентил)амида Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}-3-цис-аминоциклогексан-1-карбоновой кислоты,
23) N-[3-(морфолин-4-ил)пропил]амид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-(R)-аминоиндан-1-карбокси]-D-фенилаланина,
24) N-[3-(морфолин-4-ил)пропил]амид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-L-фенилаланина,
25) N-(1S,2R)-2-аминоциклогексил)амид (1R,3S)-3-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}аминоциклопентан-1-карбоновой кислоты,
26) N-(2-цис-аминоциклогексил)амид 3-цис-1Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-L-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
27) N-(1R,2R)аминоциклогексил)амид Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}-(L-(4R)аминопролина,
28) N-[(1S,2S)-2-аминоциклогексил]амид 3-цис-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
29) N-[(1S,2R)-2-диметиламиноциклогексил]амид 3-цис-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
30) N-(1S,2R)-2-аминоциклогексил)амид 3-цис-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
31) N-(1S,2S)-2-аминоциклогексил)амид 3-цис-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
32) N-[(1S,3R)-3-(4-(метил)пиперазин-1-ил)метил)циклопентил]амид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланина,
33) N-[(1S,3R)-3-(4-(метил)пиперазин-1-ил)карбонил)циклопентанамид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланина,
34) N-[3-(морфолин-4-ил)пропил]амид Na[Na(бензо[b]тиофен-2-илкарбонил)-D-a-метилфенилаланил]-D-фенилаланина,
35) N-((1R,2S)-2-метиламиноциклогексил)амид 3-цис-NaNa(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
36) N-(2-цис-аминоциклогексил)амид Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил-L-(4R)аминопролина,
37) N-(2-цис-аминоциклогексил)амид (1R,3S)-3-Ng{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}аминоциклопентан-1-карбоновой кислоты,
38) (1S,3R)-1-N{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}-3-{[1S-((2S)-аминоциклогексил)амино]метил}аминоциклопентан,
39) N-((1R,2S)-2-диметиламиноциклогексил)амид 3-цис-N{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил}аминоциклогексан-1-карбоновой кислоты,
40) N-((1R,2R)-2-аминоциклогексил)амид (1R,3S)-3-N{Na[Na(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбокси]-D-фенилаланил}аминоциклопентан-1-карбоновой кислоты,
41) {1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентил}амид бифенил-4-карбоновой кислоты,
42) {1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентил}амид бензофуран-2-карбоновой кислоты,
43) Метил-{1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклогексил}амид бензо[b]тиофен-2-карбоновой кислоты,
44) [1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтил]амид 1-{3-(3,4-дихлорфенил)акрилоиламино}циклопентанкарбоновой кислоты,
45) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопент-3-енил}амид бензо[b]тиофен-2-карбоновой кислоты,
46) {1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентил}амид 1-метил-1H-индол-2-карбоновой кислоты,
47) (1-{1-[3-(2,6-диметилморфолин-4-ил)пропилкарбамоил]-2-(R)-фенилэтилкарбамоил}циклогексил)амид бензо[b]тиофен-2-карбоновой кислоты,
48) {1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентил}амид 1Н-индол-2-карбоновой кислоты,
49) [1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтил]амид 1-[3-(3,4-дибромфенил)акрилоиламино]циклопентанкарбоновой кислоты,
50) {1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентил}амид 5-фенилтиофен-2-карбоновой кислоты,
51) ТФУ-соль (1-{1(R)-[3-(4-метил[1,4]диазепан-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
52) ТФУ-соль (1-{1(R)-[3-(4-метоксипиперидин-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
53) (1-{1(R)-[3-(4-гидроксипиперидин-1-ил)пропиларбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
54) ТФУ-соль (1-{1(R)-[3-(1,4-диокса-8-азаспиро[4,5]дец-8-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
55) ТФУ-соль (1-{1(R)-[3-(3,5-цис-диметилпиперазин-1-ил)-3-оксопропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
56) (1-{1(R)-[3-оксо-3-(4-пиридин-2-илпиперазин-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
57) ТФУ-соль (1-{1(R)-[3-оксо-3-(4-пиридин-2-илпиперазин-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида 6-бромнафталин-2-карбоновой кислоты,
58) (1-{1(R)-[3-оксо-3-(4-пиридин-2-илпиперазин-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амид 6-бромбензо[b]тиофен-2-карбоновой кислоты,
59) ТФУ-соль [1-(1(R)-{3-оксо-3-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]пропилкарбамоил}-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
60) ТФУ-соль [1-(1(R)-{3-оксо-3-[4-(тетрагидропиран-4-ил)пиперазин-1-ил]пропилкарбамоил}-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
61) ТФУ-соль (1-{1(R)-[3-(4-[1,3]диоксан-5-илметилпиперазин-1-ил)-3-оксопропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
62) [1-(1(R)-{[1-аминоциклопентанкарбонил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
63) ТФУ-соль [1-(1(R)-{3-оксо-3-[4-(тетрагидрофуран-2(R)-илметил)пиперазин-1-ил]пропилкарбамоил}-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
64) (1-{1(R)-[3-(4-цианометилпиперазин-1-ил)-3-оксопропилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
65) ТФУ-соль {1-[2-фенил-1(R)-(1-пиридин-2-илметилпиперидин-4-илкарбамоил)-этилкарбамоил]-циклопентил}амид бензо[b]тиофен-2-карбоновой кислоты,
66) ТФУ-соль [1-(2-фенил-(1(R)-{1-[2-(тетрагидропиран-4-ил)этил]пиперидин-4-илкарбамоил}этилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
67) (1-{1(R)-[(1-этилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид 6-бромнафталин-2-карбоновой кислоты,
68) [1-(2-фенил-(1(R)-({1-[2-(тетрагидропиран-4-ил)этил]пиперидин-4-илметил}карбамоил)этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
69) (1-{1(R)-[(1-циклогексилметилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
70) ТФУ-соль [1-(2-фенил-1(R)-{[1-(тетрагидротиопиран-4-ил)пиперидин-4-илметил]карбамоил}этилкарбамоил)-циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
71) [1-(2-фенил-1(R)-{[1-(тетрагидротиопиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)-циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
72) ТФУ-соль {2-фенил-1(R)-[(1-тиофен-2-илметилпиперидин-4-илметил)карбамоил]этил}амид 1-((Е)-3-пара-толилакрилоиламино)циклопентанкарбоновой кислоты,
73) ТФУ-соль (1-{2-фенил)-(1R)-[2-(1-пирролидин-2(S)-илметилпиперидин-4-ил)этилкарбамоил]этилкарбамоил}циклопентил)амида 6-бромнафталин-2-карбоновой кислоты,
74) (1-{2-фенил)-(1R)-[(пиперидин-4-илметил)карбамоил]этилкарбамоил}циклопентил)амид 6-бромнафталин-2-карбоновой кислоты,
75) (2-фенил-(1R)-{2-[(1-тетрагидропиран-4-илметил)пиперидин-4-ил]этилкарбамоил}этил)амида 1-(3-пара-толилакрилоиламино)циклопентанкарбоновой кислоты,
76) ТФУ-соль (1-{(1R)-[2-(1-цианометилпиперидин-4-ил)этилкарбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
77) ТФУ-соль (1-{(1R)-[(1-[1,3]диоксан-5-илметилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
78) (1-{(1R)-[(1-[1,3]диоксан-2-илметилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
79) [1-(2-фенил-(1R)-{[(1-тетрагидропиран-4-ил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-хлорбензофуран-2-карбоновой кислоты,
80) [1-(2-фенил-(1R)-{[(1-тетрагидротиопиран-4-ил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-хлорбензофуран-2-карбоновой кислоты,
81) ТФУ-соль [1-(1(R)-бензил-2-{2-[1-(тиофен-2-илацетил)пиперидин-4-ил]этиламино}этилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
82) ТФУ-соль [1-(1(R)-{[(1-аминоциклогексанкарбонил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
83) [1-(2-фенил-1(R)-{2-[1-(пирролидин-2(S)-карбонил)пиперидин-4-ил]этилкарбамоил}этилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
84) [1-(2-фенил-1(R)-{2-[1-(пирролидин-2(R)карбонил)пиперидин-4-ил]этилкарбамоил}этилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
85) [1-(2-фенил-1(R)-{2-[4-(тиофен-2-илацетил)пиперазин-1-ил]этилкарбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
86) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 5-хлорбензофуран-2-карбоновой кислоты,
87) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 5-хлорбензо[b]тиофен-2-карбоновой кислоты,
88) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 5-бромбензофуран-2-карбоновой кислоты,
89) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6-хлорбензо[b]тиофен-2-карбоновой кислоты,
90) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6-метоксибензо[b]тиофен-2-карбоновой кислоты,
91) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 4-хлорбензо[b]тиофен-2-карбоновой кислоты,
92) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6-бромбензо[b]тиофен-2-карбоновой кислоты,
93) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклогексил}амид 6-бромбензо[b]тиофен-2-карбоновой кислоты,
94) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 5-фтор-1-метил-1Н-индол-2-карбоновой кислоты,
95) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6-хлор-1-метил-1H-индол-2-карбоновой кислоты,
96) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 7-метилбензо[b]тиофен-2-карбоновой кислоты,
97) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 5-метилбензофуран-2-карбоновой кислоты,
98) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 1,5-диметил-1H-индол-2-карбоновой кислоты,
99) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6-аминобензо[b]тиофен-2-карбоновой кислоты,
100) {1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентил}амид 6,7-дихлорбензо[b]тиофен-2-карбоновой кислоты,
101) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-трет-бутилбензофуран-2-карбоновой кислоты,
102) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-иодбензо[b]тиофен-2-карбоновой кислоты,
103) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-бромбензо[b]тиофен-2-карбоновой кислоты,
104) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-иодбензо[b]тиофен-2-карбоновой кислоты,
105) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-метилбензо[b]тиофен-2-карбоновой кислоты,
106) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-трифторметилбензо[b]тиофен-2-карбоновой кислоты,
107) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-хлорбензо[b]тиофен-2-карбоновой кислоты,
108) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид бензофуран-2-карбоновой кислоты,
109) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 1-метил-1H-индол-2-карбоновой кислоты,
110) [1R-(2-фенил-1-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-хлор-1-метил-1H-индол-2-карбоновой кислоты,
111) [1R-(2-фенил-1-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-хлор-3-метилбензофуран-2-карбоновой кислоты,
112) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-метоксибензофуран-2-карбоновой кислоты,
113) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 3,5,6-триметилбензофуран-2-карбоновой кислоты,
114) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-бромнафталин-2-карбоновой кислоты,
115) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид нафталин-2-карбоновой кислоты,
116) [1-(2-фенил-1(R)-{[1-(тетрагидропиран-4-илметил)азетидин-3-илметил]карбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты.
4. Соединения общей формулы (I) по п.1 или 2, где указанные соединения определяются следующими формулами:
1) ТФУ-соль (1-{2-фенил-1(R)-[1-(тетрагидропиран-4-илметил)пиперидин-4-илкарбамоил]этилкарбамоил}циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты,
2) [1-(1(R)-{2-[(1-аминоциклогексанкарбонил)амино]этилкарбамоил}-2-фенилэтилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
3) ТФУ-соль [1-(2-фенил-1(R)-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-бромбензо[b]тиофен-2-карбоновой кислоты,
4) (1-{1-(R)-[(1-изопропилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
5) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
6) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
7) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-ил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
8) ТФУ-соль (2-фенил-1(R)-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этил)амид 1-(3-Е-пара-толилакрилоиламино)циклопентанкарбоновой кислоты,
9) [1-(2-фенил-1(R)-{2-[1-(тетрагидропиран-4-илметил)пиперидин-4-ил]этилкарбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
10) [1-(2-фенил-1(R)-{2-[1-(тетрагидропиран-4-ил)пиперидин-4-ил]этилкарбамоил}этилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты,
11) [1-(2-фенил-1(R)-{[1-(тетрагидропиран-4-ил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
12) (1-{1(R)-[(1-[1,3]диоксан-5-илметилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид 6-бромнафталин-2-карбоновой кислоты,
13) (1-{1(R)-[(1-[1,3]диоксан-5-илметилпиперидин-4-илметил)карбамоил]-2-фенилэтилкарбамоил}циклопентил)амид 5-хлорбензофуран-2-карбоновой кислоты,
14) [1-(1(R)-{[1-(1-аминоциклогексанкарбонил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
15) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-иоднафталин-2-карбоновой кислоты,
16) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-метоксинафталин-2-карбоновой кислоты,
17) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-бромбензофуран-2-карбоновой кислоты,
18) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-хлорбензофуран-2-карбоновой кислоты,
19) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-фторбензофуран-2-карбоновой кислоты,
20) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-хлорбензофуран-2-карбоновой кислоты,
21) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-бромбензофуран-2-карбоновой кислоты,
22) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 7-трет-бутилбензофуран-2-карбоновой кислоты,
23) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-метилбензофуран-2-карбоновой кислоты,
24) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-метилбензофуран-2-карбоновой кислоты,
25) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-иодбензофуран-2-карбоновой кислоты,
26) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-хлорбензо[b]тиофен-2-карбоновой кислоты,
27) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-трифторметилбензо[b]тиофен-2-карбоновой кислоты,
28) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-метоксибензо[b]тиофен-2-карбоновой кислоты,
29) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-метилбензо[b]тиофен-2-карбоновой кислоты,
30) [1-(2-фенил-1R-{[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-метилбензо[b]тиофен-2-карбоновой кислоты,
31) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-фторбензо[b]тиофен-2-карбоновой кислоты,
32) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 6-диэтиламинобензофуран-2-карбоновой кислоты,
33) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид 5-диэтиламинобензофуран-2-карбоновой кислоты,
34) [1-(2-фенил-1-{[1R-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}этилкарбамоил)циклопентил]амид нафталин-2-карбоновой кислоты,
35) [1-(1(R)-{[1-(4-метилтетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
36) [1-(1(R)-{[1-(5-этил[1,3]диоксан-5-илметил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
37) [1-(1(R)-{[4-метил-1-(4-метилтетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты,
38) [1-(1(R)-{[4-метил-1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил}-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты.
5. Соединения, определяемые следующими формулами:
1) [1-(1-аминометил-2-(R)-фенилэтилкарбамоил)циклогексил]амид бензо[b]тиофен-2-карбоновой кислоты,
2) {1-[2-фенил-1(R)-(пиперидин-4-илкарбамоил)этилкарбамоил]циклопентил}амид бензо[b]тиофен-2-карбоновой кислоты,
3) (1-{2-фенил-1(R)-[(пиперидин-4-илметил)карбамоил]этилкарбамоил}циклопентил)амид бензо[b]тиофен-2-карбоновой кислоты,
4) ТФУ-соль {1-[2-фенил-1(R)-(2-пиперидин-4-илэтилкарбамоил)этилкарбамоил]циклопентил}амида бензо[b]тиофен-2-карбоновой кислоты,
5) ТФУ-соль [1-(2-фенил-1(R)-{2-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]этилкарбамоил}этилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты,
6) С-[1-(тетрагидропиран-4-илметил)пиперидин-4-ил]метиламин в форме его свободных аминов или солей с хлористо-водородной, серной или трифторуксусной кислотой.
6. Применение соединений общей формулы (I) по пп.1-4 для приготовления фармацевтических композиций, применимых в лечении патологий, связанных со стимуляцией рецептора NK-2.
7. Применение соединений общей формулы (I) по п.6 для приготовления фармацевтических композиций, применимых в лечении респираторных патологий, таких как астма и аллергический ринит; офтальмических заболеваний, таких как конъюнктивит, кожных заболеваний, таких как аллергический и контактный дерматит и псориаз, кишечных заболеваний, таких как раздраженная ободочная кишка, язвенный колит и болезнь Крона, желудочных заболеваний, заболеваний мочевых путей, таких как цистит и недержание мочи, эректильных дисфункций, заболеваний центральной нервной системы, таких как тревожность, депрессия и шизофрения, опухолевых патологий, аутоиммунных заболеваний или заболеваний, связанных со СПИДом, сердечно-сосудистых патологий, неврита, невралгии и в лечении боли, висцералгии, воспалительных процессов, таких как остеоартрит или ревматоидный артрит.
8. Фармацевтические композиции, содержащие в качестве активного ингредиента по меньшей мере одно соединение общей формулы (I) по пп.1-4 или смеси соединений.
9. Фармацевтические композиции по п.8, дополнительно содержащие фармацевтически приемлемые разбавители и наполнители.
10. Фармацевтические композиции по п.8 или 9 для лечения респираторных патологий, таких как астма и аллергический ринит; офтальмических заболеваний, таких как конъюнктивит, кожных заболеваний, таких как аллергический и контактный дерматит и псориаз, кишечных заболеваний, таких как раздраженная ободочная кишка, язвенный колит и болезнь Крона, желудочных заболеваний, заболеваний мочевых путей, таких как цистит и недержание мочи, эректильных дисфункций, заболеваний центральной нервной системы, таких как тревожность, депрессия и шизофрения, опухолевых патологий, аутоиммунных заболеваний или заболеваний, связанных со СПИДом, сердечно-сосудистых патологий, неврита, невралгии и для лечения боли, висцералгии, воспалительных процессов, таких как остеоартрит или ревматоидный артрит.
Текст
007855 Область изобретения Данное изобретение относится к соединениям-антагонистам тахикининов вообще и, в частности,нейрокинина А, и их применению в фармацевтических композициях. Состояние данной области Тахикинины являются семейством, включающим в себя по меньшей мере три пептида, известных как Вещество Р, Нейрокинин A (NKA) и Нейрокинин В (NKB). Исследование в области антагонистов тахикининов, основывающееся в основном на одной или множественных заменах аминокислот последовательности пептидных агонистов Вещества Р и других тахикининов, привело к обнаружению нонапептидов, содержащих одну или несколько единиц Dтриптофана (Regoli et al., Pharmacol. 28, 301 (1984. Однако проблемы, возникающие из фармакологического использования высокомолекулярных пептидов (множественные сайты ферментативной гидролитической атаки, слабая биодоступность, быстрая печеночная и почечная секреция), побудили к поиску минимального пептидного фрагмента, который все еще способен к проявлению антагонистической активности. Эти исследования привели к обнаружению адекватно дериватизованных бициклических и моноциклических пептидов, антагонистов нейрокинина А (заявки на патент WO 9834949 и WO 200129066). Различные соединения были заявлены в качестве селективных антагонистов Вещества Р, например,в заявках на патенты WO 9519966 и WO 9845262; но, наряду с тем фактом, что они являются селективными в отношении рецептора NK1, эти соединения имеют структурные характеристики, которые отличаются от соединений данного изобретения, в основном таким структурным свойством, как отсутствие основной аминогруппы. Среди антагонистов NK1 авторы упоминают также антагонисты, описанные в заявке на патент WO 200014109; среди этих соединений нет даже одной альфа, альфа-дизамещенной аминокислоты, и эта основная группа, когда она присутствует, находится в положениях, которые очень сильно отличаются от положений в соединениях данного изобретения. В патенте ЕР 394989 соединения с NK1-активностью обычно не имеют основной группы и не обнаруживают альфа, альфа-дизамещенной аминокислоты. В Biorganic and Med. Chem. (1994), 2 (2), 101-113 (S. Boile et al.) описаны соединения с NK2 активностью, которые содержат альфа, альфа-дизамещенный фенилаланин (Phe), но они не обнаруживают основных свойств и не могут быть ассоциированы со структурой, описанной общей формулой (I). В заявке на патент WO 9404494 описаны антагонисты NK1, которые обнаруживают дизамещенную альфа, альфа-аминокислоту, структура которой не соответствует общей формуле (I), в частности, в отношении присутствия - среди прочего - группы -О-СО- в положении Х 1. Сущность изобретения Неожиданно было обнаружено, что данные непептидные соединения общей формулы (I), определенной ниже, обнаруживают лучшее поведение в ингибировании связывания тахикининов на рецептореNK2 и лучшую антагонистическую активность in vivo, чем активность, обнаруживаемая продуктами,описанными в цитированных выше патентах предыдущего уровня техники. Таким образом, данное изобретение относится к линейным соединениям общей формулы (I), содержащим альфа, альфа-дизамещенную аминокислоту и по меньшей мере аминогруппу, способную придавать основные свойства соединениям. Соединения общей формулы (I) где R1 обозначает ароматическую группу, выбранную из группы, состоящей из бифенила, фенилэтилена,нафтила, фенилтиофена, бензотиофена, бензофурана и индола, необязательно N-замещенного C1C6 алкильной группой, которая может быть необязательно замещена одной, двумя или тремя группами,независимо выбранными из группы, состоящей из галогена, C1-C6 алкила, необязательно замещенного не более, чем тремя атомами фтора, C1-C6 алкилокси, ОН, NHR10 и N(R10)2, где R10 выбран из Н и C1C6 алкила;R2' выбран из группы, состоящей из Н или C1-C6 алкильной группы; аминокислотный остаток общей формулы (II) выбран из группы, состоящей из 1-аминоциклогексан-1-карбоновой кислоты (Ас 6 с), 1 аминоциклопентан-1-карбоновой кислоты (Ас 5 с), 1-аминоиндан-1-карбоновой кислоты (1-Aic), 1 аминоциклопентан-3-ен-1-карбоновой кислоты (Ас 5 с), 2-метилфенилаланина и 2-метил-2-этилглицина; Х 2 выбран из -CONH- и -CH2NH-; группа -R4 - Х 3 - R5 включает по меньшей мере одну основную аминогруппу иR4 выбран из группы, состоящей из группы -(СН 2)n-, где n равно 1-3, С 5-С 8 циклоалкиленовой группы, выбранной из циклопентилена и циклогексилена, и алифатического гетероцикла, выбранного из пиперидина, пирролидина и пиперазина, необязательно замещенного одной или двумя C1-C6 алкильными группами; Х 3 обозначает связь или группу, выбранную из -СО-, -СН 2-, -СН 2-СН 2- и -NH-CO-;a) алифатического гетероцикла, выбранного из группы, состоящей из пиперидина, пирролидина,морфолина, диазепана, тетрагидропирана и 1,4-диокса-8-азаспиро[4,5]декана, необязательно замещенного одной или двумя группами, выбранными из C1-C6 алкила, C1-C6 алкилокси, ОН и цианометила;c) пиперидина, необязательно С-замещенного C1-C6 алкильной группой и замещенного группой X5R18, где Х 5 обозначает связь или выбран из группы, состоящей из -C(R11)(R12)-, -СО-, СН 2 СН 2- и -СОСН 2-,a R18 выбран из группы, состоящей из тиофена, тетрагидропирана, тетрагидротиопирана, пирролидина,циклогексана, циклопентана, 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из С 1-С 6 алкила, -NHR10, -NH(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1-C6 алкила;d) пиперазина, необязательно С-замещенного одной или двумя C1-С 6 алкильными группами и необязательно N-замещенного группой, выбранной из -CH2CN и X4-R16, где X4 обозначает связь или выбран из-СН 2- и -СОСН 2-, a R16 выбран из группы, состоящей из пиридина, тиофена, тетрагидропирана, морфолина, тетрагидрофурана и 1,3-диоксана; е) аминогруппы, выбранной из -NR11R12, -NH(CH2)m-NR11R12, где R11, R12 и m имеют определенные выше значения;f) аминоциклогексана или циклогексана, необязательно замещенного на кольце группой -NR11R12,где R11 и R12 имеют определенные выше значения;g) гетероароматического радикала, представленного пиридином. Другим предметом данного изобретения являются ретро-инвертированные соединения соединений данной формулы (I), т.е. соединения общей формулы (I), в которых одна или более амидных связей являются инвертированными. Присутствие альфа, альфа-дизамещенной аминокислоты и присутствие в R3 по меньшей мере одной аминогруппы, которая придает этим соединениям сильную основность, могут рассматриваться как специфическая структурная характеристика продуктов, принадлежащих к общей формуле (I). Другим предметом данного изобретения являются фармацевтически приемлемые соли соединений общей формулы (I) с органическими или неорганическими кислотами, выбранными из группы, состоящей из хлористоводородной кислоты, серной кислоты, фосфорной кислоты, уксусной кислоты, трифторуксусной кислоты, щавелевой кислоты, молоновой кислоты, малеиновой кислоты, фумаровой кислоты,янтарной кислоты, винной кислоты и лимонной кислоты. Кроме того, предметом данного изобретения являются отдельные энантиомеры и диастереоизомеры соединений формулы (I) или их смеси, происходящие из встраивания в структуру формулы (I) хиральных остатков или групп. Следующим предметом данного изобретения являются фармацевтические композиции, содержащие соединения общей формулы (I), и применение указанных соединений для приготовления фармацевтических композиций для лечения заболеваний, в которых нейрокинин А играет патогенную роль. Подробное описание изобретения Предпочтительными соединениями данного изобретения являются соединения общей формулы (I),гдеR1 обозначает ароматическую группу, выбранную из группы, состоящей из фенилэтилена, нафтила,бензотиофена, необязательно замещенного одной, двумя или тремя группами, независимо выбранными из галогена, С 1-С 6 алкила, необязательно замещенного не более, чем тремя атомами фтора, C1C6 алкилокси, ОН, NHR10 и N(R10)2, где R10 выбран из Н и C1-C6 алкила;R2' обозначает Н; аминокислотный остаток общей формулы (II) выбран из 1-аминоциклогексан-1-карбоновой кислоты (Ас 6 с) и 1-аминоциклопентан-1-карбоновой кислоты (Ас 5 с); Х 2 обозначает -CONH-; группа -R4 - Х 3 - R5 включает по меньшей мере одну основную аминогруппу иR4 выбран из -(СН 2)n-, где n равно 1-3, и пиперидина, необязательно замещенного C1-C6 алкильной группой; Х 3 обозначает связь или он является группой, выбранной из -СО- и -СН 2-;R5 выбран из: а) алифатического гетероцикла, выбранного из пиперидина и тетрагидропирана, необязательно замещенного одной или несколькими С 1-С 6 алкильными группами;b) пиперидина, необязательно С-замещенного С 1-С 6 алкильной группой, замещенной группой X5R18, где Х 5 обозначает связь или он является группой, выбранной из -C(R11)(R12)- и -СО-, a R18 является группой, выбранной из тетрагидропирана, циклогексана и 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из С 1-С 6 алкила, -NHR10 и -N(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1-C6 алкила;c) пиперазина, необязательно С-замещенного одной или двумя С 1-С 6 алкильными группами и необязательно N-замещенного группой X4-R16, где Х 4 обозначает-СН 2-, a R16 выбран из тетрагидропирана и 1,3-диоксана. Среди терминов, используемых для описания данного изобретения, предпочтительными являются следующие термины:- термин "C1-C6 алкил"относится к группе, выбранной из метила, этила, н-пропила, изопропила, нбутила, трет-бутила и, при необязательном замещении фтором, трифторметила;- термин "С 1-С 6 алкилокси" относится к группе, в которой алкильная часть выбрана из метила, этила, н-пропила, изопропила, н-бутила, трет-бутила и, при возможном замещении фтором, трифторметила. Соединения данного изобретения обнаружили антагонистическую активность в отношении действия вещества Р, нейрокинина А и нейрокинина В; и они продемонстрировали особенно селективную активность против действия нейрокинина А. Таким образом, соединения формулы (I) могут быть использованы для приготовления фармацевтических композиций, необязательно содержащих фармацевтически приемлемые разбавители и наполнители, обычно используемые в лекарственных продуктах, применимых для лечения и предупреждения заболеваний, в которых в качестве нейромодуляторов участвуют тахикинины вообще и конкретно нейрокинин А; в качестве примера авторы дают перечень следующих заболеваний: респираторные патологии, такие как астма, аллергический ринит и хронический обструктивный бронхит; офтальмические заболевания, такие как конъюнктивит, кожные заболевания, такие как аллергический и контактный дерматит и псориаз, кишечные нарушения, такие как раздраженная ободочная кишка, язвенный колит и болезнь Крона, желудочные заболевания, заболевания мочевых путей, такие как цистит и недержание мочи, эректильные дисфункции, заболевания центральной нервной системы, такие как тревожность, депрессия и шизофрения, опухолевые патологии, аутоиммунные заболевания или заболевания, связанные со СПИДом, сердечно-сосудистые патологии, неврит, невралгия, и для лечения боли, в частности, висцеральгии, воспалительных процессов, таких как остеоартрит или ревматоидный артрит. Данные соединения формулы (I), определенные выше, могут быть получены в соответствии со способами, описанными в литературе и хорошо известными лицу с квалификацией в данной области, например, при помощи реакций амидной конденсации, замены, добавления или восстановительного аминирования. В качестве примера, синтетические пути, описанные в общих чертах в следующих схемах реакций,могут быть использованы с осуществлением очевидных и подходящих изменений в соответствии с заместителями. В следующих схемах, если нет других указаний, заместители являются такими, как определенные-3 007855 выше. Например, соединения общей формулы (I) могут быть получены в соответствии со следующей схемой 1 реакцией активированных производных карбоновых кислот общей формулы (III) с промежуточным соединением общей формулы (IV). Схема 1 Также в качестве примера, соединения общей формулы (I) могут быть получены, как описано в следующей схеме 2, в соответствии со следующей последовательностью реакций:a) образование оксазолинона формулы (VII) из активированных производных карбоновых кислот формулы (V) и аминокислот формулы (VI) с подходящими активирующими и конденсирующими агентами;b) реакция оксазолинона формулы (VII) с аминами формулы (VIII), защищенными подходящей защитной группой Р, с последующим удалением защитных групп способами, известными лицу с квалификацией в данной области, для получения соединений формулы (IX);c) ацилирование, алкилирование или восстановительное аминирование подходящими реагентами для получения конечных соединений формулы (I). Схема 2 Соединения данного изобретения могут встречаться в различных изомерных формах. Действительно, в то время как конфигурация углерода, связанного с R5, является однозначно предварительно фиксированной во время синтеза специфического изомера аминокислотного производного, другие исходные продукты часто могут состоять из смесей стереоизомеров, которые трудно разделяются. Таким образом, соединения данного изобретения могут быть получены в виде смесей диастереоизомеров. Эти смеси могут быть разделены хроматографией. Однако соединения формулы (I) могут быть использованы как в виде отдельных энантиомеров, так и в виде смеси изомеров. Некоторые примеры данных соединений и способа их получения обеспечены в дальнейшем описании для иллюстративных и не ограничивающих данное изобретение целей. Пример 1.N[N(бензо[b]тиофенил-2-илкарбонил)-1-аминоциклопентан-1-карбонил]-D-фенилаланин-N-[3(морфолин-4-ил)пропил]амид 1 а) К раствору 1-аминоциклопентан-1-карбоновой кислоты (1 г, 7,66 ммоль) в 30 мл безводного дихлорметана (ДХМ) добавляют N,O-бис(триметилсилил)ацетамид (BSA) (3,8 мл, 15,4 ммоль) при перемешивании магнитной мешалкой; спустя 15 мин добавляют триметилхлорсилан (TMSCl) (0,38 мл, 10% от объема BSA). Аминокислота полностью силанизируется (раствор в конце этого добавления является прозрачным) и после приблизительно 2 ч перемешивания при комнатной температуре к реакционной смеси добавляют бензо[b]тиофен-2-карбонилхлорид (7,66 ммоль), растворенный в 10 мл ДХМ. Реакци-4 007855 онную смесь выдерживают в течение 12 ч при перемешивании при комнатной температуре. Раствор концентрируют при пониженном давлении, затем добавляют 50 мл водного 1 М NaHCO3 и выдерживают при перемешивании в течение 30 мин. Все переносят в делительную воронку, затем добавляют этилацетат (AcOEt) (50 мл); смесь встряхивают и органическую фазу удаляют. Водный раствор подкисляют до рН 1 при помощи 6 н. HCl и промывают AcOEt (3 х 50 мл). Органические фазы собирают вместе, переносят в делительную воронку и промывают Н 2O и солевым раствором до рН 5-6. Органическую фазу сушат на безводном Na2SO4, затем упаривают досуха. Выделенный остаток кристаллизуют из ацетонитрила с получением таким образом 1,4 г (4,84 ммоль, выход = 63%)N(бензо[b]тиофен-2-карбонил)-1-аминоциклопентан-1-карбоновой кислоты. ВЭЖХ (способ Е): Rt=14,04 мин. 1b) К раствору в безводном ТГФ (25 мл) продукта, полученного из примера 1 а) (500 мг, 1,73 ммоль), добавляют гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) (2,08 ммоль,0,402 г) и диизопропилэтиламид (DiPEA) (5,2 ммоль, 0,89 мл). Раствор выдерживают при перемешивании в течение 2 ч при комнатной температуре. Растворитель выпаривают и остаток растворяют AcOEt(50 мл); органическую фазу промывают 1 М NaHCO3 (3 х 50 мл), 1M HCl (3 х 50 мл), насыщенным водным раствором хлорида натрия (3 х 50 мл). Органический раствор сушат на безводном Na2SO4 и затем его доводят до сухого состояния. Получают 0,450 г 2-(бензо[b]тиофен-2-ил)-4-циклопентил-1,3-оксазолин-5 она (1,66 ммоль, выход=96%). ВЭЖХ (способ Е): Rt=21,86 мин. 1 с) К раствору в 15 мл безводного ТГФ N-гидроксисукцинимидилового эфира третбутоксикарбонил-D-фенилаланина (500 г, 1,38 ммоль) добавляют N-(3-аминопропил)морфолин (1,328 ммоль, 0,201 мл). Перемешивание поддерживают в течение 90 мин. Затем растворитель выпаривают и остаток растворяют AcOEt (50 мл); органическую фазу промывают 1 М NaHCO3 (3 х 50 мл), 1M HCl (3 х 50 мл), насыщенным водным раствором хлорида натрия (3 х 50 мл). Раствор сушат на безводном Na2SO4. После выпаривания растворителя получают 474 мг (трет-бутилоксикарбонил-D-фенилаланин-N-[3(морфолин-4-ил)пропил]амида) (1,21 ммоль, выход=88%). ВЭЖХ (способ Е): Rt=10,35 мин. 1d) Продукт, полученный из примера 1 с) (0,474 г, 1,21 ммоль), растворяют в 50 мл раствора 4 н. HCl в диоксане. Спустя 30 мин растворитель выпаривают, остаток растворяют и доводят до сухого состояния толуолом и абсолютным спиртом. Полученное таким образом твердое вещество переносят в делительную воронку с использованием 50 мл NaHCO3 и 50 мл CHCl3. После встряхивания органическую фазу собирают и водную фазу промывают еще 5 порциями CHCl3. Все органические фазы собирают, затем переносят в делительную воронку; проводят одно промывание насыщенным раствором хлорида натрия. Органическую фазу сушат на Na2SO4. Растворитель выпаривают с получением 0,291 г (1 ммоль, выход=83%) прозрачного масла гидрохлорида D-фенилаланин-N-[3-(морфолин-4-ил)пропил]амида. 1 е) К раствору в смеси 10 мл безводного CH3CN и 1 мл безводного ТГФ продукта, полученного из примера 1b, (66,5 мг; 0,245 ммоль), добавляют раствор продукта, полученного в примере 1d) (72 мг, 0,247 ммоль), в 5 мл безводного CH3CN. Эту реакционную смесь нагревают с обратным холодильником для дефлегмации в течение 48 ч. После удаления растворителя при пониженном давлении остаток растворяют AcOEt (50 мл) и этот раствор переносят в делительную воронку и промывают один раз насыщенным раствором хлорида натрия. Органическую фазу сушат на Na2SO4 и растворитель выпаривают. Получают 135 мг продукта, который затем очищают обращенно-фазовой хроматографией с использованием колонки Hibar MerckLiChrospher 100, RP-18e (5 мкм), элюенты А: Н 2O+0,1% ТФУ; В: CH3CN+0,1% ТФУ; элюция линейным градиентом от 10 до 50% В в течение 40 мин, скорость тока 10 мл/мин; УФ-детектирование (=230 нм). Фракции, соответствующие пику продукта, собирали, концентрировали до малого объема при пониженном давлении и лиофилизировали с получением 0,124 ммоль N-[3-(морфолин-4-ил)пропил]амидаN-[(1S,2S)-2-аминоциклогексил]амид (1R,3S)-NN[N(бензо[b]тиофен-2-илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил-3-аминоциклопентан-1-карбоновой кислоты 2 а) К раствору (1S,2S)-диаминоциклогексана (1,14 г, 10 мм) в 50 мл ДХМ добавляют по каплям дибензилдикарбонат (2 г, 7 ммоль), растворенный в 20 мл ДХМ. После завершения добавления полученный осадок фильтруют и сушат с получением 0,55 г белого твердого вещества, которое является исходным диаминциклогексаном. Органический фильтрат (80 мл) экстрагируют 1 н HCl (3 х 10 мл) и водный экстракт собирают, подщелачивают до рН 10 и экстрагируют ДХМ (3x10 мл). Собранные органические экстракты сушат на безводном Na2SO4, затем фильтруют и доводят до сухого состояния. Остаток растворяют в 3 мл метанола, затем добавляют насыщенную этилацетатом хлористо-водородную кислоту(EtOAc/HCl) (2 мл) и затем этиловый эфир (20 мл) с получением белого осадка в суспензии. Этот осадок фильтруют и сушат с получением таким образом 1,44 г гидрохлорида (1S,2S)-Nмонобензилоксикарбонилдиаминоциклогексана (выход=50,5%). ВЭЖХ (Е): Rt=7,85 мин. 2b) 360 мг (1,26 ммоль) продукта, полученного из примера 2 а), растворяют в 10 мл ДМФ и добав-5 007855 ляют к нему 0,296 г (1,29 ммоль) (1R,S) N-трет-бутилоксикарбонил-3-аминоциклопентан-3-карбоновой кислоты, 245 мг EDC, 173 мг HOBt и DiPEA до получения щелочной реакции. Эту смесь выдерживают для реакции в течение 18 ч, затем добавляют ДХМ (50 мл). Органическую фазу промывают 5% KHSO4(3 х 50 мл), NaHCO3 (3 х 50 мл), Н 2O (3x50 мл) и сушат на безводном Na2SO4. Затем органический раствор фильтруют и доводят до сухого состояния с получением 0,610 г желтого твердого вещества, которое затем растворяют в 5 мл МеОН и добавляют к нему 50 мл Et2O. Белое твердое вещество осаждается и после фильтрования получают 440 мг (выход=68%). ВЭЖХ(Е): Rt=15,5 мин. Затем остаток растворяют в 10 мл EtOАс и добавляют к нему 20 мл EtOAc/HCl; спустя 1 ч к этой смеси добавляют 100 мл Et2O с получением таким образом белого осадка, который после фильтрования дает 0,425 г гидрохлорида N-[(1S,2S)-2-N-(бензилоксикарбонил)аминоциклогексил]амида (1R,3S)-3 аминоциклопентан-3-карбоновой кислоты. ВЭЖХ (Е): Rt=8,9 мин. 2 с) 0,425 г продукта, полученного из примера 2b), растворяют в ДМФ (10 мл) и добавляют N(третбутилоксикарбонил)-D-фенилаланин (0,312 г, 1,29 ммоль), EDC (0,230 г, 1,29 ммоль), HOBt (0,175 г, 1,29 ммоль) и DiPEA до получения щелочной реакции. Эту смесь выдерживают для реакции в течение ночи,затем добавляют 30 мл ДХМ и органическую фазу промывают 5% KHSO4 (3 х 50 мл), NaHCO3 (3 х 50 мл),Н 2O (3 х 50 мл) и сушат на безводном Na2SO4. После фильтрования и удаления растворителя получают 531 мг неочищенного продукта, из которого, после растирания в Et2O, получают 470 мг белого твердого вещества (выход 83%). ВЭЖХ (Е): Rt=16,06 мин. Высвобождение Вос-группы с использованием EtOAc/HCl и последующее осаждение Et2O (70 мл) позволяет выделить 410 мг гидрохлорида N-[(1S,2S)-2-N-(бензилоксикарбонил)аминоциклогексил]амида(1R,3S)-N-[D-фенилаланил]-3-аминоциклопентан-3-карбоновой кислоты. ВЭЖХ (Е): Rt=11,27 мин. 2d) В стеклянную, защищенную CaCl2 пробирку на 100 мл суспендируют 1,29 г (10 ммоль) 1 аминоциклогексан-1-карбоновую кислоту в 20 мл ДХМ и добавляют 5 мл N,O-бис(триметилсилил)ацетамида. Реакционную смесь выдерживают при перемешивании в течение 2 ч до полного растворения производного аминокислоты. К раствору 1,8 г (0,92 ммоль) добавляют по каплям хлорангидрид бензотиофен-2-карбоновой кислоты в 20 мл ДХМ и этой смеси дают реагировать в течение 1 ч при комнатной температуре. Затем этот органический раствор промывают водой (5 х 50 мл), сушат на безводном Na2SO4,фильтруют, доводят до сухого состояния и растирают с Et2O с получением таким образом 2,60 г (выход = 90,2%) белого твердого вещества N(бензо[b]тиофен-2-илкарбонил)-1-аминоциклогексан-1-карбоновой кислоты. ВЭЖХ (способ Е): Rt=17,7 мин. 2 е) К раствору в безводном ТГФ (25 мл) продукта, полученного из примера 2d) (0,50 г, 1,67 ммоль),добавляют EDC (2,08 ммоль, 0,402 г) и DiPEA (5,2 ммоль, 0,890 мл). Этот раствор поддерживают при перемешивании в течение 2 ч при комнатной температуре. Затем растворитель выпаривают, остаток растворяют в AcOEt (50 мл), органическую фазу промывают 1 М NaHCO3 (3 х 50 мл), 1M HCl (3 х 50 мл), насыщенным водным раствором хлорида натрия (3 х 50 мл). Органический раствор сушат на безводномNa2SO4 и затем доводят до сухого состояния. Получают 0,450 г 2-(бензо[b]тиофен-2-ил)-4 циклогексилоксазол-5-она (1,57 ммоль, выход=94%). ВЭЖХ (способ Е): Rt = 2,1 мин. 2f) К 0,176 г продукта, полученного из примера 2 с), растворенного в 5 мл безводного CH3CN, добавляют 82 мг продукта, полученного из примера 2d), и DiPEA до получения щелочной реакции. Затем эту смесь нагревают для дефлегмации в течение 18 ч. Затем реакционную смесь разбавляют ДХМ (20 мл) и промывают 5% KHSO4 (3 х 50 мл), NaHCO3 (3 х 50 мл), Н 2O (3x50 мл) и сушат на безводном Na2SO4. Смесь фильтруют, доводят до сухого состояния и растирают с Et2O с получением таким образом 185 мг белого твердого вещества. ВЭЖХ (способ Е): Rt=17,08 мин. Полученный таким образом твердый продукт растворяют в 12 мл МеОН и 1 мл уксусной кислоты. К полученному раствору добавляют 250 мг палладия на угле и выполняют инсуффляцию (вдувание) водородом в течение 2 ч, пока, согласно ВЖХ в вышеописанных условиях, не исчезает пик при Rt=17,08 мин и не появляется основной пик при Rt=11,78 мин. Затем после фильтрования катализатора и удаления растворителя реакционную смесь очищают в 10 раундах препаративной хроматографии с использованием колонки Vydac PeptideProtein (250 х 22 мм), 10, с элюцией Н 2O+0,1% ТФУ (А) и CH3CN+0,1% ТФУ (В) (градиент 10-50% В в течение 110 мин; скорость тока 12 мл/мин). Хроматографические фракции, которые были чистыми согласно ВЖХ-анализу, собирают и упаривают с получением остатка 70 мг N-[(1S,2S)-2-аминоциклогексил]амида (1R,3S)-NN[N(бензо[b]тиофен-2 илкарбонил)-1-аминоциклопентан-1-карбокси]-D-фенилаланил-3-аминоциклопентан-1-карбоновой кислоты. 1 Н-ЯМР (, ДМСО-d6): 1,2-1,9 (м, 22 Н, СН 2); 2,6 (м, 1 Н, СН-СО-3 Ас 5 с); 2,9-3,20 (м, 2 Н, CH2DPhe); 3,85 (м, 1 Н, CH-NH, 1,2-ди-NН 2-циклогексан); 4,2 (м, 1 Н, CH-NH-3Ac5c); 4,45 (м, 1 Н, CH-DPhe; 7,1-7,25 (м, 5 Н, Capoм-D-Phe); 7,45-7,85 (м, 8 Н, С(5)Н+С(6)Н+NНСН-1,2-ди-NН 2 циклогексан+NHCH-3 Ас 6 с+NH3NHCH-D-Phe); 7,90-8,02 (м, 2 Н, С(4)Н+С(7)Н; 8,3 (с, 1 Н, С(3)Н); 8,9(с, 1 Н, NH-1Ac5c). MS-FAB: 644,3 (М+Н)+ Аналогичными способами или с очевидными для специалиста с квалификацией в данной области изменениями получали следующие продукты:(1-1-[3-(2,6-диметилморфолин-4-ил)пропилкарбамоил]-2-(R)-фенилэтилкарбамоилциклогексил)амид бензо[b]тиофен-2-карбоновой кислоты МС (m/z): 605,4 (MH+). ВЭЖХ (способ В): Rt=4,57 мин. Пример 49. 1-[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтилкарбамоил]циклопентиламид 1 Н-индол-2 карбоновой кислоты Пример 50.[1-(3-морфолин-4-илпропилкарбамоил)-2-(R)-фенилэтил]амид 1-[3-(3,4-дибромфенил)акрилоиламино]циклопентанкарбоновой кислоты Пример 51. 1-[1-(3-морфолин-4-ил)пропилкарбамоил]-2-(R)-фенилэтилкарбамоил]циклопентиламид 5-фенилтиофен-2-карбоновой кислоты Пример 52. ТФУ-соль (1-1(R)-[3-(4-метил[1,4]диазепан-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты 52 а) К суспензии 1-амино-1-циклопентанкарбоновой кислоты (19,2 г, 149 ммоль) в 500 мл безводного CH2Cl2 добавляют, при перемешивании магнитной мешалкой, N,O-бис(триметилсилил)ацетамид(BSA) (54 г, 268 ммоль, содержащий 5% TMSCl). После приблизительно 1 ч при перемешивании при комнатной температуре к этому раствору добавляют бензо[b]тиофен-2-карбонилхлорид (29,2 г, 149 ммоль), растворенный в 200 мл CH2Cl2, в течение приблизительно 2 ч; реакционную смесь поддерживают при перемешивании в течение дополнительных 3 ч. Затем этот раствор упаривают при пониженномAcOEt (2 х 100 мл). Затем водную фазу подкисляют водной 37% HCl до полного осаждения белого твердого вещества, которое экстрагируют AcOEt (2 х 200 мл) и сушат на безводном Na2SO4. Органическую фазу фильтруют и упаривают с получением таким образом 1-[(бензо[b]тиофен-2 карбонил)амино]циклопентанкарбоновой кислоты (38,7 г, 134 ммоль). ВЭЖХ (способ A): Rt=3,51 мин. С использованием аналогичных процедур получали также следующие промежуточные продукты: 1-[(6-бромбензо[b]тиофен-2-карбонил)амино]циклопентанкарбоновую кислоту ВЭЖХ (способ A):Rt=3,74 мин. 52b) К раствору в безводном ТГФ (500 мл) продукта, полученного в примере 52 а) (16 г, 55 ммоль),добавляют EDC.HCl (12,7 г, 66 ммоль) и диизопропилэтиламин (30 мл) при перемешивании магнитной мешалкой при комнатной температуре. Реакционную смесь поддерживают при перемешивании в течение 4 ч, затем растворитель выпаривают досуха и остаток растворяют в AcOEt (1000 мл) и промывают 10%NaHCO3 (3 х 300 мл), 10% лимонной кислотой (3 х 300 мл), Н 2O (3 х 500 мл), затем сушат на Na2SO4 и доводят до сухого состояния с получением таким образом твердого вещества нестандартного белого цвета 2 бензо[b]тиофен-2-ил-3-окса-1-азаспиро[4,4]нон-1-ен-4-она (13 г, 47,9 ммоль). ВЭЖХ (способ A): Rt=4,97 мин. С использованием аналогичных процедур получали также следующие промежуточные продукты: 2-(6-бромбензо[b]тиофен-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он, ВЭЖХ (способ A): Rt=5,55 мин. 2-(6-бромнафталин-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он, ВЭЖХ (способ A): Rt=5,65 мин. 2-(5-хлорбензофуран-2-ил)-3-окса-1-азаспиро[4,4]нон-1-ен-4-он, ВЭЖХ (способ A): Rt=4,97 мин. 52 с) К раствору в безводном ДМФ (100 мл) Z-D-фенилаланина (5 г, 16,7 ммоль) добавляют HOBt(2,34 г, 17,6 ммоль) и EDC.HCl (8,73 г, 17,55 ммоль) при перемешивании магнитной мешалкой. Спустя 30 мин к этому раствору добавляют 3-аминопропанол (1,25 г, 16,72 ммоль), растворенный в ДМФ (60 мл), и реакционную смесь выдерживают при комнатной температуре в течение 12 ч. Затем смесь разбавляют AcOEt (200 мл) и экстрагируют KHSO3 (5% раствор 200 мл) и NaHCO3 (насыщенный раствор, 200 мл). Органическую фазу, высушенную на Na2SO4, фильтруют и доводят до сухого состояния и затем промывают этиловым эфиром и белое твердое вещество в суспензии фильтруют с получением желаемого продукта (5,15 г, 14,5 ммоль). ВЭЖХ (способ В): Rt=3,48 мин. Продукт, полученный из предыдущей реакции, освобождают от защитных групп гидрированием(Н 2, 10% Pd/C) согласно процедуре, известной любому лицу с квалификацией в данной области, с получением белого твердого вещества 2(R)-амино-N-(3-гидроксипропил)-3-фенилпропионамида (2,91 г, 14,5 ммоль), которое используют сразу же в последующей реакции. 52d) К продукту, полученному на стадии 52b) (1 г, 3,7 ммоль), растворенному в безводном ДМФ (40 мл), добавляют промежуточный продукт, описанный в 52 с) (1,11 г, 5,6 ммоль), и реакционную смесь выдерживают при комнатной температуре при перемешивании магнитной мешалкой в течение 24 ч. Затем эту смесь разбавляют AcOEt (150 мл) и органическую фазу промывают дистиллированной водой (3 х 50 мл) и насыщенным раствором NaHCO3 (2 х 50 мл), затем сушат на безводном Na2SO4 и доводят до сухого состояния с получением белого твердого вещества 1-[1(R)-(3-гидроксипропилкарбамоил)-2 фенилэтилкарбамоил]циклопентиламида бензо[b]тиофен-2-карбоновой кислоты (1,51 г, 3 ммоль). ВЭЖХ (способ A): Rt=3,73 мин. 52 е) Полученный таким образом продукт (1,2 г, 2,44 ммоль), без дополнительной очистки, растворяют в AcOEt (30 мл). К этому раствору, поддерживаемому при 0 С на бане со льдом, добавляют водный раствор NaBr (0,5 М, 5,35 мл, 2,68 ммоль), 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO, 3,4 мг, 0,022 ммоль) и по каплям добавляют водный раствор NaClO (1,83 М, 1,55 мл). Двухфазную смесь выдерживают при 0 С при перемешивании в течение дополнительных 20 мин, затем органическую фазу отделяют, а водную фазу экстрагируют AcOEt (20 мл). Органические фракции собирают и промывают забуференным раствором KI (20 мл), 10% раствором Na2S2O3 (20 мл) и NaHCO3 (5%, 20 мл); затем их сушат и упаривают с получением продукта, который очищают флеш-хроматографией (ЕtOАс/гексан, 80/20) с получением 0,82 г белого твердого вещества 4-[2(R)(1-[(бензо[b]тиофен-2-карбонил)амино]циклопентанкарбониламино)-3-фенилпропиониламино]пропаналя. ВЭЖХ (способ В): Rt=3,99 мин. Полученный таким образом альдегид (100 мг, 0,203 ммоль) растворяют в метаноле (5 мл) и добавляют 1-метил[1,4]диазепан (115 мг, 1,01 ммоль) и ледяную уксусную кислоту (0,2 мл). После перемешивания этого раствора в течение 15 мин к раствору добавляют Na(CN)BH3 (20 мг, 0,32 ммоль). Спустя 12 ч растворитель выпаривают при пониженном давлении и неочищенный продукт растворяют в 1 М HCl. Этот кислотный экстракт промывают AcOEt (10 мл) и доводят до щелочного рН добавлением твердогоNaHCO3, затем экстрагируют AcOEt (2 х 25 мл). Органическую фазу упаривают, затем очищают препаративной ВЭЖХ (колонка: Combi HT (SB C18, 5 мкм, 100 А, 21 х 50 мм), способ: Н 2 О+0,1% ТФУ/МеСN+0,1% ТФУ, 95/55/95 в течение 10 мин, скорость тока = 40 мл/мин, =220, 270 нм) с получением ТФУ-соли(1-1-[3-(4-метил[1,4]диазепан-1-ил)пропилкарбамоил]-2-(R)-фенилэтилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты (40 мг, 0,067 ммоль). МС (m/z): 590,5 (MH+). ВЭЖХ (способ A): Rt=3,05 мин. Аналогичными способами были также получены следующие продукты: Пример 53. ТФУ-соль (1-1(R)-[3-(4-метоксипиперидин-1-ил)пропилкарбамоил]-2-фенилэтилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты МС (m/z): 591,3 (MH+). ВЭЖХ (способ A): Rt=3,64 мин. Пример 54.(1-1(R)-[3-(3,5-цис-диметилпиперазин-1-ил)-3-оксопропилкарбамоил]-2-фенилэтилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты 56 а) О-сукцинимидоэфир Boc-D-фенилаланина (5 г, 16,56 ммоль) растворяют в CH3CN (60 мл) и добавляют к раствору -аланина (2,08 г, 16,56 ммоль) и ТФУ (4,61 мл) в 60 мл воды. Спустя 30 мин органический растворитель выпаривают и водный остаток, подкисленный добавлением HCl, экстрагируютAcOEt (3 х 100 мл). Органический экстракт промывают водой, сушат и доводят до сухого состояния с получением бесцветного масла (4,19 г, 12,08 ммоль). ВЭЖХ (способ В): Rt=3,19 мин. Полученный таким образом продукт освобождают от защитных групп при стандартных условиях(HCl, диоксан) и полученный таким образом амин (2,9 г, 12 ммоль) используют, без дополнительных,стадий очистки, в реакции с промежуточным продуктом, описанной в примере 52b) в присутствии стехиометрического DiPEA, в вышеописанных условиях, с получением 3-[2(R)-(1-[(бензо[b]тиофен-2 карбонил)амино]циклопентанкарбониламино)-3-фенилпропиониламино]пропионовой кислоты (5,17 г,10,2 ммоль). ВЭЖХ (способ В): Rt=3,98 мин. 56b) Полученной таким образом кислоте (100 мг, 0,2 ммоль) дают реагировать с 2,6-цисдиметилпиперазином согласно стандартному способу для образования амидной связи (EDC, HOBt,CH2Cl2). Неочищенный продукт этой реакции очищают препаративной ВЭЖХ (те же самые условия, что и в примере 52) с получением ТФУ-соли (1-1(R)-[3-(3,5-цис-диметилпиперазин-1-ил)-3 оксопропилкарбамоил]-2-фенилэтилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты (25 мг, 0,035 ммоль). МС (m/z): 604,2 (MH+). ВЭЖХ (способ A): Rt=3,36 мин. Аналогичными способами с использованием подходящих промежуточных продуктов, как описано в примере 52b), и с использованием полученных подходящих аминов, если необходимо, были получены следующие продукты с использованием способов, известных лицу с квалификацией в данной области: Пример 57.MC (m/z): 615,1 (MH+). ВЭЖХ (способ A): Rt=3,79 мин. Пример 66. ТФУ-соль 1-[2-фенил-1(R)-(1-пиридин-2-илметилпиперидин-4-илкарбамоил)этилкарбамоил]циклопентиламида бензо[b]тиофен-2-карбоновой кислоты 66 а) Z-D-фенилаланину (3,28 г, 11 ммоль) дают реагировать с гидрохлоридом N-Вос-(4 амино)пиперидина (2,6 г, 11 ммоль) при обычных условиях для связывания пептидов (HOBt, EDC,DIPEA, CH2Cl2), как описано в примере 56b). Полученный таким образом аддукт (5 г, 10,3 ммоль), после простой экстрагирующей обработки, гидрируют в присутствии Pd/C в качестве катализатора с получением таким образом трет-бутилового эфира 4-(2(R)-амино-3-фенилпропиониламино)пиперидин-1 карбоновой кислоты (3,21 г, 9,27 ммоль). ВЭЖХ (способ В): Rt=3,22 мин. С использованием аналогичных процедур были также получены следующие промежуточные продукты: трет-бутиловый эфир 4-[(2R)-амино-3-фенилпропиониламино)метил]пиперидин-1-карбоновой кислоты трет-бутиловый эфир 4-[2-(2R)-амино-3-фенилпропиониламино)этил]пиперидин-1-карбоновой кислоты (в этом случае использовали N-Boc-(4-аминоэтил)пиперидин, полученный из соответствующего спирта реакцией, очевидной для специалиста с квалификацией в данной области). 66b) Соединение, полученное в примере 66 а) (1,69 г, 4,87 ммоль) реагирует с DMF при компактной температуре в течение 24 ч с оксазолиноном, описанным в примере 52 в) (1,29 г, 4,8 ммоль). Полученное таким образом промежуточное вещество (2,9 г, 4,7 ммоль) HPLC (В): Rt=4,85 мин), после простой экстрактивной обработки является лишенным защиты реакцией с TFA в CH2Cl2 с получением бензо[b]тиофен-2-карбоновой кислоты 1-[2-фенил-1(R)-(пиперидин-4-илкарбамоил)-этилкарбамоил]циклопентил-амид TFA соли. MS (m/z): 519,2 (MH+). HPLC (способ А): Rt=3,29 мин. Аналогичными способами были получены следующие соединения: ТФУ-соль (1-2-фенил-1(R)[(пиперидин-4-илметил)карбамоил]этилкарбамоилциклопентил)амида бензо[b]тиофен-2-карбоновой кислоты МС (m/z): 533,3 (MH+). ВЭЖХ (способ A): Rt=3,29. ТФУ-соль 1-[2-фенил-1(R)-(2-пиперидин-4-илэтилкарбамоил)этилкарбамоил]циклопентиламида бензо[b]тиофен-2-карбоновой кислоты МС (m/z): 547,3 (MH+). ВЭЖХ (способ A): Rt=3,39. 66 с) 200 мг (0,31 ммоль) 1-[2-фенил-1(R)-(пиперидин-4-илкарбамоил)этилкарбамоил]циклопентил)амида бензо[b]тиофен-2-карбоновой кислоты используют для реакции восстановительного аминирования пиридин-2 карбоксальдегидом (64 мг, 0,6 ммоль) с получением, после очистки препаративной ВЭЖХ в соответствии со способом, уже описанным в предыдущих примерах, желаемого продукта ТФУ-соли 1-[2-фенил-1(R)-(1 пиридин-2-илметилпиперидин-4-илкарбамоил)этилкарбамоил]циклопентиламида бензо[b]тиофен-2-карбоновой кислоты (120 мг, 0,16 ммоль). МС (m/z): 610,3 (MH+). ВЭЖХ (способ A): Rt=3,58 мин. Аналогично описанному в примере 66 с), реакция в ДМФ, при комнатной температуре и в течение периодов времени от 12 до 48 ч промежуточных продуктов, описанных в примере 66 а), с оксазолинонами, описанная в примере 52b), и реакция промежуточных продуктов, описанных в примере 66 а), с 1-(3(Е)-пара-толилакрилоиламино)циклопентанкарбоновой кислотой, описанная в примере 52 а), в условиях связывания пептидов, дает, после освобождения от аминозащитных групп, промежуточные продукты,аналогичные промежуточным продуктам, описанным в примере 66b). Такие промежуточные продукты алкилируют при условиях, которые широко описаны в литературе и хорошо известны любому лицу с квалификацией в данной области, таких как альдегид или кетон, цианоборгидрид на смоле-носителе в безводном CH2Cl2,- 13007855 альдегид или кетон, Na(AcO)3BH, в CH2Cl2 или ТГФ,алкил галогенид, KI, DiPEA в ДМФ,или при других условиях, описанных выше в примере 52d). С использованием синтетической процедуры, описанной в примере 66, были получены следующие продукты: Пример 67. ТФУ-соль[1-(1(R)-бензил-2-2-[1-(тиофен-2-илацетил)пиперидин-4-ил]этиламиноэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты 94 а) 1-тpитил-2-(R)-бeнзил-1,2-этилендиамин. К суспензии 24 г D-фенилаланинамида в ДМФ (200 мл) добавляют 41,0 г дитритилхлорида при перемешивании при комнатной температуре и, спустя 1 ч, добавляют также 80 мл TEA, разбавленного в 100 мл ДМФ. Перемешивание поддерживают в течение 10 ч, затем растворитель выпаривают, остаток растворяют в этилацетате и промывают 10% водным NaCl, 10% водной лимонной кислотой и опять 10% водным NaCl. Затем после сушки и упаривания остаток растворяют в 200 мл ДМФ. К полученному таким образом раствору добавляют 2000 мл дистиллированной воды по каплям. Получают осадок, который сначала сушат досуха, а затем растворяют в 200 мл ТГФ и этот раствор добавляют по каплям на протяжении 20 мин при 0 С при перемешивании и в атмосфере азота к раствору 400 мл 0,62 М LiAlH4 в ТГФ. Эту смесь нагревают и поддерживают при дефлегмации в течение 4 ч. После остывания смеси до 0 С добавляют 15 мл дистиллированной воды, 15 мл водного 15% NaOH и 45 мл воды в этом порядке. Фильтрованием полученного таким образом остатка получают 1-тритил-2-(R)-бензил-1,2-этилендиамин. 94b) К раствору 1-тритил-2-(R)-бензил-1,2-этилендиамина, полученному в примере 94 а) (21,6 г, 55 ммоль), в безводном CH2Cl2 (300 мл) и TEA (8,4 мл, 60,5 ммоль), поддерживаемому при 0 С, добавляют малыми порциями 2-нитробензолсульфонилхлорид (12,2 г, 55 ммоль). После завершения добавления эту смесь выдерживают при перемешивании при комнатной температуре в течение еще 4 ч, затем промывают 15% водным NaCl (150 мл), 5% водным NaHCO3 (150 мл) и опять 15% водным NaCl (150 мл). Органическую фазу сушат и упаривают при пониженной температуре с получением твердого продукта, который затем растворяют в 150 мл CH3CN, охлажденных при 0 С, и обрабатывают избытком HCl в диоксане. После 2 ч при комнатной температуре растворитель выпаривают досуха и твердый остаток растворяют в этиловом эфире и фильтруют с получением белого твердого вещества гидрохлорида N-(2(R)-амино 3-фенилпропил)-2-нитробензолсульфонамида. ВЭЖХ (способ A): Rt = 2,70 мин. 94 с) Оксазолинон, описанный в примере 52b) (407 мг, 1,5 ммоль), и промежуточный продукт 94b),описанный выше (670 мг, 1,5 ммоль), растворяют в ДМФ (8 мл), добавляют TEA (0,64 мл, 4,5 ммоль) и поддерживают при 80 С при перемешивании в течение 2 ч. Остаток, полученный при выпаривании растворителя, растворяют AcOEt (30 мл) и промывают 1 М HCl (10 мл), NaHCO3 (5%, 10 мл) и 15% воднымNaCl (10 мл). Полученный таким образом неочищенный продукт очищают флеш-хроматографией(AcOEt/гексан 1/1) с получением 0,5 г (0,8 ммоль) промежуточного продукта 1-[1(R)-бензил-2-(2 нитробензолсульфониламино)этилкарбамоил]циклопентиламида бензо[b]тиофен-2-карбоновой кислоты. ВЭЖХ (способ В): Rt=4,74 мин. 94d) 1,2 г (3,36 ммоль, 3 ммоль/г загрузки) трифенилфосфиновой смолы дают набухать в течение 30 мин в CH2Cl2 (25 мл) при уравновешивающем перемешивании; к суспензии промежуточного соединения,описанного в примере 94 с) (0,5 г, 0,84 ммоль), добавляют N-Boc-4-гидроксиэтилпиперидин (600 мг, 2,52 ммоль) и трет-бутилдиазокарбоксилат (600 мг, 2,52 ммоль). После 16 ч при перемешивании смолу удаляют фильтрованием и раствор доводят до небольшого объема (10 мл). Добавляют 5 мл трифторуксусной кислоты при перемешивании. Спустя 1 ч этот раствор сушат досуха, остаток растворяют AcOEt (30 мл) и этот раствор промывают 5% водным Na2CO3 (15 мл) и 15% водным NaCl (10 мл), сушат и упаривают. Получают (11-(R)-бензил-2-[(2-нитробензолсульфонил)-(2-пиперидин-4-илэтил)амино]этилкарбамоилциклопентил)амид бензо[b]тиофен-2-карбоновой кислоты в виде пенообразного твердого вещества (553 мг, 0,77 ммоль). ВЭЖХ (способ A): Rt=4,20 мин. 95 е) Продукт, полученный на предыдущей стадии (60 мг, 0,084 ммоль) растворяют в CH2Cl2 (2 мл) и к этому раствору добавляют 60 мкл TEA и 13,5 мкл тиофен-2-илацетилхлорида. Перемешивание магнитной мешалкой поддерживают в течение 12 ч, затем растворитель выпаривают и остаток, растворенный в AcOEt (10 мл),промывают 5% водным Na2CO3 (2x5 мл). Неочищенный продукт, полученный выпариванием растворителя (60 мг, 0,07 ммоль), растворяют в ДМФ (3 мл) и обрабатывают диазабициклоундеценом (DBU, 32 мг, 0,21 ммоль) и 2-меркаптоэтанолом (17 мг, 0,21 ммоль) в течение 12 ч. Остаток, полученный в результате выпаривания растворителя при пониженном давлении, промывают этиловым эфиром и очищают ВЭЖХ с получением 10 мг (0,013 ммоль) ТФУ-соли[1-(1(R)-бензил-2-2-[1-(тиофен-2-илацетил)пиперидин-4-ил]этиламиноэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты в виде белого лиофильного продукта. МС (m/z): 657,3 (MH+). ВЭЖХ (способ A): Rt=4,12 мин. Пример 95.[1-(1(R)-2-[(1-аминоциклогексанкарбонил)амино]этилкарбамоил-2-фенилэтилкарбамоил)цик- 16007855 лопентил]амид бензо[b]тиофен-2-карбоновой кислоты Трет-бутиловый эфир [2-(2(R)-амино-3-фенилпропиониламино)этил]карбаминовой кислоты (200 мг, 0,65 ммоль), полученный связыванием N-Boc-этилендиамина и сукцинимидоэфира Z-Dфенилаланина с последующим гидрированием, добавляют к раствору 2-бензо[b]тиофен-2-ил-3-окса-1 азаспиро[4,4]нон-1-ен-4-она (176 мг, 0,65 ммоль) в ДМФ и поддерживают при перемешивании магнитной мешалкой при комнатной температуре в течение 48 ч. Полученный таким образом продукт освобождают от защитных групп (HCl, диоксан), ацилируют 1-Вос-амино-1-циклогексанкарбоновой кислотой(156 мг, 0,65 ммоль) стандартным активированием, как описано выше, затем опять освобождают от защитных групп (HCl, диоксан). Неочищенный продукт, полученный из экстрагирующей обработки, очищают флеш-хроматографией (элюент: CHСl3/МеОН 9:1) с получением [1-(1(R)-2-[(1 аминоциклогексанкарбонил)амино]этанкарбамоил-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты (160 мг, 0,27 ммоль). МС (m/z): 604,3 (MH+). ВЭЖХ (способ A):Rt=3,58 мин. Аналогичными способами были получены следующие продукты: Пример 96. ТФУ-соль [1-(1R)-[1-(1-аминоциклогексанкарбонил)пиперидин-4-илметил]карбамоил-2-фенилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты МС (m/z): 658,3 (MH+). ВЭЖХ (способ A): Rt=3,62 мин. Пример 97.[1-(2-фенил-1(R)-2-[4-(тиофен-2-илацетил)пиперазин-1-ил]этилкарбамоилэтилкарбамоил)циклопентил]амид бензо[b]тиофен-2-карбоновой кислоты Аналогично примеру 95) трет-бутиловый эфир 4-[2-(2(R)-амино-3-фенилпропиониламино)этил]пиперазин-1-карбоновой кислоты (полученный из Z-D-фенилаланина и N-Boc-4 гидроксиэтилпиперазина реакциями и связываниями, широко описанными в литературе и частично уже сообщенными в предыдущих примерах) (100 мг, 0,26 ммоль), и 2-бензо[b]тиофен-2-ил-3-окса-1 азаспиро[4,4]нон-1-ен-4-он (72 мг, 0,26 ммоль) заставляют реагировать в ДМФ с получением продукта, который освобождают от защитных групп и затем ацилируют тиофен-2-илацетилхлоридом в CH2 Сl2 (как описано в примере 94) и очищают флеш-хроматографией с использованием AcOEt в качестве элюента. Таким образом получают 69 мг (0,10 ммоль) [1-(2-фенил-1(R)-2-[4-(тиофен-2-илацетил)пиперазин 1-ил]этилкарбамоилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты. МС (m/z): 672,3 (MH+). ВЭЖХ (способ A): Rt=3,87 мин. Пример 101. ТФУ-соль[1-(2-фенил-1(R)-2-[4-(тетрагидропиран-4-илметил)пиперазин-1-ил]этилкарбамоилэтилкарбамоил)циклопентил]амида бензо[b]тиофен-2-карбоновой кислоты Указанное в заголовке соединение получают процедурой, аналогичной процедуре, описанной в примере 100, но с проведением восстановительного аминирования тетрагидропиранил-4 карбоксиальдегидом вместо стадии ацилирования тиофен-2-илацетилхлоридом. МС (m/z): 646,2 (MH+). ВЭЖХ (способ A): Rt=3,24 мин. Пример 102. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 5-хлорбензофуран-2-карбоновой кислоты 196 мг 5-хлорбензофуран-2-карбоновой кислоты суспендируют в 12 мл безводного CH2Cl2 в атмосфере азота. Затем добавляют 100 мкл оксалилхлорида и одну каплю ДМФ. Перемешивание поддерживают до завершения реакции. Затем растворитель выпаривают и остаток доводят до сухого состояния в глубоком вакууме. 87 мг полученного таким образом ацилхлорида добавляют к смеси 132 мг бисгидрохлорида[1(R)-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтил]амида 1-аминоциклопентанкарбоновой кислоты, 200 мкл TEA и 10 мл безводного CH2Cl2 при перемешивании магнитной мешалкой. По завершении этой реакции растворитель выпаривают и остаток растворяют смесью этилацетата и 10% водного K2 СO3 при сильном перемешивании. После отделения органической фазы, промывок подщелоченной водой, сушки на безводном Na2SO4, фильтрования и выпаривания растворителя получают 134 мг- 17007855 остатка, который затем очищают флеш-хроматографией с элюцией увеличивающимися количествами метанола в этилацетате до МеОН/АсОН = 1/6 об./об., с получением желаемого амида. МС (m/z): 581,3(MH+). ВЭЖХ (способ С): Rt=13,14 мин. Аналогичной процедурой были получены следующие соединения: Пример 103. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 5-хлорбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 597,3 (М+Н+). ВЭЖХ (способ С): Rt=13,80 мин. Пример 104. 1-[1R-(3-мopфoлин-4-илпpoпилкapбaмoил)-2-фенилэтилкарбамоил]циклопентиламид 5-бромбензофуран-2-карбоновой кислоты МС (m/z): 625,2 (М+Н+, моноизотопный). ВЭЖХ (способ С): Rt=13,41 мин. Пример 105. 1-[1R-(3-мopфoлин-4-илпpoпилкapбaмoил)-2-фенилэтилкарбамоил]циклопентиламид 6-хлорбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 597,3 (М+Н+). ВЭЖХ (способ С): Rt=13,58 мин. Пример 106. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 6-метоксибензо[b]тиофен-2-карбоновой кислоты МС (m/z): 593,3 (М+Н+). ВЭЖХ (способ С): Rt=12,62 мин. Пример 107. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 4-хлорбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 597,3 (М+Н+). ВЭЖХ (способ С): Rt=13,79 мин. Пример 108. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 6-бромбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 641,3 (М+Н+, моноизотопный). ВЭЖХ (способ С): Rt=13,86 мин. Пример 109. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклогексиламид 6-бромбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 655,2 (М+Н+ моноизотопный). ВЭЖХ (способ С): Rt=14,63 мин. Пример 110. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 5-фтор-1 метил-1 Н-индол-2-карбоновой кислоты МС (m/z): 578,3 (М+Н+). ВЭЖХ (способ С): Rt =13,18 мин. Пример 111. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 6-хлор-1 метил-1 Н-индол-2-карбоновой кислоты МС (m/z): 594,3 (М+Н+). ВЭЖХ (способ С): Rt=14,03 мин. Пример 112. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 7-метилбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 577,3 (М+Н+). ВЭЖХ (способ С): Rt=13,26 мин. Пример 113. 1-[1R-(3-морфолин-4-илпропилкарбамоил)-2-фенилэтилкарбамоил]циклопентиламид 5-метилбензофуран-2-карбоновой кислоты МС (m/z): 561,3 (М+Н+). ВЭЖХ (способ С): Rt=13,01 мин. Пример 114. 1-[1R-(3-мopфoлин-4-илпpoпилкapбaмoил)-2-фенилэтилкарбамоил]циклопентиламид 1,5-диметил-1 Ниндол-2-карбоновой кислоты МС (m/z): 574,3 (М+Н+). ВЭЖХ (способ D): Rt=13,62 мин. Пример 115. 1-[1R-(3-мopфoлин-4-илпpoпилкapбaмoил)-2-фенилэтилкарбамоил]циклопентиламид 6-аминобензо[b]тиофен-2-карбоновой кислоты МС (m/z): 578,2 (М+Н+). ВЭЖХ (способ D): Rt=8,62 мин. Пример 116. 1-[1R-(3-мopфoлин-4-илпpoпилкapбaмoил)-2-фенилэтилкарбамоил]циклопентиламид 6,7-дихлорбензо[b]тиофен-2-карбоновой кислоты МС (m/z): 631,3 (М+Н+). ВЭЖХ (способ С): Rt=14,57 мин. Пример 117.[1-(2-фенил-1R-[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоилэтилкарбамо- 18007855 ил)циклопентил]амид 6-иоднафталин-2-карбоновой кислоты 117 а) 18,0 г 4-тетрагидропиранкарбоновой кислоты вводят в колбу на 250 мл с трубкой с хлоридом кальция и растворяют в 130 мл CH2Cl2. При перемешивании магнитной мешалкой последовательно добавляют по каплям 15 мл оксалилхлорида и 3 капли ДМФ. Этот раствор, который периодически дегазируют, выдерживают при перемешивании магнитной мешалкой в течение 16 ч. После выпаривания растворителя остаток сушат в глубоком вакууме при комнатной температуре, растворяют в 100 мл CH2Cl2 и помещают в баню со смесью льда и воды при поддержании интенсивного перемешивания с использованием магнитной мешалки. Раствор 21,75 г этил-4-пиперидинкарбоксилата в 30 мл CH2Cl2, содержащих 15,35 г TEA, добавляют к этой смеси при помощи капельной воронки. Во время этого добавления, которое длится 3 ч, образуется прозрачная суспензия. Реакционную смесь оставляют стоять в течение ночи,затем CH2Cl2 выпаривают и остаток сушат досуха в глубоком вакууме. Остаток растворяют в 110 мл водного 25% аммиака, затем добавляют метанол до полной солюбилизации. Метанол нагревают с обратным холодильником при дефлегмации до исчезновения эфира (берут пробы, упаривают и анализируют при помощи 1 Н-ЯМР). Раствор доводят до небольшого объема и экстрагируют 25 раз 100 мл хлороформа с получением, после выпаривания растворителя, 21,4 г неочищенного диамида. 14,79 г полученного таким образом диамида добавляют в виде порций к 175 мл раствора 1 М борана в ТГФ. Добавление продолжается в течение приблизительно 1 ч, и его проводят под током азота, так что температура не превышает 35 С. После завершения добавления реакционную смесь нагревают с обратным холодильником при дефлегмации и дефлегмацию поддерживают в течение 11 ч. На бане со смесью льда и воды к полученному, как описано выше, раствору добавляют по каплям 130 мл 4 М раствора HCl в 1,4-диоксане, предварительно разбавленного 100 мл метанола. Реакционную смесь нагревают с обратным холодильником при дефлегмации и дефлегмацию поддерживают в течение 12 ч перед охлаждением при 0-4 С. Посредством фильтрования получают 7,95 г бис-гидрохлорида С-[1-(тетрагидропиран-4 илметил)пиперидин-4-ил]метиламина. Из маточного раствора разбавлением до двойного объема диэтиловым эфиром извлекают дополнительные 1,85 г желаемого продукта. 1 Н-ЯМР (200 МГц, ДМСО-d6),(м.д.): 1,09-1,33 (м, 2 Н); 1,51-2,20 (м, 8 Н); 2,59-3,08 (м, 6 Н); 3,093,58 (м, 4 Н); 3,76-3,91 (м, 2 Н); 8,18 (шир., 3H); 10,20 (шир., 1 Н). Аналогичным образом были получены также следующие амины: С-[1-(4-метилтетрагидропиран-4 илметил)пиперидин-4-ил]метиламин. МС (m/z): 227,2 (MH+). 1 Н-ЯМР (200 МГц): (, CDCl3) 0,94 (с, 3H); 1,08-1,69 (м, 9 Н); 2,10 (с, 2 Н); 2,10-2,30 (м, 2 Н); 2,48-2,59(м, 2 Н); 2,67-2,83 (м, 2 Н); 3,47-3,79 (м, 4 Н); С-[4-метил-1-(4-метилтетрагидропиран-4 илметил)пиперидин-4-ил]метиламин МС (m/z): 227,3 (MH+). С-[4-метил-1-(тетрагидропиран-4-илметил)пиперидин-4-ил]метиламин МС (m/z): 241,2 (MH+). 117b) С использованием в качестве исходного материала амина, полученного в примере 117 а), посредством пептидного синтеза с применением Воc, при рабочих условиях, хорошо известных специалистам в данной области, реакцией вышеуказанного амина с О-сукцинимидоэфиром Boc-D-фенилаланина,удалением защитных групп, реакцией с N-Вос-1-амино-1-циклопентанкарбоновой кислотой и удалением защитных групп получают соединение (2-фенил-1R-[1-(тетрагидропиран-4-илметил)пиперидин-4 илметил]карбамоилэтил)амид 1-аминоциклопентанкарбоновой кислоты. Этому соединению дают реагировать с хлорангидридом 6-иодонафталин-2-карбоновой кислоты с использованием процедуры, аналогичной процедуре, описанной в примере 102, с получением конечного продукта [1(2-фенил-1R-[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоилэтилкарбамоил)циклопентил]амида 6-иоднафталин-2-карбоновой кислоты. МС (m/z): 751,3 (М+Н+). ВЭЖХ (способ D): Rt=14,00 мин. Аналогично процедуре, описанной в примере 117, реакцией соответствующих карбоновых кислот, активированных (2-фенил-1R-[1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоилэтил)амидом 1 аминоциклопентанкарбоновой кислоты, были получены следующие соединения: Пример 118.MC (m/z): 625,5 (М+Н+). ВЭЖХ (способ D): Rt=12,29 мин. 1 Н-ЯМР (ДМСО-d6)(среди других): 0,94-1,07 (м, 4 Н); 1,43-1,72 (м, 12 Н); 1,76-1,83 (м, 1 Н); 1,902,00 (м, 3H); 2,25-2,34 (м, 1 Н); 2,55-2,63 (м, 2 Н); 2,55-2,63 (м, 2 Н); 2,82-2,90 (м, 2 Н); 2,94-3,01 (м, 1 Н); 3,74-3,83 (м, 2 Н); 3,91 (с, 3H); 4,42-4,49 (м, 1 Н); 7,10-7,21 (м, 5 Н); 7,23-7,27 (м, 1 Н); 7,52 (т, J = 5,7 Гц,1 Н); 7,58-7,67 (м, 2 Н); 7,80 (д, J = 8,6, 1 Н); 7,95-8,06 (м, 4 Н); 8,53 (с, 1 Н), 8,78 (с, 1 Н). С использованием процедуры, аналогичной процедуре, описанной в примере 117, были получены также следующие соединения. Пример 152.[1-(1R)-[4-метил-1-(тетрагидропиран-4-илметил)пиперидин-4-илметил]карбамоил-2-фенилэтилкарбамоил)циклопентил]амид 6-бромнафталин-2-карбоновой кислоты с использованием С-[4-метил-1(тетрагидропиран-4-илметил)пиперидин-4-ил]метиламина, полученного, как описано в примере 117 а). МС (m/z): 717,4 (MH+, изотопное распределение Вr). ВЭЖХ (способ A): Rt=4,16 мин. Способы ВЭЖХ Подвижная фаза: А = Н 2O+0,1% ТФУ; В=MeCN+0,1% ТФУ Способ А Колонка: Zorbax SB-18, 3,5 мкм, 100 А (50 х 4,6 мм) Градиент: от А/В = 95/5 до А/В = 5/95 в течение 6,5 мин+1 мин изократический Скорость тока: 3 мл/мин=220, 270 нм. Способ В Колонка: Platinum RP-18, 3 мкм, 100 А (33 х 7 мм) Градиент: от А/В = 95/5 до А/В = 5/95 в течение 6,5 мин+1 мин изократический Скорость тока: 3 мл/мин=230 нм. Список аббревиатур В данном описании были использованы следующие аббревиатуры: Ас 5 с, аминоциклопенатанкарбоновая; Ас 6 с, аминоциклогексанкарбоновая; AcOEt, этилацетат; Воc, Nтрет-бутилоксикарбонил; BSA, N,O-бис(триметилсилил)ацетамид; DCM, дихлорметан; DIPEA, N,Nдиизопропилэтиламин; ДМФ,N,N-диметилформамид;TMSCI, триметилсилилхлорид; Z, N-бензилоксикарбонил. Оценку антагонистической активности на рецепторах NK-2 выполняли тестами связывания и функ- 23007855 циональными тестами в соответствии с тестами, уже описанными в литературе в отношении антагонистов NK-2. В частности, аффинность соединений данного изобретения в отношении рецептора NK-2 человека оценивали при помощи теста связывания с использованием мембран клеток яичника китайского хомячка(CHО), трансфицированных рецептором NK-2 подвздошной кишки человека, вместе с [125I]NKA (Amersham, удельная активность 2000 Ки/ммоль), радиоактивным связывающим веществом, при концентрации 100 пМ в конкурентных исследованиях. Тест-вещества тестировали в диапазоне концентраций от 0,01 до 10 нМ. В конце инкубационного периода (30 мин, 20 С) пробы отфильтровывали и радиоактивность определяли при помощи гаммасчетчика. Данные, показанные в следующей таблице, были получены для некоторых соединений общей формулы (I) и обозначают величины аффинности рецептора NK-2 человека. Соединениями данного изобретения формулы (I) можно манипулировать в соответствии с обычными способами фармакопеи для приготовления форм (композиций), пригодных для перорального, интраназального, парентерального, ингаляционного, трансдермального, местного или ректального применения в соответствии с информацией, известной в литературе для продуктов этого рода; эти формы включают в себя пероральные формы, такие как таблетки, капсулы, порошки, гранулированные препараты и пероральные растворы или суспензии, формы для сублингвального введения, для интраназального введения,аэрозольные формы, имплантаты, формы для подкожного, внутримышечного, внутривенного, внутриглазного и ректального введения. Эффективные дозы составляют 0,1-50 мг/кг массы тела. Для людей эффективная доза может предпочтительно находиться в диапазоне от 0,5 до 4000 мг/сутки, в частности от 2,5 до 1000 мг, в соответствии с возрастом пациентов и способом введения. Лечение проводят введением пациенту требуемого количества 1-4 раза в сутки в течение периодов времени до 2 недель или в любом случае до ремиссии симптомов; для хронических патологий введение может быть пролонгировано на значительно более продолжительные периоды времени в соответствии с оценкой врача. Благодаря их высокой антагонистической активности в отношении рецептора NK-2 тахикининов,данные соединения применимы в лечении заболеваний, в которых играет патогенную роль нейрокинин А, а именно в следующих патологиях: хронических обструктивных патологиях, таких как астма и аллергический ринит, кашель, бронхит; офтальмических патологиях, таких как конъюнктивит или витреоретинопатия; кожных проблемах, таких как аллергический и контактный дерматит, атопический дерматит, экзема, зуд, псориаз, ожоги, в частности солнечные ожоги; кишечных нарушениях, таких как раздраженная ободочная кишка, язвенный колит, болезнь Крона,диарея; желудочных заболеваниях, таких как тошнота или рвота; связанных с мочеиспусканием патологиях, таких как простатит, спинально-рефлекторный мочевой пузырь, недержание мочи, цистит, уретрит, нефрит, эректильные дисфункции; опухолевых патологиях, аутоиммунных заболеваних или заболеваниях, связанных со СПИДом; патологиях центральной нервной системы, таких как тревожность,депрессия, шизофрения, деменция, эпилепсия, синдром Паркинсона, болезни Альцгеймера, лекарственная и алкогольная зависимость, алкоголизм, хорея Гентингтона, нейродегенеративные заболевания и соматические нарушения, такие как стресс; лечении боли, в частности, висцералгии, неврита, невралгии; сердечно-сосудистых заболеваниях, таких как гипертензия, отеки, тромбоз, стенокардия, спазм сосуда; воспалительных заболеваниях, таких как артрит, ревматоидный артрит.- 26007855 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) где R1 обозначает ароматическую группу, выбранную из группы, состоящей из бифенила, фенилэтилена,нафтила, фенилтиофена, бензотиофена, бензофурана и индола, необязательно N-замещенного C1C6 алкильной группой, которая может быть необязательно замещена одной, двумя или тремя группами,независимо выбранными из группы, состоящей из галогена, C1-C6 алкила, необязательно замещенного не более, чем тремя атомами фтора, C1-C6 алкилокси, ОН, NHR10 и N(R10)2, где R10 выбран из Н и С 1 С 6 алкила;R2' выбран из группы, состоящей из Н или С 1-С 6 алкильной группы; аминокислотный остаток общей формулы (II) выбран из группы, состоящей из 1-аминоциклогексан-1-карбоновой кислоты (Ас 6 с), 1 аминоциклопентан-1-карбоновой кислоты (Ас 5 с), 1-аминоиндан-1-карбоновой кислоты (1-Aic), 1 аминоциклопентан-3-ен-1-карбоновой кислоты (Ас 5 с), 2-метилфенилаланина и 2-метил-2-этилглицина; Х 2 выбран из -CONH- и -CH2NH-; группа -R4 - Х 3 - R5 включает по меньшей мере одну основную аминогруппу иR4 выбран из группы, состоящей из группы -(CH2)n-, где n равно 1-3, С 5-С 8 циклоалкиленовой группы, выбранной из циклопентилена и циклогексилена, и алифатического гетероцикла, выбранного из пиперидина, пирролидина и пиперазина, необязательно замещенного одной или двумя C1-C6 алкильными группами; Х 3 обозначает связь или группу, выбранную из -СО-, -CH2-, -CH2-CH2- и -NH-CO-;a) алифатического гетероцикла, выбранного из группы, состоящей из пиперидина, пирролидина,морфолина, диазепана, тетрагидропирана и 1,4-диокса-8-азаспиро[4,5]декана, необязательно замещенного одной или двумя группами, выбранными из C1-C6 алкила, C1-C6 алкилокси, ОН и цианометила;c) пиперидина, необязательно С-замещенного C1-C6 алкильной группой и замещенного группой X5-R18,где Х 5 обозначает связь или выбран из группы, состоящей из -C(R11)(R12)-, -СО-, CH2CH2- и -СОCH2-; a R18 выбран из группы, состоящей из тиофена, тетрагидропирана, тетрагидротиопирана, пирролидина, циклогексана, циклопентана, 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из C1-C6 алкила, -NHR10, -NH(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1C6 алкила;d) пиперазина, необязательно С-замещенного одной или двумя С 1-С 6 алкильными группами и необязательно N-замещенного группой, выбранной из CH2CN и X4-R16, где Х 4 обозначает связь или выбран изe) аминогруппы, выбранной из NR11R12, -NH(CH2)m-NR11R12, где R11, R12 и m имеют определенные выше значения;f) аминоциклогексана или циклогексана, необязательно замещенного на кольце группой -NR11R12,где R11 и R12 имеют определенные выше значения;g) гетероароматического радикала, представленного пиридином. 2. Соединения общей формулы (I) по п.1, гдеR1 обозначает ароматическую группу, выбранную из группы, состоящей из фенилэтилена, нафтила,бензотиофена, необязательно замещенного одной, двумя или тремя группами, независимо выбранными из галогена, C1-C6 алкила, необязательно замещенного не более, чем тремя атомами фтора, C1- 27007855R2' обозначает Н; аминокислотный остаток общей формулы (II) выбран из 1-аминоциклогексан-1-карбоновой кислоты (Ас 6 с) и 1-аминоциклопентан-1-карбоновой кислоты (Ас 5 с); Х 2 обозначает -CONH-; группа -R4 - Х 3 - R5 включает по меньшей мере одну основную аминогруппу иR4 выбран из -(CH2)n-, где n равно 1-3, и пиперидина, необязательно замещенного C1-C6 алкильной группой; Х 3 обозначает связь или он является группой, выбранной из -СО- и -CH2-;R5 выбран из: а) алифатического гетероцикла, выбранного из пиперидина и тетрагидропирана, необязательно замещенного одной или несколькими C1-С 6 алкильными группами;b) пиперидина, необязательно С-замещенного С 1-С 6 алкильной группой, замещенной группой X5R18, где Х 5 обозначает связь или он является группой, выбранной из -C(R11)(R12)- и -СО-, a R18 является группой, выбранной из тетрагидропирана, циклогексана и 1,3-диоксана, необязательно замещенного одной или несколькими группами, выбранными из C1-C6 алкила, -NHR10 и -N(R10)2, где R10, R11 и R12 выбраны из Н и линейного или разветвленного C1-C6 алкила;c) пиперазина, необязательно С-замещенного одной или двумя С 1-С 6 алкильными группами и необязательно N-замещенного группой X4-R16, где X4 обозначает -CH2-, a R16 выбран из тетрагидропирана и 1,3-диоксана. 3. Соединения общей формулы (I) по п.1, где указанные соединения определяются следующими формулами: 1)
МПК / Метки
МПК: C07K 5/065, C07K 5/062, C07K 5/08, C07D 409/12, C07D 333/70, C07K 5/097, A61P 17/00, A61P 11/06, C07K 5/02, A61K 31/38, A61K 31/395
Метки: активность, имеющие, композиции, основные, линейные, антагонистическую, соединения, nk-2, отношении
Код ссылки
<a href="https://eas.patents.su/30-7855-linejjnye-osnovnye-soedineniya-imeyushhie-antagonisticheskuyu-aktivnost-v-otnoshenii-nk-2-i-ih-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Линейные основные соединения, имеющие антагонистическую активность в отношении nk-2, и их композиции</a>
Предыдущий патент: Мезопрогестины (модуляторы рецептора прогестерона) в качестве средств лечения и предупреждения доброкачественных зависящих от гормонов гинекологических нарушений
Следующий патент: Твердый топливный элемент и способ его изготовления
Случайный патент: Способ образования пузырьков газа в маслообразных жидкостях, флюид для бурения или технического обслуживания скважины и способ бурения скважины












